Журнал неорганической химии, 2023, T. 68, № 9, стр. 1235-1243
Синтез и строение координационных соединений кобальта(II) с изомерными формами октадекагидроэйкозаборатного аниона
В. В. Авдеева a, *, А. С. Кубасов a, А. В. Голубев a, С. Е. Никифорова a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 11.05.2023
После доработки 29.05.2023
Принята к публикации 30.05.2023
- EDN: WKBGSE
- DOI: 10.31857/S0044457X2360086X
Аннотация
Синтезированы координационные соединения [Co(DMF)6][B20H18], содержащие изомерные формы макрополиэдрического кластера [транс-B20H18]2– и [изо-B20H18]2–. Комплекс [Co(DMF)6][транс-B20H18] получен взаимодействием соли кластерного аниона бора с хлоридом кобальта(II) в диметилформамиде, комплекс [Co(DMF)6][изо-B20H18] – при перекристаллизации [Co(DMF)6][транс-B20H18] из воды в ходе самопроизвольной изомеризации макрополиэдрического кластера. Строение координационных соединений установлено методами ИК- и 1Н, 11В ЯМР-спектроскопии и РСА.
ВВЕДЕНИЕ
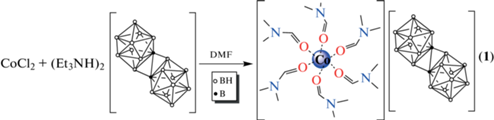
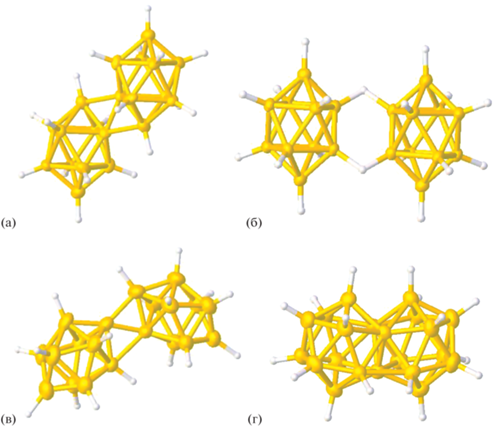
Известно, что октадекагидроэйкозаборатный анион [B20H18]2– может существовать в нескольких формах: транс, изо, цис и фац. Димерный макрополиэдрический кластер [транс-B20H18]2– образуется в ходе мягкого окисления клозо-декаборатного аниона [B10H10]2– под действием окислителей (солей железа(III), церия(IV)) [1–4] или при его электрохимическом окислении [5], анион [изо-B20H18]2– – в ходе перегруппировки Хотторна [6] при облучении раствора транс-изомера в ацетонитриле УФ-светом [7–9] или при протекании фотоизомеризации в кристаллах комплексных соединений и солей [10–13]. Изомер [цис-В20Н18]2− образуется при окислении предварительно восстановленного [транс-В20Н18]4− солями железа(III) [14]. Одним из способов получения аниона [фац-B20H18]2– является изомеризация [транс-B20H18]2– в безводной HF [14]. Строение всех известных на настоящий момент изомерных форм аниона [B20H18]2– представлено на рис. 1.
Рис. 1.
Строение изомерных форм аниона [B20H18]2–: транс- (а), изо- (б), цис- (в) и фац-изомеры (г).
Анионы [транс-B20H18]2– и [изо-B20H18]2– использовали в качестве лигандов в реакциях комплексообразования ряда металлов. Установлено, что в присутствии органических растворителей кластерные анионы бора играют роль внутрисферных лигандов при образовании комплексных соединений серебра(I) и свинца(II) [10, 13], тогда как в комплексах железа(II), кобальта(II), никеля(II), марганца(II), меди(II) и золота(III) макрополиэдрические бороводородные кластеры играют роль противоионов, стабилизируя катионные комплексы перечисленных металлов с органическими лигандами [15–17].
Авторы [2] обнаружили возможность протекания обратимой изомеризации между формами [транс-B20H18]2– и [изо-B20H18]2– бороводородного аниона: под действием УФ-облучения протекает изомеризация [транс-B20H18]2– → [изо-B20H18]2–, при нагревании протекает обратная реакция [изо-B20H18]2– → [транс-B20H18]2–. Нами обнаружена возможность самопроизвольной изомеризации [транс-B20H18]2– → [изо-B20H18]2– без УФ-облучения, которая протекает в реакционных растворах комплексов серебра(I) [10] и кобальта(II) [15] в присутствии органических лигандов (Ph3P и Phen соответственно).
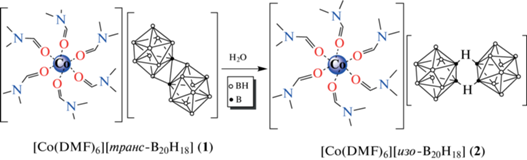
В настоящей работе изучена реакция комплексообразования кобальта(II) в присутствии аниона [транс-B20H18]2– в диметилформамиде, выделен комплекс [Co(DMF)6][транс-B20H18] и изучена его самопроизвольная изомеризация при перекристаллизации в воде с образованием [Co(DMF)6][изо-B20H18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реакции проводили на воздухе. В работе использовали ацетонитрил (для ВЭЖХ), ДМФА (для ВЭЖХ) и безводный CoCl2 (97%) производства Sigma-Aldrich. Соединение (Et3NH)2[B10H10] получали из декаборана-14 по методике [18], (Et3NH)2[транс-B20H18] – окислением водного раствора (Et3NH)2[B10H10] под действием FeCl3 по методике [1].
Синтез комплекса [Co(DMF)6][транс-B20H18] (1). Раствор CoCl2 (0.4 ммоль) в ДМФА добавляли к раствору (Et3NH)2[транс-B20H18] (0.4 ммоль) в ДМФА (10 мл). Наблюдали постепенное образование кристаллов 1 розового цвета. Через 24 ч кристаллы отфильтровывали и сушили на воздухе. Выход 67%.
| C | H | N | B | Co | |
| Найдено, %: | 29.48; | 8.21; | 11.53; | 29.4; | 8.07. |
| Для C18H60N6O6B20Co | |||||
| рассчитано, %: | 29.54; | 8.26; | 11.48; | 29.54; | 8.05. |
ИК-спектр (NaCl, см–1): ν(BH) 2555, 2518; ν(CO) 1664. 11B ЯМР-спектр (DMF-d7, δ, м.д.): 31.74 (2B, d; Bap); 17.41 (2B, s, B2, В2'); –5.54 (2B, d; Beq); –10.99 (4B, d, Beq); –14.49 (4B, d, Beq); –17.99 (4B, d, Beq); –24.26 (2B, d, Bap).
Синтез комплекса [Co(DMF)6][изо-B20H18] (2). Кристаллы 1 (0.2 ммоль) растворяли в воде (10 мл). Наблюдали образование раствора фиолетово-розового цвета. Через 3–4 сут наблюдали образование кристаллов 2 розового цвета, которые отфильтровывали и высушивали на воздухе. Выход 48%.
| C | H | N | B | Co | |
| Найдено, %: | 29.45; | 8.19; | 11.47; | 29.5; | 8.02. |
| Для C18H60N6O6B20Co | |||||
| рассчитано, %: | 29.54; | 8.26; | 11.48; | 29.54; | 8.05. |
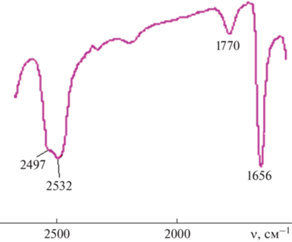
ИК-спектр (NaCl, см–1): ν(BH) 2532, 2497; ν(BHB) 1770; ν(CO) 1656. 11B ЯМР-спектр (δ, м.д.): –1.45 (4B, d); –23.83 (8B, d); –25.80 (4B, d); –26.92 (4B, d).
Элементный анализ проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Содержание бора и металла определяли методом ICP MS на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo. Для проведения анализа образцы высушивали до постоянной массы.
ИК-спектры соединений 1 и 2 записывали на ИК-Фурье-спектрофотометре Инфралюм ФТ-02 (НПФ АП “Люмекс”, Россия); суспензия в вазелиновом масле (Aldrich), пластинки NaCl, область 4000–400 см–1, разрешение 1 см–1.
Спектры 11B ЯМР растворов исследуемых веществ в DMF-d6 записывали на ЯМР-спектрометре Bruker DPX-300 на частоте 96.32 МГц с внутренней стабилизацией по дейтерию. В качестве внешнего стандарта использовали эфират трехфтористого бора.
РСА. Набор дифракционных отражений для кристаллов 1 и 2 получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2 (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Данные были проиндексированы и интегрированы с помощью программы SAINT, применяли поправку на поглощение, основанную на измерениях эквивалентных отражений (SADABS) [19]. Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода CH- и BH-групп уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
Все расчеты проводили с использованием программы SHELXTL [20]. Структура расшифрована и уточнена с помощью программного комплекса OLEX2 [21].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2159666 (1) и 2237249 (2)).
Таблица 1.
Основные кристаллографические данные для структур 1 и 2
| Параметр | 1 | 2 |
|---|---|---|
| Брутто-формула | C18H60B20CoN6O6 | C18H60B20CoN6O6 |
| М | 731.85 | 731.85 |
| Т, K | 150.0 | 100.00 |
| Сингония | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 |
| a, Å | 9.33(2) | 9.670(4) |
| b, Å | 10.410(18) | 10.282(3) |
| c, Å | 10.98(2) | 11.010(5) |
| α, град | 99.44(6) | 98.031(16) |
| β, град | 95.99(8) | 97.164(17) |
| γ, град | 104.09(5) | 104.332(9) |
| V, Å3 | 1008(4) | 1035.6(7) |
| Z | 1 | 1 |
| ρрасч, г/см3 | 1.205 | 1.173 |
| μ, мм–1 | 0.466 | 0.454 |
| F(000) | 385.0 | 385.0 |
| Излучение, нм | MoKα (λ = 0.71073) | MoKα (λ = 0.71073) |
| Интервал углов 2θ, град | 4.114–49.998 | 3.788–63.056 |
| Интервалы индексов | –11 ≤ h ≤ 9, –12 ≤ k ≤ 12, –13 ≤ l ≤ 13 |
–14 ≤ h ≤ 13, –15 ≤ k ≤ 14, –16 ≤ l ≤ 13 |
| Отражений собрано | 5350 | 12037 |
| Число независимых отражений | 3444 [Rint = 0.0391, Rsigma = 0.0929] | 6606 [Rint = 0.0353, Rsigma = 0.0753] |
| GOOF по F2 | 1.078 | 1.035 |
| R1, wR2 по N0 | R1 = 0.0917, wR2 = 0.2170 |
R1 = 0.0545, wR2 = 0.1166 |
| R1, wR2 по N | R1 = 0.1164, wR2 = 0.2307 |
R1 = 0.0893, wR2 = 0.1307 |
Расчеты методом DFT. Полная оптимизация геометрии анионов [транс-B20H18]2– и [изо-B20H18]2– выполнена на уровне теории B97-3c/6-311++G(d, p) с помощью пакета программ Orca 5.0.3 [22, 23]. Во время процедуры оптимизации геометрии операции симметрии не применяли ни для одной из структур модели. Матрицы Гессе были рассчитаны численно для всех оптимизированных модельных структур, чтобы доказать расположение правильных минимумов на поверхностях потенциальной энергии (без мнимых частот для всех расчетов). Эффекты растворителя учитывали с помощью проводниковой модели поляризуемого континуума (conductor-like polarizable continuum model, CPCM (Water)). Визуализацию рассчитанных ИК-спектров проводили с помощью ChemCraft [24].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе изучен процесс комплексообразования кобальта(II) в ДМФА в присутствии аниона [транс-B20H18]2–. Установлено, что при добавлении CoCl2 к раствору соли (Et3NH)2[транс-B20H18] в ДМФА образуется комплекс [Co(DMF)6][транс-B20H18] (1):
Схема 1 . Синтез соединения [Co(DMF)6][транс-B20H18] (1).
Соединение 1 легко растворяется в воде, это происходит, вероятно, за счет обмена лигандами в координационной сфере металла-комплексообразователя. Молекулы ДМФА постепенно заменяются на молекулы воды, что приводит к растворению соединения по механизму, подробно описанному ранее для системы [Ni(solv1)6][B10H10] ↔ ↔ [Ni(solv2)6][B10H10] [25]. Тем не менее в качестве конечного продукта из реакционного раствора выпадает соединение, содержащее исходный катионный комплекс [Co(DMF)6]2+, что говорит о меньшей растворимости соли с данным катионом по сравнению с [Co(H2O)6]2+.
При перекристаллизации соединения 1 в воде из реакционного раствора образуются кристаллы [Co(DMF)6][изо-B20H18] (2), содержащие транс-изомер макрополиэдрического аниона [B20H18]2– и тот же катионный комплекс кобальта:
Схема 2 . Синтез соединения [Co(DMF)6][изо-B20H18] (2).
В cпектре ЯМР 11В соединения 1 присутствуют семь сигналов с соотношением интегральных интенсивностей 1 : 1 : 1 : 2 : 2 : 2 : 1. В отсутствие широкополосного подавления спин-спинового взаимодействия сигнал при 17 м.д. остается синглетным, это соответствует положению В(2) в кластере. В спектре ЯМР 11В соединения 2 имеется четыре сигнала с соотношением интегральных интенсивностей 1 : 2 : 1 : 1, сигнал в слабом поле соответствует апикальным атомам бора, группа сигналов в сильном поле – экваториальным. Результаты 11B ЯМР-спектроскопии коррелируют с данными для других солей и комплексов анионов [транс-B20H18]2– и [изо-B20H18]2– [15, 17, 26].
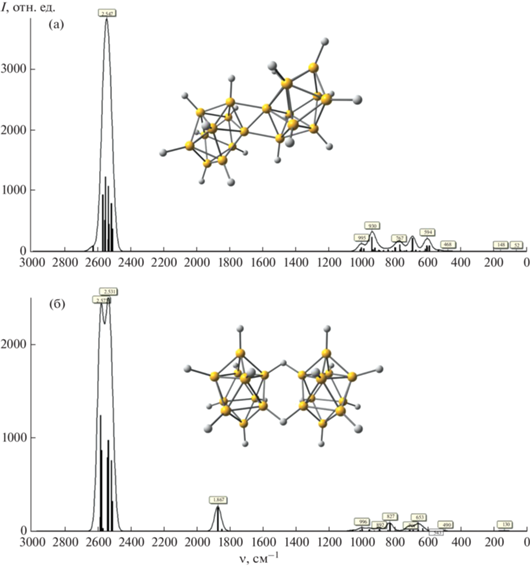
В ИК-спектрах комплексов 1 и 2 наблюдается интенсивная полоса поглощения в области 2550–2400 см–1, отвечающая валентным колебаниям ν(BH) аниона [транс-B20H18]2–. О присутствии координированных молекул ДМФА свидетельствует наличие интенсивной полосы ν(C=O) с максимумом при ~1660 см–1. Полоса колебаний ν(BHB) мостиковых атомов H наблюдается в спектре соединения 2 при ~1770 см–1 (рис. 2).
Полученные результаты коррелируют с данными, известными из литературы. Как указывалось выше, самопроизвольная изомеризация [транс-B20H18]2– → [изо-B20H18]2– обнаружена в растворах ДМФА, содержащих комплекс серебра с Ph3P [10] и комплекс кобальта(II) с Phen [15]. Можно было предположить, что наблюдаемая трансформация транс-формы [B20H18]2– в изо-форму протекает под воздействием ультрафиолетового излучения дневного света. Это кажется логичным, однако ранее в [15] мы выдерживали реакционную смесь, содержащую [Co(Phen)3][транс-B20H18] в ДМФА, в темноте и наблюдали частичную изомеризацию [транс-B20H18]2– → [изо-B20H18]2–. В свою очередь, в работе [26] раствор соли {(Ph3P)2N}2[транс‑B20H18] в ДМФА выдерживали в течение трех недель на воздухе при комнатной температуре при дневном свете; пиков, соответствующих изо-изомеру, в спектрах ЯМР 11В обнаружено не было. Таким образом, можно сделать вывод, что присутствие металла-комплексообразователя в реакционной системе инициирует изомеризацию [транс-B20H18]2– → [изо-B20H18]2–, которая протекает и в органических растворителях, и в воде.
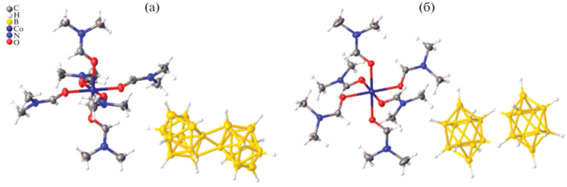
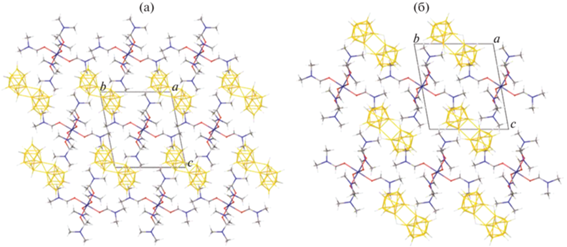
Кристаллы комплексов 1 и 2 построены из комплексных катионов [Co(DMF)6]2+ и анионов [транс-B20H18]2– или [изо-B20H18]2– соответственно (рис. 3). Триклинные элементарные ячейки комплексов (пр. гр. Р1) имеют очень близкие параметры и содержат половину катиона и половину аниона, которые расположены в центрах инверсии. В окружение атомов Co(II) входят шесть атомов кислорода шести молекул ДМФА. Октаэдры атомов металла слегка искажены. Длины связей Co–O лежат в пределах 2.050–2.074 Å в комплексе 1 и 2.0734(14)–2.1025(15) Å в комплексе 2. Валентные углы OCoO лежат в пределах 87.6°–92.4° и 87.55(5)°–92.46(5)° соответственно. Строение комплексного катиона соответствует ранее описанным примерам [27–32].
Средние длины связи B–B для апикальных атомов бора составляют 1.713 Å для аниона [транс-B20H18]2– в комплексе 1 и 1.704 Å для [изо-B20H18]2– в комплексе 2, средние длины связи B–B для экваториальных атомов бора равны 1.797 и 1.820 Å соответственно, что характерно для аниона [B10H10]2–. Экзополиэдрические связи B(1)–B(2)1 и B(2)–B(2)1 (11 – x, 1 – y, –z) в анионе [транс-B20H18]2– составляют 1.965 и 1.682 Å. Расстояние B(2)–B(6)1 в анионах [изо-B20H18]2– комплекса 2 равно 2.053(3) Å, что соответствует литературным данным для этих анионов [10, 33, 34].
Ячейки комплексов 1 и 2 практически изоструктурны: наибольшее отклонение по длинам ребер составляет 3.5%, по углам – не более 1.4%, в то время как объем ячеек отличается всего на 26 Å3 (2.5%). Таким образом, в обоих комплексах формируются катионно-анионные слои, параллельные плоскости ab, анионы укладываются в стопки один над другим параллельно оси a (рис. 4). Помимо электростатических взаимодействий катионы с анионами связаны сетью слабых взаимодействий BH…H(C), наиболее короткие контакты H…H составляют 2.474(4) Å, контакты CH…B – 2.895(9) Å в комплексе 1, 2.2766(6) и 2.812(3) Å в комплексе 2.
Для подтверждения анализа ИК-спектров анионов [транс-B20H18]2– и [изо-B20H18]2– выполнены DFT-расчеты нерезонансных колебательных спектров, которые состоят из фундаментальных переходов. Полученные расчетные данные согласуются с экспериментальными. На рис. 5 представлены расчетные ИК-спектры обоих анионов. Валентные колебания B–H в спектрах данных анионов лежат в диапазоне 2600–2500 см–1, мостиковые колебания B–H аниона [изо-B20H18]2– находятся при 1867 см–1. Данные отличия расчетных значений от экспериментальных (~100 см–1) связаны с точечным расчетом одной молекулы аниона, тогда как в молекулярных структурах имеется большое число межмолекулярных взаимодействий, которые вносят существенный вклад в колебательные спектры соединений. Отметим, что в литературе сообщается о сравнении экспериментальных данных ИК-спектров с расчетными для различных вариантов борных кластеров [35–38], однако примеров с наличием мостикового атома водорода в борном кластере немного. Например, при расчете аниона [B3H8]– и комплекса [Mg(B3H8)2(THF)2] [39] величина смещения длины волны в область меньших или больших частот сильно различается для разных методов расчета (для двух наиболее интенсивных полос, характерных для мостиковых колебаний B–H групп B–H–B (2260 см–1) и Mg–H–B (2373 см–1), соответствующие расчетные величины колеблются в пределах 268–148 и 257–145 см–1 соответственно.
Рассчитанные энергии Гиббса (∆G) для анионов [транс-B20H18]2– и [изо-B20H18]2– составляют –507.92383 и –507.90673 Eh. Разница в энергии между этими величинами может служить доказательством относительной стабильности изомерных борных кластеров, и можно сделать вывод о бóльшей стабильности транс-изомера по сравнению с изо-изомером. Эти значения согласуются с работой [6], посвященной изучению перехода аниона из транс-положения в изо-положение.
Полученные соединения можно применять в качестве прекурсоров для низкотемпературного синтеза боридов металлов [40–43]. Данное направление в материаловедении основано на использовании в качестве прекурсоров комплексных соединений [ML6][BnHn] (n = 10, 12; M = Co, Ni) с кластерными анионами бора и органическими лигандами L, которые играют роль органического топлива. Диметилформамид является одним из перспективных веществ, которые можно использовать в качестве топлива [44]; удельная теплота его сгорания (29.652 МДж/кг) значительно выше, чем, например, мочевины (9.134 МДж/кг), которую часто используют в SCS-процессах. Энергоемкость самих кластерных анионов бора позволяет снижать температуру синтеза боридов, что облегчает процесс синтеза и снижает энергозатраты. В частности, установлено, что отжиг [Co(DMF)6][An] (An = [B12H12], [B20H18]) при 900°С в течение 2 ч приводит к формированию нанокристаллического борида кобальта на бор-нидридной матрице, так как продукт отжига представляет собой двухфазную смесь [40]. Согласно данным РФА, на дифрактограмме присутствуют рефлексы, соответствующие нитриду бора BN в гексагональной модификации, а также монобориду кобальта CoB.
ЗАКЛЮЧЕНИЕ
В работе изучен процесс комплексообразования хлорида кобальта(II) в ДМФА в присутствии аниона [транс-B20H18]2–, выделено координационное соединение [Co(DMF)6][транс-B20H18]. Полученное соединение растворяется в воде, что приводит к самопроизвольной изомеризации димерного бороводородного кластера и образованию изомерного соединения [Co(DMF)6][изо-B20H18]. Строение соединений установлено методами РСА, ИК- и ЯМР-спектроскопии.
Список литературы
Chamberland B.L., Muetterties E.L. // Inorg. Chem. 1964. V. 3. P. 1450. https://doi.org/10.1021/ic50020a025
Hawthorne M.F., Pilling R.L. // J. Am. Chem. Soc. 1966. V. 88. P. 3873. https://doi.org/10.1021/ja00968a044
Hawthorne M.F., Shelly K., Li F. // Chem. Commun. 2002. P. 547. https://doi.org/10.1039/B110076A
Curtis Z.B., Young C., Dickerson R., Kaczmarczyk A. // Inorg. Chem. 1974. V. 13. P. 1760. https://doi.org/10.1021/ic50137a046
Voinova V.V., Klyukin I.N., Novikov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 295. https://doi.org/10.1134/S0036023621030190
Francés-Monerris A., Holub J., Roca-Sanjuán D. et al. // Phys. Chem. Lett. 2019. V. 10. P. 6202. https://doi.org/10.1021/acs.jpclett.9b02290
Kaczmarczyk A., Dobrott R.D., Lipscomb W.N. // Proc. Nat. Acad. Sci. USA. 1962. V. 48. P. 729.
Hawthorne M.F., Pilling R.L., Stokely P.F., Garrett P.M. // J. Am. Chem. Soc. 1963. V. 85. P. 3704.
Li F., Shelly K., Knobler C.B., Hawthorne M.F. // Angew. Chem. Int. Ed. 1998. V. 37. P. 1868. https://doi.org/10.1002/(SICI)1521-3773(19980803)37: 13/14<1868::AID-ANIE1868>3.0.CO;2-Z
Avdeeva V.V., Buzin M.I., Dmitrienko A.O. et al. // Chem. Eur. J. 2017. V. 23. P. 16819. https://doi.org/10.1002/chem.201703285
Avdeeva V.V., Malinina E.A., Zhizhin K.Y. et al. // J. Struct. Chem. 2019. V. 60. P. 692. https://doi.org/10.1134/S0022476619050020
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. P. 335. https://doi.org/10.1134/S003602362003002X
Avdeeva V.V., Buzin M.I., Malinina E.A. et al. // Cryst. Eng. Comm. 2015. V. 17. P. 8870. https://doi.org/10.1039/C5CE00859J
Bernhardt E., Brauer D.J., Finze M., Willner H. // Angew. Chem. Int. Ed. 2007. V. 46. P. 2927.
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Russ. J. Inorg. Chem. 2022. V. 67. P. 1169. https://doi.org/10.1134/S0036023622080022
Il’inchik E.A., Polyanskaya T.M., Drozdova M.K. et al. // Russ. J. Gen. Chem. 2005. V. 75. P. 1545. https://doi.org/10.1007/s11176-005-0464-y
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Polyhedron. 2022. V. 217. P. 115740. https://doi.org/10.1016/j.poly.2022.115740
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. V. 85. P. 3885.
APEX2 (V. 2009, 5-1), SAINT (V7.60A), SADABS (2008/1). Bruker AXS Inc., Madison, Wisconsin, USA, 2008-2009.
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Neese F. // Wiley Interdiscip. Rev. Comput. Mol. Sci. 2018. V. 8. P. 1. https://doi.org/10.1002/wcms.1327
Neese F. // Wiley Interdiscip. Rev. Comput. Mol. Sci. 2012. V. 2. P. 73. https://doi.org/10.1002/wcms.81
Chemcraft — graphical software for visualization of quantum chemistry computations. Version 1.8, build 648. https://www.chemcraftprog.com
Авдеева В.В., Кубасов А.С., Никифорова С.Е. и др. // Коорд. химия. 2023. Т. 49. № 6. С. 1. https://doi.org/10.31857/S0132344X22600576
Avdeeva V.V., Privalov V.I., Kubasov A.S. et al. // Inorg. Chim. Acta. 2023. V. 555. P. 121564. https://doi.org/10.1016/j.ica.2023.121564
Uflyand I.E., Tkachev V.V., Zhinzhilo V.A., Dzhardimalieva G.I. // J. Coord. Chem. 2021. V. 74. P. 649. https://doi.org/10.1080/00958972.2021.1881067
Eissmann F., Böhle T., Mertens F.O.R.L., Weber E. // Acta Crystallogr., Sect. E. 2010. V. 66. P. m279. https://doi.org/10.1107/S160053681000454X
Khutornoi V.A., Naumov N.G., Mironov Yu.V. et al. // Russ. J. Coord. Chem. 2002. V. 28. P. 183. https://doi.org/10.1023/A:1014724002211
Yaqin Guo, Xiuli Wang, Yangguang Li et al. // J. Coord. Chem. 2004. V. 57. P. 445. https://doi.org/10.1080/00958970410001671084
Shmakova A.A., Akhmetova M.M., Volchek V.V. et al. // New J. Chem. 2018. V. 42. P. 7940. https://doi.org/10.1039/C7NJ04702A
Avdeeva V.V., Vologzhanina A.V., Ugolkova E.A. et al. // J. Solid State Chem. 2021. V. 296. P. 121989. https://doi.org/10.1016/j.jssc.2021.121989
DeBoer B.G., Zalkin A., Templeton D.H. // Inorg. Chem. 1968. V. 7. P. 1085. https://doi.org/10.1021/ic50064a008
Montalvo S.J., Todd W.H., Feakes D.A. // J. Organomet. Chem. 2015. V. 798. P. 141. https://doi.org/10.1016/j.jorganchem.2015.05.064
Truong N.X., Jaeger B.A., Gewinner S. et al. // J. Phys. Chem. C. 2017. V. 121. P. 9560. https://doi.org/10.1021/acs.jpcc.7b01290
Shixiong Li, Zhengping Zhang, Zhengwen Long et al. // Sci. Rep. 2016. V. 6. P. 25020. https://doi.org/10.1038/srep25020
Biliskov N. // Infrared Spectroscopy: Theory, Advances and Development / Ed. Cozzolino D. Nova Science Publishers, 2014. https://doi.org/10.13140/2.1.3420.7687
Kubasov A.S., Golubev A.V., Bykov A.Yu. et al. // J. Mol. Struct. 2021. V. 1241. P. 130591. https://doi.org/10.1016/j.molstruc.2021.130591
Palumbo O., Nguyen P., Jensen C.M., Paolone A. // Int. J. Hydrogen Energy. 2016. V. 14. P. 5986. https://doi.org/10.1016/j.ijhydene.2016.02.124
Malinina E.A., Myshletsov I.I., Buzanov G.A. et al. // Molecules. 2023. V. 28. P. 453. https://doi.org/10.3390/molecules28010453
Авдеева В.В., Полякова И.Н., Вологжанина А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1182.
Малинина Е.А., Гоева Л.В., Бузанов Г.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 124.
Малинина Е.А., Гоева Л.В., Бузанов Г.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 11. С. 1136.
Петричко М.И., Караваев И.А., Савинкина Е.В. и др. // Журн. неорган. химии. 2023. Т. 68. № 4. С. 482. https://doi.org/10.31857/S0044457X22601821
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии