Журнал общей биологии, 2019, T. 80, № 4, стр. 297-306
Об эволюционной морфологии меловых хищных динозавров (Dinosauria: Theropoda)
Ринчен Барсболд *
Институт палеонтологии и геологии, Монгольская Академия Наук (МАН)
210351 Округ Чингэлтэй 4, Улан-Батор, ул. С. Данзана 3/1, п/я 46/50, Монголия
* E-mail: maspaleo@gmail.com
Поступила в редакцию 06.09.2018
После доработки 01.03.2019
Принята к публикации 27.04.2019
Аннотация
В эволюционной морфологии тероподов прослеживается ряд особенностей, достигающих наибольшего развития в меловое и позднемеловое время. В их числе: 1) изменение пищевых предпочтений; 2) увеличение объема головного мозга; 3) орнитизация; 4) мозаичное сочетание генерализованных (примитивных) и специализированных (продвинутых) признаков. 1. Кисть теропода обладает способностью захватывать и удерживать объекты, что является признаком хищничества. Экоморфологические особенности строения кисти и наличие гастролитов в мускульном желудке предполагают трансформацию пищевых предпочтений от плотоядного до растительноядного. Двупалость и однопалость, как последовательное развитие трехпалой кисти теропода, вместе с “крупнокоготностью” у теризинозавридов (Therizinosauridae) и дейнохейридов (Deinocheiridae) представляют радикальные морфологические преобразования, отражающие изменение состава диеты, способа добычи пищи, иногда смену среды обитания. Изменения в строении кисти расширяли ее функции и одновременно возможности адаптации к различным условиям среды. Разнообразие растительной пищи было главным фактором смены рациона питания у тероподов и формирования стратегии их выживания: смена пищевых предпочтений означала и изменения в пищедобывательном поведении продвинутых специализированных форм. Это влияло на историческую судьбу разных таксонов в их сообществах и приводило к непредсказуемым последствиям в эволюции тероподов. Отсутствие зубов и развитие клюва считаются признаками смены кормового спектра, но их связь с изменением типа питания неоднозначна. Овирапториды, отличающиеся большим числом примитивных черт в пищевых предпочтениях, сохраняют хватательную кисть и плотоядность. У таксонов с меньшим числом примитивных черт формировалась более специализированная кисть с редукцией наружных пальцев, способных лишь растягивать кожистую перепонку, превращая кисть в гипотетический плавательный орган (адаптация к обитанию в водной среде и к питанию, вероятно, моллюсками). 2. Увеличение относительного объема головного мозга тероподов способствовало совершенствованию сенсорных органов, что обеспечивало им преимущества перед гигантскими хищниками, превышающими их по массе более чем на два порядка. 3. В эволюции тероподов овирапториды “конкурируют” с дромеозавридами по близости к птицам (или рассматриваются как птицы, утратившие способность к полету). У овирапторидов развивается пигостиль, и лишь у них хвостовой отдел прогрессивно укорачивается. С другой стороны, хватательная стопа дромеозаврида могла быть функциональным заимствованием с изменением первоначального функционального назначения (эксаптацией) в эволюции стопы птиц, необходимой для их древесного образа жизни и развития активного (машущего) полета. Орнитизация была прогрессивной тенденцией в эволюции тероподов, и эта генеральная тенденция, вероятно, была обусловлена действием стабилизирующего отбора. 4. Сочетание примитивных и специализированных продвинутых признаков проявляется в следующем: у дромеозавридов строение черепа имеет относительно примитивный характер, посткраниальный скелет в основе позднебазальный, строение таза, стопы, хвостового отдела существенно модифицируется; хватательная кисть сохраняется в классическом примитивном состоянии. У овирапторидов череп необычно специализирован для тероподов, посткраниальный скелет в основе позднебазальный, в линиях овирапторидов сохраняется как примитивная хватательная, так и формируется специализированная кисть с редукцией наружных пальцев, модифицируется хвостовой отдел. Функциональная морфология меловых тероподов отличалась разнообразием и одновременно сходством родственных линий, эволюционировавших параллельно.
Хищные динозавры позднего послетриасового этапа отличались высокой способностью к структурным изменениям, сохранившимся в палеонтологической летописи (в нашем случае Монгольской Гоби и Северной Америки). В данной статье рассматривается ряд черт тероподов, эволюционная морфология которых привлекает все большее внимание. Вероятно, это обусловлено близостью группы к эволюционному стволу, ведущему к птицам. Рассмотренные ниже морфологические черты в исследованиях динозавров вообще и прежде всего тероподов, демонстрирующих наибольшую изменчивость среди динозавров, ныне нередко трактуются совсем не так, как раньше. Многие морфологические особенности тероподов были описаны в предшествующих исследованиях, однако в комплексном анализе морфологии группы ощущалась нехватка знаний об их функциональной морфологии, во многом обусловленная неполнотой ископаемого материала. В настоящее время, благодаря новым находкам, сравнительный морфологический анализ, основанный на более широком материале, стал более тщательным, открывая путь к более весомым обобщениям, касающимся строения группы.
В работе анализ морфологических черт проведен с учетом общего русла структурных преобразований, формирующих магистральное направление морфологической эволюции тероподов, большое разнообразие которых не только не скрывает закономерности их эволюционного развития, но даже подчеркивается им. В эволюции тероподов возможно выделение как частных, характерных для отдельных более мелких таксонов, закономерностей, так и более общих аспектов, характерных для группы в целом. К ним отнесены: изменение типа питания, обратно пропорциональное весу тела увеличение мозга у одного из них (ингении, Ingenia Barsbold, 1981), возникновение морфологических черт, сближающих тероподов с птицами (орнитизация тероподов), а также сочетание примитивных и продвинутых признаков в строении скелетных структур. Последней особенности эволюции рассматриваемой группы следовало бы придавать гораздо большее, возможно, превалирующее значение при анализе эволюционных преобразований морфологии тероподов вообще и в особенности их позднейших ветвей, часто воспринимаемых как наиболее орнитизированных. Рассматриваемые ниже черты строения тероподов, связанные с упомянутыми выше аспектами, отражают ряд особенностей эволюционной морфологии хищных динозавров, относимых именно к позднейшему (позднемеловому) этапу их исторического развития. Изменение типа питания – с нашей точки зрения, важная тенденция в эволюции тероподов. Поэтому в данной работе этому аспекту эволюции группы уделяется наибольшее внимание.
СМЕНА ТИПА ПИТАНИЯ
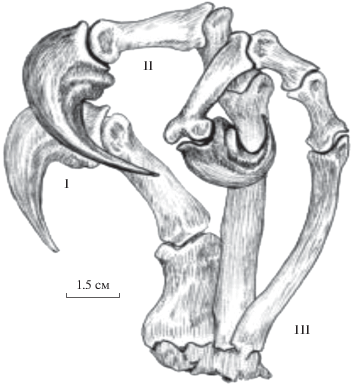
Ярко выраженной хватательной функции кисти у хищных динозавров (рис. 1) всегда придавалось большое значение, как показателю хищнического образа жизни (Osborn, 1917; Romer, 1956; Ostrom, 1969). Способность кисти схватывать объекты легко распознается по ее строению. В типичной для теропода трехпалой кисти сгибающиеся пальцы с заостренными и изогнутыми когтями вонзаются в тело жертвы (или врага), тем самым захватывая и удерживая жертву. Фиксация жертвы способствует ее последующему умерщвлению хищником. Однако данная общая функциональная интерпретация хватательной кисти, широко признанная в прошлом, стала нарушаться при нахождении дистальных элементов передних конечностей, строение которых по величине, форме и соотношениям фаланг пальцев, включая когтевые, полностью выходило за рамки строения, казалось, столь хорошо установленного ранее для кистей тероподов. Открытие хищных динозавров по необычно крупным, а в одном случае гигантским когтевым фалангам кисти (Малеев, 1955; Рождественский, 1970) предвещало появление совершенно незнакомых форм. Как выяснилось намного позже, эволюционные преобразования кисти определяются их экоморфологией, указывающей на переход от хищничества к растительноядности и ярко проявившейся в эволюции позднейших тероподов.
Рис. 1.
Левая кисть велоцираптора (вентральная сторона медио-дорзально) в хватательном положении. I, II, III – пальцы.
В посткраниальных скелетах высокой сохранности впервые у орнитомимидов (Ornithomimidae Marsh, 1881) и дейнохейридов (Deinocheiridae Osmolska et Roniewicz, 1970) в грудной полости (в мускульном желудке) обнаружены скопления гастролитов (рис. 2) (Kobayashi et al., 1999; Lee et al., 2014), с высокой вероятностью свидетельствующие об изменении спектра питания – мало изученного, но значительного феномена в эволюции тероподов. Однако у монгольского тарбозавра (Tarbosaurus Maleev, 1955), гигантского хищника и родственника американских тираннозавридов (Tyrannosauridae Osborn, 1905), также обнаружены гастролиты в сохранившихся отпечатках мускульного желудка. Следовательно, функциональное значение гастролитов трудно трактовать однозначно. Гастролиты имеются у некоторых современных хищных птиц, а также крокодилов. По-видимому, наше понимание экоморфологии различных хищников неоднозначно и далеко от полной определенности.
Рис. 2.
Гастролиты в мускульном желудке дейнохейра (Deinocheirus Osmolska et Roniewicz, 1970). По: Lee et al., 2014. Деление на линейке 1 см.

У некоторых тероподов строение кисти и ее размеры, в особенности когтевых фаланг, явно исключают совершение хватательных действий. Это относится прежде всего к теризинозавру (Therizinosaurus cheloniformis Maleev, 1955), находкой кисти которого ограничивается большинство сведений о нем. Теризинозавр остается единственным тероподом, в кисти которого были необычно удлиненные когтевые фаланги (до 0.7 м), сжатые с боков и выпрямленные. У дейнохейра (Deinocheirus mirificus Osmolska et Roniewicz, 1970) когтевые фаланги были вдвое короче, более массивны и также явно не способны схватывать и удерживать объекты. Это примеры наиболее радикальных морфологических преобразований кисти у тероподов, отражающие изменение в спектре питания. Столетием раньше отмечалась изменчивость в строении и функциях когтевых фаланг кисти у орнитомимидов (Osborn, 1917). В настоящий момент показано, что и монгольским орнитомимидам было свойственно широкое разнообразие в строении кисти и когтевых фаланг, отвечавшее разнообразию ниш позднемеловой экосистемы (Chinzorig et al., 2017). Разнообразие типов питания предполагется у целурозавров (Coelurosauria Huene, 1914) и других тероподов (Xu et al., 2002; Zhou, Zhang, 2002; Barrett, 2005; Barrett, Rayfield, 2006). В число изменивших плотоядный образ жизни входят упоминавшиеся орнитомимиды и дейнохейриды, относимые к орнитомимозаврам (Ornithomimosauria Barsbold, 1976), теризинозавриды, обнаруживаемые в последнее время в Северной Америке и Азии, а также частично монгольские овирапториды (Oviraptoridae Barsbold, 1976). Немонгольские теризинозавриды (Kirkland, Wolfe, 2001; Zhang et al., 2001; Li et al., 2007; Zanno, 2010) не обладали гигантскими когтевыми фалангами кисти, но их экоморфологические возможности соответствовали растительноядности (Zanno et al., 2009; Zanno, Makovicky, 2011). Теризинозавридов принято относить к манирапторам (Maniraptora Gauthier, 1986) с “крупнокоготностью”, представляющей плезиоморфный признак в кладе. Морфологическое разнообразие теризинозаврид отражалось в различной величине когтевых фаланг кисти, расширявшей ее функции и отражавшей адаптацию к условиям среды обитания (Paul, 1984; Weishampel, Norman, 1989; Russell D.A., Russell D.E., 1993; Zhang et al., 2001; Kirkland et al., 2005). Расширение спектра питания было главным двигателем развития растительноядности у теропод и стратегии их выживания. Когтевые фаланги соответствовали различным вариациям их применения, начиная с хватательных у базальных хищных форм и до загребающих движений у теризинозавридов, питавшихся растительной пищей (Lautenschlager, 2014). Хватательная кисть была не только у базальных форм. Она также сохранялась и у позднейших тероподов, таких как дромеозавриды (Dromaeosauridae Matthew et Brown, 1922) и менее генерализованных овирапторидов, в едва ли не эталонном морфологическом строении (рис. 1).
“Крупнокоготность” у теризинозавридов и дейнохейридов определяет наиболее радикальные преобразования кисти, становясь выразительным индикатором их растительноядности. Радикальность и уникальность перестроек в строении кисти становились, возможно, эволюционно перспективными, повышавшими конкурентоспособность их обладателей. Предельная специализация строения кисти у теризинозавра и дейнохейра также иллюстрирует мозаичную эволюцию морфологии тероподов, особенно на позднейшем этапе их расцвета. Типично трехпалая кисть теропода подвергалась иной форме радикальной эволюционной перестройки. Двупалость кисти тираннозаврида и однопалость по крайней мере у одного из алвареззауридов (Alvarezsauridae Bonaparte, 1991) дают основания предполагать направленность в ее развитии. Давно известная двупалость тираннозаврида обычно считалась заурядной редукцией трехпалой кисти теропода, которой можно не придавать особого значения. Однако прогрессивная редукция передних конечностей и двупалая (равно как и однопалая) кисть с утратой функции захвата указывают на вероятное изменение способа питания, подкрепляемое также нахождением гастролитов у тарбозавра. Плотоядные формы, как правило, не бывают только охотниками или падальщиками (Farlow, Holtz, 2002). По-видимому, прогрессивная редукция указанных структур, наиболее выраженная у позднейших форм, отражает экоморфологически выигрышное направление в эволюции гигантских хищников в нише падальщиков, сполна обеспечивавшее их потребности. Хорошим примером служат крупные птицы-падальщики.
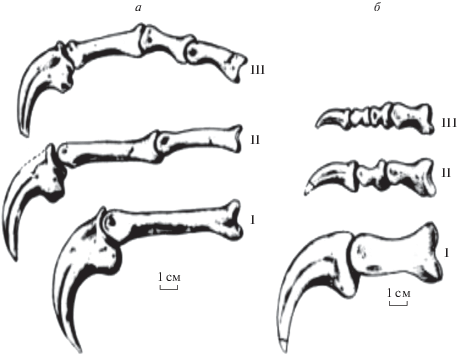
Признаками смены типа питания считаются также отсутствие зубов и развитие клюва, влиявшие на их биомеханику (Lautenschlager et al., 2013). У беззубых орнитомимидов и дейнохейридов, снабженных клювом, в сочетании с обнаруженными гастролитами и кистью, утратившей способность фиксировать объекты, комплекс морфологических преобразований кажется превышающим минимально необходимые при смене трофической ниши. У беззубых овирапторидов выделяются две линии: более генерализованная, как овирапторины (Oviraptorinae Barsbold, 1981), и менее генерализованная, как ингениины (Ingeniinae Barsbold, 1981). Массивный роговой клюв, покрывавший ростральную часть челюстных костей и способствовавший усиленному сжатию челюстей, известен у обеих линий. Кисть у овирапторинов (рис. 3а) по строению не уступает кисти дромеозавридов с максимально развитой способностью схватывать жертву (рис. 1), подтверждаемой на полноценных примерах (Ostrom, 1969; Барсболд, 1983, 2016). У более специализированных ингениинов кисть (рис. 3б) совсем другая: первый палец мог бы нести какую-то нагрузку, два наружных пальца редуцированы, их когтевые фаланги уменьшены, менее изогнуты, способность к схватыванию практически отсутствует. Строение подобной кисти могло бы предполагать развитие кожистой (плавательной) перепонки. С этим согласуется удлинение остистых отростков хвостовых позвонков, превращающее хвост в плавательный орган. Не питались ли ингениины моллюсками в озерах позднемелового времени (Мартинсон, 1982; Барсболд, 1983), поменяв среду обитания, но сохраняя в видоизмененном виде образ жизни плотоядного животного? Овирапторины с хорошо выраженной хватательной кистью не меняли тип питания, невзирая на отсутствие зубов и наличие клюва, характерных для хищных птиц.
Рис. 3.
Пальцы (I, II, III) правой кисти слева. а – более генерализованный овирапторид ситипати (Citipati Clark, Nоrell et Barsbold, 2001); б – менее генерализованный овирапторид ингения (Ingenia Barsbold, 1981).
В условиях высокой конкуренции и давления отбора многообразие ниш с богатыми пищевыми растительными ресурсами открывало широкие возможности для видообразования и могло быть использовано новыми формами для выхода в новые трофические зоны, еще не освоенные тероподами ранее. Их адаптивная радиация приобретала новые черты и направления за счет ветвей, отклонявшихся от освоенных ранее привычных ниш. Среди дромеозавридов, маневренных наземных суперхищников, оснащенных первоклассным вооружением для нападения и защиты (Ostrom, 1969; Барсболд, 1974, 2016), появляются водно-наземная (Cau et al., 2017) и едва ли не крылатая формы (Xu et al., 2002), характеризующие необычно широкий адаптивный потенциал группы. Теризинозавриды и дейнохейриды в крупном размерном классе сохраняли тероподовый облик, но стали вегетарианцами. Орнитомимиды – одна из немногих ветвей тероподов, обитавших в течение всего, наиболее длительного во всем фанерозое, мелового периода (80 млн лет). Группа уже в раннем мелу перешла к растительноядности, в позднем мелу еще шире освоила ее различные типы, будучи в весовой категории на два порядка легче, чем родственные им дейнохейриды (около 7 т; Lee et al., 2014). В развитии овирапторид большая примитивность морфологического строения коррелировала с хищничеством. Смена типа питания означала и смену поведения у изменивших питание тероподов, что, по всей вероятности, кардинально изменяло эволюционную судьбу видов внутри их сообществ и экосистемы в целом. Это не могло не влиять на эволюцию так называемых “динозавровых фаун” в последнюю и позднейшую эпоху их развития, включавшую различных рептилий, млекопитающих и многие другие организмы.
УВЕЛИЧЕНИЕ ОБЪЕМА ГОЛОВНОГО МОЗГА
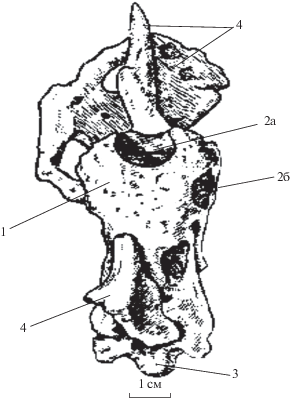
У продвинутых овирапторидов установлено увеличение объема головного мозга в обратной пропорции к весу тела. Это бросается в глаза при рассмотрении объема головного мозга и веса монгольских тарбозавров. При расчетном весе их тела 5000 кг объем мозговой полости был менее 300 см3 (Малеев, 1965), превышая примерно на треть объем, занятый собственно головным мозгом. У ингении (Ingenia Barsbold, 1981), судя по сохранившемуся природному нейрокраниальному отливу (псевдоморфозе; рис. 4), объем мозга достигал 35–40 см3 при весе тела самое большее 25–30 кг. Ингения, таким образом, будучи в 200 раз легче тарбозавра по весу, в пропорции обладала не менее чем 40-кратно более крупным головным мозгом. Это делало ее во столько же раз “интеллектуальнее” гигантских хищников, в определенной мере соотносясь с троодонтидами (Troodontidae Gilmore, 1924), имевшими более совершенные сенсорные органы и занимавшими едва ли не высшее место среди неавиальных (non-Avialan) тероподов, соответствуя по уровню развития головного мозга современным страусам (Russell, 1969; Hopson, 1977). Возможно, больший относительный размер мозга обеспечивал относительно мелким формам некоторое преимущество перед гигантами, но все же не спасшее их от “великого вымирания” в конце мезозоя.
Рис. 4.
Природный отлив головного мозга ингении (Ingenia Barsbold, 1981): 1 – большие полушария переднего мозга; зачерненные округлые отверстия соответствуют: 2а – основанию обонятельного тракта, 2б – правой зрительной доле; 3 – затылочный мыщелок; 4 – остатки костной ткани крыши черепа. (По: Барсболд, 1983).
ОРНИТИЗАЦИЯ ТЕРОПОДОВ
С последней трети прошлого столетия в рамках концепции “динозавры–птицы” обсуждался широкий круг эволюционно-морфологических проблем в изучении динозавров. Ныне по многочисленным филогенетическим схемам (рассмотрение которых не входит в задачи данного исследования) в линиях неавиальных тероподов дромеозавридов сильнее всего сближают с птицами. Вместе с тем, по степени близости к птицам монгольские овирапториды рассматривались как конкуренты дромеозавридов (Lu et al., 2002) или же как настоящие птицы, вторично утратившие способность к полету (Maryańska et al., 2002). У овирапторозавра номингии (Nomingia Barsbold et al., 2000) впервые обнаружены укороченный (почти втрое) хвостовой отдел позвоночника и пигостиль (Barsbold et al., 2000). Некогда одного этого классического признака было достаточного для отнесения таксона к птицам. Сходство сочленения нижней челюсти овирапторида и ценагната (Caenagnathus Sternberg, 1940, сем. Caenagnathidae), вначале считавшегося древней птицей, привело к признанию их родства (Osmolska, 1976), заложившего основу еще одной формирующейся линии овирапторозавров. Возникнув как довольно проблематичные древние птицы, ценагнатиды снова приближаются к ним, но уже в составе овирапторозавров.
Второе “открытие” дромеозавридов после полувека их забвения (первые два вида описаны в 1922 и 1924 гг.) было связано с получением новых для того времени сведений (Ostrom, 1969), подготовивших нестандартный подход к археоптериксу (Archaeopteryx von Meyer, 1861). Вопреки установившемуся традиционному взгляду археоптерикс стал рассматриваться не как “первоптица”, а как оперенный маленький хищный динозавр (Ostrom, 1975а, b). Родство динозавров и птиц отмечалось Т.Г. Гексли еще полтора столетия назад. В настоящее время дромеозавридов воспринимают как группу, продвинутую к авиальным тероподам (Avialae Gauthier, 1986), к которым относится и aрхеоптерикс. Сходство этих ветвей определяется их родством. Согласно одной из современных позиций, птиц относят к тероподам, ныне живущим динозаврам, освоившим некогда полет. Это позволило им выйти в новую адаптивную зону – воздушное пространство. Фундаментом такого перехода было строение и поведение таких тероподов, как дромеозавриды, овирапториды и троодонтиды (Padian, 2004). Опистопубический (Barsbold, 1979; Барсболд, 1983) таз у дромеозавридов и археоптерикса (помимо других тероподных черт) рассматривался как прогрессивный признак в разных вариантах анатомического строения, экоморфологии и происхождения. Родственные связи хищных динозавров и птиц основываются на сравнении морфологических черт, пропорций и сочленений в посткраниальных структурах у ряда тероподов, включая и дромеозавридов. Далеко не всегда учитывают, что морфологические инновации последних прослеживаются через их вероятные древние родственные связи, восходившие к археоптериксу (Ostrom, 1969, 1975a, b, 1976). Ранее не замечавшееся сходство скелета у позднеюрского археоптерикса и меловых дромеозавридов в немалой мере определяется параллельной эволюцией родственных (в разной мере) линий тероподов (Барсболд, 1983). Заселение многочисленных ниш, определившее эволюционный успех развития тероподов, подтверждается их богатым разнообразием, особенно позднейших форм. Особенно заметны в этом плане дромеозавриды, подступавшие, как отмечалось выше, также к освоению водного и даже воздушного пространства. У дромеозавридов функцией схватывания обладала не только кисть, но и стопа с “хищническим” когтем. Обе морфологические адаптации направлены на фиксацию добычи, ее умерщвление (известное у современных хищных птиц), а также лазание по деревьям как важному отправному моменту в эволюции полета. Стопа дромеозавридного типа у “почти птичьих” (paravian) тероподов является функциональным заимствованием (эксаптацией) в эволюции стопы птиц, ранние формы которых первоначально вели древесный образ жизни (Fowler, 2009; Fowler et al., 2011). Древесный образ жизни и специфика поведения тероподов, сходных с дромеозавридами, способствовали возникновению вспархивания и далее формированию активного машущего полета птиц (Manning et al., 2009).
МОЗАИЧНОСТЬ В ЭВОЛЮЦИИ ТЕРОПОДОВ
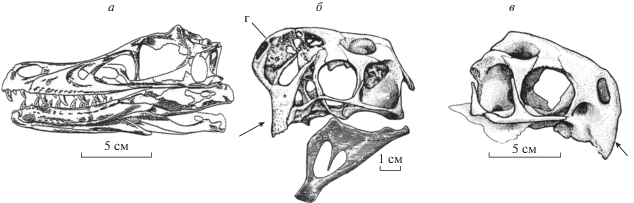
Комбинация относительно генерализованных (примитивных для рассматриваемой группы) и специализированных (продвинутых) признаков представляет наиболее яркую особенность эволюционной морфологии тероподов на позднейшем этапе их эволюции. Среди них особо выделяются две ветви, уже упоминавшиеся выше, – дромеозавриды и овирапториды. Они отличались и от других тероподов, и, особенно, друг от друга комплексом, по сути, противоположных черт. Дромеозавриды и овирапториды наилучшим образом демонстрируют сочетание различных признаков, едва ли заметных на более ранних этапах эволюции тероподов и никогда не достигавших такой морфологической выраженности, как на позднейшем этапе их эволюции. Ниже приводятся в сжатой форме наиболее иллюстративные из этих контрастных морфологических признаков. Дромеозавриды обладали черепом (рис. 5а), типичным для тероподов (Barsbold, Osmolska, 1999). Различия в деталях и пропорциях строения не отменяют его относительную примитивность. Череп же овирапторидов (Барсболд, 1983; Elzanowski, 1999; Osmolska et al., 2004) сильно отклоняется от характерной для тероподов нормы и становится крайне специализированным (рис. 5б). Посткраниальный скелет у обеих ветвей, соответствуя позднебазальному типу, способен к модификациям. У дромеозавридов стопа при локомоции функционально двупалая, так как второй палец стопы с увеличенной когтевой (“хищнической”) фалангой не мог выполнять функцию опоры на субстрат (Ostrom, 1969; Osmolska et al., 2004). Стопа у овирапторидов в рамках тероподовой нормы. Таз у дромеозавридов характеризуется опистопубической, у овирапторидов – препубической долихоилией, типичной для тероподов. Хвостовые позвонки у дромеозавридов с удлиненными соединяющими элементами преобразованы в жесткую упругую структуру, использовавшуюся в качестве балансира при крутых виражах (Ostrom, 1969) и упругой опоры на субстрат. Это позволяло в случае необходимости освобождать задние конечности для применения “хищнических” когтей стоп, что выразительно продемонстрировано на уникальной фоссилии “дерущиеся динозавры”. Хвостовой отдел у овирапторидов по сравнению с тероподами укорачивался, составляя половину его длины, отмечаемой у различных форм в менее продвинутом состоянии, а в случае формирования пигостиля укорочение еще более увеличивалось (Barsbold et al., 2000). Таким образом, посткраниальный скелет у дромеозавридов отражает уникальные специализации, тогда как в строении их черепа не было сопоставимых по масштабу морфологических изменений. У овирапторидов столь же уникальные специализации касались строения черепа, но в посткраниальном скелете изменяется строение только отмеченных выше структур. Эти две ветви наиболее ярко демонстрируют разнообразие теропод.
Рис. 5.
Череп и нижняя челюсть слева: а – дромеозаврид велоцираптор (Velociraptor Osborn, 1924); б, в – овирапториды: б – ситипати (Citipati Clark, Norell et Barsbold, 2001), в – конхораптор (Conchoraptor Barsbold, 1981), вид справа, без нижней челюсти. Стрелкой указана массивная предчелюстная кость, основа рогового клюва. г – костный гребень.
Морфология посткраниального скелета у дромеозавридов отражает уникальные специализации, однако их модификации находятся в русле “усредняющей” орнитизации. В эволюционной морфологии дромеозавридов и овирапторидов, ныне таксономически не очень обширных групп, орнитизация представляется прогрессивной, и, возможно, это основное эволюционное русло морфологических преобразований формировалось под действием стабилизирующего отбора среди позднейших тероподов. При этом эволюция в направлении действия отбора означала выход таксонов на магистральные пути последнего, действовавшего в течение длительного периода расцвета динозавров на Земле, в экосистемах которой дромеозавриды и овирапториды занимали свое достойное место.
ЗАКЛЮЧЕНИЕ
1. Способности кисти захватывать и удерживать объекты у хищных динозавров придается большое значение как показателю хищнического образа жизни. Экоморфологические особенности, проявляющиеся в модификациях кисти, а также в появлении мускульного желудка, согласуются с трансформацией типа питания от плотоядного до растительноядного. Двупалость и однопалость, как последовательное развитие трехпалой тероподовой кисти, вместе с “крупнокоготностью” представляют собой радикальные модификации, отражавшие нелинейный характер эволюции, приводившей не только к смене кормовых объектов, но и по необходимости к смене среды обитания и способа добычи пищи. Трансформация пищевого рациона означала также и смену стратегии поведения сменивших пищевые предпочтения тероподов, тем самым изменяя эволюционную судьбу таксонов внутри их сообществ и экосистемы в целом, вызывая далеко идущие последствия в эволюции группы.
2. Потеря зубов и развитие рогового клюва не всегда сопровождается сменой пищевого рациона: овирапториды с бoльшим числом примитивных черт сохраняли способную к захвату объектов кисть и плотоядность, тогда как у форм с меньшим числом примитивных черт формируется модифицированная не способная к захвату объектов кисть, которая, вероятно, более соответствовала условиям среды их обитания и способу добычи пищи.
3. Овирапторидов, так же как и дромеозавридов, сближают с птицами (или рассматривают как настоящих птиц, вторично утративших способность к полету). Овирапториды – единственная группа среди тероподов, которой характерно прогрессивное укорочение хвостового отдела позвоночника с развитием пигостиля – признака, некогда считавшегося уникальной чертой птиц. Способная к захвату стопа дромеозавридов, приспособленная к лазанию по деревьям, действительно могла служить эксаптацией стопы птиц, отражая их адаптацию к древесному образу жизни, который был необходим для развития полета. Орнитизация была прогрессивной тенденцией в эволюции позднейших тероподов, вероятно, обусловленная действием стабилизирующего отбора и маркировавшая выход групп на магистральные пути их эволюции.
4. Увеличение относительного объема головного мозга могло быть выгодным для животных меньших размерных классов, предположительно из-за большего совершенства их сенсорных органов.
5. В эволюции дромеозавридов и овирапторидов ярко проявляется мозаичность их организации, что выражается в сочетании относительно примитивных и уникальных специализированных черт, контрастных и нередко противоположных по сути, демонстрируя разнообразие эволюционной морфологии поздних хищных динозавров. Сходство некоторых морфологических черт этих групп является результатом параллельной эволюции родственных линий различной степени близости.
Список литературы
Барсболд Р., 1974. Поединок динозавров // Природа. № 2. С. 81–83.
Барсболд Р., 1976. О новом позднемеловом семействе мелких теропод Oviraptoridae fam. nov. Монголии // Докл. АН СССР. Т. 226. № 3. С. 685–688.
Барсболд Р., 1981. Беззубые хищные динозавры Монголии // Тр. Совм. Сов.-Мон. Палеонтол. Экспед. № 15. С. 28–39.
Барсболд Р., 1983. Хищные динозавры мела Монголии. Тр. Совм. Сов.-Мон. Палеонтол. Эксп. № 19. М.: Наука. 120 с.
Барсболд Р., 2016. “Дерущиеся динозавры”: расположение их тел до и после смерти // Палеонтология, стратиграфия, астробиология. К 80-летию академика А.Ю. Розанова. М.: ПИН РАН. С. 93–102.
Малеев Е.А., 1955. Гигантские хищные динозавры Монголии // Докл. АН СССР. Т. 104. № 4. С. 634–637.
Малеев Е.Н., 1965. О мозге хищных динозавров // Палеонтол. журн. № 2. С. 141–143.
Мартинсон Г.Г., 1982. Позднемеловые моллюски Монголии: Систематика, стратиграфия, тафономия. Тр. Совм. Сoв.-Мон. Палеонтол. Экспед. № 17. М.: Наука. 82 с.
Рождественский А.К., 1970. О гигантских когтевых фалангах загадочных рептилий мезозоя // Палеонтол. журн. № 1. С. 131–141.
Barrett P.M., 2005. The diet of ostrich dinosaurs (Theropoda: Ornithomimosauria) // Palaeontology. V. 48. № 2. https://doi.org/10.1111/j.1475-4983
Barrett P.M., Rayfield E.J., 2006. Ecological and evolutionary implications of dinosaur feeding behaviour // Trends Ecol. Evol. V. 21. № 4. P. 217–224.
Barsbold R., 1979. Opisthopubic pelvis in the saurischian dinosaurs // Nature. V. 279. P. 792–793.
Barsbold R., Osmolska H., 1999. The skull of Velociraptor (Theropoda) from the Late Cretaceous of Mongolia // Acta Paleontol. Polon. V. 44. P. 189–199.
Barsbold R., Currie P.J., Myhrwold N., Osmolska H., Tsogtbaatar Kh., Watabe M., 2000. The first pygostyle from a non-avian theropod // Nature. V. 403. P. 155–156.
Bonaparte J.P., 1991. Los vertebrades fosiles de la Formacion Rio Colorado, le siudad de Neuquen y cercanias, Cretacico superior, Argentina // Rev. Mus. Argent. Cienc. Nat. “Bernardino Rivadavia”. V. 4. P. 17–123.
Cau A., Beyrand V., Voeten D.F.A.E., Fernandez V., Tafforeau P., Stein K., Barsbold R. et al., 2017. Synchrotron scanning reveals amphibious ecomorphology in a new clade of bird-like dinosaurs // Nature. V. 552. P. 395–399.
Chinzorig Ts., Kobayashi Y., Tsogtbatar Kh., Currie P.J., Takahashi R., Tanaka T., Iijima M., Barsbold R., 2017. Onithomimosaurs from the Nemegt Formation of Mongolia: Manus morphological variation and diversity // Palaeogeogr. Palaeoclimatol. Palaeoecol. V. 494. P. 91–100.
Clark J.M., Norell M.A., Barsbold R., 2001. Two new oviraptorids (Theropoda: Oviraptorosauria), Upper Cretaceous Djadokhta Formation, Ukhaa Tolgod, Mongolia // J. Vert. Paleontol. V. 21. № 2. P. 209–213.
Elzanowski A., 1999. A comparison of the jaw skeleton in theropods and birds, with a description of the palate in the Oviraptoridae // Smithsonian Contrib. Paleobiol. V. 89. P. 311–323.
Farlow J.O., Holtz T.R., Jr., 2002. The fossil record of predation in dinosours // Paleontol. Soc. Papers. V. 8. P. 251–265.
Fowler D.W., 2009. The grasping foot of Deinonychus: Implications for predator ecology, evolution of the perching foot, and a new hypothesis for the origin of flight in birds // J. Vert. Paleontol. V. 29. № 3. P. 98.
Fowler D.W., Freedman E.A., Scannella J.B., Kambic R.E., 2011. The predatory ecology of Deinonychus and the origin of flapping in birds // PLoS One. V. 6. № 12. P. e28964.
Gauthier J., 1986. Saurischian monophyly and the origin of birds // The Origin of Birds and the Evolution of Flight / Ed. Padian K. San Francisco: Mem. California Acad. Sci. V. 8. P. 1–55.
Gilmore C.W., 1924. On Troodon validus, an ornithopodous dinosaur from the Belly River Cretaceous of Alberta, Canada // Bull. Dept. Mines Geol. Surv. V. 38. P. 13–26.
Hopson J.A., 1977. Relative brain size and behaviour in archosaurian reptiles // Annu. Rev. Ecol. Syst. V. 8. P. 429–488.
Huene F., 1914. Das naturliche System der Saurischia // Zbl. Miner. Geol. Palaontol. S. 154–158.
Kirkland J.I., Wolfe D.J., 2001. First definitive therizinosaurid (Dinosauria, Theropoda) from North America // J. Vert. Paleontol. V. 21. P. 410–414.
Kirkland J.I., Zanno L.E., Sampson S.D., Clark J.M., DeBliex D.D., 2005. A primitive therizinosauroid dinosaur from the Early Cretaceous of Utah // Nature. V. 435. № 7038. P. 84–87.
Kobayashi Y., Lű J.-C., Dong Z.-M., Barsbold R., Azuma Y., Tomida Y., 1999. Herbivorous diet in an ornithomimid dinosaur // Nature. V. 402. P. 480–481.
Lautenschlager S., 2014. Morphological and functional diversity in therizinosaur claws and the implications for theropod claw evolution // Proc. Biol. Sci. V. 281. № 1785. https://doi.org/10.1098/rspb.2014.0497.
Lautenschlager S., Witmer L.M., Perle A., Rayfield E.J., 2013. Edentulism, beaks, and biomechanical innovations in the evolution of theropod dinosaurs // PNAS. V. 110. № 51. P. 657–662.
Lee N-Y., Barsbold R., Currie P.J., Kobayashi Y., Lee H.-J. et al., 2014. Resolving the long-standing enigmas of a giant ornithomimosaur Deinocheirus mirificus // Nature. V. 515. P. 257–260.
Li D., Peng C., You H., Lamanna M.C., Harris J.D., Lacovara K.J., Zhang J., 2007. A large therizinosauroid (Dinosauria: Theropoda) from the Early Cretaceous of Northwestern China // Acta Geol. Sin. V. 81. P. 539–549.
Lu J., Dong Z.M., Azuma Y., Barsbold R., Tomida Y., 2002. Oviraptorosaurs compared to birds // Proceed. 5th Symposium Soc. Avian Paleont. Evol. / Eds Zhou Z.-H., Zhang F.-C. Beijing: Sci. Press. P. 175–189.
Manning P.L., Margetts L., Johnson M.R., Withers P.J., Sellers W.I. et al., 2009. Biomechanics of dromaeosaurid dinosaur claws: Application of X-ray microtomography, nanoindentation, and finite element analysis // Anat. Rec. Hoboken. V. 292. № 9. P. 1397–1405.
Marsh O.C., 1881. Principal characters of American Jurassic dinosaurs // Am. J. Sci. S. 3. V. 21. P. 417–423.
Maryańska T., Osmolska H., Wolsan M., 2002. Avialan status for Oviraptorosauria // Acta Palaeontol. Pol. V. 47. № 1. P. 97–116.
Matthew W.D., Brown B., 1922. The family Deinodontidae, with notice of a new genus from the Cretaceous of Alberta // Bull. Amer. Mus. Nat. Hist. V. 46. № 6. P. 367–385.
Meyer H., von, 1861. Archaeopteryx lithographica (Vogel Feder) und Pterodactylus von Solnhofen // N. Jb. Min. Geol. Palaont. S. 678–679.
Osborn H.F., 1905. Tyrannosaurus and other Cretaceous carnivorous dinosaurs // Bull. Amer. Mus. Nat. Hist. V. 21. P. 259–265.
Osborn H.F., 1917. Skeletal adaptations of Ornitholestes, Strutiomimus, Tyrannosaurus // Bull. Amer. Mus. Nat. Hist. V. 35. P. 733–771.
Osborn H.F., 1924. Three new Theropoda, Protoceratops zone, central Mongolia // Amer. Mus. Novit. № 144. P. 1–12.
Osmolska H., 1976. New light on the skull anatomy and systematic position of Oviraptor // Nature. V. 262. № 5570. P. 683–684.
Osmolska H., Roniewicz E., 1970. Deinocheiridae, a new family of theropod dinosaurs // Paleontol. Polonica. V. 21. P. 5–19.
Osmolska H., Currie P.J., Barsbold R., 2004. Oviraptorosauria // The Dinosauria, second edition / Eds Weishampel D.B., Dodson P., Osmolska H. Berkeley: Univ. California Press. P. 7–19.
Ostrom J.H., 1969. Osteology of Deinonychus antirropus, an unusual theropod from the Lower Cretaceous of Montana // Bull. Peabody Mus. Nat. Hist. V. 30. P. 1–165.
Ostrom J.H., 1975a. The origin of birds // Annu. Rev. Earth Planet. Sci. V. 3. P. 55–77.
Ostrom J.H., 1975b. On the origin of Archaeopteryx and the ancestry of birds // Colloq. Int. CNRS. V. 218. P. 519–532.
Ostrom J.H., 1976. Archaeopteryx and the origin of birds // Biol. J. Linnean Soc. V. 8. P. 91–182.
Padian K., 2004. Basal Avialae // The Dinosauria, second edition / Eds Weishampel D.B., Dodson P., Osmolska H. Berkeley: Univ. California Press. P. 210–231.
Paul G.S., 1984. The segnosaurian dinosaurs: Relics of the prosauropod-ornithischian transition? // J. Vert. Paleontol. V. 4. P. 507–515.
Romer A.S., 1956. Osteology of the Reptiles. Chicago: Univ. Chicago Press. 468 p.
Russell D., 1969. A new specimen of Stenonychosaurus from the Oldman Formation (Cretaceous) of Alberta // Can. J. Earth Sci. V. 6. P. 595–612.
Russell D.A., Russell D.E., 1993. Mammal–dinosaur convergence – evolutionary convergence between a mammalian and dinosaurian clawed herbivore // Natl. Geogr. Res. Explor. V. 9. P. 70–79.
Sternberg R.M., 1940. A toothless bird from the Cretaceous of Alberta // J. Paleontol. V. 14. № 1. P. 81–85.
Weishampel D.B., Norman D.B., 1989. Vertebrate herbivory in the Mesozoic: Jaws, plants, and evolutionary metrics // Paleobiology of the Dinosaurs / Ed. Farlow J.O. Geol. Soc. Am. Pap. V. 238. P. 87–100.
Xu X., Norel M.A., Wang X.L., Makovicky P.J., Wu X.C., 2002. A basal troodontid from the Early Cretaceous of China // Nature. V. 415. № 6873. P. 780–784.
Zanno L.E., 2010. A taxonomic and phylogenetic re-evaluation of Therizinosauria (Dinosauria: Maniraptora) // J. Syst. Palaeontol. V. 8. P. 503–543.
Zanno L.E., Makovicky P.J., 2011. Herbivorous ecomorphology and specialization patternsin theropod dinosaur evolution // Proc. Natl Acad. Sci. USA. V. 108. P. 232–237.
Zanno L.E., Gillette D.D., Albright L.B., Titus A.L., 2009. A new North American therizinosaurid and the role of herbivory in ‘predatory’ dinosaur evolution // Proc. R. Soc. B. V. 276. P. 3505–3511.
Zhang X.-H., Xu X., Sereno P., Kuang X.-W., Tan L., 2001. A long-necked Therizinosauroiddinosaur from the Upper Cretaceous Iren Dabasu Formation of Nei Mongol, People’s Republic of China // Vert. PalAs. V. 39. P. 282–290.
Zhou Z., Zhang F., 2002. Largest bird from the Early Cretaceous and its implications for the earliest avian ecological diversification // Naturwissenschaften. V. 90. P. 220–225.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


