Журнал общей биологии, 2020, T. 81, № 5, стр. 387-393
Высокий уровень встречаемости эндосимбионта Wolbachia в популяциях сибирского шелкопряда Dendrolimus superans sibiricus Tschetverikov, 1908 (Lepidoptera: Lasiocampidae) на территории России
Р. А. Быков 1, *, Г. В. Юрлова 1, М. А. Деменкова 1, В. В. Дубатолов 2, И. А. Керчев 2, А. П. Бурнашева 3, А. С. Рябинин 1, Е. С. Захаров 3, А. П. Шаповал 4, Ю. Ю. Илинский 1, 5
1 Институт цитологии и генетики СО РАН
630090 Новосибирск, пр. ак. Лаврентьева, 10, Россия
2 Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
3 Институт биологических проблем криолитозоны СО РАН
677000 Якутск, пр. Ленина, 41, Россия
4 Биологическая станция “Рыбачий” Зоологического института РАН
238535 Калининградская обл., пос. Рыбачий, ул. Победы, 32, Россия
5 Всероссийский центр карантина растений
140150 Московская обл., с. Быково, ул. Пограничная, 32, Россия
* E-mail: bykovra@bionet.nsc.ru
Поступила в редакцию 25.03.2020
После доработки 30.04.2020
Принята к публикации 11.06.2020
Аннотация
Сибирский шелкопряд Dendrolimus superans sibiricus – один из опасных вредителей хвойных лесов. Вспышки численности популяций этого вида наносят существенный экологический и экономический ущерб, приводя к гибели хвойных лесов. Ранее у D. superans в популяциях Хабаровского края нами была выявлена высокая частота встречаемости симбиотических бактерий Wolbachia. Эти матерински наследуемые симбионты насекомых могут являться как мутуалистами, так и репродуктивными паразитами. В данной работе мы приводим данные о распространенности и генетическом разнообразии Wolbachia в популяциях D. superans Хабаровского края, Якутии и Томской области. Нами показан высокий уровень инфицированности (69–100%) популяций сибирского шелкопряда, поддерживающийся в географически удаленных популяциях в течение нескольких лет. Генетическое разнообразие Wolbachia в популяциях D. superans Томской области и Хабаровского края представлено двумя гаплотипами ST-41 и ST-353, а в Якутии выявлен один гаплотип ST-353. Высокие частоты встречаемости и схожий генетический состав Wolbachia у D. superans в популяциях разных регионов, возможно, указывают на глубокую интеграцию симбионта в жизненный цикл вида-хозяина.
Представители р. Dendrolimus Germar, 1812 являются опасными вредителями хвойных лесов (Han et al., 2019; Qin et al., 2019; Skrzecz et al., 2020; Wilstermann et al., 2020). Мировая фауна насчитывает более 35 видов и подвидов; на территории России распространены три вида: Dendrolimus pini (L., 1758), D. spectabilis (Butler, 1881) и D. superans (Butler, 1881) (Золотухин, 2015, 2019). Сибирский шелкопряд D. superans sibiricus Tschetverikov, 1908 является одним из основных вредителей хвойных лесов на территории Евразии (Рожков, 1963; Mikkola, Ståhls, 2008). Гусеницы питаются на деревьях родов Pinus, Larix, Abies и Picea (Kirichenko et al., 2009; Золотухин, 2015). Вспышки численности D. superans приводят к дефолиации и гибели хвойных лесов, что наносит существенный экономический ущерб лесному хозяйству (Рожков, 1963; Baranchikov et al., 1997; Гродницкий, 2004; Mikkola, Ståhls, 2008).
Ранее мы выявили высокий уровень встречаемости симбиотической бактерии Wolbachia у D. superans в популяциях Хабаровского края (Юдина и др., 2017). Бактерии р. Wolbachia – это матерински наследуемые симбионты, которые могут существенно влиять на биологию вида-хозяина. Wolbachia может приводить к нарушению половой структуры популяций некоторых видов чешуекрылых в сторону преобладания самок за счет вызываемых симбионтом феминизации и андроцида (Charlat et al., 2007; Narita et al., 2007; Graham, Wilson, 2012). В некоторых случаях Wolbachia может индуцировать цитоплазматическую несовместимость, при этом показано, что у одного вида может присутствовать несколько штаммов Wolbachia, вызывающих разные репродуктивные аномалии (Hiroki et al., 2004; Charlat et al., 2006; Salunkhe et al., 2014; Arai et al., 2019). Помимо индукции репродуктивных аномалий, Wolbachia может выступать и в роли мутуалиста. Так, у ночной бабочки-листовертки Homona magnanima (Lepidoptera, Tortricidae) присутствие Wolbachia ускоряет развитие личинок и увеличивает массу куколок (Arai et al., 2019). У других видов насекомых Wolbachia может предоставлять питательные вещества своему хозяину (Kremer et al., 2009; Hosokawa et al., 2010), защищать от вирусов и паразитов (Teixeira et al., 2008; Cattel et al., 2016; Nouhuys et al., 2016), увеличивать продолжительность жизни и плодовитость инфицированных особей (Barro, Hart, 2001; Dong et al., 2007; Mariño et al., 2017), а в некоторых случаях искусственная элиминация данного симбионта у взрослых самок приводит к их полной стерильности (Dedeine et al., 2001).
Интерес к исследованию Wolbachia в популяциях D. superans обусловлен тем, что для этого вида характерны вспышки численности, которые могут как влиять на динамику и генетический состав Wolbachia, так и быть опосредованы присутствием симбионта. Изучение различных удаленных друг от друга популяций дает возможность оценить масштабы распространения Wolbachia и ее генетическое разнообразие у D. superans. В данной работе мы расширили географию нашего прошлого исследования (Юдина и др., 2017), включая в него популяции D. superans Якутии и Томской области, и пытались ответить на следующие вопросы: 1) отличаются ли частоты встречаемости Wolbachia в разных популяциях, 2) какие варианты Wolbachia встречаются в разных регионах, 3) есть ли ассоциация вариантов мтДНК D. superans и Wolbachia. Помимо этого, мы проверили на наличие Wolbachia выборку близкого к сибирскому шелкопряду вида – соснового коконопряда D. pini.
МАТЕРИАЛЫ И МЕТОДЫ
Коллекция насекомых. Материал D. superans представлен выборками 1999–2018 гг. из трех регионов России: Томской области, Якутии и Хабаровского края. Объем коллекции составил 194 образца (табл. 1). Дополнительно в анализ были взяты девять образцов D. pini, собранных в 2018 г. в Калининградской области. Все насекомые после сбора хранились в сухом виде на матрасиках.
Таблица 1.
Встречаемость Wolbachia в популяциях Dendrolimus superans и D. pini
| Регион, локация | Год | Размер выборки | Число инфицированных /% инфицированных*/95% ДИ** |
|---|---|---|---|
| Dendrolimus superans | |||
| Якутия, с. Мырыла | 1999 | 6 | 5 |
| Якутия, г. Покровск | 1999 | 5 | 4 |
| Якутия, с. Борогонцы | 2000 | 2 | 2 |
| Якутия, г. Покровск | 2000 | 1 | 1 |
| Якутия, с. Тёхтюр | 2001 | 7 | 7 |
| Якутия, с. Матта | 2002 | 13 | 9/69/39–91 |
| Якутия, г. Якутск, Намцырский тракт | 2013 | 12 | 10/83/52–98 |
| Хабаровский край, Большехехцирский заповедник*** | 2014 | 9 | 9 |
| Хабаровский край, Большехехцирский заповедник*** | 2016 | 31 | 28/90/74–98 |
| Хабаровский край, Большехехцирский заповедник | 2016 | 3 | 2 |
| Хабаровский край, Ботчинский заповедник | 2016 | 4 | 0 |
| Хабаровский край, Большехехцирский заповедник | 2017 | 64 | 61/93.8/86.9–99.0 |
| Хабаровский край, Большехехцирский заповедник | 2018 | 38 | 33/86.8/72.0–95.6 |
| Томская обл., Кривошеинский р-н | 2017 | 13 | 13/100/75–100 |
| Томская обл., Колпашевский р-н | 2017 | 15 | 15/100/78–100 |
| Томская обл., г. Томск | 2018 | 11 | 10/91/58–100 |
| Dendrolimus pini | |||
| Калининградская обл. | 2018 | 9 | 5 |
Экспериментальные процедуры. Ранее было показано, что Wolbachia у D. superans успешно детектируется как в репродуктивных тканях из брюшка, так и в мышечных тканях ног (Юдина и др., 2017). Выделение ДНК из ног предпочтительнее, поскольку генетический материал в них сохраняется лучше, чем в массивных брюшках, где он зачастую деградирует во время хранения. В связи с этим выделение ДНК в данной работе проводили преимущественно из ног D. superans. Материал индивидуально гомогенизировали в экстрагирующем буфере CTAB (2% CTAB, 1.4 M NaCl, 100 мМ Tris-HCl (pH 8.0), 20 мМ EDTA (pH 8.0)) и инкубировали в течение 2 ч при 56°C. После преципитации ДНК растворяли в 200 мкл бидистилированной воды.
Проверка качества выделения ДНК для всех образцов проводилась методом ПЦР с универсальными праймерами HCO/LCO (Folmer et al., 1994) к гену первой субъединицы цитохром с-оксидазы (COI). Для прошедших проверку образцов определяли статус инфицированности Wolbachia. Для анализа использовали праймеры, специфичные к гену coxA (Baldo et al., 2006). Определение гаплотипа Wolbachia проводилось путем секвенирования пяти генов системы мультилокусного типирования MLST (Baldo et al., 2006) для двух образцов D. pini и для пяти образцов D. superans: по одному из популяций Якутии 2013 г., Хабаровского края 2017 г. и Томской области 2017 г., и двух – из Томской области 2018 г. Помимо этого, нами был получен полный профиль двух изолятов Wolbachia из популяции Хабаровского края 2014 и 2016 гг., для которых в предыдущей работе были проанализированы только два локуса MLST (Юдина и др., 2017). Очистка ампликонов для секвенирования проводилась с помощью экзонуклеазы I E. сoli (New England Biolabs). Очищенные ампликоны секвенировали с использованием набора для секвенирования BrightDye Terminator sequencing kit (Nimagen). Полученные секвенограммы анализировали с помощью программы FinchTV v. 1.4.0. (Geospiza Inc.). Выравнивание нуклеотидных последовательностей изолятов Wolbachia проводили с использованием программ BioEdit v. 7.0.5.3 и MEGA6. Филогенетический анализ Wolbachia проводили в программе MEGA6 с использованием модели нуклеотидных замен GTR и бутстрепом 1000 итераций. Статистическую обработку результатов проводили для выборок объемом ≥10 образцов в программе MS Excel 2013 (Microsoft Corporation) с приложением AtteStat 12.0.5.
РЕЗУЛЬТАТЫ
Эндосимбиотическая бактерия Wolbachia выявлена во всех регионах сбора D. superans, уровень инфицированности варьировал от 69 до 100% (табл. 1). Не выявлено различий в частотах инфицированности между выборками 2002 и 2013 гг. сбора из Якутии (точный тест Фишера, P = 0.64), Томской области (критерий χ-квадрат Пирсона, P = 0.271) и Хабаровского края (критерий χ-квадрат Пирсона, P = 0.308), с учетом данных из работы М.А. Юдиной и соавт. (2017). При сравнении регионов в Томской области инфицированность оказалась достоверно выше, чем в Хабаровском крае и Якутии (критерий χ-квадрат Пирсона, P = 0.013). Кроме того, мы проверили наличие симбионта Wolbachia у соснового коконопряда D. pini, который является близким к D. superans видом и также характеризуется широким ареалом, в значительной степени перекрывающимся с ареалом сибирского шелкопряда. Образцы D. pini были собраны в регионе, где эти два вида вместе не встречаются, а именно в Калининградской области. У нескольких образцов в выборке соснового коконопряда мы выявили симбионта Wolbachia (табл. 1).
Мы охарактеризовали гаплотипические профили Wolbachia у D. superans и D. pini. Два гаплотипа обнаружено у D. superans, ST-41 и ST-353, при этом в Томской области и Хабаровском крае выявлены оба варианта, а в Якутии только ST-353. У D. pini выявлен ST-41. Эти гаплотипы близки, оба относятся к супергруппе В (рис. 1) и встречаются также у других видов чешуекрылых (Ilinsky, Kosterin, 2017).
Рис. 1.
Филогенетическое дерево гаплотипов Wolbachia, построенное методом максимального правдоподобия на основании конкатенированных последовательностей пяти генов MLST (gatB, coxA, hcpA, ftsZ, fbpA). Указаны номера гаплотипов (ST), супергруппы и виды-хозяева Wolbachia. Жирным шрифтом выделены гаплотипы из данного исследования, в скобках указаны регионы сбора: Т. – Томская область, Хбк. – Хабаровский край, Я. – Якутия, Клн. – Калининградская область.
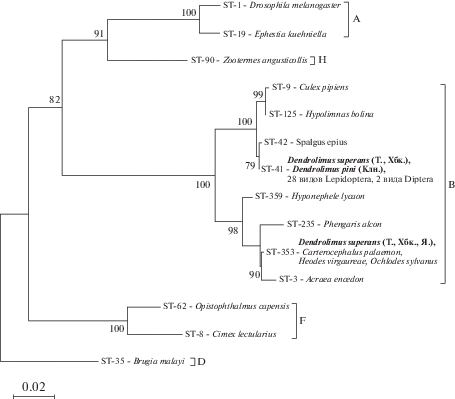
Стоит отметить, что в Хабаровском крае гаплотип ST-353 был выявлен в выборках 2016 и 2017 гг., тогда как ST-41 обнаружен в выборке 2014 г. Аналогичная ситуация наблюдается для гаплотипов в Томской области: ST-353 обнаружен в популяции 2017 г., тогда как ST-41 выявлен в выборке 2018 г.
Поскольку Wolbachia сонаследуется с мтДНК хозяина, мы провели анализ участка гена COI для образцов D. superans из Томской области с разными гаплотипами симбионта. Также в анализ были взяты последовательности гена COI из баз данных GenBank (https://www.ncbi.nlm.nih.gov/genbank/) и BOLD (http://www.boldsystems.org/) для D. superans из Монголии и Японии (рис. 2).
Рис. 2.
Филогенетическое дерево мтДНК D. superans, построенное методом максимального правдоподобия на основании участка гена COI размером 623 п.н. Для последовательностей из баз данных GenBank и BOLD указаны регионы сбора и номера в базе данных (в скобках). Последовательности, полученные в данной работе, выделены жирным шрифтом, для них указаны гаплотипы Wolbachia (в скобках).
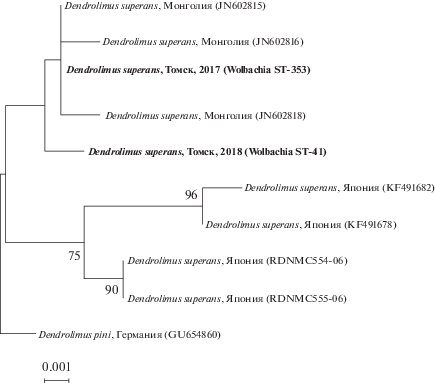
Проведенный анализ показал, что выявленные нами гаплотипы мтДНК D. superans (номера GenBank: MT373807, MT373808) генетически очень близки между собой и отличаются только одной синонимичной нуклеотидной заменой в позиции 35T/C относительно последовательности GenBank № JN602815, а также близки к гаплотипам, выявленным в популяциях Монголии. Таким образом, мы наблюдаем присутствие двух разных гаплотипов Wolbachia у образцов D. superans с филогенетически близкими вариантами мтДНК.
ОБСУЖДЕНИЕ
В данной работе мы провели скрининг популяций D. superans из трех регионов России на присутствие бактерии Wolbachia, а также впервые приводим данные о наличии симбионта у D. pini. Ранее нами было показано, что в популяциях сибирского шелкопряда Хабаровского края уровни инфицированности Wolbachia крайне высокие (Юдина и др., 2017). Здесь мы констатируем высокую частоту встречаемости Wolbachia в удаленных локалитетах ареала D. superans. Несмотря на разделяющие популяции расстояния и, соответственно, разные условия обитания популяций, мы везде наблюдаем стабильно высокую инфицированность, поддерживающуюся в течение продолжительного времени. В ходе исследования инфицированности и генетического разнообразия Wolbachia в популяциях Drosophila melanogaster на обширной территории Палеарктики показано, что в некоторых регионах популяции возобновляются после холодных сезонов, и в них поддерживается уровень инфицированности и генетический состав Wolbachia (Bykov et al., 2019). При этом для D. melanogaster не выявлено значимого влияния симбионта на биологию хозяина. В случае D. superans высокий уровень инфицированности может быть связан с возможным положительным влиянием симбионта на биологию и/или приспособленность хозяина, а также с наличием индуцируемых бактерией репродуктивных аномалий, способствующих распространению инфекции (Charlat et al., 2007; Narita et al., 2007; Graham, Wilson, 2012; Arai et al., 2019). Однако данных о каком-либо влиянии Wolbachia на D. superans в литературе к настоящему моменту нет.
Одинаково также генетическое разнообразие Wolbachia в исследованных регионах. В данном исследовании два гаплотипа Wolbachia, ST-41 и ST-353, выявлены в выборках Томской области, а в Хабаровском крае и Якутии обнаружен только ST-353. Дополнительно мы получили полные профили для двух изолятов Wolbachia, выявленных нами ранее в популяциях D. superans Хабаровского края (Юдина и др., 2017), один соответствовал ST-41, а второй – ST-353. Нельзя исключать, что в популяциях D. superans Якутии также присутствует гаплотип ST-41, но он не был выявлен в силу недостаточного числа проанализированных образцов. Остается вопросом, одинаково ли соотношение данных гаплотипов бактерии в популяциях D. superans или существует динамика частот во времени. Так, в Хабаровском крае мы выявили гаплотип ST-353 в выборках 2016 и 2017 гг., а ST-41 – в выборке 2014 г. В Томской области ST-353 обнаружен в 2017 г., тогда как ST-41 выявлен в выборке 2018 г. С одной стороны, это может быть связано с недостаточным количеством проанализированных образцов и на самом деле во всех выборках присутствуют оба гаплотипа одновременно. С другой стороны, нельзя исключать возможности временной динамики Wolbachia, которая может быть связана с динамикой популяций хозяина. Так, при исследовании инфицированности Wolbachia у лугового мотылька Loxostege sticticalis было обнаружено, что при снижении численности популяции частота встречаемости Wolbachia падала, а в период вспышки численности – возрастала (Malysh et al., 2020). Ранее мы обсуждали возможное влияние двух генетических вариантов Wolbachia на популяционную динамику D. superans (Юдина и др., 2017). Сосуществование разных гаплотипов может привести как к снижению репродуктивного потенциала популяции, так и к вспышке численности.
Известно, что Wolbachia в силу материнского типа наследования ассоциирована с мтДНК вида-хозяина (Marcade et al., 1999; Mercot, Charlat, 2004; Shoemaker et al., 2004; Graham, Wilson, 2012; Ilinsky, 2013; Chen et al., 2017). В случае D. superans мы обнаружили, что образец, содержащий Wolbachia гаплотипа ST-41, имеет гаплотип мтДНК с уникальной нуклеотидной заменой, не имеющей аналогов в базах данных. При этом для ST-353 гаплотип мтДНК не является уникальным и соответствует гаплотипам, выявленным у D. superans из Монголии. Дальнейшие исследования полиморфизма мтДНК и Wolbachia у сибирского шелкопряда должны дать ответ на вопрос об ассоциации гаплотипа ST-41 с выявленным нами гаплотипом мтДНК.
Несмотря на то, что ST-41 и ST-353 близки, относятся к одной супергруппе и им соответствуют генетически близкие гаплотипы мтДНК D. superans, мы не рассматриваем возможность их дивергенции у видов р. Dendrolimus, поскольку ST-41 встречается у многих других видов Lepidoptera, и ST-353 также выявлен у некоторых представителей чешуекрылых (Ilinsky, Kosterin, 2017). В связи с этим можно предположить возможность горизонтального переноса этих гаплотипов Wolbachia. Однако данная гипотеза требует отдельного изучения.
Таким образом, в ходе проведенного исследования нами показаны стабильные частоты встречаемости и одинаковый генетический состав Wolbachia в географически удаленных популяциях сибирского шелкопряда. Эти данные указывают на глубокую интеграцию симбионта в жизненный цикл вида-хозяина, что требует дальнейших исследований симбиотической системы “Wolbachia–D. superans”. Обнаружение у образцов D. superans с генетически близкими гаплотипами мтДНК двух вариантов Wolbachia, распространенных и у других видов чешуекрылых, может указывать на возможность существования внутри- или межвидового горизонтального переноса симбионта.
Поддержано РФФИ, проекты № 18-316-00099 и № 19-04-00983; а также БП № 0324-2019-0041.
Авторы выражают благодарность к. б. н. Даниловой М.В. за техническую помощь.
Список литературы
Гродницкий Д.Л., 2004. Сибирский шелкопряд и судьба пихтовой тайги // Природа. № 11. С. 49–56.
Золотухин В.В., 2015. Коконопряды (Lepidoptera: Lasiocampidae) фауны России и сопредельных территорий. Ульяновск: Корпорация технологий продвижения. 380 с.
Золотухин В.В., 2019. Lasiocampidae // Каталог чешуекрылых (Lepidoptera) России / Под ред. Синева С.Ю. 2-е изд. СПб.: ЗИН РАН. С. 281–284.
Рожков А.С., 1963. Сибирский шелкопряд. Систематическое положение, филогения, распространение, экономическое значение, строение и образ жизни. М.: Изд-во АН СССР. 176 с.
Юдина М.А., Дубатолов В.В., Быков Р.А., Илинский Ю.Ю., 2017. Симбиотическая бактерия Wolbachia в популяциях вредителя хвойных лесов Dendrolimus superans sibiricus Tschetverikov, 1908 (Lepidoptera: Lasiocampidae) // Вавиловский журнал генетики и селекции. Т. 20. № 6. С. 899–903.
Arai H., Hirano T., Akizuki N., Abe A., Nakai M. et al., 2019. Multiple infection and reproductive manipulations of Wolbachia in Homona magnanima (Lepidoptera: Tortricidae) // Microb. Ecol. V. 77. № 1. P. 257–266.
Baldo L., Dunning Hotopp J.C., Jolley K.A., Bordenstein S.R., Biber S.A. et al., 2006. Multilocus sequence typing system for the endosymbiont Wolbachia pipientis // Appl. Environ. Microbiol. V. 72. № 11. P. 7098–7110.
Baranchikov Y.N., Kondakov Y.P., Gottschalk K., Fosbroke S., 1997. Outbreaks of the Siberian moth Dendrolimus superans sibiricus Tschtwrk in central Siberia // Proc. USDA Interagency Gypsy Moth Forum. USDA Forest Service. NEFES, Gen. Tech. Rep. NE-240. P. 10–13.
Bykov R.A., Yudina M.A., Gruntenko N.E., Zakharov I.K., Voloshina M.A. et al., 2019. Prevalence and genetic diversity of Wolbachia endosymbiont and mtDNA in Palearctic populations of Drosophila melanogaster // BMC Evol. Biol. V. 19. № 1. P. 45–53.
Cattel J., Martinez J., Jiggins F., Mouton L., Gibert P., 2016. Wolbachia-mediated protection against viruses in the invasive pest Drosophila suzukii // Insect Mol. Biol. V. 25. № 5. P. 595–603.
Charlat S., Engelstadter J., Dyson E.A., Hornett E.A., Duplouy A. et al., 2006. Competing selfish genetic elements in the butterfly Hypolimnas bolina // Curr. Biol. V. 16. № 24. P. 2453–2458.
Charlat S., Hornett E.A., Fullard J.H., Davies N., Roderick G.K. et al., 2007. Extraordinary flux in sex ratio // Science. V. 317. № 5835. P. 214.
Chen F., Coates B., He K.L., Bai S.X., Zhang T.T., Wang Z.Y., 2107. Effects of Wolbachia on mitochondrial DNA variation in populations of Athetis lepigone (Lepidoptera: Noctuidae) in China // Mitochondrial DNA A. V. 28. № 6. P. 826–834.
Barro P.J., de, Hart P.J., 2001. Antibiotic curing of parthenogenesis in Eretmocerus mundus (Australian parthenogenic form) // Entomol. Exp. Appl. V. 99. № 2. P. 225–230.
Dedeine F., Vavre F., Fleury F., Loppin B., Hochberg M.E., Boulétreau M., 2001. Removing symbiotic Wolbachia bacteria specifically inhibits oogenesis in a parasitic wasp // Proc. Natl. Acad. Sci. V. 98. № 11. P. 6247–6252.
Dong P., Wang J.J., Hu F., Jia F.X., 2007. Influence of Wolbachia infection on the fitness of the stored-product pest Liposcelis tricolor (Psocoptera: Liposcelididae) // J. Econ. Entomol. V. 100. № 4. P. 1476–1481.
Folmer O., Black M., Hoeh W., Lutz R., Vrijenhoek R., 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. V. 3. № 5. P. 294–299.
Graham R.I., Wilson K., 2012. Male-killing Wolbachia and mitochondrial selective sweep in a migratory African insect // BMC Evol. Biol. V. 12. № 1. P. 204.
Han X., Lu C., Geib S.M., Zheng J., Wu S. et al., 2019. Characterization of Dendrolimus houi Lajonquiere (Lepidoptera: Lasiocampidae) transcriptome across all life stages // Insects. V. 10. № 12. P. 442.
Hiroki M., Tagami Y., Miura K., Kato Y., 2004. Multiple infection with Wolbachia inducing different reproductive manipulations in the butterfly Eurema hecabe // Proc. R. Soc. Lond. B. V. 271. № 1549. P. 1751–1755.
Hosokawa T., Koga R., Kikuchi Y., Meng X.Y., Fukatsu T., 2010. Wolbachia as a bacteriocyte-associated nutritional mutualist // Proc. Natl. Acad. Sci. V. 107. № 2. P. 769–774.
Ilinsky Y., 2013. Coevolution of Drosophila melanogaster mtDNA and Wolbachia genotypes // PLoS One. V. 8. № 1. P. e54373.
Ilinsky Y., Kosterin O.E., 2017. Molecular diversity of Wolbachia in Lepidoptera: Prevalent allelic content and high recombination of MLST genes // Mol. Phylogenet. Evol. V. 109. P. 164–179.
Kirichenko N.I., Baranchikov Y.N., Vidal S., 2009. Performance of the potentially invasive Siberian moth Dendrolimus superans sibiricus on coniferous species in Europe // Agric. Forest Entomol. V. 11. № 3. P. 247–254.
Kremer N., Voronin D., Charif D., Mavingui P., Mollereau B., Vavre F., 2009. Wolbachia interferes with ferritin expression and iron metabolism in insects // PLoS Pathog. V. 5. № 10. P. e1000630.
Malysh J.M., Malysh S.M., Kireeva D.S., Kononchuk A.G., Demenkova M.A., 2020. Detection of Wolbachia in larvae of Loxostege sticticalis (Pyraloidea: Crambidae) in European and Asian parts of Russia // Plant Prot. News. V. 103. № 1. P. 49–52.
Marcade I., Souty-Grosset C., Bouchon D., Rigaud T., Raimond R., 1999. Mitochondrial DNA variability and Wolbachia infection in two sibling woodlice species // Heredity. V. 83. № 1. P. 71–78.
Mariño Y.A., Rodrigues V., Jose C., Bayman P., 2017. Wolbachia affects reproduction and population dynamics of the coffee berry borer (Hypothenemus hampei): Implications for biological control // Insects. V. 8. № 1. P. 8.
Mercot H., Charlat S., 2004. Wolbachia infections in Drosophila melanogaster and D. simulans: Polymorphism and levels of cytoplasmic incompatibility // Genetica. V. 120. P. 51–59.
Mikkola K., Ståhls G., 2008. Morphological and molecular taxonomy of Dendrolimus sibiricus Chetverikov stat.rev. and allied lappet moths (Lepidoptera: Lasiocampidae), with description of a new species // Entomol. Fennica. V. 19. № 2. P. 65–85.
Narita S., Kageyama D., Nomura M., Fukatsu T., 2007. Unexpected mechanism of symbiont-induced reversal of insect sex: Feminizing Wolbachia continuously acts on the butterfly Eurema hecabe during larval development // Appl. Environ. Microbiol. V. 73. P. 4332–4341.
Nouhuys S., van, Kohonen M., Duplouy A., 2016. Wolbachia increases the susceptibility of a parasitoid wasp to hyperparasitism // J. Exp. Biol. V. 219. № 19. P. 2984–2990.
Qin J., Li J., Gao Q., Wilson J.J., Zhang A.B., 2019. Mitochondrial phylogeny and comparative mitogenomics of closely related pine moth pests (Lepidoptera: Dendrolimus) // PeerJ. V. 7. P. e7317.
Salunkhe R.C., Narkhede K.P., Shouche Y.S., 2014. Distribution and evolutionary impact of Wolbachia on butterfly hosts // Indian J. Microbiol. V. 54. № 3. P. 249–254.
Shoemaker D.D., Dyer K.A., Ahrens M., McAbee K., Jaenike J., 2004. Decreased diversity but increased substitution rate in host mtDNA as a consequence of Wolbachia endosymbiont infection // Genetics. V. 168. № 4. P. 2049–2058.
Skrzecz I., Ślusarski S., Tkaczyk M., 2020. Integration of science and practice for Dendrolimus pini (L.) management – A review with special reference to Central Europe // For. Ecol. Manag. V. 455. P. 117697.
Teixeira L., Ferreira Á., Ashburner M., 2008. The bacterial symbiont Wolbachia induces resistance to RNA viral infections in Drosophila melanogaster // PLoS Biol. V. 6. № 12. P. e1000002.
Wilstermann A., Schrader G., Kinkar M., Vos S., 2020. Pest survey card on Dendrolimus sibiricus // EFSA Support. Publ. V. 17. № 1. P. 1779E.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


