Журнал общей биологии, 2021, T. 82, № 1, стр. 57-67
Миксотрофны ли альпийские растения из семейства Gentianaceae?
В. Г. Онипченко 1, *, Н. Г. Лавренов 1, А. В. Тиунов 2, М. И. Макаров 1, М. Й. А. Вергер 3, А. А. Ахметжанова 1, Т. Г. Елумеева 1, В. Э. Смирнов 4, 5, Ван Цянь 6, У Янь 6
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Ленинские горы, 1/12, Россия
2 Институт экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
3 Кафедра Экологии растений и Биоразнообразия, Утрехтский Университет
3508 ТВ Утрехт, Нидерланды
4 Центр экологии и продуктивности лесов РАН
117997 Москва, Профсоюзная ул., 84/32, Россия
5 Институт математических проблем биологии РАН
142290 Пущино, ул. Виткевича, 1, Россия
6 Чэндуский институт биологии Китайской академии наук
610041 Чэнду, просп. Жэньминьнаньлу, 9, КНР
* E-mail: vonipchenko@mail.ru
Поступила в редакцию 13.08.2020
После доработки 30.09.2020
Принята к публикации 21.10.2020
Аннотация
Считается, что частично микогетеротрофные (миксотрофные) растения более обычны в филогенетических линиях, которые включают полностью микогетеротрофные растения. Сем. Gentianaceae – одна из таких групп. Миксотрофия мало изучена у альпийских растений по сравнению с тропическими и умеренными лесами. Проверена гипотеза о том, что альпийские виды из сем. Gentianaceae с зелеными листьями могут быть частично микогетеротрофны. Листья девяти пар видов (альпийские растения из сем. Gentianaceae и эталонное растение из другого семейства с арбускулярной микоризой, растущее поблизости) были собраны в горах Тибета (Сычуань, Китай) и Кавказа (Карачаево-Черкесская Республика, Россия). В полностью развитых листьях было определено естественное содержание стабильных изотопов (13C, 15N). В каждом случае листья растений из сем. Gentianaceae были обогащены 15N сильнее, чем листья других растений, которые служили для сравнения. За исключением двух видов из секции Pneumonanthe (Gentiana asclepiadea и G. septemfida), изученные растения из сем. Gentianaceae не показали значимого обогащения 13C. Мы предполагаем, что относительное обогащение листьев 15N может считаться указанием на частичную микогетеротрофию у альпийских видов Gentianaceae.
Некоторые сосудистые растения могут получать почти весь свой органический углерод (полные микогетеротрофы) или значительную его часть (частичные микогетеротрофы, или миксотрофы) от симбиотических микоризообразующих грибов (Merckx, 2013). Микогетеротрофия может возникать при разных типах микоризы: арбускулярной, арбутоидной и монотропоидной (с грибами, часто формирующими эктомикоризный симбиоз с зелеными растениями), а также микоризе орхидных (Leake, 1994). Частичная микогетеротрофия (сочетающая автотрофное и гетеротрофное получение органических соединений) широко распространена среди зеленых сосудистых растений, особенно в семействах Orchidaceae, Ericaceae и Burmanniaceae (Merckx et al., 2010; Bellino et al., 2014; Bolin et al., 2017; Selosse et al., 2017а), и считается эволюционным шагом к полной микогетеротрофии (Selosse, Roy, 2009; но см. Lallemand et al., 2016). Селосс и Рой (Selosse, Roy, 2009) полагают, что частично микогетеротрофные растения (ЧМР) более обычны среди филогенетических линий, которые включают полностью микогетеротрофные растения (ПМР). Сем. Gentianaceae включает в себя 25 полностью микогетеротрофных видов из четырех родов (Voyria, Voyriella, Exacum и Exochaenium) (Merckx et al., 2013), а также существуют свидетельства, что некоторые зеленые Gentianaceae могут быть частично микогетеротрофными. Например, Камерон и Болин (Cameron, Bolin, 2010), используя изотопный анализ, предположили частичную микогетеротрофию для двух американских видов, Bartonia virginica и Obolaria virginica. Частичная микогетеротрофия также, возможно, встречается у других представителей сем. Gentianaceae, таких как Curtia tenuifolia и видов р. Neurotheca (Struwe et al., 2002; Molina, Struwe, 2009), а также Pterygocalyx volubilis (Suetsugu et al., 2020).
Некоторые ПМР вступают в симбиоз с эктомикоризными грибами (базидиомицетами), однако другие ПМР из семейств Corsiaceae, Burmanniaceae, Polygalaceae и Gentianaceae образуют арбускулярную микоризу (AM) (Bidartondo et al., 2002; Merckx et al., 2010). Перемещение органических веществ между растениями разных видов было показано в основном для эктомикоризного симбиоза (Klein et al., 2016). У большинства видов из сем. Gentianaceae есть арбускулярная микориза (Sykorova et al., 2007; Akhmetzhanova et al., 2012). Если частичная микогетеротрофия подтвердится для растений из сем. Gentianaceae, это будет означать, что некоторые зеленые растения с арбускулярной микоризой могут получать органические соединения из грибной сети, и это может поддерживать рост молодых или затененных растений (Grime et al., 1987; Onipchenko, Zobel, 2000; Lerat et al., 2002; Carey et al., 2004). ПМР и ЧМР были изучены в основном в тропических и умеренных лесах (Merckx et al., 2010; Courty et al., 2011; Schiebold et al., 2017), однако о распространенности этого явления в высокогорьях известно очень мало (Onipchenko, Zobel, 2000; Tedersoo et al., 2007; Zimmer et al., 2007).
Тяжелые изотопы (13C и 15N) последовательно накапливаются в пищевых цепях благодаря избирательной потере более легких изотопов в метаболических процессах (Ponsard, Arditi, 2000; Vanderklift, Ponsard, 2003; Leake, Cameron, 2010; Potapov, Tiunov, 2016). ПМР, находящиеся в симбиозе с эктомикоризными грибами, содержат больше 13C и 15N, чем автотрофные растения (Gebauer, Meyer, 2003; Trudell et al., 2003), и, таким образом, значения δ13С, так же как и δ15N, используют для оценки степени микогетеротрофности для видов из семейств Orchidaceae и Ericaceae (Tedersoo et al., 2007; Zimmer et al., 2007; Leake, Cameron, 2010; Hynson et al., 2013). δ15N может служить индикатором значительной роли органических источников азота в почве для растений, так как они обогащены 15N (Bidartondo et al., 2004; Hobbie, Hogberg, 2012). Растения из сем. Gentianaceae могут в большой степени зависеть от органических источников азота в почве, что может быть причиной более высокого содержания в них 15N, как, например, у не образующих микоризу осоковых (Moore et al., 2018). Гифы АМ грибов также способны поглощать азот из органических источников (Klink et al., 2020).
Мы предположили, что альпийские виды Gentianaceae могут быть частично микогетеротрофными. Чтобы проверить эту гипотезу, мы исследовали девять пар обычных видов травянистых растений из двух разных горных регионов (Кавказ и Тибет) и измерили природное содержание 13C и 15N в их листьях.
Мы выбрали альпийские виды Gentianaceae по двум следующим причинам. Во-первых, есть полностью микогетеротрофные филогенетически родственные виды семейства. Во-вторых, за исключением полупаразитных видов Orobanchaceae (Euphrasia spp., Rhinanthus spp.), только среди представителей Gentianaceae встречаются однолетники в сомкнутых альпийских сообществах (очень) долгоживущих альпийских многолетников в некоторых горных регионах (Gentiana biebersteinii, G. aquatica на Северо-Западном Кавказе) (Onipchenko, 2004; Зернов и др., 2015). Кажется логичным, что подобные однолетники должны иметь дополнительный источник органического вещества, чтобы полностью завершить жизненный цикл за короткий альпийский вегетационный период.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты и сбор полевого материала
Обычный метод сравнения изотопного состава видов с эталонными видами – это сбор как минимум трех соседних автотрофных эталонных видов вместе с изучаемым, чтобы охарактеризовать существующую вариабельность у автотрофных растений (Gebauer, Meyer, 2003). Этот подход имеет очевидные преимущества, но не очень точен, когда есть высокая изменчивость между видами и между местообитаниями. В нашем случае, согласно объемной базе данных по δ15N в альпийских растениях (Körner et al., 2016), растения сем. Gentianaceae занимают промежуточное положение среди других семейств покрытосеменных по δ15N (–2.2‰) и не отличаются от большинства других видов растений с арбускулярной микоризой. Однако δ15N может локально различаться между Gentianaceae и другими AM растениями, как будет показано ниже. Таким образом, мы использовали другой подход и собирали листья изучаемого растения (Gentianaceae) и ближайшего доступного растения из эталонных видов (представитель разнотравья с арбускулярной микоризой). Как рекомендовали Прейсс и Гебауэр (Preiss, Gebauer, 2008) для более точных сравнений, мы изучили факторы обогащения (ε13C и ε15N) как разницу между значениями δ изучаемой и эталонной особей растений.
Мы собрали листья пар горных видов растений, один вид из каждой пары относился к сем. Gentianaceae, а другой был растущим по соседству видом разнотравья из другого семейства с арбускулярной микоризой. Пары видов были собраны в двух географически отдаленных регионах: на Северо-Западном Кавказе (Тебердинский заповедник, Карачаево-Черкесская Республика, Россия; 6 пар; 43° с.ш., 41° в.д.) и в Восточном Тибете (Долина Цзючжайгоу (Jiuzhaigou Valley), провинция Сычуань, КНР; 3 пары; 33° с.ш., 104° в.д.) (табл. 1). В обоих регионах выбранные виды обычны в альпийских и других горных местообитаниях (4 вида в альпийском поясе, 1 на субальпийском болоте, 3 на горных лугах в лесном поясе, 1 в горном лесу). Участки расположены на разных склонах и высоте (табл. 1), но все почвы развиваются на силикатных породах (граниты и т.д.). Для каждого вида из сем. Gentianaceae мы выбрали наиболее обычный растущий поблизости вид разнотравья с арбускулярной микоризой. Если (на некоторых площадках) ближайший сосед относился к другому виду, искали выбранный вид, чтобы для всех образцов изучаемого вида из Gentianaceae был тот же самый эталонный вид.
Таблица 1.
Список изученных видов (в квадратных скобках их сокращения на рис. 1, 2) и описание места сбора материала
| № | Виды Gentianaceae | Эталонные виды с арбускулярной микоризой | Регион, сообщество |
|---|---|---|---|
| 1 | Gentiana macrophylla Pall. [Gm] | Ranunculus sinovaginatus W. T. Wang (Ranunculaceae) [Rs] | КНР, Сычуань, долина Цзючжайгоу, вторичный горный луг (3100 м) |
| 2 | Gentiana haynaldii Kanitz [Gh] | Fragariamoupinensis (Franchet) Cardot (Rosaceae) [Fm] | |
| 3 | Gentiana grandis Harry Sm. [Gg] | Fragariamoupinensis (Franchet) Cardot (Rosaceae) [Fm] | |
| 4 | Gentiana asclepiadea L. [Ga] | Solidago virgaurea L. (Asteraceae) [Sv] | Россия, Теберда, горный пихтовый лес (1800 м) |
| 5 | Gentiana verna L. [Gv] | Alchemilla caucasica Buser (Rosaceae) [Ac] | Россия, Теберда, альпийские луга (2800 м) |
| 6 | Gentiana pyrenaica L. [Gp] | Campanula tridentata Schreber (Campanulaceae) [Ct] | |
| 7 | Gentiana bibersteinii Bunge [Gb] | Veronica gentianoides Vahl (Plantaginaceae) [Vg] | |
| 8 | Swertia iberica Fischer et Meyer [Si] | Primula auriculata Lam. (Primulaceae) [Pa] | Россия, Теберда, субальпийское болото (2400 м) |
| 9 | Gentiana septemfida Pallas [Gs] | Leontodon hispidus L. (Asteraceae) [Lh] | Россия, Теберда, альпийские луга (2800 м) |
На исследуемых участках собирали нормально развитые, не поврежденные фитофагами листья с хорошо развитых взрослых (цветущих) растений. Для каждой пары видов, которые сравнивались между собой, собирали листья растения из сем. Gentianaceae и его ближайшего соседа из другого семейства (один эталонный вид для каждого вида Gentianaceae). Сравниваемые растения были собраны на расстоянии до 1–2 м (чаще менее 0.5 м) друг от друга, так, чтобы оба вида росли при одинаковой освещенности. В каждом местообитании растения каждого вида (табл. 1) собирали в пятикратной повторности, а пары находились на расстоянии 20–200 м друг от друга, так что у клональных растений собранные листья относились к разным особям. Каждый отдельный образец включал 1–3 листа с 1–5 близко растущих (до 0.5 м) растений в зависимости от размера листьев (масса образца в сухом состоянии должна была быть не менее 100 мг).
Образцы листьев были помещены в бумажные пакетики и доставлены в лабораторию в воздушно-сухом виде. Затем образцы были высушены при 50°С и мелко размолоты в порошок на шаровой мельнице (Retsch MM 200). Сухие образцы были взвешены (около 1200 мкг сухой массы) на аналитических весах Mettler Toledo MX5 и упакованы в оловянные капсулы для изотопного анализа.
Изотопный анализ
Анализ на стабильные изотопы был проведен на изотопном масс-спектрометре Thermo Delta V Plus и элементном анализаторе Thermo Flash 1112 в Центре коллективного пользования Института экологии и эволюции А.Н. Северцова РАН, Москва. Изотопный состав N и C был выражен в тысячных долях отклонения (δ, ‰) от международного стандарта (атмосферный азот и VPDB соответственно) по формуле δnE = [(Rпроба – Rстандарт)/Rстандарт] × 1000 (‰). Образцы были проанализированы с эталонными газами, калиброванными по IAEA эталонным материалам (USGS 40, USGS 41 и IAEA-CH3). Смещение результатов в ходе анализа было скорректировано с использованием международных лабораторных стандартов (люцерна и казеин). Стандартное отклонение значений δ15N и δ13C эталонного материала (n = 6–8) было <0.2‰. Наряду с изотопным анализом во всех образцах была измерена концентрация азота и углерода (ммоль/г сухого веса).
Статистическая обработка
Мы провели статистические сравнения в парах изученных видов растений, для всех изученных видов и между двумя регионами. Чтобы сравнить δ13С, δ15N, общее содержание углерода и азота, а также соотношение C : N в горечавковых и растениях из другого семейства, был использован дисперсионный анализ с повторными измерениями (Repeated Measures ANOVA), где принадлежность к семейству (горечавковые/не горечавковые) была повторяющейся переменной (R1), а “блок” (пара видов и/или регион) был категориальным предиктором (фиксированный фактор). Апостериорный LSD-тест Фишера был использован, если R1 была значимой (при p < 0.05), чтобы выявить, в какой паре видов растения из семейства горечавковых отличались от эталонных видов. Тесты Колмогорова–Смирнова не выявили значимых отклонений изученных параметров от нормального распределения.
Чтобы сравнить с константой (равна 0) средние значения ε13C и ε15N, различия в содержании углерода, азота и соотношение C : N между растениями сем. Gentianaceae и эталонными растениями, мы использовали t-тест. Расчеты были проведены в пакете Statistica 6.0. Парные t-тесты были сделаны по всем местообитаниям, чтобы оценить различия между растениями сем. Gentianaceae и эталонными растениями. Тесты были проведены в статистической среде R (R Core Team, 2017).
РЕЗУЛЬТАТЫ
Все изученные параметры значительно варьировали по местам сбора образцов и/или по видам (рис. 1, 2). Мы не анализировали возможные причины этой изменчивости (регион, высота, свойства почвы), так как число изученных видов и географических точек было ограничено.
Рис. 1.
δ13C (‰) в листьях Gentianaceae (красные столбцы) и эталонных растений с арбускулярной микоризой (синие столбцы). Показана стандартная ошибка (n = 5). Значения p по результатам апостериорных LSD-тестов показаны под столбцами (цифры красного цвета: p < 0.05). Сокращения видов см. в табл. 1.
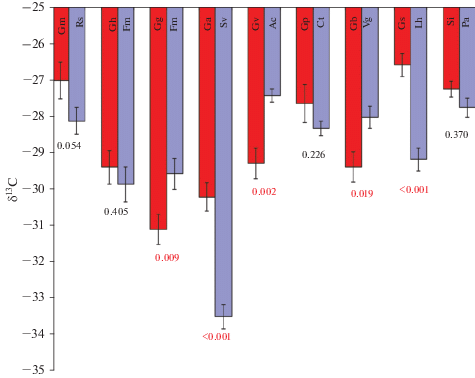
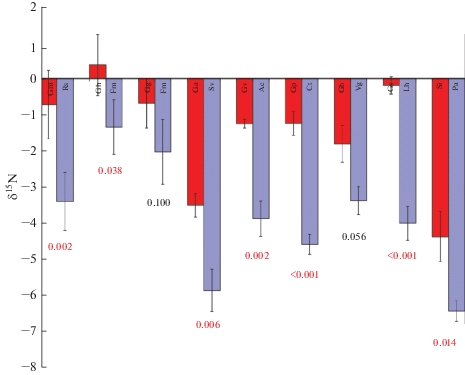
Рис. 2.
δ15N (‰) для пар Gentianaceae (красные столбцы) и эталонных растений с арбускулярной микоризой (синие столбцы). Показана стандартная ошибка (n = 5). Значения p по результатам апостериорных LSD-тестов показаны под столбцами (цифры красного цвета: p < 0.05). Сокращения видов см. в табл. 1.
Содержание углерода и азота
Содержание углерода в целом в растениях сем. Gentianaceae было выше, чем в эталонных видах (t = 4.53, p < 0.0001; табл. 2). В шести парах видов различия были значимыми (табл. 3), ни у одного из видов Gentianaceae содержание углерода не было значимо ниже.
Таблица 2.
Результаты t-тестов сравнения разностей (Gentiana–эталонное растение) с 0, n = 45
| Различия (Gentiana–эталонное растение) | Среднее | Стандартное отклонение | t | p |
|---|---|---|---|---|
| ε13C, ‰ | 0.43 | 2.05 | 1.415 | 0.164 |
| ε15N, ‰ | 2.39 | 1.79 | 8.949 | 0.000 |
| C, ммоль/г сухой массы | 1.67 | 2.47 | 4.534 | 0.000 |
| N, ммоль/г сухой массы | 0.09 | 0.51 | 1.252 | 0.217 |
| C : N | 1.94 | 14.42 | 0.903 | 0.372 |
Таблица 3.
Значимые (p < 0.05) различия между растениями из сем. Gentianaceae и эталонными видами в изученных парах
| Пары видов | |
|---|---|
| δ13С | 3–, 4+, 5–, 7–, 9+ |
| δ15N | 1+, 4+, 5+, 6+, 7+, 8+, 9+ |
| C | 1+, 4+, 5+, 6+ ,7+, 9+ |
| N | 5–, 6–, 7+, 8– |
| C : N | 5+, 6+, 7–, 8+ |
Примечание. Для номеров пар см. табл. 1. “+” – значимое различие средних > 0 (значения для растений из Gentianaceae > эталонных растений); “–” – значимые различия средних < 0 (значения для растений из Gentianaceae < эталонных растений).
Содержание азота в целом не отличалось между горечавковыми и эталонными растениями (табл. 2); в трех случаях эталонные виды имели более высокое и в одном случае (Gentiana biebersteinii–Veronica gentianoides) – более низкое содержание азота по сравнению с растениями из Gentianaceae. Соотношение C : N в целом не различалось между горечавковыми и эталонными растениями (табл. 2, 4). Значимо более высокие соотношения C : N были получены для тех же самых трех видов Gentianaceae, у которых наблюдалось меньшее содержание азота.
Таблица 4.
Сравнение растений из сем. Gentianaceae с эталонными видами растений по результатам дисперсионного анализа с повторяющимися измерениями (значения F)
| d.f. | δ13C | δ15N | C : N | ||||
|---|---|---|---|---|---|---|---|
| F | p | F | p | F | p | ||
| Горечавковые и эталонные растения (R1) | 1 | 5.4 | 0.026 | 81.1 | <0.0001 | 2.1 | ns |
| Блок (Вид или расположение) | 8 | 33.8 | <0.0001 | 12.6 | <0.0001 | 33.6 | <0.0001 |
| Блок × R1 | 8 | 10.3 | <0.0001 | 1.1 | ns | 9.4 | <0.0001 |
Содержание 13C и 15N
В то время как дисперсионный анализ (ANOVA) показал, что горечавковые были немного обогащены 13С (табл. 4), анализ ε13C не выявил значимого обогащения (табл. 2). В изученных парах растений значения ε13C были с разными знаками. Однако при сравнении отдельных пар растений (рис. 1) некоторые виды Gentianaceae не отличались от эталонных растений (Gentiana macrophylla, G. haynaldii, G. pyrenaica, Swertia iberica), в то время как у других (G. grandis, G. verna, G. biebersteinii) содержание δ13C было даже ниже, чем у эталонных растений. Только два вида горечавковых были значимо обогащены 13C по сравнению с контролем (G. asclepiadea, G. septemfida) (табл. 3).
Напротив, значения δ15N у представителей Gentianaceae были выше, чем у эталонных растений для всех изученных пар видов, и различия были значимы в семи из девяти изученных пар (рис. 2, табл. 2, 3). Как показано на рис. 2, средние значения δ15N для растений из сем. Gentianaceae и для эталонных растений перекрываются, однако при рассмотрении локальных пар видов у всех растений из Gentianaceae значения δ15N были выше, чем у эталонных растений в их окружении. В среднем горечавковые были значимо обогащены (ε15N = 2.4 ± 0.3‰, доверительный интервал ±0.52, p < 0.0001), а между принадлежностью к виду и/или местообитанием не было значимого взаимодействия (табл. 4).
Между интенсивностью микоризной колонизации и изученными параметрами углерода и азота не было найдено значимой связи (данные не показаны).
ОБСУЖДЕНИЕ
Изученные параметры, такие как значения δ13С и δ15N, различались по видам и/или местам сбора образцов. Это подчеркивает изменчивость изотопного состава среди изученных видов. Часть изменчивости можно объяснить различиями в высоте и доступности света между местообитаниями, хотя в каждой паре видов уровень освещенности был практически одинаковым. Например, очень низкие значения δ13С у Solidago virgaurea могут быть из-за того, что этот вид произрастал на меньшей высоте и в глубокой тени под пологом Abies nordmanniana. В целом, естественное содержание 13C возрастает с высотой и освещенностью (Körner, 2003; Duursma, Marshall, 2006; Courty et al., 2011; Zhou et al., 2011) и уменьшается в условиях затенения, так как выделившийся в результате дыхания почвы CO2 обеднен 13C (Hynson et al., 2013). Наши данные с этой тенденцией согласуются. Однако в целом оценить определяющее влияние факторов среды на различия между местообитаниями и видами невозможно из-за небольшого числа изученных местообитаний и видов.
Все значения δ13C были близки или меньше чем –27‰, что типично для автотрофных зеленых C3-растений. Большинство изученных растений было собрано в солнечных альпийских местообитаниях; относительно высокое естественное содержание 13C (от –27 до –30‰) типично для растений из хорошо освещенных местообитаний, особенно в альпийском поясе (Brooks et al., 1997; Preiss et al., 2010; Zhu et al., 2010; Zhou et al., 2011; Cernusak et al., 2013). У нескольких видов, которые были собраны ниже границы распространения деревьев в более сомкнутых сообществах под пологом деревьев (Gentiana asclepiadea–Solidago virgaurea; G. grandis–Fragaria moupinensis), естественное содержание 13C было ниже (<–30‰). Их значения δ13C были близки к значениям, показанным для растений теневых бореальных лесов (Tedersoo et al., 2007).
Значения δ15N значимо варьировали по изученным местообитаниям. У Gentianaceae и эталонных растений δ15N были положительно скоррелированы (r = 0.57, p < 0.001), что можно объяснить общей зависимостью значений δ15N у растений от вариабельности δ15N азота в почве. Среднее значение δ15N для эталонных растений (–3.89‰) было близко к значениям δ15N для других альпийских растений Кавказа с арбускулярной микоризой (–3.59‰), по данным М.И. Макарова с соавт. (Makarov et al., 2014). Значения δ15N для растений из сем. Gentianaceae в нашей работе (среднее –1.50‰) были значимо выше и сходны с альпийскими бобовыми (–1.50‰) и осоками, не образующими микоризу (–0.95‰) (Makarov et al., 2014). У бобовых другой источник азота, в отличие от остальных АМ растений (фиксация азота), а осоки могут использовать азот органического вещества почвы (Körner, 2003; Pörtl et al., 2007). Таким образом, мы предположили, что источник азота у изученных растений из сем. Gentianaceae отличается от источника других растений с арбускулярной микоризой, и что это может быть объяснено частичной микогетеротрофией.
Есть несколько причин считать, что обогащение 13C или 15N по сравнению с эталонными зелеными растениями – это доказательство частичной микогетеротрофии (Cameron, Bolin, 2010; Hynson et al., 2013). Во-первых, прогрессивная аккумуляция тяжелых изотопов наблюдалась на более высоких трофических уровнях пищевых цепей у многих организмов благодаря дискриминации тяжелых изотопов во время дыхания и других метаболических процессов (DeNiro, Epstein, 1976, 1978; Tcherkez et al., 2011). Во-вторых, все изученные полностью микогетеротрофные виды (с эрикоидной микоризой и микоризой орхидных, но не с АМ) обогащены 13C и 15N (Selosse, Roy, 2009). Зеленые, частично микогетеротрофные растения из семейств Orchidaceae и Ericaceae также обогащены 13C и 15N (Selosse, Roy, 2009).
Мы получили серьезное подтверждение того, что растения из сем. Gentianaceae обогащены 15N, но не 13C. Возможно несколько объяснений этого результата. Продукты фиксации азота обогащены 15N по сравнению с лабильным азотом почвы, как это показано для бобовых (Bowman et al., 1996; Nadelhoffer et al., 1996; Makarov et al., 2014), но факты усиления фиксации азота вблизи корней горечавковых не известны. С другой стороны, эталонные зеленые растения могли бы использовать формы почвенного азота, обедненного 15N по сравнению с источниками азота, используемыми горечавками. Эта возможность не может быть исключена, но кажется маловероятной, так как горечавковые и эталонные растения относятся к одной функциональной группе (только разнотравье) и формируют одинаковый (арбускулярный) тип микоризы. Мы рассматриваем частичную микогетеротрофию изученных растений из сем. Gentianaceae как наиболее вероятное объяснение их обогащения 15N. Селосс с соавторами (Selosse et al., 2017a, b) также рассматривали обогащение 15N как доказательство возможной микогетеротрофии, что в основном подтверждено для эктомикоризных растений, однако у микогетеротрофных АМ растений не всегда наблюдается обогащение 15N (Merckx et al., 2010; Bolin et al., 2017).
В противоположность микогетеротрофным растениям с микоризой, образованной базидиомицетами, полностью микогетеротрофные растения с арбускулярной микоризой не обязательно обогащены 13C, как было показано для Voyria (Gentianaceae) и Apteria aphylla (Burmanniaceae) (Courty et al., 2011). Ни мицелий, ни споры образующих арбускулярную микоризу грибов не обогащены 13C (Nakano et al., 1999; Courty et al., 2011).
Основные источники углеродного питания для грибов, образующих арбускулярную микоризу, – зеленые растения, а не обогащенное 13C органическое вещество почвы. Тем не менее AM грибы и, соответственно, микогетеротрофные горечавки не должны быть обогащены 13C, как и “ризоктониевые” симбионты орхидных не обогащены 13C (Selosse, Martos, 2014). Более того, у полностью микогетеротрофных растений с арбускулярной микоризой не обнаружено значительной дискриминации 13C на границе между АМ грибом и корнем (Courty et al., 2011). Мы, тем не менее, согласны с утверждением Корти с соавторами (Courty et al., 2011, p. 959), что “высокое содержание 13C по сравнению с зелеными растениями само по себе не является общим свойством всех микогетеротрофных растений”. Это мнение также было поддержано для растений из сем. Ericaceae Хинсон с соавторами (Hynson et al., 2016) и Гебауэр с соавторами (Gebauer et al., 2016), которые использовали естественное содержание дейтерия (2H), чтобы выявить микогетеротрофность некоторых орхидных, не обогащенных 13C. Подобные результаты (отсутствие обогащения 13C) были получены и для луговых орхидей (Schiebold et al., 2018).
Обогащение растений из сем. Gentianaceae 15N, а не 13C, очень сходно с изотопной вариацией между разными популяциями Moneses uniflora (Hynson et al., 2015). Этот вид из сем. Ericaceae считается явно микогетеротрофным на п-ове Олимпик (Вашингтон, США), где он обогащен и 13C, и 15N, но “скрыто микогетеротрофным” в Европе (Швеция и Шотландия), где он обогащен 15N, но не обогащен (или даже обеднен) 13C (Hynson et al., 2015). Одной из причин обогащения растений 15N может быть использование органических соединений почвы, где азот обычно богат 15N (Bidartondo et al., 2004; Hobbie, Hogberg, 2012). Прямое (с помощью корней) поглощение органического азота почвы кажется маловероятным, так как у некоторых видов Gentianaceae относительно слабо развита корневая система и сильна зависимость от микоризы (например, Centaurium erythraea; Grime et al., 1987). АМ грибы могут получать и транспортировать в корни такие органические соединения азота, как мономеры хитина (Jansa et al., 2019) или аминокислоты (Rains, Bledsoe, 2007; но см. Govindarajulu et al., 2005) из почвы. Вопрос о значении переноса углерода от АМ грибов в корни остается открытым, но, по крайней мере, это возможно во время разрушения арбускул внутри растительных клеток (Smith, Read, 2008). Мы рассматриваем частичную микогетеротрофию однолетних альпийских растений из Gentianaceae как адаптацию к завершению жизненного цикла за короткий вегетационный период в сообществах долгоживущих растений.
Мы поддерживаем ожидание Селосса и Рой (Selosse, Roy, 2009, p. 68), что полная “микогетеротрофия в семействе – это сильный предиктор миксотрофных видов” в этом семействе, и мы показали, что по крайней мере девять изученных альпийских видов Gentianaceae с зелеными листьями обогащены 15N и очень вероятно являются частично микогетеротрофными. Таким образом, мы поддерживаем идею, что Gentianaceae может считаться четвертым семейством покрытосеменных (после Orchidaceae, Ericaceae и Burmanniaceae) со значительной представленностью частично микогетеротрофных видов (Schiebold et al., 2017). Анализ изотопного состава корней наряду с использованием других изотопных и молекулярных методов для выявления микогетеротрофии в сем. Gentianaceae – направления для будущих исследований.
Работа М.И. Макарова и В.Г. Онипченко поддержана РНФ (грант № 16-14-10208a), работа Н.Г. Лавренова, А.А. Ахметжановой и Т.Г. Елумеевой поддержана РНФ (грант № 19-14-00038). Авторы благодарны Винсенту Мерксу (Vincent Merckx) и Марку-Андре Селоссу (Marc-André Selosse) за полезные советы и замечания.
Список литературы
Зернов А.С., Алексеев Ю.Е., Онипченко В.Г., 2015. Определитель сосудистых растений Карачаево-Черкесской республики. М.: Т-во науч. изд. КМК. 459 с.
Akhmetzhanova A.A., Soudzilovskaia N.A., Onipchenko V.G., Cornwell W.K., Agafonov V.A. et al., 2012. A rediscovered treasure: Mycorrhizal intensity database for 3000 vascular plant species across the former Soviet Union // Ecology. V. 93. № 3. P. 689–690.
Bellino A., Alfani A., Selosse M.-A., Guerrieri R., Borghetti M., Baldantoni D., 2014. Nutritional regulation in mixotrophic plants: New insights from Limonium abortivum // Oecologia. V. 175. № 3. P. 875–885.
Bidartondo M.I., Burghardt B., Gebauer G., Bruns T.D., Read D.J., 2004. Changing partners in the dark: Isotopic and molecular evidence of ectomycorrhizal liaisons between forest orchids and trees // Proc. R. Soc. Lond. B. V. 271. P. 1799–1806.
Bidartondo M.I., Redecker D., Hijri I., Wiemken A., Bruns T.D. et al., 2002. Epiparasitic plants specialized on arbuscular mycorrhizal fungi // Nature. V. 419. № 6905. P. 389–392.
Bolin J.F., Tennakoon K.U., Majid M.B.A., Cameron D.D., 2017. Isotopic evidence of partial mycoheterotrophy in Burmannia coelestis (Burmanniaceae) // Plant Species Biol. V. 32. № 1. P. 74–80.
Bowman W.D., Schardt J.C., Schmidt S.K., 1996. Symbiotic N2-fixation in alpine tundra: Ecosystem input and variation in fixation rates among communities // Oecologia. V. 108. № 2. P. 345–350.
Brooks J.R., Flanagan L.B., Buchmann N., Ehleringer J.R., 1997. Carbon isotope composition of boreal plants: Functional grouping of life forms // Oecologia. V. 110. № 3. P. 301–311.
Cameron D.D., Bolin J.F., 2010. Isotopic evidence of partial mycoheterotrophy in the Gentianaceae: Bartonia virginica and Obolaria virginica as case studies // Am. J. Bot. V. 97. № 8. P. 1272–1277.
Carey E.V., Marler M.J., Callaway R.M., 2004. Mycorrhizae transfer carbon from a native grass to an invasive weed: Evidence from stable isotopes and physiology // Plant Ecol. V. 172. № 1. P. 133–141.
Cernusak L.A., Ubierna N., Winter K., Holtum J.A.M., Marshall J.D., Farquhar G.D., 2013. Environmental and physiological determinants of carbon isotope discrimination in terrestrial plants // New Phytol. V. 200. № 4. P. 950–965.
Courty P.-E., Walder F., Boller T., Ineichen K., Wiemken A. et al., 2011. Carbon and nitrogen metabolism in mycorrhizal networks and mycoheterotrophic plants of tropical forests: A stable isotope analysis // Plant Physiol. V. 156. № 2. P. 952–961.
DeNiro M.J., Epstein S., 1976. You are what you eat (plus a few ‰): The carbon isotope cycle in food chains // Geol. Soc. Am. Abs. Prog. V. 8. P. 834–835.
DeNiro M.J., Epstein S., 1978. Influence of diet on the distribution of carbon isotopes in animals // Geochim. Cosmochim. Acta. V. 42. P. 495–506.
Duursma R., Marshall J., 2006. Vertical canopy gradients in d13C correspond with leaf nitrogen content in a mixed-species conifer forest // Trees Struct. Funct. V. 20. P. 496–506.
Gebauer G., Meyer M., 2003. 15N and 13C natural abundance of autotrophic and myco-heterotrophic orchids provides insight into N and C gain from fungal association // New Phytol. V. 160. № 1. P. 209–223.
Gebauer G., Preiss K., Gebauer A.C., 2016. Partial mycoheterotrophy is more widespread among orchids than previously assumed // New Phytol. V. 211. № 1. P. 11–15.
Govindarajulu M., Pfeffer P.E., Jin H.R., Abubaker J., Douds D.D. et al., 2005. Nitrogen transfer in the arbuscular mycorrhizal symbiosis // Nature. V. 435. № 7043. P. 819–823.
Grime J.P., Mackey J.M.L., Hillier S.H., Read D.J., 1987. Floristic diversity in a model system using experimental microcosms // Nature. V. 328. № 6129. P. 420–422.
Hobbie E.A., Hogberg P., 2012. Nitrogen isotopes link mycorrhizal fungi and plants to nitrogen dynamics // New Phytol. V. 196. № 2. P. 367–382.
Hynson N.A., Bidartondo M.I., Read D.J., 2015. Are there geographical mosaics of mycorrhizal specificity and partial mycoheterotrophy? A case study in Moneses uniflora // New Phytol. V. 208. № 4. P. 1003–1007.
Hynson N.A., Schiebold J.M.-I., Gebauer G., 2016. Plant family identity distinguishes patterns of carbon and nitrogen stable isotope abundance and nitrogen concentration in mycoheterotrophic plants associated with ectomycorrhizal fungi // Ann. Bot. V. 118. № 3. P. 467–479.
Hynson N.A., Madsen T.P., Selosse M.-A., Adam I.K.U., Ogura-Tsujita Y. et al., 2013. The physiological ecology of mycoheterotrophy // Mycoheterotrophy: The Biology of Plants Living on Fungi. N.Y.: Springer. P. 297–342.
Jansa J., Forczek S.T., Rozmoš M., Püschel D., Bukovska P., Hršelova H., 2019. Arbuscular mycorrhizal and soil organic nitrogen: Network of players and interactions // Chem. Biol. Technol. Agric. V. 6. № 10. P. 1–10.
Klein T., Siegwolf R.T., Körner C., 2016. Belowground carbon trade among tall trees in a temperate forest // Science. V. 352. № 6283. P. 342–344.
Klink S., Gieselmann P., Hubmann T., Pausch J., 2020. Stable C and N isotope natural abundances of intraradical hyphae of arbuscular mycorrhizal fungi // Mycorrhiza. V. 30. P. 773–780.
Körner C., 2003. Alpine Plant Life: Functional Plant Ecology of High Mountain Ecosystems. Berlin: Springer. 349 p.
Körner C., Leuzinger S., Riedl S., Siegwolf R.T., Streule L., 2016. Carbon and nitrogen stable isotope signals for an entire alpine flora, based on herbarium samples // Alp. Bot. V. 126. № 2. P. 153–166.
Lallemand F., Gaudeul M., Lambourdiere J., Matsuda Y., Hashimoto Y., Selosse M.-A., 2016. The elusive predisposition to mycoheterotrophy in Ericaceae // New Phytol. V. 212. № 2. P. 314–319.
Leake J.R., 1994. The biology of myco-heterotrophic ('saprophytic') plants // New Phytol. V. 127. № 2. P. 171–216.
Leake J.R., Cameron D.D., 2010. Physiological ecology of mycoheterotrophy // New Phytol. V. 185. № 3. P. 601–605.
Lerat S., Gauci R., Catford J.G., Vierheilig H., Piché Y., Lapointe L., 2002. 14C transfer between the spring ephemeral Erythronium americanum and sugar maple saplings via arbuscular mycorrhizal fungi in natural stands // Oecologia. V. 132. № 2. P. 181–187.
Makarov M.I., Onipchenko V.G., Malysheva T.I., Logtestijn R.S.P., van, Soudzilovskaia N.A., Cornelissen J.H.C., 2014. Determinants of 15N natural abundance in leaves of co-occurring plant species and types within an alpine lichen heath in the Northern Caucasus // Arct. Antarct. Alp. Res. V. 46. № 3. P. 581–590.
Merckx V., 2013. Mycoheterotrophy: an introduction // Mycoheterotrophy: The Biology of Plants Living on Fungi. N.Y.: Springer. P. 1–17.
Merckx V., Stockel M., Fleischmann A., Bruns T.D., Gebauer G., 2010. 15N and 13C natural abundance of two mycoheterotrophic and a putative partially mycoheterotrophic species associated with arbuscular mycorrhizal fungi // New Phytol. V. 188. № 2. P. 590–596.
Merckx V.S.F.T., Freudenstein J.V., Kissling J., Christenhusz M.J.M., Stotler R.E. et al., 2013. Taxonomy and classification // Mycoheterotrophy: The Biology of Plants Living on Fungi. N.Y.: Springer. P. 19–101.
Molina J., Struwe L., 2009. Utility of secondary structure in phylogenetic reconstructions using nrDNA ITS sequences – an example from Potalieae (Gentianaceae: Asteridae) // Syst. Bot. V. 34. № 2. P. 414–428.
Moore T., Alfonso A., Clarkson B.R., 2018. Plant uptake of organic nitrogen in two peatlands // Plant Soil. V. 433. № 1–2. P. 391–400.
Nadelhoffer K., Shaver G., Fry B., Giblin A., Johnson L., McKane R., 1996. 15N natural abundances and N use by tundra plants // Oecologia. V. 107. № 3. P. 386–394.
Nakano A., Takanashi K., Kimura M., 1999. The carbon origin of arbuscular mycorrhizal fungi estimated from δ13C values of individual spores // Mycorrhiza. V. 9. № 1. P. 41–47.
Onipchenko V.G., 2004. Alpine Ecosystems in the Northwest Caucasus. Dordrecht: Kluwer Academic Publishers. 407 p.
Onipchenko V.G., Zobel M., 2000. Mycorrhiza, vegetative mobility and responses to disturbance of alpine plants in the Northwestern Caucasus // Folia Geobot. V. 35. № 1. P. 1–11.
Ponsard S., Arditi R., 2000. What can stable isotopes (δ15N and δ13C) tell us about the food web of soil macroinvertebrates? // Ecology. V. 81. № 3. P. 852–864.
Pörtl K., Zechmeister-Boltenstern S., Wanek W., Ambus P., Berger T.W., 2007. Natural 15N abundance of soil N pools and N2O reflect the nitrogen dynamics of forest soils // Plant Soil. V. 295. № 1–2. P. 79–94.
Potapov A.M., Tiunov A.V., 2016. Stable isotope composition of mycophagous collembolans versus mycotrophic plants: Do soil invertebrates feed on mycorrhizal fungi? // Soil Biol. Biochem. V. 93. P. 115–118.
Preiss K., Gebauer G., 2008. A methodological approach to improve estimates of nutrient gains by partially myco-heterotrophic plants // Isot. Environ. Health Stud. V. 44. № 4. P. 393–401.
Preiss K., Adam I.K.U., Gebauer G., 2010. Irradiance governs exploitation of fungi: Fine-tuning of carbon gain by two partially myco-heterotrophic orchids // Proc. R. Soc. Lond. B. V. 277. № 1686. P. 1333–1336.
R Core Team, 2017. R: A Language and Environment for Statistical Computing. https://www.R-project.org/
Rains K.C., Bledsoe C.S., 2007. Rapid uptake of 15N ammonium and glycine-13C, 15N by arbuscular and ericoid mycorrhizal plants native to a Northern California coastal pygmy forest // Soil Biol. Biochem. V. 39. P. 1078–1086.
Schiebold J.M.-J., Bidartondo M.I., Karasch P., Gravendeel B., Gebauer G., 2017. You are what you get from your fungi: Nitrogen stable isotope patterns in Epipactis species // Ann. Bot. V. 119. № 7. P. 1085–1095.
Schiebold J.M.-J., Bidartondo M.I., Lenhard F., Makiola A., Gebauer G., 2018. Exploiting mycorrhizas in broad daylight: Partial mycoheterotrophy is a common nutritional strategy in meadow orchids // J. Ecol. V. 106. № 1. P. 168–178.
Selosse M.-A., Martos F., 2014. Do chlorophyllous orchids heterotrophically use mycorrhizal fungal carbon? // Trends Plant Sci. V. 19. № 11. P. 683–685.
Selosse M.-A., Roy M., 2009. Green plants that feed on fungi: Facts and questions about mixotrophy // Trends Plant Sci. V. 14. № 2. P. 64–70.
Selosse M.-A., Charpin M., Not F., 2017a. Mixotrophy everywhere on land and in water: The grant ecart hypothesis // Ecol. Lett. V. 20. № 2. P. 246–263.
Selosse M.-A., Bocayuva M.F., Kasuya M.C.M., Courty P.-E., 2017b. Mixotrophy in mycorrhizal plants: Extracting carbon from mycorrhizal networks // Molecular Mycorrhizal Symbiosis. Hoboken, New Jersey: John Wiley and Sons. P. 451–471.
Smith S.E., Read D.L., 2008. Mycorrhizal Symbiosis. 3rd ed. L.: Academic Press. 800 p.
Struwe L., Kadereit J.W., Klackenberg J., Nilsson S., Thiv M. et al., 2002. Systematics, chracter evolution, and biogeography of Gentianaceae, including a new tribal and subtribal classification // Gentianaceae – Systematics and Natural History. Cambridge: Cambridge Univ. Press. P. 21–301.
Suetsugu K., Matsubayashi J., Ogawa N.O., Murata S., Sato R., Tomimatsu H., 2020. Isotopic evidence of arbuscular mycorrhizal cheating in a grassland gentian species // Oecologia. V. 192. № 4. P. 929–937.
Sykorova Z., Wiemken A., Redecker D., 2007. Cooccurring Gentiana verna and Gentiana acaulis and their neighboring plants in two Swiss upper montane meadows harbor distinct arbuscular mycorrhizal fungal communities // Appl. Environ. Microbiol. V. 73. № 17. P. 5426–5434.
Tcherkez G., Mahe A., Hodges M., 2011. 12C/13C fractionations in plant primary metabolism // Trends Plant Sci. V. 16. № 9. P. 499–506.
Tedersoo L., Pellet P., Koljalg U., Selosse M.-A., 2007. Parallel evolutionary paths to mycoheterotrophy in understory Ericaceae and Orchidaceae: Ecological evidence for mixotrophy in Pyroleae // Oecologia. V. 151. № 2. P. 206–217.
Trudell S.A., Rygiewicz P.T., Edmonds R.L., 2003. N and C stable isotope abundances support the myco-heterotrophic nature and host-specificity of certain achlorophyllous plants // New Phytol. V. 160. № 2. P. 391–401.
Vanderklift M.A., Ponsard S., 2003. Sources of variation in consumer-diet δ 15N enrichment: A meta-analysis // Oecologia. V. 136. № 2. P. 169–182.
Zhou Y., Fan J., Zhang W., Harris W., Zhong H. et al., 2011. Factors influencing altitudal patterns of C3 plant foliar carbon isotope composition of grasslands on the Qinghai-Tibet Plateau, China // Alp. Bot. V. 121. № 2. P. 79–90.
Zhu Y., Siegwolf R.T.W., Durka W., Körner C., 2010. Phylogenetically balanced evidence for structural and carbon isotope responses in plants along elevational gradients // Oecologia. V. 162. № 4. P. 853–863.
Zimmer K., Hynson N.A., Gebauer G., Allen E.B., Allen M.F., Read D.J., 2007. Wide geographical and ecological distribution of N and C gains from fungi in pyroloids and monotropoids (Ericaceae) and in orchids // New Phytol. V. 175. № 1. P. 166–175.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


