Журнал общей биологии, 2021, T. 82, № 1, стр. 48-56
Новые методы исследований в палеопалинологии
О. П. Тельнова 1, 2, *, А. М. Кульков 3, **, Д. Е. А. Маршалл 4, ***
1 ФИЦ Институт геологии Коми НЦ УрО РАН
167928 Сыктывкар, Первомайская ул., 54, Россия
2 Сыктывкарский государственный университет им. Питирима Сорокина
167928 Сыктывкар, Октябрьский пр., 55, Россия
3 Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Ульяновская ул., 1, Россия
4 Школа изучения Океана и Земли, Саутгемптонский университет,
Национальный океанографический центр
SO14 3ZH Саутгемптон, Великобритания
* E-mail: telnova@geo.komisc.ru
** E-mail: aguacrystals@yandex.ru
*** E-mail: jeam@noc.soton.ac.uk
Поступила в редакцию 23.04.2018
После доработки 23.07.2020
Принята к публикации 16.10.2020
Аннотация
Выявление таксономических признаков спор в различных филогенетических линиях палеозойских растений добавляет необходимую информацию в реконструкциях древних растительных сообществ Земли и должно учитываться в других палеореконструкциях (климатических, географических и др.). Особое значение в этом контексте приобретает внедрение в палеопалинологические работы современного инструментария и разработка новых методик исследований. В дополнение к традиционным методам световой, электронной сканирующей и трансмиссионной микроскопии сегодня для изучения палеопалинологических объектов могут быть использованы томографы, атомно-силовой микроскоп, а также дополненные новыми функциональными возможностями сканирующие электронные микроскопы (СЭМ). Развивается метод хемосистематики, основанный на биохимических характеристиках эволюционного развития организмов. Метод реализуется путем синтеза результатов комплекса химических и физических методик исследований.
Для реконструкции филогенетических отношений в растительном мире и выявления направлений их эволюции важным является изучение ультраструктуры спородермы современных и ископаемых растений. Спородерма – оболочка пыльцевых зерен и спор – состоит из двух слоев: внешнего (экзины) и внутреннего (интины). У некоторых растений, например мхов, хвощей, папоротников, образуется еще один, самый наружный слой – перина, или периспорий. У семенных растений это поленкит (пыльцевой клей) и трифина. Установлено, что состав, строение и происхождение этих слоев различны. В ископаемых спородермах сохраняются только спорополленин-содержащие слои (экзина и перина). Спородерма несет в себе таксономические признаки не только видов и родов, но и таксонов более высокого ранга. Изучение ультратонкого строения спор in situ в различных филогенетических линиях палеозойских растений и сравнение с дисперсными спорами дают необходимую информацию в реконструкциях растительных сообществ прошлого Земли и применяется в других палеореконструкциях (климатических, фациальных, географических и др.).
Длительное время в арсенале палинологов было три метода микроскопии: световой (СМ), электронный сканирующий (СЭМ) и трансмиссионный (ТЭМ). Для палиностратиграфических работ (биостратиграфический метод в геологии, позволяющий определять относительный возраст горных пород) достаточно определения таксономической принадлежности дисперсных спор в СМ. Однако палиностратиграфическим назначением возможности СМ не ограничиваются. Еще в прошлом веке П.А. Никитин (1934) и Аллен (Allen, 1965) продемонстрировали верх технического мастерства и возможностей СМ – они приготовили (без ультрамикротома) тонкие срезы некоторых девонских спор и сфотографировали их. Увеличение и, соответственно, разрешение деталей у световой микроскопии значительно ниже, чем при электронной микроскопии, но результаты даже стандартных светооптических исследований могут быть использованы при интерпретации различий в толщине экзины (в ископаемом состоянии чаще всего сохраняется только экзина), количества слоев в ней.
С помощью СЭМ проводятся более детальные морфологические исследования с целью описания новых таксонов или при уточнении диагноза уже известных. Для изучения внутреннего строения спородермы с помощью СЭМ применяются методы сколов спородермы, химического и ионного травления. Первый метод имеет много ограничений: он подходит только для крупных палинологических объектов, таких как мегаспоры, одноклеточные водоросли, некоторые акритархи; скол нельзя сориентировать в необходимом направлении; нельзя выполнить точные измерения толщины спородермы и отдельных ее слоев; разрешающая способность СЭМ меньше ТЭМ; и метод является разрушающим.
В методе химического травления используется прожигающий эффект ряда химических реагентов, например, калиевой соли марганцовой кислоты (перманганат калия). Экзина, на которую воздействовали перманганатом калия, послойно изучалась в СЭМ (Claugher, 1986). Известно, что экзина в основном состоит из спорополленина (высокомолекулярный биополимер, придающий ей прочность и химическую устойчивость). Характер отложения спорополленина определяется фибриллярным матриксом, состоящим из углеводов и белков, который формируется на поверхности гликокаликса (клеточный покров) (Rowley, 1973; Steer, 1977). Многочисленные работы (Rowley et al., 1981; Southworth, 1985, и др.) показывают, что разные части экзины (экзина состоит из двух основных слоев: внешнего и внутреннего – соответственно экт- и эндэкзины) могут быть частично растворены под воздействием различных химических веществ: моноэтаноламин, хромовая кислота (полностью растворяет эктэкзину, сохраняя эндэкзину). В этих исследованиях была использована ТЭМ, которая подтвердила результаты химического травления, наблюдаемые с помощью СЭМ, и была предложена модель субструктуры экзины.
Метод ионного травления обладает рядом достоинств, отсутствующих у химического травления: выбирается необходимый участок поверхности объекта и ионным лучом постепенно, послойно протравливаются срезы, которые затем изучаются с помощью СЭМ. Если минимальная толщина среза, выполненного на ультрамикротоме, соответствует 20 нм, то в случае травления срезы могут быть еще тоньше. Серийные срезы с минимальным шагом используются для трехмерных реконструкций. Однако метод, как и два предыдущих, является разрушающим (Villanueva-Amadoz et al., 2012; Kudryavtsev et al., 2019).
СЭМ в комплексе с энергодисперсионным детектором EDS и ориентационным детектором дифракции обратнорассеянных электронов EBSD позволяет проводить параллельно с изучением скульптуры и структуры анализ элементного состава и состояния вещества спородермы. Этот метод успешно применен для реконструкции условий фоссилизации раннекаменноугольных семян (формация Pease Bay, Шотландия). Установлено, что оболочки семян состоят преимущественно из углерода с многочисленными химическими включениями. Расшифровка дифракционных картин обратнорассеянных электронов, полученных с этих включений, показала, что обнаруженные частицы с содержанием Fe-S представляют собой фазу кубического пирита. Cделан вывод о том, что фоссилизация семян происходила в морских эвксинных обстановках (сероводородные обстановки являются вариантом аноксидных), в условиях, наиболее благоприятных для образования пирита и консервации растительных фрагментов (Тельнова и др., 2019, 2020).
Впервые с применением трансмиссионного электронного микроскопа девонские споры были изучены Петтиттом (Pettitt, 1966). Он проиллюстрировал срезы мега- и микроспор археоптерисовых (род девонских древовидных растений с папоротниковидными листьями). У мега- и микроспор археоптерисовых выявлено двухслойное строение спородермы, эти слои не отделяются друг от друга, но различна их ультраструктура. В настоящее время ТЭМ нашел наиболее широкое применение при изучении рецентных и субрецентных спор. Известно небольшое количество работ по исследованиям ультраструктуры спородермы палеозойских спор in situ (репродуктивные органы палеозойских растений встречаются крайне редко) и еще меньше – дисперсных. Это объясняется сложной и длительной техникой извлечения из горной породы и подготовкой к ультрамикротомированию палеозойских спор (Тельнова, 2007). Кроме того, в процессе резки спор на ультрамикротоме теряется уникальный материал, часто невосполнимый. Поэтому продолжается поиск менее деструктивных методов изучения внутреннего строения фоссильной спородермы.
Из современного инструментария заслуживает внимание конфокальный лазерный сканирующий микроскоп (КЛСМ), имеющий более высокую разрешающую способность по сравнению со световым микроскопом и возможность получать серии виртуальных срезов, представляющих пространственное строение объекта. КЛСМ применяют для работы с современными объектами (в биологии, медицине и др.). Этот метод опробован и для изучения ископаемой спородермы. Существенным недостатком КЛСМ является более низкая разрешающая способность по сравнению с электронной микроскопией (СЭМ и ТЭМ). При изучении поверхности объектов скульптурные элементы мельче 0.3 мкм искажаются, а на виртуальных срезах неразличимы детали ультраструктуры (Гаврилова и др., 2015). Модуль конфокального микроскопа Airyscan и метод SR-SIM (микроскопия структурированного освещения сверхвысокого разрешения) позволили для ископаемых объектов, которые дают более слабую эмиссию, чем современные (фоссильная спородерма слабо прокрашивается флуоресцентными красителями), получить относительно четкие изображения (Sivaguru et al., 2016). Однако и с их применением не достигается разрешение электронных микроскопов (СЭМ, ТЭМ).
Исследования на уровне наноструктур в медицине, биологии, физике, химии формируют основу для инновационных производств и уникальных технологий. В настоящее время в практику палинологических работ также начали проникать различные томографы.
В обсуждениях ультраструктуры пермских мегаспор (Glasspool et al., 2009) приводится изображение, сделанное с помощью синхротронной рентгеновской томографии (Synchrotron Radiation X-ray Tomographic Microscopy – SRXTM). Этот же инструмент был использован при изучении и других пермских миоспор – орнаментации микроспор и внутренней структуры мегаспор (Slater et al., 2011). В процессе исследования соцветия из меловых отложений Франции в синхротронном рентгеновском томографе впервые была достигнута разрешающая способность 50 нм (Moreau et al., 2014). Определены размеры, количество борозд, сетчатая поверхность экзины, ее толщина и структура.
Первые результаты, полученные нами при изучения девонских спор (размеры спор 60–80 мкм в диаметре) в рентгеновском микротомографе (SkyScan-1172), оказались неудовлетворительными. Однако на этом же микротомографе у более крупных объектов (130–140 мкм) – одноклеточных зеленых водорослей из докембрийских отложений – удалось выяснить не только внешнюю форму, но и строение стенок исследованных форм (Розанов, Астафьева, 2008).
Нанотомографическое изучение девонской спородермы проводится впервые. На протяжении последних четырех лет основной акцент сделан на усовершенствовании методики исследований. Причем в исследованиях использован один и тот же объект (Kryshtofovichia africani Nikitin) с целью накопления положительных эффектов от использования различных режимов, фильтров, расположения объекта и др. В работе приводятся значения режимов и параметров, показавшие наилучшие результаты при визуализации объекта исследований.
МАТЕРИАЛ, ТЕРМИНОЛОГИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
Разработка методики томографического изучения ископаемой спородермы проводилась на девонских мегаспорах Kryshtofovichia africani Nikitin из коллекции российского палеоботаника П.А. Никитина (1934). Материал хранится в музее Ботанического института им. В.Л. Комарова Российской академии наук (БИН РАН). В исследованиях использован типовой материал – образец Н3326 (20 экземпляров). Местонахождение образца: Воронежская обл., окрестности с. Петино, на правом берегу р. Дон, черная глина под конгломератом. Образец стратиграфически приурочен к континентальным осадкам петинского горизонта позднего девона. Препараты и фотодокументация хранятся в лаборатории стратиграфии Института геологии Коми НЦ УрО РАН.
При описании использовалась терминология П.А. Никитина (1934) и Н.Р. Мейер-Меликян (1987) без критического анализа, поскольку этим обширным и дискуссионным вопросам необходимо посвятить отдельную статью. Значение некоторых палеопалинологических терминов объясняется при их первом упоминании.
Из-за наличия у K. africani мега- и микроспор и отсутствия семян это растение относят к Pteridophyta. Однако мегаспоры этого растения обладают уникальным образованием – андротекой, или андрокамерой – камерой для помещения микроспор (по: Никитин, 1934), не известной у других девонских растений. Сходным по названию образованием, пыльцевой камерой, снабжены семена некоторых древних голосеменных (Cycadaceae и др.). П.А. Никитин (1934) рассматривал этот факт как конвергентное развитие одинаковых приспособлений у негомологичных органов, а не как указание на родственные связи.
Объект исследований является уникальным и важным для филогенетических и эволюционных реконструкций (Chaloner, 1959; McGregor, 1969; Lu, 1980; Taylor et al., 1980; Тельнова, Мейер-Меликян, 1993, и др.). Спустя более 80 лет с момента публикации статьи П.А. Никитиным (1934) проведено изучение морфологии и ультраструктуры мегаспор K. africani с использованием современного арсенала палинологического инструментария (Tel’nova, Marshall, 2018; Тельнова и др., 2018).
С целью анализа и интерпретации полученных результатов в нанотомографе объект предварительно был исследован с помощью СМ, СЭМ и ТЭМ. Методика изучения одной и той же споры с использованием трех типов микроскопов была описана ранее (Тельнова, Мейер-Меликян, 1993; Тельнова, 2007). Споры исследовались на биологическом микроскопе “Биолам И” в проходящем свете с увеличением ×400 и фотографировались на том же микроскопе с бинокулярной насадкой МФН-11 цифровым фотоаппаратом “Canon EOS 1000D”.
Микроскульптура изучалась и фотографировалась в сканирующем электронном микроскопе TESCAN VEGA 3 (ускоряющее напряжение подбиралось в пределах 3.0–20.0 кВ в зависимости от объекта (мега- и микроспоры) и целей исследований). Работы по изучению спор с помощью световой и сканирующей электронной микроскопии проводились в Институте геологии Коми НЦ УрО РАН.
В нашей работе для ТЭМ была сделана серия ультратонких срезов, охвативших все части исследованной формы. С помощью ультратома Leica EM UC5 получали срезы толщиной 50 нм и фотографировали, используя трансмиссионный электронный микроскоп JEM-1011 (Япония) (ускоряющее напряжение 80 кВ) в лаборатории электронной микроскопии биологического факультета Московского государственного университета им. М.В. Ломоносова.
Для томографического исследования образца использовался лабораторный рентгеновский нанотомограф Skyscan-2011 с LaB6 катодом (СПбГУ РЦ “Рентгенодифракционные методы исследования”). Для небольших объектов с низкой рентгеновской контрастностью выбирались стандартные режимы съемки: напряжение на источнике – 40 кВ, ток – 0.4 А, угол вращения – 0.30°, усреднение по 5 снимкам, размер пикселя – 0.35–0.5 мкм. Оптимальное положение образца при съемке такое, при котором рентгеновский пучок параллелен, а ось вращения образца перпендикулярна наиболее изометричному сечению. Данные параметры применялись для всех исследованных на томографе мегаспор. Первичный отбор образцов проводили при помощи бинокулярного микроскопа Leica M165C.
Результатом сканирования на рентгеновском томографе является цифровая 3D-модель исследуемого образца. Процесс получения трехмерных цифровых моделей можно разделить на три этапа:
1) Сканирование образца при помощи рентгеновского томографа. В процессе сканирования образец поворачивается в расходящемся рентгеновском пучке на определенный угол (обычно 0.1–0.5°), для каждого положения получают изображение распределения рентгеновской плотности внутри образца. Для компенсации колебаний уровня фона для каждого положения обычно делают 3–5 снимков (усреднение по 3–5 снимкам). Образец поворачивается на 180° или 360°. Следует учитывать, что в рентгеновских томографах изображение формируется на рентген-люминесцентных экранах, после чего фиксируется цифровой оптической камерой. Таким образом, области образца с большей плотностью (с большим поглощением рентгеновского излучения) оказываются на теневых изображениях темными. Результатом сканирования является набор теневых изображений образца, количество изображений зависит от угла поворота (шага сканирования) и количества снимков в каждом положении.
2) После сканирования образца на основе полученных изображений необходимо создать его цифровую модель или, иначе, провести реконструкцию распределения плотности. При этом каждому значению плотности присваивается значение от 0 (для воздуха) до 255 (наиболее высокого значения плотности) и строится цифровая модель в 3D-координатах.
3) На третьем этапе проводится визуализация 3D-модели, изучение ее внутреннего строения и построение виртуальных срезов в необходимых плоскостях.
При работе на томографах Skyscan (Bruker microCT) для реконструкции была использована программа NRecon, а визуализация модели проводилась в программах CTVox и CTAn. Более подробно с математическим обоснованием метода рентгеновской томографии можно ознакомиться в работе Е.Н. Симонова (2011).
Изображения четырех мегаспор, представленные в данной работе, были получены в программе CTVox. Данная программа позволяет выделить области с той или иной плотностью, убрать фон, присвоить каждому значению плотности свой цвет, получить необходимые срезы, а также создать необходимый видеофайл.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Ранее (Tel’nova, Marshall, 2018) были детально описаны морфология и ультраструктура мегаспор K. africani. Представляемая работа дополняет предыдущую новыми результатами, полученными в ходе разработки методики нанотомографического изучения палеозойской спородермы.
Мегаспоры K. africani (рис. 1) – диаметр 0.5 мм, тело мегаспоры округлое, от него отходят три клапана (рис. 1а, в), образующие андротеку (рис. 2а, б, 3). Поверхность клапанов в СМ гладкая, вдоль края их смыкания заметны продольные короткие морщинки. На дистальной поверхности споры расположены скульптурные элементы в виде длинных (25–35 мкм) щупальцевидных выростов (рис. 1а–в). На клапанах они отсутствуют. Концы выростов часто бифуркатные (рис. 1а), некоторые внутри полые (рис. 1в). В СЭМ (рис. 2д) обнаружена микроскульптура – поверхность экзины покрыта мелкими (0.05–0.08 мкм) шипиками с расширенным округлым основанием (рис. 2д). Поверхность выростов в СЭМ представляется гладкой (рис. 2д).
Рис. 1.
Мегаспоры Kryshtofovichia africani Nikitin, 1934, экз. БИН, № Н3326.2. а – общий вид (световой микроскоп): 1 – клапан, 2 – скульптурные элементы в виде длинных щупальцевидных выростов, 3 – бифуркатные концы выростов. б – дистальная поверхность (нанотомограф): 1 – скульптурные элементы в виде длинных щупальцевидных выростов, 2 – наноскульптура спородермы (шипики с округлым основанием). в – продольный виртуальный срез (нанотомограф): 1 – клапан андротеки, 2 – скульптурные элементы в виде длинных щупальцевидных выростов, 3 – верхняя камера мегаспоры, 4 – нижняя камера полости мегаспоры. г – проксимальная поверхность (нанотомограф): 1 – трехлучевая щель прорастания.
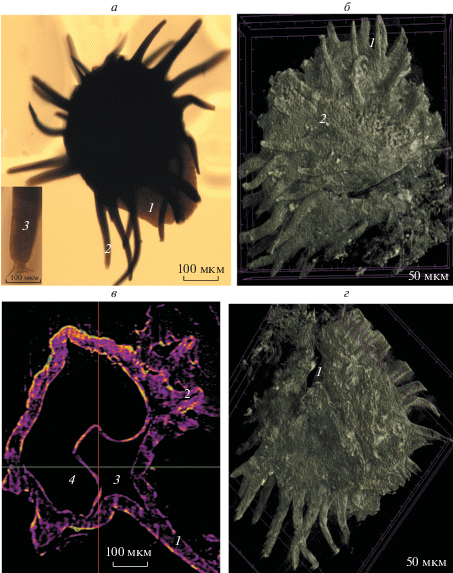
Рис. 2.
Мегаспоры Kryshtofovichia africani Nikitin, 1934, экз. БИН, № Н3326.2. a, б – виртуальные продольные срезы (нанотомограф): 1 – фрагмент внутреннего строения мегаспоры в области трехлучевой щели и андротеки, 2 – внутренняя полость (верхняя камера, сообщающаяся со щелью разверзания), 3 – внутренний и 4 – внешний слои спородермы. в, г – ультратонкие срезы эктэкзины (ТЭМ): 1 – анастомозирующие ламеллы. д – фрагмент дистальной поверхности (СЭМ): 1 – фрагмент скульптурного элемента в виде длинного щупальцевидного выроста, 2 – шипики. е – ультратонкий срез спородермы (ТЭМ): 1 – внутренний и 2 – внешний слои.
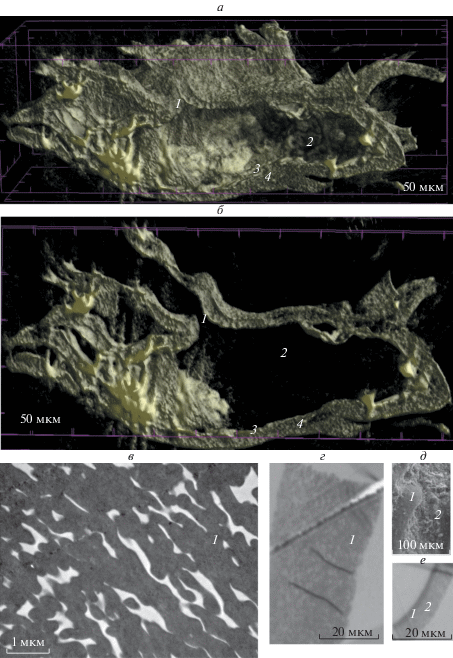
С помощью нанотомографа удалось описать зернистую скульптуру выростов (рис. 1б), не видимую в световом и сканирующем электронном микроскопах. Она представляет собой отдельные, достаточно плотно прилегающие друг к другу, округлые, сверху уплощенные глобулы. На виртуальном продольном срезе четко видна андротека (рис. 1в). Камеры полости мегаспоры образованы расслоением оболочки. Внутренний слой замыкает нижнюю камеру тела споры (рис. 1в), внешний формирует верхнюю камеру – андротеку.
В ТЭМ экзина мегаспоры выглядит двухслойной (рис. 2в, г, е): внутренний слой – относительно тонкий (1.0–1.3 мкм), структурированный, по-видимому, тонколамеллятный (рис. 2е); внешний слой (рис. 2в, г, е) – толстый (3.0–3.4 мкм), состоит из коротких анастомозирующих ламелл. В проходящем свете (СМ) они создают видимость гранулезного строения.
На томографических срезах установлено трехслойное строение экзины (рис. 3): 1) внутренний слой (рис. 2а–в, 3) – тонкий, плотный, с неявно различимой структурой, замыкающий тело споры; 2) толстый гранулезный слой (рис. 2а, б, 3) присутствует во всех структурных и скульптурных элементах мегаспоры; и 3) тонкий поверхностный (рис. 3), скульптурированный. Последний слой не наблюдается на ультратонких срезах в ТЭМ, поскольку таких срезов было выполнено ограниченное количество.
Рис. 3.
Мегаспоры Kryshtofovichia africani Nikitin, 1934, экз. БИН, № Н3326.2, виртуальные продольные срезы (нанотомограф). 1 – скульптурные элементы в виде длинного щупальцевидного выроста, 2 – андротека, образованная клапанами и соседствующая со щелью разверзания, 3 – верхняя и 4 – нижняя камеры внутренней полости, 5 – поверхностный, скульптурированный слой спородермы, 6 – внешний и 7 – внутренний слои.

П.А. Никитин (1934) определил мегаспоры K. africani как трилетные, но в его статье трехлучевая щель не описана и не проиллюстрирована. Наш инструментарий также длительное время не позволял увидеть и сфотографировать этот важный диагностический признак (Tel’nova, Marshall, 2018). Проблема объясняется, по-видимому, тем, что как П.А. Никитину, так и нам не удавалось расположить в препарате мегаспору так, чтобы в основании андротеки можно было увидеть и сфотографировать трехлучевую щель. И только сейчас появилось ее документальное подтверждение, благодаря томографическим исследованиям (рис. 1г). Щель простая, неутолщенная, лучи щели равны радиусу мегаспоры. На виртуальных продольных срезах (рис. 2а, б) четко видно, что щель открывается во внутреннюю полость. Внутренняя полость подразделяется на две камеры (рис. 3), функции которых пока сложно объяснить. Трехлучевая щель сообщается с верхней камерой (рис. 3), сформированной гранулезной структурой.
ВЫВОДЫ
До настоящего времени электронная микроскопия остается вне конкуренции по разрешающей способности: СЭМ – 2–3 нм, ТЭМ – до 1 нм, нанотомограф – в лучшем случае 50 нм. Тем не менее быстрое внедрение новых методик, не разрушающих объект, непосредственно связано с развитием нанотомографической техники. Несмотря на то, что рентгеновские томографы уступают по разрешающей способности синхротронным, на них, как на более доступные в нашей стране, возлагаются большие надежды в палеопалинологии. Они позволяют без нарушения целостности объекта (без потери уникального материала; для изучения становятся доступны коллекционные образцы) проводить комплекс работ по изучению различных проекций палеозойской спородермы, визуализировать соотношения и расположения различных структур. Сокращается время, ранее затрачиваемое (иногда до нескольких месяцев) на подготовку объекта к изучению в СЭМ и ТЭМ.
Томографы уже сегодня могут быть успешно использованы для изучения некоторых палинологических объектов в дополнение к традиционным методам электронной микроскопии. Одним из существенных ограничений в применении томографов, как рентгеновских, так и синхротронных, пока остается разрешение и, соответственно, размер объекта исследований. При изучении микроспор как нами (в нанотомографе параллельно проводились исследования микро- и мегаспор K. africani), так и зарубежными коллегами положительные результаты не достигнуты.
Важная информация получена в ходе разрабатываемой методики изучения одного и того же объекта с применением разных приборов. Объект предварительно был изучен традиционными методами электронной микроскопии. Структуры, описанные в СЭМ и ТЭМ, позволили провести их идентификацию на изображениях, сгенерированных с помощью рентгеновского нанотомографа.
В результате анализа виртуальных срезов получена новая информация: у девонских мегаспор K. africani впервые задокументирована трехлучевая щель прорастания, двухкамерное строение внутренней полости, гранулезное строение стенки верхней камеры, установлена наноскульптура спородермы, ее трехслойное строение, толщина слоев и их расположение.
Выявленная у мегаспор K. africani трехлучевая щель является важным аргументом для подтверждения предположения П.А. Никитина (1934) о том, что это растение относится к Pteridophyta. Однако его мегаспоры обладают уникальным образованием – андротекой, не известной у других девонских растений. Появление у представителей Pteridophyta андротеки рассматривается нами как первая эволюционная “попытка” защиты репродуктивного цикла у растений, существовавших в маргинальных условиях, с тенденцией продвижения на удаленные от акваторий участки суши или же приспособление к существованию в климатических условиях с выраженными сезонными изменениями.
Проведенное исследование демонстрирует важность внедрения в практику палеопалинологических работ методов томографии как дополнения и альтернативы деструктивным методам ТЭМ и отчасти СЭМ.
Авторы выражают благодарность руководству музея БИН РАН и лично хранителю коллекции А.В. Хвалю за предоставленные для научных исследований микро- и мегаспоры Kryshtofovichia africani, а также ведущему научному сотруднику кафедры высших растений МГУ С.В. Полевовой за помощь в проведении работ в ТЭМ и научному сотруднику С.С. Шевчук (ИГ Коми НЦ УрО РАН) за сопровождение исследований в СЭМ.
В настоящее время направление наших многолетних научных исследований поддержано конкурсной программой РФФИ, грант № 20-05-00445А.
Список литературы
Гаврилова О.А., Завьялова Н.Е., Теклёва М.В., Носова Н.В., Горденко Н.В. и др., 2015. Морфологические и анатомические исследования остатков ископаемых высших растений с помощью конфокального микроскопа // XIII Московское совещание по филогении растений: филогения и морфологическая эволюция. М.: МГУ. С. 89–93.
Мейер-Меликян Н.Р., 1987. Морфология спор и пыльцы // Методические аспекты палинологии. М.: Недра. С. 17–40.
Никитин А.П., 1934. Ископаемые растения петинского горизонта девона Воронежской области // Изв. АН СССР. Сер. геол. № 7. С. 1079–1090.
Розанов А.Ю., Астафьева М.М., 2008. Празинофиты (зеленые водоросли) из нижнего протерозоя Кольского полуострова // Палеонтол. журн. № 4. С. 90–93.
Симонов Е.Н., 2011. Томографические измерительные информационные системы. Рентгеновская компьютерная томография: Учебное пособие. М.: НИЯУ МИФИ. 440 с.
Тельнова О.П., 2007. Миоспоры из средне-верхнедевонских отложений Тимано-Печорской нефтегазоносной провинции. Екатеринбург: УрО РАН. 136 с.
Тельнова О.П., Мейер-Меликян Н.Р., 1993. Споры пограничных отложений девона и карбона Тимано-Печорской провинции. Л.: Наука. 77 с.
Тельнова О.П., Маршалл Д.Е.А., Кульков А.М., 2018. Наноструктурное изучение девонской спородермы // ДАН. Сер. Геол. Т. 481. № 2. С. 183–185.
Тельнова О.П., Маршалл Дж., Кудрявцев А.А., 2019. Методические аспекты в палеопалинологии // Морфологич. эволюция и стратиграф. проблемы. Мат-лы LXV сессии Палеонтол. общ-ва при РАН. СПб.: Картфабрика ВСЕГЕИ. С. 151–153.
Тельнова О.П., Кочева Л.С., Карманов А.П., 2020. Вторичная минерализация раннекаменноугольных семян // Современные проблемы теоретической, экспериментальной и прикладной минералогии (Юшкинские чтения – 2020): Мат-лы росс. конф. с междунар. участием. Сыктывкар: ИГ ФИЦ Коми НЦ УрО РАН. С. 154–155.
Allen K.C., 1965. Lower and Middle Devonian spores of North and Central Vestspitsbergen // Paleontology. V. 8. P. 687–748.
Chaloner W.G., 1959. Devonian megaspores from Arctic Canada // Paleontology. V. 1. P. 321–332.
Claugher D., 1986. Pollen wall structure, a new interpretation // Scanning Electron Microsc. P. 291–299.
Glasspool I.J., Collinson M.E., Scott A.C., Brain A.P.R., Plotnick R.E., Kenig F., 2009. An ultrastructural investigation of early Middle Pennsylvanian megaspores from the Illinois Basin, USA // Rev. Palaeobot. Palynol. V. 156. P. 62–78.
Kudryavtsev A., Vasilev E., Telnova O., Marshall J., 2019. Sample preparation by Ar Ion Beam for Microanalysis in Earth Science // 14th Multinational Congress on Microscopy, September 15–20, Belgrade, Serbia. P. 35–36.
Lu L., 1980. On the occurrence of Archaeoperisaccus in E. Yunnan // Acta Palaentol. Sin. № 19. P. 500–504.
McGregor D.C., 1969. Devonian plant fossils of the genera Kryshtofovichia, Nikitinsporites and Archaeoperisaccus // Canada Geol. Surv. Bull. V. 182. P. 91–93.
Moreau J., Cloetens P., Gomez B., Daviero-Gomez V., Néraudea D. et al., 2014. Multiscale 3D virtual dissections of 100-million-year-old flowers using X-Ray synchrotron micro- and nanotomography // Microsc. Microanal. V. 20. № 1. P. 305–312.
Pettitt J.M., 1966. Exine structure in some fossils and recent spores and pollen as revealed by light and electron microscopy // Bull. Brit. Nat. Hist. Geol. V. 13. P. 221–257.
Taylor T.N., Maihle N.J., Hills L.V., 1980. Morphological and ultrastructural features of Nikitinsporites canadensis Chaloner, a Devonian megaspore from the Frasnian of Canada // Rev. Palaeobot. Palynol. V. 30. № 1–2. P. 89–99.
Rowley J.R., 1973. Formation of pollen exine bacules and microchannels on a glycocalyx // Grana. V. 13. P. 129–138.
Rowley J.R., Dahl A., Sengupta S., Rowley J.S., 1981. A model of exine substructure based on dissection of pollen and spore exines // Palynology. V. 5. P. 105–152.
Sivaguru M., Urban M.A., Fried G., Wesseln C.J., Mander L., Punyasena S.W., 2016. Comparative performance of airyscan and structured illumination superresolution microscopy in the study of the surface texture and 3D shape of pollen // Microsc. Res. Tech. V. 81. № 2. P. 101–114.
Slater B.J., McLoughlin S., Hilton J., 2011. Guadalupian (Middle Permian) megaspores from a permineralised peat in the Bainmedart Coal Measures, Prince Charles Mountains, Antarctica // Rev. Palaeobot. Palynol. V. 167. 140–155.
Southworth D., 1985. Pollen exine substructure // Grana. V. 24. № 3. P. 161–166.
Steer M.W., 1977. Differentiation of the tapetum in Avena. I. The cell surface // J. Cell Sci. V. 25. № 1. P. 125–138.
Tel’nova O.P., Marshall J.E.A., 2018. Spores of Kryshtofovichia africani Nikitin (Tracheophyta): Morphology and ultrastructure // Paleontol. J. V. 52. № 3. P. 342–349.
Villanueva-Amadoz U., Benedetti A., Méndez J., Sender L.M., Diez J.B., 2012. Focused ion beam nano-sectioning and imaging: A new method in characterisation of palaeopalynological remains // Grana. V. 51 P. 1–9.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


