Журнал общей биологии, 2021, T. 82, № 3, стр. 188-200
Влияние Dreissena polymorpha на эффективность передачи углерода, жирных кислот, азота и фосфора от фитопланктона к зоопланктону
Е. Г. Сахарова 1, *, М. Карпович 2, М. И. Гладышев 3, 4, Н. Н. Сущик 3, 4, З. И. Горелышева 5, И. Ю. Фенева 6
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., пос. Борок, Россия
2 Белостокский университет, Институт Биологии, Отделение Гидробиологии
ул.
15-245 Белосток, Циалковского, 1J, Польша
3 Федеральный исследовательский центр Красноярский научный центр СО РАН
660036 Красноярск, Академгородок, 50, Россия
4 Сибирский федеральный университет
660041 Красноярск, просп. Свободный, 79, Россия
5 НПЦ НАН Беларуси по биоресурсам
220072 Минск, ул. Академическая, 27, Республика Беларусь
6 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: katya.sah@mail.ru
Поступила в редакцию 26.10.2020
После доработки 20.01.2021
Принята к публикации 27.01.2021
Аннотация
Эффективность передачи физиологически ценных веществ, включающих полиненасыщенные жирные кислоты (ПНЖК), азот и фосфор, от фитопланктона к зоопланктону важна для функционирования пресноводных экосистем. Двустворчатый моллюск Dreissena polymorpha может существенно влиять на функционирование планктонных сообществ. Однако работ по оценке эффективности передачи физиологически ценных веществ от фитопланктона к зоопланктону под воздействием дрейссены до сих пор не проводилось. Целью работы было оценить влияние дрейссены на эффективность переноса углерода, жирных кислот, азота и фосфора от фитопланктона к зоопланктону. В экспериментальных мезокосмах, наполненных водой из мезотрофного озера с содержащимся в ней фито- и зоопланктоном, мы манипулировали фактором присутствия/отсутствия дрейссены. Установлено, что дрейссена уменьшала эффективность переноса углерода, ПНЖК, азота и фосфора от фитопланктона к зоопланктону, понижая таким образом качество зоопланктона как ресурса для вышестоящих трофических уровней. Однако в зоопланктоне увеличивалось содержание указанных веществ относительно их содержания в потребляемых ресурсах. Это позволяет отчасти противодействовать негативному влиянию дрейссены на качество зоопланктона как биологического ресурса.
Эффективность передачи вещества и энергии от фитопланктона к зоопланктону во многом определяет функционирование пресноводных экосистем. Принято считать, что эффективность передачи углерода на следующий трофический уровень составляет 10% (Lindeman, 1942). Однако эффективность передачи углерода от фитопланктона к зоопланктону сильно варьирует в зависимости от факторов среды. Например, в эвтрофных водоемах она ниже, чем в олиготрофных (5–7% и 30% соответственно) (Lacroix, 1999).
Помимо углерода (С), от фитопланктона к зоопланктону передаются и другие вещества, имеющие различную физиологическую ценность, к ним относятся азот (N), фосфор (P) и полиненасыщенные жирные кислоты (ПНЖК), включая эйкозапентаеновую кислоту (ЭПК) и докозагексаеновую кислоту (ДГК). Если углерод выполняет энергетическую и строительную функции, то азот и фосфор влияют на синтез липидов, протеинов и нуклеиновых кислот у водных беспозвоночных (Wagner et al., 2015). Недостаток ЭПК и ДГК приводит к снижению скорости соматического роста, репродукционного потенциала и выживаемости животных, а также к сокращению их продукции (Loladze et al., 2000; Frost et al., 2005). Указанные ПНЖК являются незаменимыми, так как не синтезируются животными de novo, а создаются рядом микроводорослей (Brett, Müller-Navarra, 1997). Недостаток ПНЖК в пище рыб способствует развитию патологий в работе внутренних органов, снижению репродуктивного потенциала и увеличению смертности (Sargent et al., 2002; Glencross, 2009). Таким образом, эффективность передачи ПНЖК, азота и фосфора от фитопланктона к зоопланктону определяет состояние вышестоящих трофических уровней.
Содержание рассматриваемых веществ в фитопланктоне и зоопланктоне – это показатель их ценности как ресурса для последующих звеньев пищевой сети. Общее их содержание в планктонных сообществах зависит от видовой структуры сообщества. Например, в цианобактериях содержание ПНЖК крайне низкое, тогда как в диатомовых, криптофитовых и динофитовых водорослях, наоборот, высокое (Müller-Navarra, 1995; Gulati, DeMott, 1997). Поскольку зоопланктон потребляет не весь спектр пищевых частиц, на высшие трофические уровни переходит лишь часть содержащихся в водорослях физиологически ценных веществ. Например, ракообразные-фильтраторы, составляющие основу зоопланктона пресноводных водоемов, потребляют частицы размером меньше 30 мкм (Sommer U., Sommer F., 2006). Кроме того, видовая структура зоопланктона влияет и на общее содержание ПНЖК и биогенных веществ в зоопланктоне. Так, ветвистоусые ракообразные характеризуются более высоким содержанием ЭПК и фосфора, тогда как веслоногие ракообразные обладают более высоким содержанием ДГК и азота (Elser, Urabe, 1999; Sterner, Elser, 2002)
Одним из факторов, оказывающих сильное воздействие на структуру фито- и зоопланктонных сообществ, является присутствие двустворчатого моллюска Dreissena polymorpha (Pallas, 1771). Дрейссена может избирательно влиять на отдельные таксономические группы фитопланктона за счет фильтрационной активности (Baker et al., 1998; Karatayev et al., 2002), а также за счет выделения биогенных веществ (Wilson, 2003; Wojtal-Frankiewicz, Frankiewicz, 2011; Sarnelle et al., 2012). В результате выделения азота и фосфора в воду дрейссеной, избирательного выедания ею мелких планктонных водорослей возрастает биомасса крупноклеточных видов зеленых водорослей, труднодоступных для потребления зоопланктоном (Davies, Hecky, 2005; Dzialowski, Jessie, 2009; Wojtal-Frankiewicz, Frankiewicz, 2011; Feneva et al., 2020). Показано также, что дрейссена избирательно потребляет пищевые частицы, обогащенные ЭПК, в результате чего снижается пищевая ценность фитопланктона (Makhutova et al., 2013). Кроме того, дрейссена влияет на таксономическую структуру зоопланктона. Например, в присутствии дрейссены в составе зоопланктона увеличивается доля крупных дафний (Feniova et al., 2015). Мы предполагаем, что дрейссена может оказывать сильное влияние на эффективность передачи физиологически ценных веществ от фитопланктона к зоопланктону.
Дрейссена может оказывать позитивное влияние на пресноводные водоемы. Во-первых, она увеличивает прозрачность воды, отфильтровывая мелкие пищевые частицы (Zhu et al., 2006). Во-вторых, дрейссена способна уменьшать биомассу фитопланктона (Vanni, 2002; Conroy, Culver, 2005), в частности, может снижать количество цианобактерий, в том числе и токсичных (Smith et al., 1998; Сахарова и др., 2018). Однако есть данные, свидетельствующие о негативном влиянии дрейссены на пресноводные экосистемы. Такое влияние связано с увеличением концентрации биогенных элементов в результате их повышенной экскреции моллюсками (Vanderploeg et al., 2017), вследствие чего увеличивается биомасса фитопланктона, включая цианобактерии (Makarewicz et al., 1999; Pillsbury et al., 2002). Такие противоречивые эффекты, вызываемые вселением дрейссены, исследователи связывают с трофическим статусом водоема и концентрацией фосфора в воде. Например, показано, что в эвтрофных условиях дрейссена может подавлять развитие цианобактерий, а в условиях меньшей трофности, наоборот, стимулировать их развитие (Raikow et al., 2004). В экспериментальных условиях (Sarnelle et al., 2005) был отмечен рост биомассы цианобактерий при низких концентрациях фосфора в воде и его снижение при повышенной фосфорной нагрузке в присутствии дрейссены. Влияние дрейссены на потоки вещества и энергии в пресноводных экосистемах практически не исследовано. Особый интерес к дрейссене как фактору, влияющему на планктонные сообщества, связан с тем, что она активно распространяется по водоемам и внесена в реестр важнейших инвазивных видов мира и России (Самые опасные…, 2018).
Целью работы было оценить влияние дрейссены на эффективность переноса углерода, общих жирных кислот (ЖК), ПНЖК (ЭПК и ДГК), азота и фосфора от фитопланктона к зоопланктону в мезотрофных условиях. Для этого в экспериментальных мезокосмах, наполненных водой из мезотрофного озера с содержащимся в ней фито- и зоопланктоном, мы манипулировали фактором присутствия/отсутствия дрейссены. Мы предполагали, что дрейссена приведет к увеличению доли труднодоступных для зоопланктона крупноклеточных водорослей и, как следствие этого, к снижению эффективности передачи физиологически ценных веществ.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты проводили в пластиковых аквариумах объемом 300 л (0.94 × 0.64 × 0.50 м), заполненных содержащей естественный фитопланктон и зоопланктон водой из мезотрофного оз. Майч (Северо-Восточная Польша, площадь – 163.5 га, максимальная глубина – 16.4 м, средняя глубина – 6 м) (Gliwicz et al., 1981). Продолжительность эксперимента составляла 30 сут. Пробы брали в первый и 30-й дни опыта. В середине эксперимента пробы не отбирали, чтобы не нарушить ход эксперимента изъятием больших объемов воды с планктоном. Эксперимент включал два варианта – вода с естественным фитопланктоном и зоопланктоном (К) и вода с естественным фитопланктоном и зоопланктоном с добавлением моллюсков (М). В экспериментальные аквариумы помещали дрейссену в количестве 250 г/м2, что соответствовало примерно 200 экз. на мезокосм (такая плотность моллюсков характерна для озер Польши; Sinicyna, Zdanowski, 2007). Каждый вариант опыта состоял из трех повторностей.
Концентрацию хлорофилла (мг/л) определяли спектрофотометрическим методом с помощью спектрофотометра FluoroProbe (BBE-Moldaenke, Германия). Биомассу фитопланктона, выраженную в единицах углерода (мг С/л), рассчитывали по концентрации хлорофилла с использованием коэффициента, предложенного Якоби и Зохари (Yacobi, Zohary, 2010). Фитопланктон отбирали с помощью однолитрового стакана, тщательно перемешивая водную толщу. Пробы концентрировали осадочным методом (Кузьмин, 1975) и фиксировали раствором Утермеля с добавлением формалина. Идентификацию, измерение и учет клеток водорослей осуществляли под световым микроскопом (NikonOptiphot 2). Биомассу фитопланктона (мг/л) рассчитывали с помощью счетно-объемного метода (Mikheeva, 1989). Водоросли разделяли на три размерные фракции: <30, 30–80 и >80 мкм. Первичную продукцию фитопланктона (мг С/л × сут) определяли методом полихроматической диурон-индуцированной флуоресценции (DCMU-fluorescence) с помощью флуориметра FluoroProbe (Gaevsky et al., 2000). Первичную продукцию фитопланктона разных размерных фракций рассчитывали по пропорции, исходя из вклада водорослей разных размеров в общую биомассу и значений общей первичной продукции всего фитопланктона.
Пробы зоопланктона отбирали 2.6-литровым батометром и фиксировали 4%-ным раствором формальдегида. Зоопланктон определяли до вида. Сырой вес зоопланктона (мг/л) оценивали, используя зависимости массы особей планктонных ракообразных от их средней длины (Błędzki, Rybak, 2016). Пересчет биомассы зоопланктона на единицу углерода (мг С/л) осуществляли с помощью коэффициента, предложенного А.Ф. Алимовым (1989), который равен 1/2.3. Для расчета вторичной продукции (мг С/л × сут) использовали регрессионные модели Стоквелла и Йоханссона (Stockwell, Johannsson, 1997).
Для анализа содержания общих ЖК, ЭПК, ДГК, углерода, фосфора и азота в сестоне воду (5–10 л), взятую из мезокосмов, предварительно пропускали через газ 110 мкм, а затем фильтровали через стекловолоконные фильтры GF/F (Whatman) до их интенсивного окрашивания. Далее фильтры на определение ЖК подсушивали и помещали в стеклянный контейнер, в который добавляли 3 мл смеси хлороформа с метанолом (2 : 1) и затем хранили при температуре –20°С. Фильтры на углерод, азот и фосфор высушивали при температуре 75°С в течение суток и хранили в эксикаторе для дальнейшего анализа.
Для определения содержания общих ЖК, ЭПК, ДГК, углерода, фосфора и азота в зоопланктоне из мезокосмов брали 40–50 л воды, которую пропускали через газ 110 мкм. Далее зоопланктон на сите высушивали с помощью фильтровальной бумаги. Пробы зоопланктона на содержание общих ЖК и ПНЖК взвешивали и помещали в 3 мл контейнеры с раствором хлороформа с метанолом, которые хранили при температуре –20°С. Пробы на углерод, азот и фосфор взвешивали и высушивали при температуре 75°С в течение суток, затем хранили в эксикаторе для последующего анализа.
Состав жирных кислот фито- и зоопланктона определяли на газовом хроматографе с масс-спектрометрическим детектором (модель 6890/5975С, Agilent, США) (Gladyshev et al., 2011). Содержание углерода и азота измеряли с помощью элементного анализатора Flash EA 1112 NC Soil/MAS 200 (ThermoQuest, Милан, Италия) (Gladyshev et al., 2007). Содержание фосфора оценивали фотоколориметрическим методом (Murphy, Riley, 1962). Содержание всех веществ выражали в единицах массы на грамм углерода (мг/г С).
Продукцию физиологически ценных веществ в литре определяли, умножив содержание каждого вещества в фитопланктоне или зоопланктоне на первичную или вторичную продукцию углерода соответственно. Основу сестона составляли водоросли и цианобактерии, поэтому далее мы говорим об эффективности передачи веществ от фитопланктона к зоопланктону. Эффективность передачи углерода, общих ЖК, ПНЖК, азота и фосфора от фито- к зоопланктону оценивали как отношение продукции каждого из веществ в зоопланктоне к продукции этого же вещества в фитопланктоне и выражали это отношение в процентах (Gladyshev et al., 2011).
Статистический анализ данных выполнен в программе Past 3.20. Проверку данных на нормальность распределения проводили с помощью теста Шапиро–Уилка. Биомассы фитопланктона и зоопланктона, а также содержание веществ в гидробионтах, продукции углерода и физиологически ценных веществ в фитопланктоне и зоопланктоне и эффективности их передачи сравнивали с помощью однофакторного дисперсионного анализа (ANOVA, F тест Фишера). Для сравнения вышеуказанных параметров между фитопланктоном и зоопланктоном, а также сравнения продукции фитопланктона разных размерных фракций и эффективности передачи физиологически ценных веществ между вариантами опыта использовали t-тест Стьюдента.
РЕЗУЛЬТАТЫ
Биомасса и продукция фитопланктона были достоверно выше в первый день эксперимента, чем на 30-й день, а биомасса и продукция зоопланктона были, наоборот, ниже в первый день. Это объясняется тем, что в мезокосмах отсутствовало хищничество со стороны планктоноядных рыб. Продукция фитопланктона была значимо выше в варианте с дрейссеной, чем в контроле на 30-й день. Биомасса и продукция зоопланктона была, наоборот, ниже в варианте с дрейссеной (рис. 1, табл. 1).
Рис. 1.
Биомасса (а) и продукция (б) фитопланктона (светлые столбцы) и зоопланктона (темные столбцы). Достоверные различия (р ≤ 0.05) в параметрах между первым днем эксперимента, контролем (К) и вариантом (М) с дрейссеной на 30-й день для фитопланктона обозначены разными прописными буквами, а для зоопланктона – разными строчными буквами; * обозначает статистически значимые различия (р ≤ 0.05) между фитопланктоном и зоопланктоном. Статистические параметры представлены в табл. 1.
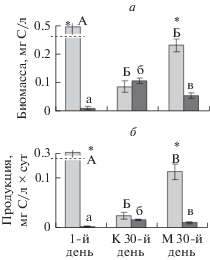
Таблица 1.
Сравнение продукционных параметров по углероду и физиологически ценным веществам в фитопланктоне и зоопланктоне
| Показатель | 1-й день | 30-й день К | 30-й день М | F, p |
|---|---|---|---|---|
| Биомасса, мг С/л | ||||
| Фитопланктон | 0.48 ± 0.14А, * | 0.08 ± 0.02Б | 0.23 ± 0.02Б, * | F = 16.9, p $ \ll $ 0.01 |
| Зоопланктон | 0.01 ± 0.01А, * | 0.10 ± 0.01Б | 0.05 ± 0.01В, * | F = 107.9, p $ \ll $ 0.01 |
| t, p | t = 5.7, p $ \ll $ 0.01 | t = 1.6, p = 0.19 | t = 12.3, p $ \ll $ 0.01 | |
| Продукция, мг С/л × сут | ||||
| Фитопланктон | 0.29 ± 0.05А, * | 0.02 ± 0.01Б | 0.11 ± 0.02В, * | F = 68.2, p $ \ll $ 0.01 |
| Зоопланктон | 0.003 ± 0.00А, * | 0.02 ± 0.00Б | 0.01 ± 0.00В, * | F = 43.4, p $ \ll $ 0.01 |
| t, p | t = 10.7, p $ \ll $ 0.01 | t = 2.1, p = 0.10 | t = 11.1, p $ \ll $ 0.01 | |
| ЭПК : С, мг/г | ||||
| Фитопланктон | 5.28 ± 0.52А, * | 3.14 ± 0.86Б, * | 2.25 ± 0.48Б, * | F = 17.7, p $ \ll $ 0.01 |
| Зоопланктон | 15.41 ± 2.77* | 10.92 ± 3.23* | 10.18 ± 3.32* | F = 2.5, p = 0.17 |
| t, p | t = 6.2, p $ \ll $ 0.01 | t = 4.0, p = 0.02 | t = 4.1, p = 0.01 | |
| ДГК : С, мг/г | ||||
| Фитопланктон | 2.78 ± 0.32А, * | 0.64 ± 0.27Б | 0.99 ± 0.13Б, * | F = 62.4, p $ \ll $ 0.01 |
| Зоопланктон | 9.44 ± 3.52* | 5.33 ± 3.91 | 9.53 ± 4.38* | F = 1.1, p = 0.39 |
| t, p | t = 3.3, p = 0.03 | t = 2.1, p = 0.10 | t = 3.4, p = 0.03 | |
| ЖК : С, мг/г | ||||
| Фитопланктон | 120.94 ± 21.09* | 141.86 ± 21.69 | 92.47 ± 19.43 | F = 4.3, p = 0.07 |
| Зоопланктон | 201.95 ± 44.55* | 122.27 ± 36.37 | 115.79 ± 42.29 | F = 4.1, p = 0.07 |
| t, p | t = 2.8, p = 0.05 | t = 0.8, p = 0.47 | t = 0.9, p = 0.43 | |
| N : С, мг/г | ||||
| Фитопланктон | 172.86 ± 6.89А | 149.62 ± 1.72Б, * | 159.99 ±10.92АБ, * | F = 7.2, p = 0.03 |
| Зоопланктон | 204.16 ± 41.67 | 217.13 ± 5.33* | 221.82 ± 0.85* | F = 0.4, p = 0.67 |
| t, p | t = 1.3, p = 0.27 | t = 20.9, p $ \ll $ 0.01 | t = 9.8, p $ \ll $ 0.01 | |
| Р : С, мг/г | ||||
| Фитопланктон | 9.12 ± 0.97 | 7.47 ± 3.51* | 11.46 ± 0.44* | F = 2.7, p = 0.15 |
| Зоопланктон | 12.26 ± 2.82А | 25.46 ± 2.81Б, * | 26.05 ± 0.61Б, * | F = 33.8, p $ \ll $ 0.01 |
| t, p | t = 1.8, p = 0.14 | t = 6.9, p $ \ll $ 0.01 | t = 33.8, p $ \ll $ 0.01 | |
| Продукция ЭПК, ЭПК : С (мг/г) × (мг С/л × сут) | ||||
| Фитопланктон | 1.54 ± 0.05А, * | 0.08 ± 0.03Б | 0.26 ± 0.09В, * | F = 358, p $ \ll $ 0.01 |
| Зоопланктон | 0.04 ± 0.01А, * | 0.18 ± 0.07Б | 0.11 ± 0.02АБ, * | F = 8.2, p = 0.02 |
| t, p | t = 29.7, p $ \ll $ 0.01 | t = 2.4, p = 0.07 | t = 2.9, p = 0.04 | |
| Продукция ДГК, ДГК : С (мг/г) × (мг С/л × сут) | ||||
| Фитопланктон | 0.81 ± 0.05А, * | 0.01 ± 0.00Б | 0.11 ± 0.00Б | F = 215, p $ \ll $ 0.01 |
| Зоопланктон | 0.03 ± 0.01* | 0.09 ± 0.07 | 0.10 ± 0.03 | F = 2.1, p = 0.21 |
| t, p | t = 15.1, p $ \ll $ 0.01 | t = 1.8, p = 0.15 | t = 0.7, p = 0.50 | |
| Продукция ЖК, ЖК : С (мг/г) × (мг С/л × сут) | ||||
| Фитопланктон | 34.99 ± 0.83А, * | 3.54 ± 1.40Б | 10.03 ± 0.73В, * | F = 547, p $ \ll $ 0.01 |
| Зоопланктон | 0.57 ± 0.12А, * | 2.01 ± 0.76Б | 1.19 ± 0.23АБ, * | F = 6.9, p = 0.03 |
| t, p | t = 41.2, p $ \ll $ 0.01 | t = 1.7, p = 0.17 | t = 20.1, p $ \ll $ 0.01 | |
| Продукция азота, N : C (мг/г) × (мг С/л × сут) | ||||
| Фитопланктон | 51.13 ± 5.82А, * | 3.64 ± 0.94Б | 18.06 ± 3.72Б, * | F = 45.8, p $ \ll $ 0.01 |
| Зоопланктон | 0.57 ± 0.12А, * | 3.52 ± 0.37Б | 2.44 ± 0.43В, * | F = 53.4, p $ \ll $ 0.01 |
| t, p | t = 8.7, p $ \ll $ 0.01 | t = 0.2, p = 0.85 | t = 7.2, p $ \ll $ 0.01 | |
| Продукция фосфора, P : C (мг/г) × (мг С/л × сут) | ||||
| Фитопланктон | 2.66 ± 0.07А, * | 0.19 ± 0.11Б, * | 1.29 ± 0.23В, * | F = 172.7, p $ \ll $ 0.01 |
| Зоопланктон | 0.03 ± 0.01А, * | 0.41 ± 0.08Б, * | 0.29 ± 0.06Б, * | F = 33.8, p $ \ll $ 0.01 |
| t, p | t = 38.0, p $ \ll $ 0.01 | t = 2.8, p = 0.05 | t = 7.3, p $ \ll $ 0.01 | |
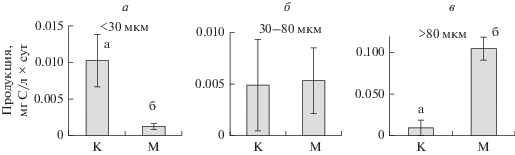
В конце эксперимента продукция водорослей размером <30 мкм была достоверно ниже в варианте с дрейссеной, чем в контроле (t = 4.3, p = 0.01). Продукция водорослей в диапазоне размеров клетки 30–80 мкм была сходной в обоих вариантах опыта, а продукция водорослей размером >80 мкм была достоверно выше в варианте с дрейссеной, чем в контроле (t = 10.1, p $ \ll $ 0.01) (рис. 2).
Рис. 2.
Продукция разных фракций фитопланктона: а – <30 мкм, б – 30–80 мкм, в – >80 мкм в контроле (К) и варианте с дрейссеной (М) на 30-й день эксперимента.
Диатомовые, криптофитовые и динофитовые водоросли доминировали по биомассе в обоих вариантах опыта (табл. 2). На 30-й день в варианте с дрейссеной преобладали крупноклеточные нитчатые зеленые водоросли Mougeotia sp. и Oedogonium sp., тогда как в контроле доминировали мелкие виды из родов Scenedesmus и Schroederia. Состав доминирующих видов зоопланктона не различался между контролем и вариантом с дрейссеной (табл. 2).
Таблица 2.
Список доминирующих видов (>10% от общей биомассы) фитопланктона и планктонных ракообразных в первый день эксперимента, в контроле (К) и варианте (М) с дрейссеной на 30-й день, где “+” – присутствие вида, “–” – отсутствие вида
| Таксон | 1-й день | 30-й день К | 30-й день М |
|---|---|---|---|
| Фитопланктон | |||
| Диатомовые | |||
| Achnanthes sp. | – | + | – |
| Cyclotellakuetzingiana Thwaites | + | – | – |
| Cyclotella sp. | + | + | + |
| Fragilaria capucina Desmazières | – | + | + |
| F. construens (Ehrenberg) Grunow | – | _ | + |
| Navicula radiosa Kützing | – | + | – |
| Rhizosolenia longiseta O.Zacharias | + | – | – |
| Stephanodiscus hantzschii Grunow | + | + | – |
| Криптофитовые | |||
| Rhodomonas acuta (Butcher) Erata & Chihara | + | + | + |
| Динофитовые | |||
| Ceratium hirundinella (O.F.Müller) Dujardin | – | + | – |
| Peridinium sp. | – | – | + |
| Зеленые | |||
| Mougeotia sp. | – | – | + |
| Oedogonium sp. | – | – | + |
| Scenedesmus bijugatus Kützing | – | + | – |
| Schroederia setigera (Schröder) Lemmermann | – | + | – |
| Планктонные ракообразные | |||
| Ветвистоусые | |||
| Bosmina spp. | + | – | – |
| Ceriodaphnia pulchella Sars, 1862 | + | + | + |
| Daphnia magna Straus, 1826 | – | + | + |
| D. pulicaria Forbes, 1893 | + | + | + |
| Scapholeberis mucronata O. F. Müller, 1776 | – | + | + |
| Веслоногие | |||
| Mesocyclops leuckarti Claus, 1857 | – | + | + |
| Thermocyclops oithonoides Sars G.O., 1863 | + | – | – |
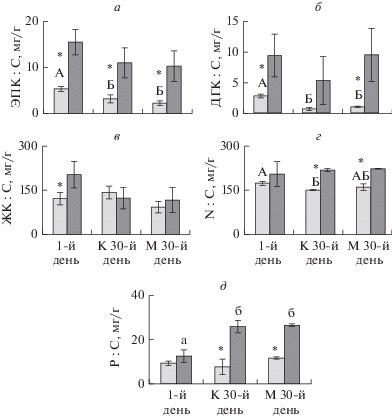
Содержание ЭПК и ДГК в фитопланктоне в первый день было значимо выше, чем в конце эксперимента. Содержание ЭПК и ДГК в зоопланктоне не менялось во времени. Содержание общих ЖК как в фитопланктоне, так и в зоопланктоне не изменилось в течение эксперимента. Содержание азота в зоопланктоне не менялось со временем. В фитопланктоне содержание азота понизилось к концу эксперимента только в контроле относительно первого дня. Содержание фосфора в зоопланктоне повысилось к 30-му дню, в то время как в фитопланктоне этот параметр не изменился (рис. 3, табл. 1). Содержание ПНЖК, общих ЖК, азота и фосфора в фитопланктоне и зоопланктоне не различалось между контролем и вариантом с дрейссеной (рис. 3, табл. 1).
Рис. 3.
Содержание физиологически ценных веществ в фитопланктоне (светлые столбцы) и зоопланктоне (темные столбцы), где а – содержание ЭПК, б – ДГК, в – ЖК, г – азота, д – фосфора. Достоверные различия (р ≤ 0.05) в параметрах между первым днем эксперимента, контролем (К) и вариантом (М) с дрейссеной на 30-й день в фитопланктоне обозначены разными прописными буквами, а в зоопланктоне – разными строчными буквами; * обозначает статистически значимые различия (р ≤ 0.05) в содержании физиологически ценных веществ между фитопланктоном и зоопланктоном. Статистические параметры представлены в табл. 1.
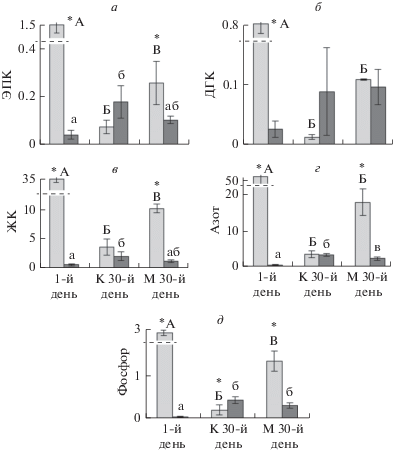
Продукция ЭПК, ДГК, общих ЖК, азота и фосфора в фитопланктоне достоверно понизилась к 30-му дню в обоих вариантах опыта, а в зоопланктоне продукция ЭПК и общих ЖК в контроле, азота и фосфора в обоих вариантах опыта, наоборот, повысилась к концу эксперимента (рис. 4, табл. 1). Продукция ЭПК, общих ЖК и фосфора в фитопланктоне была достоверно выше в варианте с дрейссеной, чем в контроле. Продукция этих веществ в зоопланктоне не различалась между вариантами опыта за исключением азота, продукция которого в зоопланктоне в варианте с дрейссеной была значимо ниже, чем в контроле (рис. 4, табл. 1).
Рис. 4.
Продукция физиологически ценных веществ ((мг/г) × (мг С/л × сут)) в фитопланктоне (светлые столбцы) и зоопланктоне (темные столбцы), где а – продукция ЭПК, б – ДГК, в – ЖК, г – азота, д – фосфора. Достоверные различия (р ≤ 0.05) в продукции между первым днем эксперимента, контролем (К) и вариантом (М) с дрейссеной на 30-й день в фитопланктоне обозначены разными прописными буквами, а в зоопланктоне – разными строчными буквами; * обозначает статистически значимые различия (р ≤ 0.05) в продукции между фитопланктоном и зоопланктоном. Статистические параметры представлены в табл. 1.
Мы провели также сравнение исследуемых параметров между фитопланктоном и зоопланктоном. В варианте с дрейссеной биомасса и продукция фитопланктона была достоверно выше, чем биомасса и продукция зоопланктона соответственно (рис. 1, табл. 1). Содержание ЭПК, азота и фосфора в обоих вариантах опыта и содержание ДГК в варианте с дрейссеной были значимо выше в зоопланктоне, чем в фитопланктоне (рис. 3, табл. 1). Продукция ЭПК, общих ЖК, азота и фосфора была достоверно выше в фитопланктоне, чем в зоопланктоне, в варианте с дрейссеной. В контроле продукция фосфора в зоопланктоне была значимо выше, чем в фитопланктоне (рис. 4, табл. 1). В остальных случаях достоверных различий в значениях продукции между фитопланктоном и зоопланктоном не обнаружено.
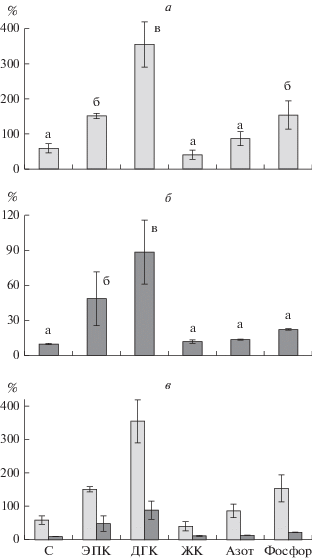
ЭПК передавалась от фитопланктона к зоопланктону в среднем в 3 и в 5 раз эффективнее, чем углерод, в контроле и в варианте с дрейссеной соответственно (в контроле F = 36.0, p $ \ll $ 0.01; в варианте с дрейссеной F = 13.5, p $ \ll $ 0.01) (рис. 5а, б). ДГК передавалась в 6 и в 9 раз эффективнее, чем углерод, в контроле и в варианте с дрейссеной соответственно. В контроле фосфор передавался в 3 раза эффективнее, чем углерод. В варианте с дрейссеной эффективность передачи фосфора не отличалась от эффективности передачи углерода (рис. 5а, б). Общие ЖК и азот в обоих вариантах передавались с такой же эффективностью, как и углерод. Как результат влияния дрейссены на продукцию физиологически ценных веществ в фитопланктоне и зоопланктоне, дрейссена снижала эффективность передачи углерода в 6 раз (t = 6.6, p $ \ll $ 0.01), ЭПК – в 3 раза (t = 7.3, p $ \ll $ 0.01), ДГК – в 4 раза (t = 6.6, p $ \ll $ 0.01), общих ЖК – в 3 раза (t = 3.6, p = 0.02), азота – в 6 раз (t = 6.3, p $ \ll $ 0.01) и фосфора – в 7 раз (t = 5.7, p $ \ll $0.01) по сравнению с контролем (рис. 5в).
Рис. 5.
Эффективность передачи физиологически ценных веществ от фитопланктона к зоопланктону: а – контроль, б – вариант с дрейссеной, в – сравнение эффективностей между контролем (светлые столбцы) и вариантом с дрейссеной (темные столбцы). Различия в эффективности между контролем и вариантом с дрейссеной статистически значимы (р ≤ 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших исследованиях дрейссена способствовала росту первичной продукции фитопланктона. Такое повышение происходило за счет увеличения продукции крупноклеточных водорослей (>80 мкм) в варианте с дрейссеной. Результаты подтверждаются данными множества других экспериментальных работ (Wojtal-Frankiewicz, Frankiewicz, 2011; Dzialowski, 2013, и др.) и полевых наблюдений (Davies, Hecky, 2005; Zhu et al., 2006; Vanderploeg et al., 2017; McEachran et al., 2019). Например, в оз. Гурон стали преобладать зеленые крупноклеточные водоросли Spirogyra sp., Stigeoclonium sp., Cladophora sp. и Mougeotia sp. вскоре после появления в нем дрейссены (Pillsbury et al., 2002). Результаты наших предыдущих экспериментальных работ показали, что дрейссена способствовала доминированию перифитонных и бентосных форм водорослей из родов Mougeotia, Zygnema и Oedogonium (Feneva et al., 2020). Они более конкурентоспособны, чем пелагический фитопланктон (Schindler, 1975; Carrick, Lowe, 1989), благодаря своей способности образовывать плотные заросли с большими поглощающими поверхностями (Simons, 1994; Gerrath, 2003; John, 2003).
В то время как первичная продукция крупноклеточных водорослей в вариантах с дрейссеной повышалась относительно контроля, первичная продукция водорослей размером менее 30 мкм, наоборот, снижалась. Это объясняется тем, что дрейссена, хотя и потребляет клетки в широком размерном диапазоне (0.7–80 мкм), максимально эффективно усваивает частицы диаметром 5–35 мкм (Sprung, Rose, 1988; White, Sarnelle, 2014). Известно, что зоопланктон потребляет также преимущественно частицы размером меньше 30 мкм (Sommer U., Sommer F., 2006). Таким образом, дрейссена способствовала снижению концентрации водорослей, доступных для планктонных ракообразных. Как следствие такой конкуренции, мы наблюдали уменьшение биомассы и продукции зоопланктона.
Дрейссена способна также непосредственно влиять на зоопланктон через его потребление. Снижение биомассы и продукции зоопланктона в вариантах с дрейссеной можно объяснить потреблением ею мелких видов зоопланктона. В экспериментальной работе Торпа и Каспера (Thorp, Casper, 2003) наблюдалось снижение численности коловраток за счет их потребления дрейссеной. Сокращение биомассы мелких видов зоопланктона в результате вселения дрейссены наблюдалось и в природе. Например, после ее вселения в р. Гудзон снизилась биомасса микрозоопланктона (Pace et al., 1998). Уменьшение численности мелких видов планктонных животных после появления дрейссены было отмечено и в р. Огайо (Jack, Thorp, 2000). В литорали восточной части Финского залива в придонном слое воды отмечалась отрицательная корреляция биомассы коловраток с биомассой дрейссены (Телеш, Орлова, 2004), что, по мнению авторов, было связано как с конкурентным вытеснением коловраток дрейссеной, так и с их потреблением моллюсками.
Наши исследования показали, что содержание ПНЖК, азота и фосфора в зоопланктоне было выше, чем в фитопланктоне. Это согласуется с данными предыдущих исследований, которые отмечали, что зоопланктон может аккумулировать важные для физиологической деятельности вещества (Hudson et al., 1999). Экспериментальные работы Карповича и соавторов (Karpowicz et al., 2019) также показали, что зоопланктон может накапливать фосфор, вследствие чего его содержание в зоопланктоне было выше, чем в фитопланктоне. В исследованиях Феневой с соавторами (Feniova et al., 2019) в мезотрофных и эвтрофных условиях содержание азота и фосфора в зоопланктоне превышало содержание этих веществ в фитопланктоне. Повышенное содержание ПНЖК в зоопланктоне по сравнению с фитопланктоном было показано в водохранилище Бугач Гладышевым и соавт. (Gladyshev et al., 2011). Важно отметить, что ракообразные могут накапливать физиологически ценные вещества, если их недостаточно (Sterner, 1993, 1997; Sterner et al., 1998; Sterner, Elser, 2002). Это свидетельствует о способности планктонных ракообразных выполнять роль резервуара для накопления биогенных элементов и ПНЖК.
Существует несколько механизмов накопления ЖК и ПНЖК зоопланктоном. Ракообразные могут синтезировать ПНЖК, трансформируя ЖК из одной формы в другую посредством удлинения молекул (Brett, Müller-Navarra, 1997). Например, Cyclopoida могут синтезировать ДГК (Desvilettes et al., 1997), в то время как Diaptomidae способны преобразовывать ЭПК в ДГК (Ravet et al., 2010). Таким образом, более высокое содержание ПНЖК в зоопланктоне по сравнению с фитопланктоном в наших экспериментах может быть связано с трансформацией некоторых форм ЖК в ПНЖК зоопланктоном.
Другим механизмом повышенного содержания ПНЖК, азота и фосфора в зоопланктоне относительно их содержания в пищевых ресурсах является избирательное потребление пищевых ресурсов ракообразными. Они могут по-разному накапливать или ассимилировать пищевые частицы. Показано, что значения δ13C у ветвистоусых ракообразных коррелировали со значениями δ13C отдельных таксономических групп фитопланктона, но не коррелировали с общим содержанием δ13C в фитопланктоне (Taipale et al., 2016). Селективное питание дафний, предпочитающих более ценные водоросли цианобактериям, экспериментально продемонстрировано М.И. Гладышевым с соавт. (Гладышев и др., 2000). Селективность потребления, скорее всего, связана с различной усвояемостью разных таксонов водорослей, а не с активным выбором пищевых частиц зоопланктоном (Feniova et al., 2018).
Как результат накопления физиологически ценных веществ зоопланктоном (ПНЖК и фосфора), эффективность их передачи от фитопланктона к зоопланктону была выше, чем для углерода и общих ЖК. Наш результат согласуется с данными Гладышева и соавторов (Gladyshev et al., 2011), которые впервые показали, что ПНЖК передаются более эффективно, чем углерод. Наши результаты показали, что и фосфор, как ценный элемент для физиологических процессов, также передается эффективнее, чем углерод. Общие ЖК передавались с такой же эффективностью, что и углерод. Это объясняется тем, что они, в отличие от длинноцепочечных ПНЖК, обычно используются как энергетический ресурс и поэтому не накапливаются в зоопланктоне (Brett, Müller-Navarra, 1997; Desvilettes et al., 1997; Kainz et al., 2004).
Эффективная передача ЭПК и ДГК от фитопланктона к зоопланктону делает зоопланктон более качественным пищевым ресурсом для планктоноядных рыб. В нашем эксперименте ДГК передавалась эффективнее, чем ЭПК. Обогащение зоопланктона ДГК очень полезно для мальков рыб, поскольку рыбам требуется большое количество ДГК для соматического роста (Vizcaino-Ochoa et al., 2010).
Дрейссена негативно влияла на эффективность передачи физиологически ценных веществ от фитопланктона к зоопланктону в результате повышения первичной продукции за счет недоступных для зоопланктона крупных водорослей и снижения вторичной продукции. В результате дрейссена способствовала снижению биомассы зоопланктона. Она уменьшала эффективность переноса углерода, ЖК, ПНЖК, азота и фосфора от фитопланктона к зоопланктону, таким образом понижая качество зоопланктона как ресурса для более высоких трофических уровней. Поскольку все эти вещества передавались от фитопланктона к зоопланктону с разной эффективностью, то дрейссена по-разному влияла на эффективность переноса физиологически ценных веществ. Так, дрейссена снижала эффективность передачи углерода в 6 раз, ЭПК – в 3 раза, ДГК – в 4 раза, общих ЖК – в 3 раза, азота – в 6 раз и фосфора – в 7 раз по сравнению с контролем.
Таким образом, дрейссена представляет серьезную угрозу пресноводным водоемам. В результате ее вселения происходит не просто смена таксономического состава фито- и зоопланктона, но и сокращение потока физиологически ценных веществ на высшие трофические уровни. Это приводит к снижению качества биологических ресурсов. Мы считаем, что механизм накопления физиологически ценных веществ зоопланктоном позволяет отчасти противодействовать негативному влиянию дрейссены на качество зоопланктона как ресурса для последующих трофических уровней.
Проведение экспериментов и сбор биологического материала выполнены при поддержке Национального центра науки Польши (UMO-506 2016/21/B/NZ8/00434). Статистическая обработка и анализ данных проводились в рамках государственного задания № АААА-А18-118012690096-1. Интерпретация полученных результатов, обзор литературы и подготовка материалов для публикации выполнены за счет гранта Российского научного фонда (проект № 21-14-00123).
Список литературы
Алимов А.Ф.,1989. Введение в продукционную гидробиологию. Л.: Гидрометеоиздат. 152 с.
Гладышев М.И., Колмаков В.И., Дубовская О.П., Иванова Е.В., 2000. Изучение микроводорослевого спектра питания Daphnia longispina в периоды цветения евтрофного водоема // ДАН. Т. 371. С. 556–558.
Кузьмин Г.В., 1975. Фитопланктон // Методика изучения биогеоценоза внутренних водоемов. М.: Наука. С. 73–87.
Самые опасные инвазионные виды России (ТОП-100), 2018 / Под ред. Дгебуадзе Ю.Ю., Петросяна В.Г., Хляп Л.А. М.: Т-во науч. изд. КМК. 688 с.
Сахарова Е.Г., Крылов А.В., Петросян В.Г., Селезнев Д.Г., Костшевска-Шлаковска И. и др., 2018. Экспериментальное исследование влияния двустворчатых моллюсков Dreissena polymorpha на фитопланктон в эвтрофных условиях // Экология. № 5. С. 376–381.
Телеш И.В., Орлова М.И., 2004. Взаимоотношения между видом вселенцем Dreissena polymorpha (Pallas) и микрозоопланктоном в прибрежных водах эстуария реки Невы (Финский залив Балтийского моря) // Биологические инвазии в водных и наземных экосистемах. М.: Т-во науч. изд. КМК. С. 268–275.
Baker S.M., Levinton J.S., Kurdziel J.P., Shumway S.E., 1998. Selective feeding and biodeposition by zebra mussels and their relation to changes in phytoplankton composition and seston load // J. Shellfish Res. V. 17. № 4. P. 1207–1213.
Błędzki L.A., Rybak J.I., 2016. Freshwater Crustacean Zooplankton of Europe. Basel: Springer. 918 p.
Brett M., Müller-Navarra D., 1997. The role of highly unsaturated fatty acids in aquatic foodweb processes // Freshwat. Biol. V. 38. P. 483–499.
Carrick H.J., Lowe R.L., 1989. Benthic algal response to N and P enrichment along a pH gradient // Hydrobiologia. V. 179. P. 119–127.
Conroy J.D., Culver D.A., 2005. Do dreissenids affect Lake Erie ecosystem stability processes? // Am. Midl. Nat. V. 153. P. 20–32.
Davies J.M., Hecky R.E., 2005. Initial measurements of benthic photosynthesis and respiration in Lake Erie // J. Great Lakes Res. V. 31. P. 195–207.
Desvilettes C., Bourdier G., Amblard C., Barth B., 1997. Use of fatty acids for the assessment of zooplankton grazing on bacteria, protozoans and microalgae // Freshwat. Biol. V. 38. P. 629–637.
Dzialowski A.R., 2013. Invasive zebra mussels alter zooplankton responses to nutrient enrichment // Freshw. Sci. V. 32. P. 462–470.
Dzialowski A.R., Jessie W., 2009. Zebra mussels negate or mask the increasing effects of nutrient enrichment on algal biomass: A preliminary mesocosm study // J. Plankton Res. V. 31. P. 1437–1440.
Elser J.J., Urabe J., 1999. The stoichiometry of consumer-driven nutrient recycling: Theory, observations, and consequences // Ecology. V. 80. P. 735–751.
Feneva I.Y., Sakharova E.G., Gorelysheva Z.I., Karpowicz M., Andrzej G. et al., 2020. Effects of zebra mussels (Dreissena polymorpha) on phytoplankton community structure under eutrophic conditions // Aquat. Invasions. V. 15. № 3. P. 435–454.
Feniova I., Dawidowicz P., Gladyshev M.I., Kostrzewska-Szlakowska I., Rzepecki M. et al., 2015. Experimental effects of large-bodied Daphnia, fish and zebra mussels on cladoceran community and size structure // J. Plankton Res. V. 37. P. 611–625.
Feniova I., Dawidowicz P., Ejsmont-Karabin J., Gladyshev M., Kalinowska K. et al., 2018. Effects of zebra mussels on cladoceran communities under eutrophic conditions // Hydrobiologia. V. 822. № 1. P. 37–54.
Feniova I., Sakharova E., Karpowicz M., Gladyshev M.I., Sushchik N.N. et al., 2019. Direct and indirect impacts of fish on crustacean zooplankton in experimental mesocosms // Water. V. 11. № 10. P. 2090.
Frost P.C., Evans-White M.A., Finkel Z.V., Jensen T.C., Matzek V., 2005. Are you what you eat? Physiological constraints on organismal stoichiometry in an elementally imbalanced world // Oikos. V. 109. P. 18–28.
Gaevsky N.A., Kolmakov V.I., Popelnitsky V.A., Gold V.M., Dubovskaya O.P., 2000. Evaluation of the effect of light intensity on the measurement of the photosynthetic rate in plankton microalgae by the chlorophyll fluorescence method // Russ. J. Plant Physiol. V. 47. P. 820–825.
Gerrath J.F., 2003. Conjugating green algae and desmids // Freshwater Algae of North America. Ecology and Classification / Eds Wehr J., Sheath R., Kociolek J.P. San Diego: Elsevier Science, Academic Press. P. 353–381.
Gladyshev M.I., Sushchik N.N., Kolmakova A.A., Kalachova G.S., Kravchuk E.S. et al., 2007. Seasonal correlations of elemental and v-3 PUFA composition of seston and dominant phytoplankton species in a eutrophic Siberian Reservoir // Aquat. Ecol. V. 41. P. 9–23.
Gladyshev M.I., Sushchik N.N., Anishchenko O.V., Makhutova O.N., Kolmakov V.I. et al., 2011. Efficiency of transfer of essential polyunsaturated fatty acids versus organic carbon from producers to consumers in a eutrophic reservoir // Oecologia. V. 165. P. 521–531.
Glencross B.E., 2009. Exploring the nutritional demand for essential fatty acids by aquaculture species // Rev. Aquacult. V. 1. № 2. P. 71–124.
Gliwicz Z.M., Ghilarov A., Pijanowska J., 1981. Food and predation as major factors limiting two natural populations of Daphnia cucullata Sars. // Hydrobiologia. V. 80. P. 205–218.
Gulati R.D., DeMott W.R., 1997. The role of food quality for zooplankton: Remarks on the state-of-the-art, perspectives and priorities // Freshwat. Biol. V. 38. № 3. P. 753–768.
Hudson J.J., Taylor W.D., Schindler D.W., 1999. Planktonic nutrient regeneration and cycling efficiency in temperate lakes // Nature. V. 400. P. 659–661.
Jack J.D., Thorp J.H., 2000. Field experiments on regulation of potamoplankton in a large river by a benthic suspension-feeding mussel, Dreissena polymorpha // Freshwat. Biol. V. 44. P. 569–579.
John D.M., 2003. Filamentous and plantlike Green algae // Freshwater Algae of North America. Ecology and Classification / Eds Wehr J., Sheath R., Kociolek J.P. San Diego: Elsevier Science, Academic Press. P. 311–352.
Kainz M., Arts M.T., Mazumder A., 2004. Essential fatty acids in the planktonic food web and their ecological role for higher trophic levels // Limnol. Oceanogr. V. 49. P. 1784–1793.
Karatayev A.Y., Burlakova L.E., Padilla D.K., 2002. Impacts of zebra mussels on aquatic communities and their role as ecosystem engineers // Invasive Aquatic Species of Europe. Distribution, Impacts and Management. Dordrecht: Springer. P. 433–446.
Karpowicz M., Feniova I., Gladyshev M.I., Ejsmont-Karabin J., Górniak A. et al., 2019. The stoichiometric ratios (C : N : P) in a pelagic food web under experimental conditions // Limnologica. V. 77. P. 125690.
Lacroix G., 1999. Biomass and production of plankton in shallow and deep lakes: Are there general patterns? // Ann. Limnol. Int. J. Lim. V. 35. № 2. P. 111–122.
Lindeman R.L., 1942. The trophic-dynamic aspect of ecology // Ecology. V. 23. P. 399–418.
Loladze I., Kuang Y., Elser J.J., 2000. Stoichiometry in producer–grazer systems: Linking energy flow with element cycling // Bull. Math. Biol. V. 62. № 6. P. 1137–1162.
Makarewicz J.C., Lewis T.W., Bertram P., 1999. Phytoplankton composition and biomass in the offshore waters of Lake Erie: Pre- and post-Dreissena introduction (1983–1993) // J. Great Lakes Res. V. 25. P. 135–148.
Makhutova O.N., Protasov A.A., Gladyshev M., Sylaieva A.A., Sushchik N.N. et al., 2013. Feeding spectra of bivalve mollusks Unio and Dreissena from Kanevskoe Reservoir, Ukraine: Are they food competitors or not? // Zool. Stud. V. 52. P. 56.
McEachran M.C., Trapp R.S., Zimmer K.D., Herwig B., Hegedus C.E. et al., 2019. Stable isotopes indicate that zebra mussels (Dreissena polymorpha) increase dependence of lake food webs on littoral energy sources // Freshwat. Biol. V. 64. P. 183–196.
Mikheeva T.M., 1989. Methods of quantitative estimates of nanophytoplankton (review) // Hydrobiol. J. V. 25. P. 3–21.
Müller-Navarra D.C., 1995. Biochemical versus mineral limitation in Daphnia // Limnol. Oceanogr. V. 40. P. 1209–1214.
Murphy J., Riley J.P., 1962. A modified single solution method for the determination of phosphate in natural waters // Anal. Chim. Acta. V. 27. P. 31–36.
Pace M.L., Findlay S.E.G., Fischer D., 1998. Effects of an invasive bivalve on the zooplankton community of the Hudson River // Freshwat. Biol. V. 39. P. 103–116.
Pillsbury R.W., Lowe R.L., Pan Y.D., Greenwood J.L., 2002. Changes in the benthic algal community and nutrient limitation in Saginaw Bay, Lake Huron, during the invasion of the zebra mussel (Dreissena polymorpha) // J. North Am. Benthol. Soc. V. 21. P. 238–252.
Raikow D.F., Sarnelle O., Wilson A.E., Hamilton S.K., 2004. Dominance of the noxious cyanobacterium Microcystis aeruginosa in low-nutrient lakes is associated with exotic zebra mussels // Limnol. Oceanogr. V. 49. № 2. P. 482–487.
Ravet J.L., Brett M.T., Arhonditsis G.B., 2010. The effects of seston lipids on zooplankton fatty acid composition in Lake Washington, Washington, USA // Ecology. V. 91. P. 180–190.
Sargent J.R., Tocher D.R., Bell J.G., 2002. The lipids // Fish Nutrition. 3rd edn / Eds Halver E., Hardy R.W. San Diego: Academic Press. P. 181–257.
Sarnelle O., White J.D., Horst G.P., Hamilton S.K., 2012. Phosphorus addition reverses the positive effect of zebra mussels (Dreissena polymorpha) on the toxic cyanobacterium, Microcystis aeruginosa // Water Res. V. 46. № 11. P. 3471–3478.
Sarnelle O., Wilson A.E., Hamilton S.K., Knoll L.B., Raikow D.F., 2005. Complex interactions between the zebra mussel, Dreissena polymorpha, and the harmful phytoplankter, Microcystis aeruginosa // Limnol. Oceanogr. V. 50. P. 896–904.
Schindler D.W., 1975. Whole-lake eutrophication experiments with phosphorus, nitrogen, and carbon // Verh. Internat. Verein Limnol. V. 19. P. 3221–3231.
Simons J., 1994. Field ecology of freshwater macroalgae in pools and ditches, with special attention to eutrophication // Neth. J. Aquat. Ecol. V. 28. P. 25–33.
Sinicyna O.O., Zdanowski B., 2007. Development of the zebra mussel, Dreissena polymorpha (Pall.), population in a heated lakes ecosystem. II. Life strategy // Arch. Pol. Fisheries. V. 15. P. 387–400.
Smith T.E., Stevenson R.J., Caraco N.F., Cole J.J., 1998. Changes in phytoplankton community structure during the zebra mussel (Dreissena polymorpha) invasion of the Hudson River (New York) // J. Plankton Res. V. 20. P. 1567–1579.
Sommer U., Sommer F., 2006. Cladocerans versus copepods: The cause of contrasting top-down controls on freshwater and marine phytoplankton // Oecologia. V. 147. P. 183–194.
Sprung M., Rose U., 1988. Influence of food size and food quantity on the feeding of the mussel Dreissena polymorpha // Oecologia. V. 77. P. 526–532.
Sterner R.W., 1993. Daphnia growth on varying quality of Scenedesmus: Mineral limitation of zooplankton // Ecology. V. 74. P. 2351–2360.
Sterner R.W., 1997. Modelling interactions of food quality and quantity in homeostatic consumers // Freshwat. Biol. V. 38. P. 473–481.
Sterner R.W., Elser J.J., 2002. Ecological Stoichiometry: The Biology of Elements from Molecules to the Biosphere. Princeton: Princeton Univ. Press. 464 p.
Sterner R.W., Clasen J., Lampert W., Weisse T., 1998. Carbon: Phosphorus stoichiometry and food chain production // Ecol. Lett. V. 1. P. 146–150.
Stockwell J.D., Johannsson O.E., 1997. Temperature-dependent allometric models to estimate zooplankton production in temperate freshwater lakes // Can. J. Fish. Aquat. Sci. V. 54. P. 2350–2360.
Taipale S.J., Vuorio K., Brett M.T., Peltomaa E., Hiltunen M., Kankaala P., 2016. Lake zooplankton δ13C values are strongly correlated with the δ13C values of distinct phytoplankton taxa // Ecosphere. V. 7. P. e01392.
Thorp J.H., Casper A.F., 2003. Importance of biotic interactions in large rivers: An experiment with planktivorous fish, dreissenid mussels, and zooplankton in the St. Lawrence // River Res. Appl. V. 19. P. 265–279.
Vanderploeg H.A., Sarnele O., Liebig J.R., Morehead N.R., Robinson S.D. et al., 2017. Seston quality drives feeding, stoichiometry and excretion of zebra mussels // Freshwat. Biol. V. 62. P. 664–680.
Vanni M.J., 2002. Nutrient cycling by animals in freshwater ecosystems // Annu. Rev. Ecol. Syst. V. 33. P. 341–370.
Vizcaino-Ochoa V., Lazo J.P., Baron-Sevilla B., Drawbridge M.A., 2010. The effect of dietary docosahexaenoic acid (DHA) on growth, survival and pigmentation of California halibut Paralichthys californicus larvae (Ayres, 1810) // Aquaculture. V. 302. P. 228–234.
Wagner N.D., Lankadurai B.P., Simpson M.J., Simpson A.J., Frost P.C., 2015. Metabolomic differentiation of nutritional stress in an aquatic invertebrate // Physiol. Biochem. Zool. V. 88. № 1. P. 43–52.
White J.D., Sarnelle O., 2014. Size-structured vulnerability of the colonial cyanobacterium, Microcystis aeruginosa, to grazing by zebra mussels (Dreissena polymorpha) // Freshwat. Biol. V. 59. P. 514–525.
Wilson A.E., 2003. Effects of zebra mussels on phytoplankton and ciliates: A field mesocosm experiment // J. Plankton Res. V. 25. P. 905–915.
Wojtal-Frankiewicz A., Frankiewicz P., 2011. The impact of pelagic (Daphnia longispina) and benthic (Dreissena polymorpha) filter feeders on chlorophyll and nutrient concentration // Limnologica. V. 41. P. 191–200.
Yacobi Y.Z., Zohary T., 2010. Carbon: Chlorophyll a ratio, assimilation numbers and turnover times of Lake Kinneret phytoplankton // Hydrobiologia. V. 639. № 1. P. 185–196.
Zhu B., Fitzgerald D.G., Mayer C.M., Rudstam L.G., Mills E.L., 2006. Alteration of ecosystem function by zebra mussels in Oneida Lake: Impacts on submerged macrophytes // Ecosystems. V. 9. P. 1017–1028.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


