Журнал общей биологии, 2021, T. 82, № 3, стр. 229-240
Светопреломляющий, светочувствительный и светоизолирующий аппарат камерных глаз
И. П. Шепелева *
Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, наб. Макарова, 6, Россия
* E-mail: ishepeleva@rambler.ru
Поступила в редакцию 21.12.2020
После доработки 27.01.2021
Принята к публикации 19.02.2021
Аннотация
На основе новых и опубликованных собственных данных и данных литературы выполнен сравнительный анализ светопреломляющего, светочувствительного и светоизолирующего аппарата камерных глаз наземного брюхоногого легочного моллюска Helicigona lapicida и человека. Выявлены сходства и различия в составе аппаратов глаз, а также свойствах и функциях их компонентов. Полученные данные необходимы для создания представления о брюхоногих моллюсках как о модельных организмах для изучения работы зрительной системы.
Зрение – многоуровневый процесс, который осуществляется зрительной системой и позволяет получать информацию об окружающем мире. Начинается в периферическом отделе зрительной системы – глазах – с формирования изображения на сетчатке, а также с восприятия, кодирования и обработки информации в ней и заканчивается в центральном отделе – коре головного мозга – принятием решения о том, с каким объектом встретился организм (Хьюбел, 1990). Изучать работу зрительной системы на позвоночных часто трудно по техническим причинам или невозможно по этическим соображениям (Кэндел, 1982). Для исследований необходимы модельные организмы, которыми могут служить беспозвоночные животные – брюхоногие моллюски (Черноризов и др., 2009; Chernorizov, Sokolov, 2010; Шепелева, 2013а, 2018а, б; Shepeleva, 2018, 2019). Среди беспозвоночных брюхоногие моллюски – одна из немногих групп, представители которой имеют камерные глаза, и первая группа, у представителей которой камерные глаза приспособлены к зрению в наземной среде и при высоком уровне освещенности, так же как у типичного представителя позвоночных – человека (Shepeleva, 2019). У брюхоногих моллюсков, как и у человека, некоторые компоненты камерных глаз или составляющие их части формируют специализированные аппараты – светопреломляющий, светочувствительный и светоизолирующий (Шепелева, 2018в, г, 2020, 2021). Центральный отдел зрительной системы этих беспозвоночных имеет общие принципы организации с аналогичным отделом позвоночных (Зайцева, 2000). В то же время зрительная система брюхоногих моллюсков устроена значительно проще (Land, 1981; Messenger, 1981; Кэндел, 1982; Зайцева, 2000; Шепелева, 2011, 2013а; Shepeleva, 2019). Анализ литературы показывает, что изучению центрального отдела зрительной системы брюхоногих моллюсков посвящено больше работ, чем изучению периферического отдела. Между тем дальнейшее развитие представления о брюхоногих моллюсках, как о модельных организмах для изучения работы зрительной системы, требует выявления сходств и различий между глазами моллюсков и человека.
Цель работы – сравнить светопреломляющий, светочувствительный и светоизолирующий аппараты камерных глаз наземных брюхоногих легочных моллюсков и человека. Для работы был выбран моллюск Helicigona lapicida (Linnaeus, 1758), глаз которого приспособлен к зрению в дневное время при высоком уровне освещенности так же, как глаз человека (Шепелева, 2006).
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служили взрослые особи наземного брюхоногого легочного моллюска Helicigona lapicida (Linnaeus, 1758). Моллюсков собирали на о. Эланд (Швеция) в июне 2004 г., содержали в террариуме с почвой при комнатной температуре и естественном световом режиме, кормили листьями одуванчиков.
В качестве материала для световой и трансмиссионной электронной микроскопии использовали глазные щупальца моллюсков, адаптированных к темноте. Щупальца последовательно фиксировали в 2.5%-ном растворе глутарового альдегида на 0.1 М какодилатном буфере (рН 8.0) в течение 2 ч при 4°С и в 1%-ном растворе тетраоксида осмия на том же буфере в течение 1 ч при 4°С. Затем материал обезвоживали в серии спиртов возрастающей концентрации, пропитывали абсолютным ацетоном, а также смесью из ацетона и смолы и заливали смолой. Полутонкие (2 мкм) и ультратонкие (70 нм) срезы нарезали при помощи ультрамикротома V LKB 2088 (Leitz, Германия). Полутонкие срезы окрашивали 0.5%-ным раствором толуидинового синего с добавлением 1%-го карбоната натрия и заключали под покровное стекло. Срезы изучали при помощи светового микроскопа Zeiss Axiophot (Carl Zeiss, Германия) и фотографировали при помощи цифровой камеры Olympus DP 50 (Olympus, Япония). Ультратонкие срезы последовательно контрастировали 2%-ным раствором ацетата урана и 0.1%-ным раствором цитрата свинца. Срезы изучали при помощи трансмиссионного электронного микроскопа JEOL JEM-1230 (JEOL, Япония) и фотографировали при помощи цифровой камеры AMT-X100.
Измерения параметров выполняли на фотографиях срезов глаз. Для средних значений полученных данных рассчитывали стандартное отклонение (Лакин, 1990). Расчеты параметров выполняли по формулам, приведенным в ранее опубликованных работах (Land, 1981; Atchison, Smith, 2000; Smith, 2000; Tang et al., 2010). Параметры, необходимые для расчетов, и рассчитанные параметры приведены в табл. 1.
Таблица 1.
Параметры компонентов светопреломляющего, светочувствительного и светоизолирующего аппарата камерных глаз Helicigona lapicida и человека
| Параметр | Helicigona lapicida | Человек | Ссылки |
|---|---|---|---|
| Размер глаза (переднезадняя × горизонтальная ось), мкм, мм | 189 × 228 | 22.0–24.8 × 24.2 | (Шепелева, 2006; Bekerman et al., 2014) |
| Светопреломляющий аппарат | |||
| Толщина линзы, образованной интегументом и роговицей, и роговицы в центре, мкм, мм | 26 | 0.5 | (Шепелева, 2006; Даниличев, 2009) |
| Радиус кривизны передней/задней поверхности линзы, образованной интегументом и роговицей, и роговицы, мкм, мм | 136/110 | 7.7/6.8 | (Шепелева, 2006; Даниличев, 2009) |
| Показатель преломления линзы, образованной интегументом и роговицей, и роговицы | 1.4 | 1.376 | (Atchison, Smith, 2000; Шепелева, 2006) |
| Фокусное расстояние линзы, образованной интегументом и роговицей, и роговицы, мкм, мм | 542 | 31 | (Грюссер, 1985; Шепелева, 2006) |
| Преломляющая сила линзы, образованной интегументом и роговицей, и роговицы, дптр | 2511.6* | 43.05 | (Даниличев, 2009) |
| Размер хрусталика (неаккомодированный–аккомодированный), мкм, мм | 143 × 99 | 3.6 × 9.0–10 × 5.0 | (Шепелева, 2006; Даниличев, 2009) |
| Радиус кривизны передней/задней поверхности хрусталика (неаккомодированный–аккомодированный), мкм, мм | 78/78 | 10/6.0–5.3/5.3 | (Грюссер, 1985; Шепелева, 2006) |
| Общий показатель преломления хрусталика (неаккомодированный–аккомодированный) | 2.0* | 1.414–1.424 | (Грюссер, 1985) |
| Градиент показателя преломления хрусталика | – | 1.386–1.406 | (Atchison, Smith, 2000) |
| Фокусное расстояние хрусталика (неаккомодированный–аккомодированный), мкм, мм | 205 | 69.91*–40.41* | (Шепелева, 2006) |
| Преломляющая сила хрусталика (неаккомодированный–аккомодированный), дптр | 6585.4* | 19.11–33.06 | (Даниличев, 2009) |
| Фокусное расстояние светопреломляющего аппарата глаза (неаккомодированный–аккомодированный), мкм, мм | 162 | 22.79–18.93 | (Шепелева, 2006; Даниличев, 2009) |
| Преломляющая сила светопреломляющего аппарата глаза (неаккомодированный–аккомодированный), дптр | 8333.3* | 58.64–70.57 | (Даниличев, 2009) |
| Показатель преломления стекловидного тела/водянистой влаги | 1.35/– | 1.336/1.336 | (Atchison, Smith, 2000; Gál et al., 2004) |
| Светочувствительный аппарат | |||
| Длина светочувствительной части фоторецепторных клеток первого /второго типа и наружного сегмента колбочек, мкм | 11/2.3/1.9/2.2 | 35 | (Polyak, 1941; Шепелева, 2006) |
| Диаметр поперечного сечения светочувствительной части фоторецепторных клеток первого/второго типа и наружного сегмента колбочек, мкм | 8.0/5.0/2.5/2.0 | 1.0 | (Polyak, 1941; Шепелева, 2006) |
| Диаметр микровилл фоторецепторных клеток первого/второго типа и толщина мембранных дисков колбочек, мкм, нм | 0.07/0.1/0.1/0.1 | 15 | (Островский, 1978; Шепелева, 2006) |
| Расстояние между основанием и вершиной выпуклой апикальной поверхности тел фоторецепторных клеток первого типа/основанием и краями вогнутой апикальной поверхности тел фоторецепторных клеток второго типа (соответствует степени погружения в пигментный слой сетчатки), мкм | 2.65 ± 0.71*/ 0.49 ± 0.12*/ 0.86 ± 0.12*/ 1.05 ± 0.08* (n = 8/5/5/5) |
– | |
| Расстояние между центрами соседних фоторецепторных клеток первого/второго типа и колбочек, мкм | 11/10/13/6 | 1.5 | (Polyak, 1941; Шепелева, 2006) |
| Пространственная разрешающая способность фоторецепторных клеток первого/второго типа и колбочек (неаккомодированный–аккомодированный), рад–1 | 8.5/9.5/7.2/15.8 | 8681*–7363* | (Шепелева, 2006) |
| Светоизолирующий аппарат | |||
| Диаметр апикальной поверхности тел пигментных клеток, мкм | 1.08 ± 0.62* (n = 7) |
14 | (Cavallotti, Schveoller, 2008) |
| Число коротких апикальных отростков пигментной клетки и длинных апикальных отростков пигментной клетки вокруг палочки/колбочки | 2.0–5.0* | 3.0–7.0/30–40 | (Афанасьев и др., 2012) |
| Диаметр коротких апикальных отростков пигментной клетки и длинных апикальных отростков пигментной клетки вокруг палочки/колбочки, мкм | 0.09 ± 0.03* (n = 21) |
– | |
| Длина коротких апикальных отростков пигментной клетки и длинных апикальных отростков пигментной клетки вокруг палочки/колбочки, мкм | 0.46 ± 0.08* (n = 13) |
3.0/5.0–7.0 | (Cavallotti, Schveoller, 2008) |
| Размер пигментных гранул, мкм | 0.2–0.8 | 1.0 × 2.0–3.0 | (Cavallotti, Schveoller, 2008; Шепелева, 2017) |
| Толщина пигментного слоя сетчатки, мкм | 27.1 ± 0.98* (n = 5) |
12 | (Cavallotti, Schveoller, 2008) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общее строение камерных глаз Helicigona lapicida и человека
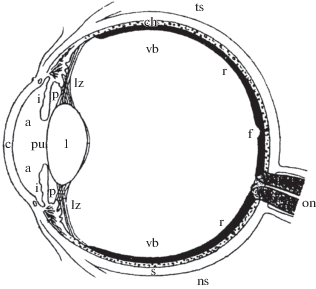
Глаза наземного брюхоногого легочного моллюска H. lapicida и человека принадлежат к камерному типу. Глаза H. lapicida имеют форму сжатого эллипсоида. Для глаз человека описано три формы: сферическая, сжатого и вытянутого эллипсоида (Stone, Flitcroft, 2004). Средний размер глаз H. lapicida составляет 189 мкм вдоль переднезадней оси и 228 мкм вдоль горизонтальной оси (Шепелева, 2006). Средний размер глаз человека вдоль переднезадней оси достигает 22.0–24.8 мм и вдоль горизонтальной оси – 24.2 мм (Bekerman et al., 2014). Размер глаз H. lapicida и человека вдоль каждой оси различается в 116.4–131.2 и 128.0 раз соответственно. Глаза H. lapicida состоят из шести компонентов: оболочки, образованной роговицей и глазной капсулой; зрачка фиксированного диаметра; хрусталика; стекловидного тела, окружающего хрусталик; неинвертированной четырехслойной сетчатки и зрительного нерва (рис. 1) (Шепелева, 2006). Глаза человека состоят из 10 компонентов: оболочки, образованной роговицей и склерой; передней камеры, заполненной водянистой влагой; радужки; зрачка переменного диаметра; задней камеры, заполненной водянистой влагой; хрусталика, подвешенного на цинновой связке; стекловидного тела, расположенного за хрусталиком; инвертированной десятислойной сетчатки; сосудистой оболочки и зрительного нерва (рис. 2) (Даниличев, 2009). Таким образом, камерные глаза H. lapicida и человека существенно различаются по размеру (более чем в 100 раз) и строению, но в то же время содержат шесть одинаковых компонентов – оболочку, зрачок, хрусталик, стекловидное тело, сетчатку и зрительный нерв. У H. lapicida и человека роговица, которая входит в состав оболочки, и хрусталик формируют светопреломляющий аппарат глаз. Фоторецепторные и пигментные клетки, входящие в состав сетчатки, образуют светочувствительный и светоизолирующий аппарат глаз соответственно. Далее в работе у H. lapicida и человека анализируются состав этих трех аппаратов, а также свойства и функции их компонентов.
Рис. 1.
Схематичное изображение камерного глаза Helicigona lapicida. Обозначения: int – интегумент, c – роговица, pu – зрачок, l – хрусталик, vb – стекловидное тело, r – сетчатка, ec – глазная капсула, on – зрительный нерв.
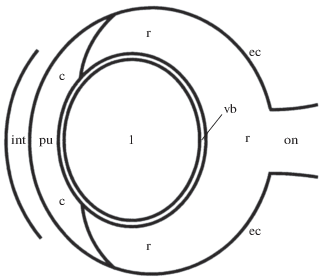
Рис. 2.
Схематичное изображение глаза человека (по: Грюссер, 1985, с изменениями). Обозначения: c – роговица, a – передняя камера, i – радужка, pu – зрачок, p – задняя камера, l – хрусталик, lz – циннова связка, vb – стекловидное тело, r – сетчатка, f – фовеа, ch – сосудистая оболочка, s – склера, on – зрительный нерв, ns – назальная сторона, ts – темпоральная сторона.
Светопреломляющий аппарат камерных глаз Helicigona lapicida и человека
Светопреломляющий аппарат камерных глаз H. lapicida и человека представлен несколькими линзами, которые преломляют свет и проводят его к сетчатке, в результате чего на сетчатке формируются изображения объектов окружающей среды (Atchison, Smith, 2000; Шепелева, 2006; Даниличев, 2009).
У H. lapicida камерные глаза расположены на вершинах пары сократимых щупалец под интегументом, который имеет искривленную поверхность. Поэтому у H. lapicida первым компонентом светопреломляющего аппарата глаза является интегумент, тогда как другими компонентами – структуры глаза – роговица и хрусталик (Шепелева, 2006). Однако у брюхоногих моллюсков интегумент и роговица – линзы, которые имеют одинаковый показатель преломления и вплотную прилегают друг к другу (Gál et al., 2004). Следовательно, интегумент и роговицу можно рассматривать как одну линзу, а светопреломляющий аппарат глаза H. lapicida как состоящий из двух линз: линзы, образованной интегументом и роговицей, и хрусталика (рис. 1) (Шепелева, 2006). Светопреломляющий аппарат глаза человека представлен двумя линзами – роговицей и хрусталиком (рис. 2) (Atchison, Smith, 2000; Даниличев, 2009). У H. lapicida обе линзы имеют постоянную преломляющую силу. Так, рассчитанная величина преломляющей силы линзы, образованной интегументом и роговицей, составляет 2511.6 дптр, хрусталика – 6585.4 дптр (табл. 1). У человека роговица имеет постоянную преломляющую силу, тогда как хрусталик – переменную, поскольку способен к аккомодации, в процессе которой меняются его форма и размер, а также форма преломляющих поверхностей и радиус их кривизны (Atchison, Smith, 2000; Даниличев, 2009). Так, величина преломляющей силы роговицы достигает 43.05 дптр, преломляющей силы хрусталика варьирует от 19.11 до 33.06 дптр (табл. 1) (Даниличев, 2009). У H. lapicida преломляющая сила линзы, образованной интегументом и роговицей, меньше преломляющей силы хрусталика. У человека, наоборот, преломляющая сила роговицы превосходит таковую хрусталика. Поэтому у H. lapicida доминирующим преломляющим компонентом в составе светопреломляющего аппарата глаза является хрусталик, у человека – роговица (Atchison, Smith, 2000; Даниличев, 2009).
Интегумент у H. lapicida покрывает роговицу, которая у H. lapicida и человека является меньшим передним отделом оболочки глаз; интегумент совместно с роговицей выполняют защитную функцию по отношению к хрусталику. Линза, образованная интегументом и роговицей у H. lapicida, и роговица у человека представляют собой выпукло-вогнутые прозрачные и бесцветные линзы. У H. lapicida роговица имеет полусферическую форму преломляющих поверхностей, у человека – асферическую форму, которая способствует сведению параксиальных и периферических лучей к общему фокусу и тем самым ослаблению сферической аберрации глаза (Doggart, 1959; Land, 1981; Atchison, Smith, 2000; Шепелева, 2006; Даниличев, 2009). Показатель преломления роговицы у H. lapicida не определен. У других видов брюхоногих моллюсков наравне с интегументом его принимают равным 1.4, у человека он составляет 1.376 (табл. 1) (Atchison, Smith, 2000; Gál et al., 2004). Интегумент у H. lapicida состоит из эпидермиса, который образован одним слоем эпителиальных клеток, лежащих на базальной мембране, и дермы; роговица образована одним слоем эпителиальных клеток, расположенных на базальной мембране (Шепелева, 2006). В роговице человека различают шесть слоев: поверхностный слой, образованный многослойным эпителием; переднюю пограничную мембрану; строму, представляющую собой соединительную ткань; слой Дюа – тонкий высокопрочный слой коллагена; заднюю пограничную мембрану; слой эндотелиальных клеток (Atchison, Smith, 2000; Даниличев, 2009; Dua et al., 2013). Биохимический состав роговицы H. lapicida так же, как других видов брюхоногих моллюсков, неизвестен, поэтому сравнить его с биохимическим составом роговицы человека пока не представляется возможным. Тем не менее роговица H. lapicida должна содержать кристаллины. Кристаллины представляют собой семейства белков, которые входят в состав роговиц и хрусталиков всех исследованных видов беспозвоночных и позвоночных, где создают и поддерживают прозрачность линз, градиент показателя преломления хрусталиков, а также поглощают вредное для глаз ультрафиолетовое излучение (Piatigorsky, 1998). Кристаллины присутствуют и в роговице человека, которая также содержит воду, другие неорганические и органические соединения и вещества (Piatigorsky, 1998). Известно, что содержание воды в ткани, которая хорошо поглощает инфракрасное излучение, коррелирует с ее показателем преломления и наоборот (Remé et al., 1996; Tuchin, 2015). У человека роговица содержит в среднем 78% воды (Taylor et al., 2015). Исходя из содержания воды в роговице и хрусталике человека, а также величины показателя преломления роговицы и хрусталика человека и роговицы H. lapicida, можно предположить, что последняя содержит более 60, но менее 70% воды. Роговица H. lapicida, наравне с роговицами других беспозвоночных и позвоночных, с большой долей вероятности способна поглощать ультрафиолетовое излучение с длинами волн короче 300 нм, а также инфракрасное излучение (Douglas, Marshall, 1999). У человека роговица полностью поглощает ультрафиолетовое излучение с длинами волн короче 300 нм и инфракрасное излучение с длинами волн длиннее 2500 нм (Boettner, Walter, 1962).
Хрусталик у H. lapicida лежит в непосредственной близости от роговицы и сетчатки и занимает всю полость глаза, у человека находится на расстоянии от роговицы и занимает незначительную часть полости глазного яблока. Хрусталик H. lapicida и человека – двояковыпуклая прозрачная линза сравнительно мягкой консистенции и разной окрашенности: бесцветная у H. lapicida и бледно-желтая у человека, благодаря чему ослабляет электромагнитное излучение фиолетово-синей части спектра и, следовательно, хроматическую аберрацию глаза (Зак, Островский, 1995; Atchison, Smith, 2000; Шепелева, 2006; Weeber et al., 2007; Даниличев, 2009). У H. lapicida хрусталик имеет форму сжатого эллипсоида, а его преломляющие поверхности – асферическую форму (Шепелева, 2006). У человека в покое аккомодации хрусталик имеет форму сжатого эллипсоида с уплощенной передней и выпуклой задней поверхностями, кривизна которых уменьшается от центральной зоны к периферической, тогда как при максимальном напряжении аккомодации хрусталик становится округлым, а обе его поверхности – более выпуклыми и равной кривизны (Atchison, Smith, 2000; Даниличев, 2009). Хрусталик H. lapicida не имеет оболочки и характеризуется зернистой структурой, которая обусловлена его секреторным происхождением. Рассчитанная величина показателя преломления хрусталика составляет 2.0 (табл. 1). Она значительно превышает максимально возможную величину показателя преломления кристаллинов хрусталиков – 1.530 (Land, 1981). Значительное расхождение в величине показателей преломления указывает на присутствие в хрусталике H. lapicida градиента показателя преломления. Также о нем свидетельствуют отчетливые изображения тестовых объектов, формируемые изолированными хрусталиками моллюска (Шепелева, 2006). Градиент показателя преломления линзы, как и ее асферическая поверхность, способствует ослаблению сферической аберрации глаза (Land, 1981). В хрусталике человека различают капсулу; слой эпителиальных клеток на внутренней передней поверхности капсулы и вещество хрусталика из веретеновидных эпителиальных клеток. Последние образуют слои разной плотности с переменным показателем преломления – от 1.386 на периферии до 1.406 в центре (табл. 1) (Atchison, Smith, 2000; Даниличев, 2009). Биохимический состав хрусталика H. lapicida и других видов брюхоногих моллюсков не определен, поэтому сравнить его с биохимическим составом хрусталика человека пока не представляется возможным. Однако на примере двух видов морских брюхоногих моллюсков показано, что хрусталик содержит кристаллины и может содержать гликозаминогликаны. Последние присутствуют в хрусталике человека, который также содержит воду, другие неорганические и органические соединения и вещества (Cox et al., 1991; Katagiry N., Katagiry Y., 1998; Piatigorsky, 1998). Содержание воды в хрусталике человека составляет примерно 69% на периферии и 63% в центре (Fisher, Pettet, 1973). Высказать предположение о содержании воды в хрусталике H. lapicida на основании величины показателя преломления не представляется возможным, поскольку величина этого параметра не известна. Измеренная величина показателя преломления хрусталиков некоторых видов морских брюхоногих моллюсков варьирует в направлении от периферии к центру от 1.40 до 1.51 или от 1.40 до 1.45 (Hamilton, 1991). По сравнению с морскими моллюсками хрусталик H. lapicida имеет более мягкую консистенцию, схожую с таковой хрусталика человека. Известно, что консистенция линзы коррелирует с величиной показателя преломления и, соответственно, содержанием воды в ней (Land, 1981). Поэтому можно предположить, что содержание воды в хрусталике H. lapicida схоже с содержанием воды в хрусталике человека. У H. lapicida, наравне с другими беспозвоночными и позвоночными, хрусталик с большой долей вероятности способен поглощать ультрафиолетовое излучение с длинами волн короче 300 нм, а также инфракрасное излучение (Douglas, Marshall, 1999). У человека хрусталик полностью поглощает ультрафиолетовое излучение с длинами волн короче 300 нм и инфракрасное излучение с длинами волн длиннее 1900 нм (Boettner, Walter, 1962).
У H. lapicida светопреломляющий аппарат глаза создает отчетливое изображение на светочувствительном слое трех из четырех видов фоторецепторных клеток (Шепелева, 2006). У человека в покое аккомодации, в зависимости от положения главного фокуса по отношению к сетчатке, различают два вида клинической рефракции: эмметропию – соразмерную рефракцию, когда длина переднезадней оси глаза совпадает с длиной фокусного расстояния его светопреломляющего аппарата и фокус располагается на сетчатке; и аметропию – несоразмерную рефракцию, когда фокус располагается за пределами сетчатки. Последняя бывает трех видов: миопия, при которой лучи фокусируются перед сетчаткой; гиперметропия, при которой лучи фокусируются за сетчаткой; астигматизм – различие в преломляющей силе роговицы и/или хрусталика во взаимно перпендикулярных меридианах, при котором образуется два фокуса (Даниличев, 2009).
Таким образом, светопреломляющий аппарат камерных глаз H. lapicida и человека содержит больше одинаковых компонентов, которые имеют больше одинаковых свойств и выполняют больше одинаковых функций (табл. 2).
Таблица 2.
Сходства и различия между светопреломляющим, светочувствительным и светоизолирующим аппаратом камерных глаз Helicigona lapicida и человека
| Состав, свойства и функции компонентов | Сходства (+) и различия (–) |
|---|---|
| Светопреломляющий аппарат | |
| Состав | |
| Интегумент | – |
| Роговица | + |
| Хрусталик | + |
| Линза, образованная интегументом и роговицей, и роговица | |
| Свойства | |
| Расположение | + |
| Размер относительно размера оболочки глаза | + |
| Вид линзы | + |
| Прозрачность | + |
| Пигментация | + |
| Форма преломляющих поверхностей | – |
| Показатель преломления | + |
| Строение | – |
| Функции | |
| Светопреломляющая | + |
| Светопроводящая | + |
| Защитная | + |
| Ослабление сферической аберрации | – |
| Светофильтр для УФ- и ИК-излучения | + |
| Хрусталик | |
| Свойства | |
| Расположение в глазной полости | – |
| Размер относительно размера глаза | – |
| Вид линзы | + |
| Прозрачность | + |
| Консистенция | + |
| Пигментация | – |
| Форма | +/– |
| Форма преломляющих поверхностей | + |
| Строение | – |
| Показатель преломления | – |
| Градиент показателя преломления | + |
| Функции | |
| Светопреломляющая | + |
| Светопроводящая | + |
| Ослабление хроматической аберрации | – |
| Участие в аккомодации | – |
| Ослабление сферической аберрации | + |
| Светофильтр для УФ- и ИК-излучения | + |
| Светочувствительный аппарат | |
| Состав | |
| Фоторецепторные клетки | + |
| Свойства | |
| Число цитологических типов | + |
| Цитологический тип | – |
| Число морфологических типов | + |
| Морфологический тип | – |
| Число морфологических видов | + |
| Морфологический вид | – |
| Строение | – |
| Чувствительность к свету | +/– |
| Зрительный пигмент | +/– |
| Максимум чувствительности зрительных пигментов | +/– |
| Расположение в сетчатке | – |
| Расположение в зрительной части сетчатки | + |
| Расположение двух типов фоторецепторных клеток в центральной и периферической области зрительной части | +/– |
| Область с максимальной пространственной разрешающей способностью фоторецепторных клеток | +/– |
| Различие в пространственной разрешающей способности между фоторецепторными клетками | – |
| Функции | |
| Восприятие и кодирование стимулов | + |
| Рабочий диапазон | +/– |
| Цветовое зрение | +/– |
| Пространственная разрешающая способность | – |
| Светоизолирующий аппарат | |
| Состав | |
| Пигментные клетки | + |
| Свойства | |
| Строение | +/– |
| Расположение пигментных гранул в пигментных клетках | +/– |
| Форма пигментных гранул | – |
| Порядок расположения пигментных гранул | – |
| Экранирующий пигмент | + |
| Образование пигментного слоя сетчатки | – |
| Расположение пигментного слоя в сетчатке | – |
| Расположение пигментных клеток в зрительной и незрительной части сетчатки | + |
| Расположение пигментных клеток по отношению к фоторецепторным клеткам | – |
| Изоляция светочувствительных частей фоторецепторных клеток при помощи отростков пигментных клеток | – |
| Погружение фоторецепторных клеток в пигментный слой сетчатки | – |
| Функции | |
| Поглощение света | +/– |
| Опорная | + |
| Транспортная | + |
| Секреторная | + |
| Антиоксидантная | – |
| Восстановление зрительного пигмента | – |
| Фагоцитоз дисков наружных сегментов палочек и колбочек | – |
Светочувствительный аппарат камерных глаз Helicigona lapicida и человека
Светочувствительный аппарат камерных глаз H. lapicida и человека образован фоторецепторными клетками, которые поглощают электромагнитное излучение в видимой части спектра и преобразуют его энергию в энергию нервных импульсов (Хьюбел, 1990).
У H. lapicida фоторецепторные клетки представлены одним цитологическим типом – микровиллярным и двумя морфологическими типами – первым и вторым. В свою очередь, клетки первого типа представлены одним видом, клетки второго типа – тремя видами. Фоторецепторные клетки состоят из светочувствительной части, тела и аксона. Клетки первого типа характеризуются длинным и широким пучком микровилл полусферической формы на выпуклой апикальной поверхности, клетки второго типа – значительно более коротким и узким пучком микровилл приблизительно такой же формы на вогнутой апикальной поверхности. Три вида клеток второго типа различаются между собой длиной и диаметром пучка микровилл, а также степенью вогнутости апикальной поверхности (табл. 1) (Шепелева, 2006). У человека фоторецепторные клетки также представлены одним цитологическим типом – цилиарным – и двумя морфологическими типами – палочками и колбочками. Палочки представлены одним видом, колбочки – тремя видами. Палочки и колбочки состоят из светочувствительного наружного сегмента, который образован стопками мембранных дисков, соединительной реснички, внутреннего сегмента, ядерной части и синаптической области с нейронами второго порядка. Палочки имеют длинный и тонкий наружный сегмент цилиндрической формы, колбочки – более короткий и толстый наружный сегмент конической формы (табл. 1) (Хьюбел, 1990; Даниличев, 2009). У H. lapicida фоторецепторные клетки первого типа имеют более высокую чувствительность к свету, чем клетки второго типа, но оба типа клеток имеют низкую чувствительность и могут функционировать при дневном освещении (Шепелева, 2006). У человека палочки имеют высокую чувствительность и работают при ночном и сумеречном освещении, а также с меньшей эффективностью – при дневном освещении, тогда как колбочки имеют низкую чувствительность и работают при дневном и сумеречном освещении (Даниличев, 2009; Tikiji-Hamburyan et al., 2017). У H. lapicida природа зрительного пигмента не определена и спектральная чувствительность фоторецепторных клеток глаза не оценена. Однако исследования, выполненные при помощи разных методов на других видах брюхоногих моллюсков, указывают на принадлежность их зрительных пигментов к классу родопсинов с максимумом чувствительности к излучению с длиной волны в диапазоне 475–500 нм и на монохроматическое зрение (Menzel, 1979; Land, 1981; Шепелева, 2013а, б; Shepeleva, 2019). У человека в палочках находится зрительный пигмент родопсин с максимумом чувствительности к излучению с длиной волны около 510 нм. Поэтому палочки обеспечивают монохроматическое зрение. Каждый вид колбочек содержит зрительный пигмент йодопсин с собственным максимумом чувствительности, в соответствии с которым получил свое название. Так, колбочки, которые содержат цианолаб с наибольшей чувствительностью около 430 нм, называются коротковолновыми; те, у которых обнаружен хлоролаб с максимальной чувствительностью около 530 нм – средневолновыми; и те, которые содержат эритролаб с наибольшей чувствительностью около 560 нм – длинноволновыми. Три вида колбочек обеспечивают цветовое зрение человека (Хьюбел, 1990; Ignatov, Mosin, 2014). Однако существуют люди с нарушенным цветовосприятием – монохроматы и дихроматы, а также такие, которые способны различать большее, чем трихроматы, количество цветов – тетрахроматы (Jordan et al., 2010).
У H. lapicida фоторецепторные клетки занимают все четыре слоя сетчатки: микровиллярный слой, образованный микровиллами фоторецепторных клеток; пигментный и соматический слои, включающие апикальные и базальные части фоторецепторных клеток соответственно; и плексиформный слой, содержащий аксоны фоторецепторных клеток. У человека фоторецепторные клетки находятся на уровне четырех из десяти слоев сетчатки: слоя палочек и колбочек, состоящего из наружных и внутренних сегментов этих клеток; наружной пограничной мембраны; наружного ядерного слоя, содержащего ядерную часть палочек и колбочек; и наружного плексиформного слоя – синаптической зоны между фоторецепторными и биполярными клетками (Хьюбел, 1990; Schubert, 2014). У H. lapicida и человека фоторецепторные клетки расположены в зрительной части сетчатки, которая разделена на центральную и периферическую области (Даниличев, 2009). Обе области являются однородными у H. lapicida и поделены на зоны у человека (Schubert, 2014). Так, у человека центральная область сетчатки (макула) содержит фовеа (центральную ямку), в которой выделяют фовеолу (дно) с центром (умбо), склон и утолщенный край, и которая окружена парафовеа и перифовеа (рис. 2). В периферической области по мере удаления от центральной области различают ближнюю, среднюю, дальнюю и крайнюю периферию (Schubert, 2014). У H. lapicida в каждой области сетчатки находятся фоторецепторные клетки первого и второго типа. У человека фовеола не содержит палочек и коротковолновых колбочек, а заполнена только средневолновыми и длинноволновыми колбочками. В остальных зонах центральной области сетчатки так же, как во всех зонах периферической области, фоторецепторные клетки представлены палочками и тремя видами колбочек (Schubert, 2014). У H. lapicida областью с максимальной плотностью расположения и, соответственно, с максимальной пространственной разрешающей способностью фоторецепторных клеток является вся центральная область, у человека – зона центральной области, фовеола (Schubert, 2014). В центральной области у H. lapicida пространственная разрешающая способность фоторецепторных клеток первого типа ниже, чем двух из трех видов фоторецепторных клеток второго типа (табл. 1). В фовеоле у человека пространственная разрешающая способность средневолновых и длинноволновых колбочек идентична, поскольку клетки имеют одинаковые параметры (табл. 1). За пределами фовеолы, где появляются палочки, их пространственная разрешающая способность ниже таковой колбочек (Land, 1981).
Таким образом, светочувствительный аппарат камерных глаз H. lapicida и человека состоит из одинаковых компонентов, которые имеют больше разных свойств и выполняют поровну одинаковых и разных функций (табл. 2).
Светоизолирующий аппарат камерных глаз Helicigona lapicida и человека
Светоизолирующий аппарат камерных глаз H. lapicida и человека представлен пигментными клетками, которые предназначены для поглощения света, рассеянного тканями глаза, и предотвращения его распространения между светочувствительными частями соседних фоторецепторных клеток. У некоторых беспозвоночных и позвоночных, включая человека, эта функция реализуется при помощи апикальных отростков пигментных клеток, которые окружают светочувствительную часть каждой фоторецепторной клетки и в которые под действием света перемещаются гранулы экранирующего пигмента (Eakin, 1972; Dontsov, Ostrovsky, 2019).
У H. lapicida пигментные клетки состоят из тела и одного вида коротких тонких апикальных отростков, похожих на микровиллы. У человека пигментные клетки состоят из тела и двух видов апикальных отростков: коротких, которые взаимодействуют с концами наружных сегментов палочек и колбочек, и длинных, которые располагаются между наружными сегментами палочек и колбочек (табл. 1) (Афанасьев и др., 2012). У H. lapicida и человека пигментные клетки содержат гранулы, заполненные экранирующим пигментом. У H. lapicida большинство гранул сосредоточено в апикальной части тел пигментных клеток, у человека – в апикальной части тел и длинных апикальных отростках (Cavallotti, Schveoller, 2008). У H. lapicida гранулы экранирующего пигмента имеют сферическую и округлую форму и располагаются в произвольном порядке. У человека демонстрируют сигарообразную форму и в большинстве случаев ориентированы вертикально и параллельно друг другу (табл. 1) (Boulton, Dayhaw-Barker, 2001). Природа экранирующего пигмента сетчатки глаза H. lapicida не определена. Однако экранирующий пигмент других представителей брюхоногих моллюсков относят к классу меланинов (Бобкова, 1996). У человека экранирующий пигмент сетчатки глаза является меланином (Cavallotti, Schveoller, 2008).
У H. lapicida апикальные части тел пигментных клеток в совокупности образуют пигментный слой сетчатки, который располагается между микровиллярным и соматическим слоем. У человека сами пигментные клетки образуют в сетчатке отдельный слой пигментного эпителия между слоем палочек и колбочек и сосудистой оболочкой (табл. 1) (Cavallotti, Schveoller, 2008). У H. lapicida и человека пигментные клетки расположены в зрительной и незрительной части сетчатки (Даниличев, 2009). В зрительной части сетчатки у H. lapicida пигментные клетки распределены таким образом, что несколько пигментных клеток окружают одну фоторецепторную клетку. Пигментные клетки не имеют длинных апикальных отростков, подходящих для изоляции светочувствительных частей фоторецепторных клеток и поглощения рассеянного света. Поэтому фоторецепторные клетки первого типа изолированы друг от друга пигментными клетками только на уровне клеточных тел, но не светочувствительных частей. Светочувствительные части фоторецепторных клеток второго типа в большей или меньшей степени погружены в пигментный слой сетчатки, что, возможно, следует рассматривать как альтернативный способ достижения их частичной изоляции друг от друга и реализации функции поглощения рассеянного света (табл. 1) (Шепелева, 2021). У H. lapicida, как у представителя группы брюхоногих моллюсков, пигментные клетки по отношению к фоторецепторным клеткам выполняют еще опорную и транспортную функции. Также в пигментных клетках синтезируются вещества, которые секретируются и транспортируются в полость глаз, где из них формируются хрусталик и стекловидное тело (Eakin, 1972). Последнее служит опорой для погруженных в него микровилл фоторецепторных клеток. У человека клетки пигментного эпителия своей апикальной поверхностью обращены к наружным сегментам палочек и колбочек. Концы наружных сегментов палочек достигают апикальной поверхности клеток пигментного эпителия, колбочек – нет (Anderson et al., 1978). Длинные апикальные отростки пигментных клеток охватывают и изолируют друг от друга наружные сегменты палочек и колбочек (Strauss, 2005; Dontsov, Ostrovsky, 2019). Отростки, которые контактируют с палочками, имеют цилиндрическую форму и покрывают только верхушку наружного сегмента, в то время как отростки, которые контактируют с колбочками, устроены сложнее и могут проникать глубже в межфоторецепторный матрикс (Boulton, Dayhaw-Barker, 2001). Отростки колбочек представляют собой пальцевидные выросты, которые становятся трубчатыми, когда достигают верхушек их наружных сегментов. Отростки расширяются, чтобы покрыть верхушки, и продолжаются вниз по наружному сегменту до одной трети его длины. Некоторые из отростков могут быть расположены концентрически, образуя многослойную оболочку вокруг наружного сегмента колбочки (Anderson et al., 1978). Помимо поглощения рассеянного света клетки пигментного эпителия выполняют антиоксидантную, опорную и транспортную функции, функции восстановления зрительного пигмента и фагоцитоза дисков наружных сегментов палочек и колбочек, а также секреторную функцию (Strauss, 2005; Афанасьев и др., 2012; Dontsov, Ostrovsky, 2019).
Таким образом, светоизолирующий аппарат камерных глаз H. lapicida и человека состоит из одинаковых компонентов, которые имеют больше разных свойств и выполняют поровну одинаковых и разных функций (табл. 2).
ЗАКЛЮЧЕНИЕ
Сравнительный анализ светопреломляющего, светочувствительного и светоизолирующего аппарата камерных глаз наземного брюхоногого легочного моллюска H. lapicida и человека, выполненный на основе собственных и литературных данных, позволил выявить между ними сходства и различия. Последние наблюдаются в составе аппаратов глаз, а также свойствах и функциях их компонентов. Светопреломляющий аппарат состоит из одинаковых и разных компонентов, но содержит больше одинаковых, тогда как светочувствительный и светоизолирующий аппараты состоят из одинаковых компонентов. Компоненты светопреломляющего аппарата имеют больше одинаковых свойств, светочувствительного и светоизолирующего аппаратов – наоборот – больше разных свойств. Компоненты светопреломляющего аппарата выполняют больше одинаковых функций, светочувствительного и светоизолирующего аппаратов – поровну одинаковых и разных функций. В целом из трех рассмотренных аппаратов камерных глаз H. lapicida и человека больше сходств, чем различий, обнаружено у светопреломляющего аппарата, и больше различий, чем сходств – у светочувствительного и светоизолирующего аппаратов.
Автор благодарит проф. Э.Дж. Ворранта за предоставленную возможность проведения исследований на кафедре биологии клетки и организма Университета Лунда, М. Соренссона за доставку моллюсков с о. Эланд и заведующую лабораторией электронной микроскопии Р. Валлен за помощь в изготовлении ультратонких срезов глаз моллюсков.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 63) и Университета Лунда.
Список литературы
Афанасьев Ю.И., Юрина Н.А., Котовский Е.Ф., 2012. Гистология, эмбриология, цитология. М.: ГЕОТАР-Медиа. 800 с.
Бобкова М.В., 1996. Форма сетчатки, структура хрусталика и природа экранирующего пигмента глаза Lymnaea stagnalis // Журн. эвол. биохим. физиол. № 1. С. 109–112.
Грюссер О., 1985. Зрение и движения глаз // Физиология человека / Под ред. Шмидта Р., Тевса Г. М.: Мир. С. 90–105.
Даниличев В.Ф., 2009. Современная офтальмология. СПб.: Питер. 688 с.
Зайцева О.В., 2000. Организация сенсорных систем брюхоногих моллюсков: принцип структурно-функционального параллелизма развития. Автореф. дисс. … докт. биол. наук. СПб.: СПбГУ. 33 с.
Зак П.П., Островский М.А., 1995. Желтизна оптических сред глаза в физиологии и патологии человеческого зрения // Сенсорные системы. Т. 9. № 1. С. 9–20.
Кэндел Э., 1982. Малые системы нейронов. Мозг. М.: Мир. 280 с.
Лакин Г.Ф., 1990. Биометрия. М.: Высш. школа. 351 с.
Островский М.А., 1978. Фоторецепторные клетки. М.: Знание. 64 с.
Хьюбел Д., 1990. Глаз, мозг, зрение. М.: Мир. 239 с.
Черноризов А.М., Шехтер Е.Д., Греченко Т.Н., Гарусев А.В., 2009. Психофизиология ахроматического зрения: от простых нервных систем к человеку // Психология человека в современном мире. Т. 4. М.: Ин-т психологии РАН. С. 370–377.
Шепелева И.П., 2006. Глаз наземного брюхоногого моллюска Helicigona lapicida (Pulmonata: Stylommatophora) // Сенсорные системы. Т. 20. № 1. С. 52–58.
Шепелева И.П., 2011. Камерные глаза брюхоногих моллюсков // Вестн. Мордовского ун-та. № 4. С. 230–239.
Шепелева И.П., 2013а. Сравнительный анализ камерных глаз брюхоногих моллюсков и человека // Сенсорные системы. Т. 27. № 4. С. 317–326.
Шепелева И.П., 2013б. Спектральная чувствительность глаза брюхоногого легочного моллюска Radix peregra (Müller, 1774) (Basommatophora, Lymnaeidae) // Ruthenica. V. 23. № 2. Р. 177–180.
Шепелева И.П., 2017. Экранирующий пигмент камерных глаз стебельчатоглазых моллюсков (Pulmonata, Stylommatophora) с разными световыми предпочтениями // Ruthenica. V. 27. № 3. Р. 133–140.
Шепелева И.П., 2018а. Дифракция в камерных глазах брюхоногих моллюсков и человека // Рос. физиол. журн. им. И.М. Сеченова. Т. 104. № 2. С. 31–38.
Шепелева И.П., 2018б. Сравнительный анализ разрешающей способности камерных глаз брюхоногих моллюсков и человека // Рос. физиол. журн. им. И.М. Сеченова. Т. 104. № 4. С. 412–424.
Шепелева И.П., 2018в. Морфологические и оптические свойства и эволюционные изменения хрусталиков глаз наземных брюхоногих моллюсков (Pulmonata, Stylommatophora) // Ruthenica. V. 28. № 1. Р. 33–38.
Шепелева И.П., 2018г. Морфологические и оптические свойства и эволюционные изменения щупальцевого эпидермиса и роговицы глаз наземных брюхоногих моллюсков (Pulmonata, Stylommatophora) // Ruthenica. V. 28. № 4. Р. 151–156.
Шепелева И.П., 2020. Клеточный состав, морфологическая характеристика и эволюционные изменения фоторецепторного аппарата камерных глаз наземных брюхоногих моллюсков (Heterobranchia, Stylommatophora) // Ruthenica. V. 30. № 2. Р. 93–101.
Шепелева И.П., 2021. Светоизолирующий аппарат камерного глаза наземного брюхоногого моллюска Arion rufus (Heterobranchia, Stylommatophora) // Ruthenica. V. 31. № 1. Р. 39–49.
Anderson D.H., Fisher S.K., Steinberg R.H., 1978. Mammalian cones: Disc shedding, phagocytosis, and renewal // Assoc. Res. Vis. Ophthalmol. V. 17. № 2. P. 117–133.
Atchison D.A., Smith G., 2000. Optics of the Human Eye. Oxford: Butterworth-Heinemann. 269 p.
Bekerman I., Gottlieb P., Vaiman M., 2014. Variations in eyeball diameters of the healthy adults // J. Ophthalmol. V. 2014. P. 503645.
Boettner E.A., Walter J.R., 1962. Transmission of the ocular media // Invest. Ophthalmol. Vis. Sci. V. 1. № 6. P. 776–783.
Boulton M., Dayhaw-Barker P., 2001. The role of the retinal pigment epithelium: Topographical variation and ageing changes // Eye. V. 15. P. 384–389.
Cavallotti C.A.P., Schveoller M., 2008. Aging of the retinal pigmented epithelium // Age-related Changes of the Human Eye / Eds Cavallotti C.A.P., Cerulli L. Totowa: Humana Press. P. 203–215.
Chernorizov A.M., Sokolov E.N., 2010. Mechanisms of achromatic vision in invertebrates and vertebrates: A comparative study // Span. J. Psychol. V. 13. № 1. P. 18–29.
Cox R.L., Glick D.L., Strumwasser F., 1991. Isolation and protein sequence identification of Aplysia californica lens crystallins // Biol. Bull. V. 181. P. 333–335.
Doggart J.H., 1959. Significance of color change in the cornea // Br. J. Ophthalmol. V. 43. № 13. P. 13–20.
Dontsov A.E., Ostrovsky M.A., 2019. Screening eye pigments as natural antioxidants // Antioxidants in Systems of Varying Complexity. Chemical, Biochemical and Biological Aspects / Eds Shishkina L.N., Goloshchapov A.N., Weisfeld L.I. Oakville: Apple Academic Press Inc. P. 141–179.
Douglas R.H., Marshall N.J., 1999. A review of vertebrate and invertebrate ocular filters // Adaptive Mechanisms in the Ecology of Vision / Eds Archer S.N., Djamgoz M.B.A., Loew E.R., Partridge J.C., Vallerga S. Dordrecht: Springer. P. 95–162.
Dua H.S., Faraj L.A., Said D.G., Gray T., Lowe J., 2013. Human corneal anatomy redefined: A novel pre-Descemet’s layer (Dua’s layer) // Ophthalmology. V. 120. № 9. P. 1778–1785.
Eakin R.M., 1972. Structure of invertebrate photoreceptors // Photochemistry of Vision / Ed. Dartnall H.J.A. Berlin; Heidelberg; N.Y.: Springer-Verlag. P. 625–684.
Fisher R.F., Pettet B.E., 1973. Presbyopia and the water content of the human crystallin lens // J. Physiol. V. 234. P. 443–447.
Gál J., Bobkova M.V., Zhukov V.V., Shepeleva I.P., Meyer-Rochow V.B., 2004. Fixed focal-length optics in pulmonate snails (Mollusca, Gastropoda): Squaring phylogenetic background and ecophysiological needs (II) // Invert. Biol. V. 123. № 2. P. 116–127.
Hamilton P.V., 1991. Variation in sense organ design and associated sensory capabilities among closely related mollusks // Am. Malacol. Bull. V. 9. № 1. P. 89–98.
Jordan J., Deeb S.S., Bosten J.M., Mollon J.D., 2010. The dimensionality of color vision in carriers of anomalous trichromacy // J. Vision. V. 10. № 8. P. 1–19.
Ignatov I., Mosin O., 2014. Studying of phototransformation of light signal by photoreceptor pigments – rhodopsin, iodopsin and bacteriorhodopsin // Eur. J. Mol. Biotechnol. V. 5. № 3. P. 104–119.
Katagiry N., Katagiry Y., 1998. Fine structure of the dioptric apparatus in the stalk eye of Onchidium verriculatum (Gastropoda, Stylommatophora): A distinct lamellar substructure of the lens // Zoomorphology. V. 118. P. 13–21.
Land M.F., 1981. Optics and vision in invertebrates // Vision in Invertebrates / Ed. Autrum H. Berlin; Heidelberg; N.Y.: Springer-Verlag. P. 471–592.
Menzel R., 1979. Spectral sensitivity and colour vision in invertebrates // Comparative Physiology and Evolution of Vision in Invertebrates / Ed. Autrum H. Berlin; Heidelberg: Springer-Verlag. P. 504–566.
Messenger J.B., 1981. Comparative physiology of vision in molluscs // Comparative Physiology and Evolution of Vision in Invertebrates / Ed. Autrum H. Berlin; Heidelberg; N.Y.: Springer-Verlag. P. 93–200.
Piatigorsky J., 1998. Gene sharing in lens and cornea: Facts and implications // Prog. Ret. Eye Res. V. 17. № 2. P. 145–174.
Polyak S.L., 1941. The Retina. Chicago: Univ. Chicago Press. 607 p.
Remé C., Reinboth J., Clausen M., Hafezi F., 1996. Light damage revisited: Converging evidence, diverging views? // Graefes Arch. Clin. Exp. Ophthalmol. V. 234. P. 2–11.
Schubert H.D., 2014. Structure of the neural retina // Ophthalmology / Eds Yanoff M., Duker J.S. Edinburgh: Elsevier. P. 419–423.
Shepeleva I.P., 2018. Spherical aberration of camera-like eyes // J. Opt. Technol. V. 85. № 8. P. 507–510.
Shepeleva I.P., 2019. A comparative analysis of the camera-like eyes of gastropod mollusks and humans // Neural Networks and Neurotechnologies / Eds Shelepin Y., Ogorodnikova E., Solovyev N., Yakimova E. St. Petersburg: VVM. P. 85–92.
Smith W.J., 2000. Modern Optical Engineering. N.Y.: McGraw-Hill. 641 p.
Stone R.A., Flitcroft D.I., 2004. Ocular shape and myopia // Ann. Acad. Med. Singap. V. 33. № 1. P. 7–15.
Strauss O., 2005. The retinal pigment epithelium in visual function // Physiol. Rev. V. 85. P. 845–881.
Tang M., Chen A., Li Y., Huan D., 2010. Corneal power measurement with Fourier-domain optical coherence tomography // J. Cataract. Refract. Surg. V. 36. № 12. P. 2115–2122.
Taylor Z.D., Garritano J., Sung S., Bajwa N., Nowroozi B. et al., 2015. THz and mm-wave sensing of corneal tissue water content: Electromagnetic modelling and analysis // IEEE Trans. Terahertz Sci. Technol. V. 5. № 2. P. 170–183.
Tikiji-Hamburyan A., Reinhard R., Storchi R., Dietter J., Seitter H. et al., 2017. Rods progressively escape saturation to drive visual responses in daylight conditions // Nat. Commun. V. 8. P. 1–17.
Tuchin V.V., 2015. Tissue optics and photonics: Light-tissue interaction // J. Biomed. Photonics Eng. V. 1. № 2. P. 98–134.
Weeber H.A., Eckert G., Pechhold W., Heijde R.G.L., van der, 2007. Stiffness gradient in the crystalline lens // Graefe’s Arch. Clin. Exp. Ophthalmol. V. 245. P. 1357–1366.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


