Океанология, 2020, T. 60, № 1, стр. 74-86
Гетеротрофный бактериопланктон шельфа моря Лаптевых и Восточно-Сибирского моря в области влияния пресноводного стока
Е. М. Беззубова 1, *, А. М. Селиверстова 1, И. А. Замятин 1, 2, Н. Д. Романова 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Московский физико-технический институт
Москва, Россия
* E-mail: elena.m.bezzubova@gmail.com
Поступила в редакцию 18.02.2019
После доработки 15.08.2019
Принята к публикации 16.12.2019
Аннотация
На основе материала, собранного в областях шельфа моря Лаптевых и Восточно-Сибирского моря, находящихся под влиянием стока рек Хатанги, Индигирки и Колымы, предпринята попытка выявить гидрохимические и биологические факторы, влияющие на пространственное распределение бактериопланктона. Наибольшие показатели количества и дыхательной активности бактериопланктона были приурочены к приустьевым областям и кромке шельфа. Полученные результаты показали, что соленость не является определяющим фактором, оказывающим влияние на количественные характеристики бактериопланктона в эстуарных областях Арктических морей. Обнаружены достоверные положительные корреляции хлорофилла “а” и феофитина с численностью и биомассой бактериопланктона.
ВВЕДЕНИЕ
Особенности функционирования экосистем арктических морей во многом обусловлены особенностями Северного Ледовитого океана. Краевые эпиконтинентальные моря составляют более 60% площади Северного Ледовитого океана. Ширина шельфа некоторых из них (моря Лаптевых, Восточно-Сибирского, Чукотского) очень велика и достигает 1000 км [5]. На Северный Ледовитый океан приходится примерно 11% мирового стока рек при том, что объем его вод составляет лишь около 1% от объема вод Мирового океана [20]. Явные признаки климатических изменений, происходящих в Арктическом регионе, а также прогнозируемое усиление антропогенного воздействия на местные экосистемы, являются веским основанием для увеличения объема исследований эстуарных областей данного региона [27]. Для моря Лаптевых средний годовой материковый сток, основной вклад в который вносят реки Лена и Хатанга, составляет 745 км3. Около 70% всего материкового стока в море Лаптевых приходится на более изученную реку Лену [7, 30, 32]. Сток Хатанги составляет 105 км3 воды в год [8]. Материковый сток в бассейн Восточно-Сибирского моря сравнительно невелик – около 250 км3 (Колыма – 132 км3, Индигирка – 59 км3, остальные реки – 25 км3) [18].
Важнейшим фактором, влияющим на эффективную трансформацию и утилизацию аллохтонного органического вещества (в том числе загрязнений) и функционированиие планктонного сообщества, является активность бактериопланктона. Роль этого компонента заключается как в деструкции и реминерализации остатков живых организмов и аллохтонного вещества, так и в концентрации в собственных клетках растворенного в воде органического вещества [10]. Главным компонентом микробных сообществ являются гетеротрофные бактерии, через которых проходит более 40% общего потока углерода в планктонных трофических сетях [22]. В экосистемах полярных широт, характеризующихся дефицитом света, ярко выраженной сезонностью, пространственной и временнóй ограниченностью цветения фитопланктона, микробная петля [23] и бактериопланктон в частности могут становиться основой пищевой цепи [26]. Несмотря на десятилетиями неутихающий интерес, данных о пространственной изменчивости и особенностях функционирования бактериопланктона, а также о факторах, влияющих на планктонное сообщество эстуариев Арктических морей не так много [9, 10, 15, 28, 30, 32]. Так некоторые авторы наблюдали обратную зависимость общей численности бактериопланктона (ОЧБ) от солености [10, 30, 32]. В ряде работ [10, 24, 28] отмечались скачкообразные изменения величин ОЧБ в различных диапазонах солености. В работе [9] обнаружена положительная корреляция между ОЧБ и содержанием в воде кремния, органического азота, кислорода и температурой воды; отрицательная – с соленостью воды, концентрацией фосфатов и нитратов, содержанием хлорофилла “а” (хл “а”).
В данной работе мы рассмотрели количественные и функциональные характеристики бактериопланктона трех районов арктического шельфа, находящихся под влиянием стока рек Хатанги, Индигирки и Колымы. Также были проанализированы гидрохимические показатели, которые могут маркировать активность микропланктона [6], и предпринята попытка выявить возможное влияние гидрофизических характеристик среды и других звеньев трофической сети.
МАТЕРИАЛЫ И МЕТОДЫ
Материал был собран в ходе 69-го рейса НИС “Академик Мстислав Келдыш” [19] с 5 по 20 сентября 2017 г. в море Лаптевых в эстуарии реки Хатанги и Восточно-Сибирском море в эстуариях рек Индигирки и Колымы (рис. 1). Пробы воды отбирали пятилитровыми пластиковыми батометрами комплекса ROSETTE, оснащенного CTD-зондом SBE 911 Plus, регистрировавшим соленость, температуру и давление. Для гидрохимического анализа отбирались пробы на большем количестве горизонтов и станций, чем для оценки характеристик бактериопланктона.
Все гидрохимические анализы проводились в течение 12 ч после отбора. Определения содержания кислорода в морской воде, растворенного неорганического фосфора (фосфаты), нитритного азота (нитриты), нитратного азота (нитраты), аммонийного азота (ион аммония), растворенного кремния проводились в судовой лаборатории стандартными методиками [13, 14, 17].
Общую численность бактерий определяли методом проточной цитометрии [25] в течение суток после отбора окрашивая клетки флуоресцентным красителем SYBR GREEN I. Для более точной оценки численности бактериопланктона и корректного сравнения с данными микроскопии дополнительно измеряли фоновые характеристики фильтрата, прошедшего через ядерный фильтр с диаметром пор 0.2 мкм. Для учета активно дышащих клеток (клетки с активной электрон-транспортной цепью) пробы воды объемом 3.6–4.5 мл экспонировали с раствором СТС (5-циано 2,3-дитолил тетразолиум хлорид, 100 мкг/мл) в течение 4 ч при температуре 4°С [31]. После окончания экспозиции пробы фиксировали нейтральным раствором формальдегида (финальная концентрация 1%), окрашивали флуорохромом DAPI и осаживали на черный ядерный фильтр с диаметром пор 0.2 мкм и замораживали до последующей обработки. Подсчет окрашенных клеток осуществляли при помощи люминесцентной микроскопии (микроскоп Leiсa DM 2500) при увеличении ×1000 на длине волны 450–490 нм для учета СТС-окрашенных клеток и в ультрафиолетовом излучении для подсчета общей численности бактерий, окрашенных DAPI. Бактериальную биомассу в углеродных единицах рассчитывали по объему бактериальных клеток [11] исходя из линейных размеров клеток, измеренных с помощью программы анализа изображений “ImageScopeColor М”.
Для статистического анализа данных использовали программу PAST 3.0. Для корреляционного анализа использовали коэффициент ранговой корреляции Спирмена (p < 0.05). Коэффициенты корреляции рассчитывались для всех проанализированных параметров среды. Визуализация данных осуществлялась в программе Surfer 15.
РЕЗУЛЬТАТЫ
Разрез от устья р. Хатанги. Разрез, выполненный в западной части бассейна моря Лаптевых осенью 2017 г., соединял эстуарий реки Хатанги с областью континентального склона (рис. 1). На основе оценки гидрофизических параметров (температура – рис. 2а, соленость – рис. 2б) выявлено наличие мощного эстуарного фронта с приблизительной широтной протяженностью 30–40 км [18].
Рис. 2.
Распределение температуры (а), солености (б), содержания растворенного кремния (в), растворенного неорганического фосфора (г), нитратного азота (д), нитритного азота (е), аммонийного азота (ж), растворенного кислорода (з) на разрезе от устья р. Хатанги.
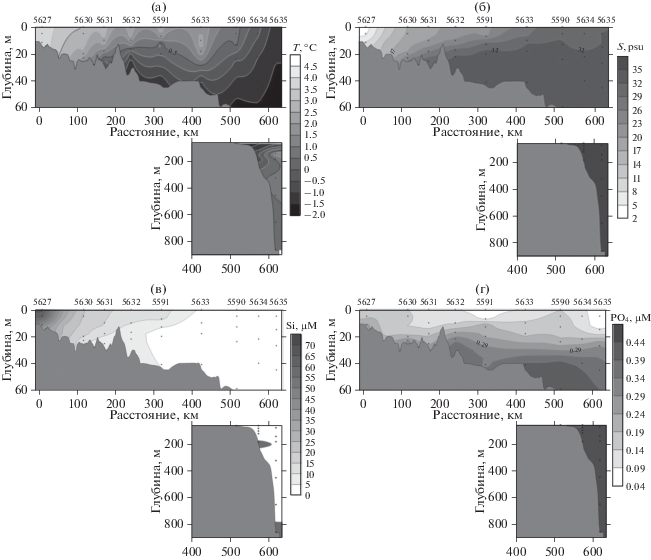
Рис. 2.
Окончание.
В сентябре 2017 г. на разрезе от устья р. Хатанги содержание растворенного кремния варьировало в диапазоне от 0.04 до 68.13 µМ (рис. 2в). Наиболее высокие величины содержания силикатов отмечены на приустьевых станциях (ст. 5627 – от 68.13 µМ на поверхности до 41.34 µМ в придонных водах). Самые низкие величины содержания растворенного кремния (от 0.04 до 1 µМ) наблюдались по всей толще воды севернее 40-метровой изобаты. Содержание растворенного неорганического фосфора на разрезе от устья р. Хатанги варьировалось от 0.04 до 0.65 µМ (рис. 2г). На протяжении всего разреза содержание фосфора возрастало с увеличением глубины. Максимальные значения отмечались в водах ст. 5635, расположенной над континентальным склоном – 0.59 µМ на глубине 320 м с увеличением до 0.65 µМ на 855 м. Минимальные значения были отмечены в верхнем 7-метровом слое станции 5591, севернее которой соленость не опускалась ниже 22 psu, а также на самой северной станции разреза 5635. Содержание нитратного азота изменялось в широком диапазоне от аналитического нуля до 10.95 µМ (рис. 2д). Концентрация нитратного азота возрастала с увеличением глубины, минимальные значения наблюдались в поверхностном 20-метровом слое воды как на приустьевых, так и на морских станциях. Содержание нитритного азота колебалось от аналитического нуля до 0.35 µМ (рис. 2е). Минимальные значения были отмечены в верхнем горизонте северной части разреза (севернее ст. 5591). Заметное возрастание нитратного азота наблюдалось на глубине 40–50 м самой северной станции разреза 5635. Максимум аммонийного азота приходился на воды приустьевых станций (рис. 2ж). Минимальные величины наблюдались в мористой части разреза на поверхностных горизонтах севернее 40-метровой изобаты (станции 5633–5635). В водах разреза отмечалось высокое относительное содержание растворенного кислорода: от 82.6 до 105.2% (рис. 2з). Наибольшее насыщение кислородом отмечено на глубине 15 м станции над континентальным склоном 5635 – 105.2%, наименьшее – на двух самых северных станциях 5634 (82.6% на горизонте 40 м) и 5635 (83.4% на горизонте 140 м).
Значения ОЧБ на разрезе от устья Хатанги в открытые воды моря Лаптевых колебались в широком диапазоне от 83 × 103 до 1.1 × 106 кл/мл; биомасса бактерий имела сходное распределение и варьировала в диапазоне от 0.5 до 7.6 мгС/м3 (табл. 1). Среднее значение ОЧБ на разрезе от устья составляло 470 ± 98 × 103 кл/мл. Величины ОЧБ, превышающие 106 кл/мл наблюдались только в поверхностных водах приустьевой области при значениях солености 3–5 psu. По мере продвижения в открытое море отмечалось постепенное снижение общей численности и биомассы бактериопланктона с увеличением солености. Однако в верхнем 30-метровом самой глубоководной станции разреза 5635 при показателях солености 32–34 psu величины ОЧБ возрастали до более чем 500 × 103 кл/мл, с максимумом 996 × × 103 кл/мл на глубине 15 м. Также в верхнем 75-метровом слое воды над континентальным склоном заметно возрастали показатели биомассы: до 2.7–5.7 мгС/м3 с максимумом на глубине 75 м ст. 5635. На глубинах более 140 м значения биомассы резко уменьшались, не превышая 0.6 мгС/м3. Доля клеток с активной электрон-транспортной цепью не превышала 1.6% при значениях солености более 22 psu, в приустьевых водах определение активной фракции бактериопланктона было затруднено из-за большого количества взвеси. В морфологическом составе бактериопланктона шельфа моря Лаптевых преобладали коккоидные формы (86–93%), палочковидные формы не превышали 10%, вклад остальных групп составлял 1–2%.
Таблица 1.
ОЧБ и биомасса бактериопланктона на разрезе от устья р. Хатанги
| Номер и координаты станции | Глубина, м | ОЧБ, тыс. кл/мл | Биомасса, мгС/м3 |
|---|---|---|---|
| 5627 73.4943 с.ш. 108.1808 в.д. |
0 | 1003 | 7.4 |
| 5 | 1022 | 7.6 | |
| 12 | 760 | 6.5 | |
| 5630 74.2542 с.ш. 110.3401 в.д. |
0 | 887 | 6.6 |
| 5 | 892 | 6.6 | |
| 20 | 801 | 6.9 | |
| 23 | 673 | 5.8 | |
| 5631 74.5831 с.ш. 111.67 в.д. |
0 | 807 | |
| 10 | 899 | ||
| 18 | 640 | ||
| 25 | 311 | ||
| 5632 74.8468 с.ш. 113.8085 в.д. |
0 | 969 | |
| 10 | 884 | ||
| 17 | 301 | ||
| 22 | 241 | ||
| 5591 75.4237 с.ш. 115.4092 в.д. |
0 | 928 | 5.7 |
| 7 | 939 | 5.1 | |
| 13 | 210 | 1.3 | |
| 20 | 156 | ||
| 41 | 246 | 1.4 | |
| 5633 76.3549 с.ш. 114.9411 в.д. |
0 | 246 | |
| 10 | 177 | ||
| 18 | 124 | ||
| 41 | 219 | ||
| 5590 77.1743 с.ш. 114.6749 в.д. |
0 | 248 | |
| 5 | 240 | ||
| 13 | 255 | ||
| 24 | 230 | ||
| 59 | 225 | ||
| 5634 77.6472 с.ш. 115.5372 в.д. |
5 | 396 | |
| 22 | 293 | ||
| 40 | 180 | ||
| 100 | 214 | ||
| 182 | 142 | ||
| 5635 78.0504 с.ш. 115.8881 в.д. |
5 | 534 | 3.4 |
| 15 | 996 | 5.7 | |
| 27 | 526 | 5.1 | |
| 45 | 363 | 2.7 | |
| 75 | 291 | 6.4 | |
| 140 | 109 | 0.6 | |
| 320 | 88 | 0.5 | |
| 855 | 83 | 0.5 |
Наибольшее влияние на распределение бактериопланктона на разрезе от устья р. Хатанги оказывала соленость. Отрицательная корреляция была наиболее выражена между соленостью и биомассой бактерий (R = –0.84), чуть ниже – между соленостью и ОЧБ (R = –0.79). Также слабая отрицательная корреляция наблюдалась между содержанием растворенного неорганического фосфора и численностью бактерий (R = –0.65). Положительная корреляция отмечалась между ОЧБ и хл “а” [3], менее выраженная – между ОЧБ и феофитином (R = 0.65 и R = 0.55 соответственно). Биомасса также положительно коррелировала с хл “а” (R = 0.69) и феофитином (R = 0.65).
Разрез от устья р. Индигирки. В Восточно-Сибирском море температура воды на поверхности устойчиво снижалась с юга на север (рис. 3а), что определялось влиянием речного стока на юге и сходом сезонного льда на севере бассейна. Распределение солености на разрезе от устья р. Индигирки (рис. 3б), прежде всего, наличие поверхностного опресненного слоя на всем его протяжении указывало на мощное воздействие континентального стока [18].
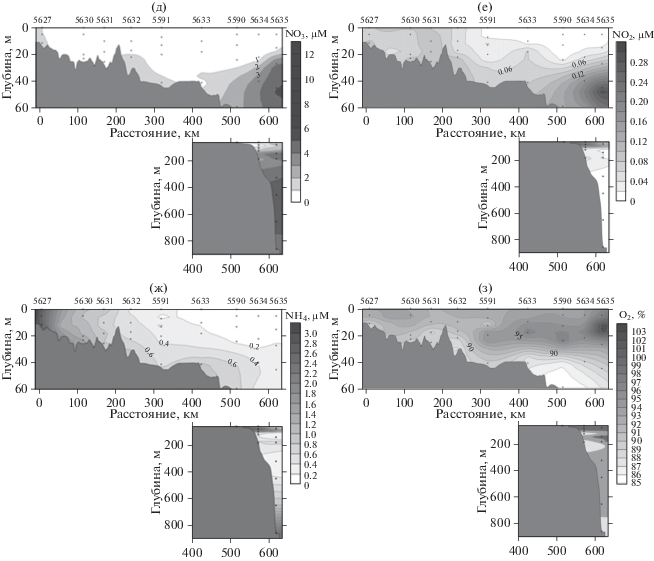
Рис. 3.
Распределение температуры (а), солености (б), содержания растворенного кремния (в), растворенного неорганического фосфора (г), нитратного азота (д), нитритного азота (е), аммонийного азота (ж), растворенного кислорода (з) на разрезе от устья р. Индигирки.
Содержание растворенного кремния в водах вдоль разреза варьировало от 4.9 до 28.6 µМ (рис. 3в). Наиболее высокие величины содержания силикатов приурочены к приустьевым станциям, а также придонным водам морских станций 5607 и 5608. Содержание растворенного неорганического фосфора на разрезе изменялось от 0.31 до 1.28 µМ и имело тенденцию к росту по мере увеличения глубины (рис. 3г). Содержание нитратного азота в верхнем 20-метровом слое было невелико, от аналитического нуля до 0.5 µМ, однако наблюдалось его повышение с глубиной (рис. 3д). Максимальное значение отмечалось на глубине 54 м самой северной станции 5607 – 8.62 µМ. Содержание нитритного азота на разрезе было наименьшим из всех трех форм азота и колебалось от аналитического нуля до 0.33 µМ с минимальными значениями в поверхностных водах и постепенным увеличением этого показателя с глубиной (рис. 3е). Величина аммонийного азота также возрастала с увеличением глубины, диапазон его содержания варьировал от аналитического нуля до 3.34 µМ (рис. 3ж). Средние показатели для столба воды уменьшались по мере отдаления от устья реки. Для всей толщи вод разреза была характерна невысокая степень насыщения кислородом: от 53.4 до 95.6% (рис. 3з). Минимум насыщения кислородом (менее 54%) располагался на горизонте 54 м ближайшей к кромке льда ст. 5607.
ОЧБ на разрезе от реки Индигирки варьировала в пределах 84 × 103–1.6 × 106 кл/мл, существенно различаясь между станциями (табл. 2). Среднее значение ОЧБ составляло 428 ± 133 × 103 кл/мл. Значения, превышающие 106 кл/мл, были обнаружены только на приустьевых станциях. Максимальные значения ОЧБ были приурочены к слою воды под пикноклином ближайшей к устью реки ст. 5598. По мере удаления от устья реки ОЧБ снижалась, достигая минимальных значений (менее 100 × 103 кл/мл) слое воды над пикноклином ст. 5605, на границе солености 29 psu. Показатели биомассы уменьшались с 5.2–30.7 мгС/м3 в водах со значениями солености 15.1–25.1 psu (ближайшие к устью ст. 5598, 5600, 5602) до 0.9–2.6 мгС/м3 при показателях солености более 26 psu, и снова возрастая в среднем для столба воды до 3.7 ± 0.1 мгС/м3 на ближайшей к кромке льда ст. 5607, где величина биомассы в среднем для столба воды составляла 3.7 ± 0.1 мгС/м3 (табл. 2). Наибольшая величина биомассы бактерий была зарегистрирована на глубине 9 м приустьевой ст. 5598. Клеток с активной электрон-транспортной цепью в рассмотренных точках обнаружить не удалось. Исключение составил верхний 30-метровый слой самой северной ст. 5607, где активная фракция бактериопланктона составляла 1.3–3%. Морфологический состав бактериопланктона также мало менялся вдоль разреза, коккоидные формы составляли 90–92%, палочки – в среднем 8%, вклад остальных морфологических групп не превышал 2%.
Таблица 2.
ОЧБ и биомасса бактериопланктона на разрезе от устья р. Индигирки
| Номер и координаты станции | Глубина, м | ОЧБ, тыс. кл/мл | Биомасса, мгС/м3 |
|---|---|---|---|
| 5598 71.4666 с.ш. 152.8998 в.д. |
0 | 614 | |
| 6 | 666 | 14.5 | |
| 9 | 1599 | 30.7 | |
| 11 | 1599 | 5.7 | |
| 5600 72.3199 с.ш. 154.5133 в.д. |
0 | 1328 | |
| 6 | 1328 | 13.8 | |
| 9 | 466 | ||
| 17 | 359 | ||
| 22 | 315 | ||
| 5602 73.2342 с.ш. 156.4292 в.д. |
0 | 883 | 5.2 |
| 16 | 196 | 1.4 | |
| 20 | 226 | 2.3 | |
| 23 | 338 | ||
| 5604 74.0795 с.ш. 158.3475 в.д. |
0 | 232 | 0.9 |
| 5 | 212 | 1.2 | |
| 11 | 231 | 1.4 | |
| 15 | 443 | 2.6 | |
| 21 | 372 | 2.2 | |
| 5605 74.8733 с.ш. 160.1832 в.д. |
0 | 84 | |
| 17 | 94 | ||
| 27 | 115 | ||
| 42 | 358 | ||
| 5606 75.6362 с.ш. 161.9955 в.д. |
0 | 132 | |
| 25 | 149 | 1.3 | |
| 33 | 309 | ||
| 42 | 323 | ||
| 5608 75.7648 с.ш. 162.267 в.д. |
0 | 147 | |
| 26 | 118 | ||
| 33 | 217 | ||
| 45 | 224 | ||
| 5607 76.1649 с.ш. 163.0537 в.д. |
0 | 215 | 3.7 |
| 20 | 295 | 3.8 | |
| 30 | 267 | 3.6 | |
| 46 | 270 | ||
| 54 | 391 | 3.7 |
На разрезе от устья р. Индигирки выраженных закономерностей между распределением бактериопланктона и параметрами среды не обнаружено.
Разрез от устья р. Колымы. Температура на разрезе от устья р. Колымы убывала с увеличением глубины и по мере продвижения на север (рис. 4а). Минимальная соленость отмечалась в поверхностных водах приустьевой станции 5619 и составляла 17 psu (рис. 4б). Максимальная соленость (31.5 psu) зарегистрирована в придонных водах самой северной станции разреза 5612.
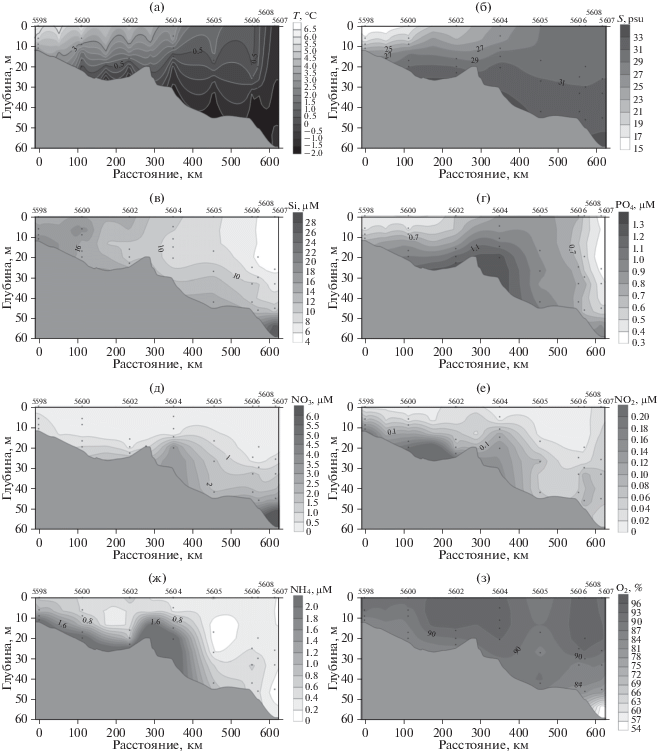
Рис. 4.
Распределение температуры (а), солености (б), содержания растворенного кремния (в), растворенного неорганического фосфора (г), нитратного азота (д), нитритного азота (е), аммонийного азота (ж), растворенного кислорода (з) на разрезе от устья р. Колымы.
Содержание растворенного кремния варьировало от 8 до 30 µМ (рис. 4в). Наибольший показатель данного параметра приходился на поверхностные воды приустьевых станций. Также высокие значения (22.7 µМ) отмечались в придонных водах самой северной исследованной точки. Минимальное содержание растворенного кремния отмечалось в поверхностном слое воды северных станций. Содержание растворенного неорганического фосфора колебалось от 0.44 до 1.38 µМ (рис. 4г). Минимальные величины были отмечены в поверхностных водах ближайшей к устью станции 5619 – 0.44 µМ, максимальные – на глубине 20 м и более двух самых северных станций разреза 5612 и 5613. Диапазон наблюдаемых величин концентрации нитратного азота составлял от аналитического нуля до 3.81 µМ (рис. 4д). Максимальное содержание нитратного азота (3.81 µМ) зафиксировано в придонных водах ст. 5612. На других станциях значения этого параметра были в разы ниже, а в верхнем 20-метровом слое не превышали 0.3 µМ. Содержание нитритного азота колебалось от аналитического нуля до 0.28 µМ (рис. 4е). Его максимум приходился на придонные горизонты станции северной части разреза 5613. Наблюдавшийся диапазон содержания аммонийного азота варьировал от 0 до 1.1 µМ (рис. 4ж). Наибольшие величины обнаружены на глубине 14 м ближайшей к устью р. Колымы станции и в точке нитритного максимума (глубина 28 м ст. 5613). В верхнем 5-метровом слое воды на расстоянии около 150–250 км от начала разреза концентрация аммонийного азота снижалась до аналитического нуля. Величины концентрации ниже разрешающей способности метода наблюдались и на глубинах более 20 м приустьевой ст. 5612. Степень насыщения растворенным кислородом вод разреза от устья р. Колымы составляла 73.1–99.6% (рис. 4з). Максимальные и минимальные значения этого показателя были отмечены на крайней северной станции разреза 5612 (на глубинах 26 и 47 м соответственно). На протяжении всего разреза наблюдалось значительное снижение насыщения кислородом на глубинах более 20 м.
Диапазон изменений величины обилия бактериопланктона на разрезе от устья р. Колымы был существенно меньше, чем на двух других рассмотренных разрезах, значения ОЧБ варьировали от 104 × 103 до 995 × 103 кл/мл (табл. 3), составляя в среднем 439 ± 111 × 103 кл/мл. ОЧБ достигала наибольшей величины в теплых опресненных поверхностных водах самой южной станции разреза и постепенно снижалась по мере продвижения от внутреннего к внешнему шельфу. Величина бактериальной биомассы была максимальной на ближайшей к устью р. Колымы станции, ее значения в столбе воды варьировали от 9.9 до 36 мгС/м3 (табл. 3). Значения биомассы также снижались по мере продвижения к внешнему шельфу, достигая минимальных показателей 0.6–0.9 мгС/м3 в поверхностных водах самой северной станции разреза 5612. Доля клеток с активной электрон-транспортной цепью в приустьевой зоне не превышала 1%, тогда как в мористой части разреза достигала 8%. В морфологическом составе бактериопланктона разреза от устья р. Колымы доминировали коккоидные формы (89–91%), палочковидные формы не превышали 9%, вклад остальных групп не превышал 1%.
Таблица 3.
ОЧБ и биомасса бактериопланктона от устья р. Колымы
| Номер и координаты станции | Глубина, м | ОЧБ, тыс. кл/мл | Биомасса, мгС/м3 |
|---|---|---|---|
| 5619 70.4342 с.ш. 163.0687 в.д. |
0 | 995 | 36.0 |
| 5 | 995 | 16.0 | |
| 8 | 795 | 9.9 | |
| 14 | 528 | 10.3 | |
| 5617 71.362 с.ш. 164.3406 в.д. |
0 | 396 | |
| 5 | 329 | ||
| 13 | 329 | ||
| 19 | 382 | ||
| 5615 72.3471 с.ш. 165.4402 в.д. |
0 | 529 | 2.9 |
| 15 | 496 | ||
| 23 | 496 | 2.4 | |
| 5613 73.3373 с.ш. 166.7887 в.д. |
0 | 168 | 1.0 |
| 15 | 221 | 1.5 | |
| 20 | 484 | 2.8 | |
| 28 | 484 | 2.9 | |
| 5612 74.3831 с.ш. 168.1917 в.д. |
0 | 104 | 0.6 |
| 20 | 133 | 0.8 | |
| 26 | 148 | 0.9 | |
| 35 | 377 | 2.3 | |
| 47 | 397 | 2.4 |
На разрезе от устья р. Колымы не наблюдалось связи между распределением обилия бактерий и соленостью. Отмечалась тесная положительная корреляция, между биомассой бактерий и хл “а” [2], между ОЧБ и хл “а” (R = 0.91 и R = 0.80 соответственно). Также заметно выражена корреляция биомассы и численности бактерий с феофитином (R = 0.82 и R = 0.76 соответственно).
ОБСУЖДЕНИЕ
Гидрохимия. Гидрохимические показатели вод исследованных районов моря Лаптевых и Восточно-Сибирского моря соответствовали концу осеннего–началу зимнего сезона [1]. Низкие показатели содержания нитратного азота и насыщения кислородом отмечались в водах всех трех разрезов. Почти нулевое содержание нитратов указывает на то, что усиление процессов деструкции началось относительно недавно [1]. На разрезе от устья р. Хатанги влияние материкового стока прослеживалось на значительном расстоянии от источника, затрагивая как поверхностный, так и придонный слои. Воды, поступающие из р. Хатанги были бедны минеральным фосфором, но содержали большое количество растворенного кремния. На большей части акватории шельфа Восточно-Сибирского моря прослеживалось слияние материковых вод. В водах разрезов от устья рек Индигирки и Колымы наблюдалось высокое содержание фосфатов и растворенного кремния. Содержание минерального фосфора в водах разреза от устья р. Колымы несколько выше, чем в водах соседнего разреза от устья р. Индигирки. При этом в случае обоих разрезов содержание фосфатов на приустьевых станциях было ниже, чем в мористых водах разрезов.
Бактериопланктон. Количественные характеристики бактериопланктона на трех исследованных нами разрезах были относительно невелики и соответствовали концу осеннего–началу зимнего сезона [9, 16, 30, 32].
В пространственном распределении бактериопланктона на разрезе от устья р. Хатанги отмечалось постепенное снижение величин ОЧБ и биомассы бактерий по мере продвижения в открытое море. Однако в верхнем 30-метровом слое воды самой глубоководной станции (глубина 855 м) наблюдалось заметное увеличение как ОЧБ, так и биомассы бактериопланктона. ОЧБ, остававшаяся в диапазоне 124–396 × 103 кл/мл на мористых станциях возрастала до 526–996 × 103 кл/мл в верхнем 30-метровом слое воды над континентальным склоном, величины биомассы, не превышавшие 1.5 мгС/м3, увеличивались до 3.4–5.7 мгС/м3. Подобный рост численности и биомассы может быть связан с влиянием “склонового эффекта” [21, 33]. На разрезах от устья р. Индигирки и Колымы количество бактериопланктона также уменьшалось по мере продвижения от внутреннего шельфа к внешнему. Но в отличие от разреза в море Лаптевых, максимальные значения ОЧБ на разрезе от устья р. Индигирки были приурочены к придонным горизонтам приустьевой станции. В северной части разреза, где показатели солености не опускались ниже 25.6 psu (станции 5604–5607), было характерно увеличение ОЧБ с глубиной. Численность бактериопланктона на разрезе от устья р. Колымы не превышала 106 кл/мл. Характер вертикального распределения численности и биомассы бактериопланктона на станциях данного разреза различался. На двух северных морских станциях ОЧБ и биомасса бактерий возрастали в придонных водах. На двух станциях в середине разреза распределение в толще воды было относительно равномерным, а на приустьевой станции численность и биомасса бактериопланктона уменьшались по мере увеличения глубины.
К настоящему времени работ по бактериопланктону районов моря Лаптевых, подверженных влиянию речного стока, не так много [4, 30, 32]. Опубликованных данных по бактериопланктону шельфовой части Восточно-Сибирского моря нам найти не удалось.
В сентябре 1989 и 1991 гг. в восточной части шельфа моря Лаптевых на разрезе от устья р. Лена и Яна при значениях солености более 13 psu сырая биомасса бактериопланктона варьировала в диапазоне 60–126 мг/м3 [30, 32]. За пределами влияния речного стока (соленость более 29.9 psu) численность и биомасса бактериопланктона была в 5–10 раз меньше, чем в эстуарных водах: 0.2–0.4 × 106 кл/мл и 13–21 мг/м3 [32]. В более поздних исследованиях [4] величины численности и биомассы бактерий были близки к полученным нами результатам и в среднем для столба воды составляли в Усть-Оленекском районе 371 ± 33 × 103 кл/мл и 6.76 ± 0.96 мг C/м3, в Усть-Ленском – 419 ± 46 × × 103 кл/мл и 6.40 ± 1.87 мг C/м3.
Согласно результатам исследования, проведенного в августе-сентябре 2001 г. в эстуарной области и на шельфе Карского моря [28], численность бактерий была высокой как в реках (соленость 0 psu), так и в эстуариях (5–15 psu), составляя в среднем 1.51 × 106 и 1.93 × 106 кл/мл соответственно. В открытых районах Карского моря (соленость >20 psu) численность бактерий в поверхностных слоях водной толщи не превышала количества 0.5 × 106 кл/мл. В августе–сентябре 2007 и 2011 гг. в области эстуариев рек Оби и Енисея и прилежащего к ним шельфа основным фактором, определяющим свойства биотопа, являлась соленость [10].
В сентябре 2011 г. было проведено сравнение бактериопланктона биотопов эстуария р. Енисей и шельфа в области Обь-Енисейского речного выноса. Была отмечена отрицательная корреляция между ОЧБ и соленостью воды (R = –0.83) [9]. Самые тесные положительные корреляционные связи ОЧБ обнаружены с температурой воды (R = 0.83) и содержанием в ней кремния (R = 0.66), менее тесные – с содержаниями в воде органического азота (R = 0.48) и кислорода (R = 0.43). Также для концентрации некоторых биогенных элементов наблюдались отрицательные корреляции с ОЧБ: R = –0.61 для фосфатов и R = –0.48 для нитратов.
В Канадском секторе Арктики в пределах плюма реки Маккензи в июне–июле 2004 г. средняя ОЧБ составила 880 × 103 кл/мл, с наибольшим показателем численности 1.4 × 106 кл/мл в устье реки (соленость 0.1 psu). С увеличением солености от 0.1 до 14.8 psu ОЧБ постепенно падала до 570 × 103 кл/мл, затем возрастала до 1.2 × 106 кл/мл (соленость 24–25.5 psu), и при солености более 27 psu снова падала до 610 × 103 кл/мл [24].
В нашей работе было отмечено снижение обилия бактериопланктона по мере увеличения солености 3.5 до 34.7 psu на разрезе от устья р. Хатанги. На шельфе Восточно-Сибирского моря закономерностей между распределением солености и количественных характеристик бактериопланктона обнаружить не удалось. Выраженных закономерностей между распределением бактериопланктона и температурой не отмечалось на всех трех разрезах.
В июне–июле 2007 г. в Гренландском море отмечалась положительная корреляция ОЧБ с температурой и соленостью воды [29]. В сентябре того же года в Карском море средние показатели обилия бактерий для морской (с соленостью более 8‰) и опресненной (с соленостью менее 5‰) воды различались не сильно, что может свидетельствовать о второстепенном влиянии фактора солености на развитие бактериопланктона [16].
Нами были обнаружены положительные корреляции между показателями обилия бактерий и содержанием фитопигментов [2, 3] на разрезах от устья р. Хатанги и Колымы. В августе–сентябре 2001 г. в поверхностных горизонтах вод Обской губы также отмечалась положительная корреляция (r = 0.78) между концентрацией хл “а” и бактериальной продукцией [28]. Данные, полученные в сентябре 2007 г., демонстрируют достаточно слабую зависимость (r = 0.55) между указанными параметрами [16].
Доля бактерий с активной ЭТЦ крайне низка, как в море Лаптевых, так и в Восточно-Сибирском море. Следует, однако, учитывать, что этот параметр является показателем именно активных, а не просто жизнеспособных клеток и, следовательно, обнаруженное количество клеток не отражает потенциальную способность перехода микробного сообщества к активному метаболизму при изменении условий существования [12].
Осенью 2011 г. в области Обь-Енисейского речного выноса [9] доля бактерий с активной ЭТЦ варьировала в намного более широком диапазоне, чем в нашем исследовании. Значимые положительные корреляции были обнаружены с содержанием в воде хл “а” (R = 0.66), температурой воды (R = 0.74), менее выраженная – с содержанием в воде органического азота (R = 0.54). Значимая отрицательная корреляция процента активно-дышащих бактерий обнаружена только с соленостью воды (R = –0.77), слабо выраженная – с содержанием в ней фосфатов (R = –0.47).
ЗАКЛЮЧЕНИЕ
В сентябре 2017 г. гидрохимическая обстановка исследованных районов шельфа моря Лаптевых и Восточно-Сибирского моря соответствовала концу осеннего–началу зимнего периода. Количественные и функциональные характеристики бактериопланктона всех исследованных областей были схожи с результатами полученными в аналогичный сезон в зоне шельфа морей Карского и Лаптевых. Максимальные величины численности и биомассы бактериопланктона были приурочены к приустьевым зонам эстуарных районов и кромке шельфа. Соленость, согласно литературным данным оказывающая определяющее влияние на распределение бактериопланктона в эстуарных районах Арктических морей, коррелировала с численностью и биомассой бактерий только на шельфе моря Лаптевых. В водах двух разрезов в Восточно-Сибирском море достоверных корреляций между соленостью и количественными характеристиками бактериопланктона обнаружено не было. Среди гидрохимических параметров достоверная корреляция обнаружена только между неорганическим фосфором и ОЧБ на разрезе от устья р. Хатанги. На разрезах от устья р. Колымы и Хатанги отмечались достоверные положительные корреляции хл “а” и феофитина с ОЧБ и биомассой бактериопланктона.
Источник финансирования. Работа выполнена при поддержке гранта РНФ № 17-77-10 138. Работа выполнена в рамках государственного задания № 0128-2019-0011.
Список литературы
Алекин О.А., Ляхин Ю.И. Химия океана. Л.: Гидрометеоиздат, 1984. 344 с.
Демидов А.Б., Гагарин В.И. Первичная продукция и условия ее формирования в Восточно-Сибирском море в осенний период // Докл. РАН. 2019. Т. 487. № 6. С. 696–700.
Демидов А.Б., Гагарин В.И., Арашкевич Е.Г. и др. Пространственная изменчивость первичной продукции и хлорофилла в море Лаптевых в августе-сентябре 2015, 2017 и 2018 гг. // Океанология. 2019. Т. 59. № 5. С. 755–770.
Копылов А.И., Сажин А.Ф., Заботкина Е.А. Вирусы, бактерии и гетеротрофные нанофлагелляты в планктоне моря Лаптевых // Океанология. 2016. Т. 56. № 6. С. 869–878.
Кособокова К.Н. Зоопланктон Арктического бассейна. Структура сообществ, экология, закономерности распределения. М.: ГЕОС, 2012. 272 с.
Лапин С.А. Пространственно-временная изменчивость гидролого-гидрохимических характеристик Обской губы как основа оценки ее биопродуктивности – диссертация на соискание ученой степени кандидата географических наук. М.: Изд-во МГУ, 2012.
Маккавеев П.Н., Полухин А.А., Селиверстова А.М. и др. Динамика биогенных элементов в приустьевом районе реке Лены: результаты экспедиций в сентябре 2015 и 2017 гг. // Арктика: экология и экономика. 2018. № 2 (30). С. 56–67.
Михайлов В.Н. Устья рек России и сопредельных стран: прошлое, настоящее и будущее. М.: 1997. 413 с.
Мошарова И.В., Ильинский В.В., Мошаров С.А. Состояние гетеротрофного бактериопланктона эстуария реки Енисей и зоны Обь-Енисейского речного выноса в осенний период в связи с факторами окружающей среды // Водные ресурсы. 2016. Т. 43. № 2. С. 202–215.
Романова Н.Д., Сажин А.Ф. Бактериопланктон шельфовой части Карского моря // Океанология. 2015. Т. 55. № 6. С. 949–954.
Романова Н.Д., Сажин А.Ф. Взаимосвязь между объемом бактериальных клеток и содержанием в них углерода // Океанология. 2010. Т. 50. № 4. С. 556−565.
Романова Н.Д., Сажин А.Ф. Методологические аспекты определения численности, биомассы и продукции бактериопланктона // Океанология. 2011 Т. 51. № 3. С. 550–560
Руководство по химическому анализу морских вод. РД 52.10.242-92. СПб.: Гидрометеоиздат, 1993. 264 с.
Руководство по химическому анализу морских и пресных вод при экологическом мониторинге рыбохозяйственных водоемов и перспективных для промысла районов Мирового океана / Ред. Сапожников В.В. М.: Изд-во ВНИРО, 2003. 202 с.
Саввичев А.С., Захарова Е.Е., Веслополова Е.Ф. Микробные процессы циклов углерода и серы в Карском море // Океанология. 2011. Т. 50. № 6. С. 942–957.
Сажин А.Ф., Романова Н.Д., Мошаров С.А. Бактериальная и первичная продукция в водах Карского моря // Океанология. 2010. Т. 50. № 5. С. 801–808.
Современные методы гидрохимических исследований океана / Ред. Бордовский О.К., Иваненков В.Н. М.: ИО РАН, 1992. 200 с.
Флинт М.В., Арашкевич Е.Г., Артемьев В.А. и др. Экосистемы морей Сибирской Арктики. Материалы экспедиционных исследований 2015 и 2017 гг. М.: ИО РАН, 2018. 232 с.
Флинт М.В., Поярков С.Г., Римский-Корсаков Н.А. Экосистемы морей Сибирской Арктики – 2017 (69-й рейс научно-исследовательского судна. “Академик Мстислав Келдыш”) // Океанология. 2018. Т. 58. № 2. С. 331–333.
Aagaard K., Carmack E.C. The role of sea ice and other fresh water in the Arctic circulation // J. of Geoph. Res. 1989. V. 94. P. 14485–14498.
Bluhm B., Kosobokova K.N., Carmack E. A tale of two basins: An integrated physical and biological perspective of the deep Arctic Ocean // Progress in Oceanography. 2015. V. 139. P. 89–121.
Cole J.J., Findley S., Pace M.L. Bacterial Production in Fresh and Saltwater Ecosystems // Mar. Ecol. Prog. Ser. 1988. V. 43. P. 1–10.
Fenchel T. The Microbial Loop – 25 Years Later // J. of Experimental Marine Biology and Ecology. 2008. V. 366. № 1. P. 99–103.
Garneau M.E., Vincent W.F., Terrado R et al. Importance of particle-associated bacterial heterotrophy in a coastal Arctic ecosystem // J. Mar. Syst. 2009. V. 75. P. 185–197.
Kamia E., Izumiyama S., Nishimura M. et al. Effects of fixation and storage on flow cytometric analysis of marine bacteria // J. Oceanology. 2007. V. 63. P. 101–112.
Kirchman D.L., Malmstrom R.R., Cottrell M.T. Control of Bacterial Growth by Temperature and Organic Matter in the Western Arctic // Deep-Sea Res. Part II: Topical Studies in Oceanography. 2005. V. 52. № 24. P. 3386–95.
McClelland J.W., Holmes R.M., Dunton K.H. et al. The Arctic Ocean Estuary // Estuaries and Coasts. 2011. V. 35. P. 353–368.
Meon B., Amon R.M.W. Heterotrophic bacterial activity and fluxes of dissolved free amino acids and glucose in the Arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquatic Microbial Ecology. 2004. V. 37. P. 121–135.
Sala M.M., Arrieta J.M., Boras J.A. et al. The impact of ice melting on bacterioplankton in the Arctic Ocean // Polar biology. 2010. V. 33. № 12. P. 1683–1694.
Saliot A., Cauwet G., Cahet G. et al. Microbial activities in the Lena River delta and Laptev Sea // Mar. Chem. 1996. V. 53. P. 247–254.
Sherr B., Sherr E., del Giorgio P. Enumeration of Total and Highly Active Bacteria // Methods in Microbiology. 2001. V. 30. P. 129–160.
Sorokin Yu.I., Sorokin P.Yu. Plankton and Primary Production in the Lena River Estuary and in the South-eastern Laptev Sea // Estuarine, Coastal and Shelf Science. 1996. V. 43. P. 399–418.
Springer A.M., Mcroy C.P., Flint M.V. The Bering Sea Green Belt: Shelf-edge processes and ecosystem production // Fisheries Oceanography. 1996. V. 5. P. 205–223.
Дополнительные материалы отсутствуют.



