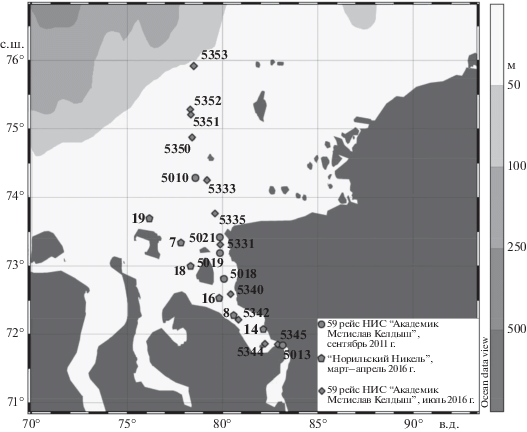
Океанология, 2020, T. 60, № 1, стр. 87-96
Сезонная изменчивость бактериопланктона эстуария р. Енисей
Н. Д. Романова 1, *, М. А. Болтенкова 2
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Мурманский морской биологический институт
Кольского научного центра РАН
Мурманск, Россия
* E-mail: Romanova-Nadya@yandex.ru
Поступила в редакцию 29.04.2019
После доработки 30.05.2019
Принята к публикации 18.06.2019
Аннотация
На основании материалов, собранных в разные сезоны в области эстуария Енисея, а также литературных данных предпринята попытка оценить масштабы и характер сезонной изменчивости микробных сообществ. Во все наблюдаемые сезоны можно говорить о существовании в области эстуария трех выделенных по солености зон, обилие и активность бактериопланктона в которых могут различаться на порядок. В водах соленостью менее 2.5 psu средние величины численности составляли 254, 2741 ± 394 и 2069 ± 185 тыс. кл/мл весной, летом и осенью соответственно. При солености более 18 psu обилие бактерий в те же сезоны составляло соответственно 196 ± 50, 683 ± 184 и 125 ± 24 тыс. кл/мл. Сходные изменения наблюдались и в распределении биомассы. Продукционные показатели характеризовались неравномерным распределением, максимальные величины наблюдались в летний период. Распределение обилия внутри выделенных по показателям солености зон обусловлено скорее мелкомасштабной пятнистостью, прослеженной по распределению органического вещества, фитопланктона и взвеси. Вклад гетеротрофной компоненты микробного сообщества является основным в ранневесенний период. Несмотря на отмеченные корреляции в распределении показателей обилия и активности бактерий, фитопланктона и органического углерода, картина их распределения вдоль градиента солености различалась.
ВВЕДЕНИЕ
Несмотря на возрастающий интерес к микробным ценозам арктических морей в связи с климатическими изменениями и активным освоением шельфа, до сих пор нет общих представлений о динамике развития микроорганизмов и факторах, на них влияющих. Тем не менее, в условиях ярко выраженной сезонности, продолжительной полярной ночи и крайне ограниченного как во времени, так и в пространстве “цветения” фитопланктона, характерных для морей Сибирской Арктики, микробная петля [18] и бактериопланктон в частности становится важнейшим элементом пелагического сообщества. Одной из областей высокой активности арктических микробных сообществ являются эстуарные районы. В Арктический регион ежегодно поступает около 11% мирового речного стока, тогда как его объем составляет всего 1% объема Мирового океана [20]. В Карское море ежегодно поступает 1300–1400 км3 пресной воды в год, что составляет 41% всего пресноводного стока в Арктику [7]. При этом на долю Обской губы и Енисея приходится 82% [32], а средний объем стока Енисея составляет 630 км3 в год [31]. Таким образом, процессы, происходящие в зоне смешения на границе река–море, влияют не только на прибрежные экосистемы, но и на весь Арктический бассейн [28]. Речной сток сибирских рек и, в частности, Енисея, имеет ярко выраженную сезонность. В период с мая по июнь его течение выносит в море около 284 км3 воды, что составляет 45% суммарного годового стока реки и отражается на объеме поступающего в эстуарную область органического вещества, а также биогенных элементов [22].
Бактериопланктон играет важнейшую роль в реминерализации биогенных элементов и трансформации органического вещества даже в условиях низких температур [16, 25]. Активность микропланктона – один из ключевых механизмов, определяющих состав и количество вещества, попадающего в море или оседающего в области маргинального фильтра [6]. Несмотря на это, данных о закономерностях распределения микроорганизмов в зоне смешения река-море, сезонной динамике их развития, влиянии на них абиотических факторов и других компонентов планктонного сообщества для морей Сибирской Арктики не так много [3, 11, 14, 29, 34 и др.]. В данной работе сделана попытка оценить масштабы и характер сезонной изменчивости микробных сообществ в эстуарной зоне р. Енисей на основании собственных экспедиционных результатов и литературных данных.
МАТЕРИАЛЫ И МЕТОДЫ
Материал был собран в ходе трех рейсов: 59-го рейса НИС “Академик Мстислав Келдыш” 17–22 сентября 2011 г., рейса судна ледокольного класса “Норильский Никель” 29 марта–04 апреля 2016 г., и 66-го рейса НИС “Академик Мстислав Келдыш” 25–28 июля 2016 г. (рис. 1). Пробы воды отбирали батометрами с горизонтов, выбранных на основании гидрофизического профиля (SBE 911 Plus by SeaBird Electronics, USA) или из поверхностного слоя воды (март–апрель 2016 г.).
Количественный учет бактериопланктона. Для учета общей численности бактерий и расчета биомассы бактериопланктона пробы воды фиксировали непосредственно после отбора нейтральным раствором формальдегида (конечная концентрация в пробе 1%) и хранили до последующей обработки. Осенью 2011 г. и весной 2016 г. численность бактериопланктона определяли с помощью флуоресцентной микроскопии (Leica DM 5000B), окрашивая пробы флуорохромом DAPI на черных ядерных фильтрах с диаметром пор 0.17 мкм [33] не ранее трех месяцев после отбора [38]. Летом 2016 г. численность бактериопланктона определяли с помощью проточной цитометрии. Пробы окрашивали флуоресцентным красителем SYBR GREEN I в течение 15 мин и просматривали на цитометре BD Accuri C6 в течение суток после отбора [24]. Для более точной оценки численности бактериопланктона одновременно просчитывали фильтрат, проходящий через фильтр с диаметром пор 0.17 мкм. На основании результатов цитометрии рассчитывали соотношение клеток с высоким и низким содержанием нуклеиновых кислот – показатель, предположительно отражающий долю активных клеток [27]. Линейные размеры клеток измеряли с помощью программы анализа изображений “ImageScopeColor М”. Бактериальную биомассу в углеродных единицах вычисляли по [12].
Продукция бактериопланктона. Определение бактериальной продукции и величины выедания бактериопланктона потребителями проводили прямым методом с использованием антибиотиков-ингибиторов бактериального роста [35] в модификации для естественных местообитаний [39]. Непосредственно после отбора пробы воды разливали в 100-мл флаконы. Для учета выедания бактериопланктона нано- и микрофагами в пробы воды добавляли антибиотики (бензилпенициллин 1 мг/л, ванкомицин 200 мг/л), подавляющие размножение бактерий, но не оказывающие влияние на их потребителей [35]. В качестве контроля экспонировали пробы без антибиотиков. Подготовленные таким образом пробы экспонировали 8–10 ч при температуре поверхностной воды. Время экспозиции было выбрано на основании предварительно поставленного эксперимента по динамике действия антибиотиков в полярных водах. Все эксперименты были выполнены в двух повторностях. Для выявления корреляций между характеристиками сообществ рассчитывали коэффициент ранговой корреляции Спирмена. Для выделения факторов, влияющих на параметры микробного сообщества, использовали пошаговый множественный регрессионный анализ методом прямого последовательного отбора значимых переменных (p < 0.05). В дальнейшем тексте для обозначения коэффициента парной корреляции мы использовали r, а множественной – R. Расчеты проводили с помощью пакета программ PAST 3.14 и STATISTICA 6.0.
РЕЗУЛЬТАТЫ
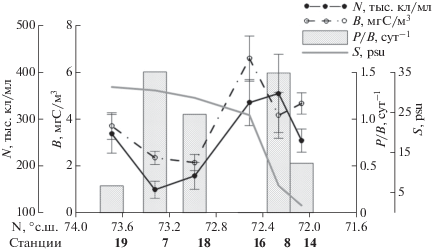
На разрезе вдоль эстуария Енисея ранней весной 2016 г. обилие бактериопланктона поверхностного слоя воды изменялось в пределах 149 до 354 тыс. кл/мл, составляя в среднем 196 ± ± 50 тыс. кл/мл в мористой части (при солености более 25 psu) и 314 ± 60 в водах с соленостью менее 18 psu (рис. 2). При этом на каждом из этих участков направленного изменения обилия вдоль градиента солености не наблюдалось: величины общей численности бактерий колебались в пределах 149–268 тыс. кл/мл при значениях солености более 25 psu, и 254–354 тыс. кл/мл при снижении этого показателя. Средние значения биомассы бактериопланктона также различались для выделенных участков почти в два раза: 2.7 ± ± 0.68 мгС/м3 и 5.13 ± 1.44 мгС/м3 для мористой и речной части разреза соответственно. Величины удельной продукции бактериопланктона на разрезе варьировали более чем в 5 раз, среднее значение этого показателя было достаточно высоким по сравнению с данными других сезонов: 0.79 ± 0.43 сут–1. При этом в области максимального градиента солености продукция бактериопланктона была близка к нулю на фоне относительно высокой общей численности бактериопланктона.
Рис. 2.
Распределение обилия бактериопланктона (N – общая численность, тыс. кл/мл, В – биомасса, мгС/м3) и величины удельной продукции (P/B, сут–1) на разрезе вдоль эстуария Енисея, март–апрель 2016 г.
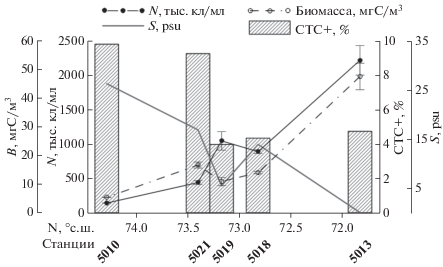
Летом 2016 г. обилие бактериопланктона в поверхностном слое воды варьировало от 3.1 млн кл/мл в устье Енисея до 214 тыс. кл/мл в мористой части разреза (рис. 3). Распределение численности бактериопланктона в поверхностном слое воды коррелировало с концентрацией хлорофилла (r = 0.8, р < 0.05), однако не совпадало с границами распространения комплексов видов фитопланктона или изменением его обилия [15]. Максимальные и минимальные значения численности бактерий наблюдались в поверхностном слое воды. Обилие бактериопланктона (за исключением придонного слоя воды) коррелировало с распределением солености на разрезе (r = –0.84, р < 0.05), при этом изменение показателей обилия было дискретно, средние величины общей численности бактериопланктона составляли 2741 ± 394, 1805 ± 333 и 683 ± 184 тыс. кл/мл в интервалах значений солености меньше 1.5, от 2.5 до 15 и более 18 psu соответственно.
Рис. 3.
Распределение обилия бактериопланктона (N – общая численность, тыс. кл/мл, В – биомасса, мгС/м3) и величины удельной продукции (P/B, сут–1) на разрезе вдоль эстуария Енисея, июль 2016 г.

Отдельного внимания заслуживает слой придонной соленой воды южнее ст. 5333, заходящий вглубь эстуария Енисея. Численность бактериопланктона в нем варьировала в небольших пределах (1025–1211 тыс. кл/мл), составляя в среднем 1152 ± 104 тыс. кл/мл при величинах солености более 21 psu. Принимая во внимание довольно низкое относительное содержание растворенного кислорода в этом слое воды (73 ± 2%), можно предположить, что в указанных водах происходит активная трансформация принесенного речным стоком органического вещества.
Обилие бактериопланктона в придонной воде на ст. 5333 и мористее не превышало 416 тыс. кл/мл и снижалось по направлению к краю шельфа, составляя в среднем 333 ± 73 тыс. кл/мл. Средняя величина насыщение воды кислородом была 83 ± 4%.
Доля клеток с высоким содержанием нуклеиновых кислот варьировала от 17 до 83% общей численности бактерий. Минимальные значения этого параметра наблюдались в распресненных водах, тогда как максимальные – на северных шельфовых станциях разреза при значениях солености больше 30 psu. В поверхностном слое воды доля клеток с высоким содержанием нуклеиновых кислот снижалась по мере увеличения концентрации феофетина (r = –0.65, р < 0.05).
Величина биомассы бактериопланктона в поверхностном слое на разрезе вдоль эстуария Енисея менялась от 1.56 до 18.25 мгС/м3. Наибольшие и наименьшие величины биомассы бактериопланктона на разрезе вдоль эстуария Енисея наблюдались в поверхностном слое. При анализе распределения биомассы бактериопланктона во всей толще воды разница для средних величин в разных диапазонах солености не имела достоверных различий, составляя 5.26, 9.56 ± 2.91 и 4.32 ± ± 1.51 мгС/м3 для вод с соленостью менее 1.5, от 2.5 до 15 и более 18 psu соответственно. В придонном слое соленой воды биомасса бактериопланктона составляла 5.61 ± 2.87 и 2.12 ± 0.37 мгС/м3 южнее и севернее ст. 5333 соответственно.
Значения удельной продукции бактериопланктона варьировали в широком диапазоне: от величин ниже разрешающей способности метода до 11.7 сут–1. Общих закономерностей в ее распределении вдоль разреза выявлено не было. Однако на самой южной станции разреза, этот показатель снижался с глубиной (с 11.7 до 1.1 сут–1), тогда как на мористых станциях наблюдалась обратная картина. Величина удельной продукции возрастала с 1 сут–1 в поверхностном слое воды до 3.2 сут–1 в придонном.
Значения обилия бактериопланктона поверхностного слоя воды, наблюдавшиеся осенью 2011 г. также снижались с 2.2 млн кл/мл в реке до 143 тыс. кл/мл в шельфовой части эстуарной области Енисея (рис. 4).
Рис. 4.
Распределение обилия бактериопланктона (N – общая численность, тыс. кл/мл, В – биомасса, мгС/м3) и доли активнодышащих клеток (СТС+, %; по данным [9]) на разрезе вдоль эстуария Енисея, сентябрь 2016 г.
Величины обилия бактериопланктона на разрезе менялись на порядок в зависимости от солености. Так, на самой южной станции разреза при солености менее 1 psu этот показатель составлял 2069 ± 185 тыс. кл/мл, а при величинах более 26 psu средние показатели обилия снижались до 125 ± 24 тыс. кл/мл. При значениях солености от 5 до 17 psu численность бактерий снижалась с 1045 до 440 тыс. кл/мл. Сходное распределение наблюдалось и в величинах биомассы. На южной станции разреза (соленость менее 1 psu) этот показатель снижался с глубиной с 47.5 до 23.6 мгС/м3, при увеличении солености с 5 до 17 psu его вел-ичина, в отличие от показателей численности, оставалась стабильной, составляя в среднем 13.9 ± 3.2 мгС/м3. При значениях солености более 26 psu среднее значение биомассы составляло 4.8 ± 1 мгС/м3. Максимальные величины продукции были отмечены на южной речной станции разреза (соленость менее 0.1 psu). Значения удельной продукции мало различались на разных глубинах (1.89–2.18 сут–1). На большинстве точек севернее этот показатель снижался ниже разрешающей способности метода и не превышал 0.45 сут–1.
ОБСУЖДЕНИЕ
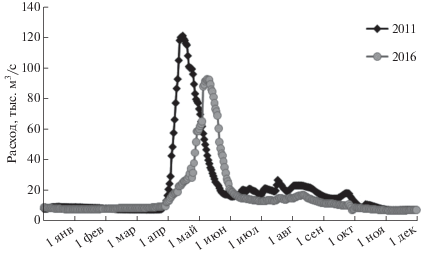
Как видно из годового графика речного стока [21] (рис. 5), периоды отбора проб пришлись на время до половодья, сразу после него, а также на осенний период, характеризующийся довольно малым объемом стока пресной воды. Анализ количественных изменений бактериопланктона в поверхностном слое позволяет заключить, что основные сезонные различия приходятся на распресненную часть эстуарной области. Летом численность бактерий в распресненной части (соленость менее 15 psu) возросла по сравнению с весенними величинами почти на порядок, тогда как в мористой части значения численности бактериопланктона во все три сезона оставались примерно на том же уровне.
Анализируя данные по распределению обилия и активности бактериопланктона, исходя из условно выделенных интервалов солености, важно учитывать, что воды разной солености приурочены к различным глубинам. Тем не менее, и в летний, и в осенний сезоны условно выделенные распресненные и морские воды на разных станциях разреза составляли как верхний фотический, так и слой под пикноклином, а величины обилия бактериопланктона имели близкие значения независимо от глубины.
Весной 2016 г. зона двукратного снижения численности бактериопланктона, совпадала с областью увеличения вклада автотрофных организмов в состав фитопланктона [30]. В условно “речной” части (2.6–14.8 psu) вклад автотрофного фитопланктона составлял всего 23%, тогда как в приустьевой (27–31 psu) его среднее значение составляло 51% [30]. Это может служить подтверждением активного вовлечения “микробной петли” в функционирование планктонного сообщества эстуарной области ранней весной.
Летом 2016 г. численность бактериопланктона снижалась с глубиной, увеличением солености и снижением относительного содержания растворенного кислорода (R2 = 0.88, p < 0.05). Доля клеток с высоким содержанием нуклеиновых кислот, напротив, возрастала с глубиной, соленостью и увеличением концентрации растворенного кислорода (R2 = 0.52, p < 0.05). Закономерностей распределения продукции бактериопланктона обнаружено не было.
Осенью 2011 г. по данным [9] доля бактерий с активной электрон транспортной цепью варьировала от 1.8 до 78.4% численности бактериопланктона. В устье Енисея этот показатель в среднем составлял 17.4% обилия бактерий, тогда как над шельфом, на фоне низких абсолютных значений обилия бактериопланктона, возрастал до 36%. Средняя доля условно жизнеспособных клеток (клетки с неповрежденной мембраной) составляла на разрезе 89.5% общей численности, минимальный их вклад в численность бактериопланктона (71.8–88.9%) был отмечен в устье Енисея [9]. Несмотря на небольшое количество точек для анализа, можно говорить о сходной картине распределения биомассы бактериопланктона и температуры воды (r = 0.63, р < 0.05) в водах соленостью более 5 psu, а также снижении доли активно дышащих клеток при увеличении доли феофитина (r = –0.65, р < 0.05).
Данные весны 2016 г. [26] показывают, что число бактериальных клеток с прикрепленными вирусными частицами варьировало от 27 до 110 тыс. кл/мл, их доля в общей численности бактерий изменялась от 14.4% в речной части разреза до 24.3% в эстуарной а на крайней морской станции разреза резко снижалась до 7.6%. Вирус-индуцированная смертность бактериопланктона составляла от 2 до 18% продукции бактерий.
В конце вегетационного сезона максимальное число клеток с прикрепленными вирусными частицами (293–331 тыс. кл/мл) наблюдалось в устье Енисея, у области эстуария этот показатель снижался до 11–139 тыс. кл/мл [5]. Однако разница в их доле от общей численности бактерий была не так ярко выражена: 13.2–16.5 и 8.5–15.6%. Вирус-индуцированная смертность бактериопланктона составляла 9.5–16.1 и 1.4–9.5% суммарной продукции бактерий для устья и эстуарной зоны соответственно [5]. Таким образом, вирусы-бактериофаги в разные сезоны играли относительно небольшую роль в контроле над численностью и продукцией бактериопланктона.
Данные экспедиционных исследований августа–сентября 2001 г. также подтверждают связь обилия бактериопланктона в поверхностном слое Енисея и прилежащего шельфа с величиной солености [29]. Обилие бактериопланктона в речной части составляло в среднем 1.5 млн кл/мл, в эстуарной области (соленостью 5–15 psu) 1.8 млн кл/мл, а в морских водах соленостью более 25 psu этот показатель снижался до 460 тыс. кл/мл. Сходное распределение было отмечено и для продукции бактериопланктона поверхностного слоя. Ее величины для речной, эстуарной и морской частей разреза составляли 11.27, 6.83 и 3.31 мгС/м3 в сутки соответственно [29]. Значения продукции в придонном слое были на 25% ниже, чем на поверхности. Была отмечена корреляция продукции бактериопланктона с концентрацией хлорофилла “а” и температурой поверхностной воды. Экспериментальные работы продемонстрировали увеличение бактериальной продукции на 17–43% при добавлении глюкозы, при этом добавление фильтрованной речной воды не вызывало рост продукции бактерий. Этот факт предположительно указывает на лимитирование роста бактериопланктона источниками лабильного углерода поздним летом [29].
Летом 2016 г. количественное распределение бактериопланктона хорошо согласовывалось как с изменением концентрации растворенного органического углерода (РОУ): (r = 0.8, p < 0.05), так и с содержанием коллоидного вещества (r = 0.75, p < 0.05) [2]. Содержание РОУ уменьшалось со снижением солености, в слабо распресненных водах его концентрации существенно варьировали. В придонном слое было отмечено увеличение значений относительного обогащения воды растворенным органическим углеродом. Несмотря на это, доля коллоидного вещества в нем была сравнительно невелика, что может косвенно свидетельствовать о более раннем периоде обогащения данных вод растворенным органическим углеродом [2]. Для весеннего и осеннего периодов показано преимущественное доминирование терригенного органического вещества в поверхностных водах. Весной 2016 г. окрашенная фракция растворенного органического углерода в поверхностном слое воды была представлена в основном гуминовыми веществами терригенного происхождения [13]. Анализ соотношения изотопов углерода осенью 2011 г. в поверхностных водах также показал, что основной вклад приходился на взвешенное вещество терригенного происхождения, тогда как в придонных слоях увеличивалась доля 13С изотопа за счет поступления автохтонного органического вещества [4]. Несмотря на небольшое количество точек для анализа, можно отметить сходную картину распределения бактериальной биомассы и концентрации растворенного органического углерода [1]. Исследования осенью 2001 г. также показали, что всего 6–16% растворенного органического вещества в эстуарной области имеют планктонное происхождение [17].
Данные о продуктивности и сезонных изменениях бактериопланктона в других районах Карского моря и эстуариях арктических морей достаточно малочисленны. В области эстуария Оби осенью 1993 г. величины обилия бактериопланктона были крайне низки, составляя 206 тыс. кл/мл в речной зоне и 173 тыс. кл/мл в области шельфа [8]. В августе–сентябре 2001 г. [29] в эстуарной области р. Обь обилие бактериопланктона поверхностного слоя в среднем составляло 1.4, 2.1 и менее 0.5 млн кл/мл в пресной (<1 psu), распресненной (5–15 psu) и морской (>20 psu) воде соответственно. Средние величины бактериальной продукции снижались по направлению к морю, составляя в среднем 7.14, 5.06 и 3.21 мкгС/л в сутки для трех выделенных зон соответственно.
Осенью 2007 г. в том же районе величины численности бактериопланктона определяли непосредственно после отбора проб [14] и более чем через три месяца хранения [11] (учитывая потенциально жизнеспособные клетки; [38]). В первом случае наблюдались относительно высокие показатели обилия на южной станции разреза с соленостью 0.05 psu (1950 и 3170 тыс. кл/мл в поверхностном и придонном слое соответственно), тогда как закономерностей распределения бактериопланктона в эстуарной области обнаружено не было. Величины численности бактерий колебались в пределах от 700 до 2540 тыс. кл/мл в поверхностном горизонте и от 580 до 3170 в придонном, а значения биомассы варьировали в пределах 11.9–33 мгС/м3 на поверхности и 9–57.1 мгС/м3 в придонном слое. По мере увеличения глубины было отмечено увеличение вклада прикрепленных клеток с 20 до 80% их общей численности [14]. Иная картина наблюдалась при анализе проб, подвергшихся хранению. В слое над пикноклином было отмечено недостоверное снижение обилия бактериопланктона в “речной” части разреза с соленостью менее 5 psu: 505 ± 197 тыс. кл/мл по сравнению с 723 ± 146 тыс. кл/мл в мористой части эстуарной области. Сходное распределение наблюдалось и для биомассы бактерий (14.2 ± 6.5 и 21.3 ± 3.8 мгС/м3 соответственно). В слое воды под пикноклином обилие бактериопланктона резко снижалось до 376 ± 64 тыс. кл/мл (8.1 ± ± 4.6 мгС/м3). Величина удельной продукции бактерий в слое над пикноклином была существенно выше в “речной” воде, нежели в мористой части эстуарной зоны, составляя 0.54 и 0.18 сут–1 соответственно. Глубже пикноклина величины продукции были близки к нулю, и только в слое придонной воды удельная продукция достигала 0.06 сут–1 [11].
Для сравнения, осенью 1991 г. в пресной воде р. Лена (море Лаптевых) в верхнем распресненном слое бухты Тикси численность бактерий превышала 1.5 млн кл/мл. В области не подверженной распреснению численность бактерий даже в поверхностном слое составляла всего 200–400 тыс. кл/мл. Под пикноклином их обилие снижалось в 2-4 раза. Величина удельной продукции бактерий в реке и дельте Лены в большинстве случаев не превышала 0.1 сут–1. В бухте Тикси и открытом море ее значения колебались в пределах 0.08–0.3 сут–1 [36].
Для сравнения, летом 2004 г. в канадской Арктике в эстуарной области реки Маккензи численность бактериопланктона варьировала от 570 до 1360 тыс. кл/мл. Величина продукции составляла 0.82 мгС/м3 в сутки и не различалась достоверно между речной, эстуарной и морской областями. Также не было обнаружено корреляции с факторами среды. Однако было показано, что существенно различался вклад прикрепленных клеток бактерий в продукцию: в речной воде он составлял 74%, тогда как в эстуарии и море он снижался до 26%. Вклад свободноживущих бактерий уменьшался с увеличением доли взвешенного органического вещества крупнее 3 мкм [19]. Летом 2006 г. также в р. Маккензи [37] не было отмечено разницы в обилии бактериопланктона в трех выделенных по солености зонах, как в поверхностном слое, так и в придонном. Величины бактериальной продукции в поверхностном слое существенно не различались, в придонных водах значения бактериальной продукции переходной области были существенно выше, а также почти в два раза выше показателей продукции на поверхности. Различия наблюдались и в величине вклада продукции прикрепленных клеток бактерий в поверхностном слое: этот показатель снижался по направлению к морю с 94 до 31% общей величины продукции. В летний период наблюдался выраженный ответ бактерий на добавление глюкозы. Максимальной величины отклик достигал в речной воде: продукция бактериопланктона увеличивалась в 3.9, 2.5 раза в речной и переходной зонах, тогда как в морской зоне увеличение продукции было недостоверно выше одного [37].
Имеющиеся на данный момент данные не включают собственно период половодья, когда по некоторым сведениям доля лабильного растворенного углерода в стоке речной воды может возрастать до величин порядка 20–40% [23], тогда как в течение большей части вегетационного сезона основным источником углерода для гетеротрофного бактериопланктона эстуарных областей сибирских шельфовых морей является органическое вещество, синтезируемое первичными продуцентами. Таким образом, для более полной картины сезонных изменений бактериопланктона не хватает наблюдений именно этого периода.
ЗАКЛЮЧЕНИЕ
На основании полученных данных и анализа литературных источников можно говорить о существовании в эстуарии Енисея трех зон, выделенных по показателям солености (рис. 6). Обилие и активность бактериопланктона в них в могут различаться на порядок. Распределение обилия внутри этих зон обусловлено скорее мелкомасштабной пятнистостью, прослеживающейся по распределению органического вещества, фитопланктона и взвеси [10]. При этом границы изменения качественных и количественных характеристик разных групп планктонных организмов не всегда совпадают.
Рис. 6.
Средние величины обилия бактериопланктона (N, тыс. кл/мл) в разные сезоны в речной (соленость менее 2.5 psu), распресненной (2.5–18 psu) и морской (>18 psu) воде.
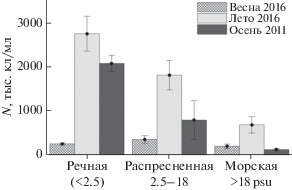
Также на основании экспедиционных результатов и литературных данных можно заключить, что основные сезонные различия в количественных характеристиках бактериопланктона приходятся на распресненную часть эстуарной области р. Енисей. Продукционные показатели микроорганизмов характеризуются неравномерным распределением, максимальные величины наблюдаются в летний период. Вклад гетеротрофной компоненты микробного сообщества является основным в ранне-весенний период. Несмотря на отмеченные корреляции в распределении показателей обилия и активности бактерий, фитопланктона и органического углерода, картина их распределения вдоль градиента солености различалась. В весенний и осенний сезоны вирусы-бактериофаги играют относительно небольшую роль в регуляции численности и продукции бактериопланктона. Отдельного внимания для дальнейших исследований заслуживает оценка вклада прикрепленных и свободноживущих бактерий в обилие и активность микроорганизмов. Также для рассмотрения сезонной динамики развития бактериопланктона важно учитывать собственно время половодья, возможно кардинально отличающегося по составу и доступности поступающего с речной водой органического вещества. К настоящему моменту таких исследований, к сожалению, нет.
Источник финансирования. Обработка материала выполнена при финансовой поддержке гранта РНФ № 17-77-10 138, анализ данных выполнен при поддержке гранта РФФИ № 18-05-00326.
Список литературы
Беляев Н.А., Поняев М.С., Кирютин А.М. Органический углерод воды, взвеси и верхнего слоя донных осадков центральной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 563–563.
Беляев Н.А., Колоколова А.В., Кирютин А.М. Отчет отряда биогеохимии // Научный отчет экспедиции 66 рейса НИС “Академик Мстислав Келдыш” в Карское море (13 июля–21 августа 2016 г.). М.: ИО РАН, 2016. С. 240-255.
Болтенкова М.А., Широколобова Т.И., Макаревич П.Р., Романова Н.Д. Сообщества планктонных бактерий и вирусов Обской губы и прилегающего шельфа Карского моря // Наука Юга России. 2018. Т. 14. С. 78–87.
Иванов М.В., Леин А.Ю., Саввичев А.С. и др. Численность и активность микроорганизмов в пограничной зоне вода осадок и их влияние на изотопный состав углерода органического вещества взвеси и донных осадков Карского моря // Микробиология. 2013. Т. 82. С. 723–731.
Копылов А.И., Сажин А.Ф, Заботкина Е.А., Романова Н.Д. Вириопланктон Карского моря: влияние вирусов на смертность гетеротрофных бактерий // Океанология. 2015. Т. 55. № 4. С. 620–631.
Лисицын А.П. Маргинальный фильтр океанов // Океанология. 1994. Т. 34. № 5. С.735–747.
Маккавеев П.Н., Мельникова З.Г., Полухин А.А. и др. Гидрохимическая характеристика вод западной части Карского моря // Океанология. 2015. Т. 55. № 4. С. 540–551.
Мицкевич И.Н., Намсараев Б.Б. Численность и распределение бактериопланктона в Карском море в сентябре 1993 г. // Океанология. 1994. Т. 34. № 5. С. 704–708.
Мошарова И.В., Ильинский В.В., Мошаров С.А. Состояние гетеротрофного бактериопланктона эстуария реки Енисей и зоны Обь-Енисейского речного выноса в осенний период в связи с факторами окружающей среды // Водные ресурсы. 2016. Т. 43. С. 202–215.
Пелевин В.В., Завьялов П.О., Беляев Н.А и др. Пространственная изменчивость концентраций хлорофилла “а”, растворенного органического вещества и взвеси в поверхностном слое Карского моря в сентябре 2011 г. по лидарным данным // Океанология. 2017. Т. 57. № 1. С. 183–193.
Романова Н.Д., Сажин А.Ф. Бактериопланктон шельфовой части Карского моря // Океанология. 2015. Т. 55. № 6. С. 949–954.
Романова Н.Д., Сажин А.Ф. Взаимосвязь между объемом бактериальных клеток и содержанием в них углерода // Океанология. 2010. Т. 50. № 4. С. 556–565.
Сажин А.Ф., Мошаров С.А., Романова Н.Д. и др. Планктонное сообщество Карского моря ранней весной // Океанология. 2017. Т. 57. № 1. С. 246–248.
Саввичев А.С., Захарова Е.Е., Веслополова Е.Ф и др. Микробные процессы циклов углерода и серы в Карском море // Океанология. 2010. Т. 50. № 6. С. 942–957.
Суханова И.Н. Отчет отряда фитопланктона // Научный отчет экспедиции 66 рейса НИС “Академик Мстислав Келдыш” в Карское море (13 июля–21 августа 2016 г.). М.: ИО РАН, 2016. С. 132–141.
Теплинская Н.Г. Бактериальная трансформация соединений азота, углерода, серы и фосфора в субантарктических донных отложениях // Экологическая безопасность прибрежной и шельфовой зон. 2007. Т. 15. С. 581–589.
Amon R.M., Meon B. The biogeochemistry of dissolved organic matter and nutrients in two large Arctic estuaries and potential implications for our understanding of the Arctic Ocean system // Marine Chemistry. V. 92. P. 311–330.
Fenchel T. The microbial loop – 25 years later // J. of Experimental Marine Biology and Ecology. 2008. V. 366. P. 99–103.
Garneau M.-E., Vincent W.F., Terrado R., Lovejoy C. Importance of particle-associated bacterial heterotrophy in a coastal Arctic ecosystem // J. Marine Systems. 2009. P. 185–197.
Gordeev V., Martin J., Sidorov I., Sidorova M. A reassessment of the Eurasian river input of water, sediment, major elements, and nutrients to the Arctic Ocean // American Journal of Science. 1996. V. 296. P. 664–691.
Holmes R.M., McClelland J.W., Tank S.E. et al. Arctic Great Rivers Observatory. 2018. Water Quality Dataset, Version YYYYMMDD. https://www.arcticgreatrivers.org/data
Holmes R.M., McClelland J.W., Peterson B.J. et al. Seasonal and Annual Fluxes of Nutrients and Organic Matter from Large Rivers to the Arctic Ocean and Surrounding Seas // Estuaries and Coasts. 2012. V. 35. P. 369–382.
Holmes R.M., McClelland J.W., Raymond P.A. et al. Lability of DOC transported by Alaskan rivers to the Arctic Ocean // Geophys. Res. Letters/ 2008. V. 35.
Kamiya E., Izumiyama S., Nishimura M. et al. Effects of fixation and storage on flow cytometric analysis of marine bacteria // J. of Oceanography 2007. V. 63. P. 101–112.
Kirchman D.L., Malmstrom R.R., Cottrell M.T. Control of bacterial growth by temperature and organic matter in the Western Arctic // Deep-Sea Res. Part II: Topical Studies in Oceanography. 2005. V. 52. P. 3386–3395.
Kopylov A.I., Sazhin A.F., Zabotkina E.A. et al. Virioplankton of the Kara Sea and the Yenisei River estuary in early spring. Estuarine // Coastal and Shelf Science. 2019. V. 217. P. 37–44.
Lebaron P., Servais P., Baudoux A.-C. et al. Variations of bacterial-specific activity with cell size and nucleic acid content assessed by flow cytometry // Aquatic Microbial Ecology. 2002. V. 28. P. 131–140.
McClelland J.W., Holmes R.M., Dunton K.H., Macdonald R.W. The Arctic Ocean Estuary // Estuaries and Coasts. 2012. V. 35. P. 353–368.
Meon B., Amon R.M. Heterotrophic bacterial activity and fluxes of dissolved free amino acids and glucose in the Arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquatic Microbial Ecology. 2004. V. 37. P. 121–135.
Mosharov S.A., Sazhin A.F., Druzhkova E.I., Khlebopashev P.V. Structure and Productivity of the Phytocenosis in the Southwestern Kara Sea in Early Spring // Oceanology. 2018. V. 58. P. 396–404.
Osadchiev A.A., Izhitskiy A.S., Zavialov P.O. et al. Structure of the buoyant plume formed by Ob and Yenisei river discharge in the southern part of the Kara Sea during summer and autumn // J. of Geophys. Res.: Oceans. 2017. V. 122. P. 5916–5935.
Polukhin A.A., Makkaveev P.N. Features of the continental runoff distribution over the Kara Sea // Oceanology. 2017. V. 57. P. 19–30.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting aquatic microflora // Limnology and oceanography. 1980. V. 25. P. 943–948.
Saliot A., Cauwet G., Cahet G. et al. Microbial activities in the Lena River delta and Laptev Sea // Marine Chemistry. 1996. V. 53. P. 247–254.
Sherr B.F., Sherr E.B., Andrew T.L. et al. Trophic interactions between heterotrophic protozoa and bacterioplankton in estuarine water analyzed with selective metabolic inhibitors // Mar. Ecol. Prog. Ser. 1986. V. 32. P. 169–179.
Sorokin Y.I., Sorokin P.Y. Plankton and Primary Production in the Lena River Estuary and in the South-eastern Laptev Sea // Estuarine, Coastal and Shelf Science. 1996. V. 43. P. 399–418.
Vallières C., Retamal L., Ramlal P. et al. Bacterial production and microbial food web structure in a large arctic river and the coastal Arctic Ocean // J. of Marine Systems. 2008. V. 74. P. 756–773.
Vosjan J.H., van Noort G.J. Enumerating nucleoid-visible marine bacterioplankton: bacterial abundance determined after storage of formalin fixed samples agrees with isopropanol rinsing method // Aquatic microbial ecology. 1998. V. 14. P. 149–154.
Weisse T. The microbial loop in the Red Sea: Dynamics of pelagic bacteria and heterotrophic nanoflagellates // Marine ecology progress series. 1989. V. 55. P. 241–250.
Дополнительные материалы отсутствуют.