Океанология, 2020, T. 60, № 1, стр. 104-113
Моделирование пространственно-распределенной системы “хищник–жертва” с периодическими миграциями хищника (на примере сообщества гарпактикоид и микроводорослей литорали Белого моря)
Е. А. Смирнова 1, А. И. Азовский 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова,
биологический факультет
Москва, Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: aiazovsky@mail.ru
Поступила в редакцию 30.08.2018
После доработки 10.06.2019
Принята к публикации 18.06.2019
Аннотация
Для анализа взаимодейcтвий между литоральными гаpпактикоидами и диатомовыми водоpоcлями построена непрерывная по времени и дискретная по пространству модель “мигрирующий хищник– неподвижная жертва”. Миграции хищника носят периодический ненаправленный характер, их локальная интенсивность определяется трофическим статусом (отношением реального рациона к максимальному). Анализ “точечного” аналога модели показал, что система имеет два нетривиальных устойчивых состояния, одно из которых соответствует переэксплуатации (устойчиво низкая численность жертвы, контролируемой голодным хищником), другое – “благополучное” (сытый хищник, плотность жертвы ограничена емкостью среды). Численное моделирование показало, что при значениях параметров, близких к реальным, в пространственно-распределенной системе реализуется либо тотальный режим переэксплуатации, либо неоднородный динамический режим с образованием короткоживущих пятен хищника и жертвы, схожий с наблюдаемым в природе. Способность хищника к миграциям сужает область параметров, при которых реализуется “благоприятный” режим, однако в этой области увеличивает трофическую эффективность системы: как средняя по пространству численность жертв, так и средний рацион хищника выше, чем без миграций. Выигрыш от миграций особенно заметен в пространственно-неоднородной для жертвы среде. Введение локальной информированности хищника (миграции преимущественно в направлении высокой плотности жертвы) не оказало существенного влияния на состояние системы.
ВВЕДЕНИЕ
Пространственно-временнáя неоднородность – неотъемлемое свойство живых систем, изучение механизмов такой неоднородности необходимо для понимания функционирования сообществ. Ярким примером подобной системы является распределение бентосных рачков гарпактикоид (Harpacticoida: Copepoda). Они образуют пятна размером от 0.5 см2 до нескольких м2 [2, 21, 28, 38, 39, 42], расположение которых непостоянно и может сильно меняться в течение суток [2, 28]. Причины такого распределения точно неизвестны, однако наиболее правдоподобной представляется гипотеза о ведущей роли биотических факторов [25, 27, 29, 33, 40], в частности, трофических взаимодействий рачков с их основным пищевым объектом – диатомовыми водорослями. По данным полевых наблюдений, гарпактикоиды выедают до 2/3 биомассы диатомовых в сутки [24, 26, 35], однако за счет размерной селективности питания гарпактикоид процент выедания может оказаться значительно выше [20]. Очевидно, что система гарпактикоиды-диатомовые существует в весьма напряженном трофическом режиме. Кроме того, в отличие от большинства представителей мейобентоса, гарпактикоиды регулярно выходят из толщи осадков в воду. Причины и механизм, индуцирующий такие миграции, также не ясны. Возможно, именно пространственно-временнáя неоднородность, определяемая миграциями, обеспечивает устойчивость системы “пища–потребитель” [19, 20].
Модель такого взаимодействия была предложена в работах Тютюнова и др. [8, 9], где были сделаны следующие допущения: частота выхода особи в воду из данной точки зависит от концентрации некоего стимула в этой точке. Выйдя в воду, особь обязательно совершает перемещение, при этом все направления перемещения равновероятны. Было показано, что рассмотренный механизм таксиса, т.е. убывание частоты выхода особи в воду при возрастании концентрации стимула, приводит к агрегированию организмов в местах с повышенной концентрацией стимула. При этом в результате бифуркации Пуанкаpе–Андpонова–Xопфа в системе могут возникать сложные пространственно-неоднородные режимы. В качестве возможных стимулов в работе [8] рассматривались локальная плотность жертвы, концентрация выделяемых ей метаболитов-аттрактантов и сытость хищника. Был сделан вывод, что пространственно-неоднородный режим возникает только в том случае, когда в качестве стимула используется сытость хищника.
В работах [8, 9] был проведен лишь общий качественный анализ системы, т.е. принципиальная возможность существования и устойчивости нетривиальных решений при произвольно заданных параметрах и стационарном распределении стимула. Вопросы же о характере поведения системы в конкретном диапазоне параметров и о биологической эффективности разных режимов остаются открытыми.
В настоящей работе данная модель модифицирована применительно к особенностям биологии рассматриваемой системы – гарпактикоидам и диатомовым литорали Белого моря. Следует оговориться, что мы не ставили своей задачей создание точной имитационной модели, учитывающей детали реальной литоральной системы. Целью работы было исследование принципиальных особенностей поведения дискретной по пространству версии модели [8, 9] при реалистичном выборе параметров и оценка потенциальной эффективности режимов с периодическими ненаправленными миграциями хищника.
ОПИСАНИЕ МОДЕЛИ И ВЫБОР ПАРАМЕТРОВ СИМУЛЯЦИИ
В основе нашей модели лежат следующие допущения:
1) Популяции хищника (условные гарпактикоиды) и их жертв (условные микроводоросли) взаимодействуют на прямоугольной сетке размером 50 × 50 ячеек с непроницаемыми внешними границами. Рассматриваемая модель принадлежит не к классу моделей с явно заданным пространственным масштабом (“spatially explicit models”), а к классу пространственно-распределенных моделей с точечной матрицей (“spatially-distributed point-grid models”). В этом случае отдельная ячейка рассматривается как внутренне-однородный участок без точной привязки к конкретному пространственному масштабу. Однако, учитывая, что величины обилия мейобентоса традиционно (как и в нашей работе) приводятся на 10 см2, а наиболее вариабельно обилие литорального микро- и мейобентоса в масштабах дециметров-метров [21, 28], представляется оправданным оценить размер ячейки порядка дециметров; таким образом, общий размер области моделирования можно приблизительно оценить как 25–100 м2. Условия в разных ячейках для жертв могут быть одинаковыми (пространственно-однородная модель) или различными (пространственно-неоднородная модель) (см. ниже).
2) Динамика обилия (биомассы) жертв в i-ой ячейке описывается уравнением логистического роста с учетом выедания:
(1)
$\frac{{d{{N}_{i}}}}{{dt}} = r{{N}_{i}}\left( {1 - \frac{{{{N}_{i}}}}{{{{K}_{i}}}}} \right) - {{P}_{i}}Q({{N}_{i}}),$Суммарное обилие хищников принимали постоянным, учитывая, что время генерации гарпактикоид в северных морях сравнимо со временем моделирования (1–2 мес.) [12].
3) Для описания функционального отклика хищника была выбрана трофическая функция Холлинга III-го типа
где Q – суточный рацион гарпактикоид (в долях от массы), Qmax – максимальный рацион, N – обилие водорослей, L – константа полунасыщения. Выбор этой функции обусловлен тем, что гарпактикоиды захватывают и глотают клетки диатомовых последовательно, по одной. Такому поведению хищников, в том числе – копепод, больше соответствует сигмоидальная форма отклика [31, 37, 43].4) Мы предполагаем, что бентосные гарпактикоиды, будучи плохими пловцами, после выхода из грунта пассивно переносятся с током воды и не способны выбирать направление миграций (модель неинформированного хищника). Процесс ненаправленной миграции представляет собой равновероятное перемещение особей во все соседние ячейки, включая исходную, на расстоянии, не превышающем радиус миграций D.
Локальная динамика хищника описывалась дискретным по времени уравнением:
(2)
${{P}_{i}}(t + g) = {{P}_{i}}(t) - {{P}_{i}}(t){{F}_{i}} + \frac{1}{{{{{(2D + 1)}}^{2}}}}\sum {{{P}_{{\langle D\rangle }}}{{F}_{{\langle D\rangle }}}} ,$Система уравнений (1)–(2) решалась численным интегрированием методом Рунге–Кутты 2-го порядка с автоматическим выбором шага интегрирования. Модель реализована на языке BASIC QB64. Стандартный цикл моделирования составлял 80 шагов (40 сут). Обилие водорослей и гарпактикоид выражали в единицах биомассы (в µг/см2).
В модели использовались следующие параметры:
g – временнóй шаг модели, через который рассчитывались значения P, Q и N (в сутках). Так как в Белом море полусуточный приливный цикл, и рачки могут только дважды выйти в воду и переместиться между участками грунта, g был выбран равным 0.5 сут;
N0 – начальная биомасса водорослей. На литорали губы Чернореченской типичные величины суммарной биомассы микроводорослей лежат в пределах 2000–13 000 µг/см2 [4, 10, 18]. Однако, учитывая, что гарпактикоиды предпочитают отнюдь не самые обильные виды водорослей, составляющие 20–30% общей биомассы [18], среднюю начальную концентрацию пищи приняли равной 1000 µг/см2;
r – максимальная скорость роста диатомовых. По литературным данным [3, 14–16, 41], значения r для отдельных видов микроводорослей находятся в пределах 0.5–2.2 сут–1, для микрофитобентоса в целом – порядка 1.0 сут–1. В модели использовались значения r от 0.5 до 1.5;
K – емкость среды для водорослей. Поскольку в литературе нет оценок емкости среды для природных популяций микрофитобентоса, мы приблизительно оценили K, сравнивая данные по скорости роста диатомовых водорослей в культуре и в природных условиях [14–16, 44]. Принимая, что рост популяций описывается логистической функцией:
получаем, что наблюдаемая скорость роста rOBS = = rMAX(1 – N/K); откуда получаем: K/N = = rMAX/(rMAX – rOBS). Используя это соотношение, мы получили, что наблюдаемая в природе численность, как правило, в 1.5–6 раз (в среднем в 2.5–3.5 раза) ниже емкости среды. Поэтому мы приняли этот диапазон значений (10 000–24 000 µг/10 см2) как приемлемый в первом приближении для варьирования K в модели;P – средняя биомасса рачков (µг/10 см2). Средняя суммарная биомасса гарпактикоид на литорали губы Чернореченской составляет 2500–3500 µг/10 см2 [2, 10, 11, 18, 20]. Анализ имеющихся первичных данных (277 проб 2000–2013 гг.) показал, что распределение величин биомассы гарпактикоид хорошо описывается логнормальным распределением с параметрами ln P = 7.48 ± 1.33; при этом среднее значение биомассы составляет 3253.2 ± 183.5 µг/10 см2; это значение и было принято в качестве базового значения P в модели;
Qmax – максимальный рацион рачков в долях от массы особи (сут–1). Используя аллометрическое соотношение между индивидуальной массой и максимальным рационом и температурную поправку, равную 0.82 для среднесуточной температуры на поверхности донных осадков +15°С [1, 3, 7], мы получили Qmax, равное 60% веса особи [20];
Величина концентрации полунасыщения L варьировала от 100 до 500 µг/см2, поскольку, по литературным данным, скорость питания гарпактикоид снижается вдвое при концентрации пищи, в 2–5 раз меньшей максимального рациона [13, 17, 20];
D – радиус миграций (наибольшее количество ячеек, на которое особь может переместиться за один выход в воду). В нашем случае изменялся от 0 до 6.
Распределение раков и водорослей визуально отображалось на графических картах. На основании этих данных оценивалось “качество жизни” хищника и жертвы – средняя по популяции сытость хищника Q/Qmax и относительное обилие жертв N/K. Характерный размер пятен оценивали расчетом пространственной автокорреляции Морана, средний срок существования пятна – корреляцией Мантеля R(Δt) (степень коррелированности между пространственным распределением обилий через разные промежутки времени Δt).
РЕЗУЛЬТАТЫ
Точечная модель без миграций (D = 0). Локальное обилие хищника в такой модели постоянно, а динамика популяции жертвы описывается уравнением:
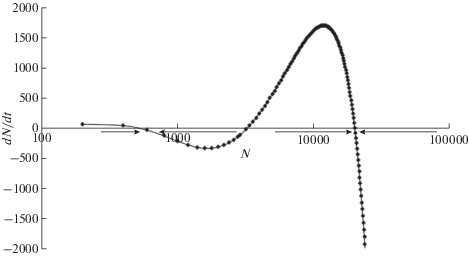
Правая часть этого уравнения эквивалентна многочлену 4-ой степени от N и в общем случае имеет три положительных корня. Следовательно, в системе без миграций могут существовать 3 нетривиальных равновесных состояния (при которых dN/dt = 0), показанных на рис. 1.
Точки равновесия I и II являются устойчивыми (аттракторы), в то время как равновесие III – неустойчиво (репеллер). В области равновесия I наблюдается ситуация устойчивой переэксплуатации (overgrazing, [36]): численность продуцентов крайне мала и не может возрасти, так как голодный хищник выедает их практически полностью. Равновесие II – “благополучное” состояние, при котором обилие водорослей сравнительно высоко, а рацион раков приближается к максимальному. Точка III – неустойчивое равновесие, откуда система при малых возмущениях перейдет либо в точку I, либо в точку II. При отсутствии миграций система, попав в одно из устойчивых равновесий, больше не может покинуть его.
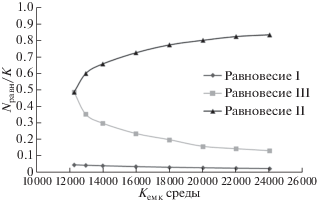
Далее мы исследовали зависимость положений равновесий от различных параметров, а частности, от емкости среды K (рис. 2). Положение равновесия I не зависит от емкости среды, поскольку численность жертв удерживается хищником на низком уровне. Существенно, что при некотором критическом значении K точки равновесия II и III сливаются в одну. При емкости среды ниже критической происходит фазовый коллапс с единственным устойчивым равновесием в состоянии овергрейзинга.
Рис. 2.
Зависимость биомассы водорослей (в процентах от емкости среды K) в равновесных точках I, II и III от емкости среды K (r = 1.2, L = 1200).
Таким образом, в “точечной” модели конечное состояние системы однозначно определяется значениями параметров. Можно предположить, что наличие миграций позволяет системе в точке “перескочить” через границу неустойчивости в области равновесия III и таким образом перейти из равновесия I (состояния овергрейзинга) в благополучную область равновесия II или наоборот.
Пространственно-однородная по K модель с миграциями. В этом варианте модели емкость среды для жертв задавалась одинаковой во всех точках пространства. Мы проанализировали зависимость средней по популяции сытости хищника (Q/Qmax) и обилия жертв (N/K) от параметров модели – емкости среды для жертв K и их репродуктивного потенциала r. При реализации данного варианта модели выраженной пространственной неоднородности не наблюдалось. Исключение составляет явление, которое можно назвать “зоной голода”: после того, как система некоторое время колеблется около неустойчивого равновесия, появляются пятна устойчиво низкой биомассы водорослей (области равновесия I), площадь которых неуклонно растет. При этом гарпактикоиды, уходящие из голодной области, концентрируются на ее границе и, выедая здесь пищу, способствуют тем самым расширению “голодной зоны” (рис. 3). Состояние популяций хищника и жертвы оценивалось в конце цикла, поскольку в неустойчивом равновесии система может находиться достаточно долго.
Рис. 3.
Разрастание “зоны голода” (а) – гарпактикоиды, (б) – водоросли). Темно-серым цветом обозначена область высокой плотности организмов, светло-серым – низкой. На рисунке (а) видна волна высокой плотности гарпактикоид, уходящих из голодной зоны. K0 = 18 000, r = 1.0, L = 700, D = 4.

Из рис. 4 и 5 видно, что при высоких значениях параметра K, т.е. при высокой продуктивности пищевого ресурса, миграции дают ракам стойкое, хотя и не слишком большое преимущество в условиях питания (в среднем по популяции 5–10% рациона). Среднее по пространству обилие жертв N также несколько выше, если в системе присутствуют миграции. При этом спектр условий, в которых раки могут благополучно существовать, с появлением миграций сужается. В отсутствие миграций, за счет исходно неоднородного распределения раков одни ячейки приходят к равновесию I, другие – к равновесию II, что в целом дает довольно высокие значения Q и N. С появлением же миграций “зоны голода” неизбежно рассширяются, и вся система приходит к состоянию овергрейзинга. В случае зависимости от скорости роста жертв r результаты получились схожими: миграции также давали ракам небольшое преимущество при высоких значениях этого параметра, но приводили систему в состояние овергрейзинга при низких.
Пространственно-неоднородная по K модель с миграциями. В следующем варианте модели мы ввели в систему неоднородность среды для продуцентов. Среда разделена на квадратные участки размером 5 × 5 ячеек, в пределах которых емкость среды для водорослей K одинакова, при этом между квадратами K изменяется случайным образом в интервале от K0/2 до 2K0. Анализ проводили аналогично пространственно-однородной модели, с построением зависимости рациона гарпактикоид Q (в % от Qmax) и средней биомассы диатомовых N (в % от K) от средней емкости среды K и скорости деления водорослей r.
Рис. 4.
Зависимость среднего рациона особи Q/Qmax от емкости среды для жертв K для системы без миграций (D = 0) и при D = 4; r = 1, L = 1200.
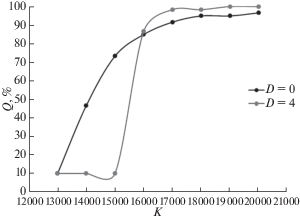
Рис. 5.
Зависимость средней биомассы водорослей (в процентах от емкости среды K) от K при D = 0 и 4; r = 1, L = 1200.

Прежде всего была проанализирована зависимость состояния системы от радиуса миграций D. Миграции на малые расстояния оказываются невыгодными, поскольку лишь ускоряют распространение “зон голода”. Однако при достаточно высокой подвижности (D ≥ 5, т.е. когда предельный радиус миграций ощутимо превышает размер пространственной неоднородности среды) способность раков к миграциям дает ощутимый выигрыш как для хищников (рис. 6), так и для популяции жертв. Схожие результаты были получены и для пространственно-однородной модели. В связи с этим мы проанализировали систему при трех величинах радиуса миграций: D = 0, D = 4 и D = 6. В этом варианте модели миграции также сужают спектр условий, в которых система может существовать без овергрейзинга, но в благоприятных условиях дают ракам заметный выигрыш в средней величине рациона – около 17% (рис. 7 и 8). При этом миграции большего радиуса, как и предполагалось, увеличивают область благополучного существования системы.
Рис. 7.
Зависимость Q/Qmax от K для пространственно-неоднородной модели при D = 0; 4 и 6; r = 1.0, L = 1400.
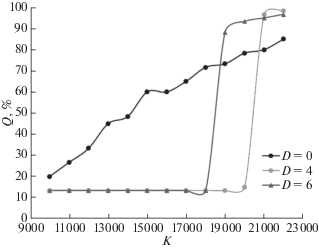
Рис. 8.
Зависимость N/K от K для пространственно-неоднородной модели при D = 0; 4 и 6; r = 1.0, L = 1400.

Для того, чтобы более детально проанализировать сужение спектра условий, при которых может существовать модель с миграциями, мы построили фазовые портреты точечной модели и пространственной модели с миграциями и без них (рис. 9 и 10). Область параметров, при которых модель с миграциями может существовать в равновесии II, значительно уже по сравнению с точечной моделью. Однако в этой области ячейки, находящиеся в равновесии I, за счет миграций имеют шанс “перескочить” через границу и прийти в равновесие II. Благодаря этому в данной области пространственная модель с миграциями имеет по сравнению с моделью без миграций преимущество по питанию хищника Q и несколько меньшее – по обилию жертв N.
Рис. 9.
Фазовые портреты (равновесные значения биомассы водорослей N/K) для точечной модели и пространственно-неоднородной модели при D = 0 и 6; r = 1.2, L = 1200.
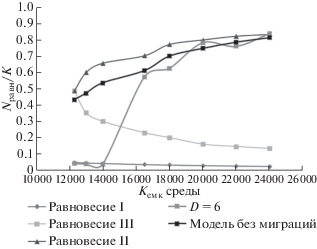
Рис. 10.
Фазовые портреты (равновесные значения рациона гарпактикоид Q/Qmax) для точечной модели и пространственно- неоднородной модели при D = 0 и 6; r = 1.2, L = 1200.

Характерные размеры и времена пространственной неоднородности. Чтобы оценить характер пространственного распределения организмов, были построены автокоррелограммы Морана для обеих популяций (рис. 11). Для водорослей средний размер пятна, оцененый как дистанция смены знака автокорреляции, составляет от 14–16 ячеек при D = 4 до 20–22 ячеек при D = 6; для раков – порядка 5 ячеек при любом радиусе миграций. При этом для водорослей наблюдается отрицательная автокорелляция на дистанциях свыше 50 ячеек, то есть их плотность имеет тенденцию различаться у противоположных краев поля. Интересно, что характерный масштаб пространственной неоднородности для подвижного хищника соответствует заданному масштабу неоднородности среды (5 × 5 ячеек), тогда как для жертв масштаб неоднородности оказывается существенно больше и зависит от подвижности хищника.
Рис. 11.
Пространственные автокореллограммы для (а) диатомовых водорослей и (б) гарпактикоид при разных радиусах миграций D.

Расчет корреляций Мантеля R(Δt), как меры соответствия пространственного распределения обилий в моменты времени t и t + Δt, показал, что картина распределения раков значительно более динамична, чем водорослей. Если принять, что при R < 0.7 картина меняется существенно (более чем на 50%), то время существования “пятен” можно приблизительно оценить в 10–20 сут для водорослей и 3–7 сут для раков.
Модель с частично-направленными миграциями. В данном варианте предполагалось, что раки, находясь в толще воды, способны оценивать количество жертв в D-окрестности, и оседание происходит более интенсивно в наиболее богатых ячейках (модель частично локально-информированного хищника). Однако это допущение не оказало существенного влияния на состояние системы. Выигрыш раков в питании и водорослей в обилии при этом варианте миграций становится даже чуть меньше.
ОБСУЖДЕНИЕ
Обычно считается, что даже частичная (локальная) информированность хищника дает ему безусловное преимущество. Так, МакНэлли [34] показал, что способность к активному выбору богатых кормовых участков (“стратегия поиска”) приводит к большей эффективности питания хищника, по сравнению со стратегией случайных ненаправленных миграций. Стратегии полной или частичной информированности хищника в ряде моделей вводятся на основе принципа эволюционной оптимальности [5, 6, 23]. В нашем случае применительно к конкретной системе “гарпактикоиды–диатомовые водоросли” стратегия информированного хищника представляется биологически малоправдоподобной, по крайней мере в условиях приливно-отливной зоны, когда способность хищника к направленным миграциям ограничена самим характером этих миграций – периодическим с ограниченными возможностями выбора направления. Результаты моделирования показывают, что даже ненаправленные миграции могут дать хищнику заметное преимущество. В то же время частичная локальная информированность хищника, против ожиданий, в нашем случае не дает ему существенного выигрыша. Очевидно, это объясняется тем, что, поскольку размещение водорослей более стабильно во времени, раки успевают отслеживать его изменения даже в случае ненаправленных миграций.
Результаты моделирования для пространственно-однородной и пространственно-неоднородной моделей оказываются схожими: в обоих случаях поведение системы зависит от средней по пространству продуктивности жертв. При высокой продуктивности и при достаточной подвижности хищника (когда предельный радиус миграций ощутимо превышает размер пространственной неоднородности среды), его способность к миграциям дает некоторое преимущество как хищникам, так и жертвам; тогда как при низкой продуктивности миграции лишь ускоряют переход к необратимому состоянию переэксплуатации. Таким образом, наши предположения о том, что миграции приводят к стабилизации системы и улучшают “качество жизни” хищника, подтвердились лишь частично. Наличие миграций сужает спектр условий, в которых система “хищник–жертва” может существовать в не слишком напряженном трофическом режиме, но в случае перехода к такому режиму, повышает эффективность функционирования всей системы. Сходный результат описан в работе [32]: в рассматриваемой ими модели плотностно-зависимые миграции усиливали трофический контроль хищником жертв, что в зависимости от выбора параметров могло приводить как к стабилизации, так и к дестабилизации системы.
В ряде работ была показана связь эффективности питания хищника с интенсивностью миграций. Так, в модели Бассета и др. [22] использовался сходный механизм миграций (их частота возрастала с ухудшением условий питания), но при этом предполагалась частичная (локальная) информированность хищника (возможность выбора наиболее богатой ресурсом ячейки из соседних). Повышение интенсивности миграций в этой модели приводило к увеличению чистой скорости потребления пищи. В работе [30] было показано, что при низких скоростях миграций популяции в разных пространственных ячейках синхронизируются, но при скорости, превышающей некий пороговый уровень, наблюдается более сложная асинхронная динамика. Эти результаты согласуются с нашими, когда при одних и тех же значениях параметров, при малом радиусе миграций (D = 4) система переходит в состояние переэксплуатации по всей площади, а при большом (D = 6) наблюдается длительный период переходного режима (система колеблется вокруг неустойчивого равновесия).
Неожиданным результатом явилось то, что поведение нашей модели описывается режимом триггерного типа, т.е. в конечном итоге система приходит либо в состояние переэксплуатации с популяцией хищника “на голодном пайке”, либо в состояние трофического благополучия, когда рацион хищника близок к максимальному. Это противоречит данным лабораторных экспериментов и полевых наблюдений, согласно которым фактический рацион гарпактикоид варьирует в широких пределах в зависимости от условий питания [13, 35]. Согласно нашим данным, реальный рацион рачков на литорали Белого моря составлял в среднем 40–65% от максимального. Возможно, это объясняется тем, что в реальных условиях система находится в переходном режиме, колеблясь в каждой точке пространства, но не достигая устойчивого равновесия. Не исключено также, что такое расхождение с реальными данными определил выбор вида и параметров трофической функции в модели.
Источник финансирования. Работа выполнена при финансовой поддержке РФФИ (гранты № 17-04-00337 и № 18-04-00206).
Список литературы
Аболмасова Г.И. Питание и элементы баланса энергии у Gammarus olivii M.-Edw. из Черного моря // Биология моря. 1976. Т. 37. С. 41–45.
Азовский А.И., Чертопруд Е.С. Пространственно-временнáя изменчивость сообщества гарпактикоид литорали Белого моря // Океанология. 2003. Т.43. № 1. С. 109–117.
Заика В.Е. Сравнительная продуктивность гидробионтов. Киев: Наукова думка, 1983. 208 с.
Мазей Ю.А., Бурковский И.В., Сабурова М.А. и др. Трофическая структура сообщества псаммофильных инфузорий в эстуарии р. Черной // Зоологический журнал. 2001. Т. 80. № 11. С. 1283–1292.
Садовский М.Г., Сенашова М.Ю., Брычев П.А. Локальная информированность особей в модели оптимизационной миграции // Докл. РАН. 2009. Т. 427. № 2. С. 176–178.
Сенашова М.Ю., Садовский М.Г. О моделировании динамики двухвидового сообщества при условии оптимизационной миграции и локальной информированности особей // Фундаментальные исследования. 2014. № 3-1. С. 50–54.
Сущеня Л.М. Интенсивность дыхания ракообразных. Киев: Наукова думка, 1972. 196 с.
Тютюнов Ю.В., Загpебнева А.Д., Cуpков Ф.А., Азовcкий А.И. Микромасштабная пятнистость распределения веслоногих рачков как результат трофически обусловленных миграций // Биофизика. 2009. Т. 54. № 3. С. 508–514.
Тютюнов Ю.В., Загpебнева А.Д., Cуpков Ф.А., Азовcкий А.И. Моделирование потока популяционной плотности организмов с периодическими миграциями // Океанология. 2010. Т. 50. № 1. С. 72–81.
Удалов А.А., Бурковский И.В., Мокиевский В.О. и др. Изменение основных характеристик микро-, мейо- и макробентоса по градиенту солености в эстуарии Белого моря // Океанология. 2004. Т. 44. № 4. С. 549–560.
Чертопруд Е.С., Азовский А.И. Сезонная динамика популяций литоральных гарпактицид (Harpacticoida: Copepoda) Белого моря // Океанология. 2005. Т. 45. № 6. С. 1–9.
Чертопруд Е.С., Азовский А.И., Сапожников Ф.В. Колонизация литоральными гарпактицидами (Harpacticoida: Copepoda) безжизненных грунтов различного гранулометрического состава // Океанология. 2005. Т. 45. № 5. С. 737–746.
Abu-Rezq T.S., Yule A.B., Teng S.K. Ingestion, fecundity, growth rates and culture of the harpacticoid copepod, Tisbe furcata, in the laboratory // Hydrobiologia. 1997. V. 347. № 1. P. 109–118.
Admiraal W. Tolerance of estuarine benthic diatoms to high concentrations of ammonia, nitrite ion, nitrate ion and orthophosphate // Mar. Biol. 1977. V. 43. № 4. P. 307–315.
Admiraal W., Peletier H., Zomer H. Observations and experiments on the population dynamics of epipelic diatoms from an estuarine mudflat // Estuar. Coast. Shelf Sci. 1982. V. 14. № 5. P. 471–487.
Admiraal W., Pelfier H. Influence of seasonal variations of temperature and light on the growth rate of cultures and natural populations of intertidal diatoms // Mar. Ecol. Prog. Ser. 1980. № 2. P. 35–43.
Araujo-Castro C.M.V., Souza-Santos L.P. Are the diatoms Navicula sp. and Thalassiosira fluviatilis suitable to be fed to the benthic harpacticoid copepod Tisbe biminiensis? // J. Exp. Mar. Biol. Ecol. 2005. V. 327. № 1. P. 58–69.
Azovsky A.I. Chertoprood E.S., Saburova M.A., Polikarpov I.G. Spatio-temporal variability of micro-and meiobenthic communities in the White Sea intertidal sandflat // Estuar. Coast. Shelf Sci. 2004. V. 60. № 4. P. 663–671.
Azovsky A.I., Saburova M.A., Chertoprood E.S., Polikarpov I. G. Selective feeding of littoral harpacticoids on diatom algae: hungry gourmands jump to survive? // Proc. of X Eur. Ecol. Congr., Kusadasi, Turkey, 2005. Izmir, META Press, 2005. P. 96.
Azovsky A.I., Saburova M.A., Chertoprood E.S., Polikarpov I.G. Selective feeding of littoral harpacticoids on diatom algae: Hungry gourmands? // Mar. Biol. 2005. № 148. P. 327–337.
Azovsky A.I., Chertoprood E.S., Saburova M.A., Polikarpov I.G. Spatio-temporal variability of micro- and meiobenthic communities in the White Sea intertidal sandflat // Estuar. Coast. Shelf Sci. 2004. V. 60. № 4. P. 663-671.
Basset A., Fedele M., DeAngelis D.L. Optimal exploitation of spatially distributed trophic resources and population stability // Ecol. Model. 2002. V. 151. № 2–3. P. 245–260.
Bernstein C., Auger P., Christophe J. Predator migration decisions, the ideal free distribution, and predator-prey dynamics // Amer. Nat. 1999. V. 153. № 3. P. 267–281.
Blanchard G.F. Measurement of meiofauna grazing rates on microphytobenthos: is primary production a limiting factor? // J. Exp. Mar. Biol. Ecol. 1991. V. 147. № 1. P. 37–46.
Blanchard G.F. Overlapping microscale dispersion patterns of meiofauna and microphytobenthos // Mar. Ecol. Prog. Ser. 1990. V. 68. № 1–2. P. 101–111.
Carman K.R., Fleeger J.W., Pomarico S.M. Response of a benthic food web to hydrocarbon contamination // Limnol. Oceanogr. 1997. V. 42. № 3. P. 561–571.
Decho A.W., Fleeger J.W. Microscale dispersion of meiobenthic copepods in response to food-resource patchiness // J. Exp. Mar. Biol. Ecol. 1988. V. 118. № 3. P. 229–243.
Fleeger J.W., Palmer M.A., Moser E.B. On the scale of aggregation of meiobenthic copepods on a tidal mudflat // Mar. Ecol. 1990. V. 11. № 3. P. 227–237.
Fleeger J.W., Decho A.W. Spatial variability of interstitial meiofauna: a review // Stygologia. 1987. V. 3. № 1. P. 35–54.
Garvie M.R., Golinski M. Metapopulation dynamics for spatially extended predator–prey interactions // Ecol. Complex. 2010. V. 7. № 1. P. 55–59.
Hassell M.P., Lawton J.H., Beddington J.R. Sigmoid functional responses by invertebrate predators and parasitoids // J. Anim. Ecol. 1977. V. 46. № 1. P. 249–262.
Hauzy C., Gauduchon M., Hulot F.D., Loreau M. Density-dependent dispersal and relative dispersal affect the stability of predator-prey meta-communities // J. Theor. Biol. 2010. V. 266. № 3. P. 458–469.
Hicks G.R. The ecology of marine meiobenthic harpacticoid copepods // Oceanogr. Mar. Biol. Ann. Rev. 1983. V. 21. P. 67–175.
Mac Nally R. Modelling confinement experiments in community ecology: differential mobility among competitors // Ecol. Model. 2000. V. 129. № 1. P. 65–85.
Montagna P.A. Rates of metazoan meiofaunal microbivory: a review //Vie et Milieu. 1995. V. 45. № 1. P. 1–10.
Noy-Meir I. Stability of grazing systems: an application of predator-prey graphs // J. Ecol. 1975. V. 63. № 2. P. 459–481.
Reiss J., Schmid-Araya J.M. Feeding response of a benthic copepod to ciliate prey type, prey concentration and habitat complexity // Freshwat. Biol. 2011. V. 56. № 8. P. 1519–1530.
Sach G., Bernem H. Spatial patterns of Harpacticoida copepods on tidal flats // Senchenberg. Mar. 1996. V. 26. № 3/6. P. 97–10.
Sun B., Fleeger J.W. Spatial and temporal patterns of dispersion in meiobenthic copepods //Mar. Ecol. Prog. Ser. 1991. P. 1–11.
Sun B., Fleeger J.W., Carney R.S. Sediment microtopography and the small-scale spatial distribution of meiofauna // J. Exp. Mar. Biol. Ecol. 1993. V. 167. № 1. P. 73–90.
Williams R.B. Division rates of salt marsh diatoms in relation to salinity and cell size // Ecology. 1964. V. 45. № 4. P. 877–880.
Woods D.R., Tietjen J.H. Horizontal and vertical distribution of meiofauna in the Venezuela Basin // Mar. Geol. 1985. V. 68. № 1–4. P. 233–241.
Yen J. Effects of prey concentration, prey size, predator life stage, predator starvation, and season on predation rates of the carnivorous copepod Euchaeta elongate // Mar. Biol. 1983. V. 75. № 1. P. 69–77.
Zaika V.E. Some remarks about primary production of benthic diatoms // Production primaire et secondaire: Colloq. franco-sovièt. CNEXO-1980. V. 10. Paris, 1980.
Дополнительные материалы отсутствуют.