Океанология, 2020, T. 60, № 1, стр. 97-103
Популяционная структура краба-вселенца (Chionoecetes opilio) в Карском море (траловые сборы и видеоучет)
А. К. Залота 1, *, В. А. Спиридонов 1, С. В. Галкин 1, А. А. Пронин 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: azalota@gmail.com
Поступила в редакцию 10.08.2018
После доработки 10.08.2019
Принята к публикации 16.12.2019
Аннотация
В работе представлены результаты изучения структуры популяции краба-вселенца Chionoecetes opilio в западной части Карского моря у пролива Карские Ворота с использованием двух методик: сборов тралом Сигсби и видеонаблюдения. При помощи буксируемого необитаемого подводного аппарата “Видеомодуль” плотность популяции крабов оценена в 2016 г. в 0.55 экз/м2 г., а в 2017 г. – 0.17 экз/м2 и 0.09 экз/м2. При сравнении размерной структуры популяции краба, полученной на основании двух методов, различий выявлено не было. Исключением является возможный недоучет молоди размером с шириной карапакса <20 мм при использовании “Видеомодуля”. Минимальный размер ширины карапакса у исследованной популяции крабов был ~10 мм, максимальный – 127 мм. Оба метода выявили присутствие всех стадий роста краба, что свидетельствует об успешном выживании и развитии вида в западной части Карского моря. Адекватная оценка развития инвазии вида-вселенца C. opilio в Карском море требует проведения ежегодных видео наблюдений в районах, представляющих характерные биотопы на разном удалении от Карских Ворот.
ВВЕДЕНИЕ
Краб-стригун (Chionoecetes opilio) относится к семейству Oregonidae – практически единственной группы настоящих крабов (Brachyura), представители которой обитают в арктических морях. Его естественный ареал охватывает северную часть Тихого океана от Берингова пролива до вод Британской Колумбии и северной части Японского моря, Чукотское море с отдельными находками в восточной части Восточно-Сибирского моря и западной части моря Бофорта, а также Северо-Западную Атлантику от крайнего северо-западного побережья США до Девисова пролива [11, 27].
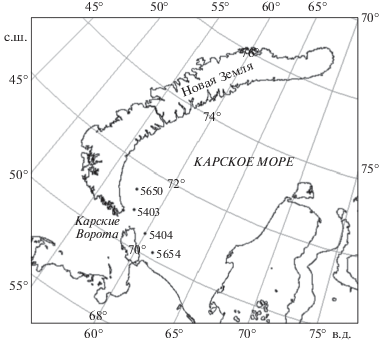
Рис. 1.
Схема положения точек траления и видеотрансект, выполненных в Карском море у пролива Карские ворота в 66-м (2016 г.) и 69-м (2017 г.) рейсах НИС “Академик Мстислав Келдыш”.
В 1996 г. краб-стригун был обнаружен в Баренцевом море [8], что, очевидно, явилось, результатом интродукции [10, 13, 24]. Развитие инвазии краба-стригуна в Баренцевом море хорошо документировано. В настоящее время вид обитает практически по всему центральному, восточному, северо-восточному шельфу бассейна, а также в Печорском море [2, 8]. В 2012 г. взрослые крабы и личинки были отмечены на нескольких станциях в юго-западной части Карского моря [6], а в 2013 г. крабы были обнаружены в юго- и в северо-восточной частях моря [10].
ИО РАН были проведены три экспедиции, которые позволяют проследить развитие инвазии Chionoecetes opilio в Карском море. В 2011 г. крабы были встречены на единственной станции в западном отроге желоба Святой Анны вблизи границы с Баренцевым морем. В 2014 г. встречаемость крабов-стригунов на станциях с глубинами от 50 до 450 м составила 60%, а в западной части моря она приближалась к 75%; молодь стригунов встречена в заливах восточного побережья Новой Земли [12, 30]. Если ранее очевидную роль в формировании карской группировки стригунов играл занос личинок из Баренцева моря, то к середине 2010-х годов появились признаки местного воспроизводства вида [5, 30].
До вселения краба-стригуна, в донных сообществах Карского шельфа практически отсутствовали массовые крупные беспозвоночные хищники. Состав и распределение донных сообществ в западной части Карского моря в XX–начале XXI века характеризовались стабильностью [1, 7, 14], что отличает этот бассейн от Баренцева моря [4]. Вселение краба-стригуна в Карское море является уникальным случаем и дает возможность наблюдения за развитием инвазии чужеродного вида и отклика на нее практически интактной арктической экосистемы, не подвергавшейся воздействию других видов-вселенцев и промысла.
Небольшие исследовательские тралы могут быть достаточно эффективны для поимки крабов, но количественная оценка популяции с их помощью затруднительна. Рыбохозяйственные институты проводят учетные съемки с помощью стандартной модели промыслового трала, путь которого по дну и полоса захвата могут быть относительно точно оценены. Однако съемка с применением подобной методики, которая выполняется ПИНРО и норвежскими Институтом морских исследований [19], является дорогостоящим исследованием, и ее проведение в районах, не представляющих промысловый интерес, таких как Карское море, маловероятно. Водолазный сбор и учет крабов возможен только для некоторых видов в районах с высокой прозрачностью воды и небольшими глубинами [29], что существенно сужает применимость данного метода. Видеонаблюдения за донными сообществами представляются удобным и эффективным методом оценки параметров популяции крабов.
Данная работа посвящена сравнению данных, полученных с помощью траловых сборов и видео наблюдений за популяцией краба-стригуна, полученных в западном районе Карского моря, прилежащем к проливу Карские Ворота, в 2016 и 2017 гг. Основной задачей данного исследования является оценка ошибок при использовании разных орудий, и формулировка рекомендаций по наиболее эффективному и информативному способу изучения вселения краба-стригуна в Карское море.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе 66-го рейса научно-исследовательского судна НИС “Академик Мстислав Келдыш” в 2016 г. на двух станциях в районе пролива Карские Ворота (рисунок) были собранны пробы с использованием трала Сигсби шириной 1.5 м и высотой 35 см. Трал был оснащен двойным мешком: наружный мешок сделан из двойной узловой капроновой дели с ячеей 45 мм; внутренний – из дели с ячеей 4 мм. Полученную пробу последовательно промывали на стальных ситах с ячеей 10 и 1 мм. Из всей траловой пробы были отобраны крабы-стригуны (Chionoecetes opilio). У всех собранных крабов был определен пол по визуальным признакам и измерена ширина карапакса (ШК) при помощи штангенциркуля.
В том же районе, в 2016 и 2017 гг. в ходе 66-го и 69-го рейсов НИС “Академик Мстислав Келдыш” произведена видеосъемка дна с помощью буксируемого необитаемого подводного аппарата (БНПА) “Видеомодуль”, разработанного и изготовленного в Институте океанологии РАН. Оборудование БНПА “Видеомодуль” включает систему управления и передачи данных, позволяющую передавать команды управления и получаемую информацию между судном и буксируемым телом по оптическому кабель-тросу в режиме реального времени. Также имеются системы навигации, регистрации глубины, три видеокамеры (одна из них высокого разрешения, настроена для проведения плановой съемки), шесть светильников заливающего света и два лазерных указателя масштаба, проецируемых на дно. Таким образом, использование БНПА “Видеомодуль” позволяет получать навигационно привязанные (в том числе по глубине), пространственно ориентированные и масштабированные фото- и видеоизображения дна с присутствующими на них животными [9].
Полученные видеотреки просмотрены с помощью программы Media Player Classic – Home Cinema в режиме полного экрана. Снимки с экрана были разделены на группы в соответствии с размером дна на изображении. Была измерена высота и ширина кадра, расстояние между двумя точками лазерного указателя масштаба и ширина карапакса присутствующих на изображениях крабов. Все промеры кадров были переведены в реальные размеры с учетом расстояния между отметками лазеров на грунте, которое в 2016 г. составляло 60 см, а в 2017 г. – 20 см.
Для оценки размерной структуры популяции использовался анализ разделения смешанного распределения на нормально распределенные группы, выполненный с использованием пакета программного обеспечения PAST [17]. Для выявления наиболее пригодной модели были использованы показатели критерия Акаике [15] и параметр логарифмического правдоподобия (log likelihood). Расчеты были выполнены с 50-кратной повторностью для выявления наиболее стабильного результата.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 2016 г. в Карском море в районе пролива Карские Ворота были выполнены два траления (станции 5403 и 5404, табл. 1).
Таблица 1.
Координаты начала и средняя глубина видеотрансект и тралений произведенных в ходе 66-го и 69-го рейсов НИС “Академик Мстислав Келдыш” в 2016 и 2017 гг.
| Метод/станция | Средняя глубина, м | Координаты начала трансекты | ||
|---|---|---|---|---|
| 2017 г. | Видео 5650 | 275 | 71°22′99′ с.ш. | 57°36′32′ в.д. |
| Видео 5654 | 229 | 70°09′96′ с.ш. | 61°14′13′ в.д. | |
| 2016 г. | Трал 5403 | 224 | 70°53′0′ с.ш. | 58°17′7′ в.д. |
| Видео и трал 5404 | 161 | 70°30′0′ с.ш. | 59°59′9′ в.д. | |
На ст. 5403 донные осадки были составлены сметанообразным илом. В траловой пробе по результатам визуальной оценки по численности преобладали: Ophiopleura borealis, Chionoecetes opilio, Molpadia borealis и Bathyarca glacialis. Также были представлены: Gersemia fruticosa, Dendronotus robustus, Pontaster tenuispinus, Gorgonacephalus arcticus, Ophioscolex glacialis.
На ст. 5404 осадки были схожими. Животных в траловом улове было очень мало. По результатам визуальной оценки численности доминирующими видами были Chionoecetes opilio, Ctenodiscus crispatus, Ophioscolex glacialis. Присутствовало также много мелких амфипод.
На ст. 5404 также была произведена видеосъемка на трансекте, заложенной в тех же координатах, что и траление. На видео треке видно очень ровное илистое дно, без каких бы то ни было включений. Из животных были видны только крабы опилио разного размера.
В 2017 г. у пролива Карские Ворота со стороны Карского моря было выполнены две видеотрансекты на станциях 5650 и 5654 (табл. 1).
На ст. 5650 рельеф дна в обследованном районе был сглаженный, поверхность осадка светло-коричневая со следами биотурбации. Донное сообщество представляло собой типичный биоценоз с доминированием крупных офиур Ophiopleura borealis, характерный для ложа и склона Новоземельской впадины, и крабов Chionoecetes opilio. По предварительным оценкам, в этом биотопе обнаружено около 20 видов макробентоса.
На ст. 5654 рельеф дна в целом не отличается от предыдущей станции, при этом донное сообщество имело иной состав. Здесь полностью отсутствовала Ophiopleura borealis. Из макрофауны были обычны крабы Chionoecetes opilio, Ceriantharia (Cerianthus lloydi), розовые Actiniaria (возможно Hormathia digitata), Alcyonaria (Gersemia spp.), крупные Asteroidea (преимущественно Urasterias lincki), и Gorgonocephalus arcticus.
Всего за два года в исследуемом районе с помощью видеозаписей на материале 3796 кадров было обследовано 2153 м2 поверхности дна. Плотность крабов-стригунов с карской стороны пролива Карские Ворота варьировала от 0.09 до 0.55 экз/м2, местный вид крабов-пауков был встречен единично лишь в 2017 г. (табл. 2).
Таблица 2.
Количество и плотность краба-стригуна Chionoecetes opilio, находки краба Hyas araneus и общие статистические характеристики видеотрансект 2016 и 2017 гг.
| 2016 г. | 2017 г. | ||
|---|---|---|---|
| cт. 5404 | cт. 5650 | cт. 5654 | |
| Количество краба-стригуна | 118 | 193 | 74 |
| Плотность краба-стригуна на м2 | 0.55 | 0.17 | 0.09 |
| Количество Hyas araneus | 0 | 16 | 2 |
| Общая площадь трансекты м2 | 213 | 1150 | 791 |
| Средняя площадь кадра м2 | 0.5 | 0.7 | 0.5 |
| Общее число просмотренных кадров | 443 | 1789 | 1564 |
Плотность поселения краба-опилио в 2016 г. на ст. 5404 составляла 0.55 экз/м2 и существенно превосходила численность вида двух станций 2017 г. – 0.17 экз/м2 на ст. 5650 и 0.09 экз/м2 на ст. 5654 (табл. 2). Это может быть связано с различающимися сообществами при сильном отличии глубин (почти на 100 м), обследованных в разные годы, или является отражением сезонной/межгодовой популяционной динамики – наблюдения 2017 г. выполнены в более поздний биологический сезон.
На ст. 5403 (глубина 224 м) в 2016 г. и на ст. 5650 (глубина 275 м) в 2017 г. по визуальной оценке было обнаружено схожее бентосное сообщество с доминированием Ophiopleura borealis. На ст. 5403 видеосъемка не проводилась, что не дает возможности сделать сравнительную оценку между годами.
На всех трех станциях, где производилась видеосъемка, донные сообщества различались. Отметим, что на ст. 5404 в траловых сборах было обнаружено очень небольшое количество организмов помимо крабов, не смотря на то, что трал пришел с наполнением и грунтом сходными со ст. 5403. Эти станции различались по глубине примерно на 60 м, но этот фактор не является основным, влияющим на обилие бентоса. Мы предполагаем, что бедность донной фауны в районе, где выполнена ст. 5404, связана с воздействием хищного чужеродного краба, популяция которого достигает здесь высокой плотности (0.55 экз/м2). Для подтверждения этой гипотезы необходимы сезонные и многолетние наблюдения, выполненные по единой методике. Сочетание видео наблюдений, которые позволяют сравнить плотность поселения крабов и оценить состав мегазообентоса, и количественных сборов при помощи дночерпателей позволит получить соответствующие достоверные оценки.
Анализ размерной структуры популяции краба-стригуна с восточной стороны от пролива Карские Ворота был проведен при помощи разделения смешанного распределения на нормально распределенные группы для всех обнаруженных крабов. Были использованы материалы видео трансект, полученные в 2016 и 2017 гг., и совмещенные данных по улову 2 тралений, выполненных в 2016 г. (табл. 3). Из исходных видеоданных 2017 г. (ст. 5650) были удалены несколько экземпляров крабов с размерами карапакса <20 мм; из данных 2016 г. – экземпляры >70 мм (ст. 5654, траловые сборы) и >100 мм (все видеотрансекты и траловые сборы). Такая корректировка данных была необходима для статистического анализа в связи с малым количеством обнаруженных крабов в этих размерных группах, соответствующих ранним (до V) и поздним (более ХI) стадиям роста [16, 22]. Удаления этих данных из анализа понизило шум и позволило выявить размерные группы с более высокой точностью. В свою очередь, удаленные данные были вручную добавлены в список обнаруженных размерных групп, соответствующих стадиям роста (отмечены звездочкой в табл. 3).
Таблица 3.
Состав размерных групп особей Chionoecetes opilio обнаруженных на видеотрансектах и собранных тралом
| Станции | Стадии роста и средняя ширина карапакса, мм | Akaik | log. Ikhood | n | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| видео 2017 г. | IV | V | VI–VII | VIII | IX | X | XI | XII | >XI | |||
| 5650 | 11.1* | 16.3**** | 34.4 | 53.5 | 79.9 | 1169 | –578.2 | 203 | ||||
| 5654 | 48.9 | 64.3 | 78.8*** | 461.4 | –226.5 | 89 | ||||||
| Все | 15.5 | 39.8 | 54.8 | 78.9 | 1783 | –883.5 | 295 | |||||
| 2016 г. 5404 | 21.8 | 31.2 | 45.1 | 56.9 | 79.6 | 115.3** | 1065 | –522 | 183 | |||
| Два трала 2016 г. ст. 5403 и 5404 вместе | ||||||||||||
| Самцы | 35.8 | 63.2 | 114** | 129.7 | –59.5 | 20 | ||||||
| Самки | 14.9** | 24.3 | 45.5 | 126.2 | –57.93 | 22 | ||||||
| Все | 10.2* | 14.9** | 24.5 | 35.1 | 45.1 | 57.2 | 71* | 114** | 237.4 | –108.4 | 41 | |
Примечание. Размерные группы были выявлены при анализе разделения смешанного распределения на нормально распределенные группы, кроме отмеченных звездочкой. n – количество особей используемых в статистическом анализе (не включают *). * 1 особь. ** 2 особи. *** 3 особи. **** 6 особи. Стадии роста (римскими цифрами) соответствуют литературным данным [2, 16].
Рост Chionoecetes opilio как промыслового вида, достаточно хорошо изучен. В литературе представлен ряд описаний размерной структуры популяций краба-стригуна в различных районах обитания [например, 16, 22, 23, 26]. Молодь и неполовозрелые крабы-стригуны проходят через серию стадий роста (СР) (instars) [20, 25, 28]. Относительное увеличение размеров неполовозрелых крабов (ШК до 40–60 мм) после линьки и средние размеры стадий роста несущественно меняются в пределах ареала краба-стригуна [18, 21, 26]. После пубертатной линьки прирост уменьшается за счет развития половых органов, и дальнейшие размеры крабов сильно зависят от температуры и наличия пищевой базы [16, 26]. В размерном составе крабов, оцененном нами с помощью траловых сборов и видео наблюдений, выявлены размерные группы, чьи средние размеры схожи с размерами стадий роста неполовозрелых крабов по литературным данным (римские цифры в табл. 3). При сравнении выявленных размерных групп по данным траловых сборов и видеонаблюдений 2016 г. отличий почти не обнаружено, за исключением отсутствия крабов размера менее 20 мм в видео материалах. Траловые сборы позволяют проводить раздельный анализ размерных групп для самцов и самок для выявления различий роста, связанных с полом. По материалам видеонаблюдений такой анализ невозможен, равно как и выявление икроносых самок. Однако количество особей, учтенных в видеонаблюдениях больше (295 особей на одной видео трансекте против 41 особи в двух тралениях) и, соответственно, достоверность статистического анализа гораздо выше при использовании видеоданных.
При анализе видеотрансект необходимо принимать во внимание возможные ошибки, связанные с: технической спецификой метода (разрешением камеры, высоты камеры над грунтом и т.д.), физических параметров изучаемого района (прозрачностью воды, рельефом и плотностью осадков и т.д.) и биологией изучаемого объекта (размеры, поведение, трудности в определении вида и т.д.).
Все три видеотрансекты выполнены на илистом грунте, в который крабы-стригуны способны закапываться. В материалах видеонаблюдений хорошо видно, как крабы частично или полностью погружены в субстрат, и на поверхности грунта заметен только их силуэт. В большинстве случаев такие крабы имели небольшие (ШК ≤ 30 мм) размеры. Таким образом, можно предположить, что при видео обследовании дна с рыхлым грунтом зарывающиеся молодые крабы могут быть существенно недоучтены. Ошибка учета крабов, связанная с их закапыванием в грунт подтверждается почти полным отсутствием в материалах видеонаблюдений молоди крабов (ШК ≤ 14 мм), для которой характерно такое поведение. Возможно также, что разрешение видеозаписи часто не позволяет распознать наличие особей этой размерной группы. Однако в траловых сборах 2016 г. также, как и на видеозаписи, почти отсутствовали крабы с шириной карапакса <20 мм, и был обнаружен только один краб с ШК 10.2 мм. В данном случае, результаты видеоряда не существенно отличались от материалов траловых сборов. На видео, полученных в 2017 г. было обнаружено небольшое количество крабов со средней шириной карапакса 16 мм и один краб размером 11 мм. В целом, следует сказать, что обнаружения крабов с ШК < 20 мм с помощью видеосъемки следует рассматривать лишь как качественные данные, которые подтверждают присутствие молоди, но не дают адекватной оценки численности.
Второй существенной проблемой учета краба-стригуна при помощи видеосъемки является присутствие в донных сообществах другого, схожего по форме нативного краба Hyas araneus. Несмотря на то, что местный краб не дорастает столь крупных размеров (ШК до 60 мм), при определенных ракурсах он практически не отличим от краба-стригуна с близким размером. Задача отличия двух крабов еще больше усложняется при малых размерах особей, так как крабы-стригуны на ранних стадиях роста имеют более вытянутый карапакс, сходный по конфигурации с карапаксом H. araneus [30], что еще более затрудняет их идентификацию. В приведенных выше результатах (табл. 2) показаны существенные межгодовые отличия в количестве находок краба H. araneus. В наших траловых сборах 2016 г. этот краб также не был обнаружен. Таким образом, надежно трактовать данные видео учета численности Chionoecetes opilio можно только имея контрольные траловые сборы из изучаемого биотопа.
Крупные крабы-стригуны ведут подвижный образ жизни [3] и при их учете с помощью трала или видеонаблюдений возникает вопрос о возможном избегании особями орудий. Трал Сигсби двигается по грунту медленно и крупные крабы способны уйти от движущегося орудия. При этом наши материалы показывают, что в трал Сигсби все же попадаются крупные особи (табл. 3). Видеомодуль не задевает дна и не создает сильных возмущений донной среды, однако он толкает перед собой воду и ярко освещает поверхность дна, что может распугивать крабов. При просмотре видео рядов случаи избегания крабами попадания в кадр были достаточно очевидны – на илистом грунте при любом движении крупных организмов возникало облако мути. В ряде случаев на видеозаписи отмечен процесс убегания краба из “кадра” в ходе учета. В целом, присутствие облака мути на видео трансектах было довольно редким (5–6 при протяженности трансекты около 1 км). Даже если считать, что этот феномен связан только с движением крабов и не принимать во внимание донных рыб, можно говорить о низком влиянии приближения видеомодуля на поведение особей.
Наши материалы позволяют заключить, что наиболее информативный способ изучения количественного распространения и размерной структуры популяции чужеродного краба-стригуна в Карском море состоит в комбинированном использовании траловых сборов и видео обследования. Для оценки плотности поселения и размерной структуры крабов шириной карапакса >20 мм необходимо производить ежегодные видеонаблюдения в стандартных точках/районах, представляющих характерные биотопы. Для более детального изучения размерной структуры поселений краба-стригуна с учетом младших стадий, половой структуры популяции и морфометрических изменений в ходе роста необходимы траловые сборы с периодичностью в 3–4 года.
Благодарности. Мы выражаем глубокую благодарность членам команды и научному составу принявших участие в рейсах научно-исследовательского судна НИС “Академик Мстислав Келдыш” в 2016 и 2017 гг. в Карское море. Мы особенно благодарны участникам отрядов бентоса и инженерно-технических исследований.
Источник финансирования. Полевые исследования проводились в рамках Государственного задания ИО РАН № 0149-2019-0008, анализ данных проведен при поддержке РФФИ (проект № 18-05-70114).
Список литературы
Антипова Т.В., Семенов В.Н. Состав и распределение бентоса юго-западных районов типично морских вод Карского моря // Экология и биоресурсы Карского моря. Апатиты: Изд-во КНЦ РАН, 1989. С. 127–137.
Баканев С.В., Жак Ю.Е., Павлов В.А. Пространственное распределение краба-стригуна опилио в Баренцевом море // Краб-стригун опилио Chionoecetes opilio в Баренцевом и Карском морях / Ред. Соколов К.М. и др. Мурманск: ПИНРО, 2016. С. 74–84.
Горянина С.В. Первые данные о миграционной активности краба-стригуна Опилио в Баренцевом море. Промысловые Беспозвоночные // Сборник материалов VIII Всероссийской научной конференции / Ред. Буруковский Р.Н., Нигматуллин Ч.М. Калининград: КГТУ, 2015. С. 54–56.
Денисенко С.Г. Биоразнообразие и биоресурсы макрозообентоса Баренцева моря. СПб.: Наука, 2013. 285 с.
Залота А.К. Чужеродные виды десятиногих ракообразных (Crustacea Decapoda) в морях России и сопредельных водах: Дис. … канд. Гидробиология: 03.02.10. М.: 2006. 234 с.
Зимина О. Л. Находка краба-стригуна в Карском море // Биология моря, 2014. Т. 40. № 6. С. 497–499.
Козловский В.В., Чикина М.В., Кучерук Н.В., Басин А.Б. Структура сообществ макрозообентоса юго западной части Карского моря // Океанология. 2011. Т. 51. № 6. С. 1072–1081.
Кузьмин С.А., Ахтарин С.М., Менис Д.Т. Первые нахождения краба-стригуна Chionoecetes opilio (Decapoda, Majidae) в Баренцевом море // Зоол. журн. 1998. Т. 77. № 4. С. 489–491.
Пронин А.А. Методика сбора и представления материалов видеосъемки дна с помощью необитаемого подводного аппарата “Видеомодуль” // Международный журнал прикладных и фундаментальных исследований. 2017. № 12-1. С. 142–147.
Соколов А.М. Интродукция краба-стригуна в Карское море. Пример дальнейшей адаптивной стратегии этого вида в российском секторе Арктики (по результатам исследований ПИНРО в 2013 г.) // Рыбное хозяйство. 2014. № 6. С. 63–67.
Соколов К.М., Павлов В.А. Пространственное распределение краба-стригуна опилио/ Краб-стригун опилио Chionoecetes opilio в Баренцевом и Карском морях / Ред. Соколов К.М. и др. Мурманск: ПИНРО, 2016. С. 9–17.
Спиридонов В.А., Залота А.К., Веденин А.А. Быстрое развитие инвазии краба-стригуна (Chionoecetes opilio) в Карском море // Материалы научной конференции “Экосистема Карского моря – новые данные экспедиционных исследований”. М.: ИО РАН, 2015. С. 179–183. ISBN 978-5904761-49-3.
Стрелкова Н.А. Об акклиматизации краба-стригуна опилио в водах Баренцева и Карского морей // Краб-стригун опилио Chionoecetes opilio в Баренцевом и Карском морях / Ред. Соколов К.М. и др. Мурманск: ПИНРО, 2016. С. 17–35.
Филатова З.А., Зенкевич Л.А. Количественное распределение донной фауны Карского моря // Тр. Всесоюзн. гидробиол. об-ва. 1957. Т. 8. С. 3–62.
Akaike H. A new look at the statistical model identification // IEEE Transactions on Automatic Control. 1974. V. 19. P. 716–723.
Alunno-Bruscia M., Sainte-Marie B. Abdomen allometry, ovary development, and growth of female snow crab, Chionoecetes opilio (Brachyura, Majidae), in the northwestern Gulf of St. Lawrence // Canadian Journal of Fisheries and Aquatic Sciences. 1998. V. 55. № 2. P. 459–477.
Hammer Ø. PAST: Paleontological STudies Version 3.0: Reference Manuel. Natural History Museum. Olso. 2013. http://folk.uio.no/ohammer/past/past3manual.pdf [последнее посещение 01.10.2015].
Ito K. Ecological studies on the edible crab Chionoecetes opilio (O. Fabricius) in the Japan Sea. II. Age and growth as estimated on the basis of the seasonal changes in the carapace width frequencies and the carapace hardness // Bull. Jpn. Sea Reg. Fish. Res. Lab., 1970. V. 22. P. 81–116.
Joint Norwegian-Russian Commission on Environmental Protection 2016 https://www.barentsportal. com/barentsportal/index.php/en/more/about-us [последнее посещение 31.07.2018]
Kon T. Fisheries biology of the Tanner crab. IV. The duration of the planktonic stages estimated by rearing experiments of larvae // Bull. Jap. Soc. Sci. Fish., 1970. № 36. P. 219–224.
Kon T. Studies on the life history of the zuwaicrab,Chionoecetesopilio (O. Fabricius) // Spec. Publ. Sado Mar. Biol. Stn., Niigata Univ., 1980. Ser. 2. 64 p.
Lovrich G.A., Sainte-Marie B., Smith B.D. Depth distribution and seasonal movements of Chionoecetes opilio (Brachyura: Majidae) in Baie Sainte-Marguerite, Gulf of Saint Lawrence // Canadian Journal of Zoology, 1995. V. 73. № 9. P. 1712–1726.
Ogata T. Studies on the population biology of the edible crab, Chionoecetes opilio O. Fabricius in the Japan Sea Region // Mar. Sci. Men. 1973. V. 5. № 3. P. 27–33.
Pavlov A.V., Sundet J.H. Snow crab // The Barents Sea ecosystem, resources, management. Half a century of Russian-Norvegian cooperation. Trondheim: Tapir Academic Press, 2011. P. 168–172.
Robichaud D.A., Bailey R.F. J., Elner R.W. Growth and distribution of snow crab, Chionoecetes opilio, in the southeastern Gulf of St. Lawrence // J. Shellf. Res. 1989. V. 8. P. 13–23.
Sainte-Marie B., Raymond S., Brêthes J.-C. Growth and maturation of the benthic stages of male snow crab, Chionoecetes opilio (Brachyura: Majidae) // Canadian Journal of Fisheries and Aquatic Sciences. 1995. V. 52. № 5. P. 903–924.
Squires H.J. Decapod Crustacea of the Atlantic coast of Canada // Canadian Bulletin Fisheries Aquatic Sciences. 1990. V. 221. P. 1–532.
Watson J. Biological investigations on the spider crab Chionoecetes opilio // Can. Fish. Rep. 1969. V. 13. P. 23–47.
Zalota A.K., Spiridonov V.A., Kolyuchkina G.A. In situ observations and census of invasive mud crab Rhithropanopeus harrisii (Crustacea: Decapoda: Panopeidae) applied in the Black Sea and the Sea of Azov // Arthrop-oda Selecta. 2016. V. 25. № 1. P. 39–62.
Zalota A.K., Spiridonov V.A., Vedenin A.A. Development of snow crab Chionoecetes opilio (Crustacea: Decapoda: Oregonidae) invasion in the Kara Sea // Polar Biology. 2018. https://doi.org/10.1007/s00300-018-2337-y
Дополнительные материалы отсутствуют.


