Океанология, 2020, T. 60, № 2, стр. 216-232
Вертикальная изменчивость первичной продукции и характеристики подповерхностного хлорофильного максимума в море Лаптевых в августе–сентябре 2015, 2017 и 2018 гг.
А. Б. Демидов 1, *, В. И. Гагарин 1, В. А. Артемьев 1, Е. Г. Арашкевич 1, П. Н. Маккавеев 1, С. А. Щука 1, А. Н. Храпко 1, А. В. Григорьев 1, О. В. Воробьёва 2, 3, И. В. Конюхов 2, А. В. Фёдоров 4
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова,
биологический факультет
Москва, Россия
3 Всероссийский научно-исследовательский институт
рыбного хозяйства и океанографии
Москва, Россия
4 Южное отделение Института океанологии
им. П.П. Ширшова РАН
Москва, Россия
* E-mail: demspa@rambler.ru
Поступила в редакцию 01.02.2019
После доработки 01.02.2019
Принята к публикации 18.06.2019
Аннотация
По материалам трех экспедиций, проведенных в море Лаптевых в августе–сентябре 2015, 2017 и 2018 гг., исследовано вертикальное распределение первичной продукции и хлорофилла “а”. Максимум первичной продукции был отмечен на поверхности и на приповерхностных горизонтах. Подповерхностный хлорофильный максимум был зарегистрирован на 39% станций, на открытом шельфе на западе моря и в районе континентального склона. На разрезе по 130° в.д. от дельты реки Лена на север подповерхностный хлорофильный максимум не был обнаружен. Как и в других районах Мирового океана, он располагался ниже верхнего перемешанного слоя, в нитраклине, у границы эвфотической зоны (1% фотосинтетически активной радиации). Как правило, подповерхностный хлорофильный максимум не сопровождался вторичным максимумом первичной продукции. Концентрация хлорофилла “а” в нем не превышала 1 мг/м3. Первичная продукция формировалась, в основном, в пределах верхнего перемешанного слоя (в среднем 72%). Вклад первичной продукции, создаваемой в подповерхностном хлорофильном максимуме, в интегральную первичную продукцию составил в среднем 23%. Такой несущественный вклад объясняется невысоким содержанием хлорофилла “а” и колимитированием первичной продукции низкой освещенностью и температурой на этих глубинах.
ВВЕДЕНИЕ
Оптические данные, полученные при дистанционном зондировании океана из космоса, относятся к сравнительно узкому приповерхностному слою. В величине спектрального коэффициента яркости, которую формирует этот слой, остаются не учтенными особенности вертикального распределения хлорофилла “а” (хл “а”), в частности его подповерхностный максимум (ПХМ). В то же время, для расчета величины первичной продукции в столбе воды (ИПП) с помощью алгоритмов, использующих спутниковые данные, необходимо установить связи поверхностных и интегральных величин продукционных параметров, на величину которых ПХМ может оказывать значительное влияние.
Вертикальное распределение хл “а” используется в моделях первичной продукции (ПП) с вертикальным разрешением. Форма кривой этого распределения зависит от трофического статуса вод, если за его показатель принимать концентрацию хл “а” на поверхности (Хл0) [45, 64]. Роль ПХМ в ИПП и регулировании потока биогенов из глубины рассматривается также в сценариях дальнейших климатических изменений в Арктике, которые могут привести к обострению пикноклина и ухудшению снабжения эвфотической зоны элементами минерального питания [59].
Присутствие ПХМ в Арктических морях принято считать характерным в летне-осенний период [4, 11, 12, 15–17, 22, 23, 28, 39–43, 62]. Причины образования ПХМ связывают с увеличением биомассы фитопланктона на этих горизонтах и/или возрастанием удельного содержания хл “а” в клетках, как адаптации к низкой освещенности [18]. В настоящее время, предметом дискуссии является вклад ПХМ в ИПП при ее расчете с помощью продукционных моделей. При решении этой проблемы обсуждается влияние ПХМ на годовую величину ИПП Арктического океана [5, 6, 29, 49, 54].
Следует отметить, что изучение ПХМ в Арктическом океане в основном проводилось в морях так называемого первого оптического типа (Case I), где оптические свойства воды формируются автохтонным органическим веществом, преимущественно фитопланктоном [25, 32]. В морях Сибирской Арктики, подверженных влиянию речного стока, который определяет высокое содержание растворенного и взвешенного вещества, а также минеральной компоненты взвеси, низкую прозрачность воды, небольшую толщину эвфотического слоя, подобных исследований значительно меньше. Первые работы, касающиеся этого вопроса, показали, что в Карском море в осенний период ПХМ выражен слабо, а его вклад в ИПП составляет от 1 до 27% [21]. Летом вклад первичной продукции, создаваемой в ПХМ, был выше и составлял в среднем 53%. Тем не менее, следует отметить что, его влияние было локальным и ограничивалось юго-западным районом моря [19].
В море Лаптевых исследования вертикального распределения ПП и хл “а” были немногочисленными и проводились, главным образом, на востоке акватории [27, 34, 56, 63] или в глубоководном районе за континентальным склоном [4, 10]. О недостаточной изученности вертикального распределения продукционных параметров в море Лаптевых свидетельствует также тот факт, что в работе [7] осреднение вертикальных профилей хл “а” для расчета годовой величины ИПП было проведено всего по двум станциям. Более того, в работе [5], в которой детально изучен ПХМ в региональном и сезонном аспектах, а также проведена оценка его вклада в годовую ИПП Арктического океана, море Лаптевых не представлено ни одной станцией.
Таким образом, проведенные в течение трех лет исследования вертикальной изменчивости продукционных параметров фитопланктона в море Лаптевых представляются актуальными. В рамках решения описанных выше проблем нами были сформулированы следующие цели работы: (1) – определение типов вертикального распределения хл “а” и ПП в районах, находящихся под влиянием речного стока и на континентальном склоне моря Лаптевых и (2) – оценка вклада ПХМ в величину первичной продукции в столбе воды.
МАТЕРИАЛ И МЕТОДЫ
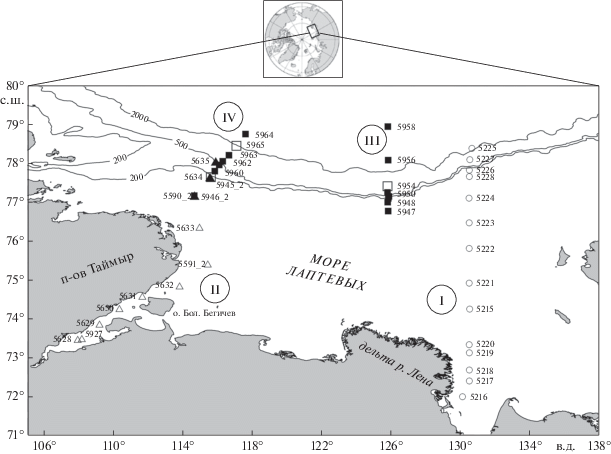
Район работ и отбор проб. Работы проводились на разрезе от дельты реки Лены на север по 130° в.д. (далее разрез “Лена”, район работ I на рис. 1) в сентябре 2015 г., на разрезе от эстуария реки Хатанги в открытое море (далее разрез “Хатанга”, район работ II на рис. 1) в сентябре 2017 г. и на разрезах через континентальный склон моря Лаптевых (далее разрезы “Восточный склон” и “Западный склон”, районы работ III и IV на рис. 1) в августе–сентябре 2018 г. Работы были выполнены, соответственно, в 63-, 69- и 72-м рейсах НИС “Академик Мстислав Келдыш”.
Рис. 1.
Расположение станций в море Лаптевых. Кружки – 63-й рейс НИС “Академик Мстислав Келдыш” (сентябрь 2015 г.). Треугольники – 69-й рейс НИС “Академик Мстислав Келдыш” (сентябрь 2017 г.). Квадраты – 72-й рейс НИС “Академик Мстислав Келдыш” (август–сентябрь 2018 г.). Темные символы маркируют станции, где был отмечен ПХМ. Римскими цифрами показаны: I – разрез “Лена”, II – разрез “Хатанга”, III – разрез “Восточный склон”, IV – разрез “Западный склон”.
Пробы воды отбирали пластиковыми батометрами комплекса Carousel Water Sampler с 6–9-ти горизонтов верхнего 100-метрового слоя после предварительного зондирования температуры, электропроводности и флуоресценции CTD-зондами Seabird Electronics (SBE-19 и SBE-32). Проба из поверхностного слоя отбиралась пластиковым ведром одновременно с замыканием батометров у поверхности.
Определение первичной продукции и концентрации хл “а”. Первичная продукция измерялась при помощи радиоуглеродной модификации метода светлых и темных склянок [57]. Постановка опытов осуществлялась по схеме имитации световых условий [37, 58] либо согласно методу Райтера-Йенча [51] с модификациями [1, 19]. Определение содержания хл “а” проводили флуориметрическим методом [30]. Расчет концентрации хл “а” и феофитина “a” проводили согласно [31]. Подробно методы определения первичной продукции и хл “а” описаны в предыдущей работе, в которой были использованы материалы упомянутых выше экспедиций в море Лаптевых [2].
Методы определения надводной и подводной облученности и гидрохимических показателей. Интенсивность надводной и подводной облученности в диапазоне фотосинтетически активной радиации (ФАР) измеряли с использованием, соответственно, датчиков LI-190 и LI-192 (LI-COR, США). Измерения надводной облученности осуществляли в течение всего светового дня, подводная облученность определялась в режиме зондирования до глубин ∼60–80 м, а на мелководных стациях – до дна.
Пробы для определения форм азота обрабатывались сразу после их отбора. Определение содержания нитритного (NO2) и нитратного азота (NO3) проводились согласно [26]. Расчет содержания растворенной двуокиси углерода и различных форм растворенного неорганического углерода проводилось pH-Alk методом по термодинамическим уравнениям карбонатного равновесия с применением концентрационных констант диссоциации угольной кислоты Роя [26, 44] с поправками [38].
Определение ПХМ, его границ, а также границ верхнего перемешанного слоя и нитраклина. Под ПХМ подразумевается слой, в котором горизонт с максимальным содержанием хл “а” для всего столба воды лежит ниже верхнего перемешанного слоя (ВПС) [12]. Верхняя и нижняя границы ПХМ определялись, исходя из допущения, что вертикальное распределение хл “а” описывается кривой Гаусса [48]. Тогда толщина ПХМ (σ) рассчитывается по формуле
(1)
$\sigma = {{{\text{Х}}{{{\text{л}}}_{{{\text{инт}}}}}} \mathord{\left/ {\vphantom {{{\text{Х}}{{{\text{л}}}_{{{\text{инт}}}}}} {{\text{Х}}{{{\text{л}}}_{{\text{м}}}}}}} \right. \kern-0em} {{\text{Х}}{{{\text{л}}}_{{\text{м}}}}}}\sqrt {2\pi } ,$За нижнюю границу ВПС принимался горизонт, на котором плотность воды (σt) впервые превысила поверхностную величину на 0.3 кг/м3 [60]. Верхней границей нитраклина считался горизонт, ниже которого значения суммы (NO2 + + NO3) начинали возрастать.
Устойчивость водного столба оценивали по значениям частоты Брента–Вяйселя
где g – ускорение свободного падения, принятое равным для широты моря Лаптевых 9.81 м/с2, а ρ – плотность воды на глубине z.РЕЗУЛЬТАТЫ
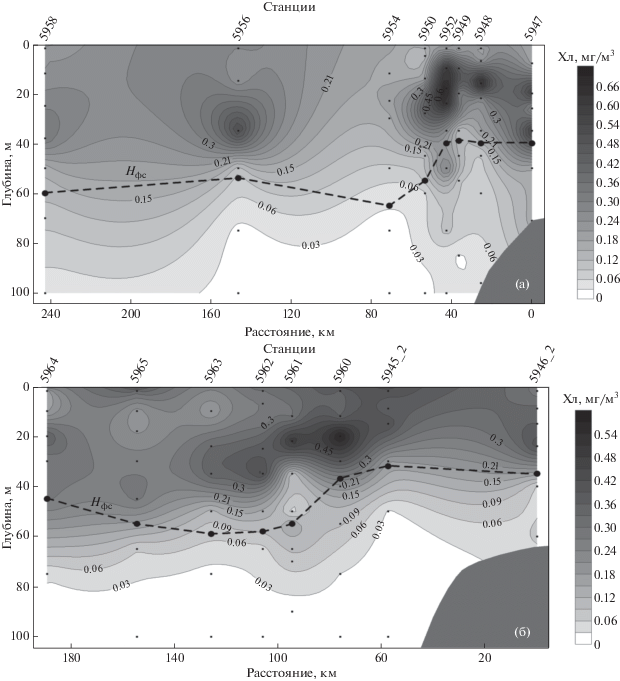
Вертикальное распределение хл “а” на разрезах. На разрезе “Лена” концентрация хл “а” на разных горизонтах изменялась больше, чем на два порядка, от 0.01 до 1.39 мг/м3 (рис. 2а). Максимальные значения отмечались на поверхности. От 50 до 100% хл “а”, в среднем 81%, содержалось в слое фотосинтеза, нижняя граница, которого лежала на глубинах от 10 до 31 м (рис. 2а).
Рис. 2.
Вертикальное распределение хл “а” на разрезах “Лена” (а) и “Хатанга” (б). Нфс – слой фотосинтеза.

Похожий масштаб изменчивости Хл был зарегистрирован на разрезе “Хатанга”. Варьирование составляло более двух порядков, а величины концентрации хл “а” находились в диапазоне от 0.02 до 2.78 мг/м3 (рис. 2б). На станциях, расположенных в южной части эстуария Хатанги, отмечался придонный максимум хл “а”. На прилегающем шельфе (<50 м) хлорофильный максимум отмечался на поверхности или в пределах ВПС. На открытом шельфе (50–200 м) и в районе континентального склона (рис. 1) на глубинах от 15 до 30 м формировался ПХМ. В пределах слоя фотосинтеза, нижняя граница которого лежала на глубинах 14–32 м, находилось в среднем 69% хл “а” (от 42 до 100%).
На разрезе “Восточный склон” диапазон изменчивости хл “а” на разных глубинах был меньше, чем на первых двух разрезах, а максимальные величины не превышали 1 мг/м3. Концентрация хл “а” варьировала в 70 раз, от 0.01 до 0.70 мг/м3. ПХМ был отмечен на всех станциях, за исключением ст. 5954, от 67 до 93% (в среднем 80%) хл “а” находилось в слое фотосинтеза, глубина которого составляла 39–65 м (рис. 3а).
Рис. 3.
Вертикальное распределение хл “а” на разрезах “Восточный склон” (а) и “Западный склон” (б). Нфс – слой фотосинтеза.
Еще меньший диапазон изменений хл “а” зарегистрирован на разрезе “Западный склон”. Отношение максимального и минимального значений составило 59 раз, величины концентрации хл “а” на разных горизонтах были в диапазоне от 0.01 до 0.59 мг/м3. ПХМ, также как и на разрезе “Восточный склон”, был характерной чертой вертикального распределения хл “а”, он отсутствовал только на двух станциях (станции 5945_2 и 5965) (рис. 1). В слое фотосинтеза (32–59 м) находилось от 77 до 92% (в среднем 83%) хл “а” (рис. 3б).
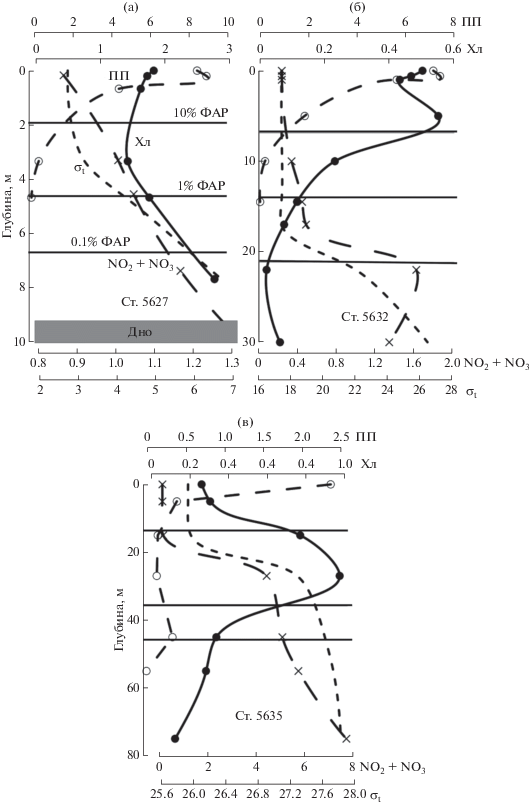
Вертикальное распределение первичной продукции, типичные вертикальные профили хл “а” и характеристики ПХМ. На разрезе “Лена” максимальные величины ПП отмечались на поверхности или в приповерхностном слое (0–5 м) (рис. 4). С глубиной ПП постепенно убывала, не образуя дополнительных максимумов. Граница слоя фотосинтеза находилась, как правило, на глубине между 1 и 0.1%-ным уровнями подповерхностной ФАР. Вертикальные профили хл “а” можно разделить на четыре типа. Первый тип характеризовался равномерным распределением Хл в ВПС и резким его уменьшением ниже этого слоя (рис. 4а). Для второго типа было характерно экспоненциальное уменьшение величин хл “а”, начиная с поверхности (рис. 4б). Третий тип характеризовался максимумом в приповерхностном слое, в пределах ВПС (рис. 4в). Четвертый тип был выделен благодаря постепенному уменьшению значений хл “а” в ВПС и слое максимальных градиентов пикноклина и резкому их снижению ниже этих слоев (рис. 4г). Общим для всех типов было отсутствие ПХМ.
Рис. 4.
Типы вертикальных профилей первичной продукции (ПП, мгС/м3 в день), хл “а” (Хл, мг/м3), суммы нитритов и нитратов (NO2 + NO3, µМ) и плотности воды (σt, кг/м3) на разрезе “Лена”. Горизонтальные линии маркируют горизонты 10, 1 и 0.1%-ной облученности от подповерхностной ФАР.

Также как и в описанном выше районе, ПП на разрезе “Хатанга” образовывала максимум на поверхности или близко к ней (рис. 5). Значения ПП уменьшались с глубиной. Граница слоя фотосинтеза находилась либо близко к горизонту с 1%-м уровнем ФАР, либо залегала глубже 0.1% подповерхностной ФАР (ст. 5635). На этом разрезе было выделено три типа вертикального распределения хл “а”. Первый тип характеризовался увеличением содержания этого пигмента ко дну (рис. 5а). Для второго типа характерен максимум в ВПС, в хорошо освещенном слое (>10% подповерхностной ФАР) (рис. 5б), который не может быть квалифицирован, как ПХМ, согласно критериям, описанным выше. И, наконец, для третьего типа вертикального распределения хл “а” характерен ПХМ, в котором горизонт с Хлм расположен ниже ВПС, близко к нитраклину и 1%-му уровню подповерхностной ФАР (рис. 5в).
Рис. 5.
Типы вертикальных профилей первичной продукции (ПП, мгС/м3 в день), хл “а” (Хл, мг/м3), суммы нитритов и нитратов (NO2 + NO3, µМ) и плотности воды (σt, кг/м3) на разрезе “Хатанга”. Горизонтальные линии маркируют горизонты 10, 1 и 0.1%-ной облученности от подповерхностной ФАР.
Первичная продукция на разрезе “Восточный склон” образовывала два пика, у поверхности и в ПХМ (рис. 6а) или убывала с глубиной без образования вторичных максимумов (рис. 6б, 6в). Граница слоя фотосинтеза располагалась между 1 и 0.1% подповерхностной ФАР или находилась близко к ее 0.1%-му уровню. На большинстве станций разреза был отмечен ПХМ. Он располагался в нитраклине, в хорошо освещенной зоне (близко к 10% ФАР) (рис. 6а), либо залегал глубже, близко к границе эвфотической зоны (1% ФАР). На единственной станции разреза (ст. 5954) ПХМ отмечен не был (рис. 6в). Здесь вертикальное распределение хл “а” в ВПС и пикноклине было близким к гомогенному, его величины уменьшались ниже этих слоев.
Рис. 6.
Типы вертикальных профилей первичной продукции (ПП, мгС/м3 в день), хл “а” (Хл, мг/м3), суммы нитритов и нитратов (NO2 + NO3, µМ) и плотности воды (σt, кг/м3) на разрезе “Восточный склон”. Горизонтальные линии маркируют горизонты 10, 1 и 0.1%-ной облученности от подповерхностной ФАР.
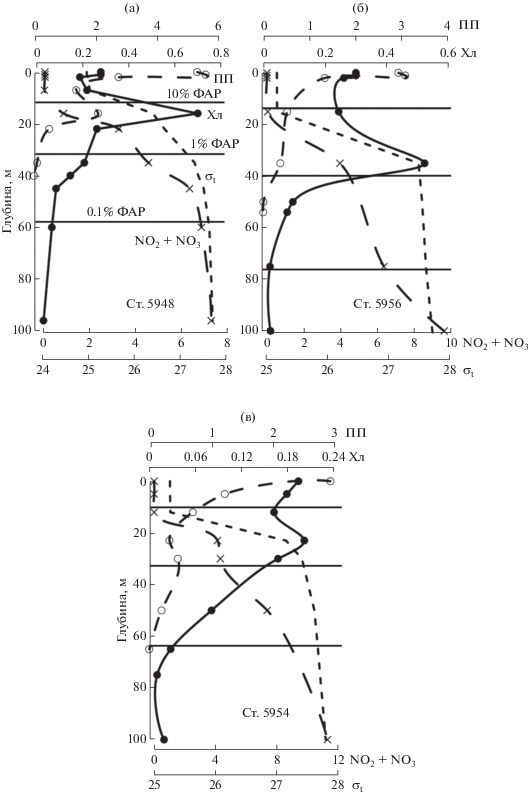
На большинстве станций разреза “Западный склон” ПП имела один максимум на поверхности (рис. 7). Исключение представляет ст. 5964, где было отмечено увеличение первичной продукции в ПХМ (рис. 7в). Граница слоя фотосинтеза находилась на глубинах между 1 и 0.1%-ным уровнями подповерхностной ФАР. На станциях без выраженного ПХМ, величины концентрации хл “а” уменьшались с глубиной по экспоненте (рис. 7а) либо образовывали более сложный, близкий к описанию синусоидой, профиль (рис. 7г). На станциях с хорошо выраженным ПХМ, он располагался, также как и в других районах, в нитраклине между 1 и 0.1%-ным уровнями подповерхностной ФАР (рис. 7б, в).
Рис. 7.
Типы вертикальных профилей первичной продукции (ПП, мгС/м3 в день), хл “а” (Хл, мг/м3), суммы нитритов и нитратов (NO2 + NO3, µМ) и плотности воды (σt, кг/м3) на разрезе “Западный склон”. Горизонтальные линии маркируют горизонты 10, 1 и 0.1%-ной облученности от подповерхностной ФАР.
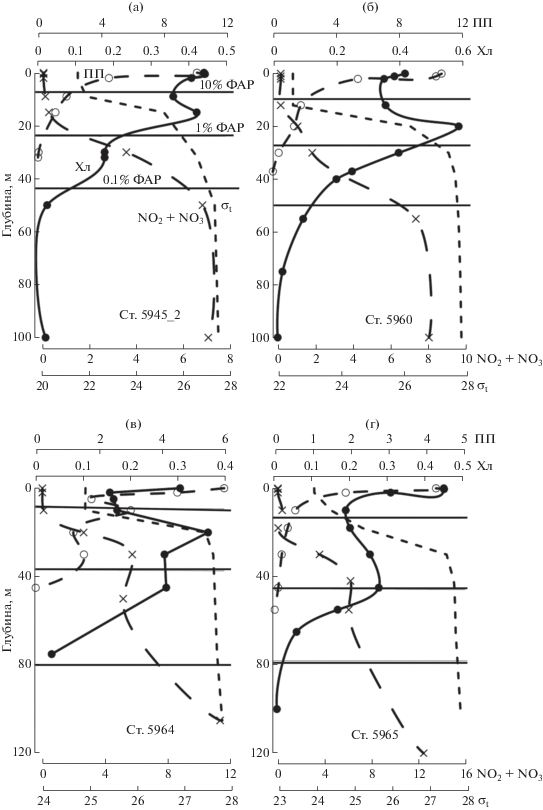
ПХМ был зарегистрирован на 39% станций, выполненных в море Лаптевых в августе–сентябре, толщина его составляла 9–19 м. Величина Хлм зарегистрирована на глубинах от 10 до 38 м (табл. 1). Максимальная концентрация хл “а” в ПХМ варьировала в 2.9 раза, от 0.34 до 0.98 мг/м3. Степень проявления ПХМ можно определить по отношению Хлм/Хл0. Величина этого отношения изменялась от 1.19 до 4.38, составив в среднем 2.1 (табл. 1). Величина ПП на горизонте Хлм (ППпхм) никогда не превышала поверхностное и подповерхностное значение (ППм). Отношение ППм/ППпхм варьировало от 1.5 до 100 и в среднем оказалось равным 15.8. Содержание феофитина “а” на горизонте Хлм изменялось от 7 до 66% от суммы хл “а” и феофитина “а”, составив в среднем 41%.
Таблица 1.
Характеристики подповерхностного хлорофильного максимума (ПХМ) в море Лаптевых в августе– сентябре
| Разрез | Ст. | Дата | Хлм | Глубина Хлм, м |
Хлм/Хл0 | Толщина ПХМ, м |
Пределы ПХМ, м |
ППм/ППпхм | Ф |
|---|---|---|---|---|---|---|---|---|---|
| “Хатанга” | 5590_2 | 19.09.17 | 0.34 | 24 | 1.70 | 12 | 18–30 | 12.5 | 7 |
| 5634 | 19.09.17 | 0.58 | 22 | 2.42 | 10 | 17–27 | 8.3 | 38 | |
| 5635 | 20.09.17 | 0.98 | 27 | 3.69 | 14 | 20–34 | 20 | 14 | |
| “Восточный склон” | 5947 | 26.08.18 | 0.58 | 20 | 3.05 | 15 | 13–28 | 100 | 21 |
| 5948 | 26.08.18 | 0.70 | 16 | 2.50 | 9 | 11–20 | 2.7 | 39 | |
| 5949 | 26.08.18 | 0.45 | 10 | 1.83 | 12 | 4–16 | 1.5 | 35 | |
| 5950 | 27.08.18 | 0.45 | 28 | 2.30 | 12 | 22–34 | 20 | 41 | |
| 5952 | 27.08.18 | 0.70 | 18 | 4.38 | 17 | 9–36 | 5.9 | 36 | |
| 5956 | 29.08.18 | 0.53 | 35 | 1.77 | 14 | 28–42 | 8.3 | 48 | |
| 5958 | 29.08.18 | 0.33 | 38 | 1.83 | 22 | 22–44 | 12.5 | 57 | |
| “Западный склон” | 5946_2 | 31.08.18 | 0.41 | 24 | 1.41 | 13 | 17–30 | 11.1 | 45 |
| 5960 | 31.08.18 | 0.59 | 20 | 1.40 | 14 | 13–27 | 7.7 | 44 | |
| 5961 | 31.08.18 | 0.51 | 22 | 1.50 | 12 | 16–28 | 8.3 | 39 | |
| 5962 | 01.09.18 | 0.43 | 35 | 1.26 | 17 | 26–43 | 8.3 | 60 | |
| 5963 | 01.09.18 | 0.35 | 35 | 1.40 | 18 | 26–44 | 9.1 | 66 | |
| 5964 | 02.09.18 | 0.37 | 20 | 1.19 | 19 | 9–28 | 5.0 | 62 |
Примечание. Хлм – максимальная концентрация хл “а” в столбе воды, мг/м3; Хлм/Хл0 – отношение максимальной и поверхностной величин концентрации хл “а”; ПХМ – подповерхностный хлорофильный максимум; ППм/ППпхм – отношение максимальной величины ПП в столбе воды и ее значения на горизонте Хлм; Ф – содержание феофитина “а” в % от суммы хл “а” и феофитина “а” на глубине Хлм.
В августе–сентябре ПХМ в море Лаптевых, как правило, располагался в слое максимальных градиентов пикноклина с отрицательной или близкой к отрицательной температурой воды (табл. 2). Содержание NO2 + NO3 на горизонте Хлм, обычно, было выше лимитирующих рост и фотосинтез фитопланктона [61]. Исключениями были станции 5590_2 и 5634 на разрезе “Хатанга” и станции 5949 и 5952 на разрезе “Восточный склон” (табл. 2), на которых ПХМ был отмечен непосредственно над верхней границей нитраклина. Абсолютные значения облученности (Iz) на глубине Хлм изменялись от 0.03 до 3.22 Ein/м2 в день, что составляло от 0.88 до 21.02% от подповерхностной облученности в диапазоне ФАР.
Таблица 2.
Некоторые абиотические факторы, характеризующие подповерхностный хлорофильный максимум (ПХМ) в море Лаптевых в августе–сентябре
| Разрез | Ст. | Дата | Глубина Хлм, м |
Tм | $N_{{\max }}^{2}$ | $\bar {N}$2 | N 2 | NO2 + NO3 | Iz Хлм абсолют. | Iz Хлм отн. |
|---|---|---|---|---|---|---|---|---|---|---|
| “Хатанга” | 5590_2 | 19.09.17 | 24 | –0.55 | 1.18 × 10–3 | 3.80 × 10–4 | 5.34 × 10–4 | 0.12 | 0.09 | 3.64 |
| 5634 | 19.09.17 | 22 | –1.01 | 5.36 × 10–3 | 4.45 × 10–4 | 6.67 × 10–4 | 0.35 | 0.09 | 3.45 | |
| 5635 | 20.09.17 | 27 | –1.50 | 2.41 × 10–3 | 1.73 × 10–4 | 3.63 × 10–4 | 4.48 | 0.08 | 2.40 | |
| “Восточный склон” | 5947 | 26.08.18 | 20 | –0.8 | 3.01 × 10–3 | 2.01 × 10–4 | 8.32 × 10–4 | 1.36 | 0.68 | 4.42 |
| 5948 | 26.08.18 | 16 | –0.39 | 2.50 × 10–3 | 4.00 × 10–4 | 7.22 × 10–4 | 0.91 | 0.80 | 5.23 | |
| 5949 | 26.08.18 | 10 | 2.28 | 1.96 × 10–3 | 6.03 × 10–4 | 1.19 × 10–3 | 0.25 | 3.22 | 21.02 | |
| 5950 | 27.08.18 | 28 | –1.34 | 2.38 × 10–3 | 2.12 × 10–6 | 5.73 × 10–4 | 3.42 | 0.20 | 1.32 | |
| 5952 | 27.08.18 | 18 | 1.75 | 1.63 × 10–3 | 7.60 × 10–5 | 1.63 × 10–3 | 0.59 | 0.76 | 6.65 | |
| 5956 | 29.08.18 | 35 | –1.79 | 4.46 × 10–3 | 2.73 × 10–6 | 9.43 × 10–5 | 3.99 | 0.05 | 1.58 | |
| 5958 | 29.08.18 | 38 | –1.80 | 1.58 × 10–3 | 4.83 × 10–4 | 1.01 × 10–5 | 5.14 | 0.18 | 2.82 | |
| “Западный склон” | 5946_2 | 31.08.18 | 24 | –0.56 | 6.26 × 10–3 | 1.12 × 10–4 | 7.20 × 10–4 | 1.42 | 0.13 | 1.43 |
| 5960 | 31.08.18 | 20 | 0.19 | 7.96 × 10–3 | 9.23 × 10–4 | 1.46 × 10–3 | 1.07 | 0.09 | 2.25 | |
| 5961 | 31.08.18 | 22 | –1.09 | 8.36 × 10–3 | 1.23 × 10–4 | 3.89 × 10–4 | 5.01 | 0.07 | 1.90 | |
| 5962 | 01.09.18 | 35 | –1.73 | 6.83 × 10–3 | 2.44 × 10–4 | 9.07 × 10–5 | 5.09 | 0.03 | 0.88 | |
| 5963 | 01.09.18 | 35 | –1.76 | 4.09 × 10–3 | 4.67 × 10–4 | 6.14 × 10–5 | 6.12 | 0.07 | 1.83 | |
| 5964 | 02.09.18 | 20 | –1.52 | 6.10 × 10–3 | 2.76 × 10–4 | 6.49 × 10–4 | 2.68 | 0.28 | 3.57 |
Примечание. Хлм – максимальная концентрация хл “а” в столбе воды, мг/м3; Tм – температура воды на глубине Хлм, °С; $N_{{{\text{max}}}}^{2}$ – максимальная для столба воды частота Брента–Вяйселя, с–2; $\bar {N}$2 – среднее значение частоты Брента–Вяйселя в ВПС, с–2; N 2 – частота Брента–Вяйселя на глубине Хлм, с–2; NO2 + NO3 – сумма нитритов и нитратов на глубине Хлм, µМ; Iz Хлм абсолют. – абсолютное значение ФАР на глубине Хлм, Ein/м2 в день; Iz Хлм отн. – относительное значение ФАР на глубине Хлм, %.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Среди исследователей, которые изучают вертикальное распределение хл “а” в Арктическом океане, существует представление о практически повсеместном существовании ПХМ в толще воды в летне-осенний период, после “цветения” при возникновении дефицита биогенных элементов в ВПС. Как и во всем Мировом океане, в Арктическом океане ПХМ образуется в нитраклине у границы эвфотической зоны (1% от подповерхностной ФАР) [18]. Таким образом, фитопланктон развивается в слоях воды при хороших условиях минерального питания и еще достаточной для фотосинтеза освещенности [41].
Профиль хл “а” используется в моделях первичной продукции с вертикальным разрешением. Один из подходов при этом предполагает допущение, что концентрация хл “а” равномерно распределяется ВПС, а ниже этого слоя экспоненциально убывает с глубиной [46]. Другой подход предусматривает сезонные изменения вертикального распределения хл “а”. Весной его распределение по глубинам гомогенно, а для лета и осени принимается упомянутое выше допущение [29]. Точка зрения на то, что распространение ПХМ в Арктическом океане является повсеместным, приводит к необходимости учитывать его вклад в ИПП в биогеохимических моделях [33, 50, 54].
В море Лаптевых ПХМ был зарегистрирован ранее только в крайних северных точках разреза от дельты реки Лены осенью 1991 г. [27] и за континентальным склоном в глубоководных районах [4, 10]. В настоящей работе впервые проанализированы результаты исследования вертикального распределения хл “а” практически на всей акватории моря. На разрезе по 130° в.д. на север от дельты реки Лены, выполненном в сентябре 2015 г., ПХМ не был зарегистрирован. Здесь практически на всех станциях содержание NO2 + NO3 в ВПС превышало лимитирующие значения [2, 3]. На разрезе “Хатанга” в сентябре 2017 г. ПХМ не был выражен в эстуарии реки и на прилегающем шельфе, в распресненной речными водами зоне (S < 28 psu). В этом районе, как правило, создавались неблагоприятные условия для образования ПХМ, связанные с невысокой прозрачностью воды, определяющейся повышенными концентрациями растворенного и взвешенного органического вещества. Напротив, на разрезах через континентальный склон (районы работ III и IV) (рис. 1) были отмечены благоприятные условия для формирования ПХМ. Величины NO2 + NO3 на горизонте Хлм, как правило, превышали лимитирующие (табл. 2). При этом ПХМ формировался в слоях, где устойчивость водного столба, оцененная по значению частоты Брента-Вяйселя (N 2), была в среднем в 2.7 выше, чем среднее ее значение в ВПС ($\bar {N}$2) (табл. 2). На трех станциях разреза “Восточный склон” (станции 5950. 5952 и 5956) это превышение составило более одного и двух порядков. Исключением из такой закономерности были станции 5958, 5962 и 5963, на которых N 2 была меньше $\bar {N}$2. Абсолютные величины облученности на горизонте Хлм были выше, чем компенсационная интенсивность света для фитопланктона [61] (табл. 2). Кроме этого, следует отметить, что популяция в ПХМ содержит клетки очень хорошо адаптированные к низкой облученности [41]. Также следует отметить, что водоросли на глубине Хлм находились, как правило, в хорошем физиологическом состоянии, которое можно оценить по содержанию феофитина “а” (в среднем 41% от суммы хл “а” и феофитина “а”).
Одна из классификаций моделей ИПП подразумевает их деление на интегрированные по глубине и модели с вертикальным разрешением [8, 13, 14, 24, 35, 52, 53]. Ранее было показано, что учет вертикального распределения хл “а” в продукционных моделях улучшает результаты расчетов ИПП незначительно [9, 20, 52], а пропуск ПХМ приводит к незначительной ошибке в расчетах ее годовых величин в Арктическом океане [5, 6]. Другие авторы считают, что учет ПХМ может почти вдвое увеличить величину ИПП в масштабах Арктического океана [29]. В любом случае, ПХМ является существенной характеристикой вертикального распределения хл “а” в сезоны года, когда водный столб резко стратифицирован, биогены лимитируют ПП в ВПС, а вклад ПХМ в ИПП может быть значителен [41].
Представляют несомненный интерес результаты расчетов вклада ПП на горизонтах ПХМ, в также различных слоев в ИПП водного столба моря Лаптевых, где подобных исследований ранее не проводилось. Данные, представленные в табл. 3, показывают, что в слое воды, формирующем сигнал, регистрируемый сканером цвета океана (1/Kd) (Hсп), где Kd – коэффициент диффузного ослабления нисходящего потока ФАР, образуется от 21 до 79% (в среднем 45%) ИПП, вклад ВПС в ИПП составляет 38–100% (в среднем 72%), а ПХМ – от 8 до 56% (в среднем 23%). Следовательно, приповерхностные слои моря Лаптевых в конце лета и в начале осени вносили основной вклад в интегральную первичную продукцию. Близкие результаты были получены осенью в Карском море [21], которое похоже с морем Лаптевых по гидрофизическим и биогеохимическим параметрам. Наши результаты также похожи на полученные ранее в сентябре оценки вклада ПХМ в ИПП для залива Баффина (5.1–15.8%), а также для моря Бофорта (20.4%) и Гренландского моря (16.6%) [6]. Следует заметить, что в середине лета вклад ПХМ в ИПП Карского моря в отдельных районах может быть значительным и доходить до 95% [19]. Большое значение первичной продукции, создаваемой в ПХМ (от 43 до 76%, в среднем 62%) было отмечено также в водах Канадской Арктики [41].
Таблица 3.
Вклад различных слоев водного столба в интегральную первичную продукцию моря Лаптевых в августе–сентябре
| Разрез | Ст. | Дата | Hфс | ИПП | Hсп | ИППсп/ ИПП, % | ВПС | ИППвпс/ ИПП, % | ИППпхм/ ИПП, % |
|---|---|---|---|---|---|---|---|---|---|
| “Лена” | 5216 | 08.09.15 | 10 | 92 | 2 | 55 | 1.5 | 43 | – |
| 5217 | 08.09.15 | 10 | 111 | 2 | 53 | 3 | 78 | – | |
| 5218 | 08.09.15 | 10 | 66 | 1.5 | 56 | 2 | 70 | – | |
| 5220 | 08.09.15 | 12 | 68 | 2 | 44 | 10 | 99 | – | |
| 5215 | 09.09.15 | 12 | 45 | 2 | 47 | 4 | 76 | – | |
| 5221 | 09.09.15 | 11 | 64 | 2 | 45 | 4 | 77 | – | |
| 5222 | 09.09.15 | 15 | 71 | 2.5 | 44 | 11 | 97 | – | |
| 5223 | 10.09.15 | 15 | 57 | 1.5 | 37 | 12 | 98 | – | |
| 5224 | 10.09.15 | 31 | 37 | 5 | 78 | 4 | 76 | – | |
| 5228 | 14.09.15 | 22 | 54 | 4 | 50 | 11 | 89 | – | |
| 5226 | 12.09.15 | 27 | 58 | 4.5 | 43 | 13 | 95 | – | |
| 5227 | 13.09.15 | 27 | 56 | 3 | 21 | 13 | 71 | – | |
| 5225 | 11.09.15 | 25 | 58 | 4 | 41 | 15 | 95 | ||
| “Хатанга” | 5627 | 17.09.17 | 7 | 17 | 1.5 | 53 | 6 | 94 | – |
| 5628 | 17.09.17 | 8 | 14 | 1.5 | 50 | 5 | 86 | – | |
| 5630 | 18.09.17 | 8 | 21 | 1.5 | 52 | 8 | 100 | – | |
| 5631 | 18.09.17 | 8 | 49 | 1.5 | 51 | 10 | 100 | – | |
| 5632 | 18.09.17 | 15 | 28 | 3.0 | 57 | 10 | 96 | – | |
| 5591_2 | 18.09.17 | 32 | 32 | 7 | 72 | 7 | 72 | – | |
| 5633 | 19.09.17 | 31 | 20 | 3 | 35 | 5 | 60 | – | |
| 5590_2 | 19.09.17 | 35 | 20 | 7 | 50 | 10 | 60 | 15 | |
| 5634 | 19.09.17 | 32 | 16 | 6.5 | 50 | 15 | 82 | 13 | |
| 5635 | 20.09.17 | 55 | 17 | 5 | 41 | 15 | 59 | 12 | |
| “Восточный склон” | 5947 | 26.08.18 | 40 | 26 | 6 | 77 | 8 | 81 | 8 |
| 5948 | 26.08.18 | 40 | 48 | 5 | 33 | 6 | 38 | 33 | |
| 5949 | 26.08.18 | 39 | 85 | 6 | 35 | 8 | 46 | 56 | |
| 5950 | 27.08.18 | 55 | 38 | 5 | 34 | 13 | 58 | 11 | |
| 5952 | 27.08.18 | 40 | 54 | 6.5 | 31 | 15 | 65 | 46 | |
| 5954 | 28.08.18 | 65 | 34 | 4 | 26 | 15 | 56 | – | |
| 5956 | 29.08.18 | 54 | 29 | 6 | 34 | 15 | 62 | 17 | |
| 5958 | 29.08.18 | 60 | 48 | 22 | 79 | 13 | 73 | 15 | |
| “Западный склон” | 5946_2 | 31.08.18 | 35 | 77 | 3.5 | 31 | 9 | 56 | 18 |
| 5945_2 | 31.08.18 | 32 | 56 | 3.5 | 41 | 9 | 68 | – | |
| 5960 | 31.08.18 | 37 | 77 | 4 | 36 | 11 | 69 | 23 | |
| 5961 | 31.08.18 | 55 | 57 | 4 | 39 | 13 | 53 | 19 | |
| 5962 | 01.09.18 | 58 | 111 | 4 | 31 | 10 | 48 | 19 | |
| 5963 | 01.09.18 | 59 | 31 | 6.5 | 42 | 11 | 55 | 16 | |
| 5964 | 02.09.18 | 45 | 78 | 4 | 22 | 13 | 51 | 44 | |
| 5965 | 02.09.18 | 55 | 26 | 6 | 50 | 6 | 50 | – |
Примечание. Hфс – толщина слоя фотосинтеза, м; ИПП – первичная продукция в столбе воды, мгС/м2 в день; Hсп – толщина слоя, формирующего поток восходящего излучения, регистрируемого сканером цвета океана (1/Kd), м; ИППсп/ИПП – вклад первичной продукции в слое Hсп в первичную продукции в столбе воды; ВПС – верхний перемешанный слой, м; ИППвпс/ИПП – вклад первичной продукции в ВПС в первичную продукции в столбе воды; ИППпхм/ИПП – вклад первичной продукции в ПХМ в первичную продукции в столбе воды (толщина ПХМ приведена в табл. 1).
Нашими исследованиями показано, что в августе–сентябре в море Лаптевых вклад ИПП, создаваемой в ПХМ, в среднем был несущественным. Максимум ПП регистрировался на поверхности и в приповерхностных слоях, а ПХМ, как правило, не сопровождался вторичным пиком первичной продукции. Эти результаты несколько противоречат представлениям, составленным по данным из других районов Арктического океана, где ПХМ сопровождался максимумом первичной продукции [17, 28, 40]. Следует отметить также, что вклад ПХМ в ИПП превышал 20% только в тех случаях, когда он располагался достаточно высоко (горизонт с Хлм ≤ 20 м), как правило, в хорошо освещенных слоях воды (табл. 3). Содержание NO2 + NO3 на этих глубинах могло быть как выше, так и ниже лимитирующих значений (табл. 2). Различными также были величины T (от –1.52 до 2.28°C). В предыдущих работах был сделан вывод о том, что содержание нитратов в ПХМ не является фактором, лимитирующим первичную продукцию [41]. Такое заключение было сделано на основании того, что, во-первых, уровень светового насыщения при потреблении нитратов в ПХМ ниже, чем при ассимиляции углерода, и, во-вторых, отсутствует зависимость скорости ассимиляции углерода от концентрации NO3. При этом уровень освещенности в ПХМ в большинстве случаев был ниже светового насыщения. Таким образом, свет может являться основным фактором, лимитирующим первичную продукцию в ПХМ [41]. Другой причиной, по-видимому, служит низкая температура воды. Известно, что, с одной стороны, температурный оптимум для роста фитопланктона находится выше 10°C [36], а с другой, не было выявлено адаптации фотосинтетических параметров к низким температурам в Арктике [47, 55].
ЗАКЛЮЧЕНИЕ
Проведенные в конце августа–начале сентября исследования вертикальной изменчивости первичной продукции и хл “а” в море Лаптевых выявили разнообразие форм кривых последнего показателя. Распределение первичной продукции по глубине было более однообразным с максимумом на поверхности или близко к ней. Не было обнаружено повсеместного присутствия ПХМ в вертикальном распределении хл “а”. Он был отмечен на открытом шельфе (>50 м) и в районе континентального склона. Первичная продукции формировалась, в основном, в ВПС. Вклад ПХМ в интегральные значения ПП на большинстве станций не превышал 20%. Более значительный вклад (до 56%) в ИПП был отмечен, когда ПХМ располагался в верхних, хорошо освещенных слоях эвфотической зоны.
Источники финансирования. Работа выполнена в рамках Государственного задания № 0149-2019-0008. Данные по продукционным показателям фитопланктона получены при поддержке Гранта РФФИ № 18-05-60 069. Гидрофизические данные получены при поддержке Гранта РФФИ № 18-05-60 302.
Список литературы
Ведерников В.И. Особенности распределения первичной продукции и хлорофилла в Черном море в весенний и летний периоды // Изменчивость экосистемы Черного моря: естественные и антропогенные факторы / Ред. Виноградов М.Е. М.: Наука, 1991. С. 128–147.
Демидов А.Б., Гагарин В.И., Арашкевич Е.Г. и др. Пространственная изменчивость первичной продукции и хлорофилла в море Лаптевых в августе–сентябре // Океанология. 2019. Т. 59. № 5. С. 755–770.
Суханова И.Н., Флинт М.В., Георгиева Е.Ю. и др. Структура сообществ фитопланктона в восточной части моря Лаптевых // Океанология. 2017. Т. 57. № 1. С. 86–102.
Ahn S.H., Whitledge T., Stockwell D.A. et al. The biochemical composition of phytoplankton in the Laptev and East Siberian seas during the summer of 2013 // Pol. Biol. 2019. V. 42. № 1. P. 133–148.
Ardyna M., Babin M., Gosselin M. et al. Parameterization of vertical chlorophyll a in the Arctic Ocean: impact of the subsurface chlorophyll maximum on regional, seasonal and annual primary production estimates // Biogeosciences. 2013. V. 10. № 3. P. 1345–1399.
Arrigo K.R., Matrai P.A., van Dijken G.L. Primary productivity in the Arctic Ocean: Impacts of complex optical properties and subsurface chlorophyll maxima on large-scale estimates // J. Geophys. Res. 2011. V. 116. C11022. https://doi.org/10.1029/2011JC007273
Arrigo K.R., van Dijken G.L. Secular trends in Arctic Ocean net primary production // J. Geophys. Res. 2011. V. 116. C09011. https://doi.org/10.1029/2011JC007151
Babin M., Bélanger S., Ellingsen I. et al. Estimating of primary production in the Arctic Ocean using ocean color remote sensing and coupled physical-biological models: strengths, limitations and how they compare // Progr. Oceanogr. 2015. V. 139. P. 197–220.
Behrenfeld M.J., Falkowski P.G. A consumer’s guide to phytoplankton primary productivity models // Limnol. and Oceanogr. 1997. V. 42. P. 1479–1491.
Bhavya P.S., Lee J.H., Lee H.W. et al. First in situ estimations of small phytoplankton carbon and nitrogen uptake rates in the Kara, Laptev and East Siberian seas // Biogeosciences. 2018. V. 15. № 18. P. 5503–5517.
Booth B.C., Larouche P., Bélanger S. et al. Dynamics of Chaetoceros socialis in the North Water // Deep-Sea Res. II. 2002. V. 49. № 22–23. P. 5003–5025.
Brown Z.W., Lowry K.E., Palmer M.A., van Dijken G.L., Mills M.M., Pickart R.S., Arrigo K.R. Characterizing the subsurface chlorophyll a maximum in the Chukchi Sea and Canada Basin // Deep-Sea Res. II. 2015. V. 118. P. 88–104.
Campbell J., Antoine D., Armstrong R. et al. Comparison of algorithms for estimating ocean primary production from surface chlorophyll, temperature, and irradiance // Global Biogeochem. Cycles. 2002. V. 16. https://doi.org/10.1029/2001GB001444
Carr M.-E., Friedrichs M.A.M., Schmeltz M. et al. A comparison of global estimates of marine primary production from ocean color // Deep-Sea Res. II. 2006. V. 53. P. 741–770.
Carmack E.C., Macdonald R.W., Jasper S. Phytoplankton productivity on the Canadian Shelf of the Beaufort Sea // Mar. Ecol. Progr. Ser. 2004. V. 277. P. 37–50.
Cherkasheva A., Nöthig E.M., Bauerfeind E., Melsheimer C., Bracher A. From the chlorophyll-a in the surface layer to its vertical profile: a Greenland Sea relationship for satellite applications // Ocean Science. 2013. V. 9. P. 431–445.
Cota G.F., Pomeroy L.R., Harrison W.G. et al. Nutrients, primary production and microbial heterotrophy in the southeastern Chukchi Sea: Arctic summer nutrient depletion and heterotrophy // Mar. Ecol. Progr. Ser. 1996. V. 135. P. 247–258.
Cullen J.J. Subsurface chlorophyll maximum layers: enduring enigma or mystery solved? // Annu. Rev. Mar. Sci. 2015. V. 7. P. 207–239.
Demidov A.B., Gagarin V.I., Vorobieva O.V. et al. Spatial and vertical variability of primary production in the Kara Sea in July and August 2016: The influence of the river plume and subsurface chlorophyll maxima // Pol. Biol. 2018. V. 41. № 3. P. 563–578.
Demidov A.B., Kopelevich O.V., Mosharov S.A. et al. Modelling Kara Sea phytoplankton primary production: Development and skill assessment of regional algorithms // J. Sea Res. 2017. V. 125. P. 1–17.
Demidov A.B., Mosharov S.A., Makkaveev P.N. Patterns of the Kara Sea primary production in autumn: Biotic and abiotic forcing of subsurface layer // J. Mar. Sys. 2014. V. 132. P. 130–149.
Erga S.R., Ssebionga N., Hamre B. et al. Environmental control of phytoplankton distribution and photosynthetic performance at the Jan Mayen Front in the Norwegian Sea // J. Mar. Sys. 2014. V. 130. P.193–205.
Ferland J., Gosselin M., Starr M. Environmental control of summer primary production in the Hudson Bay system: The role of stratification // J. Mar. Sys. 2011. V. 88. P. 385–400.
Friedrichs M.A.M., Carr M.-E., Barber R. et al. Assessing the uncertainties of model estimates of primary productivity in the tropical Pacific Ocean // J. Mar. Sys. 2009. V. 76. P. 113–133.
Gordon H.G., Morel A. Remote assessment of ocean color for interpretation of satellite visible imagery: a review. New York: Springer, 1983. 114 p.
Hansen H.P., Koroleff F. Determination of nutrients // Methods of Seawater Analysis / Eds. Grashoff K. et al. Weinheim, NewYork, Chichester, Brisbane, Singapore, Toronto: Wiley-VCH, 1999. P. 149–228.
Heiskanen A.-S., Keck A. Distribution and sinking rates of phytoplankton, detritus and particulate biogenic silica in the Laptev Sea and Lena River (Arctic Siberia) // Mar. Chem. 1996. V. 53. P. 229–245.
Hill V., Cota G. Spatial patterns of primary production on the shelf, slope and basin of the Western Arctic in 2002 // Deep-Sea Res. II. 2005. V. 57. № 24–26. P. 3344–3354.
Hill V.J., Matrai P.A., Olson E. et al. Synthesis of integrated primary production in the Arctic Ocean: II. In situ and remotely sensed estimates // Progr. Oceanogr. 2013. V. 110. P. 107–125.
Holm-Hansen O., Lorenzen C.J., Holmes R.W., Strickland J.D.H. Fluorometric determination of chlorophyll // J. Cons. Perm. Int. Explor. Mer. 1965. V. 30. P. 3–15.
Holm-Hansen O., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V. 30. P. 438–447.
Jerlov H.G. Optical oceanography. New York: Elsevier, 1968. 194 p.
Jin M., Deal C., Lee S.H. et al. Investigation of Arctic sea and ocean primary production for the period 1992–2007 using a 3-D global ice-ocean ecosystem model // Deep-Sea Res. II. 2012. V. 81–84. P. 28–35.
Juterzenka K.V., Knickmeier K. Chlorophyll a distribution in water column and sea ice during the Laptev Sea freeze-up study in Autumn 1995 // Land-ocean systems in the Siberian Arctic: Dynamics and history / Eds. Kassens et al. Berlin: Springer, 1999. P. 153–160.
Lee Y.J., Matrai P.A., Friedrichs M.A.M. et al. An assessment of phytoplankton primary productivity in the Arctic Ocean from satellite ocean color/in situ chlorophyll-a based models // J. Geophys. Res. 2015. V. 120. https://doi.org/10.1002/2015/JC11018
Li W. Photosynthetic response to temperature on marine phytoplankton along a latitudinal gradient (16° N to 74° N) // Deep-Sea Res. 1985. V. 32. № 11. P. 1381–1391.
Lohrenz S.E. Estimation of primary production by the simulated in situ method // ICES mar. Sci. Symp. 1993. V. 197. P. 159–171.
Makkaveev P.N. The total alkalinity in the anoxic waters of the Black sea and in sea-river mixture zones. Intergovermental Oceanographic Commission. Joint IOC-JGOFS CO2 Advisory Panel Meeting. Seven Session. Annex V. UNESCO, 1998.
Martin J., Dumont D., Tremblay J.-E. Contribution of subsurface chlorophyll maxima to primary production in the coastal Beaufort Sea (Canadian Arctic): A model assessment // J. Geophys. Res. 2013. V. 118. № 11. P. 5873–6318.
Martin J., Tremblay J.-E., Gagnon J. et al. Prevalence, structure and properties of subsurface chlorophyll maxima in Canadian Arctic waters // Mar. Ecol. Progr. Ser. 2010. V. 412. P. 69–84.
Martin J., Tremblay J.-E., Price N.M. Nutritive and photosynthetic ecology of subsurface chlorophyll maxima in Canadian Arctic waters // Biogeosciences. 2012. V. 9. № 12. P. 5353–5371.
Martini K.I., Stabeno P.J., Ladd C. Dependence of subsurface chlorophyll on seasonal water masses in the Chukchi Sea // J. Geophys. Res. 2016. V. 121. P. 1755–1770. https://doi.org/10.1002/2015JC011359
McLaughlin F.A., Carmack E.C. Deepening of the nutricline and chlorophyll maximum in the Canada Basin interior, 2003–2009 // Geophys. Res. Lett. 2010. V. 37. L24602. https://doi.org/10.1029/2010GL045459
Millero F.J. Thermodynamics of the carbon dioxide system in oceans // Geochim. et Cosmochim. Acta. 1995. V. 59. № 4. P. 661–677.
Morel A., Berthon J.-F. Surface pigments, algal biomass profiles, and potential production of the euphotic layer: Relationships reinvestigated in view of remote-sensing applications // Limnol. Oceanogr. 1989. V. 34. № 1. P. 1545–1562.
Pabi S., van Dijken G.L., Arrigo K.R. Primary production in the Arctic Ocean, 1998–2006 // J. Geophys. Res. 2008. V. 113. C08005. https://doi.org/10.1029/2007/JC004578
Platt T., Harrison W.G., Irwin B. et al. Photosynthesis and photoadaptation of marine phytoplankton in the Arctic // Deep-Sea Res. 1982. V. 29. № 10. P. 1159–1170.
Platt T., Sathyendranath S., Ulloa O. et al. Ocean primary production and available light: further algorithms for remote sensing // Deep-Sea Res. I. 1988. V. 35. P. 855–879.
Popova E.E., Yool A., Coward A.C. et al. Control of primary production in the Arctic by nutrients and light: insights from a high resolution ocean general circulation model // Biogeosciences. 2010. V. 7. № 11. P. 3569–3591.
Popova E.E., Yool A., Coward A.C. et al. What controls primary production in the Arctic Ocean? Results from an intercomparison of five general circulation models with biogeochemistry // J. Geophys. Res. 2012. V. 117. C00D12. 16 PP. https://doi.org/10.1029/2011JC007112
Ryther J.H., Yentsch C.S. The estimation of phytoplankton production in the ocean from chlorophyll and light data // Limnol. Oceanogr. 1957. V. 2. P. 281–286.
Saba V., Friedrichs M.A.M., Antoine D. et al. An evaluation of ocean color model estimates of marine primary productivity in coastal and pelagic regions across the globe // Biogeosciences. 2011. V. 8. P. 489–503.
Saba V., Marjorie S., Friedrichs M.A.M. et al. Challenges of modeling depth-integrated marine primary productivity over multiple decades: A case study at BATS and HOT // Global Biogeochem. Cycles. 2010. V. 24. GB3020. https://doi.org/10.1029/2009GB003655
Schourup-Kristensen V., Wekerle C., Wolf-Gladrow D.A., Völker C. Arctic Ocean biogeochemistry in the high resolution FESOM 1.4-REcoM2 // Progr. Oceanogr. 2018. V. 168. P. 65–81.
Smith W.O., Harrison W.G. New production in polar regions: the role of environmental controls // Deep-Sea Res. 1991. V. 38. № 12. P. 1463–1479.
Sorokin Yu.I., Sorokin P.Yu. Plankton and primary production in the Lena river estuary and in the south-eastern Laptev Sea // Estuar. Coast. Shelf Sci. 1996. V. 43. P. 399–418.
Steemann Nielsen E. The use of radioactive carbon (C14) for measuring organic production in the sea // J. Cons. Perm. Ins. Explor. Mer. 1952. № 18. P. 117–140.
Steemann Nielsen E. Experimental methods for measuring organic production in the sea // Rapp. P.-v. Réun. Cons. perm. int. Explor. Mer. 1958. V. 144. P. 38–46.
Steiner N.S., Sou T., Deal C. et al. The future of the subsurface chlorophyll-a maximum in the Canada Basin—A model intercomparison // J. of Geophys. Res. V. 121. P. 387–409. https://doi.org/10.1002/2015JC011232
Timmermans M.L., Cole S., Toole J. Horizontal density structure and restratification of the Arctic Ocean surface layer // J. Phys. Oceanogr. 2012. V. 42. № 4. P. 659–668.
Tremblay J-É., Michel C., Hobson K.A. Bloom dynamics in early opening waters of the Arctic Ocean // Limnol. Oceanogr. 2006. V. 51. № 2. P. 900–912.
Tremblay J-É., Simpson K., Martin J. et al. 2008. Vertical stability and the annual dynamics of nutrients and chlorophyll fluorescence in the coastal, southeast Beaufort Sea // J. of Geophys. Res. 2008. V. 113. C07S90. https://doi.org/10.1029/2007JC004547
Tuschling K. Phytoplankton ecology in the arctic Laptev Sea – a comparison of three seasons // Ber. Polarforschung. 2000. № 347. 144 p.
Uitz J., Claustre H., Morel A., Hooker S.B. Vertical distribution of phytoplankton communities in open ocean: An assessment on surface chlorophyll // J. Geophys. Res. 2006. V. 111. C08005. https://doi.org/10.1029/2005JC003207
Дополнительные материалы отсутствуют.


