Океанология, 2020, T. 60, № 3, стр. 364-380
Распределение полихет на шельфе моря Лаптевых и новосибирском мелководье и его связь с абиотическими факторами
В. Л. Семин 1, 2, *, О. Л. Зимина 3
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Южный научный центр РАН
Ростов-на-Дону, Россия
3 Мурманский морской биологический институт КНЦ РАН
Мурманск, Россия
* E-mail: svinovod@yandex.ru
Поступила в редакцию 02.08.2018
После доработки 21.06.2019
Принята к публикации 16.12.2019
Аннотация
В работе проанализировано распределение полихет на шельфе моря Лаптевых и Новосибирском мелководье по данным 115 донных тралений в августе–октябре 2014 г. Полихеты были наиболее богатой в видовом отношении группой (83 таксона, 74 определено до вида). По видовому составу было выделено два фаунистических комплекса полихет – прибрежный и мористый. Граница их распространения не совпадала с границами комплексов, выделенных для остальных групп тралового бентоса. В юго-западной части моря Лаптевых она совпадала с границей между положительными и отрицательными придонными температурами, а на Новосибирском мелководье – с изогалиной 28 PSU. В прибрежном комплексе преобладали широко распространенные по акватории моря виды. Характерными для него были только пять видов, относящихся к собирающим детритофагам и плотоядным. К мористому комплексу были приурочены 26 видов, относящиеся ко всем трофическим группировкам. Кроме того, доля редких видов в мористом комплексе была существенно больше, чем в прибрежном.
ВВЕДЕНИЕ
Море Лаптевых – одно из самых труднодоступных и ледовитых морей восточной Арктики. Тем не менее, в последние годы степень его изученности существенно возросла. В результате существовавшее в XX в. представление о крайней бедности и низкой продуктивности биоты моря Лаптевых в настоящее время пересмотрено [15].
Море Лаптевых испытывает мощное влияние речного стока – из морей Российской Арктики только Карское море получает больший объем пресной воды [1]. В южных прибрежных районах опресненный прогретый поверхностный слой воды соприкасается с дном, непосредственно влияя на бентосные организмы. Большая часть шельфа занята поверхностными арктическими водами [4]. С севера в море заходят более соленые и теплые атлантические воды [30, 32]. Грунты представлены как жесткими (скалы, валуны, галька – во многих районах в прибрежье до глубин 5–20 м), так и рыхлыми (ил, глина, в зоне влияния выноса рек – песок) [12]. Имеются обширные области с железо-марганцевыми конкрециями, служащими наряду с затопленной древесиной субстратом для прикрепленных организмов за пределами распространения жестких грунтов. Такая неоднородность гидрологических и литологических параметров создает высокое разнообразие условий обитания донных беспозвоночных.
Сведения о фауне моря, полученные в советский период, обобщены в [16]. На рубеже XX–XXI вв. в рамках российско-германской программы “Система моря Лаптевых” был проведен ряд международных экспедиций, существенно расширивших знания как об абиотических условиях, так и о фауне этого водоема (см., например, [15, 14 ]). Работы по этой программе продолжаются и в настоящее время. С 2015 г. в море Лаптевых активно работает Институт океанологии РАН [24, 32]. В 2017 г. А.А. Ведениным была защищена диссертация по донным сообществам морей Сибирской Арктики, включавшая материал по морю Лаптевых [2]. Однако преимущественное использование для сбора материала дночерпателей приводит к недоучету группы крупных и подвижных редко распределенных животных [28, 22 ], которые плохо облавливаются этими орудиями [9]. Исследование же приловов беспозвоночных в донных ихтиологических тралах при широкомасштабных ихтиологических съемках позволяет учитывать крупные формы бентосных организмов, имеющих низкую плотность поселения, а также получать информацию о распределении редких видов животных, вероятность попадания которых в дночерпатель низка [9, 26]. При этом показано, что роль таких животных в арктических донных сообществах значительно больше, чем ранее было принято считать [29]. В недавних съемках ИО РАН использовался трал Сигсби, однако в работе [2] описаны по преимуществу большие глубины, в то время как шельфовая часть моря Лаптевых была охвачена слабо.
Полихеты являются одной из наиболее богатых в видовом отношении групп морских беспозвоночных, играющей важную роль в донных сообществах. Повсеместное распространение и большое число видов даже в районах с обедненной фауной [5] в сочетании с высоким разнообразием жизненных форм и наличием представителей всех трофических групп делают полихет прекрасным объектом для изучения связи экологических характеристик с факторами среды. Целью данной работы было изучение таксоцена полихет на шельфе моря Лаптевых и Новосибирском мелководье по траловым сборам, и связи распределения этой группы с абиотическими факторами.
МАТЕРИАЛЫ И МЕТОДЫ
В июле–октябре 2014 г. Мурманским морским биологическим институтом на НИС “Дальние Зеленцы” проведена площадная траловая съемка на акватории моря Лаптевых и Новосибирского мелководья до границы континентального склона. В основу данной работы легло 51 траление в юго-западной части моря Лаптевых (далее ЮЗМЛ) и 68 тралений на Новосибирском мелководье (далее НСМ) в диапазоне глубин 10–255 м. Схема станций представлена на рис. 1, список станций с координатами и глубинами представлен в табл. 1. Донные траления проводили учетно–промысловым разноглубинным тралом с ячеей в кутовой части мешка 135 мм и вставкой с ячеей 12 мм в каждой точке в течение 30 мин на скорости 3 узла. На глубинах менее 15 м использовался трал Сигсби (длина рамы 1 м, высота 30 см, размер ячеи вставки 7 мм), который буксировали по дну 10 мин со скоростью 2 узла. Выбранных из трала полихет определяли на борту судна до наименьшего возможного таксономического уровня, фотографировали в прижизненной окраске, а затем фиксировали 4% раствором формальдегида для дальнейшего более точного определения на берегу. Всего обработано 94 пробы из донных тралов и 20 – из тралов Сигсби, еще в четырех пробах из ЮЗМЛ и 2 пробах с НСМ полихеты отсутствовали. Тип грунта определяли по пробам, собранным дночерпателем Ван-Вина. Придонные соленость и температуру определяли по данным CTD-зонда SBE 19plus.
Рис. 1.
Схема выполненных станций и распределение фаунистических комплексов в юго-западной части моря Лаптевых (ЮЗМЛ) и на Новосибирском мелководье (НСМ). 1 – станции, на которых полихеты отмечены не были; прибрежный комплекс: 2 – тепловодные станции (ЮЗМЛ), 3 – опресненные станции (НСМ); 4 – переходные станции 30–40 м (ЮЗМЛ); мористый комплекс: 5 – станции 29–33 PSU (НСМ), 6 – холодноводные станции (ЮЗМЛ), 7 – станции >33 PSU (НСМ); 8 – предположительно, верхняя граница комплекса континентального склона.
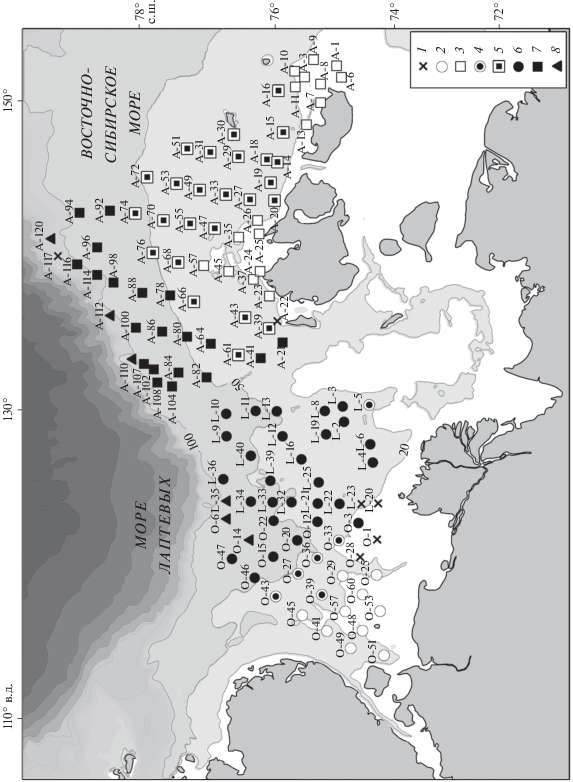
Таблица 1.
Станции, выполненные на шельфе моря Лаптевых и Новосибирском мелководье
| Станция | Широта, °с.ш. | Долгота, °в.д. | Глубина, м | Станция | Широта, °с.ш. | Долгота, °в.д. | Глубина, м |
|---|---|---|---|---|---|---|---|
| A-1 | 75.02333 | 152.3567 | 14 | A-108 | 77.76167 | 131.86 | 77 |
| A-3 | 75.55167 | 151.645 | 15 | A-109 | 78.05 | 132.9383 | 307 |
| A-6 | 74.96667 | 151.6333 | 13 | A-110 | 78.07167 | 133.4067 | 240 |
| A-7 | 75.28167 | 149.98 | 13 | A-112 | 78.385 | 136.185 | 255 |
| A-8 | 75.29 | 151.1733 | 15 | A-114 | 78.55333 | 138.795 | 125 |
| A-9 | 75.40333 | 152.7667 | 13 | A-116 | 78.805 | 139.4833 | 99 |
| A-10 | 75.72667 | 152.035 | 22 | A-117 | 79.04667 | 140.0317 | 277 |
| A-11 | 75.7 | 150.9867 | 22 | A-120 | 79.13333 | 141.175 | 259 |
| A-13 | 75.51833 | 148.535 | 14 | L-2 | 74.89833 | 129.2617 | 37 |
| A-14 | 75.99167 | 146.1667 | 32 | L-3 | 74.88167 | 130.2583 | 33 |
| A-15 | 75.89333 | 148.0617 | 30 | L-4 | 74.40167 | 126.6283 | 38 |
| A-16 | 75.97333 | 150.7517 | 30 | L-5 | 74.46333 | 130.3583 | 22 |
| A-18 | 76.14833 | 146.3017 | 35 | L-6 | 74.47 | 127.8367 | 33 |
| A-19 | 76.09167 | 144.7967 | 36 | L-8 | 75.22 | 129.9667 | 40 |
| A-20 | 76.03 | 143.6433 | 30 | L-9 | 76.76 | 128.3367 | 62 |
| A-21 | 75.90333 | 134.4883 | 43 | L-10 | 76.78 | 129.8033 | 63 |
| A-22 | 75.99167 | 135.8167 | 20 | L-11 | 76.32333 | 129.965 | 51 |
| A-23 | 76.10833 | 137.4233 | 20 | L-12 | 75.90167 | 128.3267 | 42 |
| A-24 | 76.26167 | 139.0433 | 15 | L-13 | 75.99333 | 129.9567 | 48 |
| A-25 | 76.27833 | 141.4767 | 9 | L-16 | 75.60333 | 126.835 | 40 |
| A-26 | 76.30333 | 142.365 | 17 | L-19 | 75.19833 | 128.4633 | 36 |
| A-27 | 76.40667 | 143.7 | 29 | L-20 | 74.3 | 124.0 | 13 |
| A-29 | 76.59 | 146.4967 | 36 | L-21 | 75.355 | 123.9133 | 41 |
| A-30 | 76.655 | 147.9033 | 36 | L-22 | 74.975 | 123.95 | 46 |
| A-31 | 77.00333 | 146.7583 | 33 | L-23 | 74.625 | 123.9417 | 24 |
| A-33 | 76.77333 | 144.0333 | 36 | L-25 | 75.32 | 125.34 | 37 |
| A-35 | 76.58 | 141.2633 | 13 | L-32 | 75.75833 | 124.045 | 45 |
| A-37 | 76.35833 | 138.51 | 19 | L-33 | 76.05667 | 124.0167 | 54 |
| A-39 | 76.11167 | 135.3467 | 21 | L-34 | 76.395 | 124.1033 | 64 |
| A-41 | 76.25833 | 133.4267 | 37 | L-35 | 76.765 | 124.1617 | 92 |
| A-43 | 76.485 | 136.0433 | 22 | L-36 | 76.80833 | 125.555 | 76 |
| A-45 | 76.72833 | 139.0383 | 22 | L-39 | 76.095 | 125.44 | 48 |
| A-47 | 76.93167 | 141.81 | 22 | L-40 | 76.39333 | 127.0667 | 49 |
| A-49 | 77.16167 | 144.295 | 40 | O-1 | 74.32667 | 121.6233 | 11 |
| A-51 | 77.33333 | 146.9833 | 38 | O-3 | 74.64667 | 122.71 | 10 |
| A-53 | 77.48333 | 144.74 | 40 | O-12 | 75.33833 | 122.7867 | 45 |
| A-55 | 77.295 | 142.135 | 35 | O-14 | 76.425 | 121.6283 | 83 |
| A-57 | 77.09667 | 139.4133 | 18 | O-15 | 76.04667 | 120.5217 | 55 |
| A-61 | 76.57833 | 133.6317 | 32 | O-16 | 76.765 | 122.9883 | 92 |
| A-64 | 76.99167 | 134.3367 | 32 | O-20 | 75.66833 | 121.59 | 58 |
| A-66 | 77.23167 | 137.065 | 33 | O-22 | 76.045 | 122.8467 | 53 |
| A-68 | 77.45833 | 139.64 | 34 | O-25 | 74.32833 | 119.3383 | 19 |
| A-70 | 77.66667 | 142.3517 | 41 | O-27 | 75.655 | 119.415 | 39 |
| A-72 | 77.89 | 145.1517 | 48 | O-28 | 74.62167 | 120.4817 | 14 |
| A-74 | 78.04833 | 142.795 | 52 | O-29 | 74.92667 | 119.2583 | 23 |
| A-76 | 77.80667 | 140.2633 | 46 | O-33 | 74.98333 | 121.57 | 19 |
| A-78 | 77.575 | 137.465 | 45 | O-36 | 75.34333 | 120.43 | 40 |
| A-80 | 77.33333 | 134.7833 | 45 | O-39 | 75.26667 | 118.05 | 25 |
| A-82 | 77.05167 | 132.1633 | 42 | O-41 | 75.175 | 115.7133 | 21 |
| A-84 | 77.455 | 132.47 | 58 | O-43 | 76.01 | 117.9383 | 36 |
| A-86 | 77.685 | 135.1283 | 55 | O-45 | 75.58833 | 116.72 | 19 |
| A-88 | 77.955 | 137.635 | 58 | O-46 | 76.33833 | 119.15 | 54 |
| A-92 | 78.385 | 142.95 | 62 | O-47 | 76.68167 | 120.3867 | 65 |
| A-94 | 78.77667 | 142.8367 | 86 | O-48 | 74.58167 | 115.7233 | 15 |
| A-96 | 78.55333 | 140.5883 | 73 | O-49 | 74.78333 | 114.5833 | 30 |
| A-98 | 78.33833 | 138.3 | 75 | O-51 | 74.19833 | 114.15 | 30 |
| A-100 | 78.04167 | 135.385 | 69 | O-53 | 74.27667 | 116.9983 | 10 |
| A-102 | 77.79833 | 132.6817 | 64 | O-57 | 74.87667 | 116.9633 | 18 |
| A-104 | 77.54667 | 131.575 | 65 | O-60 | 74.58 | 118.0817 | 19 |
| A-107 | 77.94833 | 133.0783 | 71 |
На берегу проводили подсчет и идентификацию полихет, в первую очередь с помощью определителя полихет Северного Ледовитого океана [5], а также ряда работ, посвященных отдельным группам [8, 18, 23, 27, 33]. Валидность названий проверялась по базе данных WORMS [34].
Статистическую обработку проводили в программах Microsoft Excel 2007 и Primer 6.1.16 с расширением Permanova 1.0.6 [17, 20]. Температурную и соленостную приуроченность видов определяли по графику зависимости численности от соответствующего фактора. Ординацию выполняли методом неметрического многомерного шкалирования (nMDS) и канонического анализа главных координат с использованием перестановочных тестов – пермутаций (CAP, в составе расширения Permanova). Для предварительного выделения границ фаунистических комплексов станции ранжировали по значениям факторов (шаг для глубины – 10 м, для солености – 1 PSU, для температуры – 1°С), вычисляли дистанции между центроидами и проводили анализ главных координат (Principal Coordinates, PCO). Полученную группировку проверяли методом ANOSIM (достоверным считали уровень значимости 0.1%). Выбор этого метода был обусловлен тем, что ANOSIM, в отличие от PERMANOVA, устойчив к выбору меры сходства/расстояния [17], что позволяет использовать его для сравнения результатов, полученных с использованием индексов Брея-Кертиса и Theta+. Регрессионный анализ проводили с помощью процедуры DistLM (Distance-based Linear Models). Достоверными считали значения P < 0.01. Так как для нескольких станций не была доступна информация по температуре и солености, число станций при анализе влияния факторов было меньше общего (94 станции). Матрицы сходства для ANOSIM, PCO и DistLM рассчитывали на основе индекса Брея-Кертиса [19] и индекса таксономической обособленности Theta+ [21]. Для анализа трофической структуры мы использовали индекс Theta+ с трофической классификацией в качестве агрегирующей матрицы (табл. 2).
Таблица 2.
Схема трофических уровней, использованная в анализе
| Макрофаги | Микрофаги | Полифаги | Симбиотрофы | ||||||
|---|---|---|---|---|---|---|---|---|---|
| хищники | падальщики | детритофаги | сестонофаги | – | – | ||||
| засадные | активные охотники | сосущий тип питания | – | глотатели (грунтоеды) | собиратели | фильтрующие с помощью жаберной кроны | использующие слизистую сеть | – | – |
Следует отметить, что, хотя траловые сборы не дают представления об абсолютных значениях численности и биомассы, они позволяют сравнивать относительное обилие организмов в пределах съемки, принимая, что различие в уловистости различных видов и их группировок оставалось одинаковым в течение периода исследований [10]. В траловых приловах таких, в целом некрупных, организмов, как полихеты, биомасса подвержена большей ошибке, чем численность, так как чем меньше линейный размер (а соответственно и индивидуальная масса) животного, тем меньше вероятность его попадания в трал. Поэтому для расчета индекса Брея–Кертиса в качестве меры относительного обилия мы использовали численности на траление, стандартизованные и лог-трансформированные. Биомассу для количественного анализа не использовали, однако учитывали при качественном описании некоторых биотопов (станции с массовым развитием Harmothoe globifera и Flabelligera affinis).
Анализ полных и редуцированных данных. DistLM-анализ, кроме полных данных, был проведен по выборке из четырех семейств: Polynoidae, Nephtyidae, Ampharetidae и Sabellidae. Целью такой редукции было отсечение “шумов”, вносимых группами, распределение которых не имело четко выраженной закономерности или отличалось от основной группы (например, Flabelligeridae). Чтобы выбрать семейства для анализа, предварительно был проведен отдельный анализ по каждому из семейств, представленных несколькими видами, и общий для семейств, представленных одним-тремя видами. Результаты сравнивали между собой, и были отобраны семейства, распределение которых проявляло общие зависимости от абиотических факторов.
РЕЗУЛЬТАТЫ
Всего на обследованной акватории было отмечено 83 таксона полихет, относящихся к 22 семействам; из них 74 определено до вида. Наряду с ракообразными, полихеты были наиболее богатой в видовом отношении группой в траловых сборах. Наиболее широко представлены были семейства Polynoidae (13 видов), Terebellidae (12 таксонов), Ampharetidae (9 видов), Sabellidae (8 видов), Nephtyidae (7 видов) и Flabelligeridae (6 таксонов); остальные семейства были представлены одним-четырьмя видами. Интересно, что при этом наибольшая встречаемость (61% по всей акватории, 75 и 51% в ЮЗ части моря и на Новосибирском мелководье соответственно) отмечена для Nereis zonata – практически единственного представителя семейства Nereididae в пробах. В целом, по встречаемости отмеченные виды полихет разделялись на три группы. Первая, относительно немногочисленная, группа характеризовалась встречаемостью в пределах 40–75% и большим относительным обилием. Основная же часть видов разделялась на две примерно равные части: с встречаемостью ниже 5%, и от 5 до 30%. Для многих видов встречаемость существенно различалась в ЮЗМЛ и на НСМ. В целом, для ЮЗМЛ характерна большая доля широко распространенных видов и меньшая – редких, по сравнению с НСМ, что отражает значительно более высокую мозаичность биотопов последнего (см. ниже). Список таксонов и их встречаемость по районам представлены в табл. 3.
Таблица 3.
Список таксонов, их встречаемость (%) на исследованной акватории и приуроченность к фаунистическому комплексу (для таксонов с встречаемостью более 5%)
| Таксон | Встречаемость | Комплекс | ||
|---|---|---|---|---|
| ЮЗМЛ | НСМ | вся обследованная акватория | ||
| Сем. Phyllodocidae | ||||
| Paranaitis wahlbergi (Malmgren, 1865) | 10 | 1 | 5 | мор |
| Phyllodoce groenlandica Örsted, 1842 | – | 3 | 2 | |
| Phyllodoce maculata (Linnaeus, 1767) | 2 | – | 1 | |
| Phyllodoce mucosa Örsted, 1843 | 8 | 3 | 5 | н/о |
| Сем. Polynoidae | ||||
| Antinoe finmarchica Malmgren, 1867 | 2 | 1 | 2 | |
| Bylgides elegans (Théel, 1879) | 10 | 6 | 8 | прибр |
| Bylgides groenlandicus (Malmgren, 1867) | 4 | 1 | 3 | |
| Bylgides promamme (Malmgren, 1867) | 42 | 18 | 28 | мор |
| Eunoe oerstedi Malmgren, 1866 | 6 | 9 | 8 | п/мор |
| Gattyana ciliata Moore, 1902 | 4 | 1 | 3 | |
| Gattyana cirrhosa (Pallas, 1766) | 29 | 10 | 18 | н/о |
| Harmothoe antilopes McIntosh, 1876 | 8 | – | 3 | н/о |
| Harmothoe globifera (Sars G.O., 1873) | 48 | 37 | 42 | п/мор |
| Harmothoe imbricata (Linnaeus, 1767) | 15 | 10 | 12 | прибр |
| Harmothoe impar impar (Johnston, 1839) sensu Malmgren, 1865 | 2 | – | 1 | |
| Harmothoe rarispina (M. Sars, 1861) | 21 | 16 | 18 | н/о |
| Melaenis loveni Malmgren, 1866 | 8 | 3 | 5 | Мор |
| Сем. Nephtyidae | ||||
| Aglaophamus malmgreni (Théel, 1879) | 52 | 60 | 57 | п/мор |
| Micronephthys neotena (Noyes, 1980) | – | 1 | 1 | |
| Nephtys caeca (Fabricius, 1780) | 6 | 4 | 5 | Прибр |
| Nephtys ciliata (Müller, 1788) | 21 | 24 | 23 | н/о |
| Nephtys longosetosa Örsted, 1842 | 4 | 3 | 3 | |
| Nephtys paradoxa Malm, 1874 | 10 | 22 | 17 | п/мор |
| Nephtys pente Rainer, 1984 | – | 1 | 1 | |
| Сем. Nereididae | ||||
| Eunereis longissima (Johnston, 1840)? | – | 1 | 1 | |
| Nereis zonata Malmgren, 1867 | 75 | 51 | 61 | п/мор |
| Сем. Syllidae | ||||
| Myrianida sp. | 4 | – | 2 | |
| Exogoninae gen. sp. | 2 | – | 1 | |
| Syllinae gen. sp. | 4 | – | 2 | |
| Сем. Sphaerodoridae | ||||
| Sphaerodorum gracilis (Rathke, 1843) | 4 | – | 2 | |
| Sphaerodoridae gen. sp. | 2 | – | 1 | |
| Сем. Onuphiidae | ||||
| Nothria hyperborea (Hansen, 1878) | 21 | 25 | 23 | п/мор |
| Сем. Lumbrineridae | ||||
| Scoletoma fragilis (O.F. Müller, 1776) | 10 | 9 | 10 | Мор |
| Сем. Spionidae | ||||
| Laonice cirrata (M. Sars, 1851) | 2 | – | 1 | |
| Сем. Cirratulidae | ||||
| Cirratulus cirratus (O. F. Müller, 1776) | 10 | 3 | 6 | Мор |
| Сем. Flabelligeridae | ||||
| Brada granulosa Hansen, 1882 | 23 | 19 | 21 | п/мор |
| Brada incrustata Støp-Bowitz, 1948 | 4 | 13 | 10 | п/мор |
| Brada inhabilis (Rathke, 1843) | 2 | 1 | 2 | |
| Brada villosa (Rathke, 1843) | 2 | – | 1 | |
| Diplocirrus sp. | 4 | 9 | 7 | п/мор |
| Flabelligera affinis M. Sars, 1829 | 52 | 27 | 37 | п/мор |
| Сем. Scalibregmidae | ||||
| Polyphysia crassa (Örsted, 1843) | 10 | 15 | 13 | п/мор |
| Scalibregma inflatum Rathke, 1843 | 13 | 13 | 13 | н/о |
| Сем. Opheliidae | ||||
| Ophelia sp. | 4 | 1 | 3 | |
| Ophelina acuminata Örsted, 1843 | 4 | – | 2 | |
| Сем. Orbiniidae | ||||
| Scoloplos spp. | – | 1 | 1 | |
| Сем. Maldanidae | ||||
| Maldane arctica Detinova, 1985 | 2 | – | 1 | |
| Maldane sarsi Malmgren, 1865 | 25 | 3 | 12 | н/о |
| Nicomache lumbricalis (Fabricius, 1780) | 21 | 4 | 11 | Мор |
| Сем. Oweniidae | ||||
| Myriochele heeri Malmgren, 1867 | 27 | 1 | 12 | Мор |
| Owenia gr. fusiformis Delle Chiaje, 1844 | 4 | – | 2 | |
| Сем. Sternaspidae | ||||
| Sternaspis scutata (Ranzani, 1817) | 6 | 1 | 3 | Прибр |
| Сем. Pectinariidae | ||||
| Cistenides hyperborea Malmgren, 1866 | 21 | 1 | 10 | Прибр |
| Сем. Ampharetidae | ||||
| Ampharete acutifrons (Grube, 1860) | 2 | 1 | 2 | |
| Ampharete borealis (M. Sars, 1856) | 50 | 12 | 28 | н/о |
| Ampharete finmarchica (M. Sars, 1865) | 15 | 13 | 14 | Мор |
| Ampharete goesi Malmgren, 1866 | 2 | – | 1 | |
| Ampharete gr. lindstroemi Malmgren, 1867 sensu Hessle, 1917 | – | 3 | 2 | |
| Amphicteis gunneri (M. Sars, 1835) | 2 | – | 1 | |
| Amphicteis ninonae Jirkov, 1985 | 2 | 3 | 3 | |
| Anobothrus gracilis (Malmgren, 1866) | 4 | – | 2 | |
| Glyphanostomum pallescens (Théel, 1879) | 2 | – | 1 | |
| Сем. Terebellidae | ||||
| Lanassa venusta (Malm, 1874) | 2 | – | 1 | |
| Leaena abranchiata (M. Sars, 1865) | 13 | 1 | 6 | Мор |
| Neoamphitrite affinis (Malmgren, 1866) | 4 | 4 | 4 | |
| Neoamphitrite groenlandica (Malmgren, 1866) | 21 | 12 | 16 | н/о |
| Nicolea venustula (Montagu, 1819) | 4 | 4 | 4 | |
| Nicolea zostericola Örsted, 1844 | 21 | 12 | 16 | н/о |
| Pista maculata (Dalyell, 1853) | 19 | 12 | 15 | н/о |
| Polycirrus latidens Eliason, 1962 | 2 | – | 1 | |
| Terebellides aff. stroemii Sars, 1835 | 4 | 3 | 3 | |
| Terebellides gracilis Malm, 1874 | – | 1 | 1 | |
| Thelepus cincinnatus (Fabricius, 1780) | 17 | 3 | 9 | Мор |
| Terebellidae gen. sp. | 8 | 3 | 5 | н/о |
| Сем. Sabellidae | ||||
| Bispira crassicornis (Sars, 1851) | – | 3 | 2 | |
| Branchiomma arcticum (Ditlevsen, 1937) | 40 | 18 | 27 | Мор |
| Chone cf. duneri Malmgren, 1867 | 15 | 3 | 8 | Мор |
| Chone infundibuliformis Krøyer, 1856 | 13 | 6 | 9 | п/мор |
| Euchone analis (Kröyer, 1856) | 21 | – | 9 | Мор |
| Euchone papillosa (Sars, 1851) | 52 | 15 | 30 | п/мор |
| Jasmineira schaudinni Augener, 1912 | – | 1 | 1 | |
| Myxicola infundibulum (Montagu, 1808) | 2 | – | 1 | |
| Сем. Siboglinidae | ||||
| Frenulata gen. sp. (“Polybrachiidae”) | 2 | – | 1 | |
Примечание. Обозначения: (–) вид не отмечен; полужирным шрифтом выделена частота встречаемости наиболее широко распространенных видов (более 40%). ЮЗМЛ – юго-западная часть моря Лаптевых, НСМ – Новосибирское мелководье; н/о – таксон отмечен в равной степени на станциях обоих комплексов, прибр – таксон отмечен преимущественно на станциях прибрежного комплекса, п/мор – таксон отмечен преимущественно на станциях мористого комплекса, мор – таксон встречен только на станциях мористого комплекса.
Сравнение уловов учетно-промыслового трала и трала Сигсби показало, что в отношении видового состава (мера расстояния Theta+) они достоверно не отличаются (ANOSIM R = 0.161, уровень значимости 1.4%). Для количественных данных (мера расстояния индекс Брея-Кертиса) имелась слабая связь с орудием сбора (ANOSIM R = 0.495). Поэтому в дальнейшем мы использовали результаты обработки количественных данных, только если они не противоречили результатам анализа качественного состава.
В трофической структуре были наиболее представлены плотоядные и детритофаги (встречаемость 90 и 81%, относительное обилие в среднем 47 и 32% соответственно). Полифаги (фактически за счет одного вида N. zonata) имели встречаемость 61% и относительное обилие 10%. Сестонофаги имели встречаемость 54% и относительное обилие 12%, в среднем.
Максимумы обилия, так же как и наибольшее число видов, были отмечены на глубинах около 50 м. Большинство (26) видов с встречаемостью более 5% отмечались чаще и имели более высокую численность при отрицательных температурах и высоких значениях солености (табл. 3). К немногим видам, явно приуроченным к прибрежным биотопам с положительными температурами и пониженной соленостью, относились Bylgides elegans, Cistenides hyperborea, Nephtys caeca, Harmothoe imbricata, а также Sternaspis scutata в ЮЗМЛ. Для остальных таксонов не было выявлено приуроченности к определенным диапазонам температуры и солености.
Анализ влияния факторов среды методом DistLM. Поскольку характер распределения и встречаемость многих видов различались для ЮЗМЛ и НСМ (табл. 3), что связано со значительной биотопической мозаичностью последнего, анализ данных по этим акваториям мы проводили раздельно. Использование различных мер сходства в DistLM-анализе (индекс Брея–Кертиса, Theta+) дало принципиально сходные результаты, но процент объясненной вариации был наибольшим при использовании индекса Theta+ с трофической классификацией в качестве агрегирующей матрицы, превышая таковой по Брею–Кертису почти в два раза. Это указывает на то, что выявленные различия обусловлены в значительной степени различиями в соотношении трофических групп. Группировка станций наиболее четко проявлялась при анализе данных (полных или редуцированных) по трем факторам – глубина, температура, соленость (рис. 2). Наибольшие значения объясненной вариации для ЮЗМЛ дал анализ редуцированных данных по четырем факторам, включая тип грунта (табл. 4, рис. 3). В случае НСМ, однако, анализ как полных, так и редуцированных данных привел к недостоверным результатам (P > 0.01) для всех факторов, кроме солености (табл. 4).
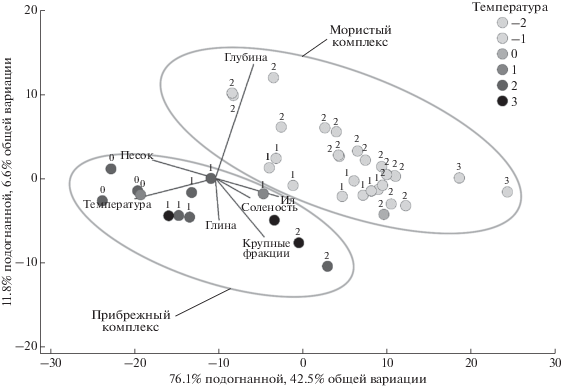
Рис. 2.
Ординация методом dbRDA результатов DistLM-анализа полного массива данных. Мера сходства: Theta+; агрегирую-щая матрица: таксономия; векторы: глубина, температура, соленость. (а) – юго-западная часть моря Лаптевых; при значках станций прибрежного комплекса обозначена соленость (PSU), при значках станций мористого комплекса – глубина (м); (б) – Новосибирское мелководье; при значках станций группы >33 PSU обозначена глубина.

Таблица 4.
Основные параметры последовательных тестов Dist-LM для юго-западной части моря Лаптевых и Новосибирского мелководья
| Фактор | Юго-западная часть моря Лаптевых | Новосибирское мелководье | ||||
|---|---|---|---|---|---|---|
| Pseudo-F | доля объясненной вариации | P | Pseudo-F | доля объясненной вариации | P | |
| Полные данные | ||||||
| Температура | 8.9095 | 0.18597 | 0.001 | 1.3207 | 0.02392 | 0.263 |
| Грунт | 2.03 | 0.11778 | 0.021 | 1.3328 | 0.09394 | 0.156 |
| Глубина | 5.9511 | 0.10118 | 0.001 | 1.0985 | 0.02002 | 0.361 |
| Соленость | 1.2615 | 0.021289 | 0.291 | 4.7507 | 0.08677 | 0.002 |
| Редуцированные данные (по четырем семействам) | ||||||
| Температура | 11.073 | 0.22114 | 0.001 | –0.30466 | –0.00518 | 0.96 |
| Грунт | 4.802 | 0.22260 | 0.002 | 2.5116 | 0.16355 | 0.024 |
| Глубина | 7.4618 | 0.09775 | 0.004 | 0.36699 | 0.00606 | 0.74 |
| Соленость | 1.2405 | 0.01614 | 0.36 | 4.7991 | 0.08758 | 0.009 |
Рис. 3.
Ординация методом dbRDA результатов DistLM-анализа данных по четырем семействам (юго-западная часть моря Лаптевых). Мера сходства: Theta+; агрегирующая матрица: трофическая классификация; векторы: глубина, температура, соленость, тип донных осадков; при значках станций обозначено соотношение ила и песка: (0) песок, (1) заиленный песок, (2) песчанистый ил, (3) ил.
Результаты анализа подтвердили предположение о различных лидирующих факторах в ЮЗМЛ и на НСМ (табл. 4).
В ЮЗМЛ группирующим фактором была придонная температура. Внутри групп станции выстраивались вдоль градиентов солености (группа станций с положительными температурами) и глубины (группа станций с отрицательными температурами) (рис. 2а). При использовании трофической классификации существенную роль играет грунт (соотношение песка и ила) (рис. 3).
На НСМ, как уже отмечалось, единственным достоверным фактором была соленость (табл. 4). Внутри мористой, более солоноводной, группы выделяются еще два диапазона: менее и более 33 PSU. На рис. 2б видно, тем не менее, что наиболее мористые станции (>33 PSU, расположены в основном глубже 40 м) выстраиваются, как и в ЮЗМЛ, вдоль градиента глубины.
Выделение групп станций, населенных различными фаунистическими комплексами. Мы выделяем для всей исследованной акватории прибрежный и мористый комплексы, однако в ЮЗМЛ и на НСМ их границы определялись различными факторами (рис. 1). Результаты совпали для всех использованных мер сходства.
Для ЮЗМЛ достоверно (ANOSIM R = 0.662) выделяются станции тепловодного (0.9–3.1°С) и холодноводного (–1.8–0°С) комплексов. Тепловодный комплекс занимал прибрежные станции, в основном с глубинами 10–30 м, холодноводный – более мористые с глубинами 40–80 м. Диапазон 30–40 м являлся переходным. Станции глубже 80 м также заметно отличались от остальных и, вероятно, являлись уже переходными к комплексу континентального склона.
На НСМ влияние температуры было значительно менее выражено (ANOSIM R = 0.429); лидирующим фактором была соленость. Прибрежный комплекс здесь включал опресненные станции (19–28 PSU) (ANOSIM R = 0.627), также расположенные в основном на глубинах 10–30 м, мористый – станции с соленостью 29–35 PSU. Выпадение из опресненной группы двух станций с соленостью около 26 PSU было обусловлено высокой температурой (более 3°С) и типом грунта, отличавшимся от всех прочих станций (каменистый в одном случае, чистый песок во втором). Разделение мористого комплекса на диапазоны более и менее 33 PSU, хорошо видное на графике DistLM, было, тем не менее, недостоверно. Станции глубже 200 м, по-видимому, являлись переходными к комплексу континентального склона.
И в ЮЗМЛ, и на НСМ в прибрежном комплексе доля видов, приуроченных к повышенной температуре и пониженной солености, и доля видов, для которых не было выявлено температурных и соленостных предпочтений, были сходными. В мористом комплексе основу составляли виды, приуроченные к отрицательным температурам и высокой солености. Последние разделялись на две группы: встречавшиеся только в мористом комплексе (13 видов), и единично в небольших количествах отмеченные и на прибрежных станциях (13 таксонов). Следует отметить, что на НСМ в группе >33 PSU (и единично в ЮЗМЛ) на ряде станций наблюдалось массовое развитие двух крупных видов: Harmothoe globifera и Flabelligera affinis. Если на большинстве станций биомасса полихет в траловых сборах была несравнима с таковой основных групп тралового бентоса (морские звезды, офиуры, голотурии), то на этих станциях полихеты достигали сравнимых величин – до килограмма на траление.
И в ЮЗМЛ, и на НСМ прибрежный комплекс был заметно беднее мористого в видовом отношении (ЮЗМЛ: 46 видов против 58; НСМ: 26 против 44 соответственно). Значительно ниже было в нем и число видов на траление (ЮЗМЛ: до 9 видов в прибрежном комплексе против 23 в мористом; НСМ: до 6 против 18 соответственно). Кроме того, прибрежный и мористый комплексы отличались друг от друга числом характерных видов. В прибрежном комплексе оно составляло 9, а в мористом – 23. Большая же часть встречавшихся в прибрежном комплексе видов относилось к обычным для всей исследованной акватории.
Роль трофических групп в комплексах также различалась (табл. 5). В ЮЗМЛ встречаемость сестонофагов и полифагов была на 20–30% больше, а их доля в общей численности в 2–3 раза выше в мористом комплексе по сравнению с прибрежным. Встречаемость плотоядных и детритофагов в мористом комплексе была ниже несущественно (на 4–5%), доля в общей численности – меньше на 5–12%. На НСМ встречаемость сестонофагов и полифагов на станциях мористого комплекса была в два раза, а доля в общей численности – в 2–3 раза выше, чем в прибрежье. Несколько выше была и встречаемость детритофагов (на 15%). Роль плотоядных при этом была незначительно меньше (встречаемость на 4%, а доля в общей численности на 8%).
Таблица 5.
Встречаемость и относительное обилие различных трофических групп на станциях прибрежных и мористых комплексов
| Трофическая группа | Юго-западная часть моря Лаптевых | Новосибирское мелководье | ||
|---|---|---|---|---|
| тепловодный | холодноводный | опресненный | морской | |
| Встречаемость, % | ||||
| Детритофаги | 93.3 | 88.5 | 71.4 | 85.1 |
| Сестонофаги | 60.0 | 88.5 | 21.4 | 44.7 |
| Плотоядные | 100.0 | 96.2 | 92.9 | 89.4 |
| Полифаги | 66.7 | 88.5 | 21.4 | 55.3 |
| Относительное обилие, % ± SD | ||||
| Детритофаги | 42.5 ± 24 | 30.2 ± 19 | 33.1 ± 32 | 31.4 ± 23 |
| Сестонофаги | 10.8 ± 14 | 18.8 ± 12 | 3.4 ± 10 | 8.9 ± 23 |
| Плотоядные | 40.1 ± 25 | 35.5 ± 24 | 57.8 ± 34 | 51.1 ± 27 |
| Полифаги | 6.7 ± 9 | 15.6 ± 9 | 5.6 ± 13 | 8.6 ± 24 |
Анализ трофической структуры таксоцена Polychaeta показал, что в ЮЗМЛ группа станций с отсутствием сестонофагов и, как правило, полифагов, примерно соответствовала прибрежному (тепловодному) комплексу станций (рис. 4а). Мористому (холодноводному) комплексу соответствовала группа станций с долей этих трофических групп, равной по 10–50%. Особняком стояла небольшая группа станций, на которых отсутствовали детритофаги и основную роль играли плотоядные (50–100%).
Рис. 4.
Ординация станций с помощью nMDS; мера сходства: Theta+, агрегирующая матрица: трофическая классификация. (а) – юго-западная часть моря Лаптевых: 1 – отсутствие сестонофагов и полифагов, 2 – по 10–50% сестонофагов и полифагов, 3 – отсутствие детритофагов, 4 – только плотоядные; (б) – Новосибирское мелководье: 1 – отсутствие полифагов, 2 – от 10 до 30% полифагов, 3 – преобладание (до 100%) плотоядных и отсутствие детритофагов, 4 – отсутствие плотоядных.

На НСМ группировка станций по трофической структуре не совпадала с прибрежным и мористым комплексами. Две основные группы выделялись по доле полифагов N. zonata – в первой они отсутствовали, во второй составляли 10–30% (рис. 4б). В каждой группе выделялись подгруппы, различавшиеся долей сестонофагов (аналогично ЮЗМЛ). Также выделялись две небольшие группы: с преобладанием (до 100%) плотоядных и отсутствием детритофагов, и с отсутствием плотоядных и преобладанием (более 50%) полифагов.
ОБСУЖДЕНИЕ
При анализе данных по всем группам бентоса из траловых уловов, в предыдущих работах на рассматриваемой акватории нами было выделено четыре фаунистических комплекса: мелководный, средних глубин, комплекс верхней части континентального склона и комплекс с доминированием Psolus-Polymastia [7, 13]. Сравнение наших данных с [12] показывает, что мелководный комплекс соответствовал сообществам с доминированием двустворчатых моллюсков (Portlandia arctica (Gray, 1824), Astarte borealis (Schumacher, 1817) + Astarte montagui (Dillwyn, 1817) + P. arctica, Ennucula tenuis (Montagu, 1808), A. borealis (+ A. montagui + Maldane sarsi Malmgren, 1865)) и мшанок Alcyonidium disciforme Smitt, 1872, а комплекс средних глубин – поясному сообществу офиур Ophiocten sericeum (Forbes, 1852). Граница между мелководным комплексом и комплексом средних глубин проходила около 40–50 м, а верхняя граница сообщества O. sericeum – 40 м. Переход от прибрежных биоценозов Bivalvia к сообществам иглокожих на глубинах около 40 м описан и в [3]. Переход от комплекса средних глубин к комплексу верхнего отдела континентального склона в море Лаптевых был приурочен к глубинам 80–100 м, что также согласуется с границей сообществ O. sericeum и Ophiopleura borealis Danielssen & Koren, 1877 (94–104 м). Однако специфический комплекс Psolus-Polymastia не имел соответствия в схеме [12]. Так как доминанты в нем представлены большим количеством крупных относительно долгоживущих организмов (до 30 кг на траление) [7], маловероятно, чтобы это могло быть временно развивающееся сообщество. Более вероятным представляется, что при существенных отличиях в составе и количестве мегабентоса, макробентос этих районов соответствует таковому для средних глубин.
Комплексы полихет, выделенные в настоящем исследовании, соответствовали комплексам мегабентоса мелких и средних глубин, выделенным в [7, 13], однако с некоторыми оговорками. Для полихет граница между фаунистическими комплексами оказалась смещена к изобате 30 м (с переходными станциями в промежутке 30–40 м). Хотя на глубинах, соответствующих мелководному комплексу, отмечен целый ряд мозаично расположенных сообществ [3, 12, 24, 31], наш материал не позволил выделить в мелководном комплексе отдельные кластеры. Таким образом, в различных прибрежных сообществах полихеты были представлены близкими наборами видов. На станциях, на которых мегабентос был представлен комплексом Psolus-Polymastia, таксоцен Polychaeta в траловых сборах также не отличался от такового на других станциях мористого комплекса, что более соответствует [12]. Если для остальных организмов мегабентоса число видов в комплексах мелководья и средних глубин было сходным, то у полихет прибрежный комплекс был беднее мористого в видовом отношении.
Для большинства групп бентоса в Арктике соленость является ведущим фактором, определяющим не только распространение отдельных видов, но и количественные характеристики сообществ, а в конечном счете и образование границ между фаунистическими комплексами [11, 31]. По нашим результатам, роль солености в распределении полихет в море Лаптевых оказалась низкой по сравнению с температурой.
При этом выделение фаунистических комплексов на НСМ осложнял тот факт, что глубина, соленость и температура здесь отличались от станции к станции практически независимо друг от друга, значительно сильнее, чем в ЮЗМЛ. Общая тенденция уменьшения придонной температуры и увеличения солености с глубиной не соблюдалась на многих станциях. Так, например, в прибрежье (10–20 м) на станции с глубиной 15 м при температуре 0.37°С соленость составляла 19 PSU, а на 19 м при температуре 3.51 соленость была 27 PSU. На континентальном склоне при сходной солености (34.5–34.8 PSU) на станции с глубиной 255 м температура составляла –1.05°С, а на 259 м температура была 0.96°С. Такие различия в соотношении значений факторов на мелководье объясняются тем, что одновременно со стоком теплой пресной воды с суши, у берегов до конца лета сохранялся ледовый припай, с таянием которого поступает опресненная холодная вода. На больших глубинах, в свою очередь, становится заметным влияние затоков с севера теплых и соленых трансформированных атлантических вод.
В ЮЗМЛ уже станции глубже 80 м были переходными к комплексу континентального склона, в то время как на НСМ на глубинах 50–200 м фауна полихет по данным траловых сборов была достаточно однородна. Только станции глубже 200 м существенно отличались на НСМ от вышележащих, в чем очевидно сказывается влияние атлантических вод: начиная с этой зоны, температура начинала повышаться с глубиной.
Глубина при анализе донных сообществ, как правило, выступает в роли “интегрального” фактора, суммирующего градиенты других факторов, закономерно изменяющихся с глубиной [6]. Благодаря этому при анализе глубина выглядит наиболее значимым параметром. Однако в настоящем исследовании глубина, как предиктор, имела низкий процент объясненной вариации и невысокую достоверность, что связано с нелинейным изменением рассмотренных факторов с глубиной в пределах шельфа. Особенно сильно это проявилось для НСМ. Ситуация, в которой отсутствовала выраженная связь глубины со структурой бентосных сообществ, описана и в [25]. Автор отмечает, что “на хребте Неккер эти переменные (температура, соленость, кислород, скорость седиментации и т.п.), похоже, изменяются скорее в зависимости от местоположения, чем от глубины”.
В DistLM-анализе объясненная вариация в модели (подогнанная вариация) превышала таковую общей объясненной вариации в 2–3 раза. Большая разница между подогнанной вариацией и общей объясненной вариацией говорит о значительном воздействии не учтенных в анализе факторов. В частности, различия в распределении трофических групп (увеличение роли сестонофагов и полифагов в мористом комплексе) указывают на необходимость учитывать такие факторы, как содержание в воде минеральной взвеси, отрицательно влияющей на фильтраторов, и скорость седиментации.
ЗАКЛЮЧЕНИЕ
Проведенный анализ показал существенные различия в структуре таксоцена Polychaeta и ее связи с абиотическими факторами между юго-западной частью моря Лаптевых и Новосибирским мелководьем. Действие некоторых факторов (абиотических или биотических) может проявляться на более мелком масштабе пространства, чем принятый в данном исследовании, и “зашумлять” общую картину, что особенно сильно проявилось для НСМ. Вероятно, это обусловлено высокой мозаичностью гидрологической структуры придонных вод этой акватории. Рассмотрение в качестве факторов среды распределения маркеров водных масс, возможно, позволит получить более достоверную картину связи распределение полихет с факторами среды на этой акватории.
Пространственное распределение фаунистических комплексов, выделенных в пределах таксоцена полихет, не совпадало с комплексами, выделенными по остальным группам. Таким образом, в исследуемом регионе совместная обработка данных по полихетам и остальному бентосу (по крайней мере, в траловых сборах) может привести к получению заниженных оценок достоверности и силы связи распределения зообентоса с факторами среды.
Благодарности. Авторы благодарят команду НИС “Дальние Зеленцы” за помощь в сборе материала и Г.А. Колючкину (ИО РАН) за обсуждение текста статьи.
Список литературы
Атлас Арктики / Под ред. Трешникова А.Ф. М.: ААНИИ и ГУГК, 1985. 204 с.
Веденин А.А. Донная фауна сибирского сектора Арктики: состав, распределение сообществ, вертикальная зональность: Дисс. канд. биол. наук: 03.02.10. М., 2017. 214 с.
Гуков А.Ю. Экология донных биоценозов морей Лаптевых и Восточно-Сибирского: Автореф. дисс. докт. биол. наук: 03.02.08. Якутск: ЯкГУ, 2013. 50 с.
Добровольский А.Д., Залогин Б.С. Моря СССР. М.: МГУ, 1982. 192 с.
Жирков И.А. Полихеты Северного Ледовитого океана. М.: Янус-К, 2001. 632 с.
Жирков И.А. Жизнь на дне. Био-география и био-экология бентоса. М.: Товарищество научных изданий КМК, 2010. 453 с.
Зимина О.Л., Семин В.Л. Особенности фауны донных беспозвоночных арктических морей (Карское, Лаптевых, Восточно-Сибирское) по результатам траловых съемок 2012–2014 гг. // Экосистема Карского моря – новые данные экспедиционных исследований. Тез. науч. конф. (Москва, ИО РАН, 27–29 мая 2015). М.: ИО РАН, 2015. С. 184–188.
Иллюстрированные определители свободноживущих беспозвоночных евразийских морей и прилежащих глубоководных частей Арктики. Т. 2. М.: Товарищество научных изданий КМК, 2010. 174 с.
Любин П.А., Анисимова Н.А., Манушин И.Е., Журавлева Н.Е. Приловы макрозообентоса в ихтиологических донных тралениях как показатель интенсивности тралового промысла // Вестник МГТУ. Т. 13. № 4. Мурманск: МГТУ, 2010. С. 641–646.
Песенко Ю.А. Принципы и методы количественного учета в фаунистических исследованиях. М.: Наука, 1982. 287 с.
Петряшев В.В., Новожилов А.В. Влияние гидрологического режима на распределение макробентоса в море Лаптевых // Фауна и экосистемы моря Лаптевых и сопредельных глубоководных участков Арктического бассейна / Под ред. Сиренко Б.И. Ч. 1. СПб.: ЗИН РАН, 2004. С. 74–85.
Петряшев В.В., Голиков А.А., Шмид М., Рахор А. Макробентос шельфа моря Лаптевых // Фауна и экосистемы моря Лаптевых и сопредельных глубоководных участков Арктического бассейна / Под ред. Сиренко Б.И. Ч. 1. СПб.: ЗИН РАН, 2004. С. 9–27.
Семин В.Л., Зимина О.Л. Предварительные данные о мегабентосе моря Лаптевых и западной части Восточно-Сибирского моря // Арктическое морское природопользование в XXI в. – современный баланс научных традиций и инноваций (к 80-летию ММБИ КНЦ РАН): тез. докл. междунар. науч. конф. (г. Мурманск, 1–3 апреля 2015 г). Апатиты: КНЦ РАН, 2015. С. 218–220.
Система моря Лаптевых и прилегающих морей Арктики: современное состояние и история развития / Под ред. Кассенс X. и др. М.: МГУ, 2009. 608 с.
Фауна и экосистемы моря Лаптевых и сопредельных глубоководных участков Арктического бассейна / Под ред. Сиренко Б.И. В серии: Исследования фауны морей. Вып. 54. № 62. СПб.: ЗИН РАН, 2004. Части 1–2.
Экосистемы Новосибирского мелководья и фауна моря Лаптевых и сопредельных вод / Под ред. Голикова А.Н. В серии: Исследования фауны морей. Вып. 37. № 45. Л.: Наука, 1990. 463 с.
Anderson M.J., Gorley A.M., Clarke K.R. PERMANOVA+ for PRIMER: guide to software and statistical methods. PRIMER-E: Plymouth, UK. 2008.
Banse K. A. R. L. Redescription of some species of Chone Kröyer and Euchone Malmgren, and three new species (Sabellidae, Polychaeta) // Fishery bulletin. 1972. V. 70. № 2. P. 459–495.
Bray J.R., Curtis J.T. An ordination of the upland forest communities of Southern Wisconsin // Ecological monographs. 1957. V. 27. № 4. P. 325–349.
Clarke K.R., Gorley R.N. PRIMER v6: User Manual/Tutorial. PRIMER-E, Plymouth, UK. 2006. 192 p.
Clarke K.R., Somerfield P.J., Chapman M.G. On resemblance measures for ecological studies, including taxonomic dissimilarities and a zero-adjusted Bray–Curtis coefficient for denuded assemblages // J. of Experimental Marine Biology and Ecology. 2006. V. 330. № 1. P. 55–80.
Christiansen B., Thiel H. Deep-sea epibenthic megafauna of the Northeast Atlantic: abundance and biomass at three mid-oceanic locations estimated from photographic transects // Deep-sea food chains and the global carbon cycle. NATO ASI Series (Series C: Mathematical and Physical Sciences) / Eds. Rowe G.T., Pariente V. Springer, Dordrecht, 1992. V. 360. P. 125–138.
Fauchald K. Sphaerodoridae (Polychaeta: Errantia) from world-wide areas // J. of Natural History. 1974. V. 8. № 3. P. 257–289.
Kokarev V.N., Vedenin A.A., Basin A.B., Azovsky A.I. Taxonomic and functional patterns of macrobenthic communities on a high-Arctic shelf: a case study from the Laptev Sea // J. of Sea Research. 2017. V. 129. P. 61–69.
Morgan N.B. Community structure of benthic invertebrates on Necker Ridge in the North Pacific: Distribution, diversity, and preliminary comparison to the Hawaiian Archipelago (MS dissertation, The Florida State University). 2013. 70 p.
Nephin J., Juniper S.K., Archambault P. Diversity, abundance and community structure of benthic macro- and megafauna on the Beaufort shelf and slope // PloS one. 2014. V. 9. № 7. e101556. https://doi.org/10.1371/journal.pone.0101556
Rainer S.F. The genus Nephtys (Polychaeta: Phyllodocida) of northern Europe: a review of species, including the description of N. pulchra sp. n. and a key to the Nephtyidae // Helgoländer Meeresuntersuchungen, 1991. V. 45. № 1. 65 p.
Rice A.L., Aldred R.G., Darlington E., Wild R.A. The quantitative estimation of the deep-sea megabenthos: a new approach to an old problem // Oceanologica acta. 1982. V. 5. № 1. P. 63–72.
Piepenburg D. Recent research on Arctic benthos: common notions need to be revised // Polar Biology. 2005. V. 28. № 10. P. 733–755.
Spielhagen R.F., Werner K., Sørensen S.A. et al. Enhanced modern heat transfer to the Arctic by warm Atlantic water // Science. 2011. V. 331. № 6016. P. 450–453.
Steffens M., Piepenburg D., Schmid M.K. Distribution and structure of macrobenthic fauna in the eastern Laptev Sea in relation to environmental factors // Polar Biology. 2006. V. 29. № 10. P. 837–848.
Stepanova S.V., Polukhin A.A., Kostyleva A.V. Hydrochemical structure of the waters in the eastern part of the Laptev Sea in autumn 2015 // Oceanology. 2017. V. 57. № 1. P. 58–64.
Tovar-Hernández M.A., Licciano M., Giangrande A. Revision of Chone Krøyer, 1856 (Polychaeta: Sabellidae) from the eastern central Atlantic and Mediterranean Sea with descriptions of two new species // Scientia Marina. 2007. V. 71. № 2. P. 315–338.
WoRMS Editorial Board (2018). World Register of Marine Species. Available from http://www.marinespecies.org at VLIZ. Accessed 2018-06-06. https://doi.org/10.14284/170
Дополнительные материалы отсутствуют.


