Океанология, 2020, T. 60, № 3, стр. 393-406
Диагенез органического вещества в осадках покрытых зарослями зостеры морской (Zostera marina L.)
П. Я. Тищенко 1, *, Н. Д. Ходоренко 1, Ю. А. Барабанщиков 1, Т. И. Волкова 1, А. А. Марьяш 1, Т. А. Михайлик 1, Г. Ю. Павлова 1, С. Г. Сагалаев 1, П. Ю. Семкин 1, П. П. Тищенко 1, М. Г. Швецова 1, Е. М. Шкирникова 1
1 Тихоокеанский океанологический институт
им. В.И. Ильичева ДВО РАН
Владивосток, Россия
* E-mail: tpavel@poi.dvo.ru
Поступила в редакцию 25.02.2019
После доработки 28.10.2019
Принята к публикации 16.12.2019
Аннотация
В феврале и июле 2014 г. были проведены комплексные органо-геохимические исследования донных отложений двух районов Амурского залива, различающихся по интенсивности поступления органического вещества, продуцируемого морскими травами (Zostera marina L.). В поровой воде донных осадков по глубине керна (80 см) были измерены концентрации растворенного органического углерода, углеводов, гумусового вещества, биогенных веществ (неорганический фосфор, кремний, аммоний), исследованы параметры карбонатной системы (рН, общая щелочность, растворенный неорганический углерод, парциальное давление углекислого газа – pCO2). В твердой фазе осадка измерялось содержание органического углерода (ОУ), процентное содержание фульвовых и гуминовых кислот, влажность осадка. Установлено, что концентрация ОУ в верхнем слое (5 см) донных отложений в зоне произрастания макрофитов была 5.51%. На участке без морских трав – 1.78%. Суммарное содержание фульвовых и гуминовых кислот составляет около 40% от общего содержания ОУ. Показано, что на акваториях с интенсивным развитием Zostera marina, по сравнению с фоновыми участками, около 50% общего содержания ОУ перерабатывается в пределах верхних 40 см осадка и сопровождается резким увеличением концентрации Si, P, ${\text{NH}}_{4}^{ + }$, щелочности и уменьшением рН, концентрации ${\text{SO}}_{4}^{{2 - }}$. Для исследованных параметров сезонная изменчивость была выражена слабо. Исключение составили рН и рСО2, что связано с влиянием температуры на константы карбонатной системы. Продукты диагенеза органического вещества (ОВ) указывают, что сульфатредукция является важным процессом, но полностью не объясняет резкое уменьшение содержания ОУ по глубине осадка. Сделано предположение, что утилизация ОВ в донных осадках, покрытых зарослями макрофитов (Zostera marina) сопровождается его трансформацией в биомассу инфауны.
ВВЕДЕНИЕ
Морская трава зостера морская (Zostera marina L.) образует подводные луга, иногда с очень высоким травостоем (до 100 см), на мягких илисто-песчаных грунтах в мелководных прибрежных акваториях. Это многолетнее растение, с хорошо развитой корневой системой является чрезвычайно продуктивным, его валовая продукция достигает 2 мгО2/ч на 1 г сырой массы растения [4]. На основе экспериментальных данных было установлено, что ее средняя продукция в летний сезон составляет 4.8 гС/м2 в сутки [32]. Натурными наблюдениями в б. Витязь (залив Петра Великого, Японское море) были получены значения 0.1–3.1 гС/м2 в сутки [7]. Для зостеры японской (Z. japonica) валовая продукция в заливе Голубином (Японское море) составляла 2.62 гС/м2 в сутки [12]. Из-за высокой продукции, наряду с тропическими лесами, мангровыми зарослями и солевыми маршами, морские травы рода Zostera включены в проект “голубой углерод” [35]. Его суть заключается в увеличении на планете площадей, занятых произрастанием высокопродуктивных растений для сдерживания роста углекислого газа в атмосфере [20, 31]. Однако высокая продукция морских трав не является достаточным условием для изъятия атмосферного углекислого газа. Другим необходимым условием является захоронение биомассы морских трав в современных осадках [19, 27]. Эффективность захоронения органического углерода в осадках зависит от многих причин, которые можно объединить словосочетанием “пути диагенеза органического вещества”. Бактериальное разложение органического вещества является ключевым процессом, изменяющим химический состав поровых вод и твердой фазы донных осадков [11, 17, 21]. В соответствии с термодинамической моделью разложения органического вещества (ОВ) в морских осадках, последовательность использования бактериями различных окислителей следующая: ${{{\text{O}}}_{{\text{2}}}}$, ${\text{NO}}_{{\text{3}}}^{ - }$, ${\text{Mn}}{{{\text{O}}}_{{\text{2}}}}$, ${\text{FeOOH}}$, ${\text{SO}}_{{\text{4}}}^{{ - {\text{2}}}}$ [21, 33]. При обычных температурах и исчерпании всех перечисленных выше акцепторов электронов органическое вещество подвергается метаногенезу [21, 33]. Для шельфовых вод 80–90% синтезированного в фотическом слое органического вещества достигает дна и обогащает собой осадки [21]. Поскольку донные осадки на шельфе обогащены ОВ, то ключевыми процессами диагенеза являются сульфатредукция и метаногенез [10]. Однако, диагенез органического вещества в донных осадках мелководных бассейнов, глубина которых не превышает глубину эвфотического слоя, имеет свои особенности, главная из которых, наличие высокой плотности заселения инфауны в зарослях морских трав. Инфауна может принимать непосредственное участие в извлечении органического вещества из донных осадков [39].
Целью работы явилось изучение ключевых процессов диагенеза ОВ в донных осадках двух районов Амурского залива, различающихся по интенсивности поступления органического вещества, продуцируемого морскими травами (Zostera marina L.), а также установление сезонных различий (зима, лето) в формировании химического состава поровых вод. Ключевые процессы диагенеза ОВ вещества устанавливались на основе результатов химического анализа поровой воды и твердой фазы донных отложений по глубине керна (80 см). В поровой воде измерялись концентрации: растворенного органического углерода (РОУ), углеводов, гумусового вещества (ГВ), биогенных веществ (неорганический фосфор, кремний, аммоний), параметры карбонатной системы (рН, общая щелочность – ТА, растворенный неорганический углерод – DIC, парциальное давление углекислого газа – pCO2), сульфаты. В твердой фазе осадка измерялось процентное содержание органического углерода (ОУ), процентное содержание фульвовых и гуминовых кислот, влажность осадка.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
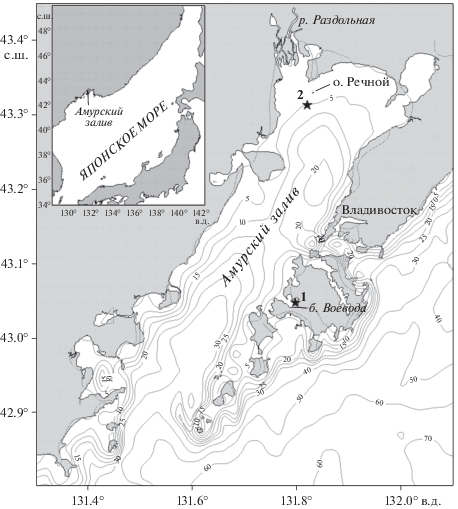
Исследования были выполнены в феврале и июле 2014 г. на двух станциях, расположенных на разных участках Амурского залива. Станция 1 (ст. 1) находилась на акватории бухты Воевода (42°59.978′ с.ш. 131°47.659′ в.д.), характеризовалась небольшими глубинами (до 5 м) и за счет хорошей освещенности песчано-илистое дно было покрыто зарослями Zostera marina [3]. Станция 2 (ст. 2) находилась у о. Речной (43°16.232′ с.ш. 131°49.261′ в.д.) (северная часть Амурского залива). При схожих глубинах (6 м) на дне не было произрастания макрофитов, поэтому в данном исследовании ст. 2 рассматривалась как фоновая (рис. 1) [6].
Рис. 1.
Географическое положение изучаемого района и схема расположения станций: ст. 1 – бухта Воевода (о. Русский) глубина места 4 м; ст. 2 – Амурский залив (о. Речной) глубина места 6 м.
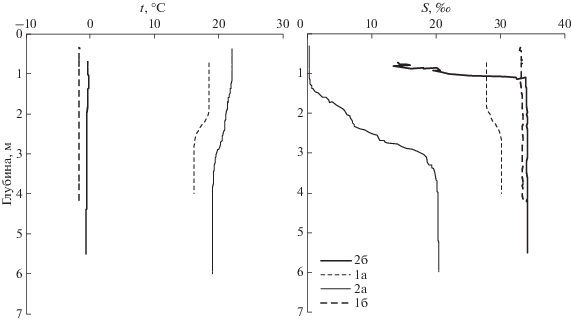
Перед началом геохимических работ проводилось зондирование водной толщи зондом RBR (XR-620) с датчиками температуры (Т), давления, электропроводности (солености), хлорофилла-а (флюоресценция), мутности. Также отбиралась проба воды придонного горизонта на гидрохимические параметры (соленость, растворенный кислород, рН, щелочность, биогенные вещества). Вертикальные профили температуры и солености на исследуемых станциях приведены на рис. 2.
Прямоточной геологической трубкой (1 м) отбирали керн донных отложений. Трубку с керном помещали в теплоизоляционный тубус и доставляли в лабораторию, где керн фотографировали, измеряли рН на разных горизонтах, с интервалом 10 см. После чего осадок каждого горизонта отжимали в прессе для получения поровой воды. Химический анализ поровой воды проводился сразу после ее получения.
Значения рН в морских осадках измеряли потенциометрическим методом, используя ячейку безжидкостного соединения, калибровка которой проводилась при разных температурах, что позволило проводить измерения без термостатирования с точностью $ \pm 0.01$ ед. рН [37]. ТА анализировалась прямым титрованием по методу $ \pm 0.2\% $ Бруевича [9]. Параметры карбонатной системы (pHin situ, DIC, pCO2) были рассчитаны с учетом поправки на содержание органической щелочности и биогенных веществ [13, 14]. Содержание ГВ в поровой воде донных отложений определяли спектрофотометрическим методом при длине волны 254 нм на спектрофотометре Shimadzu UV, модели UV-1650PC. Ошибка данного метода оценивалась нами в 2% [15]. Анализ биогенных веществ был выполнен спектрофотометрическим методом с помощью стандартной процедуры, ошибка метода составляла 2% [23]. Органический углерод в твердой фазе осадков, в поровой воде и придонной морской воде был измерен на анализаторе TOC-VCPN с приставкой для сжигания твердых проб SSM_5000А производства Shimadzu (Япония). Калибровка прибора проводилась с помощью стандартов СДО-3 “известковый ил”, ГСО 1758-80, точностью оценивалась из параллельных измерений и составляла $ \pm 3\% $. Концентрации гуминовых и фульвовых кислот в твердой фазе осадка были измерены методом щелочной экстракции, средняя величина стандартного отклонения для единичного измерения составляла 4% [16]. Концентрации углеводов были измерены триптофановым методом, подробное описание метода дано в руководстве [2]. Методика измерения углеводов, которая нами использовалась, предполагает кислотный гидролиз полисахаридов до моно углеводов. Для калибровки метода использовалась глюкоза. В данной статье полученные результаты мы рассматриваем как общее содержание углеводов в пересчете на вес углерода. Концентрации макро-анионов (Cl–, ${\text{SO}}_{4}^{{2 - }}$) измеряли методом ионно-обменной хроматографии на хроматографе LC-20A производства Shimadzu (Япония) с точностью $ \pm 1\% $. Влажность проб определяли взвешиванием осадка (около 1 г) до высушивания и после высушивания. Высушивание проводили при температуре 100–105°С в течение 1–2 сут до постоянного веса, точность 2%.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследуемых акваториях были подняты керны мелкоалевритовых илов разного цвета: серый цвет характерен для Амурского залива, для бухты Воевода цвет донных отложений был темно-серый, почти черный с характерным запахом сероводорода. Влажность донных отложений в б. Воевода и Амурском заливе по глубине керна плавно уменьшалась, соответственно, от 72 и 64% в верхнем слое до 54 и 50% (80 см). Результаты анализа содержания ОУ в твердой фазе донных отложениях станций 1 и 2 приведены на рис. 3. Профили процентного содержания ОУ в твердой фазе осадка и суммы фульвовых (ФК) и гуминовых (ГК) кислот мало отличаются для разных сезонов (февраль, июль), для теплого сезона наблюдается небольшое систематическое увеличение в содержании ОУ в твердой фазе осадков для обеих станций. В то же время, между станциями наблюдается существенное отличие. В районе зарослей зостеры (ст. 1) концентрации ОВ в твердой фазе осадка для верхнего горизонта (5 см) более чем в три раза выше, в сравнении с результатом, полученным для фоновой станции (ст. 2).
Рис. 3.
Органическое вещество в твердой фазе донных отложений б. Воевода (1, 2) и северной части Амурского з-алива (3, 4). (а) – процентное содержание органического углерода в сухом осадке; (б) – процентное содержание углерода суммы фульвовых и гуминовых кислот в сухом осадке; (в) – процентное отношение углерода суммы фульвовых и гуминовых кислот к общему содержанию органического углерода; (г) – концентрационное отношение фульвовых кислот к гуминовым. Керны донных отложений отобраны в феврале (1, 3) и июле (2, 4) 2014 г.

Концентрации РОУ в поровой воде (рис. 4а) закономерно в несколько раз выше в сравнении с придонной водой [18]. Также следует отметить, что концентрации РОУ для каждой станции систематически выше для теплого сезона. Такая же тенденция прослеживается для концентраций ГВ в поровой воде (рис. 4б). Доля ГВ в РОУ увеличивается с глубиной осадка (рис. 4в).
Рис. 4.
Профили содержания разных форм органического вещества в поровой воде донных отложений б. Воевода (1, 2) и в северной части Амурского залива (3, 4). (а) – концентрация растворенного органического углерода (РОУ), мгС/л; (б) – концентрация гуминового вещества (ГВ), мгС/л; (в) – процентное отношение ГВ к РОУ; (г) – концентрация углеводов, мгС/л. Керны донных отложений отобраны в феврале (1, 3) и июле (2, 4) 2014 г.
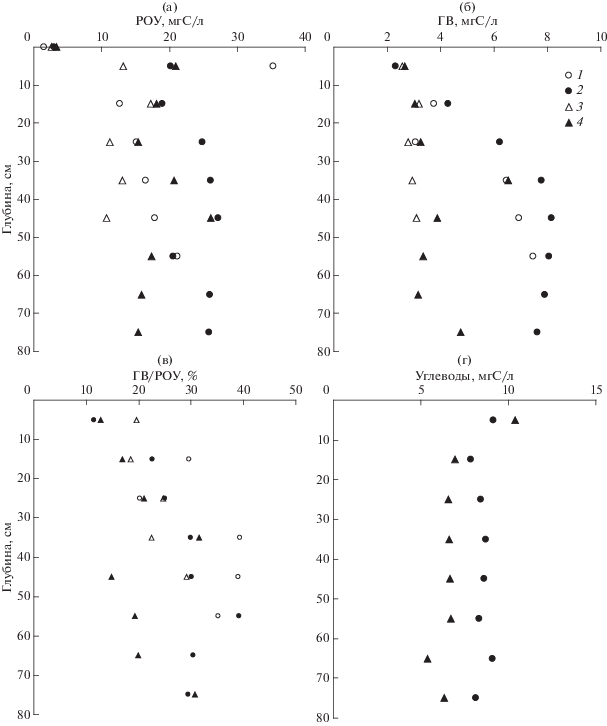
Помимо ГВ, другим важным компонентом РОУ являются углеводы, которые являются основными компонентами органического вещества, продуцируемого автотрофами. Для летнего сезона были выполнены измерения концентрации углеводов в поровой воде (рис. 4г). Суммарные концентрации углеводов и гумусового вещества составляли от 50 до 90% от общей концентрации РОУ. В отличие от ГВ, концентрация углеводов имеют тенденцию к уменьшению с глубиной колонки (рис. 4г).
Конечным продуктом трансформации ОВ под действием микроорганизмов являются неорганические вещества. Наблюдаемое уменьшение содержание ОУ, которое мы связываем с уменьшением ОВ в твердой фазе осадка, сопровождается увеличением концентрации неорганических форм биогенных веществ в поровой воде донных отложений (рис. 5). Следует отметить, что для области глубин донных отложений 0–35 см наблюдаются существенные изменения во всех измеряемых параметрах.
Рис. 5.
Профили концентраций биогенных веществ в поровой воде донных отложений б. Воевода (1, 2) и в северной части Амурского залива (3, 4). (а) – фосфаты (мкмоль/л); (б) – ион аммония (мкмоль/л); (в) – растворенный кремний (мкмоль/л); (г) – азот-фосфорное отношение. Керны донных отложений отобраны в феврале (1, 3) и июле (2, 4) 2014 г.

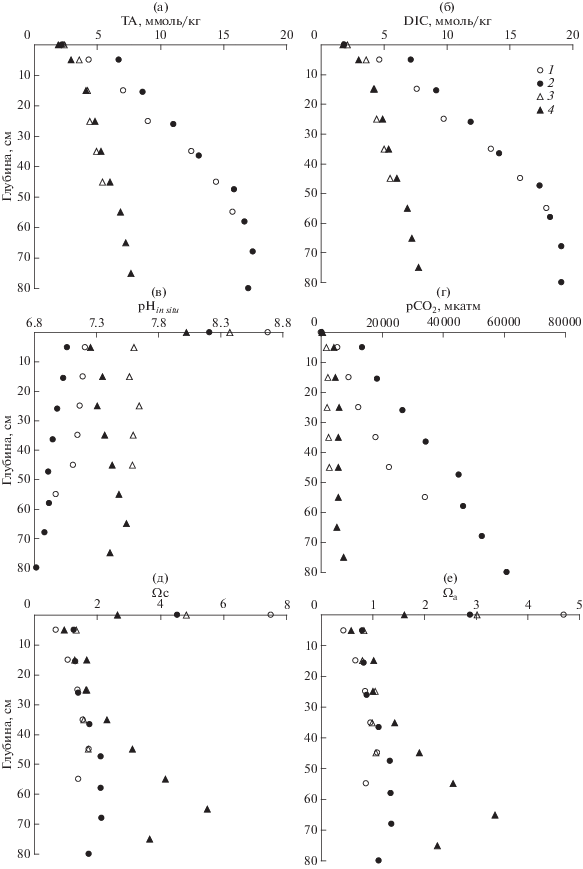
Диагенез ОВ твердой фазы осадка приводит к уменьшению процентного содержания ОУ (рис. 3а, 3б) и к увеличению концентраций продуктов диагенеза в поровой воде: биогенных веществ (рис. 4) и DIC, TA (рис. 6). Сульфат-хлоридные мольные отношения по глубине керна в б. Воевода систематически уменьшались с 0.053 для придонной воды до 0.036 (80 см), что указывает на процесс сульфат редукции. Изменения сульфат-хлоридных отношений для Амурского залива находились в более узких пределах (0.055–0.048) и не имели систематической зависимости по глубине керна.
Рис. 6.
Вертикальные профили параметров карбонатной системы в поровой воде донных отложений б. Воевода (1, 2) и в северной части Амурского залива (3, 4). (а) – общая щелочность; (б) – растворенный неорганический углерод; (в) – рНin situ; (г) – парциальное давление углекислого газа; (д) – степень насыщенности вод по отношению к кальциту; (е) – степень насыщенности вод по отношению к арагониту. Керны донных отложений отобраны в феврале (1, 3) и июле (2, 4) 2014 г.
ОБСУЖДЕНИЕ
Существенное отличие в содержании ОУ между донными отложениями б. Воевода и фоновой станцией (рис. 3а), не обусловлено различием гранулометрического состава, т.к. донные отложения для обоих исследуемых мест мало отличаются по влажности и визуально относятся к мелкоаливритовому илу. Основная причина высокого содержания ОУ на ст. 1 обусловлена потоком ОВ в донные осадки, который может формироваться как эпифитоном, поскольку листья зостеры были покрыты охристыми нитями диатомей, так и зостератами, выделяемыми травой. Зостераты – соли полисахарида (зостерина), продуцируемого зостерой. Общее количество углеводов, продуцируемое зостерой может достигать более 35% от сухой массы травы, из которых около 20% зостерина [5]. В отличие от фоновой станции, на ст. 1 наблюдается резкое уменьшение ОУ в верхних слоях осадка, что указывает на высокую скорость деградации ОВ (рис. 3а). Одним из этапов деградации ОВ является образование ФК и ГК, т.е. происходит гумификация ОВ. Вертикальное распределение суммарного процентного содержания ФК и ГК по глубине осадка для станций 1 и 2 показано на рис. 3б, из которого видно, что формы распределения Сорг и ФК + ГК очень похожи. Доля ФК и ГК в твердой фазе осадка составляет около 40% от общего содержания ОВ и остается примерно постоянной с глубиной осадка (рис. 3в). Отношения ФК:ГК указывают на более чем двукратное доминирование ФК над ГК, которое возрастает с глубиной керна (рис. 3г). Одно из возможных объяснений состоит в том, что при гумификации ОВ в условиях пониженных значений рН, происходит доминирование фульвовых кислот над гуминовыми [8].
Концентрации РОУ в поровой воде донных отложений были на порядок выше в сравнении с результатами, полученными для придонной воды (рис. 4а), что согласуется с литературными сведениями [18]. Для обеих станций концентрации РОУ для летнего сезона систематически выше на 30–40%, что, по-видимому, связано с десорбцией ОВ из твердой фазы в водную среду при повышении температуры в летний сезон. Этот эффект незначительный для ГВ (рис. 4б). В отличие от твердой фазы донных отложений отношения между концентрациями гумуса и органического углерода в поровой воде ниже и изменяются в диапазоне от 11 до 39% для б. Воеводы и от 13 до 31% с тенденцией к увеличению по глубине осадка (рис. 4в). Увеличение концентрации ГВ с глубиной осадка объясняется ростом доли устойчивых к диагенезу растворенных органических веществ [18]. Гуминовые вещества рассматриваются как более устойчивые к микробиологическому разложению в сравнении с углеводами, белками, аминокислотами.
В результате диагенеза ОВ изменяется не только концентрации ОУ в твердой фазе осадков и в поровой воде, соотношения форм органического углерода (увеличивается доля ГВ), но изменяется минеральный состав поровой воды. Наблюдаемое уменьшение содержания ОУ в твердой фазе осадка сопровождается увеличением концентрации неорганических форм биогенных веществ в поровой воде донных отложений (рис. 5, 6), что можно объяснить бактериальной деструкцией ОВ. Минерализация ОВ в морских осадках, в соответствии с термодинамической моделью, изложенной в работе [21], возможна также с участием оксидов марганца и железа. Однако роль оксидов марганца и железа существенна в микробиологической переработке взвешенного ОВ, оседающего на дно для морских бассейнов с глубинами более 1000 м (около 80–90%), а для шельфа она снижается до 10% [21]. В отсутствии кислорода, нитратов, оксидов железа и марганца при наличии сульфат ионов доминирующее значение приобретает сульфатредукция [21]. Используя стехиометрию Редфилда [34] для ОВ, этот процесс формально можно представить следующей схемой [21]:
(1)
$\begin{gathered} {{\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{{\text{106}}}}}{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{{{\text{16}}}}}{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + {\text{53SO}}_{{\text{4}}}^{{{\text{2}} - }} \to \\ \to {\text{38}}{{{\text{H}}}_{{\text{2}}}}{\text{S}} + {\text{16NH}}_{{\text{4}}}^{ + } + {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - } + \\ + \,\,{\text{106HCO}}_{{\text{3}}}^{ - } + {\text{15H}}{{{\text{S}}}^{ - }}. \\ \end{gathered} $В соответствии с реакцией (1), в поровой воде будут увеличиваться концентрации фосфора, аммония, гидрокарбонатов (ТА, DIC) и уменьшаться концентрации сульфатов. Действительно, наблюдаются увеличения концентраций биогенных веществ, особенно в верхних горизонтах донных осадков (рис. 5). В сравнении с придонной водой концентрации фосфатов в летний сезон, в поровой воде осадков на горизонте 5 см увеличились в 5 и 20 раз для Амурского залива и бухты Воевода соответственно. Подобные сравнения для аммония: 34 и 600 раз; для растворенного кремния: 7 и 35 раз. Такие контрастные изменения, особенно для районов обитания зостеры, обусловлены тем, что именно для верхних горизонтов осадка (0–3 см) наблюдаются максимальные скорости регенерации биогенных веществ, достигающие 150 нмоль/г ч–1 [24]. Более высокие концентрации биогенных веществ в поровой воде соответствуют донным отложениям с высоким содержанием ОУ и в летний сезон (концентрации аммония и кремния для июля систематически выше для обеих станций). Особенность в вертикальном распределении фосфора в донных отложениях обусловлена не только интенсивностью диагенеза ОВ, но также процессами адсорбции–десорбции, которые выполняют роль “буферного механизма” в формировании концентрации ортофосфатов в поровой воде [36]. Суть буферного механизма сводится к поддержке почти постоянной концентрации ортофосфатов в водной фазе за счет высокой сорбционной емкости твердой фазы по отношению к ортофосфатам [22]. Именно такое распределение фосфора наблюдается в поровой воде донных осадков Амурского залива (рис. 5а). Р-азложение ОВ внутри осадка должно приводить к увеличению концентрации растворенного фосфора в поровой воде, но этого не происходит, т.к. он адсорбируется на твердой фазе осадка. Другая ситуация наблюдается для ст. 1. В этом случае наблюдается резкое увеличение концентрации неорганического фосфора для горизонта более 15 см. Высокое содержание ОУ в б. Воевода приводит к тому, что в результате диагенеза все активные сорбционные центры твердой фазы для горизонта более 15 см заняты ортофосфатами. Буферный механизм твердой фазы перестает работать и наблюдается резкое увеличение концентрации неорганического фосфора с глубин более 15 см. Для зимнего сезона концентрация фосфора систематически выше, чем в июле (рис. 4). Также следует отметить чрезвычайно высокие значения N : P отношений, особенно для верхних горизонтов донных осадков (рис. 5г). В диагенезе ОВ принимают участие морские организмы инфауны и корни травы, они могут осуществлять преимущественное извлечение фосфатов для своей жизнедеятельности [39]. Увеличение концентрации кремния в поровой воде объясняется растворением кремнистых створок диатомей [28, 38]. Асимптотический профиль растворенного кремния в поровой воде исследуемых донных отложений является типичным и обусловлен растворением створок диатомей [17]. Однако предельные концентрации растворенного кремния разные для ст. 1 существенно выше, чем для ст. 2. Также они систематически выше для летнего сезона, что, по-видимому, обусловлено и большей концентрацией ОУ в твердой фазе осадка и более высокой скоростью минерализации ОВ. Необходимо также отметить, что после увеличения содержания кремния в верхнем 15 см слое ст. 2 в феврале, происходит его плавное уменьшение в нижележащих горизонтах. Это уменьшение обычно объясняется аутигенным образованием глинистых минералов [30]. Подобное уменьшение наблюдается в слое глубже 25 см зимой для ст. 1.
В результате диагенеза ОВ параметры карбонатной системы поровой воды существенно изменились в сравнении с придонной водой (рис. 6). Наблюдается увеличение ТА, которое сопровождается увеличением DIC, уменьшением рН и увеличением рСО2 (рис. 6а–6г). Очевидно, что главными продуктами минерализации ОВ являются гидрокарбонат ион (${\text{HCO}}_{{\text{3}}}^{ - }$) и двуокись углерода. Согласно уравнению (1) соотношения между $\Delta {\text{DIC}}\,{\text{: }}\Delta {\text{TA}}$ и $\Delta {\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}{\text{ : }}\Delta {\text{TA}}$, должны быть 106 : 121 = = 0.88 и –0.53 : 121 = –0.44 соответственно. Методом наименьших квадратов были получены углы наклона для зависимости DIC от TA для февраля: 1.156 (r 2 = 0.998) – б. Воевода и 1.101 (r 2 = = 0.997) – Амурский залив; для июля: 1.138 (r 2 = = 0.999) – б. Воевода и 1.014 (r 2 = 0.999) – Амурский залив. Значение угла наклона для всех данных, представленных на рис. 7а, равно 1.141 (r 2 = 0.999). Можно предположить, что действительно сульфатредукция является доминирующим процессом в диагенезе ОВ в донных отложениях обеих станций, тем более, что концентрация сульфат ионов уменьшается с увеличением щелочности поровой воды (рис. 7б). Однако методом наименьших квадратов были получены углы наклона для зависимости ${\text{[SO}}_{{\text{4}}}^{{{\text{2}} - }}]$ от TA для февраля: –0.80 (r 2 = 0.93) – б. Воевода и –0.71 (r 2 = 0.81) – Амурский залив; для июля: –0.47 (r 2 = 0.87) – б. Воевода и +1.014 (r 2 = 0.999) – Амурский залив. Значение угла наклона для всех данных, представленных на рис. 7б, равно –0.39 (r 2 = 0.37). На наш взгляд, разброс данных относительно теоретического угла наклона (–0.44) для зависимости, представленной на рис. 7б превышает экспериментальные ошибки, и обусловлен протеканием более сложных процессов, чем это представлено схемой (1) . В том случае, если реакция (1) сопряжена с взаимодействием образовавшегося сероводорода с ионами железа, присутствующими в донных осадка, то будет происходить образование сульфидов. Данную реакцию можно представить схемой:
(2)
${{{\text{H}}}_{{\text{2}}}}{\text{S}} + {\text{F}}{{{\text{e}}}^{{{\text{2}} + }}} \to {\text{Fe}}{{{\text{S}}}_{{{\text{тв}}{\text{.}}\,\,{\text{фаза}}}}} + {\text{2}}{{{\text{H}}}^{ + }}.$Рис. 7.
Зависимость концентрации растворенного неорганического углерода (а) и сульфат ионов (б) от щелочности в поровой воде донных отложений б. Воевода (1, 2) и в северной части Амурского залива (3, 4). Керны донных отложений отобраны в феврале (1, 3) и июле (2, 4) 2014 г.
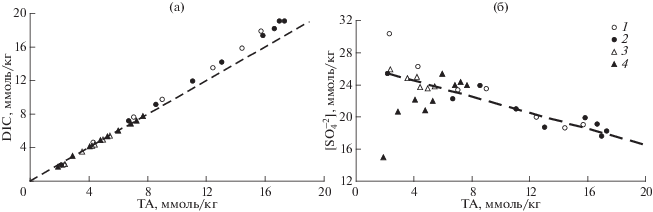
Реакция образования твердой фазы сульфида железа (2) будет уменьшать щелочность поровой воды, увеличивая угол наклона для зависимостей, представленных на рис. 7. Другим возможным процессом, который приводит к увеличению углов наклона для зависимостей DIC от TA и ${\text{[SO}}_{{\text{4}}}^{{{\text{2}} - }}]$ от TA (рис. 7а, 7б), это сочетание сульфатредукции (реакция (1)) с участием кислорода придонной воды в окислении ОВ, при условии, что регенерации сульфат ионов не происходит. Поступление в верхний слой донных отложений кислорода может обеспечиваться через биотурбацию и через сифонные системы инфауны. Наиболее заметное увеличение углов наклона было получено для февраля, когда концентрация кислорода в придонной воде была высокая (447 мкмоль/кг – б. Воевода и 396 мкмоль/кг Амурский залив), что указывает на вероятность этого процесса. Неожиданным результатом является положительный угол наклона для зависимости ${\text{[SO}}_{{\text{4}}}^{{{\text{2}} - }}]$ от TA для ст. 2 в июле. Эти значения вылетают из общего хода зависимости (черные треугольники на рис. 7б). В середине мая 2014 г. был паводок на р. Раздольной (расход реки достиг 400 м3/с). Поскольку ст. 2 расположена была недалеко от устья реки, то паводок изменил состав поровой воды. Для горизонтов 0–40 см произошла инфильтрация эстуарных вод, которая по нашим данным уменьшила концентрацию хлорид ионов и сульфат ионов. Концентрации макрокомпонентного состава морской воды, включая ${\text{[C}}{{{\text{l}}}^{ - }}]$, ${\text{[SO}}_{{\text{4}}}^{{{\text{2}} - }}]$, ТА линейно зависят друг от друга, с положительным углом наклона. Поэтому инфильтрация эстуарных вод в донные отложения, привела к тому, что результаты для июля на ст. 2 отличаются от общего хода зависимости, ${\text{[SO}}_{{\text{4}}}^{{{\text{2}} - }}]$ – TA (рис. 7б), который в целом обусловлен сульфатредукцией.
Диагенез ОВ приводит к уменьшению рН поровой воды и увеличению парциального давления углекислого газа в сравнении с придонной водой (рис. 6). Следует отметить, что сезонная изменчивость практически отсутствует в вертикальных профилях TA и DIC (рис. 6а, 6б), но она проявляется в профилях рН и рСО2 (рис. 6в, 6г). В феврале, температура придонных вод близка к точке замерзания морской воды (рис. 2). Увеличение температуры в летний сезон приводит к уменьшению рН и к увеличению рСО2 при прочих равных условиях. Несмотря на столь низкие значения рН поровой воды (менее 6.9 для ст. 1 в июле), эти воды немного пересыщены по отношению к кальциту и близки к насыщению по отношению к арагониту (рис. 6д, 6е). Исключением являются нижние горизонты ст. 2 в июле и придонные воды, где наблюдается 4-х-кратное пересыщение, а для придонных вод ст. 1, в зимний сезон вода пересыщена в 7 раз по отношению к кальциту, примерно в 5 раз по отношению к арагониту. Такие состояния рассматриваются как метастабильные и твердая фаза при таком пересыщении, как правило, не образуется [1]. Органическое вещество препятствует химическому образованию твердой фазы карбоната кальция. В тоже время, эти условия являются комфортными для жизни организмов имеющих карбонатный скелет, либо раковину. Этот вывод подтверждается визуальными наблюдениями – огромное количество отверстий в донных отложениях, сделанных двустворчатыми моллюсками.
Из полученных нами результатов следует, что, действительно, в области зарослей зостеры (ст. 1), донные отложения обогащены ОУ (рис. 3а) и идея захоронения атмосферного углекислого газа в донных осадках в форме ОВ имеет право на жизнь. Однако, около 50% от общего содержания ОУ в действительности не захоранивается, а перерабатывается в пределах верхних 40 см. Если пренебречь потоками на границе раздела “вода–дно”, то уменьшение ОУ обусловленное только микробиологической деструкцией ОВ должно сопровождаться эквивалентным увеличением концентрации DIC в поровой воде. Из рис. 3а следует, что в интервале горизонтов от 5 до 75 см содержание ОУ уменьшилось более чем на 30 мгС/г сухого осадка. Из массового баланса следует, что результатом такого уменьшения ОУ будет очень высокая концентрация DIC в поровой воде: 3 моль/кг для горизонта осадка 40 см и 4.9 моль/кг, для горизонта 75 см. Такие высокие концентрации DIC невероятны. Поэтому мы полагаем, что ключевым процессом утилизации ОВ в донных отложениях является его превращение в биомассу инфауны и в биомассу зостеры, которая имеет чрезвычайно развитую корневую систему в пределах 30 см слоя осадков. Лишь небольшая доля ОВ (по нашим оценкам 2–3%) подвергается микробиологической деструкции с участием сульфат-ионов в качестве акцепторов электронов. Другим важным микробиологическим процессом для донных осадков, содержащих высокие концентрации ОУ является метаногенез. Однако он проявляется в заметных количествах лишь при истощении сульфат-ионов, на что указывает термодинамическая модель диагенеза ОВ [21, 33], результаты изучения газового состава донных отложений [10, 29] и изотопные исследования сульфатредукции и метаногенеза [25]. Однако мы не исключаем метаногенез в более глубоких слоях осадков, в которых отсутствуют сульфат ионы, либо их концентрация становится менее 3 ммоль/кг, когда концентрация метана в донных осадках резко возрастает [10]. Более того, в осенний период на берегах мелководных бухт, покрытых зостерой, появляется острый запах сероводорода, который мы объясняем выделением пузырьков метана из глубоких слоев донных осадков. В работе [30] было высказано предположение, что пузырьки метана, выделяющиеся из более глубоких слоев донных осадков, захватывают в себя другие газы, содержащиеся в поровой воде. Таким образом, сероводород может транспортироваться пузырьками метана не только в придонную воду, но и к границе раздела вода/атмосфера, создавая острый запах сероводорода. Акустические исследования Амурского залива указывают на наличие пузырьков метана в глубинных слоях донных отложений [26]. Однако подобные исследования Карнауха В.Н. в б. Воевода не обнаружили газовых пузырьков [3].
Продукционная активность зостеры имеет сезонную изменчивость, минимальная продукция в марте, а максимальная в августе [7]. Однако исследуемые геохимические параметры донных отложений не проявляют заметной сезонной изменчивости (за исключением рН, рСО2). По-видимому, “избыточное” ОВ летнего сезона также утилизируется по пищевой цепи живыми организмами. Этот вывод подтверждается исследованиями работы [39].
ЗАКЛЮЧЕНИЕ
Мелководные бухты с зарослями зостеры, формируют донные отложения с высоким содержанием ОУ. Концентрация ОУ превышает 5% в расчете на сухой осадок, в тоже время на фоновой станции, концентрация ОУ углерода в верхнем слое осадка была менее 2%. Высокая концентрация ОУ в твердой фазе осадков б. Воевода приводит к интенсивному диагенезу ОВ. Высокие значения ТА, DIC, низкие значения рН и понижение концентрации сульфат-ионов с глубиной осадка указывают на то, что ключевым процессом диагенеза ОВ является сульфатредукция. В результате диагенеза ОВ поровая вода обогащается биогенными веществами (фосфатами, силикатами, аммонием, растворенным органическим углеродом). Резкое уменьшение ОУ донных отложений, несбалансированное эквивалентным увеличением неорганического углерода, указывает на то, что ключевым процессом утилизации ОВ в местах зарослей зостеры является его трансформация в биомассу инфауны. Установлено, что около 50% от общего содержания ОУ в донных осадках б. Воевода перерабатывается в пределах верхних 40 см. Исследования, проведенные в разные сезоны (февраль, июль) обнаружили незначительные увеличения в концентрациях ОУ, аммония, кремния, ТА и DIC в летний сезон, несмотря на высокую сезонную изменчивость продукционной активности зостеры. Заметные уменьшения в рН и увеличение рСО2 наблюдались для июля, что обусловлено влиянием увеличения температуры на карбонатное равновесие в поровой воде.
Благодарности. Работа выполнена при финансовой поддержке приоритетной комплексной программы РАН “Дальний Восток” (гранты № 18-1-007; № 18-1-010), грант РФФИ – № 20-05-00381-a, программы фундаментальных научных исследований академии наук на 2013–2020 гг. (темы № 01201363041 и № 01201353055).
Список литературы
Алекин О.А., Ляхин Ю.И. К вопросу о причинах пересыщения морской воды карбонатом кальция // Докл. АН СССР. 1968. Т. 178. № 1. С. 191–194.
Аржанова Н.В., Лапина Н.М., Налетова И.А., Торгунова Н.И. Руководство по современным биохимическим методам исследования водных экосистем, перспективных для промысла и марикультуры. М.: Изд-во ВНИРО, 2004. 123c.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю. и др. Условия образования лечебных грязей в бухте Воевода (Амурский залив, Японское море) // Изв. ТИНРО. 2018. Т. 192. С. 167–176.
Бергер В.Я. О продукции зестеры Zostera Marina Linnaeu, 1753 в Белом море // Биология моря. 2011. Т. 37. № 5. С. 362–366.
Лоенко Ю.Н., Артюков А.А., Козловская Э.П. и др. Зостерин. Владивосток: Дальнаука, 1997. 211 с.
Лоция северо-западного берега Японского моря. СПб.: ГУНИО МО, 1996. С. 45–46.
Лысенко В.Н., Матюшин В.М. Сезонные изменения роста и продукции зостеры в бухте Витязь Японского моря // Биология моря. 1984. № 4. С. 38–45.
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во МГУ, 1990. 323 с.
Павлова Г.Ю., Тищенко П.Я., Волкова Т.И. и др. Интеркалибрация метода Бруевича для определения общей щелочности в морской воде // Океанология. 2008. Т. 48. № 3. С. 477–483.
Пименов Н.В., Егоров В.Н., Канапацкий Т.А. и др. Микробные процессы цикла метана и сульфатредукция в осадках акватории севастопольских бухт // Микробиология. 2013. Т. 82. № 5. С. 614–624.
Политова Н.В., Клювиткин А.А., Новигатский А.Н. и др. Ранний диагенез в современных донных осадках Двинского залива Белого моря // Океанология. 2016. Т. 56. № 5. С. 771–783.
Сабитова Л.И., Скрипцова А.В., Чербаджи И.И. Продукционные показатели сообщества Zostera japonica Ascherson et Graebner, 1907 в заливе Голубиный (Японское море) // Биология моря. 2018. Т. 44. № 5. С. 357–364.
Тищенко П.П., Тищенко П.Я., Звалинский В.И., Сергеев А.Ф. Карбонатная система Амурского залива (Японское море) в условиях гипоксии // Океанология. 2011. Т. 51. № 2. С. 246–257.
Тищенко П.Я., Михайлик Т.А., Павлова Г.Ю. и др. Карбонатное равновесие вод реки Раздольной // Геохимия. 2017. Т. 55. № 3. С. 236–248.
Тищенко П.Я., Вальманн К., Василевская Н.А. и др. Вклад органического вещества в щелочной резерв природных вод // Океанология. 2006. Т. 46. № 2. С. 211–219.
Ходоренко Н.Д., Волкова Т.И., Звалинский В.И., Тищенко П.Я. Кинетика извлечения и количественное определение гуминовых веществ в донных отложениях // Геохимия. 2013. Т. 50. № 4. С. 423–430.
Aller R.C. Sedimentary diagenesis, depositional environments, and benthic fluxes // Treatise on Geochemistry, 2nd edition Eds. Holland, H.D., Turekian, K.K. Oxford: Elsevier, 2014. V. 8. P. 293–334.
Burdige D.J. Sediment pore waters // Biogeochemistry of marine dissolved organic matter / Eds. Dennis A. et al. San Diego: Academic Press, An Imprint of Elsevier Science, 2002. Ch. 13. P. 611–663.
Dahl M., Deyanova D., GuÈtschow S. et al. Sediment Properties as Important Predictors of Carbon Storage in Zostera marina Meadows: A Comparison of Four European Areas // PLOS ONE. 2016. V. 11. 12. e0167493. https://doi.org/10.1371/journal.pone.0167496
Duarte C.M., Sintes T., Marba N. Assessing the CO2 capture potential of seagrass restoration projects // J. Appl. Ecology. 2013. V. 50. P. 1341–1349.
Emerson S., Hedges J. Sediment Diagenesis and Benthic Flux // Treatise on Geochemistry. Amsterdam: Elsevier, 2006. V. 6. P. 293–319.
Froelich P.N. Kinetic control of dissolved phosphate in natural rivers and estuaries: A primer on the phosphate buffer mechanism // Limnol. Oceanogr. 1988. V. 33. № 4. P. 649–668.
Grasshoff K., Ehrhardt M., Kremling K. Methods of Seawater Analysis. Verlag Chemie, 1983. 419 p.
Iizumi H., Hattori A., McRoy C.P. Ammonium regeneration and assimilation in Eelgrass (Zostera marina) Beds // Mar. Biol. 1982. V. 66. P. 59–65.
Jakobsen R., Cold L. Geochemistry at the sulfate reduction–methanogenesis transition zone in an anoxic aquifer—A partial equilibrium interpretation using 2D reactive transport modeling // Geochim. Cosmochim. Acta. 2007. V. 71. P. 1949–1966.
Karnaukh V.N., Astakhov A.S., Vereshchagina et al. Formation of subsurface shallow gas accumulations in Amurskiy Bay (Peter the Great Bay, Sea of Japan) as a result of postglacial sea-level change, paleoceanographic conditions and hydrological activity // Mar. Geology. 2016. V. 372. P. 31–52.
Kennedy H., Beggins J., Duarte C.M. et al. Seagrass sediments as a global carbon sink: Isotopic constraints // Global Biogeochem. Cycles. 2010. V. 24. GB4026, https://doi.org/10.1029/2010GB003848
Lisitzin A.P. The silica cycle during the last ice age // Palaeogeogr., Palaeoclimat., Palaeoecol. 1985. V. 50. P. 241–270.
Martens C.S., Berner R.A. Interstitial water chemistry of anoxic Lbng Island Sound sediments. 1. Dissolved gases1 // Limnol. Oceanogr. 1977. V. 22. P. 10–25.
März C., Meinhardt A.-K., Schnetger B., Brumsack H.-J. Silica diagenesis and benthic fluxes in the Arctic Ocean // Mar. Chem. 2015. V. 171. P. 1–9.
Mcleod E., Chmura G.L., Bouillon S. et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2 // Front Ecol Environ. 2011. V. 9. № 10. P. 552–560.
McRoy C.P. Seagrass productivity: carbon uptake experiments in eelgrass, Zoster Marina // Aquaculture. 1974. V. 4. P. 131–137.
Middelburg J.J., Levin L.A. Coastal hypoxia and sediment biogeochemistry // Biogeosciences. 2009. V. 6. P. 1273–1293.
Redfield A.C., Ketchum B.H., Richards F.A. The influence of organisms on the composition of seawater // The Sea / Ed. Hill. M.N. New York: Interscience, 1963. V. 2. P. 26–77.
Röhr M.E., Boström C., Canal-Vergés P., Holmer M. Blue carbon stocks in Baltic Sea eelgrass (Zostera marina) meadows // Biogeosciences, 2016. V. 13. P. 6139–6153.
Sundby B., Gobeil C., Silverberg N., Mucci A. The phosphorus cycle in coastal marine sediments // Limnol. Oceanogr. 1992. V. 37. № 6. P. 1129–1145.
Tishchenko P., Pavlova G., Sagalaev S. et al. Observations of carbonate system parameters in seawater using discrete samples, in surface waters by underway system and in sediments on a board of R/V Hakuho Maru at June–July 2010 // Preliminary Report of the R/V Hakuho Maru KH-10-2 Cruise CARINA Expedition – ASIAN GEOTRACES June 11, 2010–July 23, 2010 P. 98–120.
Treppke U.F., Lange C.B., Wefer G. Vertical fluxes of diatomes and silicaflagellates in the eastern eaquatarial Atlantic, and their contribution to the sedimentary record // Mar. Micropaleont. 1996. V. 28. P. 73–96.
Van der Geest M. Multi-trophic interactions within the seagrass beds of Banc d’Arguin, Mauritania: a chemosynthesis-based intertidal ecosystem. PhD Thesis, University of Groningen, Groningen. Netherlands, 2013. 254 p.
Дополнительные материалы отсутствуют.