Океанология, 2020, T. 60, № 5, стр. 711-719
Донные сообщества залива Седова (Новая Земля, Карское море)
А. А. Удалов 1, *, А. А. Веденин 1, А. И. Чава 1, С. А. Щука 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: aludal@mail.ru
Поступила в редакцию 15.05.2020
После доработки 18.05.2020
Принята к публикации 22.06.2020
Аннотация
В ходе рейсов НИС “Академик Мстислав Келдыш” в 2015–2016 гг. было проведено исследование донной фауны залива Седова (Карское море, архипелаг Новая Земля). Было описано три основных сообщества макробентоса. Видовая структура донной фауны залива формируется под действием двух ортогональных градиентов – вертикального (глубинного) и горизонтального (расстояние от кута залива). Горизонтальные изменения определяются в первую очередь характером терригенного стока, несмотря на общие низкие значения содержания взвешенных частиц в толще воды залива. Этот фактор, определяя трофические условия существования донных беспозвоночных, действует в рамках одного сообщества, влияя на смену долей массовых видов. Усиление действия фактора ведет к более существенным перестройкам в донных сообществах (выпадение ряда видов, обособление крайних вариантов сообществ, обеднение), как это наблюдается в соседних заливах восточного побережья Новой Земли.
Карское море является одним из наиболее изученных морей Российской Арктики [3, 12, 14]. При этом если донные сообщества открытых частей моря [4, 17, 20], Объ-Енисейского мелководья [2, 22] и Байдарацкой губы [5] описаны очень подробно, то прибрежные области двух больших архипелагов (Северная Земля и Новая Земля) до последнего времени оставались за пределами исследований. Для Новой Земли это было связано с более чем полувековым закрытием доступа исследователей в район, обусловленного производимыми здесь ядерными испытаниями [1, 6]. Подробные комплексные исследования современного состояния экосистем заливов восточного побережья Новой Земли были начаты ИО РАН в 2007 г., в рамках проекта на настоящее время подробно исследовано 6 заливов [8–11, 13]. Данная работа посвящена донным сообществам залива Седова, наиболее глубокого залива, отличающегося от остальных двумя важными особенностями – отсутствием терминальных выводных ледников и отсутствием мелководного порога на выходе из залива.
МАТЕРИАЛЫ И МЕТОДЫ
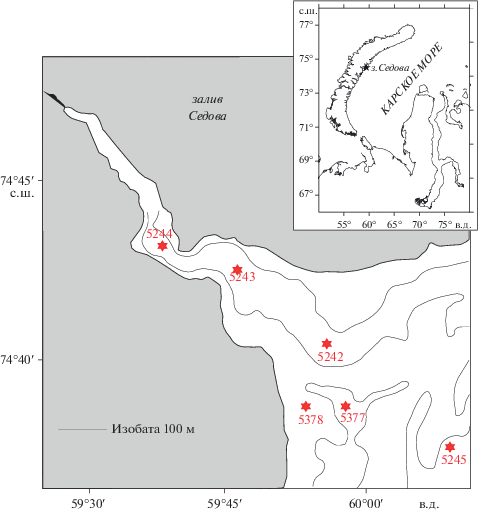
Работы в заливе Седова были проведены в ходе 63-го и 66-го рейсов НИС “Академик Мстислав Келдыш” в 2015–2016 гг. (табл. 1). Было выполнено 6 станций (рис. 1). Для отбора количественных проб макробентоса использовали дночерпатель “Океан” с площадью раскрытия 0.1 м2. На каждой станции было взято по 3 пробы. Грунт промывали на сите с диаметром ячеи 0.5 мм. Собранных животных фиксировали нейтрализованным 5–6% формалином, разбирали по основным таксономическим группам и переводили в 70% спирт.
Таблица 1.
Характеристики сублиторальных станций залива Седова
| Станция | Дата | Координаты | Глубина, м | Тип грунта | |
|---|---|---|---|---|---|
| с.ш. | в.д. | ||||
| 5242 | 25.09.2015 | 74°40.4′ | 059°56.1′ | 194 | Ил |
| 5243 | 25.09.2015 | 74°42.6′ | 059°46.0′ | 200 | Ил |
| 5244 | 25.09.2015 | 74°43.3′ | 059°37.5′ | 161 | Ил, мелкие камни |
| 5245 | 26.09.2015 | 74°37.3′ | 060°10.0′ | 107 | Ил, мелкие камни |
| 5377 | 08.08.2016 | 74°38.5′ | 059°57.8′ | 134 | Ил |
| 5378 | 08.08.2016 | 74°38.5′ | 059°53.7′ | 54 | Ил |
Параллельно на станциях определяли основные параметры водной толщи и тип грунта. Профилирование водной толщи от поверхности до дна проводили с помощью CTD зонда SBE 911 Plus. При этом измеряли вертикальное распределение температуры, электрической проводимости (соленость), содержание растворенного кислорода, мутности (ЕМФ).
В качестве меры обилия использовали относительную интенсивность метаболизма M = = ki$N_{i}^{{0.25}}{\text{B}}_{i}^{{0.75}}$, где Ni – численность, Bi – биомасса организмов, а ki – специфический коэффициент для конкретной таксономической группы [22]. Анализ сходства станций и выделение сообществ были проведены с помощью методов многомерного шкалирования и кластерного анализа с использованием пакета программ PRIMER 6.0. При выделении групп были использованы как усредненные данные по станциям, так и данные по конкретным пробам, что позволило более полно оценить стабильность выделенных группировок при небольшом числе станций. Достоверность выделения групп оценивали с помощью процедуры ANOSIM. Вклад видов во внутригрупповое сходство/различие оценивали с помощью процедуры SIMPER [15]. Анализ BEST (процедура BIOENV) использовался для выявления параметров окружающей среды, наилучшим образом объясняющих структуру сообществ [16]. В качестве параметров использовались трансформированная матрица видового сходства (индекс Брея–Кертиса), а также параметры среды – глубина, основные гидрологические параметры в придонном слое (температура, соленость, мутность, содержание кислорода). В качестве дополнительного параметра, описывающего интегральные изменения среды, связанные со стоком, мы использовали линейное расстояние от станции до кута залива (DISTANCE).
РЕЗУЛЬТАТЫ
Характеристика залива Седова. Факторы среды. Залив Седова – фьордового типа, достаточно простой по морфометрии, длинный и узкий. Его протяженность составляет 20 км, максимальная ширина на входе – 6 км. Центральная часть представляет собой котловину с глубинами 150–200 м, которая, плавно меандрируя, переходит во внешний склон Новоземельской впадины. С южной стороны залива в него вдается широкий береговой уступ с глубинами порядка 50 м, что является характерной особенностью для всех трех смежных заливов кластера Ога–Цивольки–Седова. В отличие от других заливов, порог на выходе отсутствует. При этом залив Седова отличается наиболее слабым терригенным стоком.
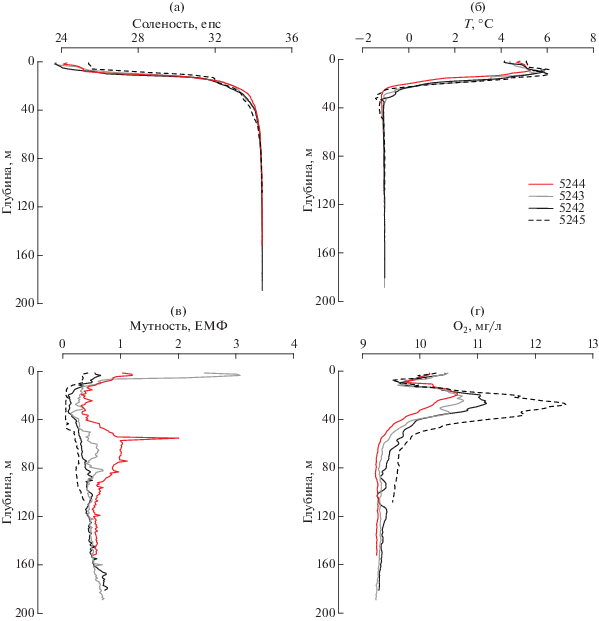
В летний период температура поверхностных вод составляла +4–6°С, поверхностная соленость 24–26 епс (рис. 2а, 2б). На всем протяжении залива слой скачка располагался на глубине 35–40 м. Глубже показатели температуры и солености выравнивались и составляли –1.05°С и 34.4 епс соответственно. При этом насыщение вод кислородом на всем протяжении залива у дна было около 9.3 мг/л (рис. 2г). Распределение мутности более разнородно. В частности, на станции 5243 наблюдались достаточно высокие значения в поверхностном слое 0–5 м (2.5–3 ЕМФ), что обусловлено наличием близкорасположенного водотока. На станциях, расположенных во внутренней части залива наблюдался промежуточный слой (50–90 м) с повышенной мутностью, непосредственно под слоем скачка (рис. 2в). Концентрация взвеси в этом слое последовательно убывала по оси залива – если на терминальной станции 5242 значения мутности составляли 1 ЕМФ, то по мере удаления в сторону открытой части они последовательно уменьшались (0.6–0.33–0.27 ЕМФ в ряду станций 5243–5242–5245 соответственно) (рис. 2в). В более глубоких слоях (100–150 м) мутность на всем протяжении залива выравнивалась и составляла 0.5–0.7 ЕМФ. Таким образом, характеристики придонных вод были практически одинаковы.
Рис. 2.
Вертикальное распределение основных гидрофизических параметров вдоль разреза через залив Седова (от кутовой части до внешнего склона, см. рис. 1). (а) – соленость, (б) – температура, (в) – мутность, (г) – содержание кислорода. Данные приведены на 25–26.09.2015 г.
Грунты на всем протяжении залива представлены тонкими илами. Периодически даже на большой глубине встречаются камни разного размера, видимо за счет ледового разноса.
Интегральные характеристики макробентоса залива Седова. В ходе исследования на 6 станциях найдено 103 вида макробентоса. Наиболее богатыми группами по числу видов являлись полихеты (37 видов), моллюски (26 видов, из них двустворчатые – 17 видов) и ракообразные (17 видов). Остальные таксоны (иглокожие, мшанки, мягкие кораллы, губки, приапулиды, сипункулиды и немертины) представлены 1–6 видами.
11 видов встречены на всех станциях, эти 11 видов составляют 75% общей численности организмов. Доминируют по численности двустворчатые моллюски Mendicula ferruginosa, Yoldiella solidula и полихета Scoletoma fragilis. При этом 69 видов встречены менее чем в 10 экземплярах, 25 видов представлены в диапазоне 10–100 экз. Только для 9 видов число найденных экземпляров превышает 100, а общим числом особей больше 1000 экз. представлен один вид (Mendicula ferruginosa). 58 видов представлены единичными экземплярами на 1–2 станциях и они составляют 3.9% численности. Фактически, мы наблюдаем достаточно однородную фауну с выраженным доминированием небольшого числа видов.
Плотность поселения организмов макробентоса во внутренней части залива составляет около 2700 экз./м2 (станции 5242, 5243, 5244). Во внешней части залива (станции 5245 и 5377) плотность меньше и составляет около 1700 экз./м2. Значения биомассы изменяются сходным образом – если на основной части залива средние значения составляют 62.2 г/м2, то во внешней части они падают до 19.5 г/м2. Доминирующим видом по биомассе является офиура Ophiopleura borealis.
Число видов в пробе (на 0.1 м2) изменяется от 18 до 33 (среднее значение – 27 видов). Число видов на станции варьирует от 29 до 50 (среднее – 43.5). При этом никаких направленных изменений общих показателей разнообразия в заливе не наблюдается, что также подтверждается индексами разнообразия ($H_{{{\text{ср}}}}^{{\text{'}}}$ = 2.3 и ES(200) ср. = 25.4).
Сообщества макробентоса. В заливе Седова мы наблюдаем достаточно высокое сходство проб – 63%, что свидетельствует об общности фауны. При этом можно выделить 3 группы станций (и проб), соответствующие трем основным донным сообществам (ANOSIM test: Global R = 0.682, p = 0.001) (рис. 3). Наибольшие отличия наблюдаются между населением станции 5378 (группа I), расположенной на склоновом уступе на выходе из залива на глубине 54 м, и населением остальных станций котловины залива с глубинами 100–200 м (рис. 3). SIMPER показывает, что основной вклад в отличие этой станции от остальных обеспечивает высокое обилие Astarte crenata, а также отсутствие офиур, главным образом Ophiopleura borealis, часто встречающейся в более глубоких частях залива (табл. 2). Astarte crenata доминирует по биомассе, по численности доминируют мелкие полихеты Scoletoma fragilis и Cirratulidae gen. sp. (табл. 3). Надо заметить, что Scoletoma fragilis массово представлена практически на всех станциях залива и в связи с этим вносит высокий вклад во внутригрупповое сходство всех трех групп (табл. 2).
Рис. 3.
Дендрограмма сходства станций (a) и анализ сходства проб методом многомерного шкалирования (б). Символы соответствуют сообществам макробентоса, описание сообществ см. табл. 3.
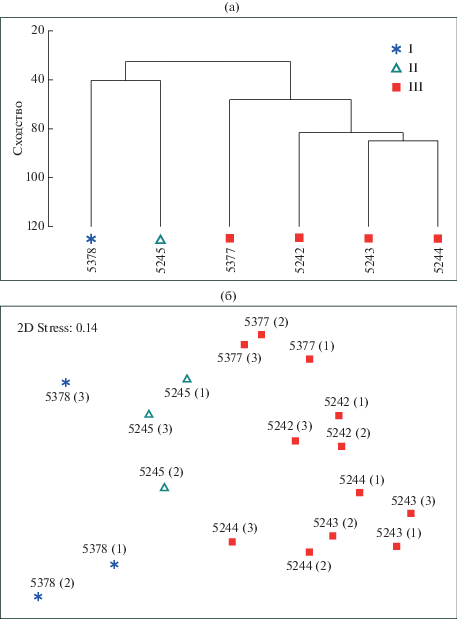
Таблица 2.
Результаты процентного анализа сходства (SIMPER) для выделенных видовых групп. Приведены вклады основных видов, обеспечивающих: (сх, %) – внутригрупповое сходство; (разл, %) – основные различия между группами
| Группа I | сх | ||||
| Astarte crenata | 17.83 | ||||
| Scoletoma fragilis | 13.41 | ||||
| Cirratulidae gen. sp. | 8.57 | ||||
| Yoldiella solidula | 5.42 | ||||
| Thyasira dunbari | 4.93 | ||||
| I vs II | разл | Группа II | разл | ||
| Astarte crenata(I) | 9.89 | Ennucula tenuis | 12.76 | ||
| Ophiacantha bidentata(II) | 7.69 | Yoldiella solidula | 11.6 | ||
| Ennucula tenuis(II) | 5.67 | Scoletoma fragilis | 11.41 | ||
| Yoldiella solidula(II) | 3.96 | Ophiacantha bidentata | 9.48 | ||
| Aglaophamus malmgreni(II) | 3.55 | Nephasoma spp. | 9.1 | ||
| I vs III | разл | II vs III | разл | Группа III | сх |
| Astarte crenata(I) | 10.68 | Ophiacantha bidentata(II) | 8.11 | Scoletoma fragilis | 20.53 |
| Ophiopleura borealis(III) | 5.15 | Ophiopleura borealis(III) | 5.52 | Mendicula ferruginosa | 9.42 |
| Spionidae gen. sp.(III) | 3.8 | Nephasoma spp.(II) | 4.09 | Scoloplos armiger | 8.69 |
| Nothria hyperborea(III) | 3.72 | Spionidae gen. sp.(III) | 4.01 | Ennucula tenuis | 7.02 |
| Ennucula tenuis(III) | 3.11 | Nothria hyperborea(III) | 3.99 | Thyasira dunbari | 6.8 |
| Ophiopleura borealis | 5.8 |
Таблица 3.
Донные сообщества залива Седова
| Тип сообщества/ станции |
Число видов | N, экз./м2 | B, г/м2 | Доминирующие виды | Доля по дыханию |
|---|---|---|---|---|---|
| I | 49 | 20 | 35.3 | Astarte crenata | 58.2 |
| (5378) | 287 | 0.66 | Scoletoma fragilis | 6.3 | |
| 170 | 0.21 | Cirratulidae gen. sp. | 2.3 | ||
| 83 | 0.08 | Yoldiella solidula | 1.0 | ||
| 1300 | 44.2 | Сумма всех видов | 100 | ||
| II | 50 | 50 | 7.0 | Ophiacantha bidentata | 28.2 |
| (5245) | 77 | 1.84 | Ennucula tenuis | 13.9 | |
| 533 | 0.44 | Yoldiella solidula | 7.8 | ||
| 217 | 0.6 | Scoletoma fragilis | 7.6 | ||
| 210 | 0.28 | Nephasoma spp. | 4.5 | ||
| 10 | 0.47 | Aglaophamus malmgreni | 2.9 | ||
| 2013 | 16.8 | Сумма всех видов | 100 | ||
| III | 76 | 5 | 17.12 | Ophiopleura borealis | 16.9 |
| (5242; 5243; | 309 | 2.83 | Scoletoma fragilis | 14.2 | |
| 52444; 5377) | 14 | 6.57 | Spionidae gen. sp. | 7.7 | |
| 15 | 5.34 | Nothria hyperborea | 7.1 | ||
| 35 | 1.78 | Ennucula tenuis | 5.7 | ||
| 88 | 1.26 | Scoloplos armiger | 4.2 | ||
| 883 | 0.3 | Mendicula ferruginosa | 3.4 | ||
| 259 | 0.27 | Yoldiella solidula | 3.4 | ||
| 58 | 0.59 | Thyasira dunbari | 3.4 | ||
| 137 | 0.28 | Trochoderma elegans | 2.9 | ||
| 75 | 0.08 | Cirratulidae gen. sp. | 0.8 | ||
| 92 | 0.02 | Micronephthys minuta | 0.5 | ||
| 2375 | 51.9 | Сумма всех видов | 100 |
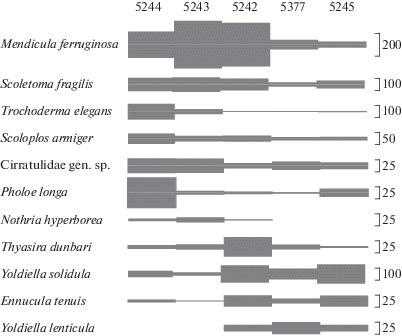
Группа II (ст. 5245) приурочена к внешней части залива. Здесь располагается сообщество с доминированием Ophiacantha bidentata, Ennucula tenuis и ряда других видов (Yoldiella solidula, Scoletoma fragilis), широко распространенных на всей акватории залива (табл. 3). Отличия группы II обусловлены в первую очередь высоким обилием здесь Ophiacantha bidentata, тогда как во внутренних частях залива наблюдается высокое обилие Ophiopleura borealis (табл. 2). Группа III занимает всю центральную часть залива (табл. 3). Внутригрупповое сходство обеспечивается в первую очередь такими видами, как Scoletoma fragilis, Mendicula ferruginosa, Scoloplos armiger и Ennucula tenuis (табл. 2). При этом внутри группы наблюдаются градиентные изменения структуры сообщества, обусловленные последовательными изменениями численности основных видов по оси залива (рис. 4). Так, происходит увеличение доли двустворчатых моллюсков Yoldiella lenticula, Yoldiella solidula и Thyasira dunbari в сторону внешней части залива, и, напротив, повышение обилия сипункулиды Golfingia margaritacea и полихет семейства Spionidae и Nothria hyperborea на внутренних станциях (станции 5244 и 5243).
Рис. 4.
Изменение численности массовых видов макробентоса вдоль оси залива. Толщина линии соответствует плотности особей (в соответствии с приведенными справа шкалами).
Влияние факторов среды на распределение донных сообществ. Анализ BIOENV показал, что комбинация действия двух факторов – глубины (DEPTH) и расстояния от кута залива (DISTANCE) наилучшим образом объясняет наблюдаемую картину видовой структуры бентоса (R = = 0.713; p = 0.003). При этом включение остальных факторов в модель (мутность, температура, содержание кислорода) не влияет на уровень объяснения. Таким образом, видовая структура донной фауны формируется под действием двух ортогональных градиентов – вертикального (глубинного) и горизонтального (расстояние от кута залива).
ОБСУЖДЕНИЕ
Хотя из-за небольшого количества станций и отсутствия исследований в наиболее внутренних кутовых участках, обусловленного навигационными причинами, мы не можем претендовать на полноту описания донных сообществ залива Седова, тем не менее можно заключить, что донная фауна залива представлена широко распространенными видами, характерными как для остальных заливов восточного побережья Новой Земли, так и для открытой части Карского моря. При этом основные количественные характеристики донных сообществ сходны с таковыми для остальных заливов восточного побережья Новой Земли [9–11, 13]. Сообщества основной части залива Седова (группы II и III) сходны с таковыми внешних частей заливов Ога, Цивольки и Благополучия. Это сходство обусловлено высокой долей в них двустворчатых моллюсков Ennucula tenuis, Yoldiella solidula, Y.lenticula, Mendicula ferruginosa, а также офиур Ophiopleura borealis и полихет Scoletoma fragilis и Cirratulidae gen. sp. [9–11, 13].
Основной особенностью соседних заливов – Ога и Цивольки – является наличие выходов ледников в кутовых частях, которые определяют особенности теригенного стока, распреснения и осадконакопления. Для этих заливов, как и для ряда других ледниковых фьордов [11, 13, 21, 23, 24], показано существенное обеднение донных сообществ, обитающих в кутовых частях, как по разнообразию, так и по количественным характеристикам. В отличие от вышеупомянутых заливов в з. Седова нет выходов ледника, однако градиентный характер распределения донной фауны все равно выражен, несмотря на сходные значения абиотических факторов на всем протяжении залива – глубину, грунт, соленостно-температурные условия, содержание кислорода и придонную мутность (рис. 2). Об этом свидетельствуют как подтвержденные последовательные изменения видовой структуры с расстоянием от кута залива, так и изменения в распределении массовых видов (рис. 4).
Само по себе расстояние не является действующим фактором, а лишь отражает совместный эффект ряда факторов, действующих коллинеарно и связанных с одной стороны с терригенным стоком и, с другой стороны, с влиянием открытого моря. Ведущим из этих факторов, меняющихся градиентно по заливу, является содержание взвешенных частиц в толще воды или мутность (рис. 2в). По причине достаточно больших глубин в терминальных частях заливов именно мутность (а не распреснение) главным образом оказывает влияние на донные сообщества и на их последовательную смену с изменением расстояния от выхода ледника [18, 19]. Изменения этого фактора носят сезонный характер, так как питание всех заливов Северного острова исключительно ледниковое и связано с их сезонным таянием. Также важно отметить, что особенности седиментации хотя и зависят от общей мутности, но носят нелинейный характер. В частности, даже при высоких значениях вертикальных потоков взвешенного вещества накопление донных осадков может быть невелико за счет выноса осадочного вещества в соседние районы мощными придонными течениями [7]. При этом, судя по состоянию донных сообществ, основная седиментация происходит в первой приледниковой котловине, причем ее степень существенно зависит от микрорельефа [11]. Содержание взвешенных частиц в водах залива существенно ниже такового для кутовых и даже средних частей заливов Ога и Цивольки. Максимальные зарегистрированные значения показателя мутности в поверхностных слоях з. Седова составляли 3 ЕМФ, средние значения по столбу воды на станциях внутренней части залива – 0.5 ЕМФ. В заливах Ога и Цивольки максимальные значения поверхностной мутности на кутовых станциях были за пределом измерения датчика (более 24.5 ЕМФ) при средних значениях по столбу воды 2–21 ЕМФ в зависимости от года и сезона. Вероятно, именно этот фактор (общий низкий уровень содержания взвешенных частиц) определяет отсутствие обеднения сообществ в верхней части залива Седова, а также отсутствие сообществ с доминированием Portlandia arctica, характерных для остальных заливов восточного побережья со сходными грунтами и глубинами [9–11, 13].
Еще одна важная особенность з. Седова – отсутствие порога на выходе из залива. Несмотря на то, что даже его наличие все равно не приводит к изоляции сообществ внутренних частей заливов для Новой Земли [9], его отсутствие и, соответственно, плавное изменение глубины в рамках одной формы рельефа приводит к наличию непрерывного градиента изменения донной фауны по всему заливу. При этом сообщества, аналогичные таковым, распространенным на внешних склонах порогов тех заливов, где порог выражен, населяют склоновые уступы в районе выхода из залива Седова (ст. 5378). Это сообщества группы I с доминированием Astarte crenata [10, 13].
Градиентный характер распределения донной фауны по оси залива проявляется в рамках одного сообщества путем смены долей массовых видов. В направлении кутовой части увеличивается доля полихет – Scoletoma fragilis, Spionidae gen. sp., Pholoe longa, Syllidae gen. sp., сипункулид Golfingia margaritacea, Nephasoma spp. и голотурии Trochoderma elegans, тогда как в противоположном направлении увеличивается доля двустворчатых моллюсков – Ennucula tenuis, Yoldiella solidula, Y. lenticula, Mendicula ferruginosa (рис. 4).
Таким образом, даже один, довольно слабо выраженный и действующий сезонно фактор (в данном случае – содержание взвешенных частиц) приводит к направленным изменениям в структуре донных сообществ. Усиление действия фактора ведет к более существенным перестройкам в донных сообществах, которое заключается в выпадении ряда видов в крайних вариантах и обособлении новых локальных сообществ, как это наблюдается в соседних заливах восточного побережья [11, 13].
Источник финансирования. Работа выполнена при поддержке РФФИ (проекты № 18-05-60 053, камеральная обработка и определение организмов донной фауны, № 18-05-60 302, получение гидрофизических данных и № 18-05-60 070, анализ материала по факторам среды и донным сообществам).
Список литературы
Айбулатов Н.А. Экологическое эхо холодной войны в Российской Арктике. М. ГЕОС. 2000. 307 с.
Галкин С.В., Кучерук Н.В., Минин К.В. и др. Макробентос эстуарной зоны реки Обь и прилежащих районов Карского моря // Океанология. 2010. Т. 50. № 5. С. 837–841.
Карское море. Экологический атлас. Москва: ООО “Арктический научный центр”. 2016. 271 с.
Козловский В.В., Чикина М.В., Кучерук Н.В., Басин А.Б. Структура сообществ макрозообентоса юго-западной части Карского моря // Океанология. 2011. Т. 51. № 6. С. 1072–1081.
Кокарев В.Н., Козловский В.В., Азовский А.И. Современное состояние макрозообентоса Байдарацкой губы (Карское море) // Океанология. 2015. Т. 55. № 5. С. 801–807.
Матишов Г.Г., Матишов Д. Г., Щипа Е., Павлова Л. Г. Радиоактивное загрязнение среды и биоты на Новой Земле вследствие испытаний ядерного оружия // Докл. РАН. 1994. Т. 337. № 6. С. 824–826.
Политова Н.В., Шевченко В.П. Потоки осадочного вещества в прибрежной зоне архипелага Новая Земля и о. Вайгач // Природа шельфа и архипелагов европейской Арктики. Вып. 8. Материалы международной научной конференции (Мурманск, 9-11 ноября 2008 г.). М.: ГЕОС, 2008. С. 311–315.
Степанова С.В., Недоспасов А.А. Особенности гидрофизического и гидрохимического режимов залива Благополучия (Новая Земля) // Океанология. 2017. Т. 57. № 1. С. 75–85.
Удалов А.А., Веденин А.А., Симаков М.И. Донная фауна залива Благополучия (Новая Земля, Карское море) // Океанология. 2016. Т. 56. № 5. С. 720–730.
Удалов А.А., Веденин А.А., Чава А.И. Донная фауна залива Степового (Новая Земля, Карское море) // Океанология. 2018. Т. 58. № 6. С. 923–932.
Удалов А.А., Веденин А.А., Чава А.И., Щука С.А. Донная фауна залива Ога (Новая Земля, Карское море) // Океанология. 2019. Т. 59. № 6. С. 1028–1038.
Филатова З.А., Зенкевич Л.А. Количественное распределение донной фауны Карского моря // Труды Всесоюзного Гидробиологического Общества. 1957. Т. VIII. С. 3–67.
Чава А.И., Удалов А.А., Веденин А.А. и др. Донная фауна залива Цивольки (архипелаг Новая Земля, Карское море) // Океанология. 2017. Т. 57. № 1. С. 160–170.
Экология и биоресурсы Карского моря. Апатиты: Изд. КНЦ АН СССР. 1989. 153 с.
Clarke K.R. Non-parametric multivariate analyses of changes in community structure // Aust. J. Ecol. 1993. V. 18. P. 117–143.
Clarke K.R., Gorley R.N. PRIMER v6: User Manual/Tutorial // PRIMER-E: Plymouth. 2006. 190 p.
Denisenko N.V., Rachor E., Denisenko S.G. Benthic fauna of the Southern Kara Sea // Siberian river run-off in the Kara Sea / Elsevier Ltd. 2003. P. 213–236.
Görlich K., Weslawski J.M., Zajaczkowski M. Suspension settling effect on macrobenthic biomass distribution in the Hornsund fjord, Spitsbergen // Polar Research 5 new series. 1987. P. 175–192.
Holte B., Dahle S., Naes K., Gulliksen B. Some macrofaunal effects of local pollution and glacier-induced sedimentation, with indicative chemical analyses, in the sediments of two arctic fjords // Polar Biol. 1996. V. 14. P. 917–927.
Jorgensen L.L., Pearson T.H., Anisimova N.A. et al. Environmental influences on benthic fauna associations of the Kara Sea (Arctic Russia) // Polar Biol. 1999. V. 22. P. 395 416.
Renaud P. E., Włodarska-Kowalczuk M., Trannum H. et al. Multidecadal stability of benthic community structure in a high-Arctic glacial fjord (van Mijenfjord, Spitsbergen) // Polar Biology. 2007. V. 30. № 3. P. 295–305.
Vedenin A.A. Galkin S.V. Kozlovskiy V.V. Macrobenthos of the Ob Bay and adjacent Kara Sea shelf // Polar Biology. 2015. V. 38. № 6. P. 829–844.
Wlodarska-Kowalczuk M., Pearson T. H. Soft-bottom macrobenthic faunal associations and factors affecting species distributions in an Arctic glacial fjord (Kongsfjord, Spitsbergen) // Polar Biology. 2004. V. 27. № 3. P. 155–167.
Wlodarska-Kowalczuk M., Węsławski J.M., Kotwicki L. Spitsbergen glacial bays macrobenthos – a comparative study // Polar Biology. 1998. V. 20. № 1. P. 66–73.
Дополнительные материалы отсутствуют.