Океанология, 2020, T. 60, № 6, стр. 899-909
Распределение личинок роющих креветок инфраотрядов Gebiidea и Axiidea в заливе Восток Японского моря
Д. Д. Голубинская 1, *, О. М. Корн 1
1 Национальный научный центр морской биологии
им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
* E-mail: dddemchyk@mail.ru
Поступила в редакцию 19.09.2018
После доработки 27.01.2020
Принята к публикации 08.04.2020
Аннотация
В зал. Восток (зал. Петра Великого, Японское море) с мая по сентябрь 2014 г. исследованы сроки встречаемости и распределение пелагических личинок крупных роющих креветок надотрядов Gebiidea и Axiidea, ведущих скрытый образ жизни. Зоэа роющих креветок встречались с конца мая до конца сентября, при температуре воды от 12.3 до 23.4°С, достигая суммарной плотности 15.5 ± ± 0.28 экз/м3 в первой половине июля. Обнаружены личинки трех видов Gebiidea и пяти видов Axiidea. В начале лета циклоническая циркуляция вод способствовала концентрации личинок мелководных видов в вершинной части залива Восток. Поздний прогрев вод, по-видимому, был причиной более позднего появления личинок этих видов в западной и восточной частях залива. Личинки более глубоководных видов встречались в основном в западной части залива. Во второй половине лета под воздействием поверхностного течения вдоль западного берега, а также стоковых течений рек личинки концентрировались южнее, в б. Средняя и у м. Пущина. Антициклонический вихрь, формирующийся при южном ветре к юго-западу от м. Пещурова, вероятно, препятствовал выносу личинок мелководных форм за пределы залива.
ВВЕДЕНИЕ
Роющие креветки инфраотрядов Gebiidea и Axiidea – животные, ведущие скрытый образ жизни. Это крупные ракообразные, строящие норы довольно сложной архитектуры в грунте морских и эстуарных участков заливов и бухт. Поскольку плотность поселений многих видов роющих креветок достаточно высока, они играют важную роль в биогеохимических процессах донных осадков и в функционировании бентосных сообществ, создавая благополучную среду обитания для разнообразных представителей инфауны [7]. Несмотря на то, что исследования макрозообентоса с использованием водолазных гидробиологических методов проводятся в российских водах Японского моря уже более 50 лет, эта группа ракообразных до последнего времени оставалась практически не изученной. Они не улавливаются такими традиционными орудиями сбора донных организмов, как трал, драга и дночерпатель, а узкая полоса литорали не позволяет собирать этих креветок во время отлива. Поэтому исследование пелагического периода в их жизненном цикле приобретает особый интерес. Данные по сезонной динамике личинок позволяют судить о характере репродуктивного цикла, исследование их плотности и распределения – иногда самый короткий путь к выяснению видового разнообразия, обилия и распределения беспозвоночных с пелагической личинкой.
Сезонная динамика и распределение личинок роющих креветок были недавно исследованы в Амурском и Уссурийском заливах – самых крупных акваториях зал. Петра Великого Японского моря [2]. Известно, что распределение личинок зависит от расположения родительских популяций и течений на исследуемой акватории. Однако данные о поселениях взрослых креветок в Амурском и Уссурийском заливах полностью отсутствуют. Единственным водоемом, где в последние годы исследован ряд видов Gebiidea и Axiidea, является зал. Восток [11–15]. Изучены также грунты и особенности гидрологии этого водоема [1, 4, 16, 17]. Представляется важным проследить связь между поселениями взрослых и распространением личинок роющих креветок в планктоне зал. Восток.
Гидрологические особенности зал. Восток. Залив Восток находится в юго-восточной части зал. Петра Великого и ограничен на западе м. Пещурова, на востоке – м. Подосенова, его площадь составляет около 35 км2, средняя глубина 13 м. Широкий заиленный песчаный пляж, окаймляющий вершину залива, прорезан устьями рек Литовка и Волчанка [3]. Вдоль западного берега грунт представлен средним и мелким песком, с примесью гальки и крупных валунов, южнее он замещается заиленным песком, постепенно переходящим в ил. Вдоль восточного берега распространены гравийно-галечные грунты. В центральной части залива грунт илистый [4]. Залив Восток характеризуется значительными колебаниями солености в течение года, особенно выраженными в кутовой части, где после дождей у поверхности она может приближаться к нулю [16]. В летний период наблюдается постепенное снижение солености по направлению к вершине залива, где ее значения на 1–3 psu ниже, чем в открытой части [1]. Пространственное распределение температуры в летний период также характеризуется постепенным увеличением от основания к вершине залива. Разность в температуре поверхностных вод северной и южной частей в среднем составляет 1–3°С [1].
Постоянная ветвь Приморского течения глубоко заходит в зал. Восток вдоль восточного побережья, описывая дугу с востока на запад, а выходит в юго-западном направлении. Воды из открытых районов Японского моря совершают круговорот против часовой стрелки и со скоростью, не превышающей 20 см/с, уходят в открытое море [1]. С продвижением в кутовую часть залива скорость течения снижается до 2–5 см/с [10]. При южных ветрах, преобладающих в летний период, в вершине залива образуется хорошо выраженный обширный циклонический вихрь, а к юго-западу от входного м. Пещурова – антициклонический вихрь. При юго-восточном и восточном ветрах течение не образует значимых внутренних вихрей [17].
Поселения роющих креветок в зал. Восток. Таксономическое исследование роющих креветок зал. Петра Великого Японского моря показало, что их фауна насчитывает 8 видов [8, 24, 25]. Upogebia major обычно обитает в приливно-отливной зоне, в морских и в опресненных водах, предпочитая илистый песок [19, 20]. Upogebia yokoyai также строит норы в мягких грунтах (ил, заиленный песок), обычно в эстуариях рек [21]. Neotrypaea japonica встречается в приливно-отливной зоне, предпочитая песчаные пляжи с небольшими валунами или илистый грунт [27, 31]. В зал. Восток U. major, N. japonica и U. yokoyai образуют поселения в заиленном песке эстуария р. Волчанка [9, 13–15]. Поселение U. major расположено в верхней сублиторали на глубине 0.5–3 м. Оно охватывает как открытые прибрежные участки дна, так и зону распространения пояса морской травы Zostera marina. Плотность поселения и биомасса U. major в среднем составляют 5.3 ± 4.6 экз/м2 и 36.46 ± 16.74 г/м2 (средняя ± стандартное отклонение) [14, 15]. U. yokoyai встречается в непосредственной близости от зарослей Z. marina на глубине 0.5–1 м [9]. Максимальная плотность поселения N. japonica на мелководном участке достигает 200 экз/м2 [13]. Помимо этого, поселения U. major и N. japonica обнаружены у протоки Волчанецкая, в б. Литовка, а также в б. Средняя и севернее входного м. Подосенова (неопубликованные данные).
Neotrypaea petalura обычно встречается в приливно-отливной зоне, на каменистых пляжах, предпочитая мелкий песок, окруженный валунами. Эугалинный вид, предпочитающий соленость 30.5–34.0 psu [27, 31]. Upogebia issaeffi также обитает только в морских водах, на песчаных и галечных грунтах, часто среди крупных валунов и скал [19]. В зал. Восток эти виды встречаются на каменистых и смешанных грунтах у западного берега залива – в районе МБС “Восток” [11, 12]. N. petalura обитает на глубине от 0.2 до 3 м, со средней плотностью 9–19 экз/м2 [11]. U. issaeffi встречается на глубинах от 1 до 6 м. Плотность поселения в локальном скоплении протяженностью 300 м варьирует от 0.2 ± 0.4 до 8.0 ± 3.0 экз/м2 [12]. Также эти виды обнаружены у м. Пашинникова, в б. Прибойная и к северу от м. Елизарова (неопубликованные данные).
Neotrypaea makarovi впервые найдена в б. Прибойная на глубине 10–12 м в заиленном песке, а также напротив полуострова, расположенного между м. Пашинникова и б. Тихая Заводь, на глубине 8–10 м при нормальной морской солености [24]. Boasaxius princeps встречен в глубоких норах, на песчаном, каменистом и гравийном субстрате, иногда под большими камнями, реже на илистом субстрате [25]. Leonardsaxius amurensis обнаружен напротив биостанции, на глубине 5–10 м, на заиленном дне [25]. Оба вида аксиид встречались в зал. Восток довольно редко.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на Морской биологической станции “Восток” Национального научного центра морской биологии ДВО РАН (зал. Восток, Японское море). С мая по сентябрь 2014 г. были собраны планктонные пробы на 10 станциях в зал. Восток (рис. 1, табл. 1). Зоопланктон отбирали в утренние часы от 1 до 5 раз в месяц методом тотальных ловов (29 мая; 6, 12, 17, 27 июня; 2, 9, 15, 22, 29 июля; 7, 14, 21, 28 августа; 7, 14 сентября). Использовали сеть Джеди с диаметром входного отверстия 38 см и фильтрующим конусом из газа № 49 (диаметр ячеи 0.112 мм). Всего собрано и обработано 160 проб планктона. Для уточнения сроков встречаемости личинок в планктоне каждые три дня отбирали ночные качественные пробы планктона с пирса МБС “Восток”, используя лампу дневного света. Поскольку личинки декапод обладают хорошо выраженным положительным фототаксисом, данный метод является наиболее эффективным для качественного анализа.
Таблица 1.
Местоположение планктонных станций в зал. Восток
| № станции | Координаты | Глубина, м | |
|---|---|---|---|
| с.ш. | в.д | ||
| 1 | 42°53′54.4″ | 132°43′46.1″ | 5.9 |
| 2 | 42°54′06.9″ | 132°44′27.9″ | 10.2 |
| 3 | 42°54′15.2″ | 132°45′32.6″ | 5.2 |
| 4 | 42°53′24.7″ | 132°46′19.6″ | 8.6 |
| 5 | 42°52′18.4″ | 132°46′15.5″ | 8.5 |
| 6 | 42°52′29.3″ | 132°43′25.7″ | 19.9 |
| 7 | 42°52′57.2″ | 132°43′22.7″ | 14.3 |
| 8 | 42°53′23.7″ | 132°44′19.0″ | 15.2 |
| 9 | 42°53′43.8″ | 132°44′08.8″ | 11.7 |
| 10 | 42°53′34.2″ | 132°44′08.0″ | 12.5 |
Использованы данные гидрометеорологической станции МБС “Восток” по температуре поверхности воды.
Планктонные пробы фиксировали 4% раствором формальдегида. Количество личинок в 1 м3 воды рассчитывали по формуле: N = n/πR 2H, где N – количество личинок в 1 м3; n – количество личинок в пробе; R – радиус входного отверстия сети, м; H – глубина лова, м.
При обработке материала использован ключ для определения личинок Gebiidea и Axiidea [5]. Карты распределения личинок построены в программе Golden Software Surfer 11 методом Natural Neighbours согласно сетке станций. Изученная область ограничивалась береговой линией с небольшим отступом в мористую сторону. В работе приведены только иллюстрации, характеризующие сезонную изменчивость в распределении личинок.
РЕЗУЛЬТАТЫ
Личинки роющих креветок встречались в планктоне с конца мая до конца сентября при температуре воды от 12.3 до 23.4°С. Суммарная плотность личинок увеличивалась от 0.7 ± 0.15 экз/м3 в конце мая до 15.5 ± 0.28 экз/м3 в первой половине июля, а затем резко снижалась. Доля зоэа креветок от числа личинок всех декапод достигала 32%. В зал. Восток обнаружены личинки восьми видов роющих креветок, преимущественно это были зоэа первой стадии. Наиболее длительный пелагический период (4 мес.) был отмечен для Upogebia major, личинки Neotrypaea japonica встречались 3.5 мес., остальные виды наблюдали в течение 2–3 мес. (табл. 2).
Таблица 2.
Сроки встречаемости личинок роющих креветок в зал. Восток в качественных ночных пробах
| Вид | Май | Июнь | Июль | Август | Сентябрь | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 20–31 | 1–10 | 11–20 | 21–30 | 1–10 | 11–20 | 21–31 | 1–10 | 11–0 | 21–31 | 1–10 | 11–20 | |
| Upogebia major (De Haan, 1841) | + | + | + | + | + | + | + | + | + | + | + | + |
| U. issaeffi (Balss, 1913) | – | – | – | – | + | + | + | + | + | + | + | + |
| U. yokoyai (Makarov, 1938) | – | – | – | + | + | + | + | + | + | + | + | + |
| Neotrypaea makarovi (Marin, 2013) | + | + | + | + | + | + | – | – | – | – | – | – |
| N. japonica (Ortmann, 1891) | – | + | + | + | + | + | + | + | + | + | + | + |
| N. petalura (Stimpson, 1860) | – | + | + | + | + | + | + | + | + | + | – | – |
| Boasaxius princeps (Boas, 1880) | – | – | – | – | + | + | – | – | – | – | – | – |
| Leonardsaxius amurensis (Kobjakova, 1937) | – | + | + | + | + | + | + | + | – | – | – | – |
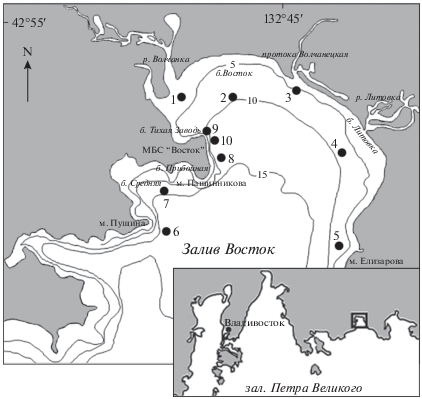
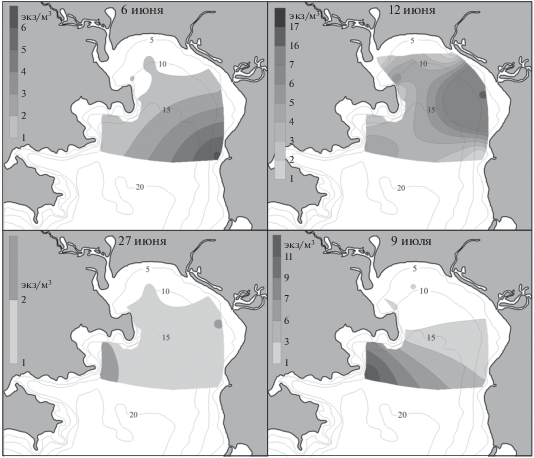
Личинки U. major были обнаружены в конце мая на четырех станциях – в эстуарии р. Волчанка, около МБС “Восток” и у м. Пущина, с плотностью 1–2 экз/м3 (рис. 2). В начале июня они были встречены также у восточного берега при максимальной плотности 4 экз/м3 в кутовой части залива. В середине и в конце июня зоэа наблюдали на большинстве станций с максимальной концентрацией 5 экз/м3 вблизи МБС “Восток” и в куту залива. В начале июля личинки достигали высокой плотности у м. Пущина (8 экз/м3) и были по-прежнему многочисленны у биостанции (6 экз/м3). В середине июля зоэа встречены только на трех станция (в б. Средняя, у м. Пущина и у биостанции), при этом их плотность не превышала 1 экз/м3. В первой половине августа они единично отмечены у биостанции и в б. Средняя.
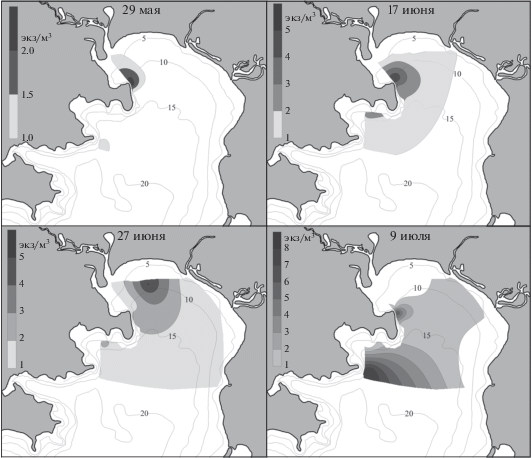
Личинки Neotrypaea japonica впервые отмечены в начале июня в устье р. Волчанка и около биостанции (рис. 3). Во второй половине месяца они появились на большинстве станций с максимальной плотностью 4 экз/м3 около МБС “Восток”. В конце июня личинки обнаружены уже по всему заливу. В начале июля плотность личинок возросла, особенно у биостанции и у м. Елизарова (до 7 и 5 экз/м3 соответственно). В середине месяца численность зоэа снизилась, оставаясь все же выше у м. Елизарова, чем на других станциях. В конце июля и в августе единичные личинки N. japonica встречены только в районе биостанции. В ночных пробах ранние зоэа этого вида присутствовали до середины сентября (табл. 2).
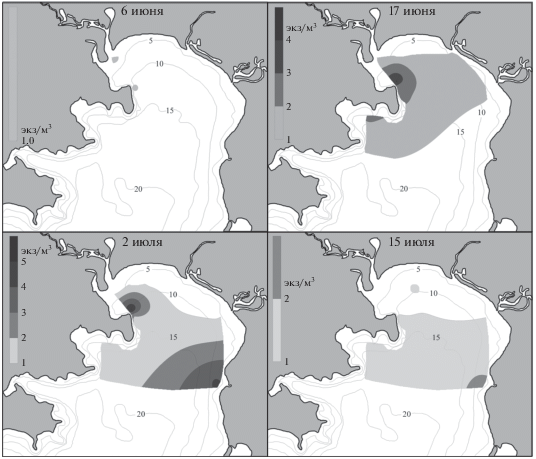
Личинки Upogebia yokoyai появились в начале июля на большинстве станций и достигли наибольшей плотности в эстуарии р. Волчанка (14 экз/м3) и в районе биостанции (27–41 экз/м3) (рис. 4а, 4б). К середине месяца зоэа данного вида встречались у м. Пущина, при этом их плотность резко снизилась, составляя не более 2 экз/м3. Единичные личинки наблюдались у биостанции и в б. Средняя до начала августа. В ночных пробах ранние зоэа U. yokoyai присутствовали до середины сентября (табл. 2).
Рис. 4.
Распределение личинок Upogebia yokoyai (а, б) и Upogebia issaeffi (в, г) в зал. Восток в разные сроки.
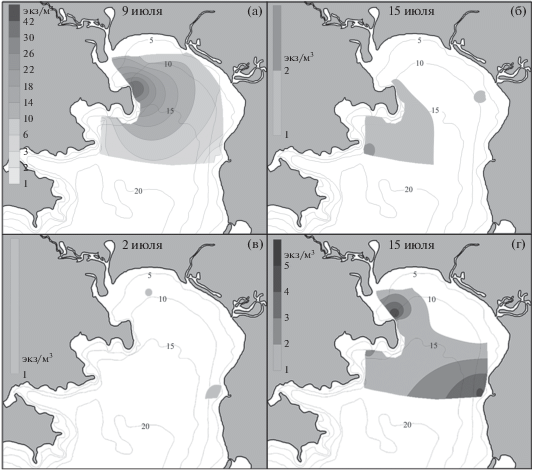
Личинки Upogebia issaeffi в начале июля встречались в кутовой части зал. Восток и у м. Елизарова с концентрацией, не превышающей 2 экз/м3 (рис. 4в, 4г). К середине месяца они отмечены на большинстве станций с максимальной плотностью у м. Елизарова (4 экз/м3) и у МБС “Восток” (5 экз/м3). Во второй половине июля и в середине августа единичные экземпляры отмечены у м. Пущина и м. Елизарова. В ночных пробах зоэа U. issaeffi встречались до середины сентября (табл. 2).
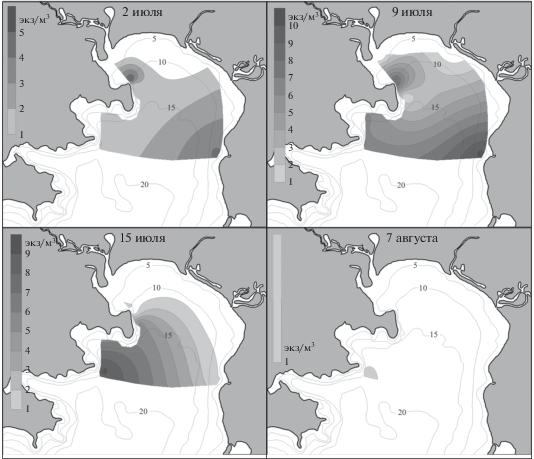
Личинки Neotrypaea petalura в ночных качественных пробах встречались уже в июне (табл. 2). В то же время в количественных пробах они впервые отмечены только в начале июля (рис. 5). Зоэа встречались повсеместно, за исключением кутовой части, наибольшие скопления зарегистрированы в районе биостанции (4 экз/м3) и у м. Елизарова (5 экз/м3). В конце первой декады июля личинки обнаружены на всех станциях, за исключением опресненных участков (станции 1, 3, 4), достигая максимальной плотности у МБС “Восток” (8 экз/м3) и у м. Елизарова (10 экз/м3). В середине июля численность личинок возрастала в б. Средняя (6 экз/м3) и у м. Пущина (9 экз/м3), а в первую декаду августа они единично отмечены только у м. Пущина.
Единичные личинки Neotrypaea makarovi были зарегистрированы в конце мая у восточного берега зал. Восток – вблизи устья р. Литовка. В начале июня они встречались уже на всех станциях, а к середине месяца в эстуарии р. Литовки достигали максимальной плотности 17 экз/м3 (рис. 6). Довольно многочисленны зоэа N. makarovi были также в куту залива, у биостанции и у м. Пущина (5–6 экз/м3). В первой декаде июля они встречались в основном в центральной части залива – в б. Средняя (8 экз/м3), у м. Елизарова (3 экз/м3) и максимальной плотности (12 экз/м3) достигали у м. Пущина. В середине июля личинок N. makarovi наблюдали единично.
Личинки Boasaxius princeps появлялись в начале июля у восточного берега зал. Восток, в районе биостанции и в б. Средняя (рис. 7а, 7б). К концу первой декады они распространялись почти на все станции, за исключением эстуария р. Волчанка, достигая максимума (10 экз/м3) в б. Средняя. В середине июля зоэа этого вида отмечены только вдоль западного побережья залива, с наибольшей плотностью 2 экз/м3 в районе б. Средняя.
Рис. 7.
Распределение личинок Boasaxius princeps (а, б) и Leonardsaxius amurensis (в, г) в зал. Восток в разные сроки.
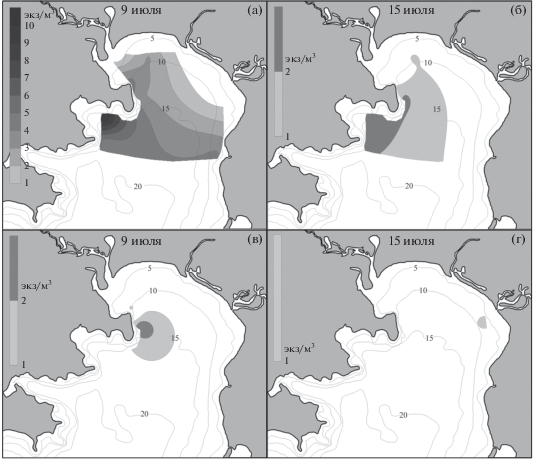
Зоэа Leonardsaxius amurensis в ночных качественных пробах отмечены с первой декады июня до первой декады августа (табл. 2). В то же время в количественных пробах они единично обнаружены только в середине июля в эстуарии р. Литовка и у биостанции с плотностью 2 экз/м3 (рис. 7в, 7г).
ОБСУЖДЕНИЕ
Сроки встречаемости личинок роющих креветок в ночных качественных пробах в зал. Восток в основном совпадали с данными по Амурскому и Уссурийскому заливам [2]. Однако в количественных пробах, взятых на сетке станций, они обнаружены только до середины августа, в то время как в Амурском и Уссурийском заливах встречались до октября. По-видимому, это объясняется тем, что в сентябре и начале октября в Амурском и Уссурийском заливах отмечены в основном старшие стадии зоэа, которые в зал. Восток не встречены. Можно предположить, что их течениями выносило в открытую часть залива, где не было планктонных станций. Если в Амурском и Уссурийском заливах среди упогебиид самыми многочисленными в планктоне были зоэа Upogebia major [2], то в зал. Восток отчетливо доминировали личинки U. yokoyai (рис. 2, 4а, 4б). Cреди неотрипей в Амурском и Уссурийском заливе наиболее длительное время встречались личинки Neotrypaea petalura, в то время как в зал. Восток самым продолжительным был пелагический период N. japonica.
Наибольшие скопления личинок Upogebia major наблюдали вблизи родительского поселения в эстуарии р. Волчанка, а также в районе биостанции, куда они перемещались под влиянием речного стока и течения, идущего вдоль западного побережья в южном направлении. В кутовой части залива под влиянием циклонического круговорота, по-видимому, концентрировались также личинки U. major, появившиеся в поселениях в б. Литовка и у протоки Волчанецкая. В начале июля наибольшую плотность личинок наблюдали в районе м. Пущина, куда они могли попадать из б. Средняя, где имеется еще одно поселение этого вида. Летом температура воды в б. Средняя ниже, чем в кутовой части залива приблизительно на 2°С [1], и, вероятно, выход личинок там происходил позднее. Одновременно в районе биостанции отмечено вторичное повышение плотности личинок, что свидетельствует о возможности повторного нереста U. major.
Исследование поселения U. major в устье р. Волчанка [15] показало, что самки с яйцами на плеоподах встречались уже в апреле. Затем количество яйценосных самок увеличивалось, и вылупление личинок происходило в конце мая, что согласуется с планктонными данными. Пополнение донного поселения молодью, по-видимому, наблюдалось в первой половине июля, т.к. в середине месяца размер сеголеток составлял 8–12 мм, а длина тела только что осевшей молоди не превышает 6 мм [22]. Однако вплоть до октября в пробах встречали единичных животных с длиной тела 14–17 мм. Таким образом, незначительное пополнение поселения молодью могло происходить и позже – либо за счет размножения немногочисленных особей в заливе, либо в результате заноса личинок из других мест обитания упогебии. Присутствие ранних стадий зоэа U. major в ночном планктоне до середины сентября подтверждает это предположение. Считается, что в Токийском заливе U. major откладывает яйца один раз за сезон размножения [18, 22], однако авторы не исключают возможности повторного нереста, поскольку иногда у яйценосных самок в конце периода вынашивания наблюдался значительный рост гонадного индекса.
В июне наибольшую плотность личинок Neotrypaea japonica наблюдали вблизи родительского поселения в эстуарии р. Волчанка. Однако в июле высокая концентрация зоэа отмечена также в районе м. Елизарова. Южнее м. Елизарова грунт представлен заиленным песком [4], и, как уже упоминалось, севернее входного м. Подосенова находится еще одно поселение N. japonica. Более позднее (почти на месяц) появление личинок у м. Елизарова связано с тем, что в этом районе температура воды по сравнению с кутовой частью залива ниже почти на 2°С [1]. Несмотря на то, что в Амурском и Уссурийском заливах мы наблюдали личинок N. japonica только в июне и июле [2], в зал. Восток они встречались гораздо дольше. Кроме того, в зал. Восток яйценосные самки присутствовали в июле и даже в августе, что наряду с наличием ранних стадий в планктоне вплоть до сентября свидетельствует о возможности повторного нереста этого вида в ходе сезона размножения. У западного побережья о-ва Кюсю личинки N. japonica образуют две когорты со сдвигом во времени 1–1.5 мес. [30].
Основные концентрации личинок Neotrypaea petalura и Upogebia issaeffi отмечены в районе биостанции и у м. Елизарова. Известно, что грунт в районе м. Елизарова песчаный с примесью гальки и валунов [4]. Возможно, здесь также расположены поселения данных видов, либо их личинки заносятся из открытой части зал. Восток. Поскольку N. petalura и U. issaeffi не переносят опреснения, зоэа этих креветок не обнаружены в районах действия стока рек Волчанка, Литовка и у протоки Волчанецкой.
Несмотря на то, что Neotrypaea makarovi обнаружена только в б. Прибойная [24], первые личинки в планктоне появились на противоположном берегу в б. Литовка, а позже максимальную по заливу концентрацию наблюдали у м. Елизарова. Вероятно, N. makarovi обитает также в районе м. Елизарова, либо личинки этого вида заносятся из открытой части зал. Восток.
В отличие от личинок мелководных видов, зоэа Boasaxius princeps и Leonardsaxius amurensis не концентрировались в вершинной части зал. Восток. Поскольку эти виды обитают глубже [8], основные скопления личинок находились в западной части залива.
Хотя приведенные выше сведения о распространении взрослых роющих креветок в зал. Восток весьма фрагментарны, в целом они согласуются с нашими данными по распространению личинок. Наличие крупных поселений трех хорошо переносящих опреснение видов в кутовой части (U. major, U. yokoyai и N. japonica) и двух видов, обитающих вдоль западного берега на смешанных грунтах и предпочитающих нормальную соленость (N. petalura и U. issaeffi), а также циклоническая циркуляция вод при южном ветре и общее направление течения способствуют концентрации личинок в вершинной части зал. Восток. Ранее было показано, что здесь также скапливаются личинки крабов-горошин, прибрежных и водорослевых крабов, появляющиеся в планктоне в первой половине лета [6]. Более поздний прогрев вод, по-видимому, является причиной более позднего появления личинок в поселениях креветок в западной и восточной частях залива. Кроме того, во второй половине лета под воздействием преобладающего при юго-восточном и восточном ветрах поверхностного течения, идущего вдоль западного берега на юг, а также стоковых течений рек личинки скапливаются южнее, в б. Средняя и у м. Пущина. Личинки более глубоководных видов (B. princeps, L. amurensis и N. makarovi) редко встречаются в кутовой части залива, а концентрируются в его западной части. Известно, что зоэа овального краба, обитающего на больших по сравнению с прибрежными крабами глубинах, также встречаются в основном в юго-западной части зал. Восток [6].
Скорость личинок декапод составляет не более 2 см/с, поэтому они пассивно переносятся течениями [23]. Однако благодаря суточным вертикальным миграциям личинки способны опускаться в более глубокие слои и использовать течения, идущие к берегу, что позволяет им возвращаться к местам обитания взрослых особей для оседания [18, 26, 28, 29]. В зал. Восток антициклонический вихрь, формирующийся при южном ветре к юго-западу от м. Пещурова, вероятно препятствует выносу личинок мелководных видов за пределы залива, а особенности гидродинамики позволяют им удерживаться вблизи родительских поселений и обеспечивать восстановление популяций.
Благодарности. Авторы благодарят Н.И. Селина и Е.С. Корниенко за помощь в сборе материала.
Список литературы
Гайко Л.А. Гидрометеорологические особенности залива Восток (Японское море). Владивосток: ТОИ ДВО РАН, 2006. 91 с. Деп. в ВИНИТИ 28.11.2006. № 1471-В2006.
Голубинская Д.Д., Корн О.М., Корниенко E.C. Сезонная динамика плотности и распределение личинок роющих креветок инфраотрядов Gebiidea и Axiidea в Амурском и Уссурийском заливах Японского моря // Биол. моря. 2016. Т. 42. № 3. С. 204–214.
Кашенко В.П. Краткая физико-географическая характеристика зал. Восток // Биологические исследования залива Восток. Владивосток: ДВНЦ АН СССР, 1976. С. 7–11.
Кашенко С.Д. Грунты залива Восток Японского моря // Биота и среда заповедников Дальнего Востока. 2014. № 1. С. 25–35.
Корн О.М., Голубинская Д.Д., Корниенко Е.С. Ключ для определения зоэа роющих креветок надотрядов Gebiidea и Axiidea из залива Петра Великого Японского моря // Биол. моря. 2017. Т. 43. № 5. С. 341–348.
Корн О.М., Корниенко Е.С. Видовой состав, период встречаемости и распределение личинок крабов (Decapoda: Brachyura) в заливе Восток Японского моря // Биол. моря. 2015. Т. 41. № 1. С. 28–35.
Корниенко Е.С. Роющие раки инфраотрядов Gebiidea и Axiidea (Crustacea: Decapoda) // Биол. моря. 2013. Т. 39. № 1. С. 3–16.
Марин И.Н. Малый атлас десятиногих ракообразных России. М.: Товарищество науч. изд. КМК. 2013. 145 с.
Марин И.Н., Корн О.М., Корниенко Е.С. Upogebia yokoyai Makarov, 1938 (Decapoda: Upogebiidae) – новый для фауны Японского моря вид креветок-гебиид // Биол. моря. 2013. Т. 39. № 3. С. 221–226.
Плотников А.В., Новожилов А.В. Некоторые особенности динамики вод залива Восток (залив Петра Великого, Японское море) // Рациональное использование биоресурсов Тихого океана. Тез. докл. Владивосток, 1991. С. 65–66.
Селин Н.И. Некоторые особенности популяционной биологии рака-привидения Nihonotrypaea petalura (Stimpson, 1860) (Decapoda: Callianassidae) из прибрежных вод залива Восток Японского моря // Биол. моря. 2013. Т. 39. № 5. С. 362–370.
Селин Н.И. Некоторые черты биологии рака-крота Upogebia issaeffi (Decapoda: Upogebiidae) из сублиторали залива Восток Японского моря // Биол. моря. 2014. Т. 40. № 1. С. 26–31.
Селин Н.И. Распределение и некоторые черты биологии креветки-привидения Nihonotrypaea japonica (Ortmann, 1891) (Decapoda: Callianassidae) из эстуария реки Волчанка (залив Восток Японского моря) // Биол. моря. 2015а. Т. 41. № 1. С. 13–19.
Селин Н.И. Особенности пространственного распределения рака-крота Upogebia major (de Haan, 1841) (Decapoda: Upogebiidae) в заливе Восток Японского моря // Биол. моря. 2015б. Т. 41. № 3. С. 215–218.
Селин Н.И. Популяционная динамика и рост рака-крота Upogebia major (De Haan, 1841) (Crustacea: Decapoda) из залива Петра Великого Японского моря //Биол. моря. 2017. Т. 43. № 4. С. 229–234.
Степанов В.В. Характеристика температуры и солености вод залива Восток Японского моря // Биологические исследования залива Восток. Владивосток: ДВНЦ АН СССР, 1976. С. 12–22.
Христофорова Н.К., Наумов Ю.А., Арзамасцев И.С. Тяжелые металлы в донных осадках залива Восток (Японское море) // Изв. ТИНРО. 2004. Т. 136. С. 278–289.
Hong J.-S. Biology of the mud shrimp Upogebia major (de Haan, 1841), with particular reference to pest management for shrimp control in Manila clam bed in the west coast of Korea // Ocean Polar Res. 2013. V. 35. № 4. P. 323–349.
Itani G. Distribution of intertidal upogebiid shrimp (Crustacea: Decapoda: Thalassinidea) in Japan // Contributions from the Biological Laboratory, Kyoto University. 2004. V. 29. № 4. P. 383–399.
Kinoshita K. Burrow structure of the mud shrimp Upogebia major (Decapoda: Thalssinidea: Upogebiidae) // J. Crust. Biol. 2002. V. 22. № 2. P. 474–480.
Kinoshita K., Itani G., Unchino T. Burrow morphology and associated animals of the mud shrimp Upogebia yokoyai (Crustacea: Thalassinidea: Upogebiidae) // J. Mar. Biol. Ass. U.K. 2010. V. 90. № 5. P. 947–952.
Kinoshita K., Nakayama S., Furota T. Life cycle characteristics of the deep-burrowing mud shrimp Upogebia major (Thalassinidea: Upogebiidae) on a tidal flat along the northern coast of Tokyo Bay // J. Crust. Biol. 2003. V. 23. № 2. P. 318–327.
Kuwahara H., Mizushima T. Study on the distribution of hair crab, Erimacrus isenbeckii, larvae in the Sea of Okhotsk // Sci. Rep. Hokkaido Fish. Exp. St. 1999. V. 55. P. 1–27.
Marin I. A new species of callianassid ghost shrimp of the genus Nihonotrypaea Manning & Tamaki, 1998 (Crustacea, Decapoda, Axiidea, Callianassidae) from southern part of the Russian coast of the Sea of Japan // Zootaxa. 2013. V. 3694. № 5. P. 434–444.
Marin I. Complete morphological re-description of mud-dwelling axiid Leonardsaxius amurensis (Kobjakova, 1937) with remarks on Axiidae (Crustacea: Decapoda: Axiidea) from the Russian coast of the Sea of Japan // Zootaxa. 2015. V. 3937. № 3. P. 549–563.
Morgan S.G., Miller S.H., Robart M.J., Largier J.L. Nearshore larval retention and cross-shelf migration of benthic crustaceans at an upwelling center // Front. Mar. Sci. 2018. V. 5. P. 161.
Sakai K. Axioidea of the World and a Reconsideration of the Callianassoidea (Decapoda, Thalassinidea, Callianassida) // Crustaceana Monographs. Leiden: Brill. 2011. V. 13. 520 p.
Shanks A.L. Pelagic larval duration and dispersal distance revisited // Biol. Bull. 2009. V. 216. P. 373−385.
Pires R.F.T., Pan M., Santos A.M.P. et al. Modelling the variation in larval dispersal of estuarine and coastal ghost shrimp: Upogebia congeners in the Gulf of Cadiz // Mar. Ecol. Prog. Ser. 2013. V. 492. P. 153–168.
Tamaki A., Ingole B., Ikebe K., Muramatsu K. et al. Life history of the ghost shrimp, Callianassa japonica Ortmann (Decapoda: Thalassinidea), on an intertidal sandflat in western Kyushu, Japan // J. Exp. Mar. Biol. Ecol. 1997. V. 210. P. 223–250.
Tamaki A., Itoh J.-I., Kubo K. Distributions of three species of Nihonotrypaea (Decapoda: Thalassinidea: Callianassidae) in intertidal habitats along an estuary to open-sea gradient in western Kyushu, Japan // Crust. Res. 1999. V. 28. P. 37–51.
Дополнительные материалы отсутствуют.