Океанология, 2021, T. 61, № 1, стр. 67-78
Влияние некоторых абиотических и биотических факторов на нерест европейского шпрота Sprattus sprattus (Linnaeus, 1758) в Черном море в ноябре 2016–2017 гг.
Т. Н. Климова 1, И. В. Вдодович 1, Б. Е. Аннинский 1, А. А. Субботин 1, П. С. Подрезова 1, *, В. В. Мельников 1
1 ФГБУН ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН”
Севастополь, Россия
* E-mail: polyklim@imbr-ras.ru
Поступила в редакцию 19.05.2019
После доработки 03.06.2020
Принята к публикации 15.08.2020
Аннотация
Исследованы изменения в численности и распределении икры и личинок европейского шпрота Sprattus sprattus, а также в фенологии его нереста в зависимости от гидрологических факторов и обилия желетелого макропланктона в Черном море в ноябре 2016–2017 гг. Несмотря на обильное развитие медуз Aurelia aurita, желетелый макропланктон не оказал существенного влияния на выживание шпрота на ранних стадиях развития. Хищнический пресс гребневиков планктофагов на икру и личинок шпрота в 2016–2017 гг., по-видимому, не был значительным. Средняя численность икры и личинок шпрота в ноябре 2016 г. (184 и 11 экз/м2 соответственно) и ноябре 2017 г. (268 и 21 экз/м2 соответственно) превысила их максимальную численность в 50-х гг. прошлого столетия. В начале нерестового периода 2016–2017 гг. личинки не различались по своему размерному составу.
ВВЕДЕНИЕ
Сезонные мезомасштабные гидрологические и экологические процессы являются решающим фактором, определяющим успех воспроизводства в популяциях рыб. Реакция на изменение климата может быть неодинаковой у гидробионтов различных трофических уровней. Как следствие, фенологические изменения, произошедшие в морском пелагическом сообществе за последние 20 лет, несомненно, отразились на функционировании всей экосистемы [31, 43]. Отмеченные изменения в фенологии нереста как теплолюбивых, так и холодолюбивых рыб в Тихом и Атлантическом океанах привели к одновременному присутствию в ихтиопланктоне личинок теплолюбивых и умеренноводных видов рыб [27]. Вместе с тем, морские экосистемы умеренного пояса оказались особенно уязвимы к изменению климата в связи с тем, что имеют четкую сезонную динамику, определяемую видовыми особенностями экологии размножения и развития гидробионтов [31, 43]. В связи с этим показательно, что в летний нерестовый сезон 2017 г. доля личинок умеренноводных видов в ихтиопланктоне Черного моря у Крымского полуострова достигала 32% от общей численности всех видов личинок [14, 36].
Европейский шпрот Sprattus sprattus (Linnaeus, 1758) наряду с хамсой Engraulis encrasicolus (Linnaeus, 1758) является одним из наиболее массовых видов рыб Черного моря. Кроме промышленной значимости этого вида, следует отметить его важную роль в трофической цепочке всей экосистемы Азово-Черноморского бассейна [1]. Поскольку массовый нерест шпрота приурочен к зимнему гидрологическому сезону, термический режим конца осеннего гидрологического сезона определяет состояние будущей промысловой популяции и соотношение возрастных групп. Начало нереста шпрота совпадает с “критическими” значениями временнóго температурного градиента более 3.5°С/мес. [9]. Максимальные градиенты температуры, достигающие 5.0–5.5°С /мес., характерны для конца октября–начала ноября, а к концу ноября–началу декабря вода в море остывает до 9–12°С – оптимальных значений для массового нереста шпрота. Отмеченное с середины 1990-х гг. повышение температуры поверхностного слоя моря, увеличение теплозапаса в слое 0–100 м, повышение температуры воды в холодном промежуточном слое (ХПС) изменили нерестовый цикл шпрота в прибрежных и открытых водах, прилегающих к Крыму [6, 19].
Изучение ихтиопланктона в стабильных гидрологических условиях не раскрывает механизмов, лежащих в основе коренных изменений в фенологии и продуктивности нереста. Термогидродинамические особенности взаимодействующих вод, такие как фронтальные зоны, часто приводят к увеличению локальных скоплений кормового зоопланктона, повышающих вероятность его выедания планктофагами [38]. При этом сами личинки и свободноплавающие икринки также могут активно потребляться крупными рыбами и некоторыми представителями мезо- и макропланктона (хетогнатами, гребневиками, медузами) [40]. В Черном море ихтиопланктонные комплексы формируются при активном участии сцифомедузы аурелии – Aurelia aurita (Linnaeus, 1758) – и гребневиков планктофагов: Mnemiopsis leidyi (A. Agassiz, 1860) и Pleurobrachia pileus (O.F. Muller, 1776), которые обычно достигают значительной биомассы и потребляют широкий спектр организмов нижнего трофического уровня [42, 44].
Влияние поверхностных фронтов и мезомасштабных вихрей на размножение рыб в различных районах Мирового океана детально описано в [28]. Пространственное распределение икры и личинок летненерестующих видов рыб в зависимости от некоторых термогидродинамических факторов (апвеллингов, мезомасштабных и синоптических вихрей, фронтальных зон и др.) было изучено и в Черном море [17, 20]. Шпрот относится к умеренно-водным короткоцикловым бореально-атлантическим реликтам, и его массовый нерест, как правило, ограничивается зимним гидрологическим сезоном. Специфика нереста шпрота в конце осеннего гидрологического сезона изучена слабо, и данные 2016 и 2017 гг. представляют в этой связи несомненный интерес.
Цель настоящих исследований – изучение пространственного распределения икры и личинок шпрота в осенний гидрологический сезон на фоне трансформациии пелагической экосистемы Черного моря под влиянием некоторых абиотических и биотических факторов.
Основные направления работы: 1) изучить пространственное распределение икры и личинок шпрота у Крымского полуострова в осенний гидрологический сезон в 2016 и 2017 гг.; 2) оценить эффективность нереста шпрота в период исследований; 3) определить возможные причины межгодовой вариабельности обилия и размерного состава личинок.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в 91 и 98 рейсах НИС “Профессор Водяницкий” с 16 ноября по 2 декабря 2016 г. и с 15 по 27 ноября 2017 г. на шельфе и в открытых водах Черного моря у Крымского полуострова в районе с координатами 43°57–45°12 с.ш. и 31°28–36°45 в.д. Ихтиопланктон и желетелый макропланктон собирали сетью Богорова–Расса (БР-80/113, ячея сита 400 мкм, площадь входного отверстия 0.5 м2). Вертикальные ловы выполняли от дна до поверхности на мелководных станциях и от нижней границы кислородного слоя, соответствующей изопикнической поверхности σt = 16.2 усл. ед., до поверхности над глубинами свыше 100 м.
Собранные ихтиопланктонные пробы фиксировали 4% раствором формалина. Всего были проанализированы 54 пробы в 2016 г. и 60 проб в 2017 г. Идентификацию икры и личинок проводили по [11]. Питание личинок рыб изучалось по методике [12].
Первичный анализ макропланктонных проб заключался в отделении через 4 мм сито фракции желетелого макропланктона и последующем ее изучении (таксономический состав, численность и размеры особей более 5 мм) непосредственно на борту судна. Численность ранних стадий гребневиков (<5 мм) и эфир аурелии определяли в стационарных условиях при микроскопии сетных проб, предварительно зафиксированных в 4% (V/V) забуференном растворе формалина. Диаметр медуз (расстояние между ропалиями) и орально-аборальную длину гребневиков измеряли с точностью до 1 мм. Массу тела организмов рассчитывали по ранее установленным линейно-весовым соотношениям [2]. Всего было проанализировано 60 проб, собранных в ноябре 2017 г. (98 рейс НИС “Профессор Водяницкий”). В 91 рейсе НИС “Профессор Водяницкий” исследования желетелого макропланктона не проводились, поэтому для оценки обилия желетелых в осенний сезон 2016 г. были использованы данные, полученные на 62-х станциях с координатами 43°22–45°15 с.ш. и 31°24–36°26 в.д. в октябре 2016 г. (89 рейс НИС “Профессор Водяницкий”).
Для анализа термического режима толщи вод, а также структуры поверхностных течений на исследуемой акватории моря во время съемок 2016 и 2017 гг. использовали экспедиционные данные вертикальных зондирований СТД-зондом “Sea-Bird 911plus” и акустическим измерителем течений АDCP (Acoustic Doppler Current Probiler) [4, 5]. В качестве дополнительной информации привлечены материалы спутниковых измерений температуры поверхности моря (ТПМ) и альтиметрические данные с соответствующих сайтов [33–35] за летне-осенний период, предшествующий съемкам, а также сопутствующие по времени данные гидрологических наблюдений в прибрежной зоне Крымского полуострова. В статье приводятся композиционные карты по ТПМ за периоды выполнения съемок в ноябре 2016 и 2017 гг.
РЕЗУЛЬТАТЫ
У шпрота межгодовые отличия в сроках начала, продолжительности и интенсивности нереста во многом определяются особенностями циркуляции вод и параметрами гидрологического режима деятельного слоя моря, формирующегося под влиянием внутригодовой изменчивости гидрометеорологических факторов и конкретных условий в приводном слое атмосферы. Общая схема поверхностной циркуляции Черного моря представлена на рис. 1.
Рис. 1.
Схема поверхностной циркуляции вод Черного моря [Staneva et al., 2001] (1 – Основное черноморское течение; 2 – Западное ядро основного циклонического круговорота; 3 – Восточное ядро; 4 – Севастопольский антициклон; 5 – Крымский антициклон).

Гидрологическая характеристика района исследований. Сезонное усиление основного черноморского течения (ОЧТ) в ноябре 2016 и 2017 гг. привело к его активному меандрированию вдоль континентального склона всей северной части Черного моря от Керченской предпроливной зоны до “большой топографической ложбины” (БТЛ) к юго- западу от Крымского полуострова [4, 5, 17].
В западном секторе исследований во время ноябрьской съемки 2016 г. в результате внедрения циклонического меандра ОЧТ на глубоководную часть БТЛ Севастопольский квазистационарный антициклон (СевАЦ) был зарегистрирован на шельфе к западу от Каламитского залива [4, 5, 17]. Антициклическая завихренность в шельфовой зоне южного Крыма, трактуемая как Крымский антициклон (КрАЦ), в октябре и ноябре проявилась на шельфе к югу от Феодосийского залива – Феодосийском “ядре” [6, 7]. Циклонический меандр ОЧТ в восточном секторе исследований прослеживался вплоть до Керченского предпроливья, образуя на своей западной границе при контакте с Феодосийским антициклоном активный поток вдольберегового течения. Южнее зоны ОЧТ прослеживалась северная часть основного циклонического круговорота (ОЦК) — его восточного “ядра” со слабыми и неустойчивыми течениями.
В 2017 г. усиление ОЧТ произошло только в октябре, что во второй половине ноября привело к формированию динамической структуры вод, близкой к наблюдаемой в ноябре 2016 г. Отличия в циркуляции поверхностных вод в ноябре 2017 г. по сравнению с 2016 г. проявились в изменении локации и активности отдельных циркуляционных структур. Усиление меандрирования струи ОЧТ активизировало циклонический меандр в восточном секторе исследований южнее Керченского пролива и, как следствие, обусловило деформацию зоны антициклонической завихренности, примыкающей к Феодосийскому заливу. В западной части полигона усиление меандра ОЧТ вдоль западного и северного склонов БТЛ привело к локализации активного антициклонического вихря над ее восточной частью. Следует отметить, что СевАЦ образовался над западным склоном БТЛ лишь к концу октября. Зона ОЦК проявилась на юго-западе исследуемой акватории в виде усиления его западного “ядра”.
Характер пространственной изменчивости ТПМ в ноябре 2016 г. хорошо согласуется со средним многолетним распределением для ноября [13] (рис. 2).
Рис. 2.
Композиционные карты температуры поверхности моря для ноября 2016 г. (вверху) и ноября 2017 г. (внизу). Стрелками указано направление ветра.

Область наиболее прогретых вод соответствовала струе ОЧТ, переносящей теплые воды из юго-восточной части Черного моря вдоль континентального склона к юго-западной оконечности Крымского полуострова. Максимальная ТПМ (до 13.5–14.0°С) наблюдались в зоне циклонического меандра ОЧТ к югу от Керченского пролива. По мере продвижения на запад эти воды заметно охлаждались, и в районе восточного склона БТЛ значения ТПМ не превышали 12.5–12.8°С (рис. 2). Области минимальных значений ТПМ (до 10.2–11.4°С) располагались на северо-западе полигона как следствие наиболее активного выхолаживания поверхностных вод в северо-западной части моря и в глубоководной юго-восточной части акватории на фоне сезонного усиления ОЦК, прежде всего, его “восточного ядра”. Пространственная неоднородность в распределении толщины верхнего квазиоднородного слоя (ВКС) была следствием совместного влияния погодных условий и основных динамических образований, формирующих циркуляцию вод на исследуемой акватории [4, 5]. Максимальное заглубление ВКС (до 60–65 м) соответствовало зоне конвергенции поверхностных течений на границе циклонического меандра ОЧТ и западной периферии СевАЦ над восточным склоном БТЛ. Большая толщина ВКС (до 35–40 м) приурочена к зоне Феодосийского антициклона, а минимальные значения отмечены в зонах подъема вод в циклоническом меандре ОЧТ над БТЛ и в восточном “ядре” ОЦК.
В пространственном распределении параметров холодного промежуточного слоя, ХПС, (прежде всего, минимальных значений температуры в “ядре” и глубины его залегания) также отмечено влияние основных динамических образований. При колебаниях температуры в пределах 8.49–8.61°С максимальные значения были отмечены в зоне антициклонической завихренности над восточным склоном БТЛ, а минимальные – в циклоническом меандре ОЧТ над БТЛ и в южной глубоководной части полигона. Наибольшее заглубление “ядра” ХПС (85–90 м) соответствовало области максимальных значений температуры юго-западнее Крымского полуострова и району локализации КрАЦ. Наименьшие глубины залегания “ядра” ХПС (45–50 м) были обнаружены в районах ОЦК и циклонического меандра ОЧТ над БТЛ.
Пространственное распределение ТПМ в ноябре 2017 г. имело те же особенности, что и в ноябре 2016 г. (рис. 2). Наиболее прогретые (до 13.6–14.2°С) воды соответствовали струе ОЧТ, однако область их распространения оказалась шире, чем годом ранее — от Керченской предпроливной зоны до Каламитского залива и зоны локализации СевАЦ. Наиболее низкие значения ТПМ (менее 11°С) были зафиксированы в юго-западной части полигона как следствие усиления западного “ядра” ОЦК.
Межгодовые отличия в параметрах осенних гидрологических сезонов 2016 и 2017 гг. проявились в вертикальной термической структуре вод. Более медленное осеннее выхолаживание в 2017 г. привело к уменьшению толщины ВКС по сравнению с 2016 г. Как результат, она достигала максимума — 40–45 м в наиболее активных зонах опускания вод в районах локализации СевАЦ и на границе Каламитского залива. Минимальная толщина ВКС (20–25 м) наблюдалась в зонах подъема вод в циклонических меандрах ОЧТ над северным склоном БТЛ и южнее Керченской предпроливной зоны, а также в западном ядре ОЦК.
Температура в “ядре” ХПС (7.6–7.9°С) оказалась почти на 1°С ниже, чем в ноябре 2016 г. При этом воды с минимальными значениями температур прослеживались в виде локальных областей вдоль свала глубин у южных и западных берегов Крымского полуострова – там, где зимует большая часть популяции шпрота. Пространственное распределение глубины залегания минимальных температур ХПС соответствовало положению основных динамических образований: минимальные значения (до 40–50 м) соответствовали зоне западной халистазы, а максимальные (до 80–90 м) – зонам опускания вод в СевАЦ и над свалом глубин юго-западнее мыса Меганом.
Ихтиопланктон. С 16 ноября по 2 декабря 2016 г. (91 рейс НИС “Профессор Водяницкий”) в ихтиопланктоне были идентифицированы икра и личинки 9 видов рыб из 6 семейств [36]. В пробах доминировали икра и личинки шпрота (98.3 и 89.3% соответственно), которые встречались во всех районах исследований, за исключением мелководной станции у входа в Феодосийский залив.
В восточном секторе средняя численность икры составляла 75.3 экз/м2, личинок – 5.1 экз/м2, что было вполне сопоставимо с данными декабря 1950-х гг. у Крымского полуострова и декабря 2006 г. для Феодосийского залива [10, 11, 15]. Максимальная численность икры и личинок шпрота наблюдалась южнее Феодосийского залива в глубоководной части моря (745 м). Если максимальная численность личинок была сопоставима с данными 1950-х гг., то максимальная численность икры была значительно выше. Доля мертвой икры была минимальной (67.4%) по сравнению с остальными районами исследований (табл. 1 , рис. 3 ).
Таблица 1.
Средняя численность икры и личинок шпрота в различных районах исследований в ноябре 2016 и 2017 гг.
| Показатели | Ноябрь 2016 г. | Ноябрь 2017 г. | ||||
|---|---|---|---|---|---|---|
| икра, экз/м2 | мертвая икра, % | личинки, экз/м2 | икра, экз/м2 | мертвая икра, % | личинки, экз/м2 | |
| Восточный сектор | ||||||
| Численность* | $\frac{{0{\kern 1pt} - {\kern 1pt} 338.0}}{{75.3}}$ | 67.4 | $\frac{{0{\kern 1pt} - {\kern 1pt} 34.0}}{{5.1}}$ | $\frac{{23.3{\kern 1pt} - {\kern 1pt} 806.0}}{{345.5}}$ | 72.7 | $\frac{{0{\kern 1pt} - {\kern 1pt} 60.0}}{{26.7}}$ |
| Центральный сектор | ||||||
| Численность | $\frac{{38.0{\kern 1pt} - {\kern 1pt} 714.0}}{{88.5}}$ | 75.2 | $\frac{{2.0{\kern 1pt} - {\kern 1pt} 88.0}}{{7.0}}$ | $\frac{{69.4{\kern 1pt} - {\kern 1pt} 566.0}}{{223.8}}$ | 75.1 | $\frac{{0{\kern 1pt} - {\kern 1pt} 52.0}}{{13.5}}$ |
| Западный сектор | ||||||
| Численность | $\frac{{12.0{\kern 1pt} - {\kern 1pt} 1114.0}}{{246.5}}$ | 76.1 | $\frac{{0{\kern 1pt} - {\kern 1pt} 112.0}}{{11.8}}$ | $\frac{{64.3{\kern 1pt} - {\kern 1pt} 445.2}}{{298.3}}$ | 74.9 | $\frac{{2.1{\kern 1pt} - {\kern 1pt} 63.0}}{{28.5}}$ |
| В среднем для моря | ||||||
| Численность | $\frac{{0{\kern 1pt} - {\kern 1pt} 1114.0}}{{184.1}}$ | 74.4 | $\frac{{0{\kern 1pt} - {\kern 1pt} 112.0}}{{10.6}}$ | $\frac{{23.3{\kern 1pt} - {\kern 1pt} 806.0}}{{272.1}}$ | 72.7 | $\frac{{0{\kern 1pt} - {\kern 1pt} 63.0}}{{21.4}}$ |
| Стандартное отклонение | 195.44 | 20.26 | 144.12 | 17.16 | ||
Рис. 3.
Карты-схемы пространственного распределения икры и личинок шпрота (экз/м2) в 91 рейсе (вверху) и 98 рейсе (внизу) НИС “Профессор Водяницкий”.
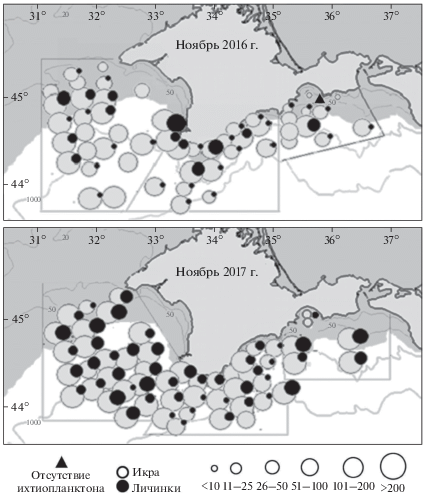
В центральном секторе исследований икра и личинки шпрота встречались на всех станциях. Средняя численность икры составляла 88.5 экз/м2, личинок — 7.0 экз/м2. Максимальная численность икры шпрота была отмечена над глубиной 1000 м, личинок — на прибрежной станции шельфа над глубиной <50 м, причем в обоих случаях их было больше (соответственно в 2 и 2.6 раза), чем в восточном районе исследований. Доля мертвой икры возросла до 75.2% (табл. 1, рис. 3).
В западном секторе икра шпрота была отмечена на всех станциях, а личинки в пробах отсутствовали на 9 станциях (рис. 3). Здесь наблюдался наиболее интенсивный нерест шпрота, средняя численность икры составляла 246.5 экз/м2, а личинок – 11.8 экз/м2. Максимальная численность икринок (1114 экз/м2) наблюдалась в районе мыса Тарханкут над глубиной 110 м, максимальная численность личинок (112 экз/м2) — у мыса Херсонес над глубиной 90 м. Доля мертвой икры была сопоставима с таковой для центрального сектора исследований и составляла 76% (табл. 1, рис. 3).
Полученные данные свидетельствуют о том, что в ноябре 2016 г. у Крымского полуострова наблюдался интенсивный нерест шпрота. Несмотря на то, что доля мертвой икры в пробах превышала 70%, нерест был результативным. Средняя длина (TL) 212 экз. личинок, собранных в ноябре 2016 года составила 3.5 мм. В восточном и центральном районах исследований она существенно не различалась (р > 0.05). В западном секторе исследований средняя длина личинок варьировала шире, чем в двух других районах (от 1.7 до 12.7 мм). Большинство личинок (97%) находилось на желточном и смешанном типах питания.
В ноябре 2017 г. ихтиопланктон был представлен 9 видами рыб из 7 семейств [14]. Как и в 2016 г., доминировали икра и личинки шпрота (98.5 и 93.8% соответственно). Средняя численность его икры возросла в 1.5, а личинок в 2 раза и составила 272.1 и 21.4 экз/м2 соответственно (табл. 1, рис. 3).
В восточном секторе средняя численность икры шпрота была максимальной и составляла 345.5 экз/м2, а численность личинок – 26.7 экз/м2 (табл. 1, рис. 3). В районе Феодосийского залива численность икры шпрота не превышала 30 экз/м2, и была поймана только одна личинка. В то же время южнее, над глубиной 150 м, численность икры и личинок достигала 806 и 60 экз/м2 соответственно. Доля мертвой икры в среднем по восточному сектору исследований составляла 72.7% (табл. 1, рис. 3).
В центральном секторе средняя численность икры составляла 223.8 экз/м2, личинок – 13.5 экз/м2 (табл. 1, рис. 3). На станции, выполненной над глубиной 2028 м на границе с восточным сектором исследований, численность личинок была максимальной и достигала 52 экз/м2. Максимальная численность икры (566 экз/м2) наблюдалась южнее бухты Ласпи, над глубиной 1428 м. Доля мертвой икры в среднем составляла 75% (табл. 1, рис. 3).
В западном секторе средняя численность икры шпрота составляла 298.3 экз/м2, личинок – 28.5 экз/м2 (табл. 1, рис. 3). Здесь, в отличие от восточного и центрального секторов, личинки шпрота были во всех пробах. Как и ранее, в этом районе нерест шпрота протекал наиболее интенсивно. Минимальная численность икры и личинок шпрота была сопоставима со средней численностью в 50-е гг. прошлого века и в декабре 2006 г. в Феодосийском заливе [11, 15]. Доля мертвой икры в западном секторе была такой же, как и в центральном секторе (табл. 1, рис. 3).
Размерный состав 514 экз. личинок шпрота, собранных в ноябре 2017 г., колебался от 1.6 до 8.5 мм. По данным [10], желточный мешок у личинок шпрота рассасывается при длине около 6 мм, период смешанного питания предположительно начинается при длине личинки около 5 мм [11]. В период наших исследований доля личинок шпрота длиной до 6 мм (желточный и смешанный тип питания) составила 98%. Длина единичных личинок шпрота, находящихся на внешнем типе питания, колебалась от 6 до 8.5 мм. Анализ размерного состава шпрота, собранного в разных районах исследований (восточный, западный и центральный), не выявил различий между ними (p > 0.05), средняя длина личинок шпрота варьировала от 3.2 до 3.5 мм.
Желетелый макропланктон. В октябре 2016 г. и ноябре 2017 г. желетелый макропланктон Черного моря был в основном представлен четырьмя массовыми видами: сцифомедузой Aurelia aurita (Linnaeus, 1758) и тремя видами гребневиков (Mnemiopsis leidyi (A. Agassiz, 1860), Pleurobrachia pileus (O.F. Muller, 1776) и Beroe ovata (Mayer, 1912)), обычно встречающимися совместно (90% и 70% проб в 2016 и 2017 гг. соответственно). Личиночные и другие разноразмерные и разновозрастные экземпляры медузы аурелии и гребневика плевробрахии присутствовали на всех станциях без исключения, причем обычно при более высокой численности и биомассе относительно других желетелых. Последние нередко встречались единично (M. leidyi), либо – на ювенильных стадиях (B. ovata). Медузы в 2017 г. (в среднем 72 мм) были значительно крупнее, чем в 2016 г. (44 мм). Среднегеометрическая аборальная длина тела у M. leidyi и B. ovata (19.0 и 13.4 мм соответственно) также была в среднем больше в 2017 г., чем в 2016 г. (8.1 и 4.8 мм соответственно), но у P. pileus – сохранилась прежней (6.3–6.6 мм).
A. aurita всюду доминировала по биомассе, которая в 2017 г. в глубоководной части моря была в ∼2.5 раза выше (p < 0.01), чем в 2016 г. (рис. 4).
Рис. 4.
Средняя биомасса доминирующих видов желетелого макропланктона (±стандартная ошибка, г м–2) на внешнем шельфе (a) и в глубоководных районах южнее Крыма (б) Черного моря осенью 2016–2017 гг.
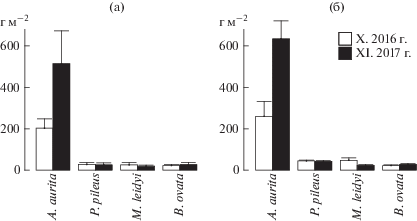
Межгодовые изменения в обилии гребневиков если и имели место, то в несопоставимо меньших масштабах. Биомасса P. pileus в 2017 г. осталась на том же уровне, что и годом ранее – ее возможные отклонения находятся в пределах ошибок выборочности. Биомасса M. leidyi в глубоководных районах моря в 2017 г. снизилась вдвое по отношению к прошлогодней (p < 0.05), а биомасса B. ovata выросла на 27% (6 г м–2). Практически также (на 23%) увеличилась она и на внешнем шельфе. Поскольку биомасса берое представляет собой, по сути, некоторую часть ассимилированной биомассы других видов гребневиков, их возможное потребление этим видом можно оценить количественно. Принимая во внимание известную для гребневиков усвояемость пищи – 80%, эффективность ее использования на рост (К2) – 30%, и диспропорцию в содержании органического вещества у B. ovata, P. pileus и M. leidyi – 2.5 : 2.2 : 1.1 мг/г сырой массы тела [3, 26] получим, что увеличение биомассы B. ovata на 1 г м–2 эквивалентно убыли ∼5 г м–2P. pileus и ∼9 г м–2M. leidyi.
Следовательно, если допустить, что в 2017 г. B. ovata питался исключительно M. leidyi, то популяция последнего в 2016 г. потеряла на 45 г м–2 больше на внешнем шельфе и на 54 г м–2 – в глубоководных районах. Учет P. pileus в пище B. ovata привел бы к более низким оценкам выедания M. leidyi. Но, независимо от этого, из расчетов следует, что осенью 2017 г. общая биомасса M. leidyi и P. pileus изначально была не только не ниже, а скорее всего даже выше, чем в 2016 г.
ОБСУЖДЕНИЕ
Характер пространственной изменчивости ТПМ в ноябре 2016–2017 гг. в целом соответствовал среднемноголетнему распределению температуры. Однако, вследствие особенностей осенних гидрологических сезонов, выхолаживание поверхностных вод в 2016 г. оказалось более интенсивным, чем в 2017 г. В результате диапазон измеренных значений ТПМ в ноябре 2017 г. превысил значения ТПМ для ноября 2016 г. на 0.2–1.2°С с минимальным отличием в восточном секторе исследований и максимальным – в западном.
Локализация отдельных зон повышенных и пониженных значений ТПМ соответствовала динамическим образованиям, формирующим циркуляцию поверхностных вод на исследуемой акватории: ОЧТ, его циклоническим меандрам южнее Керченской предпроливной зоны и в районе БТЛ, зонам антициклонической завихренности над БТЛ и на шельфе юго-восточного Крыма, восточному и западному “ядрам” ОЦК. Этот характер гидрологической циркуляции соответствующим образом отразился и на количественном распределении икры и личинок шпрота (рис. 2, 3). Так, в восточном секторе ихтиопланктонных исследований в ноябре 2016 г. минимальная численность ихтиопланктона наблюдалась на северной периферии “ядра” Феодосийского антициклона. Икра и личинки шпрота могли быть вынесены из залива течением по восточной периферии антициклона к зоне конвергенции на внешней границе меандра струи ОЧТ, где численность икры и личинок шпрота составляла 338 и 34 экз/м2 соответственно. Усиление вдольбереговой струи ОЧТ над шельфом южного берега Крыма, вероятно, способствовало выносу икры и личинок рыб в прибрежную зону центрального сектора. При этом их максимальная численность (714 и 88 экз/м2 соответственно) была отмечена в зоне влияния антициклонической завихренности ОЧТ восточнее м. Сарыч. В западном секторе пространственное распределение икры и личинок шпрота соответствовало области трансформации прогретых вод меандра ОЧТ на акваторию БТЛ. На периферии антициклонической завихренности над восточным склоном БТЛ наблюдалась максимальная численность икры и личинок – 1114 и 112 экз/м2 соответственно.
В восточном секторе в ноябре 2017 г., как и в 2016 г., минимальная численность ихтиопланктона наблюдалась в районе Феодосийского залива. Циклонический меандр струи ОЧТ южнее Керченского пролива привел к деформации зоны антициклонической завихренности, примыкающей к Феодосийскому заливу. Южнее, на границе трансформированного Феодосийского антициклона и циклонического меандра ОЧТ, наблюдалась высокая численность икры и личинок шпрота, которая достигала 806 и 60 экз /м2 соответственно. В центральном секторе минимальная численность икры и личинок шпрота наблюдалась в глубоководной юго-западной части полигона в зоне влияния западного “ядра” ОЦК. Максимальная численность икры и личинок шпрота (566 и 52 экз/м2 соответственно) наблюдалась в зонах конвергенции на внешней и внутренней границах ОЧТ. В западном секторе активизация меандра ОЧТ над западным склоном БТЛ привела к усилению течений на границах СевАЦ. Как следствие, численность икры на периферии вихря в среднем составляла 298 экз/м2, а численность личинок была максимальной по сравнению с другими районами (в среднем 28.5 экз/м2). Здесь же была отмечена и максимальная численность личинок – 63 экз/м2. Увеличение численности личинок в западном и восточном секторах исследований, возможно, связано и с особенностями температурного режима. Диапазон измеренных ТПМ и параметры вертикальной термической структуры вод соответствовали тенденции “глобального потепления”, что выразилось в повышенных значениях ТПМ, температуры в “ядре” ХПС и увеличении его теплозапаса.
Численность икры и личинок шпрота в западном, центральном и восточном районах моря в начале зимнего нерестового сезона 2016–2017 гг. находилась на уровне верхних предельных значений в период активного нереста шпрота в 1950–1970-х гг. [11]. Судя по более высокой средней численности икры и личинок в 2017 г. по сравнению с 2016 г., нерест шпрота в 2017 г. начался раньше и протекал активнее. Рост численности икры и личинок, а также фенологические сдвиги в характере нереста шпрота указывают на изменение условий его обитания под влиянием климатических и сопряженных с ними факторов. Об этом же свидетельствуют синхронные изменения в межгодовой динамике обилия желетелых, особенно медузы, чья биомасса в последние годы значительно возросла. В 2016 г. биомасса A. aurita была третьей по величине, а в 2017 г. – выше, чем когда-либо ранее в осенние месяцы. В открытых районах моря она вдвое превысила биомассу медузы в 1978 г., а по сырому веществу была примерно такой же, как биомасса гребневика M. leidyi в 1994 г. [2, 20]. Учитывая более высокое содержание органического вещества в теле медузы по сравнению с гребневиком, очевидно, что в 2017 г. популяция A. aurita аккумулировала в ∼1.5 раза больше органического вещества, чем гребневик на пике осенней биомассы в 1994 г.
Медленное выхолаживание моря в ноябре 2017 г., вероятно, способствовало сохранению тепловодного мезопланктона, потребляемого всеми планктонофагами [14]. Так, у P. pileus активнее, чем в 2016 г., происходило генеративное обновление популяции (более высокая численность при меньшей биомассе), у M. leidyi и A. aurita усилился соматический рост (более высокая биомасса при меньшей численности). Очевидно, что возрос и трофический пресс желетелых на мезо- и ихтиопланктон. Так, минимальные пищевые потребности медузы, необходимые для компенсации обмена, могли в 2017 г. достигать ∼200 мг зоопл. м–2 сут–1 (∼17 мг Сорг сут–1) на внешнем шельфе и ∼245 мг зоопл. м–2 сут–1 (∼20 мг Сорг сут–1) в глубоководных районах моря. Вероятность потребления ею ихтиопланктона выше при сокращении общей численности мезопланктонных жертв. Крупные личинки шпрота встречались в пище медузы в апреле 2016 г. [16]. Однако, судя по обилию икры и личинок шпрота в море и их отсутствию среди жертв медузы (осенью 2016–2017 гг. просмотрено 130 особей), ее хищничество не нанесло существенного ущерба ихтиопланктонным комплексам. Этому могли способствовать следующие обстоятельства: 1) обилие мезопланктона, численно превышающее количество икры и личинок рыб в море не менее чем на 2 порядка; 2) склонность медузы к эврифагии и потреблению микропланктона [25, 29]; 3) возможная дезориентация хищничества ложными целями, такими как микропланктон [37]. Хищнический пресс гребневиков планктофагов на икру и личинок шпрота в 2016–2017 гг., по-видимому, не мог быть значительным, прежде всего, из-за их невысокой биомассы, в последние годы контролируемой гребневиком B. ovata практически перманентно.
Распределение икры черноморского шпрота в ноябре 2016 и 2017 гг. соответствовало таковому в период его массового нереста в Черном море, когда икра в наибольшем количестве встречается вдали от берегов в халистатической области моря. Такой “океанический” характер распределения шпрота в период его массового нереста связан с тем, что шпрот активно питается в период нереста, а основу его кормовой базы составляет рачковый планктон, численность которого в прибрежье Черного моря подвержена значительным колебаниям, в то время как в глубоководных районах моря она стабильно высока [1]. В то же время другие расы шпрота (балтийская и средиземноморская), являясь прибрежно-пелагическими формами, нерестятся в шельфовых водах [1, 18]. Основными объектами питания черноморского шпрота являются Copepoda, главным образом представители холодноводного комплекса. [20 стр. 34–38]. По нашим данным биомасса копеподы Calanus euxinus в октябре 2016 г. достигала в среднем 2.9 ± 1.0 г м–2 на внешнем шельфе и 7.2 ± 0.7 г м–2 в глубоководной части моря, что практически соответствовало ее биомассе в период до проникновения в море гребневика M. leidyi. В 2017 г. она могла быть еще больше, поскольку все желетелые были крупнее, а их суммарная биомасса значительно выросла [22]. К тому же, в условиях гомотермии вертикальное распределение шпрота не ограничено температурными градиентами, и он может нереститься во всей толще моря, где для него доступен также тепловодный зоопланктон [1, 11]. Отсюда следует, что в начале нерестового периода 2017 г. биотические условия для нереста шпрота были благоприятны. В пищевом комке личинок шпрота длиной от 6.5 до 12.7 мм были отмечены сильно переваренные ювенильные стадии копепод (Calanoida), длина которых варьировала от 0.15 до 0.2 мм. Высокая численность личинок шпрота указывает на хорошую результативность нереста и успешность его эмбрионального и постэмбрионального развития. Тем не менее высокая численность мезопланктона в период нереста планктоноядных видов рыб не всегда является гарантией выживания личинок рыб. Так, по данным [24], была отмечена обратная зависимость между численностью зоопланктона и успешным пополнением популяции сардины. С увеличением численности зоопланктона обычно возрастает пресс планктоноядных хищников, которые выедают, в том числе, и ихтиопланктон.
Сравнительная однородность размерного состава личинок шпрота в ноябре 2016 и 2017 гг., вероятно, была обусловлена началом нереста и идентичными гидрологическими условиями в местах отбора проб. Однако размерный диапазон длин личинок шпрота в 91 рейсе был шире, чем в 98 рейсе. В период наших исследований доля личинок на желточном и смешанном типах питания (до 6 мм) составляла 97–98%. По данным литературы длина выклевывающихся личинок черноморского шпрота имеет широкий диапазон колебания 2–3.7 мм (около 2 мм по [8] и 2.8–3.7 мм по [10]). Минимальная длина предличинок шпрота в наших пробах составляла 1.6 мм и была сопоставима с данными [8]. На размерную структуру предличинок шпрота несомненно оказывают влияние изменение солености, интенсивность света, уровень кислорода и прочие факторы, которые влияют на продолжительность инкубационного периода и способствуют появлению менее развитых личинок при их вылуплении. При этом не исключена возможность, что все эти факторы воздействуют в первую очередь на активность инкубационных желез, а не на скорость эмбрионального развития [32]. С другой стороны, доказано, что наибольшее влияние на эмбриональное и постэмбриональное развитие рыб оказывает температура [30, 32]. Однако наличие личинок длиной менее 2 мм можно объяснить и меньшими размерами икры шпрота в начале нерестового сезона. Размер икры шпрота закономерно возрастает с понижением температуры воды в море, поэтому в осенний гидрологический сезон она значительно мельче, чем в зимний. С понижением температуры воды развитие икры замедляется и удлиняется период набухания икры, что и приводит к увеличению ее средних размеров [10 стр. 112]. Такие личинки описаны для глубоководных районов исследований [21]. Для них характерен высокий темп роста и замедленное развитие. Согласно экспериментальным данным [39], длительность эмбрионального развития шпрота напрямую зависит от температуры воды в море. Так, продолжительность развития от оплодотворения до вылупления ускоряется в 3 раза (с 6.2 до 2.2 сут) при повышении температуры с 5 до 19°С. Повышенная температура воды влияет и на ускорение развития личинок. Так, если пигментация глаз и формирование рта у личинок шпрота на желтковом типе питания при 5°С продолжается две недели, то при температуре 19°С они завершаются в течение 3 дней. В результате у личинок быстрее рассасывается желток, и они раньше переходят на экзогенное питание [39]. По данным [11], интенсивный нерест шпрота наблюдается при температуре от 7 до 12°С, а пигмент в глазах личинок появляется на шестые сутки после вылупления при длине около 4.5 мм.
По-видимому, личинки, чье эмбриональное развитие проходило у поверхности, где температура воды достигала 13–14°С, были более развиты при меньших размерах, чем личинки с нижних горизонтов лова, где температура воды была значительно ниже. В последние десятилетия наблюдается постепенное повышение температуры поверхности воды в Черном море. Увеличение теплозапаса в слое 0–100 м, где наблюдается нерест шпрота, повышение температуры поверхностного слоя и уменьшение толщины холодного промежуточного слоя, вероятно, привело к сокращению временны́х периодов эмбрионального и постэмбрионального развития в относительно теплой воде и увеличению численности мелкоразмерных личинок.
С другой стороны, более мелкие размеры личинок при вылуплении могут быть связаны со снижением размерно-массовых и возрастных характеристик нерестовой популяции шпрота в период наших исследований. Судя по возрастной структуре шпрота в 2016–2017 гг., большая часть нерестящихся самок относилась к младшей возрастной группе, чья икра обычно мельче, чем у старших возрастных групп [23]. Годовой вылов шпрота в 2015 и 2016 гг. был достаточно высок и составлял 26119 и 25766 т соответственно (в среднем 25943 т), в то время, как в период с 2000 по 2013 гг. он в среднем составлял всего 8746 т. Увеличение вылова шпрота в 2015 и 2016 гг., вероятно, привело к снижению вылова в 2017 г. до 14 782 т и увеличению доли младших возрастных групп (0+ и 1) в уловах [23]. Тенденция к снижению средней длины, массы и возраста шпрота в районе Крымского полуострова на фоне интенсивного промысла наблюдалась и в период 1987–1992 гг. [9]. Летом 2016 и 2017 гг. младшая возрастная группа в популяции шпрота составляла 64.7 и 64.8%, в то время как в 2015 г. – 40.1% [23]. Вероятно, высокую интенсивность нереста в ноябре 2016 и 2017 гг. обеспечивали в основном годовики, чей размер и вес были значительно меньше, чем у особей старших возрастных групп.
ЗАКЛЮЧЕНИЕ
Отмеченное с середины 1990-х гг. “глобальное потепление” привело к повышению температуры поверхностного слоя и увеличению теплозапаса в слое 0–100 м. Интенсивность процесса выхолаживания верхнего слоя моря осенью 2016 и 2017 г. способствовала развитию мезопланктона тепловодного и эвритермного комплексов – важного источника пищи для рыб-планктофагов и желетелых хищников.
Изменение температурного режима в Черном море привело к изменению фенологии нереста умеренноводных видов рыб. В районе Крымского полуострова интенсивный нерест шпрота сдвинулся с зимнего на осенний гидрологический сезон. В ноябре 2016 г. средняя численность икры составляла 184.1 экз/м2, а в ноябре 2017 г. – 272.1 экз/м2. Средняя численность икры в ноябре 2016 и 2017 гг. соответствовала максимальным значениям за все зимние нерестовые сезоны в 1960–1970 гг. исследований. Среди личинок шпрота доминировали младшие возрастные группы, составляя 97–98% от общей численности всех пойманных личинок.
Пространственная неоднородность в распределении ихтиопланктона в значительной мере определялась характером проявления динамических образований. Максимальные концентрации икры и личинок шпрота в основном были приурочены к высокоградиентным зонам конвергенции течений, а минимальные – к глубоководным районам моря со слабыми и неустойчивыми течениями.
В 2016 г. желетелый макропланктон не оказал существенного влияния на выживание шпрота на ранних стадиях развития, о чем свидетельствует высокая доля годовиков (65%) в возрастной структуре популяции шпрота 2017 г.
Высокая численность икры и личинок шпрота в ноябре 2017 г., к сожалению, не гарантирует многочисленность будущего пополнения популяции шпрота из-за возросшей биомассы медузы Aurelia aurita – хищника и конкурента в питании на всех этапах онтогенеза. В открытых районах моря биомасса Aurelia aurita была вдвое выше, чем в 1978 г., а по сырому веществу была примерно такой же, как биомасса гребневика Mnemiopsis leidyi в 1994 г.
Источник финансирования. Работа выполнена в рамках госзадания ФБГУН ФИЦ ИнБЮМ РАН № АААА-А18-118020890074-2 и № АААА-А18-118021350003-6. При поддержке грантов РФФИ “Роль глобальных и локальных факторов в формировании ихтиопланктонных сообществ моря” № 18-44-920007 и “Отклик черноморской пелагической экосистемы на изменение климата в регионе (на примере медуз, гребневиков и мелких пелагических рыб)” № 18-44-920 022.
Список литературы
Алеев Ю.Г. О биологии и хозяйственном значении черноморского шпрота Sprattus sprattus phalericus (Risso) // Труды Севастопольской биолог. станции. 1958. Т. Х. С. 97–107.
Аннинский Б.Е., Финенко Г.А., Дацык Н.А., Игнатьев С.М. Желетелый макропланктон в Черном море осенью 2010 г. // Океанология. 2013. Т. 53. № 6. С. 758–768.
Aннинский Б.Е. Состав органического вещества медузы Aurelia aurita L. и двух видов гребневиков Черного моря // Биология моря. 1994. Т. 20. № 4. С. 291–295.
Артамонов Ю.В., Алексеев Д.В., Скрипалева Е.А. и др. Особенности сезонной и синоптической изменчивости структуры вод в зоне основного черноморского течения в осенне-зимний период 2016 г. // Экологическая безопасность прибрежной и шельфовой зон моря. 2018. Вып. 1. С. 32–43.
Артамонов Ю.В., Алексеев Д.В., Скрипалева Е.А. и др. Термохалинная структура вод у берегов Крыма и прилегающей открытой акватории Черного моря летом 2016 года // Экологическая безопасность прибрежной и шельфовой зон моря. 2017. Вып. 3. С. 20–31.
Белокопытов В.Н. Климатические изменения гидрологического режима Черного моря: Автореф. дис. … докт. геогр. наук. Севастополь, 2017. 377 с.
Белокопытов В.Н., Никольский Н.В. Устойчивые антициклонические вихри у южного и западного побережья Крыма // Экологическая безопасность прибрежной и шельфовой зон моря. 2015. Вып. 1. С. 47–53.
Водяницкий В.А., Казанова И.И. Определитель пелагических икринок и личинок рыб Черного моря // Труды Всесоюз. НИИ мор. рыб. хоз-ва и океанографии. 1954. 28. С. 240–323.
Гирагосов В.Е., Зуев Г.В., Репетин Л.Н. Изменчивость репродуктивного потенциала черноморского шпрота (Sprattus sprattus рhalericus) в связи с температурными условиями среды // Морской эколог. Журнал. 2006. Т. V. № 4. С. 5–22.
Горбунова Н.И. Размножение и развитие черноморского шпрота Sprattus sprattus рhalericus (Risso) // Труды Севастопольской биолог. станции. 1958. 10. С. 108–125.
Дехник Т.В. Ихтиопланктон Черного моря. Киев: Наук. думка, 1973. 235 с.
Дука Л.А., Синюкова В.И. Руководство по изучению питания личинок и мальков морских рыб в естественных и экспериментальных условиях. Киев: Наукова думка, 1976. 110 с.
Иванов В.А., Белокопытов В.Н. Океанография Черного моря. Севастополь: ЭКОСИ-гидрофизика, 2011. 212 с.
Климова Т.Н., Аннинский Б.Е., Вдодович И.В., Подрезова П.С. Особенности видового состава и пространственного распределения ихтио- и желетелого макропланктона Черного моря у Крымского полуострова в ноябре 2017 г. // Научный журн. Евразийский союз ученых (ЕСУ). 2018. № 4 (49). Часть 3 “Биологические науки”. С. 7–11.
Климова Т.Н., Вдодович И.В., Загородняя Ю.А., Доценко В.С. Ихтиопланктон Феодосийского залива в декабре 2006 г. // Вопросы ихтиологии. 2009. Т. 49. № 2. С. 233–239.
Климова Т.Н., Игнатьев С.М., Вдодович И.В., Губанов В.В. Состояние ихтио- и макропланктонного комплексов на шельфе Крымского полуострова в апреле 2016 г. // Международная научно-техническая конференции “СИСТЕМЫ КОНТРОЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ – 2016” 24–27 окт. 2016 г. Севастополь: ИПТС, 2016. С. 159.
Климова Т.Н., Субботин А.А., Мельников В.В., Серебрянников А.Н., Подрезова П.С. Пространственное распределение ихтиопланктона у Крымского полуострова в летний нерестовый сезон 2013 г. // Морской биолог. журнал. 2019. Том. 4. № 1. С. 1–18.
Павловская Р.М. Размножение шпрота, ставриды и барабули в Черном море // Труды НИРО. 1954. 28. С. 126–135.
Попов Ю.П., Ковалишина С.П., Грандова М.А., Матыгин А.С. Многолетние изменения характеристик морских вод и фитопланктона северо-западного шельфа Черного моря // Совр. рыбохозяйственные и экологические проблемы Азово-Черноморского региона. Материалы VII Международной конференции. Керчь: ЮгНИРО, 2012. Т. 1. С. 171–178.
Современное состояние ихтиофауны Черного моря / Под ред. Коновалова С.М. Севастополь: СО “ЭКОСИ-Гидрофизика”, 1995. 215 с.
Стоянов С.А. Черноморский шпрот Sprattus sprattus sulinus (Antipa) // Бългазска Академия науките. Труды Ин-та по зоол. 1953. № 3. 90 с.
Финенко Г.А., Aннинский Б.Е., Дацык Н.А. Трофические характеристики Mnemiopsis leidyi и его воздействие на планктонное сообщество в прибрежных районах Черного моря // Океанология. 2018. Т. 58. № 6. С. 899–907.
Шляхов В.А., Шляхова О.В., Надолинский В.П., Перевалов О.А. Промыслово-биологические показатели рыболовства для важнейших распределенных запасов водных биоресурсов Черного моря как основа их регионального оценивания // Водные биоресурсы и среда обитания. 2018. Том 1. № 1. С. 86–103.
Agostini V.N., Bakun A., Francis R.C. Larval stage controls on Pacific sardine recruitment variability: high zooplankton abundance linked to poor reproductive success // Mar. Ecol.: Prog. Ser. V. 345. P. 237–244, 2007. https://doi.org/10.3354/meps06992
Anninsky B.E. Organic composition and ecological energetics of jellyfish Aurelia aurita L. (Cnidaria, Scyphozoa) under the Black Sea conditions // Trophic relationships and Food Supply of Heterotrophic Animals in the Pelagic Ecosystem of the Black Sea. Eds. Shulman G.E. Turkey, Istanbul: Black Sea Commission Publications, 2009. P. 99–160.
Anninsky B.E., Finenko G.A., Abolmasova G.I. et al. Effect of starvation on the biochemical compositions and respiration rates of ctenophores Mnemiopsis leidyi and Beroe ovata in the Black Sea // J. Mar. Biol. Ass. U.K. 2005. Vol. 85. № 3. P. 549–561.
Auth T.D., Daly E.A., Brodeur R.D., Fisher J.L. Phenological and distributional shifts in ichthyoplankton associated with recent warming in the northeast Pacific Ocean // Global Change Biology. September 2017. 24(11). https://doi.org/10.1111/gcb.13872
Bakun A. Fronts and eddies as key structures in the habitat of marine fish larvae: opportunity, adaptive response and competitive advantage // SCIENTIA MARINA. October 2006. V. 70. № S2. Barcelona (Spain). P. 105–122. ISSN: 0214–8358.
Costello J.H, Colin S.P. Morphology, fluid motion and predation by the scyphomedusa Aurelia aurita // Mar. Biol. 1994. 121. P. 327–334.
Daufresne M., Lengfellner K., Sommer U. Global warming benefits the small in aquatic ecosystems // PNAS. 2009. V. 106. № 31. P. 12 788–12 793. URL: www.pnas. org/cgi/doi/10.1073/pnas.0902080106
Edwards M & Richardson A.J. Impact of climate change on marine pelagic phenology and trophic mismatch // Nature. 2004. 430. P. 881–884. https://doi.org/10.1038/nature 02808.
Fishery Science. The Unique Contributions of Early Life Stages. / Ed. by Fuiman L.A., Werner R.G. Blackwell science, 2002. 337 p.
https://dvs.net.ru/mp/data/main_ru.shtml
https://www.myocean.eu/interactive catalogue/sst_bs
https://www.node.noaa.gov/satellite Data/pathfinder4km
Klimova T.N., Podrezova P.S. Seasonal distribution of the Black Sea ichthyoplankton near the Crimean Peninsula // Regional studies in Marine Science. 2018. 24. P. 260–269 https://doi.org/10.1016/j.rsma.2018.08.013
Malej A., Turk V., Lučić D., Benović A. Direct and indirect trophic interactions of Aurelia sp. (Scyphozoa) in stratified marine environment (Mljet Lakes, Adriatic Sea) // Mar. Biol. 2006. 151. P. 827–841.
Munk P. Differential growth of larval sprat Sprattus sprattus across a tidal front in the eastern North Sea // Mar. Ecol.: Prog. Ser. 1993. Vol. 99. P. 17–27.
Petereit Ch. Influence of temperature and salinity on sprat (Sprattus sprattus) eggs and yolk sac larvae from contrasting environments: Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultat der Christian-Albrechts-Universitat zu Kiel. 2009.
Purcell J.E., Arai M.N. Interactions of pelagic cnidarians and ctenophores with fishes: a review // Hydrobiologia. 2001. 451. P. 27−44.
Staneva J.V., Dietrich D.E., Stanev E.V., Bowman M.J. Rim Current and coastal eddy mechanisms in an eddy-resolving Black Sea general circulation model. // J. of Marine Systems, 2001, 31, 137–157.
Tsikon-Lukanina E.A., Reznichenko O.G., Lukasheva T.A. Feeding of Mnemiopsis leidyi // Rybn. Khoz. 1995. № 4. P. 46–47.
Visser M.E. & Both C. Shifts in phenology due to global climate change: the need for a yardstick // Proc. R. Soc. London, Ser. B. 2005. 272(1581). P. 2561–2569. https://doi.org/10/1098/rspb.2005.3356.
Voss R., Dickmann M., Schmidt J.O. Feeding ecology of sprat (Sprattus sprattus L.) and sardine (Sardina pilchardus W.) larvae in the German Bight, North Sea // OCEANOLOGIA. 2009. 51 (1). P. 117–138.
Дополнительные материалы отсутствуют.


