Океанология, 2021, T. 61, № 1, стр. 79-90
Размер и возраст наступления половозрелости серого морского ежа Strongylocentrotus intermedius у северо-западного побережья Японского моря
М. О. Чалиенко 1, *, М. В. Калинина 1, В. Н. Кулепанов 1, В. И. Матвеев 1
1 Тихоокеанский филиал “ВНИРО” (“ТИНРО”)
Владивосток, Россия
* E-mail: yumbo@yandex.ru
Поступила в редакцию 11.06.2019
После доработки 09.03.2020
Принята к публикации 08.04.2020
Аннотация
Обсуждается влияние океанических и биотопических факторов на размер и возраст половой зрелости серого морского ежа Strongylocentrotus intermedius вдоль северо-западного побережья Приморья. Установлена взаимосвязь между темпами роста и размерами половозрелости морских ежей: в скоплениях с высоким темпом роста размер 50%-ной половозрелости составляет 30–35 мм, а с низким – 20–22 мм. В поселениях южной части прибрежья северного Приморья окончательно половозрелыми S. intermedius становятся при достижении размеров 41–45 мм, в более северных районах – от 26–30 до 31–35 мм. На участках бухта Ежовая – мыс Хитрово и у мыса Надежды – возраст окончательной половозрелости составляет от 4+ до 5+, на остальных участках – 3+. Делается вывод о том, что в пределах исследованной акватории размеры и сроки наступления половозрелости в разных поселениях S. intermedius зависят не столько от широтной изменчивости температурного режима, сколько от локальных условий обитания, в первую очередь от обилия доступной пищи.
ВВЕДЕНИЕ
Серый морской еж Strongylocentrotus intermedius (A. Agassiz, 1863) распространен на тихоокеанском мелководье южной части Охотского моря, в Японском море и у южных Курильских островов [3]. У берегов Приморья он является одним из доминирующих по величине обилия видов, образующих устойчивые промысловые скопления [20]. Обитание в верхнесублиторальной зоне в неоднородных условиях со значительными колебаниями океанических факторов способствует приобретению S. intermedius определенных эколого-физиологических особенностей, касающихся его репродуктивного цикла и темпов роста [9, 10, 37 и др.]. Сильнее всего эти факторы влияют на интенсивность роста молодых особей как более чувствительных к условиям среды [26]. Акватория от мыса Поворотный до мыса Золотой (северное Приморье) является одним из основных районов промысла S. intermedius, однако исследований размера и возраста его половозрелости в локальных поселениях этого района ранее не проводилось. Данные по срокам и размерам полового созревания этого вида у берегов Приморья известны только для акваторий, расположенных южнее мыса Поворотный: Уссурийского залива [14] и залива Посьета [6, 28, 29].
Настоящая работа продолжает серию публикаций, освещающих особенности роста и биологии размножения S. intermedius у северо-западного побережья Японского моря севернее мыса Поворотный [5, 11, 16, 36, 37], и посвящена определению размера и возраста наступления половозрелости S. intermedius в этом районе, а также оценке совокупного влияния биотических и абиотических факторов на эти параметры.
МАТЕРИАЛЫ И МЕТОДЫ
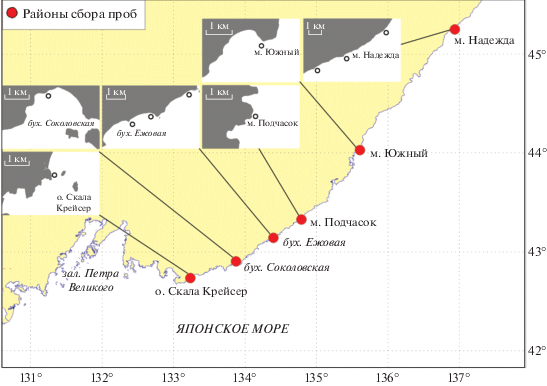
Материалом послужили пробы серого морского ежа, собранные на шести участках (у о-ва Скала Крейсер; в бухте Соколовская; на участке бухта Ежовая – мыс Хитрово; у мыса Подчасок; у мыса Южный; у мыса Надежды) вдоль северо-западного побережья Приморья, в ходе проведения водолазной съемки на НИС “Убежденный”, в третьей декаде августа–первой декаде сентября 2017 г. (на участке бухта Ежовая – мыс Хитрово в первой декаде сентября 2015 г.) (рис. 1, табл. 1).
Таблица 1.
Характеристика районов исследования и объем материала
| Район | Глубина, м | Грунт (*) | Граница залегания твердых грунтов, м |
Уклон дна |
Степень открытости (**) | Коэффициент ветрового воздействия |
Кол-во экз. |
|---|---|---|---|---|---|---|---|
| О-в Скала Крейсер | 3 | Скала, валуны, глыбы | 7 | <1° | 3 тип | 105 | 75 |
| Бухта Соколовская | 3 | Скала, валуны | 3 | <1° | 3 тип | 101 | 35 |
| Бух. Ежовая – мыс Хитрово | 3–6 | Скальное плато, камни | 3–6 | 1°–2° | 2 тип | 68 | 90 |
| Мыс Подчасок | 4–5 | Камни, валуны | 10 | 6° | 2 тип | 41 | 34 |
| Мыс Южный | 4 | Скальное плато | 20 | <1° | 2 тип | 81 | 162 |
| Мыс Надежда | 4–6 | Скальное плато | 4–8 | <1° | 2 тип | 85 | 104 |
Общий биологический анализ проводился в основном у особей <45 мм. У ежей измеряли диаметр панциря (точность ±1 мм), общую массу и массу гонады (точность ±0.1 г). Гонадный индекс (ГИ) рассчитывали как отношение массы гонады к общей массе ежа, выраженное в процентах. Достоверность различий средних значений ГИ проверяли по критерию Стьюдента при уровне значимости p = 0.05, для сравнения средних ГИ половозрелых ежей с разных районов использовались поправки, учитывающие многократность сравнений [13]. Пол и стадию зрелости гонады определяли на прижизненных мазках под световым микроскопом по следующей классификации [34]: 1 – пролиферации (начала развития), 2 – дифференциации (активного гаметогенеза), 3 – нерестовая или зрелой гонады, 4 – посленерестовая. Отдельно отмечали ежей с частично опустошенными гонадами, находящимися в состоянии нереста. Самцов и самок дифференцировали на ювенильных и половозрелых по степени развития половых желез [28, 38, 40]. Размер и возраст 50%-ной половозрелости определяли с помощью уравнения Ферхюльста [23].
Индивидуальный возраст S. intermedius определяли путем подсчета концентрических полос роста на пластинках интерамбулакрального ряда панциря [36]. Обработка пластинок проводилась по методу Йенсен [41]. Фрагменты панцирей с внешней стороны зашлифовывали и обжигали над пламенем спиртовки, пластинки помещали в спирт и просматривали под бинокуляром в отраженном свете.
Темпы роста S. intermedius определяли по материалам, собранным в 2001 и 2015–2017 гг. в летне-осенний период. Групповой рост описывали с помощью уравнения Берталанфи, значения коэффициентов уравнения подбирали по алгоритму, описанному Максимовичем [25].
Статистическую обработку данных проводили с помощью программ MS Excel и Statistica. Для построения кривых роста возраст был определен у 1434 экз., для вычисления размера и возраста половозрелости – у 499 экз.
Тип грунта определялся водолазом непосредственно на дне визуально и тактильно, по классификации морских осадков [1]. Площадь обследуемого участка составляла от 3 до 100 м2, в зависимости от видимости. На отдельных разрезах выполнялась подводная съемка камерой GoPro HERO 3. Угол наклона подводного склона оценивали по расстоянию от уреза воды до глубины 20 м с помощью геоинформационной системы MapInfo Professional.
Оценка численности и качественного состава водной растительности проводилась по материалам водолазных съемок 2004–2017 гг. стандартными методами [4, 12]. Определяли общее проективное покрытие дна макрофитами (ОПП) и проективное покрытие отдельными видами (ПП).
Температурный режим вод определяли с использованием всех доступных данных океанологических наблюдений с 1975 по 2015 гг. Основная их часть взята из океанографического массива ТИНРО-Центра и дополнена данными OCEAN DATA VIEW [42]. К работе привлекались станции до 25–30 м. Недостоверные значения характеристик отбраковывались с учетом региональных особенностей побережья Приморья. Расчет средних многолетних месячных значений температуры проводился для глубин 0.5, 10 и 20 м, полученные результаты относились к середине месяца, что позволило определить сроки перехода температуры через 5°C в среднемноголетнем аспекте. Всего было исследовано 956 станций. Сумму тепла (градусо-дни) рассчитывали по методике, приведенной в работе Викторовской и Матвеева [9]. Степень ветрового воздействия (СВВ) вычисляли по методике, предложенной Преображенским с соавторами [30]. Использовались данные ближайших к участкам гидрометеостанций за период с 2008 по 2018 гг., взятые с сайта rp5.ru.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Размер и возраст половозрелости. Морские беспозвоночные становятся половозрелыми, когда достигают определенных размеров (для морских ежей – около 30% от максимального), при которых их плодовитость становится сопоставима с плодовитостью взрослых особей [46, 49]. Считается, что для каждого вида размер половозрелости является величиной более постоянной, чем возраст половозрелости [19], и отмечается зависимость этих параметров от условий обитания [29, 45, 50 и др.].
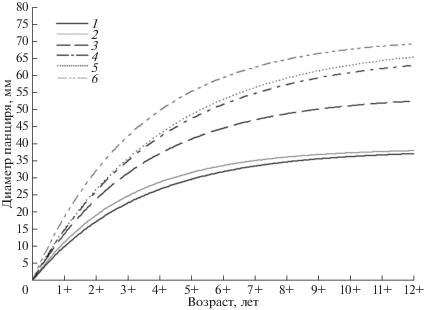
Исследованные нами акватории относятся к южной (у о-ва Скала Крейсер, бухта Соколовская, бухта Ежовая – мыс Хитрово, у мыса Подчасок) и средней (у мысов Южный и Надежды) частям побережья северного Приморья, различающихся по температурному режиму вод и продолжительности периодов отрицательных температур [9]. Как видно из рис. 2, сравнительно высокие темпы роста характерны для скоплений ежей в бухте Соколовская, у мыса Подчасок и у о-ва Скала Крейсер (южная часть побережья), а у мысов Южный и Надежды (средняя часть побережья) они значительно ниже. В районе бухта Ежовая – мыс Хитрово, относящемуся к южной части побережья, темпы роста ежей имеют средние показатели. Для построения графиков линейного роста и кривых полового созревания были использованы разные по объему и площади сбора выборки, поэтому средние размеры ежей в соответствующих возрастных классах между ними могут несколько различаться.
Рис. 2.
Групповой рост S. intermedius у побережья Приморья: 1 – у мыса Южный; 2 – у мыса Надежды; 3 – бухта Ежовая – мыс Хитрово; 4 – у мыса Подчасок; 5 – в районе о-ва Скала Крейсер; 6 – в бухте Соколовская.
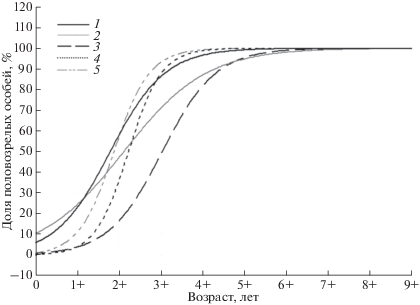
Размеры исследованных S. intermedius изменялись от 5 до 51 мм. Минимальные размеры половозрелости на разных участках варьировали от 15 мм (у мыса Южный) до 31 мм (у о-ва Скала Крейсер). Размеры 50%-ной половозрелости составили у о-ва Скала Крейсер 35 мм, в бухте Соколовская – 34 мм, у мыса Подчасок – 30 мм, на участке бухта Ежовая – мыс Хитрово – 28 мм, у мыса Южный – 20 мм и у мыса Надежды – 22 мм (рис. 3).
Рис. 3.
Доля половозрелых особей S. intermedius в разных размерных классах: 1 – у мыса Южный; 2 – у мыса Надежды; 3 – бухта Ежовая – мыс Хитрово; 4 – у мыса Подчасок; 5 – в районе о-ва Скала Крейсер; 6 – в бухте Соколовская.

Возраст морских ежей в пробах варьировал от 1+ до 8+ лет. В выборках, собранных у мысов Южный и Надежда, практически полностью отсутствовали особи в возрасте 2+ (5 и 3 экз. соответственно), что можно объяснить пространственно-временнóй нестабильностью пополнения, свойственной многим малоподвижным морским беспозвоночным. В связи с этим, при построении кривых созревания особи в возрасте 2+ в этих районах не учитывались. У мыса Подчасок в пробах, напротив, были отмечены только экземпляры в возрасте 1+ и 2+, поэтому кривая созревания для этого района не представлена.
По нашим данным (по уравнению Ферхюльста), 50%-ной половозрелости в большинстве районов (у о-ва Скала Крейсер, в бухте Соколовская, у мысов Южный и Надежды) ежи достигают в возрасте около 2+, а на участке бухта Ежовая – мыс Хитрово в возрасте 3+ (рис. 4). Учитывая, что у мыса Подчасок у ежей в возрасте 1+ и 2+ в гонадах присутствовали зрелые половые клетки (у 48 и 70% соответственно), с большой долей вероятности можно утверждать, что 50%-ной половозрелости они достигают в возрасте от 1+ до 2+. Зрелые гаметы в гонадах ежей в возрасте 1+ также отмечались во всех остальных районах (за исключением района от бухты Ежовая до мыса Хитрово), где доля таких ежей варьировала от 15 до 23%.
Рис. 4.
Доля половозрелых особей S. intermedius в разных возрастных группах: 1 – у мыса Южный; 2 – у мыса Надежды; 3 – бухта Ежовая – мыс Хитрово; 4 – в районе о-ва Скала Крейсер; 5 – в бухте Соколовская.
На всех исследованных участках с увеличением размеров ежей доля половозрелых особей постепенно возрастала (табл. 2, рис. 3). Так как у S. intermedius нерестовый период весьма растянут во времени в выборках обычно наблюдается значительная изменчивость половозрелых особей по состоянию гонад. Как правило в момент сбора материала у небольшого количества половозрелых ежей по разным причинам могут отсутствовать зрелые половые клетки в гонадах. В связи с этим в настоящей работе сроки и размеры наступления окончательной половой зрелости S. intermedius в биотопах определялись по размеру и возрасту, при которых большинство особей (более 90%) имели гонады со зрелыми половыми клетками. Учитывая большую условность приближенного описания реальных кривых полового созревания с помощью уравнения Ферхюльста, в настоящей работе размер и возраст окончательной половозрелости животных определяли по эмпирическим данным с указанием примерных размерных и возрастных диапазонов (табл. 2).
Таблица 2.
Доля половозрелых особей у разноразмерных S. intermedius в разных районах
| Размерные классы, мм | Доля половозрелых S. intermedius, % | |||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 11–15 | – | – | – | – | 18 | – |
| 16–20 | – | – | – | 0 | 34 | 38.1 |
| 21–25 | 0 | 20 | 38 | 0 | 64 | 66.7 |
| 26–30 | 0 | 0 | 53 | 50 | 96 | 79 |
| 31–35 | 33 | 57 | 71 | 75 | 96 | 90 |
| 36–40 | 82 | 71 | 92 | 75 | 100 | 100 |
| 41–45 | 100 | 100 | 96 | – | 100 | 100 |
| а* | 7.2248 | 4.4703 | 2.5807 | 3.535 | 1.726 | 2.3474 |
| b* | –0.2089 | –0.1336 | –0.0937 | –0.1195 | –0.08867 | –0.1119 |
| L50, мм | 34.6 | 33.5 | 27.6 | 29.6 | 19.5 | 21 |
В поселениях, расположенных в южной части северного Приморья, окончательно половозрелыми (более 90% особей) S. intermedius становятся при достижении ими размеров 41–45 мм, а в более северных районах у мыса Южный – 26–30 мм и у мыса Надежды – 31–35 мм (табл. 2). Возраст окончательной половозрелости ежей в разных районах также различался. У о-ва Скала Крейсер, в бухте Соколовская и у мыса Южный большинство ежей (более 90%) достигают половой зрелости в возрасте 3+, а у мыса Надежды и на участке бухта Ежовая – мыс Хитрово – от 4+ до 5+. Так как на акваториях у о. Скала Крейсер и у мыса Подчасок темпы роста ежей приблизительно сходные (рис. 2), с большой долей вероятности можно предположить, что у мыса Подчасок массовое созревание ежей также происходит в возрасте 3+. Следует отметить, что в настоящей работе размер и возраст половой зрелости определялся у животных, взятых с небольших глубин (3–6 м), на больших глубинах значения этих параметров могут быть выше.
Ранее было показано, что для разных поселений S. intermedius северо-западного побережья Японского моря от мыса Поворотный до мыса Золотой характерна значительная пространственная вариабельность темпов роста и размерного состава [36]. В настоящей работе установлено, что в разных локальных поселениях размеры наступления половозрелости ежей также различаются. Отмечается, что в районах с высокими темпами роста животных (у о-ва Скала Крейсер, в бухте Соколовская и у мыса Подчасок) размеры 50%-ной половозрелости были значительно выше, чем с низкими (у мысов Южный и Надежды): соответственно 30–35 и 20–22 мм. Ежи, обитающие на участке бухта Ежовая – мыс Хитрово, по этому показателю занимают промежуточное положение. Размеры, при которых S. intermedius достигают окончательной половозрелости, также были существенно выше в районах с высокими темпами роста ежей, за исключением участка бухта Ежовая – мыс Хитрово, где при низких темпах роста размер окончательной половозрелости ежей был сопоставим с таковым у животных из районов с высокими темпами роста. Однако при этом возраст половозрелости у них был выше.
Таким образом, размеры половозрелости S. intermedius тесно связаны с интенсивностью их роста: в поселениях с более высоким темпом роста значения этого показателя значительно выше, чем с низким. Та же закономерность отмечена для морских двустворчатых моллюсков [31] и некоторых видов рыб [15]. Вероятнее всего, эта взаимосвязь объясняется различиями условий обитания, выходящими за рамки толерантных для S. intermedius в скоплениях с низким темпом роста. На зависимость размеров половозрелости морских ежей от условий их обитания указывают и другие авторы. Так, в кутовой части бухты Троицы (южное Приморье) S. intermedius становятся половозрелыми в возрасте 2+ при достижении размеров 25–30 мм [28], в то время как на более глубоких и мористых участках этой же бухты размер половозрелости у них составляет 32.3 ± 5.4 мм [6]. По данным Гнездиловой [14], в заливе Петра Великого размер половозрелости этого вида составляет 40–45 мм. На зависимость размеров и возраста половозрелости серых морских ежей от широтной зональности и глубины обитания указывают и японские авторы. У южного побережья о-ва Хоккайдо S. intermedius становятся половозрелыми в возрасте 2-х лет при достижении средних размеров 28 мм [38], а у юго-западного побережья – 30–35 мм [40]. У северо-западного и северного побережья о-ва Хоккайдо на мелководье (<1.5 м) 50%-ной половозрелости ежи достигают в возрасте 2-х лет и размере 15–20 мм, а в более глубоководных биотопах в возрасте 3-х лет и 30 мм [44].
Размерно-половая структура. В исследуемый период (3-я декада августа–1-я декада сентября) гонады морских ежей были хорошо развиты и у большей части взрослых особей находились в преднерестовом и нерестовом состоянии: у самок в просветах половых трубочек присутствовали зрелые яйцеклетки, готовые к вымету или ооциты на последних стадиях роста и созревания, у самцов они были заполнены спермиями и сперматоцитами. У некоторой части особей половые железы были частично или полностью опустошенными, то есть ежи находились в состоянии нереста.
Индивидуальные значения гонадного индекса у половозрелых особей в разных районах варьировали от 1.4 до 25%, а средние по разным размерным классам – от 6.5 до 15.4%. У неполовозрелых особей значения этих показателей были достоверно ниже и варьировали от 0.1 до 14.3% и от 4.0 до 8.2% соответственно. Среди особей, достигших размеров окончательной половозрелости (>40 мм для районов южной и >30 мм средней частей побережья), достоверно большие средние значения ГИ отмечались в бухте Соколовская (14.9%), а наименьшие на участке бухта Ежовая – мыс Хитрово (8.2%). Средние значения этого показателя в других районах варьировали от 12 до 10.2% и достоверно не различались.
Степень наполнения гонад у морских ежей зависит от многих факторов, из которых одним из основных является обилие доступной пищи в период их активного роста [33, 44]. В свою очередь, интенсивность питания в большой степени зависит от температуры и физиологического состояния ежей [34, 19 ], а на доступность пищи существенное влияние оказывают гидродинамика и мезорельеф дна [47, 48]. В наших предыдущих работах было показано, что наилучшее наполнение гонад у S. intermedius отмечалось в биотопах с хорошо развитой разновидовой растительностью, сложным мезорельефом дна и активной гидродинамикой [17, 18]. При этом величина ГИ была максимальной как на участках с доминированием ламинарии японской и филлоспадикса, так и в биотопах со смешанными зарослями при доминировании красных и бурых водорослей. В настоящей работе сравнительно более высокие значения ГИ у ежей в преднерестовом состоянии были отмечены в бухте Соколовская с наивысшей плотностью зарослей макрофитов, умеренно защищенным берегом и дном, покрытым крупнообломочными грунтами, создающими укрытия и благоприятные условия для питания ежей.
Соотношение полов в разных размерных классах S. intermedius рассчитывалось отдельно для районов, относящихся к южной и северной частям побережья, поскольку размеры окончательной половозрелости там существенно отличались (41–45 и 31–35 мм соответственно). Отмечается, что в обоих случаях среди особей, не достигших размеров половозрелости (<41 и <31 мм соответственно), преобладали самцы, доля которых в размерных классах уменьшалась по мере увеличения размеров ежей и в целом составила соответственно 1.2 : 1 и 1.4 : 1 (табл. 3). В районах южной части побережья соотношение полов среди половозрелых особей, представленных только одним размерным классом 41–45 мм, характеризовалось небольшим преобладанием самок, а в районах средней части для размерной группы 31–45 мм в целом было равным.
Таблица 3.
Соотношение полов у разноразмерных S. intermedius
| Размерные классы, мм | Соотношение полов (самцы : самки) | |
|---|---|---|
| Южная часть побережья | Средняя часть побережья | |
| 11–20 | Нет данных | 1.6 : 1 |
| 21–30 | 1.6 : 1 | 1.3 : 1 |
| 31–35 | 1.3 : 1 | 1.1 : 1 |
| 36–40 | 1 : 1 | 1 : 1.2 |
| 41–45 | 1 : 1.2 | 1 : 1.2 |
Преобладание самцов среди мелкоразмерных S. intermedius отмечают и другие авторы [28, 38, 40]. Это характерно для большинства морских двустворчатых моллюсков и иглокожих в период ювенильной сексуальности и зависит от генетических механизмов формирования пола [19]. Среди взрослых особей, относящихся к основной репродуктивной группе, соотношение полов обычно равное. Сдвиг соотношения полов может происходить под воздействием различных факторов: условий внешней среды, выходящих за границы физиологического оптимума, размерного и возрастного составов, плотности поселения, неблагоприятной экологической обстановки, стресса и др. [8, 46].
Биотопическая характеристика районов обитания ежей. Известно, что на темпы роста морских ежей влияют локальные особенности температурного режима, которые непосредственно воздействуют на интенсивность метаболизма животных и косвенно, через обеспеченность их пищей, на трофность водоемов и уровень первичной продукции [21, 26]. Акватория вдоль северо-западного побережья Приморья от мыса Поворотный до мыса Надежды относится к центральной части ареала S. intermedius, где он обитает преимущественно в верхнесублиторальной зоне, до 25 м, совершая незначительные вертикальные миграции [3]. Оптимальный температурный диапазон для него варьирует от 10–12 до 20–23°С, температура выше 24–27°С и ниже 5°С приводит к замедлению скорости роста даже при благоприятных условиях питания [3, 39].
По данным Викторовской и Матвеева [9], южная и средняя части побережья северного Приморья различаются по количеству дней с отрицательными температурами (соответственно 75 и 90 сут), максимальным температурам прогрева воды (соответственно 19–20 и 16–18°С) и сумме тепла, необходимой для развития гамет S. intermedius (соответственно 1400–1500 и 1200–1300 градусо-дней (ГД)). По нашим данным, различия по температурному режиму исследованных районов обитания ежей, относящихся к южной и средней частям побережья, не столь существенны, что, вероятнее всего, можно объяснить локальными особенностями их местообитаний и сравнительно небольшой протяженностью исследованной акватории. Так, самая высокая среднемесячная температура была отмечена у о-ва Скала Крейсер (19.9°С), а наименьшая у мыса Южный (15.3°С), при этом значение этого показателя у мыса Надежды (18.8°С) – самого северного района, было выше, чем в районах, относящихся к южной части побережья – бухте Соколовской (18.4°С) и у мыса Подчасок (18.2°С). Сумма эффективных для роста S. intermedius температур (>5°С) в местах их обитания была наибольшей в районе о-ва Скала Крейсер (2309.1 ГД) и у мыса Подчасок (2308.1 ГД), а наименьшей у мыса Южный (2090.5 ГД) и в районе бухта Ежовая – мыс Хитрово (2090.7 ГД), относящемуся к южной части побережья (рис. 5). В то же время, сумма эффективных температур у мыса Надежды (2214.6 ГД) была сравнима с таковой для бухты Соколовская (2252.6 ГД).
Акватории у о-ва Скала Крейсер и в бухте Соколовская приурочены к наиболее южной части северного Приморья – району от мыса Поворотный до мыса Овсянкина, характеризующемуся, в отличие от более северных выровненных побережий, значительной изрезанностью береговой линии крупными и мелкими бухтами и присутствием многочисленных ручьев и рек. Оба участка сбора проб – кутовая часть глубоко вдающейся в берег бухты Соколовская, а также участок в районе о-ва Скала Крейсер, прикрытый от прямого действия волн надводными камнями, относятся к умеренно защищенному типу побережий со сравнительно высокой степенью ветрового воздействия – 101–105 (табл. 1). Однако с учетом топографических особенностей, степень гидродинамической активности здесь ниже, чем на участках открытого побережья. Акватория у мыса Подчасок имеет наиболее приглубый подводный береговой склон, не защищенный от прямого действия волн, при этом степень ветрового воздействия здесь в сравнении с остальными районами исследований самая низкая и примерно в два раза ниже, чем в двух предыдущих районах – 41, что, несмотря на открытость побережья, в совокупности может свидетельствовать о сравнительно умеренном влиянии гидродинамики на морских ежей. На этих трех акваториях дно образовано в основном крупнообломочными грунтами (скальными плитами, глыбами и валунами), предоставляющими животным укрытия от воздействия морского прибоя и способствующими задержке и оседанию объектов дрифтовой и седиментационной природы [37]. В районах со сниженными темпами роста ежей (бухта Ежовая – мыс Хитрово, у мысов Южный и Надежды) они обитают на слабозащищенных открытых морских побережьях, где подводный береговой склон представлен плоской скалистой платформой, лишь местами покрытой валунами и глыбами, что увеличивает стрессовое воздействие прибоя на ежей и способствует снижению темпов роста. Следует отметить, что во всех районах, кроме акватории у мыса Южный, граница залегания твердых грунтов, предпочитаемых серыми ежами, была менее 10 м. Таким образом, область обитания ежей в этих районах ограничена участками дна в наибольшей степени подверженных воздействию гидродинамики и с более выраженными сезонными изменениями температурного режима воды.
Серые морские ежи – всеядные животные с преобладанием фитофагии, спектр питания которых в первую очередь определяется составом кормовых объектов в месте обитания [18, 43]. Считается, что ламинария японская (Saccharina japonica) является предпочитаемой ежами пищей, наиболее способствующей их соматическому и гонадному росту. При отсутствии пластинчатых водорослей ежи начинают употреблять в пищу детрит, красные корковые, известковые и сине-зеленые водоросли, листовой опад и остатки морских животных [32, 33, 44]. При этом интенсивность питания в большей степени зависит от скорости водообмена и физиологического состояния ежей, чем от вида поедаемой пищи.
Районы с высокими темами роста ежей (у о-ва Скала Крейсер, мыса Подчасок и бухты Соколовская) характеризуются хорошо развитой растительностью (общее проективное покрытие (ОПП) от 34.4 до 72%) с доминированием в фитоценозах бурых пластинчатых водорослей и морских трав (табл. 4) и умеренной плотностью ежей (до 10 экз/м2).
Таблица 4.
Среднее проективное покрытие массовыми видами макрофитов в исследованных районах
| Район | ОПП | Проективное покрытие, % | |||||
|---|---|---|---|---|---|---|---|
| Saccharina japonica | Costaria costata | Desmarestia viridis | Phyllospadix iwatensis | Rhodophyta* | Chlorophyta | ||
| О-в Скала Крейсер | 34.4 | 18 | 6 | 7 | 1 | 0.2 | 1 |
| Бухта Соколовская | 71.9 | 21.6 | 17.9 | 30.4 | 1 | 0.3 | 0.3 |
| Бухта Ежовая – мыс Хитрово | 35.3 | 6.4 | 19.7 | 3.4 | 2.4 | 0.9 | 1.6 |
| Мыс Подчасок | 35 | 3.4 | 8.7 | 8.9 | 14.5 | 0.4 | 0 |
| Мыс Южный | 1.6 | 0 | 0 | 1.2 | 0.6 | 0 | 0 |
| Мыс Надежда | 16.3 | 2.6 | 8 | 0.8 | 0.7 | 0.25 | 0.21 |
В районах с низкими темпами роста ежей растительность развита гораздо слабее: у мыса Надежды (ОПП 16.3%) она была представлена в основном костарией и ламинарией, у мыса Южный (ОПП 1.6%) преобладали красные корковые и известковые водоросли, а макрофиты практически отсутствовали и были представлены десмарестией и филлоспадиксом (табл. 4). При этом, плотность ежей здесь довольно высокая – до 34 экз/м2 у мыса Надежды и до 25 экз/м2 у мыса Южный [37]. Участок бухта Ежовая – мыс Хитрово, где темпы роста ежей имели средние значения, характеризуется хорошо развитой разновидовой растительностью (ОПП 35.3%), с преобладанием костарии. Сравнительно более низкие темпы роста ежей на этом участке могут быть обусловлены стрессовым воздействием на них прибоя, а также пищевой конкуренцией, вызванной повышенной плотностью ежей, достигающей в этом районе 55 экз/м2 [37].
Отмечается, что хорошо развитая водная растительность наблюдалась в районах, вблизи которых в море впадали реки и ручьи (у о-ва Скала Крейсер, в бухте Соколовская, участок бухта Ежовая – мыс Хитрово, у мыса Подчасок). Воздействие речного стока, несущего богатые биогенами воды, и наличие твердых грунтов создает благоприятные условия для роста и развития фитоценозов в этих районах. На участке побережья, к которому относятся район у о-ва Скала Крейсер и бухта Соколовская, задержке и накоплению на дне взвешенных в воде веществ способствует еще и значительная изрезанность береговой линии и сложный мезорельеф дна. Здесь произрастают промысловые поселения S. japonica [22]. Акватории у мыса Подчасок и от бухты Ежовая до мыса Хитрово имеют довольно ровную береговую линию, однако развитию фитомассы в этих районах, вероятно, способствуют стоки рек Черная, Маргаритовка и Петропавловка, впадающих в море вблизи этих районов.
Таким образом, различия в темпах роста и размерах полового созревания серых ежей в нашем случае обусловлены не столько широтной изменчивостью температурного режима, сколько локальными условиями обитания, в которых наиболее результативными факторами являются условия питания и обилие доступной пищи. Данное предположение подтверждается результатами ранее проведенных исследований, показавших, что при благоприятных условиях питания высокие темпы роста ежей могут наблюдаться как в южной, так и в северной частях Приморья [7, 37].
Согласно Бажину и Лоуренс [2], ежи семейства Strongylocentrotidae в условиях наиболее типичных местообитаний, близких к оптимальным, реализуют “конкурентный” тип стратегий, при котором энергетические ресурсы равномерно расходуются на три базовые функции: поддержание жизнедеятельности, рост и воспроизводство. Однако при обитании в субоптимальных условиях, например, в “ежиных пустошах”, при недостатке пищи или жизненного пространства, ежи могут проявлять черты “стресс-толерантного” вида, направляя основные энергетические траты на поддержание жизнедеятельности, в ущерб расходам на репродуктивную и соматическую продукцию, что проявляется в снижении темпов роста животных, увеличении времени до наступления половозрелости и снижении величины “гонадной продукции”.
В нашем случае снижение темпов роста и размеров половозрелости, а также увеличение времени до ее наступления наблюдалось в трех районах, характеризующихся неблагоприятными трофическими условиями и ограниченным жизненным пространством. При этом у мыса Южный, где условия питания были наихудшими, увеличения возраста наступления половозрелости и снижения гонадной продукции у тугорослых S. intermedius не наблюдалось, однако было отмечено значительное снижение размеров половозрелых особей. Следовательно, можно предположить, что в данном случае перераспределение энергии произошло в пользу поддержания жизнедеятельности и воспроизводства, за счет снижения энергетических трат на соматический рост. У мыса Надежды и на участке бухта Ежовая – мыс Хитрово, где при дефиците доступного корма отмечалось ограничение жизненного пространства из-за повышенной плотности ежей, наблюдалось увеличение времени до наступления половозрелости в обоих районах и уменьшение размеров половозрелости у мыса Надежды. При этом существенного снижения гонадной продукции здесь отмечено не было. По-видимому, в этих районах переключение энергетических трат также в первую очередь было направлено на выживание и воспроизводство. На угнетающее влияние высоких плотностей и иерархической (размерной) структуры в скоплениях ежей на их рост и сроки полового созревания указывают и другие авторы [26, 27], данные которых согласуются с теорией Шварца с соавторами [35] о выделении более крупными особями метаболитов, ингибирующих рост более мелких животных при совместном обитании. Поэтому при ограничении жизненного пространства темпы роста и сроки полового созревания морских ежей даже в одном скоплении могут сильно различаться, что проявляется в неравномерной картине полового созревания и повышении возраста окончательной половозрелости, что мы и наблюдали на участках бухта Ежовая – мыс Хитрово и у мыса Надежды.
ЗАКЛЮЧЕНИЕ
В шести районах северо-западного побережья Приморья от мыса Поворотный до мыса Надежды, отличающихся топографией береговой линии, степенью гидродинамической активности, мезорельефом дна, гранулометрическим составом грунтов, качественным и количественным составом водной растительности и температурным режимом вод, размеры и возраст половой зрелости S. intermedius существенно различаются, что связано с разным темпом роста ежей в этих местообитаниях. В скоплениях с высоким темпом роста размер 50%-ной половозрелости равен 30–35 мм, а с низким – 20–22 мм. Размеры окончательной половозрелости ежей в поселениях южной части северного Приморья (о-в Скала Крейсер, бухта Соколовская, мыс Подчасок, бухта Ежовая – мыс Хитрово) составляют 41–45 мм, в более северных районах – 26–30 мм (мыс Южный) и 31–35 мм (мыс Надежды). Установлено, что на участках бухта Ежовая – мыс Хитрово и у мыса Надежды окончательно половозрелыми ежи становятся в возрасте от 4+ до 5+, на остальных участках – 3+.
Отмечается, что низкие темпы роста, снижение размеров половозрелости и увеличение времени до ее наступления у серых морских ежей наблюдается в районах, характеризующихся неблагоприятными условиями питания, недостатком водной растительности и ограничением жизненного пространства. При этом в пределах исследованной акватории размеры и сроки наступления половозрелости в разных поселениях S. intermedius зависят не столько от широтной изменчивости температурного режима, сколько от локальных условий обитания, в первую очередь условий питания. Выявленные локальные различия в половом созревании серых ежей являются проявлением высокой лабильности и вариабельности адаптационных способностей S. intermedius, связанных с реализацией его жизненной стратегии в конкретных условиях обитания.
Список литературы
Арзамасцев И.С., Преображенский Б.В. Атлас подводных ландшафтов Японского моря. М.: Наука, 1990. 224 с.
Бажин А.Г., Лоуренс Д.М. Анализ типов жизненных стратегий морских ежей как метод оценки перспективности их использования в аквакультуре // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Сб. науч. тр. Камчат. НИИ рыб. хоз-ва и океанографии. 2010. Вып. 17. С. 73–86.
Бажин A.Г., Степанов В.Г. Морские ежи семейства Strongylocentrotidae морей России. Петропавловск-Камчатский.: КамчатНИРО, 2012. 196 с.
Блинова Е.И., Вилкова О.Ю., Милютин Д.М., Пронина О.А. Методические рекомендации по учету запасов промысловых гидробионтов в прибрежной зоне. М.: ВНИРО, 2003. 80 с.
Борисовец Е.Э., Брегман Ю.Э., Викторовская Г.И., Калинина М.В. Биология серого морского ежа Strongylocentrotus intermedius (A. Agassiz) северо-западного побережья Японского моря. I. Распределение и размерный состав // Изв. ТИНРО. 2000. Т. 127. С. 416–439.
Брегман Ю.Э. Взаимосвязь роста и энергетического обмена у некоторых промысловых донных беспозвоночных залива Посьета (Японское море): Автореф. дис. канд. биол. наук. Владивосток: ДВНЦ АН СССР, 1973. 24 с.
Брегман Ю.Э. К изучению популяционной структуры и роста серого морского ежа Strongylocentrotus intermedius (Agassiz) у северо-западного побережья Японского моря // Изв. ТИНРО. 2000. Т. 127. С. 397–415.
Ващенко М.А., Жадан П.М. Исследование влияния хронического загрязнения морской среды на состояние репродуктивной функции беспозвоночных животных // Тихоокеанский медицинский журн. 2012. № 2. С. 110–114.
Викторовская Г.И., Матвеев В.И. Связь сроков размножения морского ежа Strongylocentrotus intermedius с температурой воды у побережья Северного Приморья // Океанология. 2000. Т. 40. № 1. С. 79–84.
Викторовская Г.И., Седова Л.Г. Некоторые аспекты биологии серого морского ежа в центральном районе северного Приморья // Изв. ТИНРО. 2000. Т. 127. С. 382–396.
Викторовская Г.И., Седова Л.Г., Борисовец Е.Э., Матвеев В.И., Калинина М.В., Брегман Ю.Э. Биологическая характеристика скоплений серого морского ежа Strongylocentrotus intermedius (Agassis) в прибрежной зоне Приморья (Японское море) // Изв. ТИНРО. 2004. Т. 139. С. 225–259.
Воронов А.Г. Геоботаника. Учеб. пособие для ун-тов и пед. ин-тов. Изд. 2-е, испр. и доп. М.: Высшая школа, 1973. 384 с.
Гланц С. Медико-биологическая статистика. Пер. с англ. М.: Практика, 1998. 459 с.
Гнездилова С.М. Морфологическая и цитохимическая характеристика овогенеза и половых циклов у морских ежей Strongylocentrotus nudus и S. intermedius: Автореф. дис. канд. биол. наук: 03.099. Владивосток: ДВНЦ АН СССР, 1971. 24 с.
Дубинина А.Ю., Золотов А.О. Плодовитость и созревание северной двухлинейной камбалы Lepidopsetta polyxystra Orr et Matarese (2000) тихоокеанского шельфа Камчатки // Изв. ТИНРО. 2013. Т. 172. С. 119–132.
Калинина М.В., Викторовская Г.И., Борисовец Е.Э., Брегман Ю.Э., Кулепанов В.Н. Биология серого морского ежа Strongylocentrotus intermedius (Agassiz) северо-западного побережья Японского моря. II. Репродукционная характеристика // Изв. ТИНРО. 2002. Т. 131. С. 249–265.
Калинина М.В., Гусарова И.С., Гаврилова Г.С., Викторовская Г.И. Влияние экологических факторов на размножение морских ежей в различных биотопах залива Петра Великого // Изв. ТИНРО. 2000. Т. 127. С. 490–511.
Калинина М.В., Сухин И.Ю., Викторовская Г.И. Влияние биотопических условий на состояние гонад серого морского ежа Strongylocentrotus intermedius (залив Петра Великого, Японское море) // Вопросы рыболовства. 2004. Т. 5. № 1 (17). С. 147–164.
Касьянов В.Л. Репродуктивная стратегия морских двустворчатых моллюсков и иглокожих. Л.: Наука, 1989. 183 с.
Кафанов А.И., Павлючков В.А. Экология промысловых морских ежей рода Strongylocentrotus материкового япономорского побережья России // Изв. ТИНРО. 2001. Т. 128. С. 349–373.
Константинов А.С. Общая гидробиология: Учеб. Для студентов биол. спец. вузов. 4-е издание, перераб. и доп. М.: Высшая школа, 1986. 472 с.
Кулепанов В.Н., Ерышев А.А. Состояние зарослей бурой водоросли Saccharina japonica в прибрежье Приморья // Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование: материалы VII Всероссийской научно-практической конференции с международным участием (22-24 марта 2016 г.): в 2 ч. Петропавловск-Камчатский: КамчатГТУ, 2016. Ч. 1. С. 89–91.
Лакин Г.Ф. Биометрия: учебное пособие для биол. спец. вузов. М.: Высшая школа, 1990. 352 с.
Лукин В.И. Биономические типы верхней сублиторали дальневосточных морей СССР // Биология шельфовых зон Мирового океана. Тез. докл. Второй всес. конф. по морской биологии. Владивосток: ДВНЦ АН СССР, 1982. Ч. 1. С. 44–45.
Максимович Н.В. Статистическое сравнение кривых роста // Вестн. Ленинградского ун-та. 1989. № 24. С. 18–25.
Мина М.В., Клевезаль Г.А. Рост животных. Анализ на уровне организма. М.: Наука, 1976. 291 с.
Найденко Т.Х. Особенности роста морского ежа Strongylocentrotus intermedius до половозрелости в лабораторной культуре // Исследование иглокожих дальневосточных морей. Владивосток: ДВО АН СССР, 1987. С. 83–97.
Найденко Т.Х., Дзюба С.М. Рост и созревание морского ежа Strongylocentrotus intermedius в лабораторных условиях // Биол. моря. 1982. № 4. С. 20–24.
Найденко В.П., Третьяков А.С., Школдин А.В. Зависимость сроков полового созревания морского ежа Strongylocentrotus intermedius в заливе Посьета от условий местообитания // Подводные гидробиологические исследования. Владивосток: ДВНЦ АН СССР, 1982. С. 142—146.
Преображенский Б.В., Жариков. В.В., Дубейковский Л.В. Основы подводного ландшафтоведения. Владивосток: Дальнаука, 2000. 360 с.
Селин Н.И. Ретроспективная оценка продукционного процесса у морских двустворчатых моллюсков на основе анализа локальных и широтных особенностей их роста // Х Съезд гидробиологичекого общества при РАН. Тезисы докл. (г. Владивосток, 28 сентября–2 октября 2009 г.). Владивосток: Дальнаука, 2009. С. 356–357.
Сухин И.Ю. Сравнительный анализ состава содержимого кишечников серого и черного морских ежей // Изв. ТИНРО. 2002. Т. 131. С. 306–314.
Холодов В.И. Трансформация органического вещества морскими ежами (Regularia). Киев: Наук. думка, 1981. 160 с.
Хотимченко Ю.С., Деридович И.И., Мотавкин П.А. Биология размножения и регуляция гаметогенеза и нереста у иглокожих. М.: Наука, 1993. 168 с.
Шварц С.С., Пястолова О.А., Добринская Л.А., Рункова Г.Г. Эффект группы в популяциях водных животных и химическая экология. М.: Наука, 1976. 152 с.
Чалиенко М.О. Особенности группового роста серого морского ежа (Strongylocentrotus intermedius) у северо-западного побережья Японского моря // Изв. ТИНРО. 2018. Т. 194. С. 3–17.
Чалиенко М.О., Кулепанов В.Н., Матвеев В.И. Влияние некоторых факторов среды на рост серого морского ежа (Strongylocentrotus intermedius) у северо-западного побережья Японского моря // Изв. ТИНРО. 2018. Т. 195. С. 111–127.
Agatsuma Y., Momma H. Release of cultured seeds of sea urchin, Strongylocentrotus intermedius (A. Agassiz), in the Pacific coastal waters of southern Hokkaido. I. Growth and reproductive cycle // Sci. Rep. Hokk. Fish. Exp. St. 1988. № 31. P. 15–25.
Agatsuma Y. Ecology of Strongylocentrotus intermedius // Edible sea urchins: Biology and Ecology. Amsterdam: E-lsevier, 2001. V. 32. P. 333–346.
Fuji A. Studies on the biology of the sea urchin. II. Size at first maturity and sexuality of two sea urchins, Strongylocentrotus nudus and S. intermedius // Bull. Fac. Fish. Hokkaido Univ. 1960. № 11. P. 43–48.
Jensen M. Age determination of echinoids // Sarsia. 1969. № 37. P. 41–44.
Johnson D.R., Boyer T.P., Garcia H.E. et al. World Ocean Database 2013 User’s Manual. NODC Internal Report 22, NOAA Printing Office. Maryland: Silver Spring, 2013. 172 p.
Kawamura K. Ecological studies on the sea urchin Strongylocentrotus intermedius on the coast of Funadomari in the north region of Rebun Island (II) // Sci. Rep. Hokkaido Fish. Exp. St. 1965. № 3. P. 19–38.
Kawamura K. Fishery biological studies on a sea urchin, Strongylocentrotus intermedius // Sci. Rep. Hokkaido Fish. Exp. St. 1973. № 16. P. 1–54.
Kenner M.C., Lares M.T. Size at first reproduction of the sea urchin Strongylocentrotus purpuratus in a central California kelp forest // Mar. Ecol. Prog. Ser. 1991. V. 76. P. 303–306.
Lawrence J.M. A functional biology of echinoderms. London and Sidney: Croom Helm Ltd. Publishers, 1987. 340 p.
Sellem, F., Guillou M., Reproductive biology of Paracentrotus lividus (Echinodermata: Echinoidea) in two contrasting habitats of Northern Tunisia (South-East Mediterranean) // J. Mar. Biol. Assoc. U. K. 2007. № 87. P. 763–767.
Tertschnig W.P. Daily activity pattern and foraging dynamics of the sea urchin Tripneustes ventricosus in a tropical seagrass community and environment (Virgin Islands) // Mar. Ecol. 1989. V. 10. № 1. P. 3–21.
Thompson R.J. Fecundity and reproduction effort in the blue mussel (Mytilus edulis), the sea urchin (Strongylocentrotus droebachiensis) and the snow crab (Chionoecetes opilio) from populations in Nova Scotia and Newfoundland // J. Fish. Res. Board Canada. 1979. V. 36. P. 955–964.
Walker C.W., Unuma T., McGinn N.A., Harrington L.M., Lesser M.P. Reproduction in sea urchins // Edible sea urchins: biology and ecology. Amsterdam: Elsevier, 2001. V. 32. P. 5–26.
Дополнительные материалы отсутствуют.