Океанология, 2021, T. 61, № 1, стр. 91-105
Хлорорганические пестициды и полихлорированные бифенилы в подкожной жировой ткани белух (Delphinapterus leucas) Белого, Карского и Берингова морей
В. В. Краснова 1, *, А. Д. Чернецкий 1, Е. М. Панова 1, А. Н. Болтунов 2, Д. И. Литовка 3, В. Н. Светочев 4, Д. П. Самсонов 5, Р. А. Беликов 1, В. В. Андрианов 6
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Научно-экспедиционный центр “Морские млекопитающие”
Москва, Россия
3 Аппарат Губернатора и Правительства Чукотского автономного округа
Анадырь, Россия
4 Мурманский морской биологический институт РАН
Мурманск, Россия
5 Научно-производственное объединение “Тайфун” Федеральной службы
по гидрометеорологии и мониторингу окружающей среды
Обнинск, Россия
6 Федеральный исследовательский центр комплексного изучения Арктики
им. академика Н.П. Лаверова РАН
Архангельск, Россия
* E-mail: vera.krasnova@mail.ru
Поступила в редакцию 14.01.2020
После доработки 24.04.2020
Принята к публикации 15.08.2020
Аннотация
Впервые получены сведения о содержании ХОП и ПХБ в тканях белух (Delphinapterus leucas) из российской Арктики. Проанализированы образцы кожи и подкожного жира белух разного возраста и пола (n = 22), собранные в Белом, Карском и Беринговом морях в 2012–2017 гг. Среди анализируемых ХОП доминировало соединение 4,4'-ДДЕ; основными конгенерами ПХБ были пары ПХБ-138 + + ПХБ-158 и ПХБ-153 + ПХБ-168, что характерно и для других арктических морских млекопитающих. Самые высокие концентрации и широкий диапазон этих соединений были обнаружены у белух из Белого моря (4,4'-ДДЕ: 3778.3 ± 4856.3 нг/г липидов, диапазон от 33.2 до 16 007.8 нг/г липидов; ПХБ-138 + ПХБ-158: 1270.1 ± 1528.8 нг/г липидов, диапазон от 127.6 до 4957.4 нг/г липидов; ПХБ-153 + ПХБ-168: 1144.1 ± 1230.2 нг/г липидов, диапазон от 113 до 4515.2 нг/г липидов). Самые низкие уровни найдены у белух из Анадырского лимана Берингова моря (4,4'-ДДЕ: 1003.3 ± 1422.1 нг/г липидов, диапазон от 186 до 3125 нг/г липидов; ПХБ-138 + ПХБ-158: 95 ± 99.2 нг/г липидов, диапазон от 29.9 до 242.1 нг/г липидов; ПХБ-153 + ПХБ-168: 114.8 ± 118.8 нг/г липидов, диапазон от 35.4 до 290.9 нг/г липидов). Среди причин такого географического ранжирования загрязнителей у белух рассматриваются биологические параметры анализируемых животных, особенности транспортных путей ПХБ и ХОП, а также региональное загрязнение окружающей среды.
ВВЕДЕНИЕ
Несмотря на запрет производства и использования хлорорганических соединений, являющихся стойкими органическими загрязнителями (СОЗ), в большинстве стран мира, их угроза для окружающей среды сохраняется и в настоящее время [52]. Долгое время не разлагаясь, СОЗ накапливаются в экосистеме и начинают оказывать на нее негативное воздействие. Обладая высокой липофильностью, хлорорганические соединения аккумулируются в тканях организма, богатых липидами [58]. Плохое выведение хлорорганических соединений из организма способствует их биологическому концентрированию в трофических цепях, поэтому чем выше положение вида в пищевой цепи, тем большему риску он подвергается [35, 38, 52, 58]. Показано, что хлорорганические соединения способствуют развитию онкологических заболеваний у животных и людей, вызывают иммунодепрессию, повышая их восприимчивость к болезням, и приводят к репродуктивной патологии [31, 49].
Белухи (Delphinapterus leucas) распространены в Северном полушарии циркумполярно, населяя все арктические и субарктические моря [54]. Занимая вершину трофической цепи в морских арктических экосистемах, они подвержены негативному воздействию загрязняющих веществ, которые попадают в эти районы посредством глобального атмосферного переноса, через океанские течения, со стоком континентальных рек, а также с ледовым дрейфом [46, 48].
В настоящее время проведены сравнительные работы по содержанию хлорорганических соединений в тканях белух Канадской Арктики, эстуария р. Святого Лаврентия, Аляски, Шпицбергена, Западной Гренландии, оценено их разнообразие и уровни в зависимости от места обитания животных [19, 32, 36, 39, 40, 53]. Наибольшие концентрации хлорорганических соединений были обнаружены в тканях белух из эстуария р. Святого Лаврентия, что, возможно, послужило причиной сокращения численности этой популяции в результате репродуктивной дисфункции, случаев гермафродитизма, а также развития онкологических заболеваний у животных [21, 27, 36, 37]. Напротив, у белух, обитающих вблизи Шпицбергена, концентрации ПХБ и ДДТ оказались ниже уровней, которые, как считается, оказывают отрицательное воздействие на репродуктивную или иммунную системы [19]. Сведения о содержании хлорорганических соединений в тканях белух российской Арктики на сегодняшний день отсутствуют.
В российских водах выделяют несколько популяций белух. Среди них наиболее изучена беломорская, которая, по-видимому, не является однородной. По данным последних исследований, она подразделяется на несколько субпопуляций, вероятно, пространственно связанных с основными заливами Белого моря [12, 15, 50]. Каждая из них формирует отдельные летние скопления, которые в безледовый период занимают на акватории заливов постоянные места обитания [1–3, 15].
Популяционная структура карских белух недостаточно изучена и до сих пор вызывает разногласия. Согласно традиционным представлениям [7, 11, 14], карская популяция объединяет белух Баренцева, Карского и Белого морей и западных районов моря Лаптевых. По мнению авторов упомянутых работ, Карское море, наряду с Белым, является основным летним местом обитания белух. Из-за суровой ледовой обстановки и ограниченности объектов питания на зиму большинство животных перемещается в Баренцево море. По предположениям других авторов, значительная часть белух остается регулярно на зимовку в Карском море [4–6, 23]. Международная китобойная комиссия [30] на акватории этого моря выделяет две обособленные популяции белух, приуроченные к их основным летним местам нагула: в Обской губе и в Енисейском заливе.
По результатам последних исследований, Берингово море населяют как минимум пять популяций белух [18, 44, 45]. Предположительно, одни из них резиденты, такие как белухи восточно-беринговоморской популяции и животные Анадырского лимана и Бристольского залива. Другие, такие как белухи восточно-чукотской и восточно-бофортской популяций, совершают сезонные длительные миграции [26].
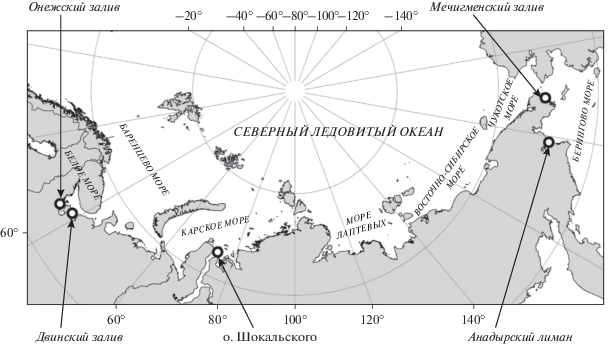
Данная работа приводит первые сведения о концентрациях ПХБ и ХОП в образцах тканей белух из Белого (Онежский и Двинской заливы), Карского (Обская губа) и Берингова (Анадырский лиман и Мечигменский залив) морей и представляет результаты их сравнительного анализа.
МАТЕРИАЛ И МЕТОДЫ
Сбор, хранение и обработка образцов
В Белом море образцы кожи и подкожных тканей белух собирались в Двинском и Онежском заливах от выброшенных на берег погибших белух (n = 6) или дистанционно при помощи арбалета от свободно плавающих животных (n = 6). В Карском море образцы (n = 2) были отобраны в районе Обской губы во время отлова белух для установки на них спутникового передатчика. Образцы беринговоморских белух были получены в Анадырском лимане (n = 4) от выброшенных на берег погибших животных и в с. Лорино (Мечигменский залив) от животных, добытых охотниками в рамках аборигенного промысла (n = 4) (табл. 1, рис. 1).
Таблица 1.
Сведения о месте и времени отбора проб тканей белух
| Регион отбора | Место и метод отбора | Год отбора | № образца | Возраст белухи | Пол белухи | Кол-во липидов, % | |
|---|---|---|---|---|---|---|---|
| Белое море | Онежский залив, жижгинское скопление белух | о-в Жижгин, отобрано от погибшего животного | 2012 | 13 | Половозрелая | Самка | 84.73 |
| д. Летняя Золотица, отобрано от погибшего животного | 2017 | 24 | Половозрелая | Самка | 87.38 | ||
| Онежский залив, южное скопление белух | м. Глубокий, отобрано с помощью арбалета | 2012 | 5 | Половозрелая | Самка | 1.4 | |
| о-в Осинки, отобрано от погибшего животного | 2012 | 7 | Детеныш- сеголеток | Самец | 97.8 | ||
| м. Глубокий, отобрано от погибшего животного | 2017 | 20 | Детеныш- сеголеток | Самка | 86.5 | ||
| Онежский залив, соловецкое скопление белух | о-в Соловецкий, м. Белужий, отобрано с помощью арбалета | 2014 | 14 | Половозрелая | Самка | 2.25 | |
| 2014 | 16* | Половозрелые | Самки | 2.26 | |||
| 2014 | 15 | Неполовозрелый | Самец | 1.71 | |||
| 2017 | 25 | Половозрелая | Самка | 1.76 | |||
| о-в Парусный, отобрано от погибшего животного | 2016 | 21 | Неполовозрелый | Самец | 83.95 | ||
| Двинской залив, Мудьюгское скопление белух | о-в Голая Кошка, отобрано с помощью арбалета | 2015 | 18 | Половозрелая | Самка | 2.52 | |
| о-в Муравой, отобрано от погибшего животного | 2015 | 17 | Половозрелый | Самец | 68.1 | ||
| Карское море | У входа в Обскую губу | о-в Шокальского, отобрано от живых животных во время установки спутникового передатчика | 2016 | 1, 2 | Половозрелые | Самки | mean 9.04 диапазон: 5.12–12.96 |
| Берингово море |
Мечигменс-кий залив | с. Лорино, отобрано от погибших животных | 2013 | 8, 9, 10, 11 | Половозрелые | Не известно | mean 84.0 диапазон: 78.95–88.81 |
| Анадырский лиман | г. Анадырь, отобрано от погибших животных | 2013 | 12 | Половозрелая | Самка | 92.4 | |
| 2016, 2017 | 23, 26 | Половозрелые | Самцы | mean 87.74 диапазон: 83.81–91.66 |
|||
| 2017 | 27 | Детеныш- сеголеток | Самец | 78.89 | |||
При дистанционном отборе образцы (n = 6), полученные с помощью полой трубки из нержавеющей стали длиной 35 мм и диаметром 5 мм, представляли собой срезы кожных покровов с невысоким содержанием липидов, массой от 60 до 100 мг, которые после отбора помещались в спирт. Остальные образцы (n = 16) после отбора были завернуты в алюминиевую фольгу и заморожены (–20°C). В большинстве случаев это были образцы с высоким содержанием жира (табл. 1).
В связи с невозможностью точного определения возраста анализируемых животных были выделены три возрастные группы по сочетанию окраски и размеру особей: половозрелые (от пяти лет и старше); неполовозрелые (от трех до пяти лет) и детеныши-сеголетки [9, 29]. У большинства белух при помощи молекулярно-генетического анализа был определен пол (табл. 1).
Химический анализ хлорорганических пестицидов и ПХБ
Образцы кожи и подкожных тканей белух были проанализированы в научно-производственном объединении “Тайфун” Федеральной службы по гидрометеорологии и экологическому мониторингу (г. Обнинск, Россия). Определялись концентрации следующих стойких органических загрязнителей (СОЗ): полихлорированные бифенилы (ПХБ), согласно IUPAC конгенеры и их комбинации под номерами: 28 + 31, 44, 49, 52, 70, 74, 87, 95, 99, 101, 110, 119, 128, 138 + 158, 149, 151, 153 + 168, 167, 171, 177, 178, 183, 187, 191, 194, 199, 201, 202, 206, 208, а также хлорорганические пестициды (ХОП): ГХБ, ɑ-ГХЦГ, β-ГХЦГ, γ-ГХЦГ, гептахлор эпоксид, оксихлордан, цис-хлордан, транс-хлордан, транс-нонахлор и цис-нонахлор, 4,4′- ДДТ, 4,4′-ДДЕ, 4,4′-ДДД, 2,4′-ДДЕ, 2,4′-ДДД и 2,4′-ДДТ, мирекс.
Идентификация и определение количественного содержания ПХБ и ХОП в пробах проводилась методом хромато-масс-спектрометрии высокого разрешения. Для контроля полноты извлечения аналитов и последующих количественных расчетов в анализируемый образец на стадии пробообработки вводилась смесь суррогатных стандартов – конгенеры ПХБ и ХОП, изотопно-меченые по углероду (13С). У образцов, законсервированных в спирту, для уменьшения потерь весь спирт, в котором хранился образец, добавляли к экстракту аналитов из образца. Таким образом, извлеченные спиртом аналиты попадали в анализ и приписывались этому образцу.
Для извлечения аналитов навеску гомогенизированного образца массой 1–3 г перетирали с безводным Na2SO4 в фарфоровой ступе. Половину полученной сухой смеси помещали в стеклянную колонку на слой кварцевой ваты и добавляли к ней смесь растворов изотопно-меченых суррогатных стандартов в н-нонане, затем добавляли остаток анализируемой пробы. Смесь суррогатных стандартов (surrogate standards) включала конгенеры ПХБ (13С12) 28, 52, 101, 138, 153, 180, 209, а также 13С12-4,4'-ДДЕ, 13С12-4,4'-ДДТ, 13С6‑β-ГХЦГ, 13С6-γ-ГХЦГ, 13С6-ГХБ, 13С10-Оксихлордан, 13С10-транс-нонахлор.
Экстрагировали аналиты, пропуская через колонку с пробой 300 см3 смеси гексан-дихлорметан 1 : 1 со скоростью 3–4 мл/мин. Экстракт концентрировали на роторном испарителе до объема около 1 см3, добавляли около 1 см3 дихлорметана и очищали методом колоночной хроматографии.
Очистка экстракта проводилась в два этапа, первый из которых включал удаление из пробы липидов и стероидов методом гель-фильтрации на колонке Bio-Beads S-X3. На втором этапе экстракт после гель-фильтрации очищали от примесей, мешающих анализу, методом колоночной хроматографии, последовательно, на мультислойной колонке, заполненной кислым и щелочным силикагелем, и колонке с активированной окисью алюминия. ПХБ, изомеры ДДЕ, мирекс, ГХБ элюировали из колонки с окисью алюминия раствором гексан-дихлорметан 97 : 3 об. (фракция I). Полярные пестициды элюировали смесью гексан-дихлорметан 40 : 60 об. (фракция II). Полученные элюаты концентрировали на роторном испарителе до объема 1 мл, вносили в элюат раствор внутреннего (recovery) стандарта (ПХБ 155) и доводили объем раствора до 100 мкл, отдувая избыток растворителя потоком азота.
Анализ каждой фракции выполнялся на хромато-масс-спектрометре Agilent 7200Q-TOF в режиме масс-спектрального разрешения R > 9000. Разделение компонентов анализируемой смеси проводилось на кварцевой капиллярной колонке типа DB-5MS 30 м × 0.25 мм × 0.25 мкм в режиме программирования температуры от 80 до 280°С. Идентификация аналитов проводилась на основании наличия в масс-спектре выделенного компонента характеристических ионов, масса которых определяется с точностью до 0.003 Da и хроматографическим временем удерживания, определяемым с точностью ±1 с.
Содержание липидов в каждом образце определялось весовым методом на основе анализа фракции экстракта, полученного после отделения липидов на колонке с Bio-Beads S-X3.
Для контроля качества измерений в каждой аналитической серии из 10 проб анализировалась бланковая проба (procedure blank) и нативная проба с добавками аналитов (spike matrix). Контроль правильности определений регулярно проверялся также путем анализа SRM1945 (Organic in Whole Blubber certified) Promochem. Лаборатория НПО “Тайфун” с 2005 г. регулярно участвует в международных интеркалибрационных испытаниях по программе AMAP ring tests, c 2013 года по программе NCP-AMAPIII-7, NCP-AMAPIII-10, NCP-AMAPIII-11, а также в рамках программы UNEP CIND/INCA (2013, 2016 гг.).
Методы статистического анализа полученных данных
Для статистического анализа значения конгенеров в образцах ниже предела обнаружения (LOD) были заменены на ноль. LOD = 0.2 нг/г липидов для мирекса; LOD = 0.15 нг/г липидов для конгенеров ПХБ 191, 194, 199, 201, 202, 206, 208; LOD = 0.1 нг/г липидов для гептахлор эпоксида, конгенеров ПХБ 28 + 31, 44, 49, 70, 74, 119, 128, 158, 149, 151, 167, 171, 177, 178, 183, 187; LOD = = 0.05 нг/г липидов для α-, β- и γ-ГХЦГ, оксихлордана, транс-хлордана; LOD = 0.03 нг/г липидов для гексахлорбензола, цис-хлордана, 2,4'-ДДЕ, 2,4'-ДДД, 2,4'-ДДТ, 4,4'-ДДД; LOD = 0.01 нг/г липидов для цис-нонахлора. Минимальные значения представляют минимальные обнаруженные концентрации аналитов.
Геометрические (GM) и арифметические (M) средние значения были рассчитаны для концентраций анализируемых загрязнителей и процентного содержания липидов в образцах. Средние арифметические представлены вместе со стандартным отклонением (SD). Для сравнения выборок образцов из различных районов по концентрациям в них конгенеров ПХБ и ХОП использовались непараметрические методы: критерий Краскела–Уоллиса (сравнение четырех районов: Белое море, Карское море, Мечигменский залив и Анадырский лиман) и U-критерий Манна–Уитни (сравнение двух районов в Беринговом море: Мечигменский залив и Анадырский лиман). Уровень статистической значимости р = 0.05. Статистический анализ проводили с использованием статистического пакета Statistica 12 StatSoft Inc. Частота обнаружения для каждого аналита была оценена как процент образцов, в которых был обнаружен аналит.
РЕЗУЛЬТАТЫ
Сводные данные по концентрации СОЗ в анализируемых образцах подкожного жира белух представлены в табл. 2.
Таблица 2.
Концентрации хлорорганических соединений в образцах подкожного жира белух из Белого и Карского морей, Анадырского лимана и Мечигменского залива Берингова моря (нг/г липидов). Приведены среднее геометрическое (GM), среднее арифметическое и стандартное отклонение (M ± SD), минимальное и максимальное (Min–Max) значения
| Хлорорганические соединения нг/г липидов | Белое море (n = 12) | Карское море (n = 2) | Анадырский лиман (n = 4) | Мечигменский залив (n = 4) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GM | M ± SD | min–max | GM | M ± SD | min–max | GM | M ± SD | min–max | GM | M ± SD | min–max | |
| Пестициды | ||||||||||||
| α-ГХЦГ | 6.5 | 10.3 ± 17 | <LOD–60.6 | – | 2 ± 2.8 | <LOD; 3.9 | 13 | 25.2 ± 35.8 | 5.3–78.8 | 51.1 | 52.7 ± 15.7 | 40.9–74.6 |
| β-ГХЦГ | 12.9 | 15 ± 23.3 | <LOD–76.9 | – | 2.3 ± 3.3 | <LOD; 4.6 | 66.5 | 69.6 ± 24.4 | 44.5–102 | 179.1 | 180.7 ± 26.8 | 143.2–205.8 |
| γ-ГХЦГ | 3.6 | 7.1 ± 18 | <LOD–63.8 | <LOD | <LOD | <LOD | 5.1 | 5.8 ± 3.6 | 3.6–11.2 | 9 | 9.2 ± 2 | 7–11.8 |
| ƩГХЦГ1 | 24.9 | 32.4 ± 41.5 | <LOD–146.2 | – | 4.3 ± 6 | <LOD; 8.5 | 97.3 | 100.6 ± 29.7 | 69.6–134.5 | 240.4 | 242.7 ± 37.8 | 195.9–287.4 |
| Гексахлорбензол (ГХБ) | 141.4 | 169.9 ± 161.1 | <LOD–585.7 | 547.4 | 565.2 ± 199.1 | 424.4; 706 | 82.3 | 97.3 ± 47.9 | 26–128 | 87.8 | 88 ± 7 | 78.8–94.3 |
| Гептахлор эпоксид | – | 5.4 ± 18.7 | <LOD–64.7 | <LOD | <LOD | <LOD | – | 1.5 ± 3 | <LOD–5.9 | 95.9 | 96.1 ± 6.7 | 86.5–102 |
| Оксихлордан | 94.8 | 162.6 ± 215.6 | <LOD–725.9 | 193.9 | 194 ± 7.1 | 189; 199 | 89.6 | 150.8 ± 172.8 | 29.7–401 | 361.4 | 361.7 ± 17.2 | 337.4–376.8 |
| транс-хлордан | 4.3 | 7 ± 11.1 | <LOD–31 | <LOD | <LOD | <LOD | 1.3 | 1.4 ± 0.6 | 0.8–2 | 17.9 | 18 ± 2.2 | 16.5–21.3 |
| цис-хлордан | 8.8 | 11 ± 9.8 | <LOD–35.7 | 18 | 18.1 ± 2.6 | 16.2; 19.9 | 5.1 | 5.1 ± 1 | 4.3–6.3 | 23.6 | 24.3 ± 6.4 | 14.9–29 |
| транс-нонахлор | 249.6 | 378.4 ± 327.8 | 47–1047 | 615 | 615 ± 0 | 615; 615 | 151.5 | 183.1 ± 137.4 | 76.6–382 | 685.8 | 686.2 ± 26.5 | 668.5–725.4 |
| цис-нонахлор | 60.6 | 78.5 ± 74.6 | <LOD–232 | 169 | 170.9 ± 35.7 | 145.6; 196.1 | 15.4 | 15.6 ± 3.1 | 13–20 | 103.5 | 103.9 ± 9.2 | 90.8–112.3 |
| ƩChl2 | 403.2 | 642.9 ± 575.5 | 64.2–1533.3 | 997.7 | 997.9 ± 31.3 | 975.8; 1020 | 276.9 | 357.4 ± 311.2 | 137.3–809.4 | 1290 | 1290.2 ± 25.4 | 1252.2–1305.2 |
| 2,4'-ДДE | 16.9 | 34.6 ± 41.3 | <LOD–124.3 | 27.2 | 27.4 ± 3.6 | 24.8; 29.9 | 6.5 | 8.8 ± 8 | 3.3–20.3 | 9.4 | 15.3 ± 19.2 | 4.4–44.1 |
| 4,4'-ДДE | 1437.3 | 3778.3 ± 4856.3 | 33.2–16 007.8 | 1856.9 | 1857 ± 29.7 | 1836; 1878 | 490.8 | 1003.3 ± 1422.1 | 186–3125 | 1234.9 | 1246.9 ± 198.7 | 1009.5–1493.9 |
| 2,4'-ДДД | 24.3 | 38.4 ± 44.7 | <LOD–153.7 | 59 | 60 ± 15.7 | 48.9; 71.1 | 7.2 | 15.5 ± 23.3 | 2.8–50.5 | 9.3 | 9.5 ± 2.2 | 7–12.2 |
| 4,4'-ДДД | 321.6 | 584.4 ± 737.7 | <LOD–2227.1 | 485.6 | 486.3 ± 34.2 | 462.1; 510.4 | 42.9 | 47.7 ± 23.7 | 22.8–68.9 | 71.6 | 71.8 ± 6.3 | 67.4–81.1 |
| 2,4'-ДДТ | 101.5 | 383.6 ± 748.1 | <LOD–2668.7 | 97.2 | 97.2 ± 3.4 | 94.8; 99.6 | 30.2 | 42.5 ± 43.5 | 12.4–107 | 122.3 | 122.7 ± 11.1 | 112.1–137.8 |
| 4,4'-ДДТ | 345.7 | 782.9 ± 1069.7 | 55–3704.9 | 120.9 | 121 ± 0.8 | 120.4; 121.5 | 47.3 | 58.3 ± 43 | 18.9–119 | 192.5 | 200.6 ± 69.8 | 146.9–298.7 |
| ƩДДТ3 | 2358.8 | 5602.2 ± 7349.9 | 218.4–24 886.5 | 2648.8 | 2648.8 ± 21.1 | 2633.8; 2663.7 | 646.1 | 1176.1 ± 1553.1 | 268.7–3488.9 | 1654.9 | 1666.8 ± 227.2 | 1378.3–1928.5 |
| Мирекс | 15.5 | 18.6 ± 26.4 | <LOD–80.7 | 8.6 | 8.9 ± 2.9 | 6.8; 10.9 | 5.2 | 7 ± 5 | 1.3–12.5 | 81.2 | 83.8 ± 23.8 | 58.1–105.5 |
| Ʃ Пестицидов4 | 3064.4 | 6204.4 ± 7617.8 | 415.8–26 630.6 | 4221.3 | 4225 ± 248.4 | 4049.3; 4400.6 | 1186.6 | 1628 ± 1660.2 | 589.9–4551.2 | 3366.6 | 3370.4 ± 177.8 | 3084.9–3568.3 |
| Полихлорбифенилы (ПХБ) | ||||||||||||
| #28/#31 [CL3] | 16.7 | 25.1 ± 26.1 | <LOD–84.5 | 3 | 4.2 ± 4.1 | 1.3; 7.1 | 5.1 | 6.5 ± 3.8 | 1.3–9.8 | 1.3 | 1.7 ± 1.2 | 0.5–3.4 |
| #44 [CL4] | 8.3 | 15.3 ± 21.6 | <LOD–70.1 | 16.2 | 16.9 ± 6.6 | 12.2; 21.6 | 0.8 | 1 ± 0.6 | 0.3–1.8 | 15.2 | 15.5 ± 3.1 | 12.1–19.3 |
| #49 [CL4] | 31.7 | 34.8 ± 25.6 | <LOD–91.9 | 46.7 | 46.8 ± 3.5 | 44.3; 49.2 | 13.7 | 19.1 ± 18.9 | 6–46.8 | 57.6 | 59.1 ± 15 | 44.2–75.3 |
| #52 [CL4] | 139.7 | 267.7 ± 268.5 | 13.2–792.8 | 156.4 | 156.5 ± 8.8 | 150.3; 162.7 | 33.1 | 46.3 ± 46.4 | 14.5–114.5 | 189.6 | 190.2 ± 16.6 | 172.5–211.9 |
| #70 [CL4] | 16.2 | 35.8 ± 39.7 | <LOD–113.4 | 6.3 | 9.3 ± 9.6 | 2.5; 16.1 | 3.5 | 3.8 ± 1.9 | 2.7–6.7 | 4.8 | 5.4 ± 3.2 | 2.6–10 |
| #74 [CL4] | 49.3 | 59.1 ± 58.4 | <LOD–214.3 | 63.4 | 63.5 ± 1.6 | 62.3; 64.6 | 9.5 | 11.9 ± 9.2 | 4.1–24.8 | 31.7 | 32.2 ± 6.4 | 23.1–37.8 |
| #87 [CL5] | 64.5 | 120.1 ± 138.3 | 9.2–415.1 | 76.1 | 76.1 ± 0.4 | 75.8; 76.4 | 11.7 | 16 ± 15.7 | 5.3–39.2 | 62.9 | 64.3 ± 14.5 | 43.8–74.7 |
| #95 [CL5] | 136.6 | 218.3 ± 198.9 | 19.8–487.4 | 113.1 | 113.3 ± 7.6 | 107.9; 118.6 | 21.1 | 27.9 ± 26 | 10.4–66.2 | 139.7 | 140 ± 11.1 | 128.8–154.3 |
| #99 [CL5] | 289.8 | 445.5 ± 337.8 | 38.7–1041.7 | 295.1 | 295.4 ± 17.7 | 282.9; 307.9 | 39.3 | 55.6 ± 57.7 | 18.8–141 | 179.6 | 181.8 ± 31.5 | 138.8–213.5 |
| #101 [CL5] | 239.1 | 339.9 ± 260 | 52.7–726.7 | 267.2 | 267.4 ± 11.1 | 259.5; 275.2 | 62.1 | 94.2 ± 106.1 | 27.5–251.6 | 276 | 277.6 ± 33.5 | 228.7–303.4 |
| #110 [CL5] | 85.3 | 167 ± 273.4 | 26.5–1002 | 76.9 | 77 ± 0.4 | 76.7; 77.2 | 16.6 | 23.2 ± 21.8 | 6.7–54.2 | 80.2 | 85 ± 34.4 | 56–131.5 |
| #119 [CL5] | 7.8 | 9.9 ± 13.3 | <LOD–33.2 | 10.1 | 10.2 ± 0.6 | 9.7; 10.6 | 1.6 | 1.4 ± 1.5 | <LOD–3.6 | 11.2 | 11.3 ± 1 | 9.8–12.1 |
| #128 [CL6] | 85 | 144.6 ± 154.9 | <LOD–495.3 | 21.4 | 21.5 ± 0.4 | 21.2; 21.7 | 4.4 | 5.6 ± 4.6 | 1.6–12.2 | 39.7 | 40.8 ± 11.3 | 31.8–56.8 |
| #138 [CL6] + #158 | 673 | 1270.1 ± 1528.8 | 127.6–4957.4 | 638 | 640.1 ± 73 | 588.4; 691.7 | 66.9 | 95 ± 99.2 | 29.9–242.1 | 264.2 | 266.7 ± 43.6 | 230–329.7 |
| #149 [CL6] | 212.9 | 392.6 ± 469.7 | <LOD–1523.9 | 189.2 | 189.4 ± 9.7 | 182.5; 196.2 | 28.8 | 39.6 ± 39.7 | 12.6–98.6 | 186.4 | 188.2 ± 30.6 | 161.3–231.9 |
| #151 [CL6] | 79.7 | 123.3 ± 165.8 | <LOD–512.4 | 58.9 | 58.9 ± 2.4 | 57.2; 60.6 | – | 2.7 ± 5.4 | <LOD–10.8 | 86.3 | 87 ± 12.6 | 72–102.7 |
| #153 [CL6] + #168 | 701.3 | 1144.1 ± 1230.2 | 113–4515.2 | 653.7 | 661.2 ± 139.7 | 562.4; 759.9 | 81.2 | 114.8 ± 118.8 | 35.4–290.9 | 341.8 | 347.2 ± 68.7 | 259.6–426 |
| #167 [CL6] | 24.2 | 57.5 ± 129.5 | <LOD–463.8 | <LOD | <LOD | <LOD | 1.3 | 2.1 ± 3.5 | <LOD–7.3 | 5.3 | 5.5 ± 1.9 | 3.7–7.9 |
| #171 [CL7] | 14.9 | 21.6 ± 24 | <LOD–66.2 | 5.8 | 6.1 ± 2.2 | 4.5; 7.6 | 1.2 | 1.7 ± 1.6 | 0.5–4 | 8.8 | 9.1 ± 2.8 | 7.1–13.2 |
| #177 [CL7] | 29.1 | 47.6 ± 50.1 | <LOD–139 | 11 | 11.1 ± 2.5 | 9.3; 12.9 | 3.7 | 5.7 ± 5.4 | 1–12.8 | 6 | 6.2 ± 2 | 5–9.1 |
| #178 [CL7] | 25.2 | 28.7 ± 35.4 | <LOD–104.2 | 8.9 | 9.4 ± 3.9 | 6.6; 12.1 | 2.4 | 3.5 ± 3.5 | 0.8–8.6 | 15.3 | 15.8 ± 5 | 13–23.2 |
| #183 [CL7] | 43.7 | 67 ± 64.5 | <LOD–178.6 | 16.1 | 16.4 ± 4.2 | 13.4; 19.3 | 4.7 | 7 ± 7.7 | 1.8–18.4 | 25.3 | 25.9 ± 6.5 | 20.3–35 |
| #187 [CL7] | 118.3 | 187.3 ± 190.9 | <LOD–562.2 | 50 | 50.6 ± 10.3 | 43.3; 57.8 | 14.4 | 20 ± 18.6 | 4.8–47 | 110.5 | 113.7 ± 33.2 | 91.1–162.8 |
| #191 [CL7] | 2.6 | 2.6 ± 4.2 | <LOD–11.4 | – | 1.9 ± 2.6 | <LOD; 3.7 | 0.3 | 0.3 ± 0.2 | <LOD–0.5 | 1.1 | 1.1 ± 0.4 | 0.8–1.7 |
| #194 [CL8] | 16.2 | 12.3 ± 15.7 | <LOD–51.1 | 7.4 | 7.4 ± 0.1 | 7.3; 7.5 | 1 | 0.9 ± 1.6 | <LOD–3.3 | 3.7 | 3.9 ± 1.3 | 3–5.8 |
| #199 [CL8] | 10.8 | 13.2 ± 18.3 | <LOD–60.5 | 5 | 5.1 ± 1.1 | 4.3; 5.9 | 1.6 | 1.9 ± 2.8 | <LOD–6 | 4.9 | 7.2 ± 4.7 | 0.7–11.7 |
| #201 [CL8] | 5 | 4 ± 4.8 | <LOD–14 | <LOD | <LOD | <LOD | 0.5 | 0.6 ± 0.8 | <LOD–1.7 | 3.5 | 3.5 ± 0.7 | 2.9–4.5 |
| #202 [CL8] | 5.5 | 6.7 ± 7.4 | <LOD–23.1 | 2.8 | 2.8 ± 0.6 | 2.4; 3.2 | 0.7 | 1.3 ± 1.5 | 0.2–3.5 | 7.7 | 7.8 ± 1.6 | 6.4–10 |
| #206 [CL9] | 2.1 | 1.1 ± 1.7 | <LOD–4.3 | <LOD | <LOD | <LOD | – | 0.2 ± 0.4 | <LOD–0.7 | 0.8 | 0.8 ± 0.1 | 0.7–0.9 |
| #208 [CL9] | 1.2 | 0.8 ± 1.7 | <LOD–1.5 | <LOD | <LOD | <LOD | – | 0.1 ± 0.3 | <LOD–0.5 | 0.8 | 0.8 ± 0.3 | 0.6–1.2 |
| ƩПХБ | 3413.4 | 5263.4 ± 4731.3 | 549–15 804.9 | 2810.9 | 2817.8 ± 277.4 | 2621.6; 3013.9 | 443.6 | 609.5 ± 609.4 | 210.7–1512.6 | 2182.1 | 2194.8 ± 269.3 | 1853.4–2484.6 |
ХЛОРОРГАНИЧЕСКИЕ ПЕСТИЦИДЫ (ХОП)
Из 17 анализируемых пестицидов только три аналита – транс-нонахлор, 4,4'-ДДЕ и 4,4'-ДДТ – были обнаружены во всех образцах (100% встречаемость). Частота обнаружения остальных пестицидов у белух изменялась в зависимости от их района обитания. Так, у образцов из Мечигменского залива все пестициды имели 100% встречаемость. В Анадырском лимане были обнаружены все пестициды, за исключением гептахлор эпоксида, встречаемость которого составила 25%. В образцах из Карского моря три аналита (γ-ГХЦГ, гептахлор эпоксид и транс-хлордан) не были обнаружены, а α- и β-ГХЦГ имели встречаемость 50%. Частота обнаружения 14 пестицидов в образцах из Белого моря варьировала от 8 до 97% со средним значением 78%.
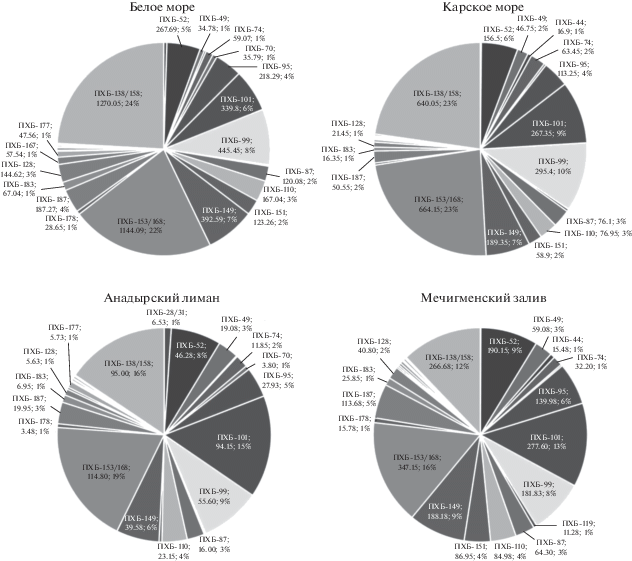
Во всех образцах доминировал пестицид 4,4'-ДДЕ, составляя от 37 до 58% (рис. 2). Самая высокая его концентрация была обнаружена в образцах из Белого моря (3778.3 ± 4856.3 нг/г липидов), наименьшая – в образцах из Анадырского лимана (1003.3 ± 1422.1 нг/г липидов) (табл. 2). Однако статистически значимых различий в концентрациях этого пестицида в подкожном жире белух из исследуемых четырех регионов нет (критерий Краскела–Уоллиса: p = 0.42).
Рис. 2.
Средние концентрации (нг/г липидов) и процентное содержание хлорорганических пестицидов в образцах подкожного жира белух из Белого моря (n = 12), Карского моря (n = 2), Анадырского лимана (n = 4), Мечигменского залива (n = 4). Показаны конгенеры с долей содержания в ƩХОП ≥ 1%.
У образцов из Белого моря вторым по значимости после 4,4'-ДДЕ был пестицид 4,4'-ДДТ (12%). Его концентрация была в 13 раз выше, чем в Анадырском лимане, и в 4 и 6 раз больше, чем в образцах из Карского моря и Мечигменского залива соответственно (критерий Краскела–Уоллиса: p = 0.027). Для образцов из других трех регионов вторым по значимости был пестицид транс-нонахлор, вклад которого составлял от 11 до 20% (M = 15.3%) (рис. 2). Концентрации этого соединения статистически значимо различались в четырех районах исследования (критерий Краскела–Уоллиса: p = 0.048), и наибольшая была обнаружена в подкожном жире белух из Мечигменского залива (табл. 2).
Концентрации большинства анализируемых пестицидов в образцах были заметно выше в Мечигменском заливе, чем в Анадырском лимане. Для гептахлор эпоксида, β-ГХЦГ и γ-ГХЦГ, хлорданов (цис-хлордан, транс-хлордан, транс-нонахлор и цис-нонахлор), 4,4'-ДДТ и мирекса обнаруженные различия были статистически значимыми (U-критерий Манна–Уитни: p < 0.05).
ПОЛИХЛОРИРОВАННЫЕ БИФЕНИЛЫ (ПХБ)
Во всех образцах подкожного жира белух были обнаружены восемь конгенеров (ПХБ-52, ПХБ-95, ПХБ-87, ПХБ-99, ПХБ-101, ПХБ-110, ПХБ-153 + + ПХБ-168 и ПХБ-138 + ПХБ-158) из 30 анализируемых. Частота встречаемости остальных 22 конгенеров широко варьировала. Особенно разнообразна их встречаемость была в Белом море и Анадырском лимане: от 42 до 92% (M = 76%) и от 25 до 100% (M = 82%) соответственно. Для образцов из Карского моря концентрации четырех конгенеров (ПХБ-167, ПХБ-201, ПХБ-206 и ПХБ-208) были ниже уровней обнаружения. У образцов из Мечигменского залива все конгенеры имели 100% встречаемость.
Для всех регионов в ƩПХБ доминировали пента- и гекса-хлорбифенилы, суммарно занимая от 77 до 86% (M = 81.5%), причем доля пента-ХБ увеличивалась, а гекса-ХБ уменьшалась с запада на восток. Наряду с ними значительный вклад в ƩПХБ внесли тетра-ХБ. Их доля увеличивалась с запада на восток, и самое большое содержание обнаружено в образцах из Мечигменского залива (14% от ƩПХБ). Самым незначительным был вклад нона-хлорбифенилов (от 0 до 0.07%, M = 0.04%).
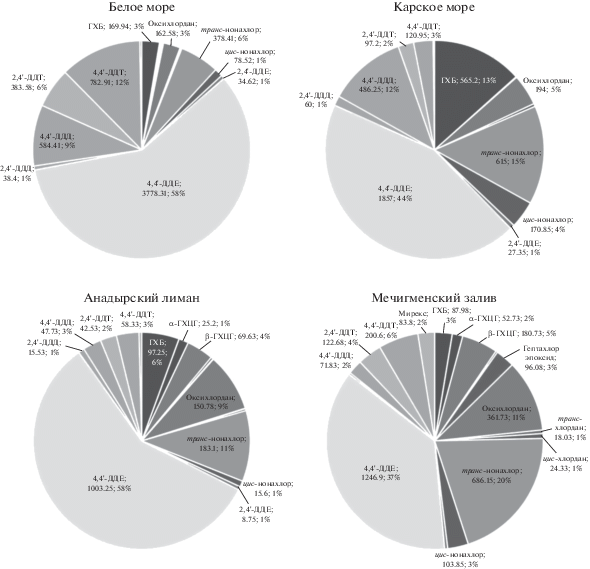
В ƩПХБ во всех анализируемых образцах доминировали две пары конгенеров: ПХБ-138 + + ПХБ-158 и ПХБ-153+ПХБ-168 (от 12 до 24% и от 16 до 23% соответственно) (рис. 3). Их наиболее высокие концентрации обнаружены в образцах из Белого моря (ПХБ-138 + ПХБ-158: 1270.1 ± ± 1528.8 нг/г липидов; ПХБ-153 + ПХБ-168: 1144.1 ± 1230.2 нг/г липидов), наименьшие – в образцах из Анадырского лимана (ПХБ-138 + ПХБ-158: 95 ± 99.2 нг/г липидов; ПХБ-153 + ПХБ-168: 114.8 ± 118.8 нг/г липидов) (рис. 3, табл. 2). Концентрации этих конгенеров в образцах из четырех исследуемых регионов статистически значимо различаются (критерий Краскела–Уоллиса: p = = 0.02), однако для образов из Анадырского лимана и Мечигменского залива значимых различий в уровнях ПХБ-138 + ПХБ-158 и ПХБ-153 + + ПХБ-168 нет (U-критерий Манна–Уитни: p < < 0.06). Другими большими вкладчиками в ƩПХБ были конгенеры ПХБ-99, -101, -149, -52 и -95 (рис. 3).
ОБСУЖДЕНИЕ
У всех анализируемых образцов подкожного жира белух, независимо от их местообитания, наибольшие концентрации были получены для хлорорганических пестицидов: так, среднее арифметическое у ƩХОП было выше, чем у ƩПХБ, почти в 3 раза в Анадырском лимане и в 1.5 раза – в трех других исследуемых регионах (табл. 2). Среди анализируемых хлорорганических пестицидов доминировало соединение 4,4'-ДДЕ; основными конгенерами ПХБ были пары ПХБ-138 + + ПХБ-158 и ПХБ-153 + ПХБ-168. Преобладание или значительные концентрации этих соединений характерны не только для белух из разных районов обитания [19, 32, 39, 40], но и для других арктических морских млекопитающих, таких как белый медведь Ursus maritimus [33], кольчатая нерпа Pusa hispida, гренландский тюлень Pagophilus groenlandicus [42, 51], атлантический морж Odobenus rosmarus rosmarus [24]. Это объясняется не только широким применением хлорорганических соединений в промышленности и сельском хозяйстве, что обеспечило им и их метаболитам высокую распространенность в окружающей среде, но и их физическими и химическими свойствами, а также видоспецифической способностью поглощать, метаболизировать или выводить их из организма [25, 47].
Известно, что 4,4'-ДДЕ является метаболитом 4,4'-ДДТ и наиболее стойким и биоаккумулирующимся соединением из пестицидов группы ДДТ [16]. Соотношение 4,4'-ДДЕ/ƩДДТ в наших исследованиях было ниже единицы, что говорит о поступлении в окружающую среду ДДТ и дальнейшем его преобразовании в ДДЕ-соединение. Поступление ДДТ во все исследуемые районы, вероятнее всего, осуществляется путем переноса на большие расстояния старых выбросов этого соединения, которые за время преобразовались в ДДЕ [19, 39]. Соотношение 4,4'-ДДЕ/ƩДДТ у белух из Берингова моря (Анадырский лиман: 0.85; Мечигменский залив: 0.75) было выше, чем у белух из Карского и Белого морей (0.70 и 0.67 соответственно). Это позволяет предположить, что поступления ДДТ в западный сектор российской Арктики по сравнению с восточным сектором прекратились позже. В пользу этого может свидетельствовать и то, что в образцах из Белого моря, в отличие от других исследуемых регионов, среди хлорорганических пестицидов вторым по значимости является 4,4'-ДДТ (рис. 2).
Конгенерный состав ПХБ в образцах, обнаруженный в этом исследовании, сопоставим с таковым в других регионах обитания белухи. Так, преобладание пента- и гексахлорконгенеров характерно для белух Шпицбергена и Канадской Арктики [19, 39]. В то же время у белух залива Святого Лаврентия доминировали гекса- и гепта-хлорконгенеры. Считается, что такие отличия могут быть вызваны разными источниками загрязнения ПХБ и путями его переноса в эти регионы [39, 40]. Воды залива Святого Лаврентия были загрязнены в результате не только атмосферного переноса и обширного водосбора, но и прямого сброса ПХБ в водную среду [41]. Преобладание гекса- и гепта-конгенеров у обитающей здесь популяции белух может указывать на их более высокую метаболическую активность: высокий уровень ƩПХБ вызывает индукцию фермента P450, в результате чего сохраняются конгенеры с более высоким содержанием хлора [39]. Уровень ƩПХБ у белух этого исследования мог быть недостаточно высоким для индукции этого фермента, поэтому сохранилось содержание менее хлорированных пента- и гекса-конгенеров.
В результате более детального анализа в данной работе были выявлены некоторые географические отличия распределения хлорсодержащих соединений.
Белое море
Самые высокие концентрации 4,4'-ДДЕ, конгенеров ПХБ-138 + ПХБ-158 и ПХБ-153 + ПХБ-168 были обнаружены в образцах из Белого моря, что оказалось достаточно предсказуемым. Действительно, Белое море считается одним из сильно загрязненных регионов Российского Севера [22], куда, помимо материковых сбросов многочисленных рек (Северная Двина, Мезень, Онега и др.), поступают сточные воды с целлюлозно-бумажных комбинатов и других хозяйственных предприятий. Наибольшие концентрации этих соединений были обнаружены у самцов белух. Так, концентрация 4,4'-ДДЕ (16 007.8 нг/г липидов) в образце половозрелого самца № 17 из Двинского залива (о. Муравой) была в 4 раза выше средней концентрации этого соединения в беломорской выборке. Содержание конгенеров ПХБ-138 + ПХБ-158 (4957.4 нг/г липидов) и ПХБ-153 + ПХБ-168 (4515.2 нг/г липидов) у самца из Онежского залива (образец № 15) превышало среднее значение этих соединений в выборке также в 4 раза (табл. 1, 2). Известно, что у ластоногих и китообразных, в том числе и у белух, уровень хлорорганических пестицидов бывает выше у самцов, чем у самок, которые благодаря лактации способны вывести значительные количества загрязняющих веществ [17, 36, 39, 55, 56]. Например, концентрация 4,4'-ДДЕ у самцов белух из Гудзонова залива была больше, чем у самок, в два и более раз, в море Бофорта ‒ в три раза, в эстуарии Святого Лаврентия ‒ почти в пять раз [39]. В этом исследовании в жировой ткани самцов беломорских белух концентрации и других хлорорганических пестицидов были выше, чем у самок, однако для подтверждения этого необходимо увеличить анализируемую выборку.
Самые незначительные концентрации 4,4'-ДДЕ (33.2 нг/г липидов), конгенеров ПХБ-138 + + ПХБ-158 (127.6 нг/г липидов) и ПХБ-153 + + ПХБ-168 (113 нг/г липидов) были обнаружены у детеныша-сеголетка (образец № 20, самка) из Онежского залива Белого моря в районе м. Глубокий (табл. 1, 2). Такие низкие концентрации этих соединений, по всей видимости, во многом были обусловлены возрастом исследуемой особи. Имея молочное вскармливание, детеныш-сеголеток еще не успел накопить свой запас загрязняющих веществ и отчасти отражает их содержание в жировой ткани своей матери. В целом концентрации этих соединений у образцов, полученных от самок, значительно варьировали, что могло зависеть от их рациона питания, района нагула, а также во многом от их возраста и репродуктивной активности [39, 55]. Возможно, именно поэтому в образце другого детеныша-сеголетка (№ 7) концентрация 4,4'-ДДЕ была достаточно высокой (8471.4 нг/г липидов) (табл. 1, 2). Необходимо также учитывать, что имеются региональные различия в уровнях загрязнения в пределах Белого моря, что было показано на примере градиента загрязнителей для зоопланктона в Кандалакшском заливе [42].
Таким образом, обнаруженные широкие диапазоны концентраций исследуемых соединений в образцах беломорских белух, вероятно, во многом обусловлены разным возрастом и полом животных, вошедших в анализируемую выборку, что в свою очередь не позволяет провести корректное сравнение уровней хлорорганических соединений с белухами из других районов обитания. Однако в целом, без учета возраста и пола анализируемых особей, средние уровни ƩПХБ и ƩДДТ у беломорских белух (табл. 2) были схожи с таковыми у самцов белух Шпицбергена, у которых средняя арифметическая ƩПХБ составляет 5103 ± 1874 нг/г липидов, ƩДДТ – 5108 ± 1089 нг/г липидов [19].
Карское море
Концентрации хлорсодержащих соединений в анализируемых образцах двух самок белух из Карского моря практически не отличались друг от друга (табл. 2). Уровень ƩДДТ у карских белух был в пределах диапазона, обнаруженного для Белого моря, а ƩПХБ была ниже. Такое распределение загрязнителей, возможно, связано с развитой целлюлозно-бумажной промышленностью в беломорском регионе (Архангельский, Соломбальский и Котласский ЦБК) – одного из основных источников ПХБ. В то же время проведенные исследования содержания хлорорганических соединений в кольчатой нерпе из этих регионов похожую тенденцию распределения загрязнителей не показали [51]: животные из юго-западной части Карского моря (о. Диксон) имели более высокий уровень и ƩДДТ, и ƩПХБ по сравнению с Белым морем. В целом, у китообразных метаболическая способность выведения хлорорганических загрязнителей ниже, чем у тюленей [19, 43, 57]. Действительно, концентрация 4,4'-ДДЕ в тканях карских белух этого исследования (GM = 1856.9 нг/г липидов) были в 2.6 раза выше, чем у самок кольчатой нерпы из района о. Диксон (GM = 708 нг/г липидов), но в 1.7 раз ниже, чем у самцов (GM = = 3290 нг/г липидов). Следует отметить, что в Белом море у белух концентрация этого соединения (GM = 1437.3 нг/г липидов) была выше, чем у кольчатой нерпы, независимо от пола последних (GM = 350 нг/г липидов у самок, GM = 381 нг/г липидов у самцов) [51].
Обнаруженные у карских белух уровни всех анализируемых загрязнителей, кроме гексахлорбензола, были ниже, чем у самцов белух, обитающих в районе о. Шпицберген [19], хотя считается, что в отличие от Шпицбергена, хлорорганические загрязнители в Карское и Белое моря попадают не только путем атмосферного переноса, но и за счет большого речного стока [22, 42, 46, 51]. В данном случае, вероятно, большое значение на полученный результат оказал именно пол анализируемых животных.
Берингово море
У белух из Мечигменского залива (n = 4) уровни исследуемых загрязнителей между собой мало отличались, и возможно, эти животные относились к одной половозрастной группе (табл. 1). Обнаруженные у них концентрации большинства ХОП и конгенеров ПХБ были существенно и статистически значимо выше, чем у белух из Анадырского лимана (табл. 2), что согласуется с представлениями о популяционном разнообразии белух, обитающих в Беринговом море [18, 44, 45]. Согласно результатам спутникового мечения, через Мечигменский залив проходят основные пути миграций на зимовку в Берингово море белух восточно-бофортской и восточно-чукотской популяций [26]. Это позволяет предположить, что белухи, отловленные в районе п. Лорино, могли принадлежать к одной из них. Действительно, нормированные данные по концентрациям хлорорганических загрязнителей на влажный вес у белух из Мечигменского залива были наиболее близки к уровням этих соединений, известным для самцов белух из восточно-бофортской популяции [39] (табл. 3). В нашей выборке по средним значениям концентраций ƩДДТ, ƩПХБ и наиболее распространенного хлордана транс-нонахлора белухи Мечигменского залива ближе к животным из Карского моря (табл. 2). Это сходство, вероятно, может быть результатом особенностей питания белух из этих регионов. В отличие от анадырской популяции, у которой важную роль в питании играет анадырская кета (Oncorhynchus keta), у арктических белух Карского моря и Мечигменского залива основным объектом питания является сайка (Boreogadus saida) [7, 8, 10, 28, 34]. С другой стороны, концентрации других менее распространенных пестицидов у них сильно различались. Так, среднее значение концентрации ГХБ в образцах жира белух из Мечигменского залива было в 6 раз ниже, чем в карских образцах. Напротив, содержание ƩГХЦГ и мирекса у мечигменских белух по сравнению с карскими было выше в 57 и 9 раз соответственно. Возможно, эти различия во многом являются результатом особенностей поступления загрязнителей в окружающую среду. Например, мирекс на территории СССР и РФ не производился и не использовался [13], и его попадание в Белое и Карское моря происходило путем атмосферного переноса из Индии и Южного Китая, где этот пестицид активно применялся. В Северной Америке мирекс широко использовался с 1959 по 1978 гг. для борьбы с огненными муравьями [20], что могло быть причиной более высокой его концентрации в образцах жира у белух из Мечигменского залива, предположительно летующих в море Бофорта, где большое влияние имеют воды р. Маккензи [39].
Таблица 3.
Концентрации хлорорганических соединений в образцах подкожного жира белух из разных районов обитания (нг/г влажного веса). Приведено среднее арифметическое значение ± стандартное отклонение
| Регион | Пол животных, количество образцов | ƩГХЦГ | транс-нонахлор | 4,4'-ДДE | ƩДДТ | Мирекс | ƩПХБ |
|---|---|---|---|---|---|---|---|
| Анадырский лиман1 | Смешанная выборка (n = 4) | 88.6 ± 32 | 162.4 ± 129.1 | 903.7 ± 1312.8 | 1056.8 ± 1435.8 | 6.3 ± 4.7 | 543.9 ± 567.6 |
| Мечигменский залив1 | Не известен (n = 4) |
203.4 ± 30 | 576.2 ± 33.6 | 1050.8 ± 197.6 | 1405.3 ± 243 | 71 ± 22.9 | 1847.7 ± 277.4 |
| Море Бофорта2 | M (n = 10) | 230 ± 60 | 530 ± 40 | 1030 ± 440 | 2200 ± 830 | 40 ± 10 | 3330 ± 850 |
| F4 (n = 2) | 170 | 210 | 350 | 670 | 20 | 1230 | |
| Восточная часть Чукотского моря (Аляска)3 | M | 330 ± 760 | – | – | 3630 ± 900 | – | 5200 ± 900 |
В Анадырском лимане образцы оказались значительно менее загрязненными, чем в трех других исследованных регионах. Вероятно, во многом это обусловлено слабым промышленным развитием этого региона, и основным путем попадания хлорорганических загрязнителей в воды лимана является атмосферный перенос. У трех белух из Анадырского лимана (образцы №№ 23, 12, 27), несмотря на их разный пол и возраст, а также дату отбора образцов (табл. 1), были выявлены похожие уровни хлорорганических загрязнителей, и только в образце № 26 (половозрелый самец) концентрации наиболее распространенных пестицидов, таких как 4,4'-ДДЕ, 4,4'-ДДТ, транс-нонахлор, оксихлордан, и доминирующих конгенеров ПХБ (№№ 138, 153, 99, 101, 149, 52 и 95) были значительно выше. Например, концентрация 4,4'-ДДЕ (3488.9 нг/г липидов) у него была больше в 6 раз, чем в образце самца (№ 23), и в 16 раз выше, чем в образцах самки (№ 12) и детеныша-сеголетка (№ 27). Несмотря даже на небольшие размеры нашей выборки, на основании полученных данных можно предположить, что самец № 26 не принадлежит к анадырской популяции белух. Так, по данным спутникового мечения, через акваторию Анадырского залива зимой мигрируют животные и восточно-бофортской, и восточно-чукотской популяций, а в декабре ареалы белух анадырской и восточно-чукотской популяций частично перекрываются [26].
ЗАКЛЮЧЕНИЕ
Представленные данные являются первыми сведениями о концентрациях ПХБ и ХОП в подкожной жировой ткани белух российской Арктики. Обнаруженные в этом исследовании особенности распределения хлорорганических загрязнителей согласуются с более ранними сообщениями об их содержании у белух из других районов обитания. Обсуждено возможное влияние транспортных путей ПХБ и ХОП на их концентрацию в подкожном жире белух из разных популяций. Обнаружен широкий диапазон концентраций хлорорганических загрязнителей у белух Белого моря, что было обусловлено разным возрастом и полом животных в выборке. Высокие концентрации ПХБ и ХОП у беломорских белух по сравнению с животными из трех других регионов, вероятно, являются следствием загрязнения Белого моря региональной и местной промышленностью и хозяйственной деятельностью. Анадырская популяция, по-видимому, имеет самые низкие концентрации загрязнителей, что позволяет отличить эту популяцию белух от других.
Благодарности. Авторы выражают благодарность за помощь сбора образцов сотрудникам Кенозерского национального парка и ЧукотТинро.
Источники финансирования. Работа выполнена в рамках Госзадания № 0149-2019-0009. Химический анализ образцов был проведен при финансовой поддержке Международного фонда защиты животных (IFAW).
Список литературы
Алексеева Я.И., Краснова В.В., Беликов Р.А. и др. Сравнительная характеристика трех летних регулярных прибрежных скоплений белухи (Delphinapterus leucas) Белого моря // Морские млекопитающие Голарктики. Тез. докл. 7-ой межд. конф. Суздаль. 2012. Т. 1. С. 33–37.
Андрианов В.В., Белькович В.М., Лукин Л.Р. Распределение белухи (Delphinapterus leucas) в Онежском заливе Белого моря в летний период // Океанология. 2009. Т. 49. № 1. С. 79–89.
Белькович В.М. Белуха европейского Севера: новейшие исследования // Рыбное хозяйство. 2004. № 2. С. 32–34.
Буторин Д.А. Где живет белуха // Рыбное хозяйство. 1966. №1. С. 28–29.
Гептнер В.Г., Чапский К.К., Арсеньев В.А., Соколов В.Е. (ред.) Млекопитающие Советского Союза. Ластоногие и зубатые киты. М.: Высшая школа, 1976. Т. 2. Ч. 3. 717 с.
Клейненберг С.Е., Яблоков А.В., Белькович В.М., Тарасевич М.Н. Белуха. Опыт монографического исследования вида. М.: Наука, 1964. 456 с.
Клумов С.К. Белуха Советского севера (сырьевая база и промысел) // Труды ВНИРО. 1939. № 12. С. 3–78.
Ковалев К.В. Миграции и промысел белухи в Енисейском заливе // Тр. Арктич. ин-та. 1938. № 123. С. 71–120.
Краснова В.В., Белькович В.М., Чернецкий А.Д. Формирование поведения детенышей беломорской белухи (Delphinapterus leucas) в ранние периоды постнатального онтогенеза // Биология моря. 2009. Т. 35. № 1. С. 41–47.
Литовка Д.И, Андронов П.Ю., Батанов Р.Л. Оценка сезонного распределения Белухи Delphinapterus leucas и объектов ее питания в прибрежных водах северо-западной части Берингова моря // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. 2013. Вып. 28. Стр. 50–70.
Матишов Г.Г., Огнетов Г.Н. Белуха (Delphinapterus leucas) арктических морей России: биология, экология, охрана и использование ресурсов. Апатиты: Изд-во КНЦ РАН, 2006. 295 с.
Мещерский И.Г., Чернецкий А.Д., Краснова В.В. и др. Митохондриальные линии белух (Delphinapterus leucas) Российской Арктики // Изв. РАН. Серия биологическая. 2018. № 2. С. 165–172.
Отчет “Стойкие органические загрязнители (СОЗ) на Байкальской природной территории” // ФЦП “Охрана озера Байкал и социально-экономическое развитие Байкальской природной территории на 2012–2020 годы”. Результаты работы совместной экспедиции ИПМ “НПО “ТАЙФУН” и ЛИН СО РАН в 2014 г. Обнинск, 2015. 55 с.
Чапский К.К. Морские звери Советской Арктики. Л.: Главсевморпуть, 1941. 187 с.
Чернецкий А.Д., Краснова В.В. Структура репродуктивного скопления белухи Delphinapterus leucas (Pallas, 1776) у острова Соловецкий (Белое море) по результатам фотоидентификации 2007–2013 гг. // Биология моря. 2018. Т. 44. № 5. С. 337–346.
Aguilar A. Relationship of DDE/ƩDDT in marine mammals to the chronology of DDT input into the ecosystem // Can. J. Fish. Aquat. Sci. 1984. V. 41. P. 840–844.
Aguilar A. Using organochlorine pollutants to discriminate marine mammal populations: A review and critique of the methods // Mar. Mammal. Sci. 1987. V. 3. P. 242–262.
Allen B.M., Angliss R.P. Beluga whale (Delphinapterus leucas): Bristol Bay stock. NOAA Stock Assessment Report NOAA-TM-AFSC-301. 2014. 5 p.
Andersen G., Kovacs K.M., Lydersen C. et al. Concentrations and patterns of organochlorine contaminants in white whales (Delphinapterus leucas) from Svalbard, Norway // The Science of the Total Environment. 2001. V. 264. P. 267–281.
ATSDR. Toxicological Profile for Mirex and Chlordecone. Draft for Public Comment. 2019. 332 p. http://www.atsdr.cdc.gov/toxprofiles/tp66.pdf
Beland P., De Guise S., Girard C. et al. Toxic compounds and health and reproductive effects in St Lawrence beluga whales // Int. Assoc. Great Lakes Res. 1993. V. 19. P. 766–775.
Berger V., Dahle S., Galaktionov K. et al. White Sea Ecology and Environment. St. Petersburg–Tromso: Derzavets Publisher, 2001. 157 p.
Boltunov A.N., Belikov S.E. Belugas (Delphinapterus leucas) of the Barents, Kara and Laptev seas // NAMMC-O Sci. Publ. 2002. V. 4. P. 149–168.
Boltunov A., Semenova V., Samsonov D. et al. Persistent organic pollutants in the Pechora Sea walruses // Polar Biology. 2019. V. 42. № 9. P. 1775–1785.
Borga K. Bioaccumulation of organochlorines OCs in an Arctic marine food chain, Canadian Science Thesis. Tromsø: Norwegian College of Fishery and Science, 1997. 108 p.
Citta J.J., Lowry L.F., O’Corry-Crowe G.M. et al. Satellite telemetry reveals population specific winter ranges of beluga whales in the Bering Sea // Mar. Mammal Sci. 2017. V. 33. № 1. P. 236–250.
De Guise S., Martineau D., Beland P. et al. Possible mechanisms of action of environmental contaminants on St. Lawrence beluga whales Delphinapterus leucas // Environ Health Perspect. 1995. V. 103. P. 73–77.
Hauser D.D.W., Laidre K.L., Parker-Stetter S.L. et al. Horne regional diving behavior of Pacific Arctic beluga whales Delphinapterus leucas and possible associations with prey // Mar. Ecol. Prog. Ser. 2015. V. 541. P. 245–264.
Hill H.M., Campbell C., Dalton L. et al. The first year of behavioral development and maternal care of beluga (Delphinapterus leucas) calves in human care // Zoo Bio-l. 2013. V. 32. № 5. P. 565–570.
IWC (International Whaling Commission) Report of the Scientific Committee from its Annual Meeting 3–15 May 1999 in Grenada // J. Cetacean Res. Manage. 2000. 2 (Suppl).
Jepson P.D., Law R.J. Persistent pollutants, persistent threats // Science. 2016. V. 352. № 6292. P. 1388–1389.
Krahn M.M., Burrows D.G., Stein J.E. et al. White whales Delphinapterus leucas from three Alaska stocks concentrations and patterns of persistent organochlorine contaminants in blubber // J. Cetacean Res. Manage. 1999. V. 1. P. 239–249.
Lie E., Bernhoft A., Rigetb F. et al. Geographical distribution of organochlorine pesticides (OCPs) in polar bears (Ursus maritimus) in the Norwegian and Russian Arctic // Sci. Total Environ. 2003. V. 306. P. 159–170.
Loseto L.L., Stern G.A., Connelly T.L. et al. Summer diet of beluga whales inferred by fatty acid analysis of the eastern Beaufort Sea food web // J. Exp. Mar. Bio. Ecol. 2009. V. 374. P. 12–18.
Macdonald R.W., Bewers J.M. Contaminants in the arctic marine environment: priorities for protection // ICES J. Mar. Sci. 1996. V. 53. P. 537–563.
Martineau D., Beland P., Desjardins C. et al. Levels of organochlorine chemicals in tissue of beluga whales Delphinapterus leucas from the St Lawrence Estuary, Quebec // Arch. Environ. Contam. Toxicol. 1987. V. 16. P. 137–147.
Martineau D., De Guise S., Foumier M. et al. Pathology and toxicology of beluga whales from the St. Lawrence Estuary, Quebec, Canada. Past, present and future // The Science of the Total Environment. 1994. V. 154. P. 201–115.
Mc Clurg T.P. Trace metals and chlorinated hydrocarbons in Ross seals from Antarctica // Mar. Pollut. Bull. 1984. V. 15. № 10. P. 384–389.
Muir D.C.G., Ford C.A., Stewart R.E.A. et al. Organochlorine contaminants in belugas Delphinapterus leucas from Canadian waters // Can. Bull. Fish Aquat. Sci. 1990. V. 224. P. 165–190.
Muir D.C.G., Ford C.A., Rosenberg B. et al. Persistent organochlorines in beluga whales (Delphinapterus leucas) from the St Lawrence River Estuary – I. Concentrations and patterns of specific PCBs, chlorinated pesticides and polychlorinated dibenzo-p-dioxines and dibenzofurans // Environ. Pollut. 1996. V. 93. P. 219–234.
Muir D.C.G., Koczanskia K., Rosenberga B., Béland P. Persistent organochlorines in beluga whales (Delphinapterus leucas) from the St Lawrence River estuary —II. Temporal trends, 1982–1994 // Environ. Pollut. 1996. V. 93. P. 235–245.
Muir D.C.G., Savinova T., Savinov V. et al. Bioaccumulation of PCBs and chlorinated pesticides in seals, fishes and invertebrates from the White Sea, Russia // Sci. Total Environ. 2003. V. 306. P. 111–131.
Norstrom R.J., Muir D.C.G., Ford C.A. et al. Indications of P450 monooxygenase activities in beluga (Delphinapterus leucas) and narwhal (Monodon Monoceros) from pattern of PCB, PCDD and PCDF accumulation // Mar. Environ. Res. 1992. V. 34. P. 267–272.
O’Corry-Crowe G.M., Dizon A.E., Suydam R.S., Lowry L.F. Molecular genetic studies of population structure and movement patterns in a migratory species: The beluga whale (Delphinapterus leucas) in the western Nearctic. In: Pfeiffer C.J., ed. Molecular and cell biology of marine mammals. FL, Malabar: Krieger Publishing Co. 2002. P. 53–64.
O’Corry-Crowe G.M., Lydersen C., Heide-Jørgensen M.P. et al. 2010. Population genetic structure and evolutionary history of North Atlantic beluga whales (Delphinapterus leucas) from West Greenland, Svalbard and the White Sea // Polar Biology. 2010. V. 33. P. 1179–1194.
Oehme M., Schlabach M., Kalleborn R. and Haugen J.E. Sources and pathways of persistent polychlorinated pollutants to remote areas of the North Atlantic and levels in the marine food chain: a research update // Sci. Total Environ. 1996. V. 186. P. 13–24.
O’Hara T.M., Becker P.R. Persistent organic contaminants in Arctic marine mammals. In: Vos J.G., Bossart G.D., Fournier M., O’Shea T. (eds). New perspectives: toxicology and the environment. V. 3 — systems. Toxicology of marine mammals. London: Taylor & Francis Group, 2002. P. 168–205.
Ottar B. The transfer of airborne pollutants to the Arctic region // Atmos. Environ. 1981. V. 15. P. 1439–1445.
Reijnders P.J.H. Organohalogen and heavy metal contamination in cetaceans: observed effects, potential impacts and future prospects. In: Simmonds M.P., Hutchinson J.D. (eds). The conservation of whales and dolphins – science and practice. Chichester: John Wiley and Sons Ltd., 1996. P. 205–217.
Report of the NAMMCO. Global Review of Mondontids. 13–16 March 2017, Hillerød. Denmark: North. Atl. Mar. Mammal Comm. 2018. https://nammco.no/ wp-content/uploads/2018/05/report-global-review-of- monodontids-nammco-2018_after-erratum-060518_ with-appendices_2.pdf
Savinov V., Muir D.C.G., Svetochev V. et al. Persistent organic pollutants in ringed seals from the Russian Arctic // Sci. Total Environ. 2011. V. 409. P. 2734–2745.
Simmonds M.P. Of Poisons and Plastics: An Overview of the Latest Pollution Issues Affecting Marine Mammals. In: Marine Mammal Welfare. Human Induced Change in the Marine Environment and its Impacts on Marine Mammal Welfare. Springer International Publishing AG, 2017. P. 27–41. https://doi.org/10.1007/978-3-319-46994-2
Stern G.A., Muir D.C.G., Segstro M.D. et al. PCBs and other organochlorine contaminants in white whales Delphinapterus leucas from West Greenland: variation with sex and age // Medd. Grønland Biosci. 1994. V. 39. P. 245–259.
Stewart B.E., Stewart R.E.A. Delphinapterus leucas // Mammalian species. 1989. V. 336. P. 1–8.
Tanabe S., Miura S., Tatsukawa R. Variations of organochlorine residues with age and sex in Antarctic Minke whales // Mem. Nat. Inst. Polar Res., Spec. Issue. 1986. V. 41. P. 174–181.
Tanabe S., Loganathan B.G., Subramanian A.N., Tatsukawa R. Organochlorine residues in short-finned pilot whales. Possible use as tracers of biological parameters // Mar. Pollut. Bull. 1987. V. 18. P. 561–563.
Tanabe S., Watanabe S., Kan H., Tatsukawa R. Capacity and mode of PCB metabolism in small cetaceans // Mar. Mammal. Sci. 1988. V. 4. P. 103–124.
Thomann R.V. Bioaccumulation model of organic distribution in aquatic food chains // Environ. Sci. Technol. 1989. V. 23. P. 699–707.
Дополнительные материалы отсутствуют.