Океанология, 2021, T. 61, № 2, стр. 264-275
Функциональное состояние фитопланктона и оптические характеристики взвеси Онежского залива Белого моря
И. В. Конюхов 1, *, А. Ф. Котикова 1, Т. А. Белевич 1, Л. В. Ильяш 1, М. Д. Кравчишина 2, С. И. Погосян 1
1 Московский государственный университет им. Ломоносова, Биологический факультет
Москва, Россия
2 ФГБУН Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: vanka.kon@gmail.com
Поступила в редакцию 27.12.2017
После доработки 15.05.2019
Принята к публикации 15.08.2020
Аннотация
Проведен анализ состояния фитопланктона Онежского залива Белого моря в июне 2015 г. Концентрация хлорофилла “а”, численность и биомасса клеток определены для всего сообщества фитопланктона и отдельно для фракции пикопланктона. Данные сопоставлены с результатами оптических измерений, проведенных в тех же пробах. Обнаружена высокая корреляция (R 2 = 0.82) между оптической плотностью взвесей в полосе поглощения хлорофилла (680 нм) и интенсивностью флуоресценции хлорофилла. Микроводоросли имели высокую квантовую эффективность фотосистемы 2 (Fv/Fm > 0.4). Для пикофракции величина Fv/Fm была ниже, чем у суммарного фитопланктона, вероятно, ввиду присутствия цианобактерий. Вклад пикопланктона в общую биомассу не превышал нескольких процентов, но его вклад в общий сигнал флуоресценции хлорофилла in vivo мог достигать 40%.
ВВЕДЕНИЕ
Функциональное состояние и обилие фитопланктона (ФП) в морских экосистемах характеризуется выраженной пространственно-временнóй изменчивостью, которая определяется как биотическими, так и абиотическими факторами. Среди абиотических факторов одними из наиболее значимых являются структура и динамика вод. Гидрологическому режиму каждого моря, а в ряде случаев и отдельным гидрографическим районам конкретного водоема присущи свои характерные черты, что определяет специфичность пространственной неоднородности структурных и функциональных характеристик ФП [27].
Белое море – небольшой субарктический полузамкнутый водоем с сильно расчлененной акваторией, включающей восемь гидрографических районов (четыре залива, Бассейн, Горло, Воронка), различающихся по глубине, площади акватории, температуре и солености поверхностных вод, термохалинной структуре вод, объему речного стока, интенсивности приливного воздействия и другим параметрам [9]. Особенности гидрофизических условий в Онежском заливе, расположенном в юго-западной части моря, определяют его мелководность, интенсивное приливное воздействие, существенный речной сток, наличие квазиоднородного и стратифицированного типов вертикального распределения температуры и солености, формирование динамичных фронтальных зон между водами с разной термохалинной структурой. Это ставит вопрос о функциональном состоянии планктонных водорослей не только в поверхностном слое, но и в более глубоководных слоях. Известно, что в летний период по уровню первичной продукции и концентрации хлорофилла “а” Онежский залив уступает другим заливам Белого моря [8, 14].
Флуоресцентный метод широко используется в мировой практике экологических исследований для оценки физиологического состояния ФП и его фотосинтетической способности, включая соотношение между фиксацией углерода и другими процессами в электрон-транспортной цепи [44]. Данный метод основан на измерении активной флуоресценции хлорофилла “а”. Основной определяемый параметр – относительная переменная флуоресценция Fv/Fm – рассматривается как показатель максимальной квантовой эффективности фотосинтеза и часто используется при исследовании функционального состояния и физиологических изменений в ФП [25, 29]. В Белом море и в частности Онежском заливе подобные исследования ранее не проводились. Данные о состоянии ФП и его пространственной изменчивости могут дать важную дополнительную информацию для верификации результатов спутникового мониторинга не только субарктического Белого моря, но и шельфовых арктических морей.
Цель настоящей работы – оценка функционального состояния фотосинтетического аппарата ФП, определение биомассы ФП и оптических характеристик взвеси и их пространственной изменчивости в Онежском заливе Белого моря в третьей декаде июня 2015 г. с использованием современных флуорометрических и спектрофотометрических методов.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор проб. Материалом для работы послужили пробы, отобранные на акватории Онежского залива на 20 комплексных станциях (рис. 1) с 22 по 27 июня 2015 г. в ходе рейса НИС “Эколог”. С помощью гидрологических зондов CastAway (США) и SBE-25 (США) проводили вертикальное зондирование для измерения температуры, электропроводности и давления. По этим характеристикам производился расчет солености и плотности. Степень стратификации водного столба оценивали по среднему градиенту плотности между глубинами 20 и 1 м (E = ∆δ/∆z) [7]. Для расчетов индекса Е на станциях с глубиной <20 м использовали значения плотности воды придонного слоя. Прозрачность воды определяли по белому диску, по глубине видимости которого рассчитывали протяженность эвфотической зоны [43]. Границей эвфотической зоны принимали глубину с 1% фотосинтетически активной радиации. Воду отбирали с нескольких горизонтов (табл. 1) с помощью пятилитрового батометра Нискина.
Рис. 1.
Размещение комплексных и гидрологических станций в Онежском заливе Белого моря. Условные обозначения: 1 – комплексная гидрологическая станция; 2 – зондовая гидрологическая станция; 3 – холодный фронт приливного перемешивания; 4 – теплый фронт приливного перемешивания; 5 – стоковый фронт; 6 – условная граница района.
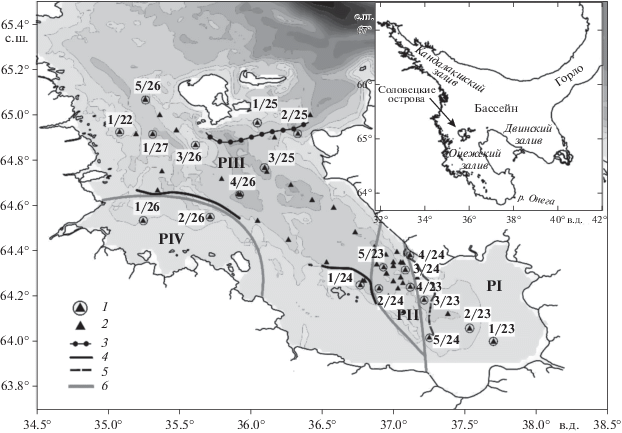
Таблица 1.
Глубина на комплексных станциях (Гл, м) и глубина верхнего перемешанного слоя (числа в скобках), температура (Т, °С), соленость поверхностного слоя (S, епс), степень стратификации водного столба (Е, кг/м3), глубина эвфотического слоя (ФС, м), горизонты отбора проб (Гор, м). В колонках Т, S и E справа указаны средние значения по району
| Район | Станции | Гл | Т | S | Е | ФС | Гор | |||
|---|---|---|---|---|---|---|---|---|---|---|
| PI | 5/24 | 16(4) | 15.2 | 13.3 | 0.11 | 23.3 | 0.11 | 0.174 | 8.1 | 0; 2; 5; 10 |
| 1/23 | 9(3) | 11.8 | 0.19 | 0.19 | 6.8 | 0; 2; 5 | ||||
| 2/23 | 14(4) | 13.4 | 0.42 | 0.42 | 6.8 | 0; 2; 5; 10 | ||||
| 3/23 | 35(9) | 11 | 0.02 | 0.02 | 15 | 0; 2 | ||||
| 4/24 | 31(3) | 14.9 | 0.13 | 0.13 | 8.1 | 0; 2; 5; 10 | ||||
| PII | 4/23 | 20(4) | 11.1 | 11.4 | 0.06 | 24.5 | 0.06 | 0.068 | 8.6 | 0; 2; 5; 10 |
| 3/24 | 15(5) | 12.2 | 0.07 | 0.07 | 9.5 | 0; 2; 8; 15 | ||||
| 2/24 | 35(6) | 10.4 | 0.02 | 0.02 | 13.5 | 0; 2; 4; 10 | ||||
| 5/23 | 15(4) | 11.9 | 0.12 | 0.12 | 8.2 | 0; 2; 5; 10 | ||||
| PIII | 1/24 | 32(32) | 8.6 | 7.4 | <0.01 | 26.4 | <0.01 | <0.029 | 16.4 | 0; 2; 5; 10 |
| 4/26 | 32(6) | 7.9 | 0.01 | 0.01 | 21.6 | 0; 2; 5; 15; 20 | ||||
| 3/25 | 51(4) | 8 | 0.03 | 0.03 | 16 | 0; 2; 4; 10 | ||||
| 2/25 | 47(9) | 6.1 | 0.03 | 0.03 | 15 | 0; 2; 5; 10; 20 | ||||
| 1/25 | 9(9) | 3.3 | 0.11 | 0.11 | 9 | 0; 2; 4; 7 | ||||
| 3/26 | 56(5) | 8.6 | 0.04 | 0.04 | 17.5 | 0; 2; 5; 10; 15 | ||||
| 1/27 | 37(37) | 7.9 | <0.01 | <0.01 | 20 | 0; 2; 5; 10; 20 | ||||
| 1/22 | 35(35) | 8.1 | <0.01 | <0.01 | 13.5 | 0; 2; 5 | ||||
| 5/26 | 47(47) | 8.3 | <0.01 | <0.01 | 19 | 0; 2; 5; 10; 20 | ||||
| PIV | 1/26 | 14(4) | 11.2 | 10.7 | 0.21 | 24.6 | 0.21 | 0.125 | 9.5 | 0; 2; 5 |
| 2/26 | 19(4) | 10.2 | 0.04 | 0.04 | 17.5 | 0; 2; 5; 10 | ||||
Оценка численности и биомассы ФП. При подготовке и количественной обработке проб ФП, согласно [45], принимали следующие диапазоны максимального линейного размера водорослей: пикофитопланктон (пикоФП) – 0.2–2 мкм, нанофитопланктон – 2–20 мкм, микрофитопланктон – 20–200 мкм.
Для оценки численности нано- и микрофитопланктона пробы воды (объем 1 л) фиксировали раствором Люголя, концентрировали методом обратной фильтрации (диаметр пор фильтра 2 мкм) и просчитывали под микроскопом Микромед 3 в камере Ножотта объемом 0.05 мл. Линейные размеры клеток измеряли окуляр-микрометром. Объем клеток рассчитывали, исходя из объема соответствующих стереометрических фигур [31] с последующим переводом в единицы углерода по аллометрическим зависимостям [39].
Подсчет численности пикоФП проводили по общепринятому методу [46]. Подпробы воды объемом 10 мл наливали в фильтрационную воронку, добавляли насыщенный раствор примулина, выдерживали 5–7 мин, затем добавляли 2% раствор глютарового диальдегида и осаждали на ядерные фильтры с диаметром пор 0.12 мкм, предварительно окрашенные суданом черным. Фильтры с осажденными клетками пикоФП помещали в жидкий азот и хранили до последующей обработки. Подсчет клеток на фильтрах проводили под люминесцентным микроскопом Leica DM5000B при увеличении ×1000, просматривая 30–50 полей зрения в зависимости от концентрации клеток. При подсчете учитывали “тип” свечения клеток (оранжевый – цианобактерии, или красный – эукариотические водоросли), а также измеряли размеры клеток. Клеточное содержание углерода рассчитывали по объемам клеток с использованием аллометрических зависимостей [49].
Концентрацию хлорофилла “а” определяли флуорометрическим методом в экстрактах [16] с помощью флуорометра Trilogy 1.1 (Turner Designs, США). Калибровка прибора выполнена при помощи стандарта – порошка хлорофилла “а” (C6144–1MG “Sigma”, Австрия), в растворе которого концентрация пигмента определена спектрофотометрически.
Оценка параметров флуоресценции. Параметры флуоресценции хлорофилла были определены для всего ФП и отдельно для пикофракции (в фильтрате после пропускания исходной воды через ядерный фильтр с размером пор 2 мкм). Измерения флуоресценции проводили в кварцевой кювете объемом 30 мл на приборе Мега-25 [10]. Перед измерениями пробы выдерживали в течение 30 мин в темноте. Сигнал флуоресценции пробы воды помимо флуоресценции хлорофилла содержит некоторый уровень флуоресценции растворенных органических веществ (Ff ). Величину Ff определяли в пробах воды, отфильтрованных через стекловолоконные фильтры GF/F. Интенсивность флуоресценции измеряли при открытых (Fo) и закрытых (Fm) реакционных центрах фотосистемы 2. После этого вычитали фоновый сигнал Ff и получали истинные значения флуоресценции хлорофилла планктонных водорослей: для всего ФП Fo и Fm, для пикофракции Foпико и Fmпико. Расчет относительной переменной флуоресценции хлорофилла проводили для всего ФП Fv/Fm = (Fm – Fo)/Fm и для пикофракции Fv/Fmпико = (Fmпико – Foпико)/Fmпико. Относительная переменная флуоресценция характеризует квантовую эффективность фотосистемы 2, а точнее – ее среднее значение по всем клеткам фитопланктона в пробе. Величины Fv/Fm изменяются от 0 до 0.8 [35]. Высокие значения (>0.4) характерны для водорослей в хорошем физиологическом состоянии, тогда как низкие (<0.4) свидетельствуют о неблагоприятном состоянии фотосинтетического аппарата [12].
Оценка абсорбционных характеристик. Абсорбционные характеристики взвешенных частиц и окрашенных растворенных органических веществ определяли в полости интегрирующей сферы [11]. Спектрофотометр для измерения поглощения (Integrating cavity absorption meter, ICAM) построен на базе спектрометра Ocean Optics USB 2000 (США). Для определения спектров поглощения окрашенного растворенного органического вещества (ОРОВ) нулевую линию спектрофотометра регистрировали при заполнении сферы дистиллированной водой. После этого из интегрирующей сферы сливали воду и заменяли ее пробой отфильтрованной морской воды (фильтр GF/F). Полученный разностный спектр поглощения принимали за спектр поглощения ОРОВ.
Для определения спектров поглощения взвешенных в воде частиц нулевую линию спектрофотометра регистрировали в сфере, заполненной отфильтрованной морской водой. После этого в полость интегрирующей сферы помещали пробу морской воды и регистрировали спектр поглощения взвешенных в воде частиц. Затем интегрирующую сферу заполняли пробой воды, профильтрованной через ядерный фильтр с порами 2 мкм. Полученный разностный спектр обозначали как спектр поглощения пикофракции.
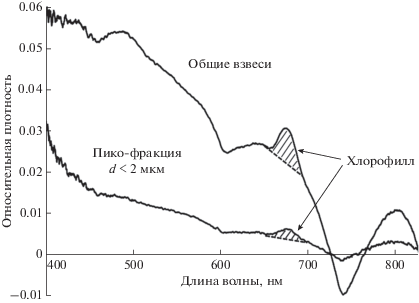
По спектру поглощения ICAM оценивали содержания хлорофилла “а”. Для этого рассчитывали площадь области, ограниченной сверху спектром поглощения, а снизу – прямой, проходящей через точки спектра при 650 и 695 нм (рис. 2). Формальная размерность этого интеграла – [нм]. Отбросив размерность, мы использовали численные значения данного интеграла в качестве независимой оценки содержания хлорофилла в пробах воды – хл “а”ICAM – в относительных единицах.
Рис. 2.
Спектры поглощения взвешенных в воде частиц. Площадь заштрихованной области была использована для оценки содержания хлорофилла (метод ICAM).
Статистическая обработка данных. Для оценки зависимости между переменными рассчитывали коэффициент корреляции Пирсона (R), предварительно убедившись в нормальном характере распределения исходных случайных величин. Достоверность различий средних значений оценивали по критерию Манна–Уитни с использованием программы PAST V.3 [32].
РЕЗУЛЬТАТЫ
Гидрофизические условия. Термохалинная структура вод в районах исследования в июне 2015 г. подробно освещена в работе [1]. В данной работе будут приведены только данные, важные для описания функционального состояния и структуры ФП. Согласно различиям в гидрофизических условиях, на акватории залива может быть выделено четыре района РI–РIV (табл. 1). В кутовой части залива (РI), а также в западной части (РIV) воды были стратифицированы в результате влияния речного стока. Верхний перемешиваемый слой в этих районах характеризовался более низкой соленостью (в среднем 23.3 епс для PI и 24.6 епс для РIV) и более высокой температурой (в среднем 13.3°С для PI и 10.7°С для РIV). Границей РI являлся стоковый фронт, а РIV – теплый фронт приливного перемешивания. Район PIII, охватывающий акваторию у Соловецких островов и центральную часть залива, характеризовался слабой стратификацией водного столба (среднее значение E < 0.029 кг/м3), низкой температурой (в среднем 7.4°С) и повышенной соленостью поверхностного слоя (в среднем 26.4 епс), что обусловлено воздействием приливного перемешивания. Самые холодные и соленые воды отмечены за холодным фронтом приливного перемешивания (ст. 1/25). В южной части залива между стоковым фронтом и теплым фронтом приливного перемешивания располагались воды (PII), стратификация которых (среднее Е = 0.068 кг/м3) была меньше, чем в PI (среднее Е = 0.174 кг/м3), но выше, чем в PIII (среднее Е < 0.029 кг/м3). Границы PII динамичны, поскольку положение приливного и стокового фронта может существенно меняться в зависимости от высоты прилива, объема речного стока, ветрового воздействия и др. [13]. Глубина эвфотического слоя превышала протяженность перемешиваемого слоя на всех станциях за исключением четырех станций в РIII (табл. 1).
Содержание биогенных элементов (минеральных форм азота, фосфора, кремния) [1] превышало пороги лимитирования развития ФП – 1 мкМ по азоту и кремнию и 0.1 мкМ по фосфору.
Состав ФП. Идентифицированы 114 таксонов разного ранга, по числу видов преобладали диатомовые водоросли (59 таксонов) и динофлагелляты (43). Отмечены криптофитовые, золотистые, диктиохофициевые, зеленые и эвгленовые водоросли. Помимо этого, некоторые мелкоклеточные формы (3–8 мкм) не удалось идентифицировать даже до самого высокого ранга, они были объединены в группу “мелкие неидентифицированные водоросли”. ПикоФП был представлен цианобактериями и эукариотическими водорослями, идентификация которых возможна только на основе молекулярно-генетических методов.
Биомасса ФП. Обилие ФП было относительно невысоким. Средние для всего исследованного района значения интегрального обилия в эвфотическом слое составляли: суммарная биомасса ФП – 148 ± 88 мг С/м2, биомасса пикоФП – 1.8 ± ± 1.7 мг С/м2, содержание хлорофилла “а” – 6.4 ± 2.3 мг/м2. Доля феопигментов составляла 28–58% от суммарной концентрации пигментов. Средние для эвфотического слоя значения параметров обилия существенно варьировали на разных станциях в пределах одного района (рис. 3а, б) и для всей исследованной акватории составили: суммарная биомасса ФП – 12 ± 6 мг С/м3, биомасса пикоФП – 0.16 ± 0.19 мг С/м3, содержание хлорофилла “а” – 0.53 ± 1.18 мг/м3. Средние значения биомассы ФП для отдельных районов достоверно не различались, средние значения биомассы пикоФП были достоверно выше в районе PI, чем PII и PIII (р = 0.03), а содержание хлорофилла “а” достоверно выше в PI, чем в PIII (р = 0.01).
Рис. 3.
Глубина верхнего перемешиваемого слоя (ВПС, маркер 2) (а), средние значения концентрации хлорофилла “а” (хл “а”, маркер 1) (а), суммарной биомассы фитопланктона (Всум, маркер 3) и биомассы пикофитопланктона (Впико, маркер 4) (б) в эвфотическом слое четырех районов Онежского залива (РI–PIV). Звездочкой (*) отмечены станции, на которых глубина верхнего перемешиваемого слоя больше глубины эвфотического слоя.
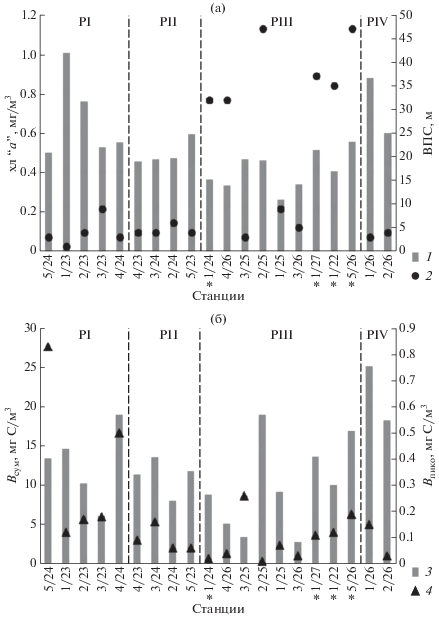
В состав доминирующих по биомассе таксонов ФП входили в РI Teleaulax sp. Heterocapsa triquetra, неидентифицированные мелкие жгутиковые; в PII и PIII – Skeletonema spp.; в PIV – Thalassiosira nordenskioeldii. В пикоФП почти на всех станциях доминировали Synechococcus-подобные цианобактерии. Преобладание пикоэукариот было выявлено только на четырех станциях (1/22, 3/24, 3/25 и 1/26). Вклад пикоФП в суммарную биомассу ФП колебался от 0.01 (ст. 3/25) до 8% (ст. 3/25).
Вертикальное распределение биомассы ФП и содержания хлорофилла “а”. Суммарная биомасса ФП и содержание хлорофилла “а”, как правило, снижались с глубиной, однако на ряде станций отмечены максимальные значения этих параметров на глубинах 5–10 м (рис. 3). Для вертикального распределения биомассы пикоФП, наоборот, максимумы в поверхностном слое встречались реже, чем на больших глубинах. Неравномерное распределение биомассы ФП, пикоФП и хлорофилла “а” с глубиной было обнаружено и на станциях со слабой стратификацией водного столба, например на станциях 1/24, 1/27, 1/22, 5/26.
Эффективность первичных процессов фотосинтеза. Квантовая эффективность работы фотосистемы 2, характеризуемая величиной относительной переменной флуоресценции ФП (Fv/Fm), на исследованной акватории была высокой как в поверхностном горизонте (рис. 4), так и на больших глубинах (рис. 5). В большинстве случаев значения Fv/Fm превышали 0.4, что свидетельствует о хорошем состоянии фотосинтетического аппарата водорослей. Из всего массива данных (все горизонты всех станций) только два значения были ниже 0.4 (рис. 5). Следует отметить, что значения Fv/Fm > 0.5 зарегистрированы и при невысокой концентрации фотоавтотрофного ФП (содержание хлорофилла “а” <0.5 мг/м3). Средние значения Fv/Fm в поверхностном слое между районами достоверно не различались, за исключением более низких Fv/Fm в PIII по сравнению с РI (р = 0.04).
Рис. 4.
Квантовая эффективность фотосистемы 2 Fv/Fm у фитопланктона (маркер 1) и пикофитопланктона (маркер 2) в поверхностном горизонте.
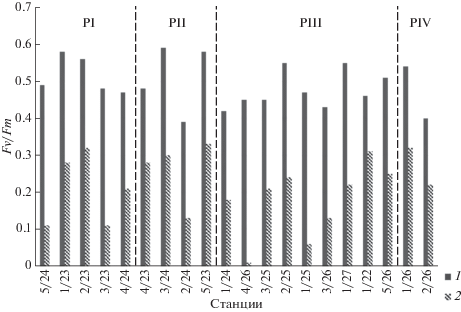
Рис. 5.
Квантовая эффективность фотосистемы 2 Fv/Fm у фитопланктона при разной концентрации хлорофилла “а”. Включены данные по всем горизонтам всех станций.

Значения квантовой эффективности фотосистемы 2 пикоФП (Fv/Fmпико) были ниже, чем у суммарного ФП как в поверхностном горизонте (рис. 4), так и на всех других горизонтах. Пределы колебаний составили 0–0.42 (максимум на ст. 2/23, 2 м), мода – 0.30, медиана – 0.21.
Характер вертикального распределения показателя квантовой эффективности фотосистемы 2 различался на разных станциях. Отмечено как некоторое снижение, так и увеличение Fv/Fm с глубиной. На станциях, где верхний перемешиваемый слой был больше, чем эвфотическая зона, значения Fv/Fm были высокими (порядка 0.5) даже на глубинах вне эвфотической зоны.
Оптические характеристики взвеси. Спектры поглощения взвешенных в воде частиц Онежского залива (рис. 6) характеризовались максимальным поглощением в коротковолновой области и уменьшением поглощения в длинноволновой области спектра. В дальней красной области спектров взвеси регистрируемое значение поглощения в ряде случаев имело отрицательное значение (рис. 2, 6). Такое искажение спектра поглощения обусловлено флуоресценцией хлорофилла [11]. В спектрах поглощения пикофракции на многих станциях и горизонтах были выявлены максимумы в области от 700 до 800 нм (рис. 6).
Рис. 6.
Типичные спектры поглощения взвешенных в воде частиц, определенные в полости интегрирующей сферы (ICAM) для разных горизонтов водной тощи. (а) – общие взвеси (ст. 2/23), (б) – пикофракция (ст. 5/26).

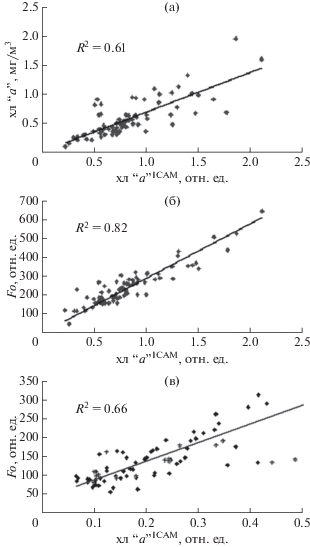
Между оценками концентрации хлорофилла “а” по спектрам поглощения взвеси (хл “а”ICAM ) и величинами, определенными флуорометрическим методом в ацетоновых экстрактах (хл “а”), выявлена достоверная корреляция (R 2 = 0.61) (рис. 7а). Более высокая корреляция связывает величины хл “а”ICAM и интенсивность флуоресценции хлорофилла Fo (R 2 = 0.82) (рис. 7б). Также достаточно высокая корреляция существует между содержанием хлорофилла пикоФП, рассчитанного из спектров поглощения, и интенсивностью флуоресценции хлорофилла Fo тех же проб (R 2 = 0.66) для акваторий PI, РIII и РIV (рис.7в). В акватории РII корреляция между этими параметрами значительно снижается.
Рис. 7.
Корреляция: а) между содержанием хлорофилла, определенным по спектрам поглощения ICAM в области 650–695 нм, и содержанием хлорофилла, измеренным в ацетоновых экстрактах. б) между содержанием хлорофилла, определенным по спектрам поглощения ICAM в области 650–695 нм, и интенсивностью флуоресценции хлорофилла фитопланктона (Fo). в) между содержанием хлорофилла пикофитопланктона, определенным по спектрам поглощения ICAM в области 650–695 нм, и интенсивностью флуоресценции хлорофилла пикопланктона (Fo) (знаком + выделены точки, принадлежащие акватории РII).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В третьей декаде июня 2015 г. в эвфотическом слое Онежского залива биомасса ФП была относительно невысокой. Так, среднее содержание хлорофилла “а” в июне 2015 г. было меньше средних значений содержания хлорофилла “а” (2.81 мг/м3) для эвфотического слоя всего моря в июне 2008 г. [5]. При относительно невысокой биомассе фотоавтотрофный планктон характеризовался высокой квантовой эффективностью фотосистемы 2 во всем эвфотическом слое (Fv/Fm превышали > 0.4), что свидетельствует о хорошем физиологическом состоянии водорослей [12]. Это согласуется с тем, что в период проведения настоящего исследования развитие ФП в водах залива не было лимитировано содержанием биогенных элементов [1].
Хорошее физиологическое состояние было присуще ФП в районах с разной термохалинной структурой вод и разным составом доминирующих таксонов. Достоверные отличия по значениям Fv/Fm отмечены между ФП поверхностного слоя в стратифицированных водах в кутовой части залива с более низкой соленостью и более высокой температурой (РI) и ФП центральной части залива у Соловецких островов в условиях низкой температуры и повышенной солености поверхностного слоя при слабой стратификации водного столба (PIII). Более низкие средние значения Fv/Fm в PIII, видимо, обусловлены тем, что при выносе в поверхностный слой водорослей из слоев у нижней границы эвфотической зоны водоросли могут испытывать фотоингибирование, поскольку они были адаптированы к условиям более низкой освещенности. В целом, хорошее физиологическое состояние ФП в районах с разной термохалинной структурой вод и разным составом доминирующих таксонов (РI – Teleaulax sp. Heterocapsa triquetra, неидентифицированные мелкие жгутиковые; PII и PIII – Skeletonema spp., PIV – Thalassiosira nordenskioeldii) свидетельствует о том, что в фитопланктонном сообществе в основном присутствуют те виды, чьи функциональные возможности наилучшим образом соответствуют складывающемуся в определенный момент комплексу абиотических факторов.
Квантовая эффективность фотосистемы 2 пикоФП была ниже, чем у суммарного ФП на всех горизонтах эвфотической зоны. Величины медианы значений Fv/Fm пико (0.21) и моды (0.30) может свидетельствовать о неблагополучном функциональном состоянии пикоФП. Однако, учитывая отсутствие лимитирования фотоавтотрофов содержаним биогенных элементов, а также способность пикоформ акклимироваться к изменяющимся световым условиям [32], можно предположить следующие причины, обусловливающие низкую квантовую эффективность фотосистемы 2 у пикоФП. (1) В пикофракции по численности и биомассе доминировали Synechococcus-подобные цианобактерии, что характерно для летнего периода в умеренных и субполярных водах. Среди пикоцианобактерий в субполярных морских водах преобладают Synechococcus spp., представленные разными генотипами/экотипами с выраженной дифференциацией экологических ниш [32, 33]. У цианобактерий в силу особенностей строения фотосинтетического аппарата даже в оптимальных условиях роста значения Fv/Fm меньше, чем у эукариотических водорослей [6]. (2) Интенсивность флуоресценции хлорофилла в пикофракции оценивали в фильтрате после пропускания пробы воды через ядерный фильтр. Возможно, сама процедура фильтрации вызывает частичное повреждение пикоФП. (3) Не следует исключать возможности того, что в фильтрат попадали фрагменты с хлоропластами клеток более крупных форм [50]. Так, метагеномное секвенирование области V4 гена 18S рРНК пробы со ст. 3/24 с глубины 4 м выявило присутствие фильтрате водорослей, размеры которых соответствуют нано- и микроформам [2].
Регистрация высокой квантовой эффективности фотосистемы 2 в отсутствие лимитирования развития планктонных водорослей содержанием биогенных элементов ставит вопрос о причинах выявленного невысокого обилия фотоавтотрофного ФП. Возможно, такая ситуация обусловлена динамичностью гидрофизических условий в заливе, в частности интенсивным приливным перемешиванием, ветровым воздействием и выносом ФП из залива стоковым течением. Например, в случаях, когда верхний перемешиваемый слой больше эвфотической зоны, ФП испытывает дефицит световой энергии, и увеличение биомассы ФП не происходит [23, 26]. К тому же, при выносе в поверхностный слой ФП из слоев у нижней границы эвфотической зоны водоросли испытывают фотоингибирование, что также препятствует возрастанию биомассы ФП. Ветровое воздействие снижает вертикальную устойчивость вод, особенно в мелководных прибрежных районах, что ведет к увеличению протяженности верхнего перемешиваемого слоя и снижению доступности световой энергии для водорослей. Энергетические затраты водорослей на фотоакклимацию (увеличение клеточной концентрации пигментов) снижают их скорость роста [26]. Отсутствие увеличения биомассы ФП в результате периодического нарушения стратификации водного столба показано и для других водных экосистем [24, 42]. О значимости выноса ФП из залива стоковым течением свидетельствует тот факт, что наибольшая биомасса ФП в поверхностном слое обнаружена на станциях, расположенных у приливных фронтальных зон, которые являются барьерами, снижающими вынос ФП [1].
Помимо гидрофизических факторов, невысокое обилие ФП могут определять и биотические факторы, в частности пресс выедания растительноядным зоопланктоном. Так, зарегистрированная значительная доля феопигментов (28–58%) в суммарной концентрации пигментов при высокой квантовой эффективности фотосистемы 2 может быть обусловлена не только аллохтонными источниками феопигментов, но также и прессом выедания зоопланктоном [20, 34, 36].
В целом, суммарная биомасса ФП, биомасса фототрофных водорослей и биомасса пикоФП достоверно не отличались от таковых примерно в те же календарные сроки в 2012 г., когда температура и соленость поверхностного слоя изменялись в тех же пределах, что и в 2015 г. [3]. Это дает основание полагать, что полученные в настоящей работе оценки обилия ФП являются характерным для ФП Онежского залива в июне.
Особенности вертикального распределения ФП. Неравномерность распределения биомассы ФП, пикоФП и хлорофилла “а” с глубиной отмечалось не только в стратифицированных водах, но и в районах со слабой стратификацией водного столба, протяженным перемешиваемым слоем, где следовало бы ожидать равномерное распределение ФП по глубине. Это может быть обусловлено следующим обстоятельством. В самом начале развития термической стратификации в водах с большой глубиной перемешиваемого слоя стратификация может не регистрироваться в течение нескольких дней и даже недель. В этот период однородные вертикальные профили будут свидетельствовать о глубинном перемешивании [38, 47], тогда как “истинный” перемешиваемый слой, в котором сохраняется конвекция водных масс, уже становится гораздо тоньше [19], что способствует возрастанию биомассы ФП и формированию пиков на разных глубинах [30, 48].
Особенности оптических характеристик взвеси в Онежском заливе. Спектры поглощения взвешенных в воде Онежского залива частиц (рис. 6) значительно отличались от спектров поглощения, которые характерны для чистых культур клеток морского ФП. Для культур клеток в области около 440 нм обычно четко выражен максимум поглощения, и при движении от 440 нм к 400 нм интенсивность поглощения снижается [11, 15]. Для взвешенных частиц в водах Онежского залива мы не наблюдали уменьшения поглощения на участке 440–400 нм, во многих случаях интенсивность поглощения монотонно увеличивалась по направлению к 400 нм (рис. 6). Мы полагаем, что это обусловлено большим вкладом в поглощение частиц нефитопланктонного происхождения (терригенной взвеси) [4]. Спектр поглощения таких взвесей, как правило, характеризуется максимальным поглощением в коротковолновой области и уменьшением поглощения в длинноволновой области спектра.
Выявлена достоверная корреляция между измеренными значениями интенсивности флуоресценции хлорофилла Fo и площадью под полосой поглощения хлорофилла в спектре ICAM. Она характерна как для всего ФП (в нефильтрованных пробах воды), так и для пикопланктона (пробы фильтратов после фильтрации через фильтр с диаметром пор 2 мкм).
В спектрах поглощения пикопланктона на многих станциях и горизонтах обнаруживается максимумы в области от 700 до 800 нм. Такие максимумы поглощения в дальней красной области спектра имеют хлорофиллы “d” и “f” [22, 37]. Хлорофиллы “d” и “f” обнаружены у некоторых видов цианобактерий, обитающих в условиях с преобладанием инфракрасного света, таких как почва, строматолиты, тела других гидробионтов [17, 18, 21, 22, 28, 40, 41]. В настоящее время отсутствуют сведения о существовании планктонных цианобактерий (включая пикоформы), способных к синтезу хлорофиллов “d” и “f”. Это, в принципе, закономерно и ожидаемо, поскольку свет с такими длинами волн практически отсутствует в толще воды. Следует, однако, отметить, что у цианобактерии Chlorogloeopsis fritschii PCC 9212, выделенной из почвы, в плотных культурах при освещении видимым светом обнаружен синтез хлорофиллов “d” и “f” [17]. Авторы упомянутой работы полагают, что при высокой плотности самозатенение клеток в формирующихся конгломератах ведет к формированию микросреды с преобладанием дальнего красного света, что и обусловливает синтез хлорофиллов “d” и “f”. Выявление источников, ответственных за максимумы поглощения в дальней красной области спектра у пикоФП Белого моря, требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
В третьей декаде июня 2015 г. ФП в эвфотическом слое Онежского залива Белого моря характеризовался высокой квантовой эффективностью фотосистемы 2. Хорошее физиологическое состояние было присуще ФП в районах с разной термохалинной структурой вод и разным составом доминирующих таксонов. Квантовая эффективность фотосистемы 2 для пикофракции была ниже, чем у суммарного ФП. При хорошем физиологическом состоянии планктонных водорослей их суммарная биомасса была относительно невысокой, что в отсутствие лимитирования содержанием биогенных элементов может быть обусловлено динамичностью гидрофизических условий в заливе и прессом выедания.
Благодарности. Авторы выражают благодарность участникам экспедиции: О.В. Копелевичу, А.Н. Храпко, А.В. Григорьеву, М.А. Родионову, Е.Д. Добротиной и А.Е. Новихину.
Источник финансирования. Исследование выполнено за счет грантов Российского научного фонда (проект № 14-17-00800), предоставленного через Институт океанологии им. П.П. Ширшова РАН и РФФИ (проект № 16-05-00502).
Список литературы
Белевич Т.А., Ильяш Л.В., Зимин А.В. и др. Зависимость особенностей пространственного распределения летнего фитопланктона Онежского залива Белого моря от локальных гидрофизичеких условий // Вестн. МУ. Сер. 16: Биология. 2016. № 3. С. 27–33.
Белевич Т.А., Ильяш Л.В., Милютина И.А. и др. Обилие и видовой состав фототрофных пикоэукариот Онежского залива Белого моря // Вестн. МУ. Сер. 16: Биология. 2017. Т. 72. № 3. С. 128–134.
Ильяш Л.В., Белевич Т.А., Ступникова А.Н. и др. Влияние локальных гидрофизических условий на пространственную изменчивость фитопланктона Белого моря // Океанология. 2015. Т. 55. № 2. С. 241–251.
Кравчишина М.Д. Взвешенное вещество Белого моря и его гранулометрический состав // М.: Научный мир, 2009. 264 с.
Кравчишина М.Д., Буренков В.И., Копелевич О.В. и др. Новые данные о пространственно-временнóй изменчивости концентрации хлорофилла “а” в Белом море // Докл. АН. 2013. Т. 448. № 3. С. 342–348.
Кузнецова Н.И., Азизбекян Р.Р., Конюхов И.В. и др. Подавление процессов фотосинтеза цианобактерий и планктонных водорослей метаболитами бактерий Brevibacillus laterosporus // Докл. АН. 2007. Т. 421. № 2. С. 262–266.
Мамаев О.И. Термохалинный анализ вод Мирового океана. Л.: Гидрометеоиздат. 1987. 296 с.
Мордасова Н.В., Вентцель М.В. Особенности распределения фитопигментов и биомассы фитопланктона в Белом море в летний сезон // Комплексные исследования экосистемы Белого моря. М.: Изд-во ВНИРО, 1994. С. 83–92.
Пантюлин А.Н. Динамика, структура и водные массы // Система Белого моря. Т. II. Водная толща и взаимодействующие с ней атмосфера, криосфера, речной сток и биосфера / Отв. ред. Лисицын А.П. М.: Научный мир, 2012. С. 309–379.
Погосян С.И., Гальчук С.В., Казимирко Ю.В. и др. Применение флуориметра “МЕГА-25” для определения количества фитопланктона и оценки состояния его фотосинтетического аппарата // Вода: Химия и экология. 2009. № 6. С. 34–40.
Погосян С.И., Дургарян А.М., Конюхов И.В. и др. Абсорбционная спектроскопия микроводорослей, цианобактерий и растворенного органического вещества: измерения во внутренней полости интегрирующей сферы // Океанология. 2009. Т. 49. № 6. С. 934–939.
Погосян С.И., Конюхов И.В., Рубин А.Б.и др. Влияние дефицита азота на рост и состояние фотосинтетического аппарата зелёной водоросли Сhlamydomonas reinhardtii // Вода: химия и экология. М., 2012. № 4. С. 68–76.
Романенков Д.А., Зимин А.В., Родионов А.А. и др. Изменчивость фронтальных разделов и особенности мезомасштабной динамики вод Белого моря // Фундаментальная и прикладная гидрофизика 2016. Т. 9. № 1. С. 59—72.
Сапожников В.В., Аржанова Н.В., Мордасова Н.В. Гидрохимические особенности биопродуктивности и продукционно-деструкционные процессы в Белом море // Система Белого моря. Т. II. Водная толща и взаимодействующие с ней атмосфера, криосфера, речной сток и биосфера / Отв. ред. Лисицын А.П. М.: Научный мир, 2012. С. 433–473.
Шифрин К.С. Введение в оптику океана // Л.: Гидрометеоиздат, 1983. 280 с.
Arar, E.J., Collins G.B. Method 445.0 In vitro determination of chlorophyll “a” and pheophytin ain marine and freshwater algae by fluorescence // Washington, DC: U.S. Environmental Protection Agency, 1997.
Airs, R.L., Temperton, B., Sambles, C. et al. Chlorophyll f and chlorophyll “d” are produced in the cyanobacterium Chlorogloeopsis fritschii when cultured under natural light and near-infrared radiation // FEBS Lett. V. 588. 2014. P. 3770–3777.
Behrendt L., Larkum A.W., Norman A. et al. Endolithic chlorophyll “d”-containing phototrophs // The ISME Journal. 2011. V. 5. Iss. 6. P. 1072–1076.
Brainerd, K.E., Gregg M.C. Surface mixed and mixing layer depths // Deep Sea Res. 1995. Part I. V. 42. P. 1521–1543.
Carpenter S.R., Elser M.M., Elser J.J. Chlorophyll production, degradation, and sedimentation: Implications for paleolimnology // Limnol. Oceanogr. 1986. V. 31. P. 112–124.
Chen M., Li Y.Q., Birch D., Willows R.D. A cyanobacterium that contains chlorophyll “f”–“a” red-absorbing photopigment // FEBS Lett. 2012. V. 586. P. 3249–3254.
Chen M., Schliep M., Willows R.D. et al. A red-shifted chlorophyll // Science. 2010. V. 329. P. 1318–1319.
Chiswell S.M., Calil P.H.R., Boyd P. Spring blooms and annual cycles of phytoplankton: a unified perspective // J. Plankton Res. 2015. V. 37. Iss. 3. P. 500–508.
Daniels C.J., Poulton A.J., Esposito M. et al. Phytoplankton dynamics in contrasting early stage North Atlantic spring blooms: composition, succession, and potential drivers // Biogeosciences. 2015. V. 12. P. 2395–2409.
Erga S.R., Ssebiyonga N., Hamre B., Frette Q., Hovland E., Hancke K., Drinkwater K., Rey F. Environmental control of phytoplankton distribution and photosynthetic performance at the Jan Mayen Front in the Norwegian Sea // J. of Marine Systems. 2014. V. 130. P. 193–205.
Falkowski P.G., Raven J.A. Aquatic photosynthesis // Princeton: Princeton University Press, 2007. 488 p.
Ferland J., Gosselin M., Starr M. Environmental control of summer primary production in the Hudson Bay system: The role of stratification // J. of Marine Systems. 2011. V. 88. P. 385–400.
Gan F., Bryant D.A. Adaptive and acclimative responses of cyanobacteria to far-red light // Environ. Microbiol. 2015. V. 17. P. 3450–3465.
Garrido M., Cecchi P., Vaquer A., Pasqualini V. Effects of sample conservation on assessment of the photosynthetic efficiency of phytoplankton using PAM fluorometry // Deep Sea Res., Part I. 2013. V. 71. P. 38–48.
Giering S.L.C., Sanders R., Martin A.P. et al. High export via small particles before the onset of the North Atlantic spring bloom // J. Geophys. Res. Oceans. 2016. V. 121. P. 6929–6945.
Hillebrand H., Dürselen C.D., Kirschtel D. et al. Biovolume calculation for pelagic and benthic microalgae // J. Phycol. 1999. V. 5. P. 403–424.
Hammer O., Harper D.A.T., Ryan P.D. Past: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. Iss. 1. Part 4. P. 1–9.
Huang S., Wilhelm S.W., Harvey R. et al. Novel lineages of Prochlorococcus and Synechococcus in the global oceans // ISME J. 2012. V. 6. P. 285–297.
Klein B., Gieskes W.W.C., Kraay G.G. Digestion of chlorophylls and carotenoids by the marine protozoan Oxyrrhis marina studied by HPLC analysis of algal pigments // J. Plankton Res. 1986. V. 8. P. 827–836.
Kromkamp J.C., Forster R.M. The use of variable fluorescence measurements in aquatic ecosystems: differences between multiple and single turnover measuring protocols and suggested terminology // Eur. J. Phycol. 2003. V. 38. P. 103–122.
Litaker W., Duke C.S., Kenney B.E., Ramus J. Diel chl a and phaeopigments in a shallow tidal estuary: potential role of microzooplankton grazing // Mar. Ecol.: Prog. Ser. 1988.V. 47. P. 259–270.
Manning W.M., Strain H.H. Chlorophyll “d”, a green pigment of red algae // J. Biol. Chem. 1943. V. 151. P. 1–19.
Marshall J., Schott F. Open-ocean convection: Observations, theory, and models // Rev. Geophys. 1999. V. 37. Iss. 1. P. 1–64.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol. Oceanogr. 2000. V. 45. P. 569–579.
Miyashita H., Ikemoto H., Kurano N. et al. Chlorophyll “d” as a major pigment // Nature. 1996. V. 383. P. 402.
Miyashita H., Ohkubo S., Komatsu H. et al. Discovery of chlorophyll “d” in Acaryochloris marina and chlorophyll “f” in a unicellular cyanobacterium, Strain KC1, Isolated from Lake Biwa // J. Phys. Chem. Biophys. 2014. V. 4. P. 149.
Nakane T., Nakaka K., Bouman H., Platt T. Environmental control of short-term variation in the plankton community of inner Tokyo Bay, Japan // Estuarine, Coastal Shelf Sci. 2008. V. 78. P. 796–810.
Parsons T.H., Takahashi M., Hargrave B. Biological oceanographic processes. Oxford: Pergamon, 1984. 330 p.
Röttgers R. Comparison of different variable chlorophyll a fluorescence techniques to determine photosynthetic parameters of natural phytoplankton // Deep-Sea Res., Part I. 2007. V. 54. P. 437–451.
Sieburth J.M., Smetacek V., Lenz J. Pelagic ecosystem structure: heterotrophic compartments of the plankton and their relationships to plankton size fractions // Limnol. Oceanogr. 1978. V. 23. P. 1256–1263.
Sherr E.B., Sherr B.F., Fessenden L. Heterotrophic protists in the Central Arctic Ocean // Deep Sea Res, Part II. 1997. V. 44. P. 1665–1682.
Taylor J.R., Ferrari R. Shutdown of turbulent convection as a new criterion for the onset of spring phytoplankton blooms // Limnol. Oceanogr. 2011. V. 56. Is. 6. P. 2293–2307.
Townsend D.W., Keller M.D., Sieracki M.E., Ackleson S.G. Spring phytoplankton blooms in the absence of vertical water column stratification // Nature. 1992. V. 360. Iss. 6399. P. 59–62.
Verity P.G., Robertson C.Y., Tronzo C.R. et al. Relationship between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton // Limnol. Oceanogr. 1992. V. 37. P. 1434–1446.
Wright S.W., Ishikawa A., Marchant H.J. et al. Composition and significance of picophytoplankton in Antarctic waters // Polar Biol. 2009. V. 32. P. 797–808.
Дополнительные материалы отсутствуют.


