Океанология, 2021, T. 61, № 2, стр. 250-263
Распределение и взаимоотношения гетеротрофных микроорганизмов и вирусов на шельфе Восточно-Сибирского моря
А. И. Копылов 1, *, Д. Б. Косолапов 1, Е. А. Заботкина 1, А. В. Романенко 1, А. Ф. Сажин 2
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
пос. Борок, Ярославская обл., Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: kopylov@ibiw.ru
Поступила в редакцию 10.06.2020
После доработки 18.06.2020
Принята к публикации 30.09.2020
Аннотация
В водах Восточно-Сибирского моря на меридиональном разрезе от устья р. Колыма в сентябре 2017 г. изучали распределение гетеротрофных бактерий, вирусов и гетеротрофных нанофлагеллят, определяли продукцию бактерий и их смертность в результате выедания простейшими и лизиса вирусами. Численность бактериопланктона снижалась по мере удаления от устья Колымы, размеры и биомасса бактерий, напротив, увеличивались вплоть до участков шельфа с отрицательными значениями температуры воды. Воды характеризовались высокой концентрацией мелкодисперсных детритных частиц, к которым была прикреплена значительная часть микроорганизмов и вирусов. Смертность гетеротрофного бактериопланктона составляла большую часть его суточной продукции. Основной причиной смертности бактерий было их выедание простейшими.
ВВЕДЕНИЕ
Гетеротрофные бактерии являются важнейшим компонентом планктонных трофических сетей, через который проходит большая часть потока углерода в водных экосистемах [21, 47]. Основными причинами смертности бактериопланктона являются его выедание простейшими, в первую очередь гетеротрофными нанофлагеллятами, и лизис вирусами. При потреблении бактерий простейшими значительное количество бактериального углерода поступает на более высокие уровни трофических сетей, а углерод бактериальных клеток, лизированных вирусами, пополняет запасы растворенного органического вещества (РОВ) и остается в пределах микробной петли [7, 32, 45].
В холодных полярных водах смертность гетеротрофного бактериопланктона, обусловленная вирусами-бактериофагами, варьирует в широких пределах: от <1 до 100% его продукции [26, 40, 48]. В разные сезоны в прибрежных и центральных районах Северного Ледовитого океана простейшие за сутки выедают от 6.7 до 152% суточной бактериальной продукции [37, 44]. Поэтому в зависимости от абиотических факторов водной среды, плотности и активности микроорганизмов и других факторов, функционирование микробных трофических сетей на разных участках арктических морей в разное время года имеет свои особенности [1].
Восточно-Сибирское море (ВСМ) — наименее изученное из морей Сибирской Арктики, что, прежде всего, связано с труднодоступностью, суровыми климатическими условиями и продолжительностью ледового периода. Это самое мелководное и одно из самых ледовитых арктических морей. Даже к концу лета оно на 65% покрыто льдом [6]. Глубина около 72% его акватории не превышает 50 м, а глубины менее 30 м занимают половину площади моря [15]. Реки, впадающие в ВСМ, характеризуются повышенной концентрацией взвешенных веществ. Две самые большие из них – Колыма и Индигирка – являются наиболее мутными среди крупных рек Российской Арктики [25]. Средняя концентрация взвеси в речном стоке в ВСМ составляет 134 г/м3, что в 3–7 раз больше, чем в реках, впадающих в другие моря Российской Арктики. Характерной чертой ВСМ является его низкая продуктивность [4]. Все эти условия оказывают существенное влияние на особенности структуры и функционирования микробных сообществ ВСМ.
Цель работы − в шельфовой зоне Восточно-Сибирского моря определить численность и биомассу бактериопланктона, вириопланктона и гетеротрофных нанофлагеллят, оценить степень инфицирования гетеротрофного бактериопланктона вирусами, его продукцию и смертность в результате вирусного лизиса и выедания простейшими.
МАТЕРИАЛ И МЕТОДЫ
Сбор материала был осуществлен в ходе 69-го рейса НИС “Академик Мстислав Келдыш” 8–9 сентября 2017 г. в шельфовой зоне Восточно-Сибирского моря на разрезе, состоящем из 5 станций, от устья р. Колыма (ст. 5619, 70°25.98′ с.ш., 163°04.159′ в.д.) до зоны внешнего шельфа (ст. 5612, 74°28.02′ с.ш., 168°11.87′ в.д.) (рис. 1). Пробы воды отбирали с помощью зонда SBE 911 с комплексом “Rosett” SBE 32 с 5-литровыми пластиковыми батометрами Нискина. На каждой станции воду отбирали на 3–5 горизонтах.
Морскую воду для микроскопических исследований сразу после отбора фиксировали 25% глутаровым диальдегидом до конечной концентрации в пробе 1%, хранили в темноте при температуре 4°C и обрабатывали в лаборатории в течение 2 мес. Численность и размеры бактерий определяли методом эпифлуоресцентной микроскопии с использованием флуоресцентного красителя DAPI и черных ядерных фильтров (ОИЯИ, Россия) с диаметром пор 0.17 мкм [36]. Бактерий учитывали с помощью микроскопа Olympus BX51 (Olympus, Japan), соединенного с цифровой камерой “ColorView III” и персональным компьютером. Изображение преобразовывали в цифровую форму с помощью программного обеспечения “CellF” и использовали для последующего подсчета и измерения бактериальных клеток различной морфологии. На каждом фильтре считали не менее 400 и измеряли не менее 100 клеток бактерий. Сырую биомассу бактерий вычисляли путем умножения их численности на средний объем клеток. Содержание углерода в бактериальных клетках (С, фг С/кл) рассчитывали с использованием аллометрического уравнения: С = 120 V 0.72 [34]. На этих же фильтрах подсчитывали количество детритных частиц, имеющих размеры от 0.3 до 30 мкм. Принимали, что содержание органического углерода в детрите приблизительно составляло 5%.
Скорость размножения и продукцию гетеротрофного бактериопланктона определяли методом “разбавления” по изменению его численности в изолированных пробах воды, инкубируемых в течение 36–40 ч в климатической камере при температуре in situ. Для устранения бактериотрофных организмов пробы морской воды разбавляли в 10 раз водой, профильтрованной через мембранный фильтр (ОИЯИ, Россия) с диаметром пор 0.17 мкм [23]. Эксперименты проводили в трехкратной повторности. Удельную скорость роста бактерий (μ, ч–1) вычисляли по формуле: μ = (ln Nt – ln No)/t, где No и Nt – численности бактерий в начале и конце инкубации, t – время инкубации, часы. Продукцию бактериопланктона (PВ, мг С/(м3 сут) или кл/(мл сут)) рассчитывали как произведение удельной скорости роста и биомассы (или численности) бактерий в неразбавленной морской воде. Время удвоения численности бактериопланктона (Td, ч) вычисляли как: Td = ln 2/μ.
С помощью метода “разбавления” определяли также удельную скорость элиминации бактерий в результате выедания простейшими и лизиса вирусами (g, ч–1) по разнице между удельными скоростями роста бактерий в разбавленной и неразбавленной пробах морской воды. Убыль, включающую скорость отмирания (смертность) бактериопланктона (МВ, мг С/(м3 сут)), рассчитывали по формуле: МВ = BВ g × 24.
Численность вириопланктона определяли методом эпифлуоресцентной микроскопии с использованием флуорохрома SYBR Green I и фильтров из оксида алюминия Anodisc (Wathman) с диаметром пор 0.02 мкм [33]. Вирусы учитывали с помощью эпифлуоресцентного микроскопа Olympus BX51 (Olympus, Япония) при увеличении ×1000 с системой анализа изображений. На каждом фильтре подсчитывали не менее 400 вирусных частиц. Содержание углерода в 1 вирусной частице принимали равным 0.055 фг С [40].
Для определения частоты видимых инфицированных вирусами гетеротрофных бактерий (Frequency of visibly infected cells, FVIC) и среднего количества зрелых фагов в инфицированных бактериях (Burst size, BS), численности вирусов, прикрепленных к бактериальным клеткам и детритным частицам, и размера капсидов вирусов применяли метод электронной трансмиссионной микроскопии. Вирусы и бактерии осаждали центрифугированием при 100 000 g (35 000 об/мин) в течение 2 ч с использованием ультрацентрифуги OPTIMA L-90k (Beckman Coulter, США) на никелевые сеточки плотностью 400 мешей, покрытые пиолоформом с угольным напылением. Сеточки просматривали в электронном микроскопе JEM 1011 (Jeol, Япония) при увеличении ×50 000–150 000. Для каждой пробы готовили две сеточки. На каждом препарате учитывали не менее 800 клеток бактерий.
Для расчета доли всех инфицированных клеток бактерий (Frequency of infected cells, FIC) использовали уравнение: FIC = 7.1 FVIC – 22.5 FVIC 2 [16]. Долю бактерий, погибших в результате вирусного лизиса, в общей смертности бактериопланктона (Viral-mediated mortality of bacteria, VMB), определяли по формуле: VMB = (FIC + 0.6 FIC 2)/ (1 – 1.2 FIC) [16]. В расчетах использовали абсолютные значения FVIC и FIC. Скорость отмирания бактерий в результате вирусного лизиса (Viral-induced mortality of bacteria, VIM, кл/(мл сут) или мг C/(м3 сут)), рассчитывали как VIM = = VMB × МB, где МB − общая смертность бактериопланктона. Продукцию вириопланктона (PV, частиц/(мл сут)) вычисляли по уравнению PV = = BS × VIM, где VIM, кл/(мл сут). Время оборота численности вирусов получали делением их численности на продукцию. Скорость поступления в окружающую водную среду лабильных органических веществ лизированных вирусами бактериальных клеток находили по разнице между VIM и PV. Полученные величины, по-видимому, несколько завышены, так как в расчетах не учитывали энергетических трат вирусов на синтез белков капсидов и процессы репликации нуклеиновых кислот. Такие данные до сих пор отсутствуют в литературе.
Численность гетеротрофных нанофлагеллят (NHNF) определяли с использованием флуорохрома примулин и черных ядерных фильтров с диаметром пор 0.17 мкм [19]. Препараты просматривали при увеличении ×1000 под эпифлуоресцентным микроскопом Olympus BX51. Допускали, что содержание углерода в сырой биомассе гетеротрофных нанофлагеллят составляет 22% [18]. Усвояемость пищи у ГНФ принимали равной 0.7 [7].
При установлении зависимостей между параметрами был использован ранговый коэффициент корреляции Спирмена для уровня значимости 0.05.
РЕЗУЛЬТАТЫ
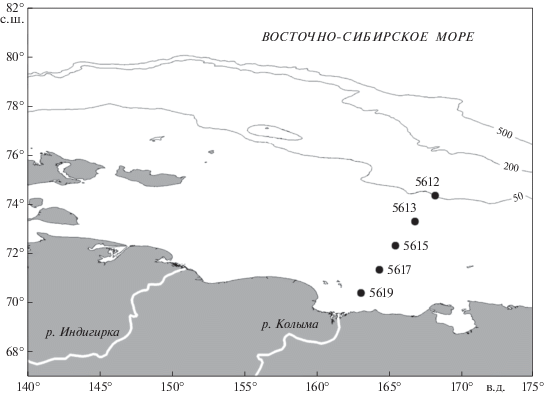
Температура, соленость и содержание в воде мелких детритных частиц. Значения температуры и солености, исследуемых шельфовых вод Восточно-Сибирского моря, варьировали в широком диапазоне: от 6.7 до –1.7°C и от 17.0 до 31.8 psu соответственно (рис. 2а, б). Соленость поверхностного слоя воды изменялась от 17.0 psu вблизи устья р. Колыма до 29.4 psu на наиболее удаленной от устья реки станции. На трех станциях разреза (ст. 5619, 5617 и 5615) температура воды от поверхности до дна была положительной, а на станциях 5613 и 5612 она изменялась от 0.5–3.4°С в поверхностном слое до –1.2–(–1.7)°С в придонном. Содержание в воде детритных частиц размером 0.3–2.5 мкм колебалось в пределах (115–3491) × 103 мл–1, достигая наиболее высоких значений в придонных горизонтах (рис. 2в). Средние для столба воды значения этого параметра постепенно снижались с удалением от устья реки (1219 ± 1520) × 103 мл–1 на ст. 5619 до (407 ± 414) × 103 мл–1 на ст. 5612. Концентрация более крупных детритных частиц размером 2.6–30 мкм изменялась от 4 × 103 до 301 × 103 мл–1, достигая наибольших значений в придонных горизонтах (рис. 2 г). Средние для столба воды значения этого параметра также снижались с удалением от устья реки; от (146 ± 105) × 103 мл–1 на ст. 5619 до (43 ± 29) × 103 мл–1 на ст. 5613 и (61 ± 20) × 103 мл–1 на ст. 5612.
Рис. 2.
Распределение температуры (а), солености (б) и детритных и минеральных частиц размером 0.3−2.5 (в) и 2.6−30.0 мкм (г) в шельфовых водах Восточно-Сибирского моря.
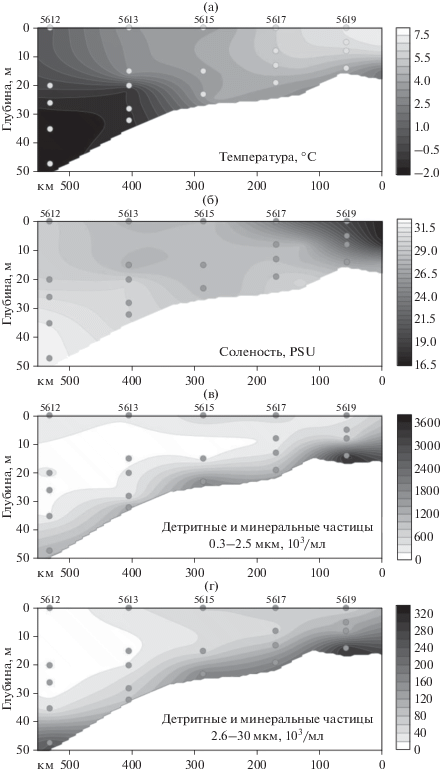
Численность и биомасса гетеротрофных бактерий, вирусов и гетеротрофных нанофлагеллят. Общая численность (NВ) и биомасса (ВВ) бактериопланктона изменялись в широких пределах (табл. 1). Минимальные и максимальные значения этих параметров различались в 3.5 и 6.9 раз соответственно. Наибольшие концентрации бактериопланктона на большинстве станций регистрировались в поверхностном слое воды и только на ст. 5612 – в придонном. Осредненное для пробы воды минимальное (0.052 мкм3) и максимальное (0.184 мкм3) значения среднего объема бактериальных клеток (VB) различались в 3.5 раза. Средние для столба воды значения VB на участке шельфа с положительной температурой воды увеличивались в направлении с юга на север, но уменьшались на ст. 5612, где температура воды была, в основном, отрицательной: 0.071 ± 0.009, 0.084 ± 0.019, 0.108 ± 0.032, 0.112 ± 0.041 и 0.078 ± ± 0.015 мкм3 соответственно. В результате средняя для столба воды NВ снижалась с увеличением расстояния от устья реки, а средняя для столба воды ВВ, напротив, увеличивались до участков шельфа с отрицательными значениями температурой воды (рис. 3). Соответственно, по разрезу от ст. 5619 до ст. 5613 наблюдалась тенденция к увеличению отношения BB к NB с удалением от берега, а также, в меньшей степени, от поверхности к глубине.
Таблица 1.
Общая численность и биомасса гетеротрофного бактериопланктона (NВ и ВВ), вириопланктона (NV и ВV) и гетеротрофных нанофлагеллят (NНNF и ВНNF)
| № ст. | Горизонт, м | NВ, × 103 кл/мл | BB/NB, ×10–12 мг С/кл |
BВ, мг С/м3 |
NV, ×103 частиц/мл | BV, мг С/м3 |
NНNF, ×103 кл/мл | BНNF, мг С/м3 |
|---|---|---|---|---|---|---|---|---|
| 5619 | 0 | 2094 | 18.1 | 37.9 | 10 256 | 0.6 | 556 | 3.3 |
| 5 | 1390 | 18.5 | 25.7 | 13 497 | 0.7 | 502 | 1.6 | |
| 8 | 1491 | 18.8 | 28.1 | 11 144 | 0.6 | 377 | 2.3 | |
| 17 | 591 | 15.2 | 9.0 | 6268 | 0.4 | 616 | 5.2 | |
| 5617 | 0 | 1545 | 24.4 | 37.7 | 5179 | 0.3 | 628 | 3.4 |
| 8 | 1022 | 19.9 | 20.3 | 5694 | 0.3 | 440 | 2.6 | |
| 13 | 827 | 16.4 | 13.6 | 3598 | 0.2 | 565 | 2.8 | |
| 22 | 623 | 18.1 | 11.3 | 4757 | 0.3 | 942 | 4.6 | |
| 5615 | 0 | 1171 | 29.5 | 34.5 | 3298 | 0.2 | 565 | 3.7 |
| 15 | 1334 | 23.1 | 30.8 | 4488 | 0.3 | 251 | 2.7 | |
| 27 | 777 | 19.3 | 15.0 | 5394 | 0.3 | 565 | 4.6 | |
| 5613 | 0 | 1769 | 35.3 | 62.5 | 4921 | 0.3 | 628 | 4.7 |
| 15 | 1519 | 23.1 | 35.1 | 4928 | 0.3 | 691 | 5.6 | |
| 20 | 710 | 22.0 | 15.6 | 5971 | 0.3 | 754 | 6.1 | |
| 28 | 980 | 23.0 | 22.5 | 5102 | 0.3 | 691 | 3.8 | |
| 33 | 1102 | 19.0 | 21.0 | 4344 | 0.2 | 816 | 6.0 | |
| 5612 | 0 | 946 | 22.5 | 21.3 | 4661 | 0.3 | 647 | 4.0 |
| 20 | 901 | 20.9 | 18.8 | 10 245 | 0.6 | 848 | 5.2 | |
| 26 | 708 | 16.1 | 11.4 | 13 821 | 0.7 | 785 | 6.7 | |
| 35 | 682 | 18.8 | 12.8 | 6585 | 0.4 | 1005 | 5.9 | |
| 47 | 1329 | 16.0 | 21.3 | 7055 | 0.4 | 1227 | 10.2 |
Рис. 3.
(а) − Средние для столба воды значения обшей численности (NВ, ×103кл/мл) (I) и биомассы (ВВ, мг С/м3) (II) бактериопланктона; (б) − доли (%) одиночных бактерий (1), бактерий на детритных частицах (2) и нитей (3) в NВ (I) и ВВ (II).

Доли одиночных бактерий, бактерий, ассоциированных с детритом, и бактериальных нитей в общей численности бактериопланктона изменялись в пределах 27.2−98.4 (в среднем 83.17 ± ± 20.70), 1.6−72.8 (в среднем 16.75 ± 20.71) и 0−0.3 (в среднем 0.08 ± 0.10)% соответственно, а в общей биомассе – 33.3−98.5 (в среднем 82.23 ± 19.81), 1.5−66.7 (в среднем 17.33 ± 19.90), 0−1.8 (в среднем 0.44 ± 0.55)% соответственно. Бактерии, прикрепленные к детритным частицам, вносили наибольший вклад в формирование общей численности и биомассы бактериопланктона в придонных горизонтах. Средние для столба воды доли бактерий, ассоциированных с детритом, в NB и ВВ уменьшались по мере удаления от устья реки (рис. 3). Количество детритных частиц размером 5–30 мкм, заселенных бактериями (на поверхности 1 частицы находилось от 4 до 17 бактерий), изменялось от 1.09 × 103 до 71.8 × 103 мл–1 (в среднем (20.7 ± 18.8) × 103 мл–1), что составляло от 17 до 40 (в среднем 26.1 ± 5.9)% общего количества детритных частиц данного размера. Средняя для столба воды численность этих частиц снижалась с удалением от устья р. Колыма: от (26.2 ± 20.0) × 103 мл–1 на ст. 5619 до (18.2 ± 30.1) × 103 мл–1 на ст. 5612. Наибольшая концентрация детритных частиц, заселенных бактериями, регистрировалась в придонных горизонтах воды.
Общая численность вирусов (NV) изменялась в широких пределах (табл. 1). На крайних станциях разреза (ст. 5619 и 5612) вертикальное распределение NV было неравномерным. Минимальные и максимальные значения NV на этих станциях различались в 2.2−3.0 раза, тогда как в середине разреза разница между этими значениями была меньше и составляла 1.4−1.6 раз (табл. 1). Наибольшие средние для столба воды NV были зарегистрированы на крайних станциях разреза (рис. 4).
Рис. 4.
(а) − Средняя для столба воды общая численность вириопланктона (NV, ×103 вирусов/мл), (б) − доли в NV (%) свободных вирусов (1), вирусов, прикрепленных к бактериям, (2) и вирусов, прикрепленных к детритным частицам (3).
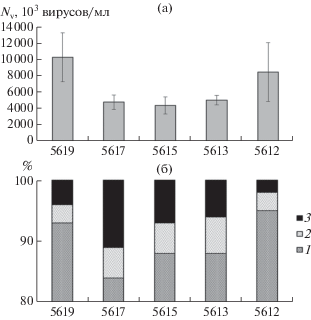
Общая численность вириопланктона превышала таковую бактериопланктона в 2.8−19.5 (в среднем в 6.7 ± 3.8) раз, а общая биомасса вириопланктона составляла 0.5−6.1 (в среднем 2.0 ± ± 1.4)% общей биомассы бактериопланктона. Между NV и NB обнаружена слабая положительная корреляция (r = 0.14).
На исследованном участке шельфа ВСМ доли свободных вирусов, вирусов, прикрепленных к бактериям и детритным частицам, в NV составляли 64.2−87.6 (в среднем 89.7 ± 8.7), 0.7−12.2 (в среднем 4.5 ± 2.8) и 0.7−35.0 (в среднем 5.8 ± ± 7.9)% соответственно.
Диаметр капсидов свободных вирусных частиц менялся от 15 до 263 нм. Средние для пробы воды диаметры капсидов находились в пределах 42−99 нм, а в среднем для всех проб диаметр капсида составил 56 ± 14 нм.
Численность бактерий с прикрепленными к их клеткам вирусами колебалась в пределах (61−331) × 103 (в среднем (184 ± 84) × 103) кл/мл или 12.0−33.0 (среднем 17.4 ± 3.4)% NВ. На поверхности одной клетки находилось от 1 до 10 вирусов, а в среднем для пробы воды – от 1.2 ± 0.3 до 1.6 ± 0.5 вирусов. Диаметр капсидов вирусов, прикрепленных к бактериям, составлял от 16 до 142 нм. В среднем для пробы воды эта величина колебалась в пределах 46−99 нм, а в среднем для всех проб диаметр капсида составлял 58 ± 14 нм.
Численность детритных частиц размером 0.3−2.5 мкм, имеющих на своей поверхности прикрепленные бактерии, колебалась в пределах (15−394) × 103 мл–1 (в среднем (127 ± 114) × 103) мл–1, что составляло 7.3−40.0 (в среднем 18.9 ± 9.1)% общей численности детритных частиц этого размера. На одной частице находилось от 1 до 15 вирусов, а в среднем для пробы воды – от 1.2 ± 0.4 до 8.0 ± 7.0 вирусов. Диаметр капсидов вирусов, прикрепленных к частицам детрита, колебался в пределах 21−109 нм, в среднем для пробы воды – в пределах 36−80 нм, а в среднем для всех проб составлял 48 ± 10 нм.
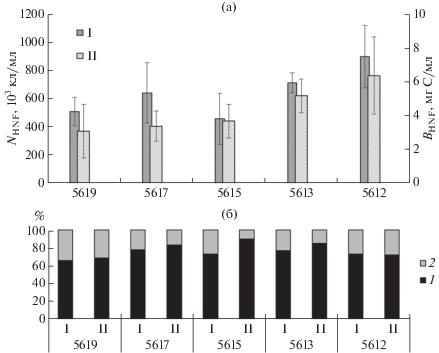
Численность гетеротрофных нанофлагелят (NНNF) изменялась в пределах 251−1227 (в среднем 671 ± 220) кл/мл, а отношение NВ/NНNF – в пределах 661−5315 (в среднем 1874 ± 1158). Средний для всех образцов воды объем клетки ГНФ составлял 31 ± 8 (диапазон 15−51) мкм3. Биомасса ГНФ (ВНNF) колебалась от 1.6 до 10.2 (в среднем 4.5 ± 1.9) мг С/м3, что составляло 6.2−58.8 (в среднем 23.0 ± 17.0)% биомассы бактериопланктона.
Численность и биомасса ГНФ, ассоциированных с взвешенными частицами размером 5− 30 мкм, составляли от 9.1 до 49.9 (в среднем 24.8 ± ± 11.5)% их общей численности и от 4.9 до 52.2 (в среднем 20.3 ± 12.8)% их общей биомассы. Количество детритных частиц, заселенных ГНФ, варьировало в диапазоне 63−739 (в среднем 236 ± ± 171) мл–1 и составляло 0.1−8.6 (в среднем 1.0 ± ± 1.9)% количества всех детритных частиц этого размера.
Средние для столба воды NНNF и ВНNF увеличивались в направлении с юга на север, достигая наибольшего значения на самой северной ст. 5612, расположенной на внешнем шельфе (рис. 5). В тоже время ГНФ, прикрепленные к детриту, вносили максимальный вклад в формирование общей численности и биомассы ГНФ на ближайшей к устью реки ст. 5619.
Рис. 5.
(а) – Средние для столба воды общая численность (NНNF, ×103кл/мл) (I) и биомасса (ВНNF, мг С/м3) (II) гетеротрофных нанофлагеллят; (б) – доли (%) свободных (1) и прикрепленных к детритным частицам (2) в NНNF (I) и ВНNF (II).
Смертность бактерий в результате вирусного лизиса и потребления гетеротрофными нанофлагеллятами. Частота видимых инфицированных вирусами бактерий (FVIC) изменялась от 0.5 до 1.6% и составляла в среднем 1.0 ± 0.4% NB (табл. 2). Корреляционный анализ данных не выявил взаимосвязей между FVIC и NV, FVIC и NB, FVIC и РВ. В то же время были установлены умеренная положительная корреляция между FVIC и долей бактерий с прикрепленными вирусами в общей численности бактериопланктона (r = 0.41) и умеренная отрицательная корреляция между FVIC и концентрацией детритных частиц размером 0.3−2.5 мкм (r = 0.47).
Таблица 2.
Частота видимых инфицированных бактерий (FVIC), частота инфицированных бактерий (FIC), вирус-индуцированная смертность бактерий (VMB) и среднее количество видимых фагов внутри бактериальных клеток (ВS)
| № ст. | Горизонт, м | FVIC, % NВ | FIC, % NВ | VMB, % MB | ВS *, фагов/клетку |
|---|---|---|---|---|---|
| 5619 | 0 | 1.2 | 8.2 | 9.5 | 4 |
| 8 | 0.5 | 3.5 | 3.7 | 9.0 ± 1.4 | |
| 17 | 0.5 | 3.5 | 3.7 | 10.3 ± 6.0 | |
| 5617 | 0 | 1.6 | 11.5 | 13.1 | 14.7 ± 15.9 |
| 8 | 1.0 | 6.9 | 7.8 | 11.3 ± 4.6 | |
| 13 | 1.6 | 11.5 | 13.1 | 5.0 ± 1.7 | |
| 22 | 1.0 | 6.9 | 7.8 | 5.8 ± 1.7 | |
| 5615 | 0 | 0.8 | 5.5 | 6.1 | 6.3 ± 4.0 |
| 15 | 0.8 | 5.5 | 6.1 | 6.0 ± 2.0 | |
| 27 | 0.7 | 4.9 | 5.3 | 5.0 ± 1.4 | |
| 5613 | 0 | 0.5 | 3.5 | 3.7 | 5.0 ± 1.4 |
| 15 | 1.5 | 10.1 | 12.3 | 6.2 ± 2.5 | |
| 33 | 0.7 | 4.9 | 5.3 | 5.7 ± 1.5 | |
| 5612 | 0 | 1.0 | 6.9 | 7.8 | 5.8 ± 1.0 |
| 20 | 1.3 | 8.9 | 10.4 | 12.2 ± 8.4 | |
| 47 | 1.0 | 6.9 | 7.8 | 7.3 ± 3.6 |
Доля всех зараженных вирусами бактерий в сообществе (FIC) составляла 3.5−11.5 (в среднем 6.8 ± 2.6)% NB. Вирус-индуцированная смертность (VMB) бактериопланктона составляла 3.7−13.1 (в среднем 7.7 ± 3.2)% МВ (табл. 2).
Анализ отношения численности бактерий с прикрепленными вирусами к численности видимых инфицированных бактерий показал, что на одну видимую инфицированную бактерию на разных глубинах приходилось от 9 до 41 (в среднем 20 ± 10) клетки, атакованной вирусами, т.е. попыток вирусов инфицировать бактерий.
Количество фагов в инфицированных бактериальных клетках (BS) колебалось от 4 до 47, составляя в среднем для всех инфицированных бактерий 7.7 ± 3.1. Средние для пробы воды значения этого показателя различались в 3.7 раза (табл. 2).
Среди инфицированных вирусами бактерий преобладали палочки, которые составляли в среднем 53.8 ± 15.4% численности всех инфицированных бактерий. Доли инфицированных кокков и коккобацилл, а также вибрионов составили 32.7 ± 17.2 и 13.4 ± 15.8% соответственно. Инфицированные нитевидные бактерии обнаружены не были.
Общая смертность бактерий (МВ) была выше в поверхностном горизонте водной толщи, чем в придонном (табл. 3). Отношение общей смертности бактериопланктона к его продукции (МВ/РВ) колебалось в пределах 47−81%, составляя в среднем 66 ± 12%. Основной причиной смертности бактерий в исследованном районе шельфа ВСМ было их выедание простейшими (гетеротрофными и миксотрофными флагелятами, инфузориями), которое составляло 86.9−96.3 (в среднем 92.2 ± 3.2%)% МВ. Скорость осветления воды сообществом простейших при потреблении бактерий изменялась в пределах 0.11−0.27 (в среднем 0.18 ± 0.05) мл/сут. Кроме бактерий из этого объема воды простейшие могли использовать в пищу детритные частицы, соизмеримые по размерам с бактериями. К значительной части этих мельчайших детритных частиц были прикреплены вирусные частицы, что увеличивало энергетическую ценность детрита. По нашим расчетам, простейшие потребляли от 17 ×103 до 284 ×103 (в среднем (111 ± 80) ×103) частиц/(мл сут). В верхних горизонтах масса детритных частиц составляла 1.2−27.8 (в среднем 12.3 ± 8.0)% биомассы потребленных бактерий. В придонном слое воды на ст. 5619 масса детритных частиц превышала биомассу бактерий в 3.2 раза, а в придонных горизонтах на остальных станциях разреза она составляла 54.5−96.0 (в среднем 71.8 ± 19.1)% биомассы бактерий, потребленных простейшими. Крупные (>0.2 мкм) вирусные частицы, которые потенциально могли служить пищевыми объектами для простейших, были обнаружены только в одной пробе воды. Однако простейшие потребляли вирусы, находящиеся на поверхности и внутри бактериальных клеток, а также прикрепленные к детритным частицам. Биомасса вирусных частиц, потребленных простейшими, составляла 0.1−1.6 (в среднем 0.4 ± 0.4)% биомассы потребленных бактерий.
Таблица 3.
Общая смертность бактерий (МВ), смертность бактерий в результате вирусного лизиса (VIМ), смертность бактерий в результате потребления простейшими (GВ), скорость потребления вирусов, ассоциированных с бактериями и детритными частицами (GV), скорость потребления детритных частиц простейшими (GD)
| № ст. | Горизонт, м | МВ | VIМ | GВ | GV | GD | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ×103 кл/ (мл сут) |
мг С/ (м3 сут) |
×103 кл/ (мл сут) |
мг С/ (м3 сут) |
×103 кл/ (мл сут) |
мг С/ (м3 сут) |
×103 вирусов/ (мл сут) | мкг С/ (м3 сут) |
×103 частиц/ (мл сут) |
мг С/ (м3 сут) |
||
| 5619 | 0 | 586 | 13.55 | 55 | 1.28 | 531 | 12.27 | 290 | 16 | 73 | 1.38 |
| 8 | 314 | 7.62 | 12 | 0.28 | 302 | 7.34 | 188 | 10 | 112 | 2.12 | |
| 17 | 70 | 1.20 | 3 | 0.04 | 67 | 1.16 | 127 | 7 | 284 | 3.81 | |
| 5617 | 0 | 427 | 14.03 | 56 | 1.84 | 371 | 12.19 | 799 | 44 | 123 | 1.64 |
| 8 | 171 | 4.43 | 13 | 0.35 | 157 | 4.08 | 163 | 9 | 40 | 0.76 | |
| 22 | 102 | 2.34 | 13 | 0.31 | 89 | 2.03 | 287 | 15 | 145 | 1.94 | |
| 5615 | 0 | 175 | 7.18 | 11 | 0.44 | 164 | 6.74 | 110 | 6 | 79 | 1.06 |
| 15 | 217 | 6.69 | 13 | 0.41 | 204 | 6.28 | 117 | 6 | 17 | 0.33 | |
| 27 | 112 | 2.78 | 6 | 0.15 | 106 | 2.63 | 206 | 11 | 256 | 2.66 | |
| 5613 | 0 | 382 | 19.50 | 14 | 0.72 | 368 | 18.78 | 164 | 9 | 48 | 0.88 |
| 15 | 348 | 10.71 | 43 | 1.32 | 305 | 9.39 | 258 | 14 | 26 | 0.58 | |
| 33 | 128 | 3.15 | 7 | 0.17 | 121 | 2.98 | 915 | 50 | 145 | 1.94 | |
| 5612 | 0 | 279 | 8.22 | 22 | 0.64 | 257 | 7.58 | 292 | 16 | 87 | 1.16 |
| 20 | 246 | 6.65 | 26 | 0.69 | 221 | 5.96 | 352 | 19 | 52 | 1.00 | |
| 47 | 227 | 4.48 | 18 | 0.35 | 210 | 4.13 | 316 | 17 | 182 | 2.44 | |
Продукция бактериопланктона и вириопланктона. Характер вертикального распределения продукции бактериопланктона (РВ) различался на разных станциях разреза (табл. 4). На ст. 5619, испытывающей наибольшее влияние речного стока Колымы, РВ на поверхности превышала таковую у дна в 5.1 раза (по численности) и 6.9 раза (по биомассе), тогда как на самой мористой ст. 5612 существенной разницы в величинах РВ на разных глубинах не наблюдалось. Удельная скорость роста бактерий на поверхности, за исключением ст. 5615, была выше, чем в придонном горизонте. Средние для столба воды значения РВ колебались в пределах (254−437) × 103 (в среднем (362 ± 77) × 103) кл/(мл сут) или 8.4−16.4 (в среднем 10.7 ± 3.4) мг С/(м3 сут), достигая наибольших значений на ст. 5613 и 5619. В придонном слое воды наблюдалась тенденция увеличения продукции бактериопланктона с удалением от устья реки при близких величинах удельной скорости роста и постепенным понижением температуры воды от 2.3 до –1.7°С.
Таблица 4.
Продукция бактериопланктона (РВ) и вириопланктона (РV), удельная скорость роста бактерий (μ1) и время оборота численности бактерий (ТВ) и вирусов (ТV)
| № ст. | Горизонт, м | РВ | μ, сут–1 | ТВ, сут | РV | ТV, сут | ||
|---|---|---|---|---|---|---|---|---|
| ×103 кл/(мл сут) | мг С/(м3 сут) | ×103 вирусов/(мл сут) | мкг С/(м3 сут) | |||||
| 5619 | 0 | 744 | 17.34 | 0.358 | 2.8 | 222 | 12 | 44 |
| 8 | 420 | 10.21 | 0.282 | 3.6 | 105 | 10 | 100 | |
| 17 | 146 | 2.52 | 0.275 | 4.0 | 26 | 1 | 205 | |
| 5617 | 0 | 573 | 18.81 | 0.371 | 2.7 | 840 | 46 | 5 |
| 8 | 327 | 8.48 | 0.320 | 3.1 | 151 | 8 | 35 | |
| 22 | 180 | 4.13 | 0.290 | 3.5 | 80 | 4 | 37 | |
| 5615 | 0 | 264 | 10.91 | 0.227 | 4.4 | 67 | 4 | 43 |
| 15 | 283 | 8.63 | 0.213 | 4.7 | 79 | 4 | 53 | |
| 27 | 221 | 5.47 | 0.284 | 3.5 | 30 | 2 | 146 | |
| 5613 | 0 | 532 | 27.15 | 0.301 | 3.3 | 71 | 4 | 62 |
| 15 | 498 | 15.35 | 0.328 | 4.0 | 257 | 14 | 18 | |
| 33 | 271 | 6.66 | 0.246 | 4.1 | 41 | 2 | 77 | |
| 5612 | 0 | 342 | 10.16 | 0.361 | 2.8 | 131 | 7 | 33 |
| 20 | 310 | 8.38 | 0.344 | 2.9 | 187 | 10 | 52 | |
| 47 | 331 | 6.52 | 0.249 | 4.0 | 216 | 12 | 30 | |
Продукция вириопланктона (РV) на ст. 5619 и 5617 (в наибольшей степени испытывающих влияние стока р. Колыма) регистрировалась в поверхностном горизонте водной толщи, а на наиболее мористой ст. 5612 – в придонном. Средняя для столба воды РV изменялась в пределах (59−359) × 103 (в среднем (167 ± 115) × 103) кл/(мл сут) или 3.3−19.3 (в среднем 9.3 ± 6.7) мкг С/(м3 сут) и достигала максимального значения на ст. 5617. Среднее для всех проб время оборота численности вириопланктона оказалось равным 64 ± 52 сут, что в 18 раз больше такового для бактериопланктона (3.6 ± 0.6 сут).
ОБСУЖДЕНИЕ
В период наблюдений исследуемый район Восточно-Сибирского моря находился под влиянием стока р. Колыма [15]. Вблизи устья реки наблюдалось существенное опреснение поверхностного слоя воды. По мере продвижения на север температура воды в поверхностном горизонте, оставаясь положительной, уменьшалась на порядок, тогда как соленость увеличивалась в 1.7 раз, а средняя для столба воды концентрация детритных частиц размером 0.3−30.0 мкм снизилась в 2.9 раз.
Наши исследования в ВСМ вдоль разреза от устья р. Колыма до области внешнего шельфа проводились в конце вегетационного сезона, когда происходило снижение фотосинтетической активности фитопланктона и отмирание гидробионтов [5]. В этот период содержание растворенного органического углерода (РОУ) изменялось от 1.51 до 13.93 мг С/л и составляло в среднем 4.18 мг С/л [15].
Величины численности, биомассы и продукции бактериопланктона в водах ВСМ находились в диапазоне колебаний, наблюдаемых в других арктических морях, в которых эти показатели варьируют в широких пределах в зависимости от района и сезона проведения исследований [9, 10, 13, 31, 41, 43]. Обычно высокими показателями обилия и продукции гетеротрофного бактериопланктона характеризуются эстуарии арктических рек, а их сток является важнейшим аллохтонным источником органического углерода и азота для морского бактериопланктона [24]. Количество и величина продукции бактерий, как правило, уменьшаются по мере удаления от эстуариев в открытые области морей и от поверхностных к глубинным слоям водной толщи.
Однако такая закономерность наблюдается не везде. Так, в эстуарной области р. Маккензи и прилегающем к ней районе моря Бофорта (Канадская Арктика) численность гетеротрофного бактериопланктона в летний период варьировала в пределах (570−1360) × 103 кл/мл, а его продукция – в пределах 1.8−10.0 мг С/(м3 сут) [43]. Авторами этой работы не было установлено различий в распределении и активности бактериопланктона между речной, эстуарной и морской областями, а также между поверхностными и придонными горизонтами воды. Важным компонентом сообщества, вносившим значительный вклад в формирование общей численности и продукции бактериопланктона, были клетки, ассоциированные с взвешенными частицами.
В прибрежных водах ВСМ, испытывающих влияние р. Колыма, значительное количество бактериопланктона было ассоциировано с мелкими (5−30 мкм) детритными частицами, в результате чего бактерии могли использоваться в качестве дополнительного источника пищи грубыми фильтраторами. Запасы растворенного и взвешенного органического вещества обеспечивали сравнительно высокие удельные скорости размножения бактерий, как в условиях положительной (0.301 ± ± 0.050 сут–1), так и отрицательной (0.280 ± ± 0.056 сут–1) температуры воды.
В ВСМ средняя продукция бактериопланктона под 1 м2 оказалась равной 217 ± 156 мг С/(м2 сут) и была существенно выше средней интегральной первичной продукции фитопланктона – 28 ± ± 13 мг С/(м2 сут) [4]. Допуская, что отношение продукции бактерий к их рациону составляет 0.27 [31], получаем, что на разных глубинах водной толщи гетеротрофный бактериопланктон потреблял от 9.3 до 101 (в среднем 40 ± 24) мг C/(м3 сут) и за сутки снижал концентрацию автохтонного и аллохтонного РОУ в среднем на 0.96%. Бактерии также тратили за сутки на энергетический обмен от 6.8 до 73.4 (в среднем 29 ± 18) мг C/м3, что составляло 0.69% концентрации РОУ [15].
Численность вириопланктона (NV), отношение численности вириопланктона к численности бактериопланктона (NV/NB), частота видимых инфицированных бактерий (FVIC) и вирус-индуцированная смертность бактерий (VMB) на шельфе ВСМ находятся в нижней половине диапазона этих параметров, обнаруженных в других районах Арктики (NV ((0.1−64.1) × 106 вирусов/мл), NV/NB (0.8−70.0), FVIC (0.2−5.2%), VMB (1.4−57.9%)), сопоставимы с таковыми в других сибирских арктических морях, но ниже таковых в продуктивных Баренцовом и Беринговом морях [3, 9–11, 17, 20, 22, 27–30, 32, 40, 41].
Исследованный район ВСМ характеризовался высоким содержанием в воде мелких детритных частиц. Их количество (в среднем (655 ± 791) × × 103 мл–1) было ниже численности одиночных бактерий (в среднем (887 ± 485) × 103 кл/мл) в 1.4 раза. Это оказалось причиной частых столкновений вирусов с частицами детрита, и, как следствие, сравнительно высокой численности вирусов, прикрепленных к детриту. Вирусы, присоединяясь к детриту, теряют свою активность, что в водах с высокой концентрацией взвешенных частиц уменьшает инфицирование бактериопланктона бактериофагами [46]. Это подтверждается отрицательной корреляцией между численностью мелких детритных частиц и частотой видимых инфицированных бактерий в шельфовых водах ВСМ.
Численность и биомасса планктонных гетеротрофных нанофлагеллят в период исследований были невысокими, составляли в среднем 671 ± ± 220 кл/мл и 4.5 ± 1.9 мг С/м3 соответственно и находились в пределах значений этих параметров, обнаруженных в других арктических морях [8, 12, 14, 37, 38].
ГНФ были прикреплены к большому количеству детритных частиц, что увеличивало энергетическую ценность детрита как пищевого объекта для гидробионтов. Отношение численности бактерий к численности ГНФ на большей части исследованной акватории ВСМ было высоким, что свидетельствовало о благоприятных трофических условиях для существования этих простейших.
Смертность бактерий в результате их выедания простейшими на всех глубинах водной толщи превышала их смертность от вирусного лизиса в 7−29 (в среднем в 15 ± 7) раз. В результате значительно больше углерода отмерших бактерий поступало в трофическую сеть, чем пополняло запасы РОВ и оставалось в пределах “микробной петли”. Данные немногочисленных исследований свидетельствуют о том, что в разных районах Северного Ледовитого океана зимой и весной выедание бактерий простейшими составляло в среднем 152 ± 159, и 31 ± 26% продукции бактериопланктона соответственно [44], а летом и в начале осени – 6.7−14.1% продукции бактериопланктона [37]. Ряд исследователей [40] полагают, что в Арктике значение вирусов в смертности бактериопланктона может быть эквивалентно его потреблению гидробионтами, а при низкой численности простейших гибель бактерий в результате вирусного лизиса может превышать их выедание [48].
Возможно, в шельфовых водах ВСМ гетеротрофные нанофлагелляты наряду с бактериями потребляли также детритные частицы (в том числе с прикрепленными вирусами), концентрация которых была высокой. Как было показано ранее, в экспериментальных исследованиях ГНФ способны использовать в качестве источника пищи мелкодисперсный детрит [35, 39].
Пикофитопланктон (прокариотные цианобактерии и эукариотные водоросли) также служат пищевыми объектами для гетеротрофных нанофлагеллят и других простейших [7]. По данным [2], в сентябре 2017 г. в поверхностном горизонте воды ВСМ средние численность и биомасса пикоцианобактерий оказались в пределах (0.25 ± 0.43) × × 109 кл/м3 и 0.12 ± 0.17 мг С/м3 соответственно. Средний вклад цианобактерий в общую численность и биомассу пикофитопланктона не превышал 7 и 6% соответственно. При средней скорости осветления воды 0.22 ± 0.06 мл/сут потребление пикоцианобактерий сообществом простейших в период проведения исследования составляло в среднем 55 кл/(мл сут) или 26 мкг С/(м3 сут), а эукариотного пикофитопланктона –730 кл/(мл сут) или 414 мкг С/(м3 сут). В итоге, по нашим расчетам, биомасса потребленного пикофитопланктона составила 3.8% биомассы потребленных бактерий и 38.1% массы потребленных детритных частиц.
Количество органического вещества, поступающего в воду из лизированных вирусами бактериальных клеток (в среднем 0.6 ± 0.4 мг C/(м3 сут)), было значительно ниже такового, выделяемого при питании бактериями простейших (в среднем 2.1 ± 1.4 мг C/(м3 сут)).
Суммарная скорость поступления органического вещества бактерий, неиспользованного вирусами и неусвоенного простейшими, составила 0.4−6.3 (в среднем 2.7 ± 1.8) мг C/(м3 сут). Это лабильное органическое вещество могло повторно использоваться гетеротрофными бактериями, обеспечивая 3.5–8.4 (в среднем 6.2 ± 1.4)% их суточных потребностей в углероде и на некоторых глубинах водной толщи могло быть для них важным источником субстратов.
ЗАКЛЮЧЕНИЕ
На разрезе в Восточно-Сибирском море от устья р. Колыма до области внешнего шельфа в конце вегетационного сезона выявлены особенности распределения и взаимоотношений гетеротрофных бактерий, нанофлагеллят и вирусов.
Значительное количество вирусов и микроорганизмов было прикреплено к детритным частицам размером 0.3−30 мкм, что связано, прежде всего, с высокой концентрацией последних. Микроорганизмы, ассоциированные с детритными частицами, увеличивали их энергетическую ценность и становились доступными для потребления крупными фильтраторами планктона. В то же время вирусы при столкновении с детритными частицами теряли активность, что снижало их воздействие на бактерий. Смертность гетеротрофного бактериопланктона, обусловленная, в основном, выеданием простейшими, составляла значительную часть его суточной продукции. Значения численности и биомассы бактериопланктона, вириопланктона и ГНФ, а также функциональных характеристик бактерий и вирусов в малопродуктивном ВСМ были сопоставимы с таковыми в более продуктивных море Лаптевых и Карском море.
Источник финансирования. Работа выполнена в рамках государственного задания (№ АААА-А18-118012690098-5) при финансовой поддержке РФФ-И (проект № 18-05-60069, 19-04-00322).
Список литературы
Беззубова Е.М., Селиверстова А.М., Замятин И.А., Романова Н.Д. Гетеротрофный бактериопланктон шельфа моря Лаптевых и Восточно-Сибирского моря в области влияния пресноводного стока // Океанология. 2020. Т. 60. № 1. С. 74−86. https://doi.org/10.31857/S0030157420010025
Белевич Т.А., Ильяш Л.В., Чульцова А.Л., Флинт М.В. Пространственное распределение планктонных пикоцианобактерий на шельфе Карского моря, моря Лаптевых и Восточно-Сибирского моря // Вестник Московского университета. Сер. 16. Биология. 2019. Т. 74. № 4. С. 247–253.
Венгер М.П., Копылов А.И., Заботкина Е.А., Макаревич П.Р. Влияние вирусов на бактериопланктон открытой и прибрежной части Баренцева моря // Биология моря. 2016. Т. 42. № 1. С. 19–26.
Демидов А.Б., Гагарин В.И. Первичная продукция и условия ее формирования в Восточно-Сибирском море в осенний период // Докл. АН. 2019. Т. 487. № 6. С. 696–700. https://doi.org/10.31857/S0869-56524876696-700
Дриц А.В., Пастернак А.Ф., Кравчишина М.Д. и др. Роль планктона в вертикальном потоке вещества на шельфе Восточно-Сибирского моря // Океанология. 2019. Т. 59. № 5. С. 746–754. https://doi.org/10.31857/S0030-1574595746-754
Думанская И.О. Ледовые условия морей Азиатской части России. Москва: “Социн”, 2017. 637 с.
Копылов А.И., Косолапов Д.Б. Микробная “петля” в планктонных сообществах морских и пресноводных экосистемах. Ижевск: “КнигоГрад”, 2011. 332 с.
Копылов А.И., Косолапов Д.Б., Заботкина Е.А. и др. Планктонные вирусы, гетеротрофные бактерии и нанофлагелляты в пресных и морских водах бассейна Карского моря (Арктика) // Биология внутренних вод. 2012. № 3. С. 15−24.
Копылов А.И., Сажин А.Ф., Заботкина Е.А. и др. Вирусы, бактерии и гетеротрофные нанофлагелляты в планктоне моря Лаптевых // Океанология. 2016. Т. 56. № 5. С. 869–878. https://doi.org/10.7868/S0030157416050051
Копылов А.И., Сажин А.Ф., Заботкина Е.А. и др. Вирио- и бактериопланктон в эстуарной зоне реки Обь и прилегающих районах шельфа Карского моря // Океанология. 2017. Т. 57. № 1. С. 118−127. https://doi.org/10.7868/S0030157417010051
Копылов А.И., Сажин А.Ф., Заботкина Е.А., Романова Н.Д. Вириопланктон Карского моря: влияние вирусов на смертность гетеротрофных бактерий // Океанология. 2015. Т. 55. № 4. С. 620−629. https://doi.org/10.7868/S0030157415040103
Косолапова Н.Г., Косолапов Д.Б., Копылов А.И., Романенко А.В. Гетеротрофные нанофлагелляты в пелагиали и донных отложениях восточной части моря Лаптевых // Океанология. 2019. Т. 59. № 6. С. 974−986. https://doi.org/10.31857/S0030-1574596974-986
Романова Н.Д., Сажин А.Ф. Бактериопланктон шельфовой части Карского моря // Океанология. 2015. Т. 55. № 6. С. 949–954. https://doi.org/10.7868/S0030157415060179
Романова Н.Д., Мазей Ю.А., Тихоненков Д.В. и др. Сообщества гетеротрофных микроорганизмов на границе “вода–дно” в Карском море // Океанология. 2013. Т. 53. № 3. С. 375–386. https://doi.org/10.7868/S0030157413030106
Экосистемы морей Российской Арктики. Материалы экспедиционных исследований 2015 и 2017 гг. М.: ИО РАН, 2018. 232 с.
Binder B. Reconsidering the relationship between virally induced bacterial mortality and frequency of infected cells // Aquat. Microb. Ecol. 1999. V. 18. P. 207−215. https://doi.org/10.3354/ame018207
Boras J.A., Sala M.M., Arrieta J.M. et al. Effect Of Ice Melting On Bacterial Carbon Fluxes Channeled By Viruses And Protists In The Arctic Ocean // Polar Biol. 2010. V. 33. P. 1695–1707. https://doi.org/10.1007/s00300-010-0798-8
Børsheim K.Y., Bratbak G. Cell volume to carbon conversion factors for bacterivorous Monas sp. enriched from seawater // Mar. Ecol. Prog. Ser. 1987. V. 36. P. 171−175. https://doi.org/10.3354/meps036171
Caron D.A. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy and comparison with other procedures // Appl. Environ. Microbiol. 1983. V. 46. № 2. P. 491−498. PMID:. 16 346 372
Clasen J.L., Brigden S.M., Payet J.P., Suttle C.A. Evidence that viral abundance across oceans and lakes is driven by different biological factors // Freshwater Biol. 2008. V. 53. P. 1090−1100. https://doi.org/10.1111/j.1365-2427.2008.01992.x
Cole J.J., Findley S., Pace M.L. Bacterial production in fresh and saltwater ecosystems: a cross-system overview // Mar. Ecol. Prog. Ser. 1988. V. 43. P. 1−10. https://doi.org/10.3354/meps043001
De Corte D.S., Yokokawa T., Herndl G.J. Changes in viral and bacterial communities during the ice-melting season in the coastal Arctic (Kongsfjorden, Ny-Ålesund) // Environ. Microbiol. 2011. V. 13. № 7. P. 1827–1841.https://doi.org/10.4319/lo.2013.58.2.0465
Ducklow H.W., Hill S.M. The growth of heterotrophic bacteria in the surface waters of warm core rings // Limnol. Oceanogr. 1985. V. 30. № 2. P. 239–259. https://doi.org/10.4319/lo.1985.30.2.0239
Garneau M.-È.,Vincent W.F., Alonso-Sáez L. et al. Prokaryotic community structure and heterotrophic production in a river-influenced coastal arctic ecosystem // Aquat. Microb. Ecol. 2006. V. 42. P. 27–40. https://doi.org/10.3354/ame042027
Gordeev V.V., Martin J.M., Sidorov J.S., Sidorova M.V. A reassessment of the Eurasian river input of water, sediment, major elements, and nutrients to the Arctic Ocean // Amer. J. Sci. 1996. V. 296. P. 664–691. https://doi.org/10.2475/ajs.296.6.664
Guixa-Boixereu N., Vaqué D., Gasol J. M. et al. Viral distribution and activity in Antarctic waters // Deep-Sea Res. Part II. 2002. V. 49. P. 827–845. https://doi.org/10.1016/S0967-0645(01)00126-6
Hodges L.R., Bano N., Hollibaugh J.T., Yager P. Illustraing the importance of particulate organic matter to pelagic microbial abundance and community structure – an Arctic case study // Aquat. Microb. Ecol. 2005. V. 40. P. 217−227. https://doi.org/10.3354/ame040217
Howard-Jones M.H., Ballard V.D., Allen A.E. et al. Distribution of bacterial biomass and activity in the marginal ice zone of the central Barents Sea during summer // J. Mar. Syst. 2002. V. 38. P. 77−91. https://doi.org/10.1016/S0924-7963(02)00170-7
Kopylov A.I., Zabotkina E.A., Romanenko A.V. et al. Virioplankton of the Kara Sea and the Yenisei River estuary in early spring // Est. Coast. Shelf Sci. 2019. V. 217. P. 37−44. https://doi.org/10.1016/j.ecss.2018.10.015
Maranger R., Vaqué D., Nguyen D. et al. Pan-Arctic patterns of planktonic heterotrophic microbial abundance and processes: controlling factors and potential impacts of warming // Prog. Oceanogr. 2015. V. 139. P. 221− 232. https://doi.org/10.1016/j.pocean.2015.07.006
Meon B., Amon R.M.W. Heterotrophic bacterial activity and fluxes of dissolved free amino acids and glucose in the arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquat. Microbial. Ecol. 2004. V. 37. P. 121–135. https://doi.org/10.3354/ame037121
Middelboe M., Nielsen T.G., Biorsen P.K. Viral and bacterial production in the North Water in situ measurements batch-culture experiments and characterization of a viral-host system // Deep Sea Res. 2002. V. 49. P. 5063−5079. https://doi.org/10.1016/S0967-0645(02)00178-9
Noble R.T., Fuhrman J.A. Use of SYBR Green for rapid epifluorescence count of marine viruses and bacteria // Aquat. Microb. Ecol. 1998. V. 14. P. 113−118.
Norland S. The relationship between biomass and volume of bacteria // Handbook of Methods in Aquatic Microbial Ecology. Boca Raton: Lewis Publ., 1993. P. 303–308.
Park S., Brett M.T., Müller-Navarra D.C. et al. Heterotrophic nanoflagellates and increased essential fatty acids during Microcystis decay // Aquat. Microb. Ecol. 2003. V. 33. P. 201–205. https://doi.org/10.3354/ame033201
Porter K.G., Feig Y.S. The use DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943−948. https://doi.org/10.4319/lo.1980.25.5.0943
Sherr E.B, Sherr B.F., Fessenden L. Heterotropic protists in the central Arctic Ocean // Deep Sea Res. 1997. V. 44. P. 1665−1682. https://doi.org/10.1016/S0967-0645(97)00050-7
Sherr E.B., Sherr B.F., Wheeler P.A., Thompson K. Temporal and spatial variation in stocks of autotrophic and heterotrophic microbes in the upper water column of the central Arctic Ocean // Deep Sea Res., Part I. 2003. V. 50. P. 557−571. https://doi.org/10.1016/S0967-0637(03)00031-1
Scherwass A., Fischer Y., Arndt H. Detritus as a potential food source for protozoans: utilization of fine particulate plant detritus by a heterotrophic flagellate, Chilomonas paramecium, and a ciliate, Tetrahymena pyriformis // Aquat. Ecol. 2005. V. 39. P. 439–445. https://doi.org/10.1007/s10452-005-9012-4
Steward G.F., Fandino L.B., Hollibaugh J.T. et al. Microbial biomass and viral infections of heterotrophic prokaryotes in the sub-surface layer of the central Arctic Ocean // Deep Sea Res., Part I. 2007. V. 54. P. 1744− 1757. https://doi.org/10.1016/j.dsr.2007.04.019
Steward G.F., Smith D.C., Azam F. Abundance and production of bacteria and viruses in the Bering and Chukchi Seas // Mar. Ecol. Prog. Ser. 1996. V. 131. P. 287− 300. https://doi.org/10.3354/meps131287
Tremaine S.C., Mills A.L. Tests of the critical assumptions of the dilution method for estimating bacterivory by microeucaryotes // Appl. Environ. Microbiol. 1987. V. 53. № 12. P. 2914–2921. https://doi.org/10.1128/aem.53.12.2914-2921.1987
Vallières C., Retamal L., Ramlal P. et al. Bacterial production and microbial food web structure in a large arctic river and the coastal Arctic Ocean // J. Mar. Syst. 2008. V. 74. P. 756–773. https://doi.org/10.1016/j.jmarsys.2007.12.002
Vaque D., Guadavol O., Peters F. et al. Seasonal changes in planktonic bacterivory rates under the ice-covered coastal Arctic Ocean // Limnol. Oceanogr. 2008. V. 53. № 6. P. 2427−2438. https://doi.org/10.2307/40058333
Weinbauer M.G. Ecology of prokaryotic viruses // FEMS Microbiol. Rev. 2004. V. 28. № 2. P. 127−181. https://doi.org/10.1016/j.femsre.2003.08.001
Weinbauer M.G., Bettarel Y., Cattaneo R. et al. Viral ecology of organic and inorganic particles in aquatic systems: avenues for further research // Aquat. Microb. Ecol. 2009. V. 57. № 3. P. 321–341. https://doi.org/10.3354/ame01363
Wheeler P.A., Gosselin M., Sherr E. et al. Active cycling of organic carbon in the central Arctic Ocean // Nature. 1996. V. 380. P. 697–699. https://doi.org/10.1038/380697a0
Wells L.E., Deming J.W. Significance of bacterivory and viral lysis in bottom waters of Franklin Bay, Canadian Arctic, during winter // Aquat. Microb. Ecol. 2006. V. 43. P. 209−221. https://doi.org/10.3354/ame043209
Дополнительные материалы отсутствуют.