Океанология, 2021, T. 61, № 3, стр. 387-400
Влияние речного стока на гидрохимические характеристики вод Удской губы и залива Николая (Охотское море) в летний сезон
П. Ю. Семкин 1, *, П. Я. Тищенко 1, Г. Ю. Павлова 1, С. Г. Сагалаев 1, П. П. Тищенко 1, Н. Д. Ходоренко 1, Е. М. Шкирникова 1, М. Г. Швецова 1
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
Владивосток, Россия
* E-mail: pahno@list.ru
Поступила в редакцию 03.09.2019
После доработки 24.09.2020
Принята к публикации 14.02.2021
Аннотация
Представлены результаты экспедиции ТОИ ДВО РАН, проведенной в июле 2016г. в зонах смешения рр. Уда и Усалгин, которые в период паводка занимают бóльшую часть приемных бассейнов – Удскую губу и залив Николая соответственно. Оцененный расход рр. Уда и Усалгин составил 4390 и 173 м3/с соответственно, а эстуарные воды с соленостью до 8‰ распространялись от устьевых створов в приемные бассейны на расстояние 25 км и 2.5 км соответственно. Граница устьевого взморья, выделяемая по положению изогалины 30‰, в обеих зонах смешения находилась на расстоянии 85 км от устьевых створов. Речной сток – основной поставщик взвеси, ограничивал толщину фотического слоя и фотосинтез на ранней стадии зон смешения до солености воды ~24‰, где воды были источником СО2 для атмосферы. На поздней стадии зон смешения доминировала продукция, при этом акватория была стоком для атмосферного CO2. Главным источником неорганических форм биогенных веществ являлась минерализация автохтонного органического вещества, осевшего на дно приемных бассейнов. На поздней стадии зоны смешения было отмечено пониженное соотношение DISi/DIN < 1 и относительно низкое отношение DIN/DIP – в диапазоне 1.8–8.
ВВЕДЕНИЕ
Прибрежные морские акватории, заметно распресненные речным стоком – эстуарии [52], находятся в числе первых по экономической значимости для населения всего мира за счет ресурсов их экосистем [41]. Исследования гидрохимии вод эстуариев актуальны в связи с дестабилизацией экосистем морского шельфа в результате прибрежной эвтрофикации под влиянием речного стока [45, 50], особенно в густонаселенных районах [60]. Побережья дальневосточных морей относительно мало населены, однако антропогенное воздействие на шельфовые экосистемы Японского моря уже сопровождается формированием “мертвых зон” [26, 29]. В Охотском море отмечено снижение численности отдельных видов гидробионтов в результате антропогенного воздействия [39].
Акватории в районе Шантарского архипелага, находящиеся под влиянием речного стока – это уникальная экосистема, которая включает летний ареал полярного кита Balaena mysticetus Linnaeus, 1758 [12], белухи Delphinapterus leucas Pallas, 1776 [14] и других морских млекопитающих. Реки, впадающие в северо-западную часть Охотского моря, являются нерестовыми для лососей [7], в результате чего на их побережьях сосредотачивается множество медведей. Приливные осушки – это места кормления птиц, в том числе краснокнижных [11].
Факторы, определяющие гидродинамику и гидрохимические характеристики зоны смешения речных и морских вод, были рассмотрены в недавних работах по прибрежно-морским акваториям Японского [2, 5, 6, 22–24, 30, 31, 55, 58] и Охотского морей [3, 8, 25, 49]. В районе Шантарского архипелага только недавно были проведены комплексные исследования (гидрологические, гидрохимические, гидробиологические, геохимические) речных, эстуарных и морских вод в экспедиции ТОИ ДВО РАН летом 2016 г. [32]. В предшествующих публикациях по данному району [4, 53] изучали воды за пределами эстуариев и без учета устьевой области реки. В ряде публикаций, напротив, изучены исключительно речные воды [7, 36, 37].
Цель статьи – оценить влияние речного стока на гидролого-гидрохимические характеристики в Удской губе и в заливе Николая Охотского моря, кутовые части которых являются эстуариями рр. Уда и Усалгин соответственно. Эти реки различны по своим морфометрическим характеристикам, ландшафту речной долины и территории водосбора, но приемные бассейны этих рек сходны по величине приливов и климатическим условиям.
МАТЕРИАЛЫ И МЕТОДЫ
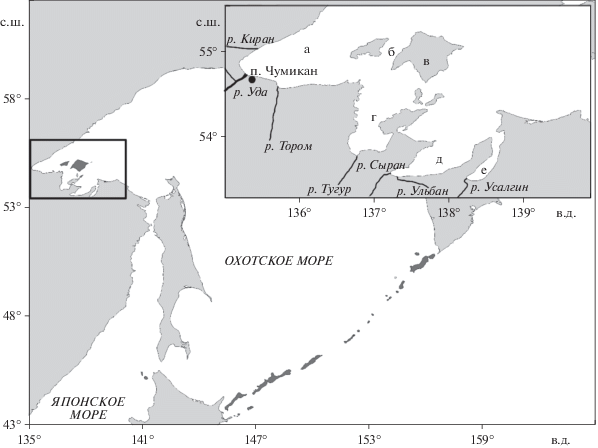
Наиболее значимые водотоки в районе Шантарского архипелага представлены на рис. 1, из которых р. Уда – крупнейшая и, среди рек Охотского моря, третья по величине расхода после рр. Амур и Пенжина [20].
Рис. 1.
Географическое положение изучаемого района. На вставке показана акватория Шантарского архипелага с обозначениями: а) Удская губа; б) Северный пролив; в) о. Большой Шантар; г) Тугурский залив; д) Ульбанский залив; е) залив Николая.
Река Уда от истока на хребте Джагды до устья, в кутовой части Удской губы (рис. 1) дренирует в основном горную, таежную местность. Среднегодовой расход воды составляет 510 м3/с [21]. Площадь водосбора реки – 61 300 км2 при длине 457 км. В водном режиме реки выделяются летне-осенние паводки в июле, августе и сентябре с суммарным объемом речного стока около 12 км3 за период трех месяцев при годовом стоке 16.096 км3/год [21].
В отличие от р. Уда, водосбор которой находится в горной местности, долина р. Усалгин представляет собой в основном заболоченную местность. Площадь водосбора реки – 2420 км2 при длине 142 км (Государственный водный реестр) от истока до устья в кутовой части залива Николая (рис. 1). При данной площади водосбора и годовом количестве осадков расчетный среднегодовой расход р. Усалгин будет составлять около 15 м3/с.
Изучаемые акватории относятся к макроприливным эстуариям [42], поскольку высота приливов в Удской губе достигает 9.7 м [10]. Термохалинные и гидрохимические характеристики приемных бассейнов рек в летний сезон формируются в результате интенсивного приливного перемешивания поверхностной, относительно теплой (с ядром на поверхности воды) и подповерхностной охотоморской (с отрицательной температурой в ядре на глубине около 50 м) водных масс [17, 33].
Антропогенные нагрузки на водосборы исследуемых акваторий в связи с труднодоступностью территории не выражены, по сравнению с ближайшими внутриматериковыми территориями Хабаровского края [11]. На берегах расположены только небольшие поселки, промысловые фермы и заводы по переработке лососей.
В рамках комплексной экспедиции на НИС “Профессор Гагаринский” в июле 2016 г. в исследуемых акваториях для зондирования и отбора проб воды применяли шестипозиционную пробоотборную систему воды SBE ECO-55 в комплекте с гидрологическим зондом SBE 19, оборудованным датчиками давления, температуры, электропроводности, флуоресценции и мутности. Концентрацию O2 определяли с помощью оптического датчика кислорода на дополнительном зонде Rinko-Profiler ASTD102 (JFE Advantech, Япония), который был откалиброван на основании данных, полученных методом Винклера. На глубинах менее 15 м работы проводили на моторной лодке, при этом для зондирования использовали зонд Rinko-Profiler ASTD102, а для отбора проб воды 5-литровые батометры Нискина. Пробы воды отбирали с поверхностного (глубина 0–0.5 м) и придонного (0.3–0.7 м от дна) горизонтов и доставляли на судно. В день отбора на борту судна выполняли определения: рН [28], общая щелочность (TA – Total Alkalinity) [1], концентрация главных биогенных веществ (растворенный кремний, фосфаты, нитраты, нитриты, аммоний) [13], проводили фильтрацию хлорофилла а. Анализ проб на соленость, общий азот и фосфор, растворенный органический углерод (РОУ), гумусовое вещество (ГВ – humic substance (HS)), концентрацию хлорофилла а, основной солевой состав проводили в лаборатории гидрохимии ТОИ ДВО РАН. Параметры карбонатной системы (pHin situ, DIC – растворенный неорганический углерод ${\text{(DIC}} = [{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}{\text{]}} + {\text{[HCO}}_{{\text{3}}}^{ - }{\text{]}} + {\text{[CO}}_{{\text{3}}}^{{ - {\text{2}}}}{\text{])}}$, pCO2-парциальное давление двуокиси углерода) были рассчитаны, используя измеренные величины рН, TA и концентрации гумусового вещества (спектрофотометрическим методом) [28]. Анализ общего азота и фосфора выполняли на автоматическом анализаторе Skalar San++. Содержание РОУ было измерено на анализаторе Shimadzu TOC-VCPN. Концентрации макроионов измеряли методом ионно-обменной хроматографии на хроматографе Shimadzu LC-20A. Концентрацию хлорофилла а и ГВ определяли спектрофотометрическим методом на спектрофотометре Shimadzu UV-3600.
РЕЗУЛЬТАТЫ
Гидрологические и гидрохимические характеристики речного стока
Река Уда впадает в Удскую губу сетью разветвленных водотоков с общей шириной устьевого створа с островами около 3.5 км [19]. Исследования в зоне смешения р. Уда были проведены в период летнего паводка с суммарным количеством осадков с первого июля до момента исследований 21.07.2016 – 116 мм по данным в селе Удское, в 82 км до устья (архив погоды https:www.RP5.ru). Эта величина осадков находится в диапазоне среднемесячных значений за многолетний период для июля и августа [21]. Поэтому результаты, представленные в данной статье, относятся к классической ситуации периода летнего паводка в данном районе, когда среднемесячный расход р. Уда в устьевом створе составляет около 1500 м3/с. Это приближенный расход, рассчитанный нами на основании среднемноголетнего объема речного стока, составляющего в июле приблизительно 4 км3. В настоящее время, согласно данным УГМС в г. Хабаровске, на единственном гидропосту в Тугуро-Чумиканском районе в селе Удское наблюдения проводятся только за уровнем воды р. Уда. Поэтому расход может быть только приближенно оценен на основании данных об этом уровне (https://gmvo.skniivh.ru/), количестве осадков на территории водосбора и площади этой территории. Наши исследования в данном районе были проведены в период с 19 по 21 июля после пика летнего паводка с максимумом уровня для этого года, который наблюдался 16.07.2016. Для оценки расхода р. Уда на момент отбора проб мы использовали расход р. Тауй Охотского моря с максимумом паводка 18.07.2016 и коэффициент связи между площадями водосбора рр. Уда и Тауй, равный 2.36. Это ближайшая к исследуемому району река, где ведутся измерения расхода воды, с близкой площадью водосбора – 25 900 км2, которая имеет сходный с р. Уда водный режим, однако удаленная на расстояние ~1000 км от нее. Согласно этой оценке, расход р. Уда в период летнего паводка на момент наших исследований составлял 4390 м3/с.
Река Усалгин впадает в залив Николая водотоком шириной до 700 м [18], который по нашим наблюдениям сокращается примерно до 100 м в момент малой воды в заливе Николая. Исходя из площади и количества осадков на территории водосбора, приближенный среднемесячный расход р. Усалгин в июле составляет 41 м3/с. Исследования в данном районе были проведены 16.07.2016, когда наблюдался пик летнего паводка в р. Уда с максимальным уровнем для этого года (https:// gmvo.skniivh.ru/) и интенсивный рост расхода воды в р. Тауй. Площадной коэффициент связи между рр. Усалгин и Тауй равен 0.093, а расчетный расход на период отбора проб составил 173 м3/с. Поэтому результаты, полученные в устьевой области р. Усалгин, относятся к максимальному стоку реки для данного года.
Гидрохимические характеристики вод р. Уда (табл. 1) были получены в момент малой воды в районе устьевого створа на устьевом баре правого притока, на берегу которого расположен пос. Чумикан. То есть зона смешения находилась за пределами устьевого створа реки. В р. Усалгин характеристики речных вод (табл. 1) получены в 7.5 км выше по течению реки от устьевого створа, в период отливной фазы в заливе Николая. В макрокомпонентом составе преобладали ионы натрия и хлорид-ионы при общей низкой минерализации речных вод, которая характерна для водотоков Шантарского архипелага (табл. 1). Это связано с влиянием моря на нижнее течение рек [36, 37], что особенно прослеживается в двукратном превышении концентраций ионов ${\text{C}}{{{\text{l}}}^{ - }}$ и ${\text{N}}{{{\text{a}}}^{ + }}$ в р. Уда по сравнению с р. Усалгин. Такое же превышение в концентрации ионов ${\text{C}}{{{\text{a}}}^{{2 + }}}$ и ${\text{M}}{{{\text{g}}}^{{2 + }}}$ (табл. 1) может быть связано с влиянием горных пород на водосборе р. Уда. Различие в ландшафте водосборов также отражается и на концентрациях биогенных веществ, параметрах карбонатной системы, концентрации общего органического вещества, гуминов и хлорофилла а (табл. 1), поскольку р. Усалгин дренирует болотистую местность.
Таблица 1.
Гидрохимические характеристики нижнего течения р. Уда 21.07.2016 и р. Усалгин 16.07.2016
| S | Cl– | ${\text{SO}}_{4}^{{2 - }}$ | Na+ | K+ | Ca2+ | Mg2+ | |
|---|---|---|---|---|---|---|---|
| Р. Уда | 59 | 536 | 57 | 507 | 22 | 181 | 112 |
| Р. Усалгин | 34 | 209 | 18 | 265 | 12 | 95 | 76 |
| P | P общ. | Si | ${\text{NO}}_{2}^{ - }$ | ${\text{NO}}_{3}^{ - }$ | ${\text{NH}}_{4}^{ + }$ | N общ. | |
| Р. Уда | 0.2 | 0.3 | 131.6 | 0.0 | 1.9 | 0.5 | 14.3 |
| Р. Усалгин | 1.1 | 4.6 | 126.2 | 0.1 | 2.1 | 2.7 | 15.5 |
| TA | pH | DIC | pCO2 | РОУ | ГВ | Chl/FTU | |
| Р. Уда | 410 | 7.039 | 504 | 1960 | 6.4 | 5.0 | 0.3/20 |
| Р. Усалгин | 192 | 6.852 | 265 | 1416 | 19.7 | 7.9 | 1.8/91 |
Примечание. S – соленость (мг/кг); ${\text{C}}{{{\text{l}}}^{ - }}$, ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$, ${\text{N}}{{{\text{a}}}^{ + }}$, ${{{\text{K}}}^{ + }}$, ${\text{C}}{{{\text{a}}}^{{2 + }}}$, ${\text{M}}{{{\text{g}}}^{{2 + }}}$ – концентрации (мкмоль/кг) макрокомпонентов; P, N, Si, ${\text{NO}}_{{\text{2}}}^{ - }$ ${\text{NO}}_{{\text{3}}}^{ - }$, ${\text{NH}}_{{\text{4}}}^{ + }$ – концентрации (мкмоль/кг) биогенных веществ; pH – pHin situ в шкале общей концентрации ионов водорода [46]; ТА – общая щелочность (мкмоль/кг); DIC – концентрация (мкмоль/кг) растворенного неорганического углерода; РОУ – концентрация (мгС/л) растворенного органического углерода; ГВ – концентрация (мгС/л) гумусового вещества; Chl – концентрация (мкг/л) хлорофилла а и мутность (FTU – Formazin Turbidity Unit); pCO2 (мкатм).
Гидрологические характеристики зон смешения
Горизонтальная изменчивость солености и температуры. Распресняющий эффект р. Уда и малых рек (Тыл, Тором, Ая, Киран) наблюдался на бóльшей части Удской губы в поверхностном слое, в период работ с 19.07.2016 по 21.07.2016 (рис. 2а). Внешняя граница устьевого взморья, определяемая по предельному положению поверхностной изогалины 30‰ в направлении, перпендикулярном устьевому створу, находилась в ~85 км от устьевого створа реки. При этом линза вод с соленостью менее 24‰, которая также могла быть связана с таянием мелкобитого льда в этом районе, распространялась в потоке общей циркуляции вод на расстояние более 100 км в северо-восточном направлении до Северного пролива (рис. 2а). Приняв соленость 8‰ в качестве внешней границы эстуария [16], эстуарием р. Уда следует считать кутовую часть Удской губы, на расстоянии 25 км от устьевого створа. Приближенная площадь максимального распространения эстуарных вод в Удской губе с соленостью до 8‰ составляла 900 км2 (длина периметра береговой линии и границы эстуарного барьера с соленостью 8‰ в сумме была 150 км). Общая площадь устьевого взморья, определяемая по предельному положению изогалины 30‰, составляла 4500 км2.
Рис. 2.
Соленость (а) и температура (б) поверхностного слоя воды акваторий Шантарского архипелага. Точками обозначены комплексные станции, выполненные в период с 11.07.2016 по 25.07.2016. Пунктирные линии объединяют станции, выполненные в Удской губе в период с 19 по 21 июля и в заливе Николая 16 июля, для представления вертикального распределения характеристик в зонах смешения.
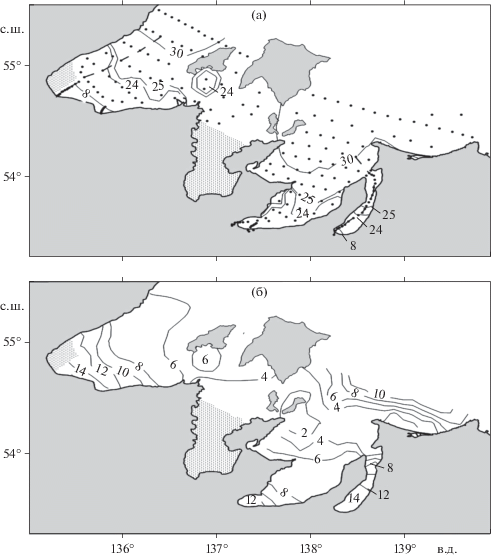
Внешняя граница устьевого взморья р. Усалгин в период наших исследований 16.07.2016 находилась за пределами залива Николая. Во всей акватории залива прослеживалось влияние берегового стока р. Усалгин и относительно небольших рек, впадающих в залив вдоль его восточного побережья. Воды с соленостью менее 24‰ распространялись на расстояние ~35 км от устьевого бара. Внешняя граница эстуария с соленостью вод 8‰ находилась на расстоянии ~2.5 км от устьевого створа реки. Для акватории залива Николая площадь эстуарных вод составляла около 25 км2.
Температура воды рр. Уда и Усалгин в период работ составляла соответственно 13.2 и 11.5°С. В это же время в мористом районе Удской губы и на входном створе в залив Николая температура поверхностного слоя воды принимала значения менее 6°С. В целом, контур распределения температуры соответствовал контуру распределения солености поверхностного слоя воды в изучаемых акваториях (рис. 2).
Вертикальная изменчивость солености и температуры. При имеющемся речном стоке и приливном перемешивании распреснение в Удской губе и в заливе Николая проявилось по всей глубине приемных бассейнов, до внешней границы устьевых взморьев (рис. 3а, 3в). При этом эстуарные воды с соленостью от 1 до 8‰ были распространены только на мелководье, а гораздо более протяженным эстуарий в Удской губе можно считать из-за отдельных линз эстуарных вод, на удалении около 15 и 25 км от устьевого створа реки (рис. 3а).
Рис. 3.
Соленость и температура в продольном профиле Удской губы (а, б) и залива Николая (в, г) соответственно. Отсчет расстояния от устьевого створа р. Уда в Удской губе и от крайней станции на разрезе в р. Усалгин в 7.5 км выше по течению от устьевого бара реки.
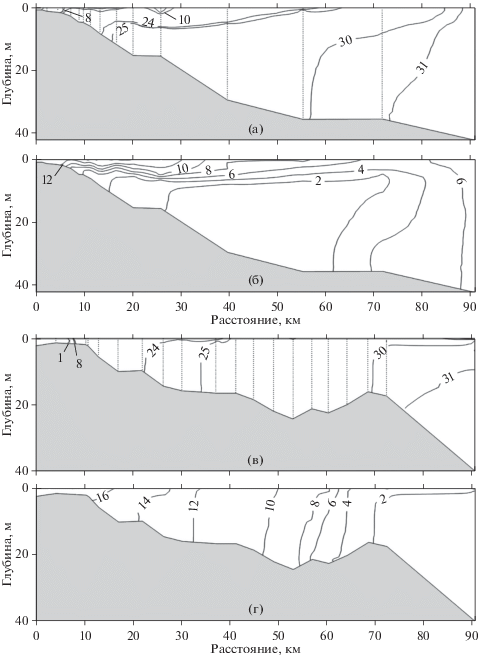
В зоне смешения р. Уда относительно теплые воды, сформированные под влиянием речного стока, наблюдались в основном в поверхностном слое, в то время как в заливе Николая они были распространены от поверхности до дна (рис. 3б, 3г). В центральной части Удской губы и мористей входного створа залива Николая температура большей части водной массы приемных бассейнов принимала значения в диапазоне 0–1.5°С. Данная водная масса, по-видимому, сформировалась в результате зимней конвекции, что характерно для всей подповерхностной охотоморской водной массы [17]. В целом, на продольных профилях в Удской губе и в заливе Николая эстуарные воды с соленостью до 8‰ включительно занимали менее 5% от общей водной массы. Зоны смешения вод с соленостью до 30‰ существовали по всей глубине на бóльшей части этих акваторий без значительных градиентов (рис. 3а, 3в).
Гидрохимические характеристики зон смешения
Параметры карбонатной системы. В процессе реакций продукционно-деструкционных процессов органического вещества (ОВ) происходит перераспределение компонентов карбонатной системы – ${\text{H}}{}_{{\text{2}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}$, ${\text{HCO}}_{{\text{3}}}^{ - }$, ${\text{CO}}_{{\text{3}}}^{{ - 2}}$, и изменение величины ее параметров pH, pCO2, TA, DIC [28]. Во время смешения речных и морских вод эти процессы приводят к отклонению от линейности на графике “концентрация–соленость” (“неконсервативная зависимость веществ”) [48], что можно видеть в результатах зависимости pH и pCO2 от солености (рис. 4а, 4б). Выделяется экстремум pH для эстуарных вод в Удской губе с соленостью 6.4‰ – 7.85 при pH речных вод – 7.04. Наибольшая величина pH для морских вод в зоне смешения р. Уда составляла 8.2, а наименьшая – 7.0. Величина pH в зоне смешения р. Усалгин систематически ниже, чем для зоны смешения р. Уда, что указывает на доминирование деструкции ОВ здесь, однако максимальная величина pH – 8.27 – наблюдалась в водах залива Николая. Наибольшая величина pCO2 была в диапазоне солености от 0.034 до 0.235‰ – 1400–2400 мкатм, а экстремум 2567 мкатм наблюдался в водах залива Николая с соленостью 5.1‰ (рис. 4б). После порога солености 24‰ значения pCO2 для обеих зон смешения на графике лежат ниже ${\text{pC}}{{{\text{O}}}_{{\text{2}}}}_{{{\text{атм}}}}$ (400 мкатм), в этом случае вода является стоком для атмосферного углекислого газа.
Рис. 4.
Зависимость параметров карбонатной системы от солености в зоне смешения р. Уда (1 – поверхностный горизонт, 2 – придонный горизонт) и Усалгин (3 – поверхностный горизонт, 4 – придонный горизонт): (а) – pH в шкале общей концентрации ионов водорода [46], (б) – парциальное давление углекислого газа (мкатм), (в) – общая щелочность (ммоль/кг), (г) – общий растворенный неорганический углерод (ммоль/кг). Пунктирная линия соответствует pCO2атм = 400 мкатм.
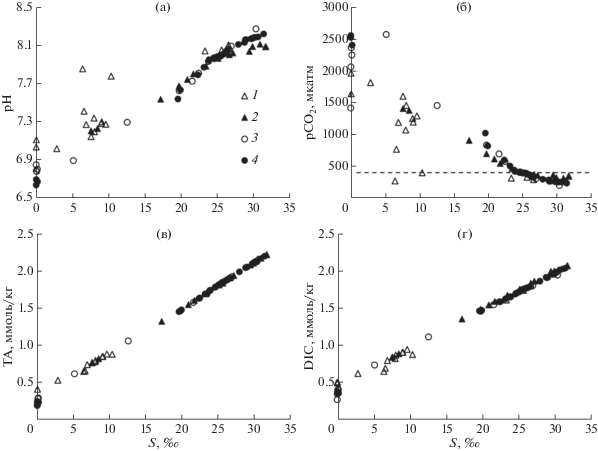
Зависимость DIC от солености воды в общих чертах повторяет зависимость щелочности от солености (рис. 4в, 4г). Изменчивость DIC от изменчивости ТА обычно отличается более значимым разбросом точек от линейной зависимости, что объясняется продукционными и деструкционными процессами в эстуарии.
Компоненты растворенного органического вещества и концентрация хлорофилла а. Химический состав РОУ условно можно разделить на два класса – ГВ и негуминовые (НГВ) вещества, содержание которых равно разности: НГВ = РОУ – ГВ (рис. 5а, 5б, 5в). Наибольший диапазон изменчивости разных форм РОУ отмечен в зоне смешения р. Усалгин, что связано с их высокой концентрацией в речных водах. Максимальная концентрация РОУ (22.6 мгС/л) наблюдалась при солености 0.2‰. Следует отметить близкие концентрации НГВ в обеих зонах смешения при солености от 1 до 25‰, в то время как концентрация ГВ значительно уменьшается в данном диапазоне солености – с 8 до 0.3 мгC/л.
Рис. 5.
Зависимость компонентов органического вещества и хлорофилла а от солености в зоне смешения р. Уда (1 – поверхностный горизонт, 2 – придонный горизонт) и р. Усалгин (3 – поверхностный горизонт, 4 – придонный горизонт): (а) – растворенный органический углерод; (б) – гуминовые вещества; (в) – негуминовое органическое вещество; (г) – хлорофилл а.
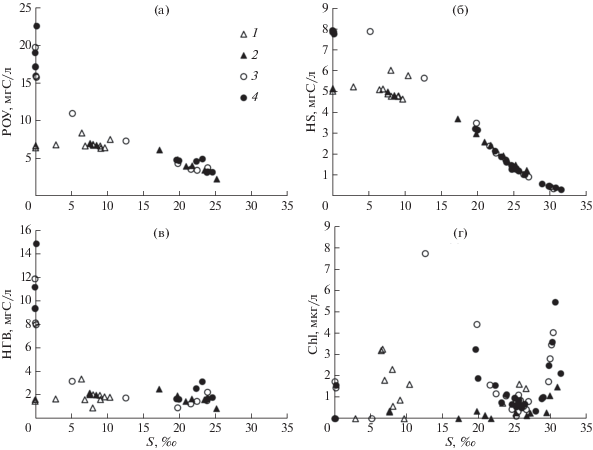
В распределении концентрации хлорофилла а (рис. 5г) в зоне смешения р. Уда выделяется экстремум – 3.24 мкг/л в поверхностных водах при солености 6.7‰, а также экстремумы – 1.60 мкг/л в поверхностном и в придонном слоях воды при солености соответственно 26 и 31‰. В водах залива Николая экстремумы хлорофилла а были более выражены, как в поверхностном слое при солености 12.6‰, так и в придонном слое – 5.4 мкг/л при солености более 30‰.
Биогенные вещества. На протяжении всей зоны смешения р. Уда отмечалось повышение общего фосфора (P общ.) при росте солености (рис. 6а). Для зоны смешения р. Усалгин наблюдалось снижение концентрации P общ. от речных вод до границы солоноватых вод – соленость ~24‰. После порога солености 24‰ возрастающие графики P общ. в диапазоне от 0.9 до 1.6 мкмоль/л для обеих зон смешения совмещались. В распределении общего азота (N общ.) от солености (рис. 6б), после порога солености 20‰ происходило уменьшение концентрации. До этой границы изменения N общ. были аналогичны изменчивости P общ. – рост концентрации в зоне смешения р. Уда и снижение концентрации в зоне смешения р. Усалгин. Зависимость растворенного неорганического фосфора (P) от солености во многом схожа для обеих зон смешения с зависимостью P общ. (рис. 6в).
Рис. 6.
Зависимость концентрации биогенных веществ (мкмоль/л) от солености в зоне смешения р. Уда (1 – поверхностный горизонт, 2 – придонный горизонт) и Усалгин (3 – поверхностный горизонт, 4 – придонный горизонт): (а) – общий фосфор, (б) – общий азот, (в) – фосфаты, (г) – нитраты, (д) – силикаты, (е) – аммонийный азот.
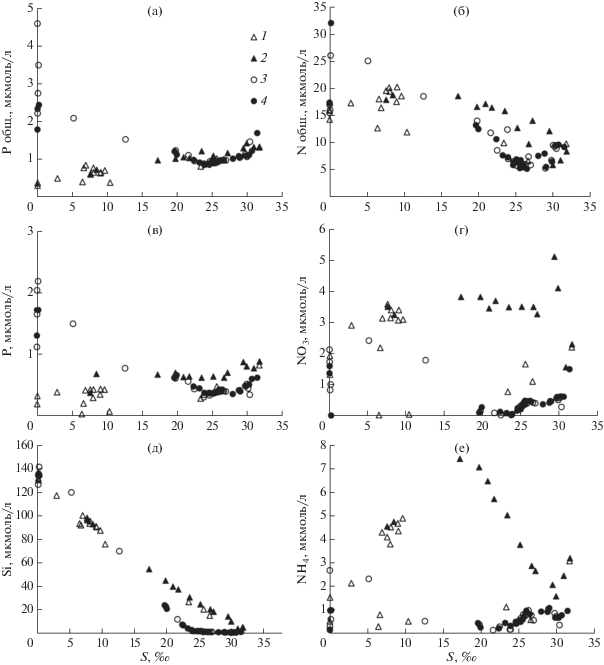
Относительно невысокие концентрации нитратного и аммонийного азота характерны для обеих зон смешения, с наибольшей концентрацией в солоноватой и морской водах в Удской губе, в то время как концентрация силикатов почти линейно снижается с ростом солености (рис. 6г–6е). В распределении нитратов выделяется экстремум – 5.11 мкмоль/л при солености 29.45‰. Также отмечены два экстремума в распределении аммонийного азота – 7.37 и 3.17 мкмоль/л при солености соответственно 17.2 и 31.7‰. Причем последний является общим для поверхностного и придонного слоя воды. В зоне смешения р. Усалгин концентрации нитратов и аммония снижалась практически до 0 при солености около 24‰, далее, по мере роста солености наблюдалось небольшое повышение (рис. 6г, 6е).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Важнейшим фактором экосистемы является интенсивность освещенности в водной толще, которая определяет направленность продукционно-деструкционных процессов в акваториях. В свою очередь, освещенность во многом зависит от мутности вод. В эстуариях с интенсивным приливным перемешиванием повышенная мутность может приводить к таким явлениям в экосистеме, как гипоксия [47]. В основном, повышенная мутность в зонах смешения вод характерна для эстуарного барьера в диапазоне солености 1–8‰, что связано с процессами коагуляции и флоккуляции [9]. Размыв берегов в результате динамических процессов также способствует повышению мутности вод, что отмечалось в гиперприливном эстуарии рр. Пенжина и Таловка Охотского моря в момент полной воды [8]. По нашим данным, наблюдается резкое увеличение мутности на начальном этапе смешения вод (рис. 7а), особенно для устьевой области р. Усалгин, где при солености воды 0.034, 0.055, 0.117‰ мутность составляла 91, 154, и 246 FTU соответственно. Для устьевой области р. Уда при солености 0.059 и 0.077‰ мутность составляла 18 и 71 FTU соответственно. Эти экстремумы, вероятно, связаны, прежде всего, с мутностью речной воды, а также с процессами флоккуляции на ранней стадии роста солености и динамическим взмучиванием в результате реверсивных приливных течений, усиливающихся по мере приближения к устьевому створу. Влияние динамического взмучивания на концентрацию взвеси в воде в большей степени следует ожидать в устьевой области р. Усалгин, где на расстоянии ~10 км перед устьевым створом берега сложены из торфа, глины, ила. Органические соединения и глинистые минералы в воде являются главными естественными сорбентами для формирования флоккул в сорбционной системе маргинального фильтра [9]. Высокие концентрации этих веществ в речных и эстуарных водах р. Усалгин в нашем случае, вероятно, и способствуют формированию экстремумов мутности на ранней стадии смешения вод еще до солености 1‰. В водах эстуария р. Уда побережье и дно нижнего течения и район устьевого створа реки сложены из гальки. Концентрация гуминовых веществ и общего растворенного органического углерода в р. Уда почти вдвое меньше, чем в р. Усалгин. Наибольший экстремум мутности – 129 FTU здесь проявился при солености 2.9‰, т.е. в пределах эстуарного барьера. По мере роста солености от ~10‰, т.е. за пределами эстуарного барьера, в водах Удской губы и залива Николая существенное снижение мутности сопровождалось увеличением толщины фотического слоя (рис. 7а, 7б). Толщина фотического слоя резко возрастала по мере удаления от устьевого створа при относительно малом падении мутности поверхностного слоя воды после солености 20‰ – на уровне менее 1 ед. FTU. Вероятно, в данном диапазоне солености вод условия освещенности в большей степени контролировались концентрацией окрашенного органического вещества (CDOM) – характеристикой, которая не регистрируется датчиком мутности. То есть на ранней стадии зоны смешения в пределах эстуария (соленость воды до 8‰) фотосинтез ограничен из-за повышенной мутности. Резкое изменение солености воды за короткий период времени из-за сочетания высокой водности рек и интенсивного приливного перемешивания губительно влияет на клетки фитопланктона, которые под действием осмотического давления разрушаются [35]. По-видимому, интенсивный адвективный водообмен не позволят выживать видам даже с высокой скоростью деления. Поэтому в наших исследованиях концентрация хлорофилла а для эстуарных вод (до 8‰) находилась на относительно низком уровне (рис. 5г).
Рис. 7.
Зависимость мутности (а), глубины фотического слоя (б), AOU (в) и НГВ/РОУ (г) от солености в зонах смешения рр. Уда и Усалгин в поверхностных (1, 3) и в придонных (2, 4) горизонтах соответственно.
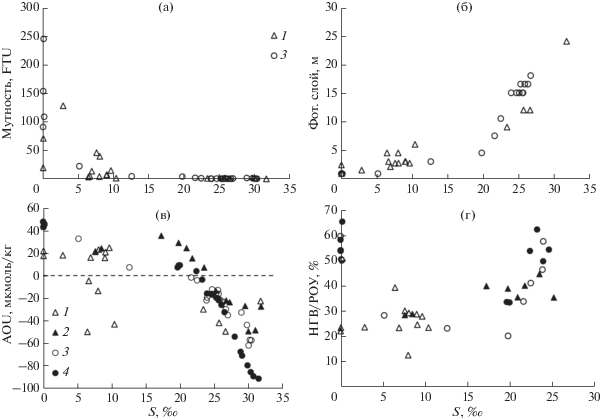
Судя по параметрам карбонатной системы (рис. 4), доминирование фотосинтеза над деструкцией органического вещества наблюдалось на поздней стадии смешения вод после эстуарного барьера, что подтверждается распределением AOU: где AOU – Apparent oxygen utilization – кажущееся потребление кислорода (рис. 7в). Отдельно для поверхностных вод выделялась только относительно узкая полоса зоны смешения в пределах и на границе эстуарного барьера р. Уда с соленостью 6.4 – 10.4‰, где AOU также находилась в отрицательном диапазоне. В целом, граница перехода величины pCO2 через пороговое значение 400 мкатм происходила при немного большей солености (24‰) (рис. 4б), чем для AOU (22‰) (рис. 7в). Эта разница может быть связана с дополнительным процессом – сезонным нагревом вод, который уменьшает AOU, но увеличивает pCO2 [27]. Зависимости pCO2 от солености для зон смешения обеих исследуемых рек (рис. 4б) имели схожий контур и незначительно отличались только соленостью, после которой величина pCO2 становилась меньше порогового значения 400 мкатм, когда акватория являлась стоком для атмосферного углекислого газа.
Концентрация веществ в зонах смешения рек во многом определяется возрастом вод [40, 43, 44] – временем, прошедшим с момента, когда речная вода покидает устье реки, где ее возраст равен нулю, до ее прибытия в какое либо место зоны смешения [56].
Длительный период адвективного обмена на поздней стадии зоны смешения предполагает медленное изменение солености вод и устойчивое развитие клеток фитопланктона, в условиях большой толщины фотического слоя. Обычно в зонах влияния рек поток биогенных веществ с речным стоком стимулирует продукцию фитопланктона [54], а на поздней стадии зоны смешения происходит ограничение фотосинтеза биогенными веществами [34]. В исследуемых нами районах общей закономерностью в распределении минеральных форм биогенных веществ являются относительно высокие их концентрации по мере роста солености по сравнению с концентрацией в речной воде, за исключением распределения силикатов (рис. 6). Сравнение концентраций общего фосфора и общего азота с минеральными формами указывает на то, что биогенные вещества в зонах смешения находятся в органической форме. Особенно это справедливо для азота. Концентрации неорганических форм в придонных горизонтах, как правило, больше соответствующих концентраций в поверхностных водах. Особенно это справедливо для Удской губы. Этот факт указывает на то, что главным источником неорганических форм биогенных веществ является минерализация органического вещества осевшего на дно приемного бассейна. В большей степени это проявляется для Удской губы, т.к. глубина бассейна больше в сравнении с заливом Николая. В отличие от речного стока Японского моря, дренирующего густонаселенные территории и приводящего к эвтрофикации прибрежных морских акваторий [5, 29, 31], сток рр. Уда и Усалгин обладает малыми концентрациями биогенных веществ (табл. 1). Рассчитанные потоки минеральных форм фосфора, азота и силикатов (табл. 2) для р. Уда соответственно в 7, 3 и 52 раза меньше в сравнении с потоками трансграничной р. Раздольной Приморского края, рассчитанными при расходе воды 1000 м3/с в паводок [15]. Потоки вещества с речным стоком р. Усалгин гораздо меньшие, чем для стока р. Уда в связи с меньшим расходом реки, несмотря на бóльшие их концентрации (табл. 1).
Таблица 2.
Среднесуточные потоки (тонн/сутки) с речным стоком растворенного неорганического фосфора (FDIP), азота (FDIN), кремния (FDISi); общего фосфора (FPtot) и азота (FNtot); органического углерода (FCorg) и взвешенного вещества (ВВ)
| Река | Расход | FDIP | FPtot | FDISi | FDIN | FNtot | FCorg | ВВ |
|---|---|---|---|---|---|---|---|---|
| Уда | 4390 | 2.35 | 3.53 | 1398 | 12.74 | 75.94 | 2428 | 7472 |
| Усалгин | 173 | 0.51 | 2.13 | 53 | 1.03 | 3.24 | 293 | 1360 |
Зависимость растворенного кремния от солености в исследуемых зонах смешения мало чем отличается от этой зависимости в приемных бассейнах Японского моря, поскольку концентрации в речных водах в обоих случаях очень высокие. Как было отмечено выше, концентрация DISi практически линейно уменьшается с увеличением солености для поверхностных и придонных вод, особенно это справедливо для Удского залива (рис. 6д). Исключением является район поздней стадии зоны смешения р. Усалгин после порога солености 24‰. В данной части зоны смешения отмечается неконсервативная зависимость силикатов от солености. Это может быть связанно с изъятием DISi в результате развития биомассы диатомовых водорослей, прикрепленных к донным отложениям (перифитон) в заливе Николая, где глубина бассейна примерно в два раза меньше, в сравнении с Удской губой, поэтому фотосинтетически активная радиация (ФАР) проникает до дна. Известно, что при приближении соотношения DISi : DIN к 1 : 1 происходит ограничение роста диатомовых [57, 59]. В наших исследованиях на границе зоны смешения р. Уда при солености более 30‰ DISi/DIN = = 0.9, DIN/DIP = 8. Для зоны смешения р. Усалгин при солености более 25‰ DISi/DIN = 1.2–0.5, при значительно низком DIN/DIP = 1.8–4, что связано с понижением концентрации нитратного и аммонийного азота в данной области зоны смешения. В условиях пониженного за счет изъятия азота отношения DIN/DIP отношение DISi/DIN крайне мало. Поэтому DISi лимитируют фотосинтез диатомовых водорослей здесь, как отмечалось ранее в целом для Охотского моря [38]. При этом в водах с соленостью более 24‰, которые занимают основной объем в обеих зонах смешения, наблюдается доминирование продукции, что отражают параметры карбонатной системы (рис. 4), величина AOU (рис. 7в) и процентное содержание НГВ (рис. 7г), предположительно, в виде полисахаридов – продукта метаболизма фитопланктона [51] в результате благоприятных условий для фотосинтеза.
ВЫВОДЫ
В период летнего паводка кутовые части Удской губы и залива Николая являются макроприливными эстуариями со слабой стратификацией вод и интенсивным приливным перемешиванием, а зоны смешения занимают всю их акваторию от поверхности до дна.
Совместное влияние реки и моря определяет в зонах смешения положение границы между гетеротрофным бассейном – с преобладанием деструкции и автотрофным бассейном – с преобладанием продукции органического вещества. Эта граница в период летнего паводка находится около изогалины 24‰. В гетеротрофном бассейне воды являются источником, а в автотрофном бассейне становятся стоком для углекислого газа атмосферы.
Приливы вызывают вертикальное перемешивание, поставляя неорганические формы биогенных веществ в фотический слой, основным источником которых является минерализация автохтонного органического вещества, осевшего на дно, в то время как их поток с речным стоком относительно мал. На поздней стадии зон смешения вод лимитирующим фактором фотосинтеза для диатомей становится недостаток силикатов, основным источником которых является речной сток.
Благодарности. Авторы выражают благодарность научному составу и экипажу НИС “Профессор Гагаринский” рейса № 71, отдельно благодарны участникам лодочных работ В.М. Шулькину (ТИГ ДВО РАН) и А.О. Мизгину (ДВФУ). За ценные советы и консультации признательны В.В. Мельникову (ТОИ ДВО РАН).
Источник финансирования. Работа выполнена в рамках программы академии наук на 2013–2020 гг. (темы 01201363041 и 01201353055) и РНФ (проект № 19-17-00058).
Список литературы
Бруевич С.В., Деменченок С.К. Определение щелочности в малых объемах морской воды прямым титрованием. Инструкция по производству химических исследований морской воды. Л.: Главсевморпуть, 1944. 83 с.
Важова А.С., Зуенко Ю.И. Особенности распределения биогенных элементов вдоль градиента солености в эстуариях рек Суходол и Раздольная (залив Петра Великого, Японское море) // Изв. ТИНРО. 2015. Т. 180. С. 226–235.
Горин С.Л. Попрядухин А.А., Коваль М.В. Гидрологические процессы в лагунно-русловом эстуарии в теплый период года (на примере устья реки Большой, западная Камчатка) // Водные ресурсы. 2019. Т. 46. № 1. С. 2–13.
Дзюбан А.Н. Первичные продукционные процессы в воде Тугурского залива Охотского моря // Океанология. 2003. Т. 43. № 3. С. 383–392.
Звалинский В.И., Тищенко П.П., Михайлик Т.А., Тищенко П.Я. Эвтрофикация залива Петра Великого // Океанологические исследования дальневосточных морей и северо-западной части Тихого океана: в 2 кн. / Гл. ред. Акуличев В.А.; ТОИ ДВО РАН. Владивосток: Дальнаука, 2013. Кн. 1. С. 260–293.
Звалинский В.И., Марьяш А.А., Тищенко П.Я. и др. Продукционные характеристики эстуария реки Раздольной в период ледостава // Изв. ТИНРО. 2016. Т. 185. С. 155–174.
Золотухин С.Ф., Махинов А.Н., Канзепарова А.Н. Особенности морфологии и гидрологии нерестовых рек северо-западного побережья Охотского моря // Изв. ТИНРО. 2014. Т. 176. С. 139–154.
Коваль М.В., Горин С.Л., Романенко Ф.А. и др. Условия среды обитания и биологическое сообщество гиперприливного эстуария рек Пенжина и Таловка (севро-западная Камчатка) // Океанология. 2017. Т. 57. № 4. С. 597–610.
Лисицын А.П. Маргинальный фильтр океанов // Океанология. 1994. Т. 34. С. 735–747.
Лоция Охотского моря. Книга 1406. Вып. 1.
Махинов А.Н., Крюкова М.В., Пронкевич В.В. Ульбанский залив // Природа. 2017. № 8. С. 32–43.
Мельников В.В., Федорец Ю.В. Распределение зоопланктона и полярного кита Balaena mysticetus Linnaeus, 1758 в заливе Академии Охотского моря // Биология моря. 2016. Т. 42. № 3. С. 189–194.
Методы гидрохимических исследований основных биогенных элементов. М.: ВНИРО. 1988. 120 с.
Мещерский И.Г., Шпак О.В., Глазов Д.М. и др. Белуха (Delphinapterus leucas) в морях Дальнего Востока: состав и распределение митохондриальных линий // Морские млекопитающие Голарктики. 2012. Т. 2. С. 90–95.
Михайлик Т.А., Тищенко П.Я., Колтунов А.М. и др. Влияние реки Раздольной на экологическое состояние вод Амурского залива (Японское море) // Водные ресурсы. 2011. Т. 38. № 4. С. 474–484.
Михайлов В.Н., Горин С.Л. Новые определения, районирование и типизация устьевых областей рек и их частей–эстуариев // Водные ресурсы. 2012. Т. 39. № 3. С. 243–257.
Морошкин К.В. Водные массы Охотского моря. М.: Наука, 1966. 67 с.
Навигационная карта № 63123. Залив Николая (Масштаб 1 : 100 000). ГУНИО МО, 1987 г.
Навигационная карта № 62 179. От мыса Большой Дуганджа до мыса Борисова с островами Феклистова и Большой Шантар (Масштаб 1 : 250 000). ГУНИО МО, 1987 г.
Ресурсы поверхностных вод СССР. Т. 19: Северо-восток. Л.: Гидрометеоиздат, 1969. 283 с.
Ресурсы поверхностных вод СССР. Т. 18: Дальний Восток; вып. 2: Нижний Амур. Л.: Гидрометеоиздат, 1970. 592 с.
Семкин П.Ю., Тищенко П.Я., Ходоренко Н.Д. и др. Продукционно-деструкционные процессы в эстуариях рек Артемовка и Шкотовка (Уссурийский залив) в летний сезон // Водные ресурсы. 2015. Т. 42. № 3. С. 311–321.
Семкин П.Ю., Тищенко П.Я., Лобанов В.Б. и др. Структура и динамика вод в эстуарии реки Партизанской (Японское море) // Водные ресурсы. 2019. Т. 46. № 1. С. 24–
Состояние морских экосистем находящихся под влиянием речного стока / Отв. ред. д.г.-м.н. Грамм-Осипов Л.М. Владивосток: Дальнаука, 2005. 260 с.
Состояние морских экосистем находящихся под влиянием стока реки Амур / Отв. ред. д.б.н. Челомин В.П. Владивосток: Дальнаука, 2009. 228 с.
Стунжас П.А., Тищенко П.Я., Ивин В.В. и др. Первый случай аноксии в водах Дальневосточного морского заповедника // ДАН. 2016. Т. 467. № 2. С. 218–221.
Тищенко П.Я., Павлова Г.Ю., Салюк А.Н. и др. Карбонатная система и растворенный кислород Японского моря. Анализ биологического и температурного фактора // Океанология. 1998. Т. 38. № 5. С. 678–684.
Тищенко П.Я., Чичкин Р.В., Ильина Е.М. и др. Измерение рН в эстуариях с помощью ячейки безжидкостного соединения // Океанология. 2002. Т. 42. № 1. С. 32–41.
Тищенко П.Я., Лобанов В.Б., Звалинский В.И. и др. Сезонная гипоксия Амурского залива (Японское море) // Изв. ТИНРО. 2011. Т. 165. С. 108–129.
Тищенко П.Я., Семкин П.Ю., Тищенко П.П. и др. Гипоксия придонных вод эстуария реки Раздольная // ДАН. 2017. Т. 476. № 5. С. 576–580.
Тищенко П.Я., Семкин П.Ю., Павлова Г.Ю. и др. Гидрохимия эстуария реки Туманной (Японское море) // Океанология. 2018а. Т. 58. № 2. С. 192–204.
Тищенко П.Я., Лобанов В.Б., Шулькин В.М. и др. Комплексные исследования прибрежных акваторий Японского и Охотского морей, находящихся под влиянием речного стока (71-й рейс научно-исследовательского судна “профессор Гагаринский”) // Океанология. 2018б. Т. 58. № 2. С. 340–342.
Ушаков П.В. Система вертикальных зон Охотского моря // ДАН СССР. 1949. Т. 68. № 4. С. 769–772.
Хайлов К.М. Экологический метаболизм в море. Киев: Наук. Думка, 1971. 252 с.
Хлебович В.В. Критическая соленость биологических процессов. Л.: Наука. 1974. 235 с.
Шестеркина Н.М., Таловская В.С. Особенности формирования химического состава водотоков бассейна Тугурского залива Охотского моря // География и природные ресурсы. 2010. № 2. С. 99–105.
Шестеркин В.П. Гидрохимия рек южной части о Феклистова (Шантарские острова) // Тихоокеанская геология. 2015. Т. 34. № 5. С. 108–110.
Шунтов В.П. Биология дальневосточных морей. Владивосток: ТИНРО-центр, 2001. Т. 1. 580 с.
Blanchard A.L., Demchenko N.L., Aerts L.A.M. et al. Prey biomass dynamics in gray whale feeding areas adjacent to northeastern Sakhalin (the Sea of Okhotsk), Russia, 2001–2015 // Mar. Environ. Res. 2019. V. 145. P. 123–136.
Chevalier C., Devenon J.L., Pagano M. et al. The atypical hydrodynamics of the Mayotte Lagoon (Indian Ocean): Effects on water age and potential impact on plankton productivity // Estuarine, Coastal Shelf Sci. 2017. V. 196. P. 182–197.
Costanza R., d’Arge R., Rudolf de Groot. The value of the world’s ecosystem services and natural capital // Nature. 1997. V. 387. P. 253–260.
Davies J. L. A morphogenetic approach to world shorelines // Z. Geomorphol. 1964. V. 8. P. 127–142.
Delhez E.J.M., Heemink A.W., Deleersnijder E. Residence time in a semi-enclosed domain from the solution of an adjoint problem // Estuarine, Coastal Shelf Sci. 2004. V. 61. 691–702.
de Brauwere A., de Brye B., Blaise S., Deleersnijder E., Residence time, exposure time and connectivity in the Scheldt Estuary // Journal of Marine Systems. 2011. V. 84. Iss. 3–4. P. 85–95.
Diaz R.J., Rosenberg R. Spreading Dead Zones and Consequences for Marine Ecosystems // Science. 2008. V. 321. P. 926–929.
Dickson A.G. pH scales and proton-transfer reactions in saline media such as sea water // Geochim. Cosmochim. Acta. 1984. V. 48. P. 2299–2308.
Hayami Yu., Wada M., Umezawa Yu. et al. Hypoxic water mass in the highly turbid well-mixed macrotidal Rokkaku River Estuary, Ariake Sea, Japan // Estuarine, Coastal Shelf Sci. 2019. V. 219. P. 210–222.
Kaul L.W., Froelich P.N. Modeling estuarine nutrient geochemistry in a simple system // Geochim. Cosmochim. Acta. 1984. V. 48. P. 1417–1433.
Kitamura M., Nakagawa Y., Nishino Y. et al. Comparison of the seasonal variability in abundance of the copepod Pseudocalanusnewmani in Lagoon Notoroko and a coastal area of the south western Okhotsk Sea // Polar Sci. 2018. V. 15. P. 62–74.
Levin L.A., Ecau W., Gooday A.J. et al. Effect of natural and human-induced hypoxia on coastal benthos // Biogeosciences. 2009. V. 6. P. 2063–2098.
Passow U. Transparent exopolymer particles (TEP) in aquatic environments // Progress in Oceanogr. 2002. V. 55. P. 287–333.
Pritchard D.W. What is an estuary: a physical viewpoint // Estuaries. Washington: Am. Ass. Adv. Sci., 1967. Publ. 83. P. 3–5.
Rogachev K.A., Carmack E.C., Foreman M.G.G. Bowhead whales feed on plankton concentrated by estuarine and tidal currents in Academy Bay, Sea of Okhotsk // Cont. Shelf Res. 2008. V. 28. Iss. 14. P. 1811–1826.
Rosenberg R. Eutrophication — the future marine coastal nuisance? // Mar. Pollut. Bull. 1985. V. 16. P. 227–231.
Shulkin V.M. Tishchenko P. Ya., Semkin P. Yu. et al. Influence of river discharge and phytoplankton on the distribution of nutrients and trace metals in Razdolnaya River estuary, Russia // Estuarine, Coastal Shelf Sci. 2018. V. 211. P. 166–176.
Takeoka H. Fundamental concepts of exchange and transport time scales in a coastal sea // Cont. Shelf Res. 1984. V. 3. P 311–326.
Turner R.E., Qureschi N., Rabalais N.N. et al. Fluctuating silicate: nitrate ratios and coastal food webs // Proc. of the National Academy of Sciences (USA). 1998. V. 95. P. 13 048–13 051.
Watanabe K., Kasai A., Antonio E. et al. Influence of salt-wedge intrusion on ecological processes at lower trophic levels in the Yura Estuary, Japan // Estuarine, Coastal Shelf Sci. 2014. V. 139. P. 67–77.
Wu J., Chou T. Silicate as the limiting nutrient for phytoplankton in a subtropical eutrophic estuary of Taiwan Estuarine // Estuarine, Coastal Shelf Sci. 2003. V. 58. Iss. 1. P. 155–162.
Wu G., Cao W., Wang F. et al. Riverine nutrient fluxes and environmental effects on China’s estuaries // Sci. Total Environ. 2019. V. 661. P. 130–137.
Дополнительные материалы отсутствуют.


