Океанология, 2021, T. 61, № 3, стр. 401-412
Сероводородное заражение прибрежных озер на разных стадиях изоляции от Белого моря
Г. Н. Лосюк 1, *, Н. М. Кокрятская 1, Е. Д. Краснова 2
1 Федеральный исследовательский центр комплексного изучения Арктики
им. акад. Н.П. Лаверова УРО РАН
г. Архангельск, Россия
2 Беломорская биологическая станция им. Н.А. Перцова
Биологического факультета МГУ им. М.В. Ломоносова
г. Москва, Россия
* E-mail: glosyuk@yandex.ru
Поступила в редакцию 21.05.2020
После доработки 11.09.2020
Принята к публикации 23.11.2020
Аннотация
В работе представлены результаты исследований с 2012 по 2019 гг. четырех прибрежных озер с уникальной гидрологической и гидрохимической структурой, находящихся на разных стадиях отделения от Кандалакшского залива Белого моря. Во всех водоемах постоянно присутствует или сезонно появляется стратификация, вследствие чего в анаэробных условиях активизируется процесс бактериального восстановления сульфатов и накапливается сероводород − соединение, токсичное для аэробных форм жизни. Наибольшее количество сероводорода зарегистрировано в оз. Трехцветном, находящемся на меромиктической стадии изоляции.
ВВЕДЕНИЕ
Карельский берег Белого моря сильно изрезан и имеет множество заливов и лагун. Часто такие заливы отделены от моря небольшими каменистыми порогами. В результате изостатического постгляциального поднятия берега со скоростью 3–4 мм/год небольшие заливы и лагуны отделяются от моря [7]. Этот процесс занимает длительное время, в течение которого, по мере нарастания изоляции, морские заливы проходят стадию лагун с ассиметричными приливами и сезонной стратификацией, затем через стадию водоемов с периодическим забросом морской воды (чаще всего в сизигийные приливы) и далее – меромиктическую стадию, которая может длиться несколько столетий, по окончании которой они превращаются в “обычные” пресноводные озера [6]. За это время в гидрохимической и гидробиологической структуре таких водоемов происходят значительные изменения: уменьшается влияние моря и поступление соленой воды, изменяется промывной режим, опресняется верхний горизонт водоема за счет атмосферных осадков и поверхностных вод с суши, устанавливается сезонная или постоянная стратификация. Происходит смена гидробионтов и микробиологических сообществ. В условиях стратификации кислород придонных вод полностью расходуется на окисление автохтонного и аллохтонного органического вещества. В анаэробных условиях активизируется деятельность сульфатредуцирующих бактерий, что приводит к появлению и накоплению сероводорода. Наиболее известными акваториями со стратифицированной структурой и сероводородным заражением вод являются Черное море [3], оз. Могильное (Россия) [17], Доронинское (Россия) [1], Шира и Шунет (Россия) [16], фьорд Фрамварен (Норвегия) [34], оз. Медуз (Палау) [26], а также озера в Канаде (оз. Огак) [32], Франции [25], Финляндии [27]. Подобные водоемы могут формироваться не только в естественных условиях, но и в результате хозяйственной деятельности человека, когда происходит отделение небольших морских заливов и нарушается их естественная связь с морем (строительство плотин, мостов и дорог).
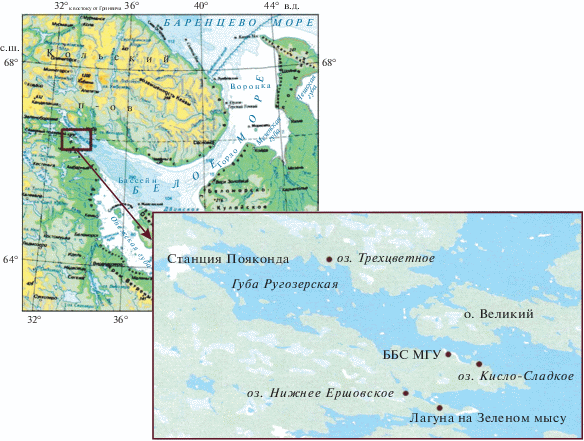
Несколько таких водоемов, находящихся на разных стадиях естественного отделения от Белого моря, обнаружены недалеко от Беломорской биологической станции им. Н.А. Перцова Биологического факультета МГУ им. М.В. Ломоносова (Карельский берег, Кандалакшский залив Белого моря), и начиная с 2012 г. [7] за ними ведутся м-ониторинговые комплексные наблюдения [30]. Исследуемые акватории представляют собой модель для изучения внутриводоемных процессов в течение небольшого периода времени, без необходимости ждать сотни лет последовательной смены стадий сукцессии. Специфичной чертой обследуемых водоемов является присутствие в придонных водах сероводорода, генерируемого в ходе сульфатредукции, который является не только токсическим агентом, но и сильнейшим восстановителем. Он играет роль основного регулятора окислительно-восстановительных условий и влияет на общую направленность и эффективность протекающих в водоеме процессов. Наличие или отсутствие свободного сероводорода в водной среде определяется соотношением интенсивности процесса восстановления сульфатов, с одной стороны, и наличием окислителей и элементов, способных к связыванию образующегося сероводорода, с другой.
Целью данного исследования является изучение формирования и развития сероводородного заражения в воде озер, находящихся на разных стадиях изоляции от Кандалакшского залива Белого моря.
Для исследования выбраны четыре озера, два из которых (Нижнее Ершовское и Трехцветное) в наибольшей степени изолированы от моря. В третий водоем − оз. Кисло-Сладкое – морская вода поступает только при совпадении высокого прилива со штормовым нагоном. И четвертый водоем − так называемая лагуна на Зеленом мысе, находящаяся на начальной стадии отделения. Она наиболее подвержена влиянию моря − ежедневным приливам и отливам. Данные водоемы в числе нескольких других, обнаруженных в этом районе Белого моря, являются уникальными по своей гидрохимической структуре и привлекают внимание ученых разных направлений [30].
МАТЕРИАЛЫ И МЕТОДЫ
Карта-схема расположения исследуемых водоемов приведена на рис. 1. Координаты станций отбора проб и основные морфометрические характеристики озер – в табл. 1. Отбор проводился в наиболее глубокой точке акватории озер с разных горизонтов в различные сезоны силиконовой трубкой, закрепленной на калиброванном тросе, погружным насосом “Whale Premium Submersible Pump GP1352” (США) или горизонтальным поликарбонатным батометром (США) объемом 2 и 5 л. Для фиксации сероводорода (H2S) использовались растворы ацетата цинка и ацетата кадмия для фотометрического и йодометрического методов определения соответственно [4, 15, 18].
Таблица 1.
Морфометрические параметры исследуемых водоемов
| Параметр | Оз. Нижнее Ершовское 66°32.14′ N 33°03.74′ E |
Оз. Трехцветное 66°35.53′ N 32°58.85′ E |
Оз. Кисло-Сладкое 66°32.87′ N 33°08.14′ E |
Лагуна
на Зеленом мысе 66°31.80′ N 33°05.65′ E |
|---|---|---|---|---|
| Площадь водоема, км2 | 0.081 | 0.032 | 0.016 | 0.012 |
| Площадь водосбора, км2 | 1.23 | 0.64 | 0.16 | 0.19 |
| Длина, м | 500 | 340 | 196 | 120 |
| Ширина, м | 245 | 135 | 147 | 120 |
| Максимальная глубина, м | 2.5 | 7.5 | 4.7 | 6.0 |
| Средняя глубина, м | 1.0–1.5 | 2.5 | 1.0–1.5 | 2.0 |
При анализе проб с большим (более 100 мг/л) содержанием сероводорода возникла необходимость подтвердить правильность высоких значений полученных концентраций сульфидов, поскольку анализ таких проб сопровождается методическими трудностями. Так, например, высокое содержание сульфидов (в концентрациях более 10 мг/л) может частично или полностью подавлять реакцию образования окрашенного соединения при фотометрическом определении, а разбавление проб после развития окраски приводит к нелинейному изменению оптической плотности в зависимости от концентрации. Решение этой проблемы было предложено в работе [4], когда при анализе проб воды сероводородной зоны Черного моря авторы предложили разбавлять пробы с высоким содержанием сероводорода непосредственно при отборе.
Для анализа проб с высоким содержанием сероводорода пробы воды объемом 0.2–5 мл в зависимости от предполагаемой концентрации отбирались автоматическим дозатором непосредственно из шланга насоса или батометра и помещались в стеклянные цилиндры с раствором ацетата цинка (при фотометрическом определении) или ацетата кадмия (при йодометрическом определении), затем объем пробы был доведен дистиллированной водой до 50 мл. Разбавленные таким образом образцы анализировались фотометрическим и йодометрическим методами, как это ранее было применено при анализе проб воды сероводородной зоны Черного моря [4]. Для оценки воспроизводимости результатов при определении больших концентраций сероводорода дополнительно были выполнены исследования некоторых проб озерной воды двумя методами в трех повторностях (табл. 2). Анализ приведенных данных показывает, что воспроизводимость результатов при анализе проб с высоким содержанием сероводорода обоими методами можно оценить как приемлемую.
Таблица 2.
Результаты определения содержания сероводорода (мг/л) в пробах озерной воды двумя методами анализа (фотометрическим и йодометрическим)
| № | Объем пробы, мл | Метод анализа | Результаты определений | Среднее | Стандартное отклонение | Относительное стандартное отклонение, % |
|---|---|---|---|---|---|---|
| 1 | 0.5 | Йодометрия | 600 | 622 | 15 | 2.4 |
| 630 | ||||||
| 636 | ||||||
| 2 | 5.0 | Йодометрия | 570 | 582 | 12 | 2.0 |
| 600 | ||||||
| 577 | ||||||
| 3 | 5.0 | Йодометрия | 583 | 566 | 22 | 4.0 |
| 532 | ||||||
| 583 | ||||||
| 4 | 5.0 | Йодометрия | 549 | 564 | 10 | 1.8 |
| 579 | ||||||
| 564 | ||||||
| 5 | 0.2 | Фотометрия | 687 | 679 | 6 | 0.8 |
| 676 | ||||||
| 673 | ||||||
| 6 | 0.5 | Фотометрия | 565 | 559 | 4 | 0.8 |
| 560 | ||||||
| 552 | ||||||
| 7 | 1.0 | Фотометрия | 221 | 240 | 13 | 5.2 |
| 257 | ||||||
| 242 | ||||||
| 8 | 1.0 | Фотометрия | 101 | 107 | 8 | 7.4 |
| 102 | ||||||
| 119 |
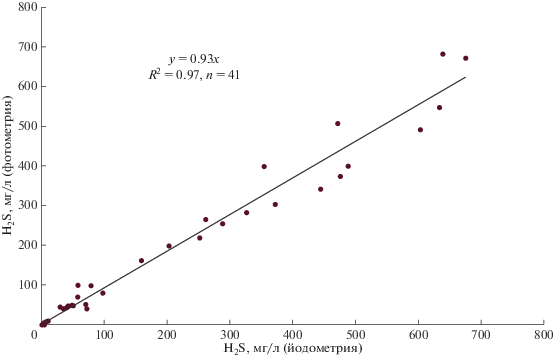
В ходе выполнения данной работы авторами было проведено 41 параллельное определение сероводорода двумя методами исследования в широком диапазоне концентраций (от 1.8 до 687 мг/л). На рис. 2 приведены полученные результаты. Разброс данных по обе стороны линии тренда свидетельствует, что систематического отклонения результатов исследования не наблюдается, а высокий уровень корреляции (R 2 = 0.97) между ними подтверждает корректность полученных значений концентраций при высоком уровне содержания сероводорода в озерной воде.
Рис. 2.
Сравнение параллельных определений содержания сероводорода фотометрическим методом (ось ординат) и йодометрическим методом (ось абсцисс).
Справедливость применения такого подхода (определение двумя методами и разбавление проб при отборе) подтвердилась в марте 2018 г., когда для определения сероводорода в разбавленных при отборе пробах использовали только фотометрический метод. Для придонных горизонтов оз. Трехцветное данные были завышены в среднем на 30% и составляли около 900 мг/л по сравнению с более ранними и поздними результатами (порядка 600 мг/л). Аналогичную ошибку мы получили при анализе вод с большими концентрациями сероводорода и из других озер. Эти данные в работе не рассматриваются. Таким образом, для получения точных данных при анализе проб с высокими концентрациями сероводорода/сульфидов в работе использовали оба метода анализа с разбавлением проб дистиллированной водой при отборе.
Для фотометрического определения сероводорода использовали фотометр “Эксперт 003” (Россия). Измерения температуры и солености воды проводили кондуктометром WTW Condi 315i (Германия), содержание кислорода измеряли при отборе оксиметром “МАРК 302Э” (ВЗОР, Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
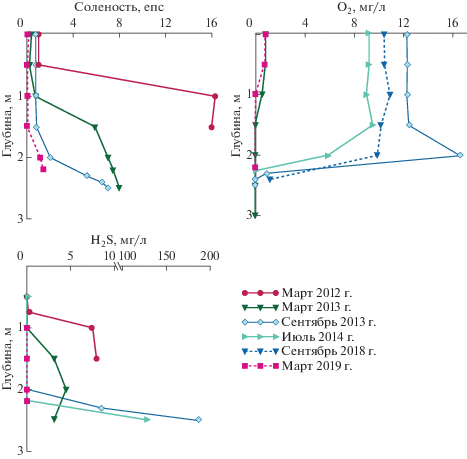
Оз. Нижнее Ершовское. Это нижнее из двух озер, образовавшихся на месте древнего пролива, соединенное протокой с пресным Верхним Ершовским озером, из которого оно получает пресную воду. От моря это озеро отделено каменистым барьером, по которому из него вытекает пресный ручей. Поступление небольшого количества воды из моря происходит не чаще, чем раз в год только во время сильных сизигийных приливов и штормов. Большая часть водной толщи пресная или солоноватая (0.1−0.7 епс). Осенью 2011 г. во время шторма в него, как и во все остальные изучаемые водоемы, попала морская вода. В поверхностном слое озера соленость повысилась до 1.1 епс, а в придонном до 15 епс. Это вернуло водоем на более раннюю стадию его изоляции от моря и задало новую точку наблюдений.
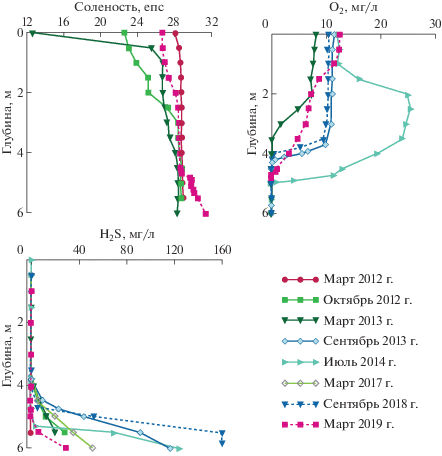
В марте 2012 г. были проведены первые комплексные исследования водоема. На поверхности (0.1 м) вода оказалась осолоненной до 0.9 епс, а на глубине ниже 1 м соленость резко возрастала до 16.4 епс (рис. 3). В марте 2013 г. соленость несколько уменьшилась, на глубине 1.5 и 2.5 м она составляла соответственно 5.9 и 8.0 епс. В другие периоды наблюдений (с июля 2014 г. по март 2016 г.) в водоеме преобладали пресные воды, и только в донных ямах присутствовали солоноватые (1.4−4.7 епс). В 2018 г. озеро оказалось пресным по всей акватории.
Температура в озере меняется по всей водной толще в зависимости от климатического сезона; поскольку глубина озера невелика (максимально 2.5 м), летом оно прогревается до дна (до 19°С) [6]. Содержание кислорода также в целом соответствует климатическому сезону [6], но во всех случаях в периоды с соленостной стратификацией в придонном слое воды оно уменьшается практически до нуля.
Начиная с января 2013 г. в оз. Нижнем Ершовском появилась прослойка воды зеленого цвета, расположенная на границе аэробной и сероводородной водных масс, цвет которой обусловлен наличием зеленых серобактерий [28, 29]. Своим массовым развитием серобактерии обязаны сероводороду, который появился в придонном слое при активизации сульфатредукции после поступления морской воды.
Процесс восстановления сульфатов в озере проходит только в солоноватых придонных горизонтах, где в марте 2012 г. концентрация сероводорода составила 8.1 мг/л, в марте 2013 г. – 4.5 мг/л, в июле 2013 г. – 9.0 мг/л (рис. 3) [12]. Активизация процесса сульфатредукции связана с созданием благоприятных условий: развитием гипоксии в озере, поступлением сульфатов и наличием достаточного количества органического вещества. Наибольшее содержание сероводорода в придонной водной массе в оз. Нижнее Ершовское наблюдалось осенью. Максимальные значения содержания сероводорода в 2013 г. отмечены в сентябре (188 мг/л). В июле 2014 г. сероводородный слой, как и в предыдущие годы, был тонким придонным, мощность его не превышала 20−30 см, но содержание сероводорода было очень высоким – до 130 мг/л. Сохранение с сентября 2013 г. столь высоких концентраций сероводорода (в январе 2014 г. величина этого показателя составляла немногим менее 100 мг/л) позволяет предположить наличие вертикальной стабильности водных масс озера в это время, несмотря на его малую глубину. Но уже с марта 2018 г. по март 2019 г. содержание сероводорода значительно (0.01− 14.4 мг/л) уменьшилось, часто до следовых количеств. Вероятно, это связано с возвращением озера к состоянию, исходному, до затекания морских вод – полностью отделившемуся от моря пресному водоему. Процесс сульфатредукции в воде может протекать только во время сезонной стагнации с соленой линзой в донной яме.
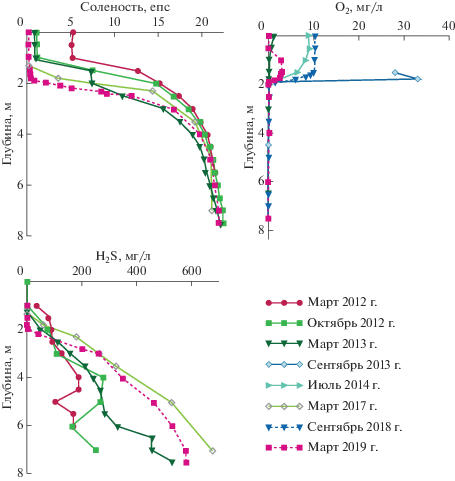
Оз. Трехцветное. Оз. Трехцветное считается полностью отделившимся от моря водоемом со стабильной стратифицированной структурой и всеми признаками меромиксии [7]. Озеро получило свое название за разные цвета трех его слоев: верхний пресный слой воды – желтоватый из-за гуминовых веществ, поступающих со стоком из болота. Ниже расположены соленые воды: сначала идет слой ярко-зеленого цвета, а затем сероводородная вода мутно-желтого цвета. Зеленый цвет – результат массового развития зеленых серобактерий [21, 29].
В оз. Трехцветном уже с самого начала исследований в 2012 г. проявлялись черты, характерные для меромиктических водоемов. В условиях стабильной стратификации отсутствие водообмена между поверхностным горизонтом (миксолимнионом) и придонным горизонтом приводит к образованию хемоклина, с резкой сменой окислительно-восстановительных условий, а также – статичной анаэробной зоны (монимолимниона). Подобные условия делают меромиктические водоемы уникальными объектами для изучения геохимии и микробиологии анаэробных процессов. В оз. Трехцветном пресный миксолимнион располагается до глубины 1 м, застойная соленая сероводородная водная масса (монимолимнион) начинается с глубины 1.5−1.8 м, а между ними находится узкий пикноклин с резкими физико-химическими градиентами. Слой зеленой воды мощностью 15−20 см располагается непосредственно над хемоклином. В результате микробиологических исследований на границе аэробной и анаэробной зон были обнаружены в большом количестве аноксигенные фототрофные бактерии – зеленоокрашенные серобактерии, которые придают ярко зеленый цвет воде [13, 33].
В ноябре 2011 г. в оз. Трехцветное, как и в другие изучаемые водоемы, во время сигизийного прилива, совпавшего с сильным ветровым нагоном, попала соленая вода. Это привело к осолонению миксолимниона и, возможно, несколько увеличило соленость нижележащих вод [6]. Его меромиктическая структура не была нарушена, несмотря на просачивание сероводородных вод монимолимниона в поверхностные горизонты. Поскольку более ранних наблюдений не было, трудно сказать, насколько зафиксированные в марте 2012 г. концентрации сероводорода в монимолимнионе являются следствием разбавления глубинных озерных вод свежей морской водой, и в каких количествах сероводород присутствовал в них ранее. Уже к сентябрю 2012 г. поверхностный слой очистился от сероводорода, однако его содержание в анаэробных глубинных (ниже 4-х метров) водах продолжало увеличиваться в течение нескольких последующих лет и стало относительно стабильным только к 2016 г. (рис. 4). Концентрация сероводорода в придонных горизонтах с тех пор сохраняется на уровне значений порядка 600 мг/л [11, 12, 31], что значительно превышает его содержание в таких известных водоемах с анаэробными условиями как Черное море – 12.3 мг/л [3], оз. Могильное – 160 мг/л [17] и фьорд Фрамварен (Норвегия) – 200 мг/л [34].
В настоящее время воды миксолимниона полностью пресные; ниже хемоклина кислород полностью отсутствует, а воды монимолимниона заражены сероводородом. В любое время года на глубине ниже 4 м температура и соленость постоянны и составляют соответственно 6−7°С и ~ 22 епс. Таким образом, мы имеем классический пример меромиктического водоема (рис. 4).
Накопление сероводорода в анаэробном слое оз. Трехцветное происходит на фоне уменьшения количества сульфатов: хорошо прослеживается уменьшение отношения SO4/Cl с глубиной [2].
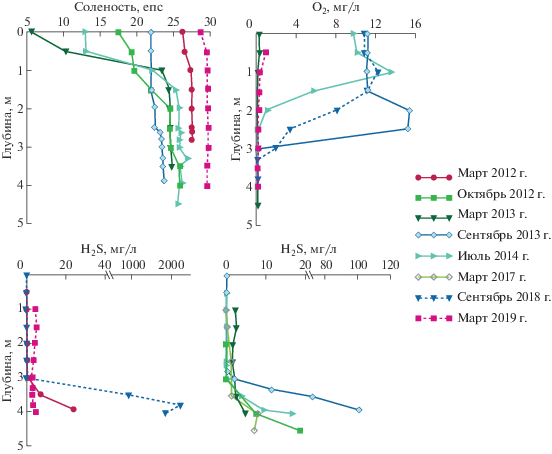
Оз. Кисло-Сладкое. Оз. Кисло-Сладкое образовалось в результате отделения морского залива, отгороженного от морской акватории островом с двумя каменистыми отмелями по сторонам. В результате подъема суши одна из отмелей превратилась в перемычку, в настоящее время уже заросшую луговыми травами, а другая – это каменистый порог, через который во время сизигийных приливов и нагонов в озеро поступает вода из моря. В остальное время течение направлено из озера в море. Поступление пресной воды в водоем возможно только во время таяния снега и со стоком небольшого пресного ручья в летнее время [6]. В 2001 и 2002 гг. С.И. Шапоренко с соавторами [22–24] была описана трехслойная структура этого озера: 1) опресненный верхний слой до глубины 1 м с соленостью 13 епс − эпилимнион; 2) до глубины 3.2−3.75 м – гиполимнион, представляющий собой слой воды, насыщенной кислородом, и с температурой выше, чем у поверхностного слоя; 3) придонный анаэробный слой воды с высоким содержанием сульфидов.
Опреснение водной толщи озера, а также ветровое перемешивание сказываются только на верхнем слое воды глубиной до одного метра. Он изолирует от контакта с атмосферой нижележащие более соленые воды, что приводит в летнее время к эффекту парника и появлению феномена заглубленного максимума температуры, свойственного гелиотермическим водоемам: температура подповерхностного слоя несколько больше вышележащего. Температура придонных слоев даже в летние месяцы, несмотря на небольшую глубину водоема (около 4.5 м), не превышает 11°С, хотя поверхностные слои могут прогреваться до 18−28°С [6]. Среди гидрохимических особенностей озера можно отметить уникально высокие концентрации растворенного кислорода в среднем слое, достигавшие на некоторых станциях 26−28 мг/л (200−300% насыщения). Причиной этого является цветение водорослей и наличие скачка плотности, препятствующего смешению подповерхностных вод с вышележащими [22].
В летнее время на границе аэробного и анаэробного слоев (в редокс-зоне) в озере может возникать слой розового цвета. Такую окраску ему придает массовое развитие криптофитовых водорослей рода Rodomonas sp. [9, 10, 14].
Многолетние наблюдения за оз. Кисло-Сладкое показали, что описанные выше процессы, а также вертикальная стратификация и трехслойная структура характерны только для летнего периода. Во время высоких осенних нагонов и сизигийных приливов возможна промывка водоема, что наблюдалось несколько раз, и он становился однородным по всей толще. Но весной после таяния льда и снега вертикальная стратификация в водоеме образуется вновь, что приводит к застойным явлениям в придонных слоях и образованию сероводородного заражения.
В результате сильного нагона осенью 2011 г. в озеро попало большое количество морской воды, и в марте 2012 г. соленость у поверхности составляла 26.2 епс (рис. 5). В дальнейшем поверхностный слой опреснялся за счет осадков и таяния снега (минимальная соленость около 6 епс зарегистрирована в марте 2013 г.). В сентябре 2013 г. градиент солености был слабым (21.9 епс у поверхности и 23.8 епс у дна), что связано, скорее всего, с сезонными забросами морской воды во время высоких осенних приливов. В июле 2014 г. показатели вернулись к значениям января 2013 г., и соленость поверхностных вод составила 13 епс. В марте 2019 г. были зафиксированы рекордные значения солености по всей глубине озера ~30 епс, что может свидетельствовать о зимней промывке водоема соленой и холодной водой, пришедшей, скорее всего, из центральных частей Белого моря.
После первой осенней промывки, в марте 2012 г. сероводород в озере был обнаружен только в придонном горизонте и в небольшом количестве (28.3 мкг/л), что значительно ниже значений, полученных ранее для данного водоема С.И. Шапоренко с соавторами: 5.6−10.3 мг/л [22–24]. Но уже в октябре 2012 г. сероводород присутствовал в озере по всей водной толще с максимальным значением в придонном слое – 18.9 мг/л (рис. 5). Подобное распределение сохранялось в озере и в последующий холодный период (в январе и марте 2013 г.). Осенью и летом 2013 и 2014 гг. сероводород обнаруживался только в глубинной водной массе (ниже 2.5 м). Однако если в летние месяцы его содержание ниже этого горизонта составляло 2.3−16.7 мг/л, то в сентябре оно многократно возросло, достигнув 101 мг/л. Образование столь значительных количеств сероводорода осенью связано, скорее всего, с развитием благоприятных условий для процесса восстановления сульфатов. К ним относится сочетание анаэробных условий в период сезонной стагнации с накоплением органических веществ в придонных соленых водах в результате отмирания биомассы, образовавшейся в течение вегетационного периода. В марте 2019 г. содержание сероводорода в глубинных слоях озера было минимально (4.3 мкг/л), из-за притока кислородосодержащих морских вод с отрицательной температурой и, как следствие этого, затухания процесса сульфатредукции.
Данный водоем отличается от трех других самой большой нестабильностью всех гидрохимических характеристик, значения которых определялись климатическим сезоном и степенью промывки озера морской водой во время высоких приливов. Содержание сероводорода в придонных горизонтах водоема также сильно менялось в зависимости от сезона и сложившихся гидрологических условий. Для озера характерны периодическая стратификация и накопление сероводорода в придонных слоях в период стагнации.
Лагуна на Зеленом мысе. Эта лагуна расположена у основания п-ва Зеленый мыс и связана с кутом губы Кислой небольшим порогом, через который во время каждого прилива поступает морская вода, а во время отлива поверхностный слой воды стекает из озера в море. Озеро образовалось на месте древнего пролива, который отделял от материка остров, превратившийся впоследствии в п-в Зеленый мыс [6, 8].
Сезонная вертикальная стратификация в лагуне, как и в оз. Кисло-Сладкое, зависит от осенней промывки водоема. Вода в лагуне по всей толще соленая. Только после схода льда возникает небольшое опреснение верхнего слоя, гораздо меньшее, чем в других исследованных водоемах. В придонных горизонтах соленость больше, чем на соседней морской акватории. Это может быть связано как с очень маленьким водосборным бассейном этого водоема, так и с ледовым высаливанием при замерзании морской воды [5]. Несмотря на небольшую разницу в плотности соленых вод на поверхности и у дна, в лагуне на Зеленом мысе, как и в оз. Кисло-Сладкое, в теплое время года наблюдается парниковый эффект. Нижние горизонты в летнее время сохраняют постоянную температуру и соленость. Стратифицированная структура водоема может сохраняться на протяжении многих лет, если не произойдет осенней или зимней промывки лагуны.
В лагуне на Зеленом мысе, как и в оз. Кисло-Сладкое, на границе аэробной и анаэробной зон летом существует слой воды розового цвета, обусловленный развитием криптофитовых водорослей Rhodomonas sp. [9, 10, 21, 28]. Он появляется только летом и развивается при продолжительной стагнации. В зимнее время красноватый оттенок воде придают не водоросли, а анаэробные коричнево-окрашенные зеленые серобактерии [9].
После осенней промывки 2011 г. содержание сероводорода даже в придонной воде в марте 2012 г. не превышало 200 мкг/л [31], что значительно ниже концентраций, зафиксированных С.И. Шапоренко с соавторами в летнее время в 2001−2002 гг. [22]. Следующей осенью в октябре 2012 г. его содержание в придонных слоях возросло до 12.6 мг/л на глубине 5 м и 28.7 мг/л в придонных водах (5.5 м), что втрое меньше ранее зарегистрированного максимума (90 мг/л) (рис. 6). К осени 2013 г. количество сероводорода увеличилось до 117 мг/л, а в июле 2014 г. – до 125 мг/л. В марте 2016, 2017 и 2018 гг. максимальное содержание сероводорода в придонных слоях определялось на уровне 50 мг/л. В сентябре 2018 г. было зафиксировано рекордное для этого водоема количество H2S ~ 160 мг/л, а в марте 2019 г. − только 29 мг/л. Высокие концентрации сероводорода, характерные для придонных вод этого водоема, по мнению С.И. Шапоренко [22], обусловлены массовым развитием в лагуне нитчатых водорослей, которые, отмирая, скапливаются на дне и служат субстратом для сульфатредуцирующих бактерий. В целом, для лагуны на Зеленом мысе, так же как и для оз. Кисло-Сладкое, характерно увеличение придонных концентраций сероводорода в течение вегетационного сезона года с достижением максимальных значений осенью. Зимняя вертикальная стратификация здесь зависит от высоты осенних сизигийных приливов и от проницаемости ледового барьера на пороге, которые влияют на степень промывки водоема и, как следствие, на распределение сероводорода.
ВЫВОДЫ
В результате изучения четырех озер, находящихся на разных стадиях отделения от Кандалакшского залива Белого моря, установлено, что все они имеют уникальную гидрологическую и гидрохимическую структуру, формирующуюся на определенном этапе их эволюции. После штормового заброса воды из моря в начале зимы 2011−2012 гг. озера вернулись на более ранние стадии изоляции, задав новую точку отсчета наблюдений за восстановлением стратификации и формированием в них сероводородного заражения.
В пресноводном мелком оз. Нижнее Ершовское сероводородное заражение развилось после заброса содержащих сульфаты морских вод. Концентрация сероводорода в придонной соленой линзе достигла 130−190 мг/л. После того как озеро вновь стало пресным, концентрация снизилась, и в настоящее время содержание сероводорода в придонных горизонтах сопоставимо с данными для похожих озер со значительным поступлением болотных вод [19, 20].
Меромиктическое оз. Трехцветное из всех исследуемых нами водоемов характеризуется самым высоким содержанием сероводорода. В последние несколько лет оно достигло 500−680 мг/л, что значительно превышает количество сероводорода в других известных водоемах с эвксинной зоной.
В оз. Кисло-Сладкое и в лагуне на Зеленом мысе появление и накопление сероводорода обусловлено вертикальной стратификацией, которая зависит от степени их промывки морскими водами. Для обоих озер характерно увеличение придонных концентраций сероводорода в течение вегетационного сезона с достижением максимальных значений осенью. В лагуне на Зеленом мысе содержание сероводорода больше (до 120− 160 мг/л), чем в оз. Кисло-Сладкое (не более 20 мг/л), что, скорее всего, связано с массовым развитием нитчатых водорослей, которые, отмирая, скапливаются на дне и служат субстратом для сульфатредуцирующих бактерий.
Благодарности. Авторы благодарят сотрудников Беломорской биологической станции МГУ им. Н.П. Перцова за помощь в экспедиционных работах.
Источники финансирования. Работа выполнена при финансовой поддержке Минобрнауки РФ (проект № АААА-А18-118012390167-1) и РФФИ (грант № 19-05-00377).
Список литературы
Борзенко С.В., Замана С.В. Восстановленные формы серы в рапе содового озера Доронинское (Восточное Забайкалье) // Геохимия. 2011. № 3. С. 268– 276.
Васильчук Ю.К., Фролова Н.Л., Краснова Е.Д. и др. Изотопно-геохимический состав воды в меромиктическом озере Трехцветном на Беломорском побережье // Водные ресурсы. 2016. Т. 43. № 5. С. 555–566.
Волков И.И. Соединения восстановленной серы в воде Черного моря // Докл. РАН. 2007. Т. 417. № 2. С. 232–235.
Дубинин А.В., Демидова Т.П., Кременецкий В.В. и др. Определение восстановленных форм серы в анаэробной зоне Черного моря: сравнение методов спектрофотометрии и йодометрии // Океанология. 2012. Т. 52. № 2. С. 200–209.
Краснова Е.Д., Воронов Д.А., Воронова А.Д. Роль вымораживания рассола из морского льда в формировании вертикальной стратификации в водоемах, отделяющихся от Белого моря // Геология морей и океанов: Матер. XX Межд. науч. конф. (Школы) по морской геологии. М.: ГЕОС, 2013. Т. III. С. 201−205.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А. и др. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов. Труды Беломорской биостанции МГУ. Т. 12. М.: Т-во научных изданий КМК, 2016. С. 211–241.
Краснова Е.Д., Пантюлин А.Н., Белевич Т.А. и др. Комплексные исследования отделяющихся водоемов на разных стадиях изоляции от Белого моря в марте 2012 г. // Океанология. 2013. Т. 53. № 5. С. 714–717.
Краснова Е.Д., Пантюлин А.Н. Кисло-сладкие озера, полные чудес // Природа. 2013. № 2. С. 39–48.
Краснова Е.Д., Пантюлин А.Н., Маторин Д.Н. и др. Природа красных слоев в водоемах, отделяющихся от Белого моря // Матер. науч. конф. “Морская биология, геология, океанология – междисциплинарные исследования на морских стационарах”, посвященной 75-летию Беломорской биологической станции им. Н.А. Перцова (27 февраля–1 марта 2013 г., Москва). Тез. докл. М.: Т-во научных изданий КМК, 2013. С.151–156.
Краснова Е.Д., Пантюлин А.Н., Маторин Д.Н. и др. Цветение криптофитовой водоросли Rhodomonas sp. (Cryptophyta, Pyrenomonadaceae) в редокс зоне водоемов, отделяющихся от Белого моря // Микробиология. 2014. Т. 83. № 3. С. 346–354.
Лосюк Г.Н., Кокрятская Н.М. Химические параметры процесса сульфатредукции в озере Трехцветном (Кандалакшский залив Белого моря) // Материалы XXII международной научной конференции (Школы) по морской геологии “Геология морей и океанов”, 20–24 ноября 2017 г., г. Москва. М.: ГЕОС, 2017. Т. III. С. 223–226.
Лосюк Г.Н., Кокрятская Н.М. Заражение сероводородом озер на разной стадии отделения от Белого моря // Сборник трудов I международной молодежной научно-практической конференции “Арктические исследования: от экстенсивного освоения к комплексному развитию”. Архангельск, 26–28 апреля 2018 г. Архангельск, 2018. Т. 2. С. 183–186.
Лунина О.Н., Саввичев А.С., Бабенко В.В. и др. Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий меромиктического озера Трехцветное (Кандалакшский залив Белого моря) // Микробиология. 2019. Т. 88. № 1. С. 100–115. https://doi.org/10.1134/S0026365619010051
Лунина О.Н., Саввичев А.С., Краснова Е.Д. и др. Сукцессионные процессы в сообществе аноксигенных фототрофных бактерий озера Кисло-Сладкое (Кандалакшский залив Белого моря) // Микробиология. 2016. Т. 85. № 5. С. 531–544.
Методы гидрохимических исследований океана. М.: Наука, 1978. 272 с.
Пименов Н.В., Русанов И.И., Карначук О.В. и др. Микробные процессы циклов углерода и серы в озере Шира (Хакасия) // Микробиология. 2003. Т. 72. № 2. С. 259–267.
Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО, 2002. 163 с.
Современные методы гидрохимических исследований океана. М.: ИОАН СССР, 1992. 200 с.
Титова К.В., Кокрятская Н.М., Жибарева Т.А. Особенности сульфатредукции и накопления соединений восстановленной серы в пресноводном неглубоком озере Назаровское (Архангельская область) // Принципы экологии. 2019. №4. С. 69–80.
Титова К.В., Кокрятская Н.М., Жибарева Т.А. Процесс сульфатредукции в пресноводных озерах (Белое, Нижнее, Святое) Коношского района Архангельской области // Вестн. МГОУ. Естественные науки. 2017. № 4. С. 123–134. https://doi.org/10.18384/2310-7189-2017-4-123-134
Харчева А.В., Краснова Е.Д., Воронов Д.А. и др. Спектрально-оптические и физико-химические свойства воды в меромиктических водоемах Кандалакшского залива Белого моря // Геология морей и океанов: Матер. XX Межд. науч. конф. (Школы) по морской геологии. М.: ГЕОС, 2013. Т. 3. С. 261−265.
Шапоренко С.И. Гидролого-гидрохимическая характеристика отшнуровывающихся водоемов района ББС (Кандалакшский залив Белого моря) // Тр. Беломорской биол. станции. 2003. Т. 9. С. 184–190.
Шапоренко С.И. Кисло-сладкие озера у Полярного круга // Природа. 2004. № 11. С.23–30.
Шапоренко С.И., Корнеева Г.А., Пантюлин А.Н., Перцова Н.М. Особенности экосистем отшнуровывающихся водоемов Кандалакшского залива Белого моря // Водные ресурсы. 2005. Т. 32. № 5. С. 517–532.
Bura-Nakic E., Viollier E., Jezequel D. Reduced sulfur and iron species in anoxic water column of meromictic crater Lake Pavin (Massif Central, France) // Chem. Geol. 2009. V. 266. P. 311–317.
Dawson M.N., Hamner W.M. Geographic variation and behavioral evolution in marine plankton: the case of Mastigias (Scyphozoa, Rhizostomeae) // Mar. Biol. 2003. V. 143. P. 1161–1174. https://doi.org/10.1007/s00227-003-1155-z
Hakala A. Meromixis as part of lake evolution – observations and a revised classification on true meromictic lakes in Finland // Boreal Environ. Res. 2004. V. 9. P. 37–53.
Kharcheva A.V., Meschankin A.V., Lyalin I.I. et al. The study of coastal meromictic water basins in the Kandalaksha Gulf of the White Sea by spectral and physicochemical methods // SPIE Proc. 2014. V. 90310T.
Krasnova E.D., Kharcheva A.V., Milutina L.A. et al. Study of microbial communities in redox zone of meromictic lakes isolated from the White Sea using spectral and molecular methods // J. Mar. Biol. Assoc. U. K. in special issue − EMBS European Marine Biology Symposium. 2015. V. 95. № 8. P. 1579−1590.
Krasnova E., Matorin D., Belevich T. et al. The characteristic pattern of multiple colored layers in coastal stratified lakes in the process of separation from the White Sea // Chin. J. Oceanol. Limnol. 2018. V. 6. P. 1–16.
Losyuk G., Kokryatskaya N., Krasnova E. Formation of hydrogen sulfide in isolated basins at the Karelian of the White sea coast // EARSeL eProceedings. Special Iss.: 1st Student Workshop on Ecology and Optics of the White Sea. 2015. V. 14. P. 49–54.
McLaren I.A. Population and production ecology of zooplankton in Ogac Lake, a landlocked fiord on Baffin Island // J. Fish. Res. Board Can. 1969. V. 26. P. 1485–1559. https://doi.org/10.1139/f69-139
Savvichev A.S., Babenko V.V., Lunina O.N. et al. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake, Trekhtzvetnoe // Environ. Microbiol. 2018. V. 20. № 10. P. 3784–3797. https://doi.org/10.1111/1462-2920.14384
Yao W., Millero F.J. The chemistry of the anoxic waters in the Framvaren Fjord, Norway // Aquat. Geochem. 1995. V. 1. № 1. P. 53–88.
Дополнительные материалы отсутствуют.