Океанология, 2021, T. 61, № 6, стр. 969-976
Трансформация донных сообществ Печорской губы и возможное вымирание популяции Portlandia aestuariorum в типовом местообитании
П. Ю. Дгебуадзе 1, *, А. Б. Басин 2, М. В. Чикина 2, А. А. Удалов 2, А. А. Балакин 3, И. Л. Разгон 3, Ю. В. Ермилова 3, В. А. Чава 3, А. А. Гебрук 3, 4, Н. В. Шабалин 3, В. О. Мокиевский 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
3 Центр морских исследований МГУ
Москва, Россия
4 Эдинбургский университет, Школа геологических наук
Эдинбург, Великобритания
* E-mail: p.dgebuadze@gmail.com
Поступила в редакцию 07.12.2020
После доработки 09.02.2021
Принята к публикации 08.04.2021
Аннотация
Проведена бентосная съемка в координатах типового местонахождения двустворчатого моллюска Portlandia aestuariorum в Печорской губе Баренцева моря. Выполнены траловая и дночерпательная съемки на 7 станциях по трансекте вдоль оси губы. В собранном материале не обнаружено ни одного экземпляра P. aestuariorum. Вся исследованная акватория губы занята олигомиксным сообществом с доминированием Limecola balthica.
ВВЕДЕНИЕ
Траление и отбор дночерпательных проб в Печорской губе Баренцева моря были запланированы ради сбора Portlandia aestuariorum в типовом биотопе для генетического анализа. Этот вид был описан в работе Н.А. Мосевича [8] в ранге подвида Yoldia arctica subsp. aestuariorum natio petchorae. Материал был собран А.М. Поповым и Л.О. Ретовским на судне “Мурман” в 1924 г. тралением в координатах 68°33′3″ N, 54°59′ E на глубине 10 м. Было собрано 14 экземпляров этого вида, придонные температура и соленость составляли +12.2°С и 10.81‰ [8]. Позднее З.А. Филатова [9] выделила эту форму в самостоятельный вид Portlandia aestuariorum Mossewitsh, 1928. В дальнейшем статус этого вида оставался неопределенным: его рассматривали либо как подвид, либо как самостоятельный вид. А.Д. Наумов [7], со ссылкой на свои предыдущие исследования, однозначно признает P. aestuariorum хорошо очерченным видом с выраженными морфологическими и экологическими отличиями от P. arctica. Видовой статус этого вида зафиксирован в каталоге моллюсков Ю.И. Кантора и А.В. Сысоева [16]. Это соответствует и нашим представлениям, подкрепленным молекулярно-генетическими данными [4], о существовании в Арктике двух самостоятельных видов рода Portlandia с отчетливо разными экологическими предпочтениями. Таксономический анализ этого изменчивого рода предполагает в том числе исследование материала из типового места обитания. Таким для Portlandia aestuariorum (Mossewitsсh, 1928) следует считать Печорскую губу Баренцева моря: в работе Н.А. Мосевича [8] приводится описание моллюсков из двух районов (из Печорской губы – natio petchorae, и из бухты Тикси моря Лаптевых – natio lenae). Поскольку первым в тексте описан материал из Печорской губы, его и следует считать типовым.
В дальнейшем исследования бентоса Печорской губы проводились нерегулярно [11, 12]. В.Б. Погребов с соавторами [8] по материалам съемок 1991–2002 гг. указывал P. aestuariorum в качестве характерного вида наиболее осолоненных участков эстуария Печоры. Подробное описание бентоса Печорской губы выполнено Н.В. Денисенко с соавторами [13] на материале 22 станций, собранных в конце июня 1995 г., на пике весеннего половодья и, соответственно, в период максимального распреснения акватории. По этим данным, портландии (Portlandia arctica в понимании авторов) входили в состав сообщества Limecola balthica, занимавшего всю северо-восточную часть губы.
Отсутствие портландии в траловой и дночерпательной пробах в координатах типового местонахождения заставило нас расширить район работ и выполнить несколько дополнительных станций отбора проб.
МАТЕРИАЛ И МЕТОДЫ
Печорская губа представляет собой крупный залив в юго-восточной части Баренцева моря (Печорского моря) протяженностью около 100 км (шириной 40–120 км). С севера данный залив ограничен п-вом Русский Заворот и Гуляевскими кошками, образующими дугу, которая завершается в северо-восточной части губы. Печорская губа является мелководным заливом с глубинами до 6–10 м, в который впадает крупная р. Печора.
Материал для данного исследования был собран с борта ИС “Картеш” 19 июля 2020 г. на семи станциях, повторяющих координаты сборов 1924 г. (станция Д0) и съемки 1995 г. (по данным из таблицы в работе Денисенко с соавторами [13] (рис. 1). На каждой станции была взята одна количественная проба дночерпателем Ван-Вина с площадью захвата 0.2 м2, на станции Д0 проведено траление малым тралом Сигсби (раскрытие 1 м, продолжительность траления 15 мин на скорости 0.7 узла). На этой же станции был проведен лов ихтиопланктонной сетью в придонном слое. На каждой станции проведено зондирование СТД-зондом для определения профиля температуры и солености. Координаты станций и глубина приведены в табл. 1. Еще одна дополнительная станция (Д3) была обработана только на наличие моллюсков рода Portlandia (не найдены).
Рис. 1.
Схема отбора проб в Печорской губе. Соединяющая станции линия соответствует разрезу на рис. 2.
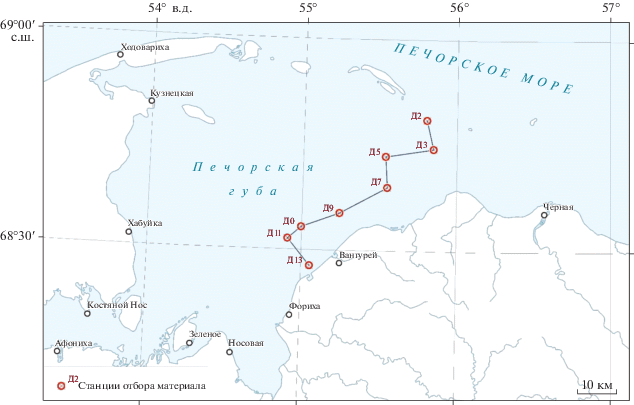
Таблица 1.
Основные характеристики станций отбора проб
| Номер станции | Координаты | Глубина, м |
|---|---|---|
| Д2 | 68°48.65 N 55°48.08 E | 17.5 |
| Д3 | 68°44.54 N 55°50.85 E | 7.5 |
| Д5 | 68°43.42 N 55°32.17 E | 7.6 |
| Д7 | 68°39.03 N 55°32.93 E | 6.9 |
| Д9 | 68°35.28 N 55°14.54 E | 10.2 |
| Д0 | 68°33.22 N 54°59.75 E | 9.3 |
| Д11 | 68°31.56 N 54°54.59 E | 8.2 |
| Д13 | 68°27.74 N 55°03.28 E | 6.4 |
На палубе весь материал был промыт через сито с ячеей 0.5 мм и зафиксирован 96% этиловым спиртом. В лаборатории пробы были разобраны, все виды определены и взвешены с точностью до третьего знака в граммах. Все экземпляры доминирующего вида – Limecola balthica – были поштучно взвешены с точностью до третьего знака в граммах и промерены (с точностью до второго знака в мм) по стандартной для двустворчатых моллюсков схеме: длина, высота, ширина раковины. Объем выборки составил 130 особей. Для разделения выборки по размерным классам использовался алгоритм Mixture analysis, реализованный в программе Past v. 3.25 [15]. Анализ сходства станций и выделение сообществ были проведены с помощью методов многомерного шкалирования и кластерного анализа с использованием пакета программ PRIMER 6.0. В качестве меры обилия использовали относительную интенсивность метаболизма M = ${{k}_{i}}N_{i}^{{0.25}}{\text{B}}_{i}^{{0.75}},$ где Ni – численность, Bi – биомасса организмов, а ki – специфический коэффициент для конкретной таксономической группы.
РЕЗУЛЬТАТЫ
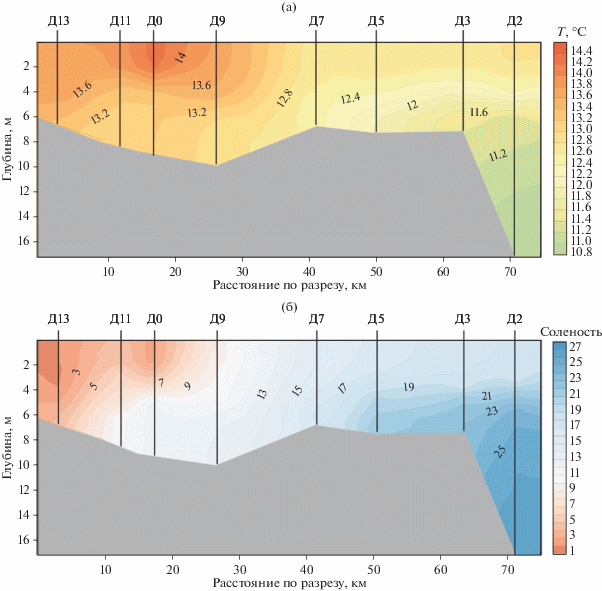
Сборами был охвачен диапазон глубин от 6.5 до 17.5 м. Придонная соленость менялась от 4.0 до 26.5 psu, увеличиваясь в направлении выхода из губы р. Печоры к морю. Диапазон придонных температур составил от 11 до 13°С, минимальные значения температур наблюдались в мористой части губы. На всем протяжении разреза зарегистрирована двухслойная структура водной толщи с выраженным слоем скачка основных гидрофизических параметров, расположенном на глубинах от 2 до 6 м. Также наблюдается выраженный эстуарный фронт, который в период исследований находился между станциями Д9 и Д7 (рис. 2). Грунт на мористых станциях (Д2, Д3) – слабо заиленный песок, на остальных – ил и глина.
Рис. 2.
Схематическое расположения станций отбора проб на субширотном разрезе и значения температуры (а) и солености (б) в момент съемки. Профиль и положение станции соответствуют линии на рис. 1.
Всего в дночерпательных и траловых пробах обнаружено 24 вида донных беспозвоночных животных, еще один вид (Gammaracanthus loricatus) был пойман ихтиопланктонной сетью. Один вид – Hyas araneus – в количестве трех мелких особей был обнаружен только в траловых сборах. Также в траловых сборах обнаружен единственный экземпляр Galathowenia oculata. Средняя биомасса по дночерпательным пробам составила 30.7 г/м2, среднее число видов – 8.7 на пробу (от 7 до 11) (табл. 2).
Таблица 2.
Видовой состав и количественные характеристики макробентоса по станциям (N – численность, зкз/м2, B – биомасса, г/м2; для станций Д5, Д7, Д9, Д11, Д0 приведены средние и предельные значения)
| Вид | Д2 | Д13 | Д5–Д11 | |||
|---|---|---|---|---|---|---|
| N | B | N | B | N | B | |
| Limecola balthica | 5 | 7.25 | 5 | 6.93 | 123 (60–260) | 30.9 (7.0–72.3) |
| Ampharete vega | 0 | 0 | 5 | 0.01 | 1 (0–5) | 0.002 (0–0.1) |
| Capitella capitata | 0 | 0 | 0 | 0 | 3 (0–15) | 0.004 (0–0.015) |
| Cirratulidae gen. sp. | 0 | 0 | 0 | 0 | 2 (0–5) | 0.001 (0–0.0025) |
| Eteone ex gr. flava | 5 | 0.01 | 5 | 0.005 | 2 (0–5) | 0.0025 (0–0.005) |
| Marenzelleria arctia | 0 | 0 | 225 | 0.47 | 29 (0–65) | 0.153 (0–0.63) |
| Marenzelleria wireni | 5 | 0.405 | 0 | 0 | 0 | 0 |
| Micronephthys minuta | 0 | 0 | 0 | 0 | 85 (0–395) | 0.077 (0–0.295) |
| Nephtys longosetosa | 5 | 0.25 | 0 | 0 | 0 | 0 |
| Ophelia limacina | 20 | 0.855 | 0 | 0 | 0 | 0 |
| Polynoidae gen. sp. | 0 | 0 | 0 | 0 | 3 (0–10) | 0.002 (0–0.005) |
| Prionospio cirrifera | 5 | 0.002 | 0 | 0 | 0 | 0 |
| Scoloplos armiger | 10 | 0.005 | 0 | 0 | 0 | 0 |
| Spionidae gen. sp. | 0 | 0 | 0 | 0 | 1 (0–5) | 0.001 (0–0.0025) |
| Halicryptus spinulosus | 0 | 0 | 5 | 1.19 | 14 (5–20) | 0.359 (0.011–0.89) |
| Nemertea gen. sp. | 0 | 0 | 0 | 0 | 4 (0–10) | 0.202 (0–0.525) |
| Saduria entomon | 0 | 0 | 20 | 1.145 | 2 (0–5) | 1.3 (0–4.47) |
| Monoporeia affinis | 0 | 0 | 635 | 0.66 | 51 (0–170) | 0.028 (0–0.11) |
| Pontoporeia femorata | 0 | 0 | 20 | 0.001 | 316 (75–665) | 0.345 (0.06–1.24) |
| Priscillina armata | 10 | 0.07 | 0 | 0 | 0 | 0 |
| Diastylis sulcata | 0 | 0 | 5 | 0.001 | 88 (25–130) | 0.052 (0.05–1.24) |
| Amphipoda: Caprellidae | 0 | 0 | 0 | 0 | 1 (0–5) | 0.0001 (0–0.0005) |
| Суммарная биомасса | 8.8475 | 10.411 | 33.4 (7.5–74.9) | |||
| Суммарное число особей | 65 | 925 | 725 (270–1025) | |||
| Число видов | 8 | 9 | 8.8 (7–11) | |||
Все станции были весьма сходны между собой по видовому составу, за исключением самой мористой станции Д2. Здесь обнаружено шесть видов макрозообентоса, отсутствующих на других станциях: Marenzelleria wireni, Nephtys longosetosa, Ophelia limacina, Prionospio cirrifera, Scoloplos armiger и Priscillina armata. Кроме того, на этой станции не были найдены Halicryptus spinulosus, Pontoporeia femorata, Diastylis sulcata, присутствующие на всех остальных станциях. Marenzelleria wireni отмечена только при входе в губу (ст. Д2), на остальных станциях обычна Marenzelleria arctia. Единственный вид, встреченный на всех без исключения станциях – Limecola balthica (рис. 3).
Рис. 3.
Суммарная биомасса (размер круга) и относительное обилие (площади секторов) доминирующих видов на исследованных станциях.

По структурному сходству все станции близки между собой и представляют варианты монодоминантного сообщества, в котором доминирующий вид (Limecola balthica) обеспечивает 80–90% биомассы сообщества. Наименьшее структурное сходство с остальными станциями демонстрируют станция Д13, расположенная ближе всего к устью р. Печоры, с самой низкой долей участия доминирующего вида (66.5% от общей биомассы), а также станция Д2 с самой низкой общей биомассой и заметными фаунистическими отличиями (рис. 4). Остальные станции представляют собой единую группу (simproof test, p < 0.05). Выявленное сообщество может быть обозначено как сообщество Limecola balthica с участием характерных видов Halicryptus spinulosus, Pontoporeia femorata, Diastylis sulcata и Marenzelleria arctia. Тем не менее, внутри данного сообщества мы все равно наблюдаем постепенное изменение видового состава вдоль эстуарного градиента. В наиболее опресненной части (станции Д13–Д9) наблюдается постоянное присутствие видов Saduria entomon и Monoporeia affinis, при этом последний доминирует по численности на наиболее опресненной станции Д13 (635 экз/м2). Напротив, на более мористых станциях Д7 и Д5 эти виды исчезают, но появляются полихеты Micronephthys minuta, Capitella spp., Cirratulidae gen. sp. и Polynoidae gen. sp. Различия видового состава между двумя группами станций достоверны (рис. 4, simproof test, p < 0.05) и очевидно определяются положением эстуарного фронта, который проходит как раз между станциями Д7 и Д9 (рис. 2).
Рис. 4.
Дендрограмма сходства станций по фаунистическому составу ((а) – индекс Жаккара) и по видовой структуре ((б) – индекс Брея-Кёртиса). Жирным цветом показаны группы станций, достоверно выделяемые по SIMPROOF-test (p < 0.05).

Анализ размерной структуры популяции Limecola balthica в районе исследований показал присутствие нескольких размерных (возрастных) классов. Наиболее наглядно это выглядит при анализе индивидуальных весов особей (рис. 5). Вся выборка распадается на три класса с центральными значениями 0.12, 0.6 и 1.28 мм. Самый мелкий класс – самый обильный. По длине раковины выделяются две отчетливые группы с центральными значениями 11.6 и 17.7 мм. В собранном материале не найдено ни одного экземпляра Portlandia aestuariorum, ни в целом виде, ни в виде отдельных створок.
ОБСУЖДЕНИЕ
Исчезновение в обширном районе достаточно массового вида – факт, заслуживающий внимания и анализа. Portlandia aestuariorum регистрировалась в Печорской губе как обильный по численности и распространенный вид с 1926 до 1990-х гг. Н.А. Мосевич [5] пишет о 14 экземплярах, собранных, скорее всего, в результате одного траления. Наиболее подробные данные представлены Н.В. Денисенко с соавторами [13] для 1995 г. Портландия входила в состав сообщества Limecola balthica с достаточно высокими показателями обилия вида: средней биомассой 14.2 г/м2 и средней численностью 50 экз/м2, что соответствует 5 экземплярам на пробу. Показатель встречаемости был определен в 0.29. Это сообщество было описано на девяти станциях, расположенных вокруг точки первого описания вида. Средняя биомасса сообщества на этих станциях была почти на порядок больше (130.3 ± 64.8 г/м2), чем по данным нашей съемки (30.7 г/м2). Это различие определяется, в основном, за счет двух видов моллюсков Portlandia arctica и Cyrtodaria kurriana со средними биомассами 62.5 и 14.2 г/м2. Второй вид сохранился в Печорской губе, в 2016 г. он был обнаружен на мелководьях ее северо-западной части на глубине около 1 м [14]. Выпадение двух видов из состава сообщества не повлекло изменения в обилии других видов. Структура сообщества, обнаруженного на всех станциях, достаточно близка к описанной Н.В. Денисенко с соавторами [13] в 1995 г. Наблюдаемые изменения можно трактовать как расширение комплекса видов, характерного в прошлом для наиболее распресненной части губы, в сторону моря до входного бара. Это привело к выпадению малоподвижных форм, не адаптированных к обитанию в области критической солености по В.В. Хлебовичу [10]. Наблюдаемые нами значения придонной солености на большинстве станций не выходят за пределы амплитуды толерантности Portlandia aestuariorum – 10–14 psu, при которых этот вид регистрировался в Печорской губе в прошлом. Возможное объяснение может заключаться в увеличении паводкового стока р. Печоры в 1990-х гг. [2]. Однако наблюдаемые изменения [1, 2] не столь велики, чтобы вызвать полное вытеснение видов и смещение границ сообществ. Другое объяснение следует искать в популяционной биологии отдельных видов, которая остается слабо изученной.
Популяция доминирующего вида – Limecola balthica, выглядит благополучной и устойчивой. Судя по размерной структуре, в популяции присутствует несколько возрастных классов. Если опираться на соотношение между длиной раковины и возрастом, полученное для Белого моря, близкого по условиям (прежде всего – температурным), то модальному классу 11 мм соответствует возраст 3–5 лет, а модальному классу 17 мм – 7–8 лет [3]. По данным для Мурманского побережья [6] моллюски таких размеров должны быть на несколько лет старше. Вне зависимости от абсолютного возраста популяция Limecola имеет полимодальную структуру с несколькими пиками, соответствующими нескольким последовательным актам успешного пополнения. Такая структура свидетельствует о равновесном состоянии популяции.
Благодарности. Мы выражаем глубокую благодарность научному составу и членам команды ИС “Картеш” за помощь при сборе материала, а также Центру Морских Исследований МГУ (ЦМИ МГУ) за организацию морских экспедиционных работ.
Источник финансирования. Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-05-60 053) и Госзадания ИОРАН № 0128-2021-0007.
Список литературы
Алексеевский Н.И., Магрицкий Д.В., Михайлов В.Н. Антропогенные и естественные изменения гидрологических ограничений для природопользования в дельтах рек Российской Арктики // Водн. Хоз. Рос. 2015. № 1. С. 14–31.
Денисенко С.Г. Многолетние изменения зообентоса в Печорском море // Изв. РГО. 2006. Т. 138. № 2. С. 137–148.
Максимович Н.В., Герасимова А.В., Кунина Т.А. Продукционные свойства поселений Macoma balthica в губе Чупа (Белое море) 2. Продукция // Вестн. Лен. Унив. Сер. 3. 1993. Вып. 1. С. 3–11.
Мокиевский В.О., Удалов А.А., Чава А.И., Симакова У.В., Кокарев В.Н., Неретина Т.В. Сообщества Portlandia арктических морей: таксономические и структурные различия на географическом градиенте // Докл. РАН. Науки о Земле. 2020. Т. 493. № 2. С. 88–92.
Мосевич Н.А. Материалы к систематике, экологии и распространению современной и ископаемой Yoldia arctica (Gr.). Мат. Ком. по изуч. Якутской АССР, в. 19, 1928.
Назарова С.А., Генельт-Яновский Е.А., Максимович Н.В. Линейный рост Maсоmа balthica в осушной зоне Мурманского побережья Баренцева моря // Вестн. СПбГУ. Сер. 3. 2010. Вып. 4. С. 35–43.
Наумов А.Д. Белое море и его донные экосистемы // Исследования фауны морей. Т. 78(86). СПб.: ЗИН РАН, 2019. 413 с.
Погребов В.Б, Кийко О.А., Стогов И.А., Чернова Н.В. Состав, структура и многолетняя динамика экосистемы Печорской губы // Выборочные материалы семинара “Мониторинг Печорского моря: настоящее и будущее”. Нарьян-Мар, 16–19 сентября, 2002. С. 35–39.
Филатова З.А. Некоторые зоогеографические особенности двустворчатых моллюсков рода Portlandia // Труды ИОАН. 1951. Т. VI. С. 117–131.
Хлебович В.В. Критическая соленость биологических процессов. Л.: Наука. Ленингр. отд., 1974. 236 с.
Чуксина Н.А. Гидробиологическое изучение Северной Двины и Печоры м опресняемых ими районов моря // Тр. Всес. Гидроб. общ. 1981. Т. 24. С. 89–96.
Чуксина Н.А. К оценке устьевой области реки Печоры как рыбохозяйственного водоема // Водные ресурсы. 1987. 4. С. 141–142.
Denisenko N.V., Denisenko S.G., Lehtonen K.K. Distribution of macrozoobenthos in an Arctic estuary (Pechora Bay, SE Barents Sea) during the spring flood period // Polar Biol. 2019. Vol. 42(9). P. 1667–1684.
Gebruk A.A., Borisova P.B., Glebova M.A., Basin A.B., Simakov M.I., Shabalin N.V., Mokievsky V.O. Macrozoobenthos of the shallow waters of Pechora Bay (SE Barents Sea) // Nature Conservation Research. 2019. V. 4(4). P. 1–11.
Hammer O., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics software package for education and data analysis // Paleontologia Electronica. 2001. V. 4(1). P. 1–9.
Kantor Y.I., Sysoev A.V. Catalogue of molluscs of Russia and adjacent countries. M.: KMK Scientific Press, 2005. 627 p.
Дополнительные материалы отсутствуют.



