Океанология, 2022, T. 62, № 2, стр. 245-259
Сезонная динамика альгофлоры стратифицированного озера Кисло-Сладкое, частично изолированного от Белого моря
Д. А. Иванова 1, *, Е. Д. Краснова 2, Д. А. Воронов 3, И. Г. Радченко 1
1 Кафедра общей экологии и гидробиологии, Биологический факультет, Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Беломорская биологическая станция им. Н.А. Перцова МГУ им. М.В. Ломоносова
пос. Приморский, Республика Карелия, Россия
3 Институт проблем передачи информации им. А.А. Харкевича РАН
Москва, Россия
* E-mail: da.ivanova99@yandex.ru
Поступила в редакцию 18.08.2021
После доработки 21.09.2021
Принята к публикации 16.12.2021
- EDN: JINWLO
- DOI: 10.31857/S0030157422020083
Аннотация
Приведены данные по составу и обилию альгофлоры в прибрежном стратифицированном озере Кисло-Сладкое (Карельский берег Белого моря) после осенней промывки морской водой. Исследована сезонная динамика и вертикальная структура фитопланктона с 17 марта по 3 октября 2019 г., а также ледовая флора 17 марта и 1 апреля того же года. Наибольшая углеродная биомасса ледовых водорослей, 0.79 г С/м3, отмечена в апреле с доминированием Nitzschia frigida. Интегрированная биомасса фитопланктона в столбе воды изменялась от 0.01 г С/м2 в марте, достигала 5.83 г С/м2 в период весеннего цветения в конце мая с доминированием Chaetoceros invisibilis и до октября менялась в пределах 0.07–0.29 г С/м2, при этом автотрофные водоросли сменялись гетеротрофными формами. Регрессионный анализ показал, что на структуру фитопланктона оказывали влияние длина светового дня, температура воды, содержание растворенного кислорода, глубина, рН воды, соленость и освещенность.
ВВЕДЕНИЕ
При изоляции морского залива от моря водоем оказывается в качественно новом состоянии, которое с точки зрения гидрологии характеризуется как меромиксия, а в плане экологии – как новая экосистема, биота которой уникальна по сравнению с морем, от которого происходит отделение. Новый водоем характеризуется вертикальной неоднородностью абиотических и биотических компонентов экосистемы [13].
Извилистая береговая линия, которая отличает берег Белого моря от побережья многих других морей, волнистый донный рельеф, где глубокие участки перемежаются с песчаными и каменистыми отмелями, достаточно высокая скорость поднятия берега [22] способствуют отделению морских заливов от моря и преобразованию их в озера.
Поскольку на беломорском побережье таких водоемов много, на разных стадиях отшнуровывания от моря, то, выстроив их в типологический ряд, можно реконструировать события прошлого и предсказать, что произойдет с морским заливом, если отделить его искусственно. Если при гидростроительстве, в первую очередь при конструировании приливных электростанций и при сооружении фильтрующих дамб для строительства мостов, создается существенное препятствие для приливного течения, в водоеме неминуемо возникнет стратификация [3, 19]. Нижняя часть водной толщи станет непригодной для жизни аэробной фауны и флоры, а, в случае поступления большого количества органических веществ, например, в виде бытовых стоков или в виде рыбных фекалий и неусвоенного корма при садковом разведении рыбы, граница сероводородного заражения может подняться настолько высоко, что во всем водоеме существование аэробных организмов станет невозможным.
Большинство научно-исследовательских работ по меромиктическим озерам посвящены их гидрологии. Экологические исследования чаще всего касаются сообществ микроорганизмов хемоклина и анаэробной зоны. Из арктических и субарктических отделившихся от моря озер отдельные исследования фитопланктона были проведены в оз. Могильном [1, 4, 6, 17, 14, 18 ] и норвежском фьорде Фрамварен [31, 43]. Исследования фитопланктона беломорских прибрежных водоемов до недавнего времени ограничивались разовыми съемками [12, 32], которые не позволяют составить представление ни об альгофлоре, ни об ее сезонной изменчивости. Настоящая работа посвящена исследованию динамики ледовых водорослей и фитопланктона в прибрежном меромиктическом озере Кисло-Сладкое, находящемся на начальной стадии изоляции. Его уровень незначительно поднят над уровнем моря, что приводит к периодическому нарушению меромиксии из-за забросов большого количества морской воды с последующим установлением стратификации.
Целью настоящей работы являлось исследование развития стратификации озера после промывки озера поздней осенью 2018 г. и сопряженных изменений в составе, численности и биомассе ледовой флоры и фитопланктона в различных слоях толщи воды в течение вегетационного сезона, а также выделение абиотических факторов, определяющих динамику структуры фитопланктона.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для работы послужили пробы льда и воды, отобранные на станции с максимальной глубиной в Кисло-Сладком озере с марта по октябрь 2019 года.
Характеристика района исследования. Кисло-Сладкое озеро находится в Кандалакшском заливе в 1.5 км от Беломорской биологической станции им. Н.А. Перцова МГУ им. М.В. Ломоносова (рис. 1). Площадь поверхности озера – 16 200 м2, площадь водосборного бассейна – 157 000 м2, средняя глубина – 1–1.5 м, максимальная глубина – 4.5 м [13]. Примерно 150 лет назад озеро было узким проливом между северным коренным берегом полуострова Киндо и небольшим безымянным островом с подводными порогами по обеим сторонам, которые в результате общего поднятия суши вышли на поверхность и образовали перемычки, отделяющие акваторию озера от пролива Великая Салма [41]. Кисло-Сладкое озеро изолировано от Белого моря частично: в сизигийный прилив происходят заплески морской воды через один из поднятых на поверхность порогов. Летом для озера характерна пятислойная структура: верхний слой подвергается опреснению, под ним располагается пикноклин, далее аэробный слой с морской соленостью, затем хемоклин и нижний сероводородный слой. Однако поздней осенью, когда море охлаждается до отрицательных температур, в озеро могут приходить водные массы с повышенной плотностью и опускаться на дно, что приводит к промывке водоема. В другие же годы к моменту ледостава, который защищает водоем от забросов из моря, в озере сохраняется стратификация, которая установилась летом. Эти два сюжета чередуются, и до 2018 года в озере наблюдалась квазицикличность с сохранением стратификации на протяжении двух лет [15].
Отбор проб. Для исследования ледовых водорослей озера отбирали керны льда с помощью ледовой пилы. Нижнюю 10-сантиметровую часть керна помещали в пластиковую емкость и растапливали при комнатной температуре. Пробу растаявшего льда (440–867 мл) фиксировали раствором формалина с конечной концентрацией 2%.
Для исследования фитопланктона пробы воды объемом 41–2060 мл отбирали с различных глубин от 0.5 до 4.5 м (придонный слой) с помощью погружного насоса Whale Premium Submersible Pump GP1352 (США) и фиксировали формалином с конечной концентрацией 2%. Глубины выбирали с шагом 1 м, чтобы охватить всю аэробную зону. В течение лета сформировалась и постепенно увеличивалась в объеме придонная анаэробная зона, где фитопланктона нет, поэтому нижние горизонты не включали в анализ. Дополнительные пробы с 10-сантиметровым шагом брали, когда граница аэробной и анаэробной зон (хемоклин) оказывалась между стандартными глубинами, так как в этом узком слое обычно формируется своеобразное сообщество.
Одновременно на разной глубине измеряли соленость кондуктометрами WTW Cond 3110 (Германия) и YSI Pro (США), последним также измеряли температуру in situ; содержание растворенного кислорода определяли с помощью оксиметра YSI Pro ODO (США), pH и окислительно-восстановительный потенциал (ОВП) – портативными измерителями WaterLiner WMM-73 (Тайвань), освещенность – бытовым люксметром LuxLiner LMI-20 (Китай), модифицированным для погружения под воду. Помимо концентрации кислорода в мг/л, оксиметр рассчитывал проценты насыщенности воды кислородом. Перед каждой серией измерений прибор калибровали, чтобы концентрация кислорода в воздухе была 100%. Для измерения освещенности подо льдом делали отдельную лунку малого диаметра и опускали в нее люксметр, не удалив шугу, которая образуется при сверлении льда. Таким образом в лунке оставался почти весь ледовый материал, только в раздробленном виде. За границу фотической зоны принимали глубину, на которую поступал 1% падающей солнечной радиации. Длину светового дня рассчитывали на основании данных с сайта “Meteonovosti.ru” [44] как промежуток времени между восходом и заходом солнца.
Обработка проб. При необходимости пробы растопленного льда и воды для просчета в счетной камере концентрировали методом обратной фильтрации и отстойным методом [23].
Все 53 пробы просчитывали под световым микроскопом МИКМЕД-1 (ЛОМО, Россия) при увеличении ×300 и c водной иммерсией при увеличении ×600 в камере Нажотта (объем 0.05 мл). Просчитывали по 4 камеры для проб марта–апреля и по 3 камеры для проб мая–октября.
Современную классификацию водорослей приводили по электронной базе данных “AlgaeBase” [28].
Неидентифицированные динофитовые водоросли делили на группы согласно строению клеточной стенки: голые (naked) и панцирные (armored). По группам согласно максимальному линейному размеру разделяли неидентифицированные эвгленовые (<30/≥30 мкм) и криптофитовые водоросли (≤20/>20 мкм), пеннатные диатомеи (16–18 мкм и 19–35 мкм) и сборную группу Thalassiosira spp. (11–22, 26–32 и 37–48 мкм). Неидентифицированные коккоидные и жгутиковые клетки были объединены в группу НКЖ с градацией по размерам: 3–8, 10–16, 18–22 и 24–32 мкм.
Для верификации видовой принадлежности диатомовые водоросли дополнительно просматривали при помощи сканирующего электронного микроскопа (Camscan S-2 Cambridge Scanning Electron Microscope, Великобритания) в Центре коллективного пользования МГУ им. М.В. Ломоносова.
При подсчете и идентификации клетки водорослей измеряли окуляр-микрометром и определяли их объемы методом геометрического подобия [29]. Объемы клеток использовали для расчета углеродной биомассы (ВС) согласно уравнениям [35] и полагая, что 1 мкм3 соответствует 1 пг (10–12 г) биомассы клетки [38]. Измерения проводили для 1–25 клеток каждого вида и определяли среднюю углеродную биомассу вида (или группы видов определенного размерного диапазона). Интегрированную углеродную биомассу (Bint, мгC/м2) в столбе воды оценивали трапециевидным интегрированием BС от поверхности до дна.
Способ питания водорослей определяли по электронной базе данных “Nordic Microalgae” [45] или визуально, по наличию хлорофилла.
Статистический анализ проводили с использованием пакета программ “PRIMER (v.6) and PERMANOVA+” [25].
При анализе сходства структуры фитопланктона в качестве характеристики структуры фитопланктона в пробе рассматривали значения Bint 99 таксонов и групп таксонов, трансформированные путем извлечения из них квадратного корня, чтобы снизить влияние доминирующих видов на оценку сходства. Матрицу сходства строили, используя индекс Брея-Кертиса, при котором вклад каждого вида пропорционален его обилию в пробе. Процедуру неметрического многомерного шкалирования (nMDS) использовали для визуализации сходства между пробами: пробы, которым соответствует бóльшая мера сходства, располагаются на диаграмме ближе друг к другу. Наиболее близко расположенные пробы объединяли в группы. Одноуровневый анализ сходства (one-way ANOSIM) применяли, чтобы определить, были ли выделенные на основании результатов nMDS группы достоверно отличными друг от друга. Процедуру процентного анализа сходства (SIMPER) использовали для определения различия между группами проб и уровня сходства внутри групп проб, а также для выделения характерных видов, наличие и обилие которых обусловливало высокое сходство проб внутри каждой группы. Для тех проб, которые не объединились в группы, в качестве характеристики структуры фитопланктона в пробе рассматривали значения BС на соответствующей глубине.
При анализе влияния абиотических факторов на динамику структуры фитопланктона в качестве характеристики структуры фитопланктона в пробе рассматривали значения BС 99 таксонов и групп таксонов на соответствующей глубине, трансформированные путем извлечения из них квадратного корня. Для оценки возможного влияния на динамику структуры фитопланктона были выбраны такие абиотические факторы, как соленость и температура воды, глубина отбора пробы, концентрация растворенного кислорода, рН воды, освещенность, длина светового дня – в качестве непрерывных переменных, а также знак ОВП конкретного слоя воды – в качестве дискретной переменной. Оценку проводили методом регрессионного анализа, основанным на матрице сходства (DistLM), где отбор объясняющих переменных проходил пошагово и в качестве критерия отбора был использован скоректированный R 2 (adjusted R 2). Для ординации значений из данной модели использовали анализ избыточности на матрицах расстояний (dbRDA).
РЕЗУЛЬТАТЫ
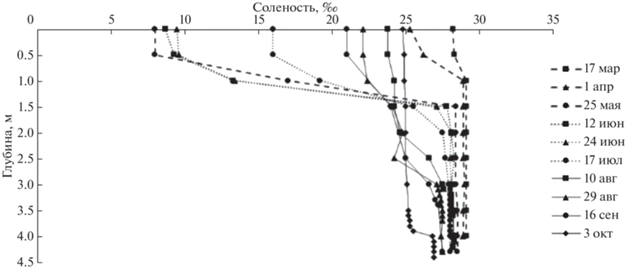
Гидрологические условия. Соленость всей толщи озерной воды подо льдом в марте и в апреле держалась на одном уровне и составляла 29.1 и 28.9‰ соответственно (рис. 2), за исключением вод, непосредственно контактировавших со льдом: их соленость была несколько ниже вследствие подтаивания льда. После схода льда, к 25 мая, поверхностный слой озера стал опресненным за счет растаявшего льда и поступления пресной воды с водосборной площади. Установилась стратификация водного столба. На глубине около 1 м наблюдался галоклин: перепад солености между выше- и нижележащими слоями составлял 20.4‰. В период с мая по июль соленость поверхностных вод увеличивалась от 8 до 16‰ из-за постоянного их стока из озера в Белое море и смешения с подповерхностными солеными водами. К 10 августа галоклин стал менее выраженным, перепад солености между поверхностным и придонным горизонтами составил 6.2‰ в сентябре и 2.1‰ в октябре.
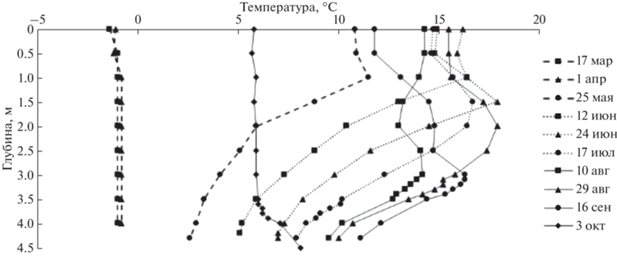
Температура воды в период ледового покрытия была отрицательной (рис. 3). Температура подповерхностных вод была квазиоднородной (‒1°С в марте и –0.8°С в апреле). После схода льда начался прогрев озера, температура увеличивалась, достигнув максимума на поверхности в конце июля – 16.2°С. Для периода с мая по сентябрь характерна термическая стратификация водной толщи, где самый теплый слой находился не на поверхности, а на глубине 1–3.2 м. Максимальная температура в нем достигала в конце августа +17.9°С. Авторы предыдущих исследований [13] полагают, что поскольку вода в озере прозрачная, то солнечные лучи хорошо прогревают дно и придонную воду, но разность в плотности слоев препятствует теплообмену с атмосферой, что создает “эффект парника”. Ниже теплого слоя температура равномерно уменьшалась с глубиной. В октябре в озере установилась обратная термическая стратификация, аналогичная таковой в пресных водоемах умеренных широт осенью [7].
Длина светового дня увеличивалась от 11.9 ч в период ледового покрытия, достигала максимальных значений – 24 ч в июне, затем падала до 11.1 ч в октябре. Освещенность также росла от весны к лету, достигнув максимальных значений в июне, и падала к осени (рис. 4). При прохождении через толщу воды освещенность резко уменьшалась на глубине около 1 м. В период ледового покрытия глубина фотической зоны была около 0.5 м. После схода льда в солнечные дни фотическая зона распространялась либо на всю глубину озера (июнь), либо ее граница проходила возле дна (октябрь). В пасмурные дни, в зависимости от сезона, фотическая зона распространялась только до глубин 3.1–4 м.
Значения рН воды в период ледового покрытия были нейтральными – 7.01–7.23. Начиная с весеннего цветения, значения pH оказались в более щелочной области, при этом максимальные показания отмечались до конца июня – 8.83–8.98. С июля по октябрь pH уменьшался от поверхности ко дну, где становился нейтральным, при этом наблюдалось небольшое повышение в срединных слоях озера. Значения концентрации растворенного кислорода в толще воды в период ледового покрытия были самыми низкими (рис. 5). В марте до глубины 1 м толща воды была аэробной, глубже 1 м – микроаэробной, в апреле ниже 1 м сложились заморные условия с отрицательным ОВП. К маю по всему водному столбу концентрация растворенного кислорода выросла и достигла 223% насыщения. Считается [13], что пикноклин задерживает не только тепло, но и кислород, который образуется в ходе фотосинтеза. Вероятно, благодаря этому в июне вся толща воды также была аэробной с максимальными значениями 248.3–270.7% ниже 2.5 м. Начиная с июля, в Кисло-Сладком появился хемоклин как слой с резким изменением характеристики химического состава воды: на глубине 3.6 м концентрация кислорода достигала 0 мг/л, ниже располагалась сероводородная зона. В последующие месяцы глубина сероводородной зоны то поднималась, то опускалась.
Рис. 5.
Вертикальное изменение концентрации растворенного в воде кислорода в вегетационный период 2019 г.

Видовая структура альгофлоры. В период исследований обнаружено 99 таксонов и групп таксонов водорослей, из которых 54 определены до вида и 23 – до рода, принадлежащих 10 классам: Bacillariophyceae (21), Coscinodiscophyceae (5), Mediophyceae (11), Dinophyceae (19), Oxyrrhidophyceae (1), Cyanophyceae (14), Chlorophyceae (2), Trebouxiophyceae (1), Dictyochophyceae (2), Thecofilosea (1). Остальные водоросли были отнесены нами к Euglenozoa, Cryptophyta и НКЖ.
Большая часть альгофлоры представлена морскими видами, но встречались и пресноводные – 16 видов, все с автотрофным типом питания, относящиеся к классам Bacillariophyceae (3), Coscinodiscophyceae (1), Cyanophyceae (9), Chlorophyceae (2), Trebouxiophyceae (1).
Биомасса и доминирующие таксоны. В период ледового покрытия в марте–апреле наибольшая ВC водорослей отмечалась во льду (табл. 1). В марте во льду доминировали гетеротрофные эвгленовые водоросли и автотрофная пеннатная диатомовая водоросль Navicula septentrionalis. К началу апреля вследствие улучшения световых условий ВС ледовой флоры выросла более чем в 60 раз, а доминирующим наряду с высоким обилием N. septentrionalis стал ледовый вид Nitzschia frigida. Автотрофная пеннатная диатомовая водоросль N. frigida присутствовала во льду и в марте, но высокого обилия не достигала.
Bint в столбе воды изменялась от 0.01 г С/м2 в марте, достигала 5.83 г С/м2 в период весеннего цветения в конце мая и до октября менялась в пределах 0.07–0.29 г С/м2 (рис. 6).
Рис. 6.
Сезонная динамика интегрированной биомассы (Вint) фитопланктона в озере Кисло-Сладкое в вегетационный период 2019 г.

Подо льдом в марте и апреле ВC фитопланктона уменьшалась с глубиной (табл.). В середине марта преобладали гетеротрофная динофлагеллята Micracanthodinium claytonii, бесцветные криптофитовые водоросли и автотрофные НКЖ. В апреле в подледном фитопланктоне основную массу составляли автотрофные пеннатные диатомовые водоросли N. frigida и N. septentrionalis, которые, по-видимому, поступали в толщу воды изо льда. В мае, когда после схода ледового покрова установилась стратификация водного столба с опресненным верхним слоем, ВC фитопланктона достигла наибольших за весь период исследований значений. При этом на всех глубинах доминировала морская автотрофная диатомовая водоросль Chaetoceros invisibilis. В начале июня ВC увеличивалась от поверхности ко дну. Максимальные значения в придонных слоях связаны с доминированием гетеротрофной водоросли Ebria tripartita, которая вегетировала во всех слоях, кроме поверхностного. В конце июня наибольшие значения ВC также отмечены в придонном слое, где доминировала автотрофная динофитовая водоросль Gymnodinium arcticum. В опресненных поверхностных водах в июне преобладали такие автотрофные пресноводные виды, как Microcystis ichtyoblabe, M. pulverea, cf. Nanofrustulum trainorii и, по-видимому, пресноводные НКЖ, дававшие вклад в BC до 29%. В июле максимальные значения ВC отмечены на поверхности, где наибольший вклад давала E. tripartita, и на глубине 3.6 м, где большей частью доминировали также гетеротрофные водоросли: динофитовые Oxyrrhis marina, растущая только в этом слое, и Gyrodinium fusiforme, вегетация которой распространялась на все слои, кроме поверхностного и придонного. С августа по октябрь наибольшие значения BC наблюдались на разных горизонтах водного столба и определялись высоким обилием водоросли O. marina.
Таблица 1.
Углеродная биомасса фитопланктона (ВC), доминирующие виды/группы видов и типы их питания (А – автотрофный, Н – гетеротрофный, М – миксотрофный, ? – неизвестный); в скобках даны доли видов/ групп видов в ВC фитопланктона, полужирным начертанием выделены пресноводные виды
| Биотоп | BC, мг С/м3 | Доминирующие виды/группы видов | Тип питания |
|---|---|---|---|
| 17.03.2019 | |||
| Лед | 12.99 | spp. Euglenozoa (56%) | H |
| Navicula septentrionalis (18%) | A | ||
| НКЖ 3–8 μm (10%) | A | ||
| 0.5 м | 5.84 | Micracanthodiniumclaytonii (43%) | H |
| 2.5 м | 1.08 | НКЖ 3–8 μm (45%) | A |
| 3.5 м | 2.62 | spp. Cryptophyta (32%) | H |
| 01.04.2019 | |||
| Лед | 791.49 | Nitzschia frigida (68%) | А |
| N. septentrionalis (18%) | А | ||
| 0.5 м | 73.26 | N. frigida (36%) | A |
| N. septentrionalis (33%) | A | ||
| 2.5 м | 5.92 | N. frigida (52%) | A |
| 3.5 м | 0.51 | N. frigida (34%) | A |
| N. septentrionalis (33%) | A | ||
| 25.05.2019 | |||
| 0.5 м | 462.94 | Chaetoceros invisibilis (90%) | A |
| 1.5 м | 705.69 | C. invisibilis (99%) | A |
| 2.5 м | 2287.40 | C. invisibilis (98%) | A |
| 3.5 м | 1922.34 | C. invisibilis (98%) | A |
| 4.0 м | 1672.38 | C. invisibilis (98%) | A |
| 4.3 м | 1751.62 | C. invisibilis (83%) | A |
| 12.06.2019 | |||
| 0.5 м | 5.72 | НКЖ 3–8 μm (29%) | A |
| Microcystis ichtyoblabe (15%) | A | ||
| 1.5 м | 28.47 | Oblea rotunda (35%) | H |
| 2.5 м | 30.94 | Ebria tripartita (24%) | H |
| НКЖ 10–16 μm (18%) | A | ||
| 3.5 м | 70.81 | E. tripartita (36%) | H |
| 4.3 м | 104.97 | E. tripartita (32%) | H |
| 24.06.2019 | |||
| 0.5 м | 8.64 | M. ichtyoblabe (29%) | A |
| cf. Nanofrustulum trainorii (21%) | A | ||
| 1.5 м | 2.77 | Microcystis pulverea (22%) | A |
| НКЖ 3–8 μm (19%) | A | ||
| 2.5 м | 9.58 | E. tripartita (49%) | H |
| 3.5 м | 47.82 | Gymnodinium arcticum (50%) | A |
| 4.5 м | 104.45 | G. arcticum (72%) | A |
| 17.07.2019 | |||
| 0.5 м | 40.52 | E. tripartita (62%) | H |
| 1.5 м | 7.95 | НКЖ 3–8 μm (35%) | A |
| 2.5 м | 1.50 | НКЖ 3–8 μm (43%) | A |
| 3.5 м | 3.50 | НКЖ 10–16 μm (42%) | A |
| 3.6 м | 56.27 | Oxyrrhis marina (43%) | H |
| Gyrodinium fusiforme (34%) | H | ||
| 4.1 м | 7.83 | Kamptonema laetevirens (50%) | A |
| 10.08.2019 | |||
| 0.5 м | 4.96 | E. tripartita (86%) | H |
| 1.5 м | 0.29 | НКЖ 3–8 μm (86%) | A |
| 2.5 м | 5.90 | Dinophysis norvegica (65%) | M |
| НКЖ 3–8 μm (33%) | A | ||
| 3.0 м | 17.45 | E. tripartita (35%) | H |
| НКЖ 3–8 μm (33%) | A | ||
| 3.4 м | 179.49 | O. marina (85%) | H |
| 4.0 м | 10.11 | НКЖ 3–8 μm (81%) | A |
| 29.08.2019 | |||
| 0.5 м | 6.66 | Naked dinoflagellate (32%) | ? |
| 1.5 м | 7.73 | E. tripartita (53%) | H |
| 2.5 м | 11.81 | Scrippsiella trochoidea (44%) | A |
| 3.4 м | 127.96 | O. marina (98%) | H |
| 3.5 м | 172.25 | O. marina (95%) | H |
| 16.09.2019 | |||
| 0.5 м | 18.25 | O. marina (25%) | H |
| Naked dinoflagellate (25%) | ? | ||
| 1.5 м | 41.20 | E. tripartita (35%) | H |
| 2.5 м | 30.07 | G. fusiforme (90%) | H |
| 3.0 м | 87.38 | O. marina (79%) | H |
| 3.3 м | 13.80 | O. marina (46%) | H |
| НКЖ 3–8 μm (43%) | A | ||
| 3.4 м | 17.52 | НКЖ 3–8 μm (58%) | A |
| 03.10.2019 | |||
| 0.5 м | 3.83 | O. marina (51%) | H |
| G. fusiforme (37%) | H | ||
| 1.5 м | 7.38 | G. fusiforme (57%) | H |
| 2.5 м | 27.01 | G. fusiforme (74%) | H |
| 3.5 м | 52.56 | O. marina (71%) | H |
| 3.8 м | 891.14 | O. marina (98%) | H |
| 3.9 м | 750.54 | O. marina (99%) | H |
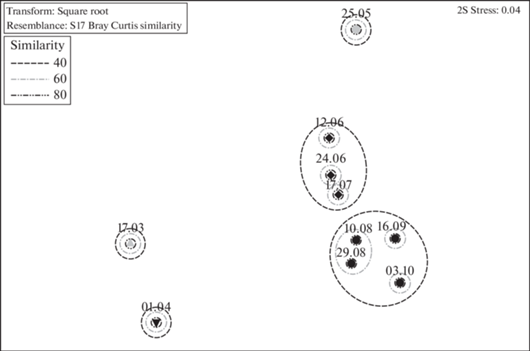
Сообщества фитопланктона. nMDS проб фитопланктона на основе Bint показало, что на уровне сходства 40% пробы объединяются в 2 группы: группу проб июня-июля и группу проб с августа по октябрь (рис. 7). Три пробы, 17 марта, 1 апреля и 25 мая, не вошли ни в одну группу. Одноуровневый ANOSIM выявил достоверные различия между выделенными группами/пробами (наблюдаемое значение статистики R = 0.503, p = 0.001). По результатам анализа SIMPER, различие между пробами 17 марта и 1 апреля составляет 69.86%, между 1 апреля и 25 мая – 97%. Поскольку пробы 17 марта, 1 апреля и 25 мая представляют собой Bint подпроб фитопланктона с разных горизонтов, это позволило нам рассматривать каждую пробу как группу подпроб, чтобы с помощью процедуры SIMPER определить характерные виды для группы подпроб. Характерными видами или группами видов являются: для 17 марта – криптофитовые водоросли (вклад в сходство – 56.29%), для 1 апреля – N. frigida (39.25%) и N. septentrionalis (33.62%), для 25 мая – C. invisibilis (95.67%), определивший весеннее цветение. Сходство внутри группы проб июня–июля составляет 52.27%, характерными видами являются E. tripartita (22.23%), G. fusiforme (13.56%) и G. arcticum (12.96%). Сходство внутри группы проб августа–октября составляет 49.95%, характерный вид – O. marina (52.95%). Различие между группами подпроб 25 мая и проб июня–июля составляет 77.74% и пробами июня–июля и августа–октября – 66.40%.
Рис. 7.
Ординация (nMDS) проб фитопланктона на основе Bint, трансформированной в корень квадратный. На диаграмме представлены даты отбора проб и линии, объединяющие группы проб со сходством 40–80% (similarity).
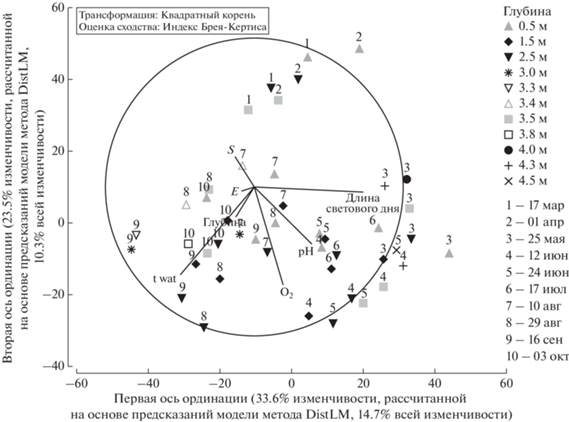
Факторы среды, определяющие динамику и структуру фитопланктона. DistLM определил, что при последовательном анализе (sequential tests) 7 из 8 исследуемых параметров окружающей среды оказывали статистически достоверное влияние на формирование структуры фитопланктона. В порядке убывания влияния этими переменными были: длина светового дня (Daylight), температура воды (t wat), содержание растворенного кислорода (О2), глубина (Depth), рН воды, соленость (S) и освещенность (E). На них приходилось 43.8% изменчивости структуры фитопланктона (p < 0.05 во всех случаях). ОВП был исключен из модели регрессии при пошаговом отборе (step-wise selection procedure) как несущественная объясняющая переменная. dbRDA (рис. 8) показал, что в течение года происходит смена факторов, определяющих состав фитопланктона. Пробы, отобранные в период ледового покрытия, обособляются, и главными факторами служат температура воды и глубина. При этом отмечается высокое сходство между соседними глубинами разных дат (0.5 м 17 марта и 2.5 м 1 апреля, 2.5 м 17 марта и 3.5 м 1 апреля), что, по-видимому, объясняется оседанием фитопланктона. В мае решающее значение имеет длина светового дня, что характерно для весеннего цветения [39]. В июне–июле длина светового дня влияет в меньшей степени, и существенными для структуры фитопланктона оказываются рН воды и содержание растворенного кислорода. Оба эти параметра связаны с самим фитопланктоном: выработанным в ходе фотосинтеза кислородом и усилением процессов деструкции в придонной зоне вследствие оседания мортмассы. В августе–октябре, когда увеличивалось доминирование гетеротрофного фитопланктона, главными факторами оказываются сезонное уменьшение температуры воды, ухудшение световых условий и рост солености.
Рис. 8.
Анализ избыточности на матрицах расстояний (dbRDA) линейной модели, описывающий связь между факторами среды (соленость (S), температура воды (Twat), глубина отбора пробы (Depth), концентрация растворенного кислорода (O2), рН, освещенность (E), длина светового дня (Daylight)) и структурой фитопланктона. Номер маркера соответствует хронологическому номеру даты отбора проб относительно первой (17 марта).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В период исследований в вертикальном распределении фитопланктона Кисло-Сладкого озера не обнаружена слоистая структура, характерная для меромиктических водоемов, а также отсутствовал типичный для области хемоклина вид – криптофитовая водоросль Rhodomonas sp. [12, 32 ], что и следовало ожидать в год после промывки озера морской водой [15].
В сезонной динамике фитопланктона Кисло-Сладкого озера отмечены весеннее цветение и осеннее увеличение биомассы, но не выявлен летний пик биомассы, характерный для Белого моря. Наблюдения за динамикой альгофлоры Белого моря в течение вегетационного сезона были проведены только в двух районах, расположенных в Кандалакшском заливе – в приустьевом участке губы Чупа (декадная станция ББС “Картеш” ЗИН РАН) и в проливе Великая Салма [30]. Согласно этим наблюдениям в сезонном развитии фитопланктона обычно наблюдается два пика биомассы – весенний и летний, в некоторые годы прослеживается менее выраженное осеннее увеличение обилия фитопланктона. Следует отметить, что максимальное обилие водорослей в Кисло-Сладком озере осенью наблюдалось не в поверхностном слое, как в море, а в слое над хемоклином (на глубине 3.9 м).
Период ледового покрытия. Биомасса ледовых водорослей возрастала c марта к апрелю, что обусловлено увеличением падающей радиации и, соответственно, улучшением световых условий для водорослей. В марте и в апреле уровень радиации в нижних слоях льда при ясной погоде достигал 250–900 лк, что было выше компенсационной интенсивности света [33]. Увеличение биомассы в нижнем слое льда в марте-апреле было также показано для Белого моря [8, 9, 20, 40 ]. В сравнении с ранними исследованиями ледовой флоры в морской акватории BC ледовых водорослей в Кисло-Сладком озере как в марте (12.99 мгС/м3), так и в апреле (791.49 мгС/м3) была значительно ниже значений, полученных в губе Чупа в марте 2001 г. (115.9–674.1 мгС/м3) и в апреле 2002 г. (1164–35 428 мгС/м3) [40]. BC, пересчитанная на интегрированную под квадратным метром, в нижнем 10-сантиметровом слое льда в середине марта (12.99 мгС/м3 × 0.1 м = 1.3 мгС/м2) была близка к значениям, полученным в проливе Великая Салма в 1997 г. (1.79 мгС/м2), но выше значений, полученных в Кандалакшском заливе в 2002 г. (0.89 мгС/м2), и ниже значений, полученных в губе Чупа в 2003 г. (29.28 мгС/м2) [9], а также в 2013 и 2014 гг. (2.5–38.4 мгС/м2) [16]. В середине апреля значение того же параметра (79.1 мгС/м2) превышало таковое в проливе Великая Салма в 1997 г. (1.68–4.10 мгС/м2) и в губе Чупа в 2003 г. (34.77–64.70 мгС/м2) или находилось в пределах варьирования в Кандалакшском заливе в 2002 г. (2.17–88.86 мгС/м2) [9]. Пространственно-временнáя изменчивость обилия ледовых водорослей характерна для арктических льдов, причем выявлены как микромасштабная (несколько метров–десятки метров), так и мезомасштабная (сотни метров–километры) вариабельность [9], что обусловлено такими факторами, как толщина льда, соленость, температура, содержание биогенных элементов, морфология нижней поверхности льда, генезис ледового покрова и др.
Подледный фитопланктон был лимитирован низкой освещенностью (фотическая зона составляла около 0.5 м), поэтому большая часть его биомассы концентрировалась в верхнем слое толщи воды озера, а в его составе преобладали гетеротрофные эвгленовые водоросли и фототрофные ледовые водоросли N. frigida и N. septentrionalis, возможно, вымываемые в толщу воды с нижней поверхности льда. С ростом биомассы ледовых водорослей в апреле увеличился их выход изо льда в толщу воды. В период таяния льда и расширения каналов с рассолом происходит потеря ледового сообщества [33]. Тяжелые колониальные пеннатные водоросли опускались и доминировали даже в придонных слоях. Опускание ледовых водорослей косвенно подтверждается проведенным в настоящей работе анализом DistLM, который показал более высокое сходство вышележащего слоя в марте с нижележащим слоем в апреле (до горизонта 3.5 м) и меньшее сходство близлежащих горизонтов как в марте, так и в апреле, а также меньшее сходство аналогичных горизонтов марта и апреля. Доминирование во льду и в подледном планктоне Белого моря водоросли N. frigida характерно для весеннего периода [2, 9, 16, 21, 30, 39 , 40 ] так же, как и N. septentrionalis [30, 40 ]. BC в подледном планктоне озера в марте (5.84 мгС/м3) была ниже значений, полученных в губе Чупа в 2001 г. (15–444 мг С/м3) [40], в 2017 г. (78.4 мгС/м3) [39], выше таковых в проливе Великая Салма в 1997 г. (0.18 мгС/м3) и в пределах варьирования в 1974 г. (2–21 мгС/м3) [30]. В апреле BC в подледном планктоне озера (73.26 мгС/м3) была в пределах варьирования в губе Чупа в 2002 г. (3–647 мгС/м3) [40], выше таковых в проливе Великая Салма в 1970, 1974, 1977, 1997, 2009 гг. (0.28–30 мгС/м3), в Кандалакшском заливе в 2002 г. (1.0–5.86 мгС/м3) [9, 30] и в губе Чупа в 2017 г. (1.4–56.0 мгС/м3) [39], но ниже таковых в губе Чупа в 2003 г. (772.3 мгС/м3) [9, 30] и в проливе Великая Салма в 2010 г. (115.7 мгС/м3) [2]. Пространственно-временная изменчивость обилия подледного фитопланктона также характерна для арктических морей [33].
Весеннее цветение. В мае 2019 г. в озере Кисло-Сладкое установилась стратификация водного столба, вызванная опреснением поверхностного слоя. Поступление пресной воды в озеро происходило за счет таяния льда, талых вод с водосбора и впадающего ручья. При этом фитопланктон был представлен большей частью морскими формами. Основу биомассы фитопланктона во всей толще воды составляла морская диатомовая водоросль C. invisibilis, достигавшая высокого обилия даже в опресненном слое. Высокое обилие водоросли способствовало обогащению водной толщи кислородом и потреблению бикарбонат-иона, что вело к смещению карбонатного равновесия в щелочную сторону в верхнем слое толщи. Полученные нами значения биомассы фитопланктона в поверхностном слое (0.46 гС/м3) соответствуют таковым в период весеннего цветения губы Чупа в 1968 г., где биомасса достигала 8.1 г/м3 (в пересчете на углеродную биомассу – примерно 0.5 гС/м3 [24]) и доминировали крупные виды Coscinodiscus concinnus и Thalassiosira gravida, а также комплексы родов Navicula и Nitzschia [11]. Обилие C. invisibilis в Кисло-Сладком озере было таково, что интегрированная биомасса фитопланктона в этот период (5.8 гС/м2) значительно превосходила таковую в море в 2017 г. – 1.4 гС/м2, где доминировали крупные голые динофлагелляты и водоросли Thalassiosira sp. [39].
Вид C. invisibilis описан недавно [26] и был обнаружен только в Белом и Карском морях [21, 27]. В Белом море он встречался в губе Чупа Кандалакшского залива в апреле-мае при температуре воды 3–9°С и солености 25–32‰ [5]. Высокая биомасса данного вида в озере Кисло-Сладкое в мае 2019 г. является результатом отсутствия лимитирования ресурсами: освещенностью и, вероятно, достаточным количеством биогенных элементов, поступивших в водную толщу из донного осадка при зимнем перемешивании озера из-за морской интрузии. Максимум биомассы C. invisibilis приходился на более глубокие слои (начиная с 2.5 м), где соленость воды составляла 28.4–28.5‰, а температура – 2.6–5.1°С. Эти физико-химические параметры воды, по-видимому, были оптимальными для данного вида. Есть вероятность, что C. invisibilis более широко распространен в Белом море, однако из-за мелких размеров не замечается исследователями при просмотре в световом микроскопе. При работе со световым микроскопом для обнаружения C. invisibilis лучше пользоваться объективом c водной иммерсией при увеличении ×600, а для адекватного подсчета вода в счетной камере должна отстояться, поскольку водоросль оседает очень медленно.
Летне-осенний период. В июне–июле в озере вегетировало сообщество фитопланктона, характерными видами которого по результатам регрессионного анализа стали E. tripartita, G. fusiforme и G. arcticum. При этом в июне началось расслоение фитопланктона. На поверхности доминировали пресноводные M. ichtyoblabe, M. pulverea и cf. N. trainorii, вероятно, привнесенные впадающим в озеро ручьем. Глубже преобладали морские гетеротрофные виды E. tripartita и Oblea rotunda, а также автотрофный вид G. arcticum. Биомасса фитопланктона значительно уменьшилась по сравнению с майскими показателями, что предположительно связано с лимитированием биогенными элементами, концентрация которых в озере могла упасть после цветения C. invisibilis, также уменьшилась концентрация кислорода. С этим может быть связано и появление гетеротрофных форм, которые активно питались автотрофными водорослями. Максимальные значения суммарной биомассы в озере (104.45–104.97 мгС/м3) были близки к таковым для Кандалакшского залива в июне 1998 г. (93.1 мгС/м3), когда у поверхности развивался комплекс видов рода Thalassiosira [30], и в июне 2015 г. (97.28–102.51 мгС/м3) с доминированием Skeletonema costatum [10], но выше наибольших значений, полученных в июне 1986–1987 гг. в губе Чупа и в 1999 г. в Кандалакшском заливе – 20–44 мгС/м3 [30].
С июля, когда степень опреснения стала уменьшаться и вблизи дна появился сероводородный слой вследствие усиления бактериальной сульфатредукции, в планктоне Кисло-Сладкого озера наибольшего обилия достигали только морские виды: E. tripartita и динофлагелляты O. marina, G. fusiforme, Dinophysis norvegica, Scrippsiella trochoidea. Максимальные значения суммарной биомассы в июле (40.52 и 56.27 мгС/м3) соответствовали значениям в поверхностном слое для губы Чупа в 1967–1968 гг. (в пересчете на углеродную биомассу – примерно 40.6 и 55.5 мгС/м3 соответственно) [11], но были на порядок ниже полученных для этого района значений в 1986 г. (320 мгС/м3) и 1987 г. (229 мгС/м3) при доминировании Skeletonema costatum и комплекса видов рода Chaetoceros [30], а также значений, полученных для Кандалакшского залива (150 мгС/м3) в 1972 г. [30], где доминировали схожие виды. В тоже время при доминировании НКЖ и автотрофной динофлагелляты Heterocapsa rotundata в июле 2009 г., биомасса фитопланктона в проливе Великая Салма Кандалакшского залива, 13.5–18.0 мгС/м3 [2], была значительно ниже наших значений.
В Кисло-Сладком озере нами был обнаружен ранее не зарегистрированный в водоемах России вид, который мы предположительно определили как Nanofrustulum trainorii (E.A. Morales) E.A. Morales [37]. Данный вид встречался с 25 мая по 10 августа на различных глубинах, кроме придонного слоя, но высокого обилия достигал только в конце июня–июле в поверхностных и подповерхностных горизонтах, где его вклад в BC составлял 14–23% (в остальное время – 0.02–8%). Эта пеннатная диатомовая водоросль с линейными размерами от 3 до 6 мкм и, по-видимому, с широким диапазоном галотолерантности, была впервые найдена в пруду Эйвери (Avery Pond) и в озере Айлс (Lake of Isles) в Коннектикуте США [36].
В августе-октябре сформировалось сообщество фитопланктона с доминирующим и характерным видом – гетеротрофной динофитовой водорослью O. marina. Максимальное обилие ее отмечалось на разных горизонтах, но нижняя граница развития фитопланктона поднималась с увеличением сероводородной области. Доминирование динофлагеллят, начиная с августа, для Белого моря обычно: в Кандалакшском заливе высокого обилия достигали D. norvegica, Ceratium fusus, C. tripos, Karlodinium veneficum, K. vitiligo и Gymnodinium japonica, однако O. marina никогда не входил в число доминирующих видов [30]. Доминирование динофлагеллят может косвенно свидетельствовать о лимитировании диатомовых водорослей недостатком кремния. Кроме того, важное значение имеет стабильность водного столба: усиление турбулентности ведет к доминированию диатомей, тогда как стратификация водного столба способствует преобладанию динофлагеллят [34]. Полученные нами максимальные значения биомассы фитопланктона в августе-октябре (87.38–891.14 мгС/м3) наблюдали глубже 3 м за счет развития O. marina. Вероятнее всего, высокое обилие O. marina связано с развитием микроорганизмов хемоклина и других организмов, которыми он питается вследствие своего широкого спектра пищевых объектов [42]. В верхних слоях толще воды биомасса фитопланктона (0.29–41.20 мгС/м3) соответствовала таковой поверхностных вод Кандалакшского залива с 1970 по 2009 г. – от 3.6 до 57 мгС/м3 при доминировании динофлагеллят [2, 30], но была ниже биомассы фитопланктона в проливе Великая Салма в августе 2010 г. – 130.40 мгС/м3 при доминировании диатомовых водорослей Ditylum brightwelii и Chaetoceros affinis [2].
Таким образом, обилие и состав ледовых водорослей, а также обилие, состав и вертикальное распределение подледного фитопланктона в Кисло-Сладком озере в марте–апреле были аналогичными таковым морской акватории. После схода ледового покрова сезонная динамика и вертикальное распределение фитопланктона, состав доминирующих и характерных видов, их обилие в Кисло-Сладком озере отличались от таковых в Белом море, что обусловлено изоляцией озера и восстановлением гидрологической стратификации. В течение года происходила смена абиотических факторов, определяющих состав фитопланктона: в зимнее время решающее значение имела температура воды и глубина, в конце весны главным фактором стала освещенность, в первой половине лета главную роль играли параметры, связанные с самим фитопланктоном: концентрация кислорода, выработанного им в ходе фотосинтеза, и pH, отражающий смещение карбонатного равновесия в щелочную сторону из-за расходования бикарбонат-иона в верхней части водоема и усиление деструкции оседающей мортмассы в придонном слое, сопровождающееся появлением сероводородной зоны вследствие усиления бактериальной сульфатредукции. В августе–октябре основным фактором стала температура.
Список литературы
Анциферов М.Ю., Трофимов А.Г. Гидрологические условия // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО, 2002. С. 20–33.
Белевич Т.А., Ильяш Л.В. Обилие пикофитопланктона в проливе Великая Салма Белого моря // Микробиология. 2012. Т. 81. № 3. С. 389–389.
Демиденко Н.А., Саввичев А.С., Савенко А.В. Гидрологические и экологические условия водоемов губы Канды, отделенной от Белого моря фильтрующей дамбой // Материалы Всероссийской научной конференции “Поздне- и постгляциальная история Белого моря: геология, тектоника, седиментационные обстановки, хронология” : сборник статей. М.: КДУ, Университетская книга, 2018. С. 43–51.
Дерюгин К.М. Реликтовое озеро Могильное (остров Кильдин в Баренцевом море) // Тр. ПЕНИ. 1925. Т. 2. С. 1–112.
Диатомовые водоросли России и сопредельных стран: ископаемые и современные. Т II, вып. 4 / Ред. Н.И. Стрельникова. СПб.: Изд-во С.-Петерб. ун-та, 2006. 180 с.
Ежова Е.Е., Ланге Е.К., Полунина Ю.Ю. и др. Планктон и бентос меромиктического озера Могильное (о. Кильдин, Баренцево море) // Природа морской Арктики: современные вызовы и роль науки. Тез. докл. Междунар. науч. конф. 2010. С. 71–73.
Ефремова Т.В. Термические процессы в озерах Карелии // Изучение водных объектов и природно-территориальных комплексов Карелии. Петрозаводск: Карельский научный центр РАН, 2007. С. 52–58.
Житина Л.С., Федоров В.Д. Ледово-планктонные водоросли прибрежья Белого моря // Вестник Московского университета. Серия 16. Биология. 2003. № 1. С. 24–31.
Ильяш Л.В., Житина Л.С., Кудрявцева В.А., Мельников И.А. Сезонная динамика видового состава и биомассы водорослей в прибрежных льдах Кандалакшского залива Белого моря // Журнал общей биологии. 2012. Т. 73. № 6. С. 459–470.
Ильяш Л.В., Белевич Т.А., Дриц А.В. Пространственное распределение пикофитопланктона в Белом море в начале лета // Вестник Московского университета. Серия 16. Биология. 2018. Т. 73. № 3. С. 160–165.
Кокин К.А., Кольцова Т.И., Хлебович Т.В. Состав и динамика фитопланктона Карельского побережья Белого моря // Ботан. журн. 1970. Т. 50. № 4. С. 499–509.
Краснова Е.Д., Пантюлин А.Н., Маторин Д.Н. и др. Цветение криптофитовой водоросли Rhodomonas sp. (Cryptophyta, Pyrenomonadaceae) в редокс-зоне водоемов, отделяющихся от Белого моря // Микробиология. 2014. Т. 83. № 3. С. 346–354.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А. и др. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов. Труды Беломорской биостанции МГУ. 2016. Т. 12. С. 211–241.
Краснова Е.Д. Вертикальная зональность в распределении массовых одноклеточных организмов в оз. Могильном в 2018–2019 гг. // Труды VIII международной научно-практической конференции “Морские исследования и образование: MARESEDU-2019”. 2020. Т. 2. С. 444–446.
Краснова Е.Д., Воронов Д.А., Мардашова М.В. Многолетняя динамика гидрологической структуры озера Кисло-Сладкого – полуизолированной лагуны на берегу Белого моря // География: развитие науки и образования. 2020. Т. 1. С. 319–324.
Кудрявцева В.А., Белевич Т.А., Житина Л.С. Видовой состав диатомовых водорослей во льду пролива Великая Салма Белого моря перед весенним цветением // Вестник Московского университета. Серия 16. Биология. 2017. Т. 72. № 2. С. 63–69.
Ланге Е.К. Сообщество фитопланктона меромиктического озера Могильное (о-в Кильдин, Баренцево море) // Природа морской Арктики: современные вызовы и роль науки: тез. докл. междунар. науч. конф. 2010. С. 126–128.
Ланге Е.К., Гогорев Р.М. Современные диатомовые меромиктического озера Могильное (о. Кильдин, Баренцево море) // Диатомовые водоросли: морфология, систематика, флористика, экология, палеогеография, биостратиграфия: материалы XII междунар. науч. конф. диатомологов. 2011. С. 101–104.
Марфенин Н.Н., Малютин О.И., Пантюлин А.Н. и др. Влияние приливных электростанций на окружающую среду. М.: Изд-во МГУ им. М. В. Ломоносова, 1995. 122 с.
Михайловский Г.Е., Житина Л.С. Криопланктонная флора Белого моря и ее сезонная динамика, выявленная методом корреляционного анализа // Океанология. 1989. Т. 29. № 5. С. 796–803.
Ратькова Т.Н., Сажин А.Ф., Кособокова К.Н. Одноклеточное население беломорской пелагиали подо льдом в ранне-весенний период // Океанология. 2004. Т. 44. № 2. С. 259–266.
Романенко Ф.А., Шилова О.С. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений п-ова Киндо // Доклады Академии наук. 2012. Т. 442. № 4. С. 544–548.
Современные методы количественной оценки распределения морского планктона / Отв. ред. М.Е. Виноградов. М.: Наука, 1983. 280 с.
Федоров В.Д. О методах изучения фитопланктона и его активности. М.: Изд-во Моск. ун-та, 1979. 168 с.
Clarke R.K., Gorley R.N. Primer V6: User Manual – Tutorial. Plymouth Marine Laboratory, Plymouth, 2006. 190 p.
Gogorev R.M. A new Chaetoceros species (Bacillariophyta) from Plankton of the Russian Arctic seas and its comparison with species of the section Simplicia // Бот. журн. 2003. Т. 88. № 4. С. 82–100.
Gogorev R.M., Samsonov N.I. The genus Chaetoceros (Bacillariophyta) in Arctic and Antarctic // Novosti Sist. Nizsh. Rast. 2016. V. 50. P. 56–111.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway: National University of Ireland, 2020. http://www.algaebase.org/
Hillebrand H., Dürselen C.D., Kirschtel D. et al. Biovolume calculation for pelagic and benthic microalgae// Journal of Phycology. 1999. V. 35. № 2. P. 403–424.
Ilyash L.V., Belevich T.A., Zhitina L.S. et al. Phytoplankton of the White Sea // Biogeochemistry of the atmosphere, ice and water of the White Sea. Springer, Cham, 2018. P. 187–222.
Klaveness D., Løvhøiden F. Meromictic lakes as habitats for protists // Algae and Cyanobacteria in Extreme Environments. Springer, Dordrecht, 2007. P. 59–78.
Krasnova E.D., Matorin D N., Belevich T.A. et al. The characteristic pattern of multiple colored layers in coastal stratified lakes in the process of separation from the White Sea // Journal of Oceanology and Limnology. 2018. V. 36. № 6. P. 1962–1977.
Leu E., Mundy C.J., Assmy P. et al. Arctic spring awakening – Steering principles behind the phenology of vernal ice algal blooms // Prog. Oceanogr. 2015. V. 139. P. 151–170.
Margalef R. Life-forms of phytoplankton as survival alternatives in an unstable environment // Oceanologica acta. 1978. V. 1. № 4. P. 493–509.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol. Oceanogr. 2000. V. 45. № 3. P. 569–579.
Morales E.A. Morphological studies in selected fragilarioid diatoms (Bacillariophyceae) from Connecticut waters (USA) //Proceedings of the academy of natural sciences of Philadelphia. 2001. V. 151. № 1. P. 105–120.
Morales E.A., Wetzel C.E., Novais M.H. et al. Morphological reconsideration of the araphid genus Pseudostaurosira (Bacillariophyceae), a revision of Gedaniella, Popovskayella and Serratifera, and a description of a new Nanofrustulum species // Plant Ecology and Evolution. 2019. V. 152. № 2. P. 262–284.
Phytoplankton manual / Ed. by A. Sournia. Paris: United Nations Educational, Scientific and Cultural Organization, 1978. 337 p.
Radchenko I., Smirnov V., Ilyash L., Sukhotin A. Phytoplankton dynamics in a subarctic fjord during the under-ice–open water transition // Marine Environmental Research. 2021. V. 164. P. 105–242.
Ratkova T.N., Wassmann P. Sea ice algae in the White and Barents seas: composition and origin // Polar Research. 2005. V. 24. № 1–2. P. 95–110.
Repkina T.Y., Shilova O.S., Krasnova E.D. et al. From the Sea Strait to the Meromictic Lake: Evolution and Ecosystems of Water Bodies at Fiard Coasts (Lake Kislo-Sladkoye at the Kandalaksha Bay Coast, the White Sea, Russia) // Quaternary International, in press.
Roberts E.C., Wootton E.C., Davidson K. et al. Feeding in the dinoflagellate Oxyrrhis marina: linking behaviour with mechanisms // Journal of Plankton Research. 2011. V. 33. № 4. P. 603–614.
Sørensen K. The distribution and biomass of phytoplankton and phototrophic bacteria in Framvaren, a permanently anoxic fjord in Norway // Marine Chemistry. 1988. V. 23. № 3–4. P. 229–241.
http://www.hmn.ru/
http://nordicmicroalgae.org
Дополнительные материалы отсутствуют.