Океанология, 2022, T. 62, № 2, стр. 235-244
Изменение количественных характеристик макро- и мейобентоса в заливе Благополучия с 2013 по 2020 гг. (Новая Земля, Карское море)
П. П. Лепихина 1, 2, *, А. Б. Басин 2, Д. В. Кондарь 2, А. А. Удалов 2, М. В. Чикина 2, В. О. Мокиевский 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: lepikhina_p@mail.ru
Поступила в редакцию 27.05.2021
После доработки 05.08.2021
Принята к публикации 16.12.2021
- EDN: BBKMOW
- DOI: 10.31857/S0030157422020113
Аннотация
Количественные характеристики макро- и мейобентоса залива Благополучия (Новая Земля, Карское море) претерпели значительные изменения между 2013 и 2020 гг. В изученный период на акватории всего залива отмечено существенное увеличение численности мейобентоса при снижении показателей обилия макробентоса. Средние значения плотности поселений мейобентоса увеличились в три раза (с 702 до 2293 экз/10 см2), тогда как средние значения численности макробентоса снизились вдвое – с 1530 до 645 экз/м2. Численность мейобентоса в период между 2013 и 2020 гг. возросла за счет увеличения численности свободноживущих нематод. Наблюдаемые изменения могут быть результатом воздействия на экосистему залива краба-стригуна Chionoecetes opilio. Вселение этого вида в Карское море привело к преобразованиям в донных сообществах залива Благополучия, проявившимся в снижении численности и биомассы макробентоса и компенсационном увеличении плотности мейобентоса.
ВВЕДЕНИЕ
Макро- и мейобентос тесно связаны между собой многочисленными типами взаимодействий [21, 32, 38], однако сравнительные исследования различных аспектов (трофические взаимодействия, модификация макробентосными организмами субстрата и пр.) данных групп, существующих неразрывно друг от друга в донных отложениях, редки. Известно, что количественные изменения макро- и мейофауны взаимозависимы и что увеличение показателей обилия мейобентоса может наблюдаться параллельно со снижением таковых у макробентоса, в частности на градиенте глубин [4, 16, 17, 37], в эстуариях [14] и на прибойной литорали [30]. Другими словами, мейобентос может компенсировать развитие макробентоса и частично замещать его в трофической цепи [18]. К настоящему времени разнонаправленные изменения в обилии макро- и мейобентоса были описаны для моря Лаптевых [17] и для Белого, Баренцева, Восточно-Сибирского [4–6, 18], Балтийского [9] и Чёрного морей [10], что подтверждает гипотезу о компенсации мейобентосом макробентоса.
Если взаимное пространственное распределение макро- и мейобентоса описано довольно подробно, то временные аспекты взаимосвязей макро- и мейобентоса, связанные с долгосрочными перспективами функционирования экосистемы, гораздо менее известны [10]. В последние десять лет Карское море (и в частности, район архипелага Новая Земля) подвергается активной инвазии краба-стригуна Chionoecetes opilio [7, 12, 13]. До вселения краба-стригуна в донных сообществах Карского шельфа отсутствовали массовые крупные хищные декаподы, а донные сообщества западной части Карского моря характеризовались стабильностью [1, 8]. Вселение краба-стригуна в Карское море является уникальным экспериментом в природе. Он дает возможность наблюдения за развитием инвазии чужеродного вида и отклика на нее интактной арктической экосистемы. На фоне общего изменения трофических отношений в донной экосистеме исследование взаимоотношений двух основных размерных блоков – макро- и мейобентоса (в частности, проверка гипотезы компенсации) вызывают особый интерес.
Первое исследование донной фауны залива Благополучия было выполнено в 2013 г. В ходе съемки была описана довольно богатая фауна макробентоса, при этом не наблюдалось существенных различий по численности и биомассе макробентоса между внутренней и внешней частями залива [15]. В 2013 г. краба-стригуна в заливе найдено не было, а в 2014 г. было зарегистрировано первое массовое появление молодых особей C. opilio на дне [40, 41]. Повторный сбор проб макро- и мейобентоса на аналогичной 2013 г. сетке станций, охватывающей весь спектр биотопов, был произведен в 2020 г. В это время максимальная численность крабов вдоль восточного побережья Новой Земли была зарегистрирована именно в заливе Благополучия и достигала 70 экз/100 м2 [3], при этом популяция была уже достаточно зрелой и содержала крупных репродуктивных особей возрастной когорты, осевшей в заливе в 2013–2014 гг. [40, 41].
Цели данной работы – сравнить количественные изменения макро- и мейобентоса в 2013 и 2020 гг. и проверить применимость правила компенсации макробентоса мейобентосом как реакцию на воздействие крупного хищника.
МАТЕРИАЛЫ И МЕТОДЫ
Район исследования. Залив Благополучия расположен на восточном берегу северного острова Новой Земли (75°40′ N, 63°40′ E). Длина залива 12 км, максимальная ширина на входе 6 км. Залив фиордового типа простирается от устья на северо-запад, имеет воронкообразную форму, расширяющуюся к открытому морю, и выраженную котловину с глубинами 180–200 м, отделенную от открытого моря порогом с глубинами около 40 метров. В залив поступает мощный сток двух рек, берущих начало от ледника Налли, расположенного в 5 км от вершины залива.
Климат залива арктический с низкими температурами, высокой влажностью воздуха, частыми осадками и туманами. Залив покрыт льдом с ноября по июнь. Воды залива подвержены сезонным изменениям температурного и соленосного режимов. Летом температура поверхностных вод в центральной части залива составляет +4–5.5°С, снижаясь под влиянием ледникового стока до +1.8°С в куту. Поверхностная соленость увеличивается от внутренней части залива в сторону открытого моря с 21–23 до 31.2–32.5. В летний период термоклин располагается на глубине 40–50 м, под термоклином температура и соленость становятся стабильными и составляют –1.1°С и 34.2–34.5 соответственно. Открытый водообмен между внутренней котловиной залива и внешней частью сохраняется, поскольку порог расположен ниже уровня сезонного термоклина [11]. Осадки в центральном бассейне (на глубинах более 30 м) довольно однородны и представлены хорошо насыщенными кислородом илами, иногда с примесью гальки [15].
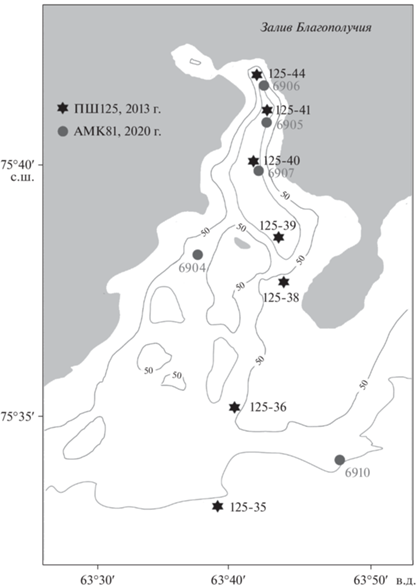
Отбор проб, обработка материала и статистический анализ данных. Исследование было проведено во внутренней части залива Благополучия и на прилегающей части склона Новоземельской впадины (75°40′ N, 63°40′ E). Отбор проб был осуществлен в ходе 125 рейса НИС “Профессор Штокман” в сентябре 2013 года и в ходе 81 рейса НИС “Академик Мстислав Келдыш” в сентябре 2020 года. В 2013 году было выполнено семь станций, в 2020 году – 5 станций на глубинах от 35 до 174 м (рис. 1). Гидрологические и гидрохимические параметры (глубина, соленость, температура придонной воды, концентрация растворенного кислорода, мутность воды) были измерены на всех станциях (табл. 1).
Таблица 1.
Характеристика станций залива Благополучия (О – дночерпатель “Океан”, ВВ – дночерпатель Ван-Вина, БК – бокс-корер)
| Станция | Дата | Орудие сбора макробентоса | Орудие сбора мейобентоса | Широта, с.ш. | Долгота, в.д. | Глубина, м | Придонная вода | |||
|---|---|---|---|---|---|---|---|---|---|---|
| соленость | температура, °C | мутность, ЕМФ | О2, % | |||||||
| 125-35 | 13.09.2013 | О | О | 75°33.4′ | 63°38.4′ | 127 | 34.7 | –0.90 | 0.42 | 83.10 |
| 125-36 | 13.09.2013 | О | О | 75°34.9′ | 63°39.5′ | 65 | 34.4 | –0.93 | 1.17 | 90.00 |
| 125-38 | 14.09.2013 | О | О | 75°37.7′ | 63°43.5′ | 35 | 33.7 | 0.34 | 2.00 | 97.10 |
| 125-39 | 14.09.2013 | О | О | 75°38.0′ | 63°42.8′ | 128 | 34.6 | –1.50 | 1.01 | 85.20 |
| 125-40 | 14.09.2013 | О | О | 75°40.1′ | 63°41.4′ | 148 | 34.6 | –1.48 | 1.04 | 85.60 |
| 125-41 | 14.09.2013 | О | О | 75°41.2′ | 63°42.8′ | 118 | 34.5 | –1.43 | 1.27 | 85.70 |
| 125-44 | 15.09.2013 | О | О | 75°41.9′ | 63°41.9′ | 67 | 34.5 | –1.31 | 1.40 | 86.60 |
| 6904 | 07.09.2020 | ВВ | ВВ | 75°38.0′ | 63°37.6′ | 72 | 34.3 | –0.39 | 1.07 | 83.61 |
| 6905 | 07.09.2020 | ВВ | ВВ | 75°41.1′ | 63°42.8′ | 103 | 34.3 | –0.48 | 1.57 | 81.73 |
| 6906 | 08.09.2020 | ВВ | ВВ | 75°42.0′ | 63°41.7′ | 67 | 34.3 | –0.46 | 3.27 | 83.70 |
| 6907 | 08.09.2020 | ВВ | БК | 75°40.1′ | 63°41.1′ | 174 | 34.4 | –0.49 | 1.61 | 79.02 |
| 6910 | 10.09.2020 | ВВ | ВВ | 75°35.1′ | 63°49.7′ | 98 | 34.3 | –0.36 | 0.90 | 84.74 |
Для сбора проб макрофауны использовали дночерпатели “Океан” и Ван-Вина с площадью раскрытия 0.1 м2. На каждой станции было взято по три пробы. Грунт на макробентос промывали через сито с диаметром ячеи 0.5 мм и фиксировали в 5–6% растворе формалина на борту. Все собранные животные были определены до низшего возможного таксономического ранга, подсчитаны и переведены в 70% спирт. Многоклеточная мейофауна была собрана с помощью дночерпателя “Океан” в 2013 году и с помощью дночерпателя Ван-Вина или бокс-корера (площадь раскрытия 0.25 м2) в 2020 году в зависимости от условий (глубина, тип грунта, волнение моря) (табл. 1). Для изучения количественных характеристик мейобентоса на каждой станции было отобрано по две повторности на глубину 5 см от поверхности осадка трубчатым пробоотборником (площадь 3 см2) в 2020 году и три повторности, усредненные в одну пробу по техническим причинам, в 2013 году. Образцы осадка фиксировали в 4% нейтральном формалине на борту судна, а затем красили бенгальской розой в лаборатории. Экстракцию организмов мейофауны из грунта проводили методом центрифугирования в градиенте плотности водного коллоидного раствора силикатов (LEVASIL®) [22]. Cупернатант промывали через сито с диаметром ячеи 40 мкм. Извлеченные организмы были подсчитаны и классифицированы по основным таксонам.
Статистический анализ данных выполнен в программах MS Excel 2007 и PAST v3.22 [28]. Для оценки достоверности различий численности макро- и мейобентоса между 2013 и 2020 гг. был проведен однофакторный дисперсионный анализ (ANOVA) с последующим применением апостериорных тестов. Наиболее предпочтительным из последних был тест Тьюки (Tukey’s HSD).
РЕЗУЛЬТАТЫ
Абиотические факторы. Температура придонного слоя воды во время съемки 2013 г. составляла –1°C в целом по заливу, средняя концентрация растворенного кислорода равнялась 87.6%, мутность воды изменялась от 0.4 до 2 ЕМФ. В 2020 г. придонная температура была –0.4°C в среднем по заливу, концентрация растворенного кислорода снизилась до 82.6%, мутность воды варьировала в пределах 0.9–3.3 ЕМФ (табл. 1). Средняя по заливу придонная соленость в оба года исследования была 34. Таким образом, в 2020 г. наблюдалось увеличение температуры придонной воды на 0.6°C и снижение концентрации растворенного кислорода на 5% по сравнению с 2013 г.
Макробентос. Плотность поселения организмов в 2013 г. изменялась от 560 до 2720 экз/м2 на станцию (среднее ± стандартное отклонение: 1529.5 ± 513.9 экз/м2), биомасса, в среднем по заливу, составила 73.1 г/м2. В 2020 г. численность организмов была значительно ниже и варьировала в диапазоне 210–1360 экз/м2 на станцию (644.7 ± 362.5 экз/м2), биомасса тоже снизилась и составляла в среднем по заливу 30 г/м2 (рис. 2б, в). По численности в оба года исследования доминировали полихеты и двустворчатые моллюски, по биомассе в 2013 г. – двустворчатые моллюски, сипункулиды и иглокожие, в 2020 – только сипункулиды и двустворчатые моллюски (рис. 3). Средняя численность полихет по заливу в 2013 г. составила 750 экз/м2, тогда как в 2020 г. только 320 экз/м2. Снизилась численность и двустворчатых моллюсков с 507.6 до 294.7 экз/м2. Биомасса двустворчатых моллюсков в среднем по заливу сократилась с 29.1 до 8.4 г/м2, тогда как биомасса сипункулид увеличилась с 13.8 до 18.7 г/м2. В 2020 г. полностью исчезли макробентосные остракоды, представленные единственным видом Philomedes globosus [29], хотя в 2013 г. они были третьими по обилию (168 экз/м2), и иглокожие, представленные офиурами и голотуриями. Соотношение численности полихет и ракообразных сильно изменилось в пользу первых с 6 : 1 (2013 г.) до 48 : 1 (2020 г.).
Рис. 2.
Изменения численности мейобентоса, численности и биомассы макробентоса в 2013 и 2020 гг. и расположение станций по разрезу. Указаны средние значения для каждой станции и стандартное отклонение.

Рис. 3.
Изменения процентного соотношения массовых групп макробентоса в 2013 и 2020 гг. по численности (а, б) и биомассе (в, г). Rest – суммарная численность (а, б) и биомасса (в, г) остальных групп макробентоса.
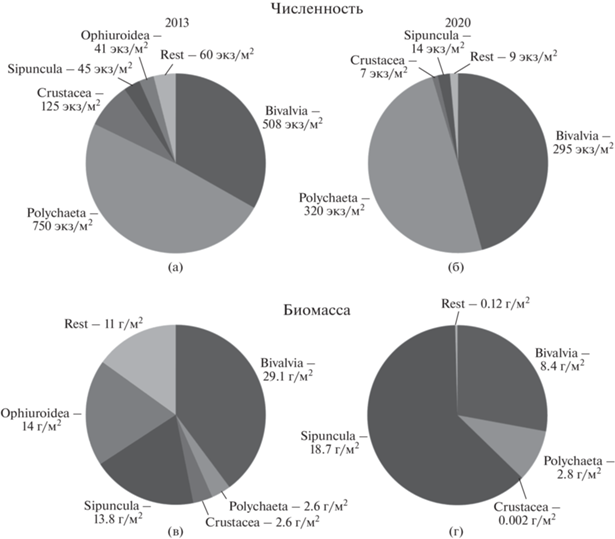
Численность макробентоса в 2013 г. на внешнем склоне залива (ст. 125-35, 125-36, 125-38) была несколько выше, чем в его внутренней части (ст. 125-39, 125-40, 125-41, 125-44). Средняя биомасса организмов между внутренней котловиной и внешней частью залива практически не различалась: 72.5 г/м2 против 73.8 г/м2.
Средняя плотность поселения организмов в 2020 г. во внешней части залива и на пороге (ст. 6904, 6910) была выше, чем в его внутренней части (ст. 6905, 6906, 6907): 928.3 ± 425.2 экз/м2 против 455.6 ± 128.1 экз/м2. Средние значения биомассы макробентоса на пороге и во внешней части залива (59.8 г/м2) были в шесть раз выше, чем во внутренней части (10.1 г/м2), тем самым демонстрируя аналогичную закономерность распределения. Изменения численности двух массовых групп макробентоса – полихет и двустворчатых моллюсков – носят взаимно противоположный характер. По направлению от порога и внешнего склона залива (ст. 6904, 6910) к внутренней акватории происходило постепенное уменьшение доли двустворчатых моллюсков от общей численности макробентоса (с 486.7 до 166.7 экз/м2, т.е. с 52 до 37%). Параллельно происходило увеличение доли полихет от общей численности организмов (с 381.7 до 278.9 экз/м2, т.е. с 41 до 61%). В 2013 г. подобная тенденция отсутствовала, обилие полихет и двустворчатых моллюсков было почти равным во внутренней и внешней частях залива: 78.7/70.1 и 50.3/51.3 экз/м2 соответственно.
Мейобентос. В составе многоклеточного мейобентоса залива Благополучия и на прилегающей части склона Новоземельской впадины, по данным 2013 г., выявлено 14 таксономических групп. По численности лидировали нематоды (Nematoda), на долю которых приходилось более 88% всего мейобентоса на каждой станции, и гарпактикоиды (Harpacticoida), составляя от 0.4 до 12.1% (рис. 4). Остальные группы (Gastrotricha, Ostracoda, Polychaeta, Oligochaeta, Hydrozoa, Kinorhyncha, Tardigrada, Acari, молодь Bivalvia и Priapulida) давали незначительный вклад в общую численность. Hydrozoa, представленные единственным родом и видом Plotocnide borealis (прежде определяемой как Boreohydra simplex [33]), встречаются на двух станциях, при этом на станции 125-44 они достигли 5.8% общей численности и были вторым по обилию. Что касается Harpacticoida, то их доля относительно суммарной численности мейобентоса постепенно увеличивалась с глубиной (за исключением станции 125-36).
Рис. 4.
Изменения процентного соотношения массовых групп мейобентоса в 2013 и 2020 гг. по численности. Rest – суммарная численность остальных групп мейобентоса.
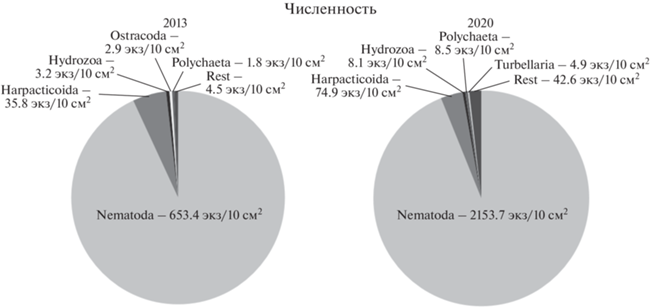
В 2020 г. в составе многоклеточного мейобентоса были найдены представители 11 крупных таксонов. К таксонам, встреченным в 2013 г., добавились Turbellaria и Porifera, однако Tardigrada, Acari, молодь Bivalvia и Priapulida не были встречены. Количественно в пробах преобладали нематоды, на втором месте были гарпактикоиды (рис. 4). Соотношение нематод и гарпактикоидных копепод сильно сдвинуто в сторону доминирования первых, как и в 2013 г. Доля нематод на исследованных станциях была примерно одинаковой – порядка 93.5% (89.4–95.9%) от общей численности, а доля гарпактикоидных копепод не превышала 6.5%.
Таким образом, таксономический состав мейобентоса за семь лет существенно не изменился, доля нематод в суммарной численности была и остается очень высокой.
По данным съемки 2013 г. плотность поселения многоклеточного мейобентоса на исследованных станциях изменялась от 140 до 1912 экз/ 10 см2, составляя в среднем 701.5 экз/10 см2. При этом обилие организмов во внутренней котловине залива (291.5 ± 184.6 экз/10 см2) было на порядок ниже, чем на пороге и внешней стороне склона (1248.2 ± 671.3 экз/10 см2). Т.е. увеличение численности многоклеточного мейобентоса происходит от кутовой части залива в сторону внешнего склона. Такое же распределение демонстрировала самая массовая группа мейобентоса – нематоды, обилие которых варьировало от 134.1 до 1756.5 экз/10 см2, в среднем 653.4 экз/10 см2. Численность гарпактикоидных копепод составляла в среднем 35.8 экз/10 см2, меняясь от 2.4 до 107.1 экз/10 см2.
В 2020 г. общие закономерности количественного распределения мейобентоса остались теми же: высокое обилие на ст. 6910, расположенной на выходе из залива, и последующее снижение через ст. 6904 у порога к внутренним станциям 6905, 6906, 6907. Однако средняя суммарная численность мейобентоса увеличилась более, чем в три раза, и составила 2293 экз/10 см2 (рис. 2а). Увеличение общей численности произошло в большей степени за счет нематод (среднее обилие по всей трансекте – 2153.7 экз/10 см2). Численность гарпактикоидных копепод также возросла, однако не так значительно, как у нематод – в среднем по всем станциям она составила 74.9 экз/ 10 см2. В целом, соотношение между нематодами и гарпактикоидами (нематодно-копеподное отношение) принципиально изменилось: в 2013 г. оно составляло 18.3 : 1, а в 2020 г. – 28.8 : 1. Также наблюдалось увеличение численности гидроидов Plotocnide borealis в два с половиной раза.
Сравнительный анализ количественного распределения макро- и мейобентоса в 2013 и 2020 гг. Результаты однофакторного дисперсионного анализа указывают на статистически значимые различия количественных характеристик макро- и мейобентоса на всей акватории залива между 2013 и 2020 гг. (табл. 2). Таким образом, наблюдается общая направленная тенденция увеличения доли мейобентоса в донном сообществе на фоне ее снижения у макробентоса.
Таблица 2.
Результаты однофакторного дисперсионного анализа количественных изменений мейо- и макробентоса по всему заливу, во внешней и внутренней частях в 2013–2020 гг. (жирным выделены достоверные значения при p < 0.05, жирным курсивом – p < 0.01)
| Фактор | Мейобентос | Макробентос | |||||
|---|---|---|---|---|---|---|---|
| вся акватория залива | внешняя часть | внутренняя часть | вся акватория залива | внешняя часть | внутренняя часть | ||
| Численность | df | 1 | 1 | 1 | 1 | 1 | 1 |
| MS | 7.38383 × 106 | 6.74123 × 106 | 2.13998 × 106 | 2.28364 × 106 | 792 675 | 1.43617 × 106 | |
| F | 6.276 | 10.31 | 4.505 | 11.45 | 2.403 | 14.3 | |
| Residuals | df | 10 | 3 | 5 | 10 | 3 | 5 |
| MS | 1.17646 × 106 | 653 682 | 475 011 | 199 506 | 329 887 | 100 422 | |
| Total | df | 11 | 4 | 6 | 11 | 4 | 6 |
ОБСУЖДЕНИЕ
Сопоставление результатов 2013 и 2020 гг. показывает, что в заливе Благополучия между двумя годами исследований наблюдается заметная трансформация донных сообществ. Данная трансформация проявляется, во-первых, в уменьшении численности и биомассы макробентоса и сопровождается изменением структуры на уровне крупных таксонов. В период исследования общая численность и биомасса макробентоса сократились в два раза. Полностью исчезли такие массовые группы как офиуры и макробентосные остракоды, в то время как биомасса сипункулид относительно общей биомассы, напротив, возросла с 18.9 до 62.3%. Средние значения численности двух доминирующих групп – полихет и двустворчатых моллюсков – сократились в три и два раза соответственно. Соотношение численности полихет и ракообразных увеличилось в сторону первых в восемь раз.
Во-вторых, наблюдается трехкратное увеличение численности мейобентоса с изменением соотношения двух доминирующих таксонов – нематод и гарпактицид – с 18.3 : 1 до 28.8 : 1. Таксономический состав мейобентоса на уровне крупных таксонов между 2013 и 2020 гг. существенно не изменился. Численность мейобентоса пропорционально увеличилась как во внутренней, так и во внешней частях залива, т.е. общий характер распределения мейобентоса с более высокой численностью на внешнем склоне остался неизменным. Общие показатели обилия возросли главным образом за счет увеличения численности нематод, обилие представителей других групп мейобентоса осталось практически без изменений. В оба года исследования нематоды заметно опережали гарпактицид и другие группы мейобентоса по обилию, составляя 93–95% в среднем по заливу. Наблюдалось также двукратное увеличение численности гидроидов Plotocnide borealis в 2020 г. Рост их обилия может быть реакцией на увеличение пищевого ресурса – нематод [33]. Мы предполагаем, что описанные выше изменения обилия макро- и мейобентоса связаны между собой.
В качестве одной из причин наблюдаемых изменений можно предположить возможные изменения гидрологической структуры залива, связанные как с режимом стока, так и с водообменом с Карским морем. Уменьшение площади выводных ледников, а также их усиленное таяние, наблюдаемое для архипелага Новая Земля [2], может способствовать увеличению седиментации взвешенного теригенного вещества, что, несомненно, приводит к изменению таксономической структуры и количественных характеристик сообществ макробентоса [27, 36]. Однако сравнение распределения мутности по заливу в 2013 и 2020 гг. это не подтверждает. Наблюдаемое повышение температуры в придонном слое также может приводить к уменьшению доли арктических элементов фауны в макробентосе и изменению структуры сообществ [1, 39], однако наши данные не позволяют определить, является ли данное повышение многолетним трендом или межгодовой (либо сезонной) флуктуацией.
Наиболее вероятной причиной снижения обилия макробентоса и изменения его структуры является хищничество краба-стригуна C. opilio, являющегося активным неизбирательным хищником в бентосе [26, 40], при этом организмы мейобентоса не являются предпочитаемым кормом краба из-за их малых размеров. В 2013 г. в заливе Благополучия краба-стригуна зарегистрировано не было, тогда как в 2020 г. его численность на данной акватории была самой высокой вдоль восточного побережья архипелага Новая Земля и достигала 70 экз/100 м2 [3]. Ответное изменение обилия мейобентоса может иметь две причины. Первая причина – это использование той доли органического вещества, которая ранее потреблялась макробентосом. В литературе есть ряд работ, показывающих быструю реакцию мейобентоса и нематод, в первую очередь на поступление дополнительной органики [34, 35]. Вторая причина – уменьшение давления макробентосных хищников. Многочисленные экспериментальные исследования показали, что мейофауна является важным составляющим рациона эпибентосных хищников [23], например, креветок [19, 31]. Кроме этого, ряд исследований указывает на то, что хищническое поведение макробентосных организмов влияет на численность мейобентоса [20, 24, 25], в частности, продемонстрировано возрастание плотности поселений мейофауны в результате снижения численности выедающих ее макробентосных хищников [20], что и наблюдается в заливе Благополучия. Последующий детальный анализ пищевых связей и распределения потоков органического вещества в бентосе позволит оценить достоверность этих гипотез.
Список литературы
Антипова Т.В., Семенов В.Н. Состав и распределение бентоса юго-западных районов типично морских вод Карского моря // Экология и биоресурсы Карского моря. Апатиты: Изд-во. Кольского научного центра РАН. 1989. С. 127–137.
Архипелаг Новая Земля и Карское море: геохимия, гляциология, радиационное состояние / Ред. Флинт М.В. М.: АПР. 2018. 152 с.
Галкин С.В., Залота А.К., Удалов А.А., Пронин А.А. Оценка плотности популяций краба-вселенца Chionoecetes opilio в Карском море с использованием БНПА “Видеомодуль” // XVII Международная научно-техническая конференция “Современные методы и средства океанологических исследований”. 2021. (В печати).
Гальцова В.В. Мейобентос в морских экосистемах (на примере свободноживущих нематод) // Тр. ЗИН. 1991. Т. 224. 240 с.
Голиков А.Н., Аверинцев В.Г. Биоценозы верхних отделов шельфа архипелага Земли Франца-Иосифа и некоторые закономерности их распределения. Биоценозы шельфа Земли Франца-Иосифа и фауна сопредельных акваторий // Иссл. фауны морей. 1977. Т. 14. № 22. С. 5–54.
Голиков А.Н., Скарлато О.Н., Аверинцев В.Г. и др. Экосистемы Новосибирского мелководья и некоторые закономерности их распространения и функционирования // Экосистемы Новосибирского мелководья и фауна моря Лаптевых и сопредельных вод Арктического океана. Л.: Наука. 1990. С. 4–79.
Зимина О.Л. Находка краба-стригуна Chionoecetes opilio (O. Fabricius, 1788) (Decapoda: Majidae) в Карском море // Биология моря. 2014. Т. 40. № 6. С. 497–499.
Козловский В.В., Чикина М.В., Кучерук Н.В., Басин А.Б. Структура сообществ макрозообентоса юго-западной части Карского моря // Океанология. 2011. Т. 51. №. 6. С. 1072–1081.
Максимов А.А., Петухов В.А. Роль макро- и мейобентоса в донных сообществах вершины Финского залива // Тр. ЗИН. 2011. Т. 315. №. 3. С. 289–310.
Мокиевский В.О., Воробьева Л.В., Гарлицкая Л.А. и др. Многолетние изменения в мейобентосе восточной части Чёрного моря // Океанология. 2010. Т. 50. № 6. С. 994–1001.
Степанова С.В., Недоспасов А.А. Особенности гидрофизического и гидрохимического режимов залива Благополучия (Новая Земля) // Океанология. 2017. Т. 57. №. 1. С. 1–11.
Соколов А.М. Интродукция краба-стригуна опилио в Карское море как пример дальнейшей адаптивной стратегии этого вида в российском секторе Арктики (по результатам исследований ПИНРО в 2013 г.) // Рыбное хозяйство. 2014. Т. 6. С. 63–67.
Спиридонов В.А., Залота А.К., Веденин А.А. Быстрое развитие инвазии краба-стригуна (Chionoecetes opilio) в Карском море // Материалы научной конференции “Экосистема Карского моря – новые данные экспедиционных исследований”. М.: Институт Океанологии РАН. 2015. С. 179–183.
Удалов А.А., Бурковский И.В., Мокиевский В.О. и др. Изменения основных характеристик микро-, мейо- и макробентоса по градиенту солености в эстуарии Белого моря // Океанология. 2004. Т. 44. № 4. С. 549–560.
Удалов А.А., Веденин А.А., Симаков М.И. Донная фауна залива Благополучия (Новая Земля, Карское море) // Океанология. 2016. Т. 56. № 5. С. 720–730.
Удалов А.А., Кондарь Д.В., Милютина М.А. и др. Количественное распределение мейобентоса в Байдарацкой губе (Карское море) // Океанология. 2017. Т. 57. № 1. С. 171–182.
Шереметевский А.М. Роль мейобентоса в биоценозах шельфа южного Сахалина, восточной Камчатки и Новосибирского мелководья // Иссл. фауны морей. 1987. Т. 35. № 43. 135 с.
Шереметевский А.М. К вопросу о компенсации развития макробентоса мейобентосом на примере мидиевых банок Белого моря // Экология моря. 1991. Т. 39. С. 89–91.
Bell S.S., Coull B.C. Field evidence that shrimp predation regulates meiofauna // Oecologia. 1978. V. 35. P. 141–148.
Bell S.S. Au experimental study of the relationship between below-ground structure and meiofauna taxa // Mar Biol. 1983. V. 76. № 1. P. 33–39.
Braeckman U., Van Colen C., Soetaert K. et al. Contrasting macrobenthic activities differentially affect nematode density and diversity in a shallow subtidal marine sediment // Mar Ecol Prog Ser. 2011. V. 422. P. 179–191.
Burgess R. An improved protocol for separating meiofauna from sediments using colloidal silica sols // Mar Ecol Prog Ser. 2001. V. 214. P. 161–165.
Coull B.C. Are members of the meiofauna food for higher trophic levels? // Trans Am Microsc Soc. 1990. V. 109. P. 233.
Danovaro R., Scopa M., Gambi C., Fraschetti S. Trophic importance of subtidal metazoan meiofauna: evidence from in situ exclusion experiments on soft and rocky substrates // Mar Biol. 2007. V. 152. P. 339–350.
Fleeger J.W., Johnson D.S., Galván K.A., Deegan L.A. Top-down and bottom-up control of infauna varies across the saltmarsh landscape // J Exp Mar Biol Ecol. 2008. V. 357. P. 20–34.
Gebruk A., Zalota A.K., Dgebuadze P. et al. Trophic niches of benthic crustaceans in the Pechora Sea suggest that the invasive snow crab Chionoecetes opilio could be an important competitor // Polar Biol. 2021. V. 44. № 1. P. 57−71.
Görlich K., Weslawski J.M., Zajaczkowski M. Suspension settling effect on macrobenthic biomass distribution in the Hornsund fjord, Spitsbergen // Polar Research 5 new series. 1987. P. 175–192.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: paleontological statistics software package for education and data analysis // Palaeontol Electronica. 2001. V. 4. P. 1−9.
Horne D.J., Bruce A., Whittaker J.E. Ostracoda // European register of marine species: a check-list of the marine species in Europe and a bibliography of guides to their identification. Collection Patrimoines Naturels. 2001. V. 50. P. 244−251.
McLachlan A. Composition, distribution, abundance and biomass of the macrofauna and meiofauna of four sandy beaches // Zool.-Afr. 1977. V. 12. №. 2. P. 279–306.
Nilsson P., Sundback K., Jonsson B. Effect of the brown shrimp Crangon crangon on endobenthic macrofauna, meiofauna and meiofaunal grazing rates // Neth J Sea Res. 1993. V. 31. P. 95–106.
Olafsson E. Do macrofauna structure meiofauna assemblages in marine soft-bottoms? A review of experimental studies // Vie Milieu. 2003. V. 53. P. 249–265.
Pyataeva S.V., Hopcroft R.R., Lindsay D.J., Collins A.G. DNA barcodes unite two problematic taxa: the meiobenthic Boreohydra simplex is a life-cycle stage of Plotocnide borealis (Hydrozoa: Aplanulata) // Zootaxa. 2016. V. 4150. P. 85–92.
Quintana C.O., Yoshinaga M.Y., Sumida P.Y.G. Benthic responses to organic matter variation in subtropical coastal area off SE Brazil // Mar Ecol. 2010. V. 31. № 3. P. 457−472.
Shimanaga M., Shirayama Y. Response of benthic organisms to seasonal change of organic matter deposition in the bathyal Sagami Bay, central Japan // Oceanologica Acta. 2000. V. 23. № 1. P. 91–107.
Syvitski J.P., Farrow G.E., Atkinson R.J.A. et al. Baffin Island fjord macrobenthos: bottom communities and environmental significance // Arctic. 1989. V. 42. № 3. P. 232–247.
Thiel H. The size structure of the deep-sea benthos // Int Rev Hydrobiol. 1975. V. 60. №. 5. P. 575–606.
Urban-Malinga B., Drgas A., Gromisz S., Barnes N. Species-specific effect of macrobenthic assemblages on meiobenthos and nematode community structure in shallow sandy sediments // Mar Biol. 2014. V. 161. P. 195–212.
Wlodarska M., Weslawski J.M., Gromisz S. A comparison of the macrofaunal community structure and diversity in two arctic glacial bays – a ‘cold’ one off Franz Josef Land and a ‘warm’ one off Spitsbergen // Oceanologia. 1996. V. 38. P. 251–283.
Zalota A.K., Spiridonov V.A., Vedenin A.A. Development of snow crab Chionoecetes opilio (Crustacea: Decapoda: Oregonidae) invasion in the Kara Sea // Polar Biol. 2018. V. 41. P. 1983–1994.
Zalota A.K., Zimina O.L., Spiridonov V.A. Combining data from different sampling methods to study the development of an alien crab Chionoecetes opilio invasion in the remote and pristine Arctic Kara Sea // PeerJ, 2019. https://doi.org/10.7717/peerj.7952
Дополнительные материалы отсутствуют.