Океанология, 2022, T. 62, № 3, стр. 403-415
Первичная продукция и хлорофилл размерных групп фитопланктона Карского моря в период схода сезонного льда
А. Б. Демидов 1, *, В. М. Сергеева 1, В. И. Гагарин 1, Е. В. Еремеева 1, О. В. Воробьева 2, Т. А. Белевич 3, В. А. Артемьев 1, А. А. Полухин 1, А. В. Григорьев 1, А. Н. Храпко 1, С. А. Щука 1, М. В. Флинт 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: demspa@rambler.ru
Поступила в редакцию 15.11.2021
После доработки 03.12.2021
Принята к публикации 16.12.2021
- EDN: FZYKMO
- DOI: 10.31857/S0030157422030030
Аннотация
Величины первичной продукции (ИПП) и хлорофилла “а” (Хлфс) в столбе воды Карского моря получены в период схода сезонного льда в конце июня 2021 г. во время 83-го рейса НИС “Академик Мстислав Келдыш”. В период проведения исследований ИПП достигала 1352 мгС/м2 в день. Высокие средние значения ИПП (740 мгС/м2 в день) и Хлфс (81.40 мг/м2) у кромки льда позволяют говорить о весеннем “цветении” фитопланктона. Наибольшие величины ИПП отмечены на станциях, где хлорофилл “а” (хл “а”) был сосредоточен в верхнем перемешанном слое. Также, высокие значения ИПП были зарегистрированы на станциях, где был отмечен подповерхностный максимум хл “а” в слое максимальных градиентов пикноклина. В зоне “цветения” микрофитопланктон (>20 µm) вносил основной вклад в суммарные величины ИПП и Хлфс, в среднем, соответственно, 92 и 82%. Вклад пикофитопланктона (<3 µm) в суммарную величину первичной продукции возрастал в среднем с 3 до 70% от поверхности до границы слоя фотосинтеза на глубинах 32–55 м. В вертикальном распределении вклада различных размерных фракций в суммарные величины хл “а” такой тенденции не наблюдалось. Такие результаты свидетельствуют об увеличении удельной ассимиляционной активности пикофитопланктона при уменьшении интенсивности света с глубиной.
ВВЕДЕНИЕ
Во время весеннего сезона, который в Арктическом океане (АО) длится приблизительно с апреля по июнь включительно, по разным оценкам создается до 50–54% годовой интегральной для столба воды первичной продукции (ИПП) [12, 27]. Эти оценки опираются на модельные расчеты и спутниковые данные. В тоже время известно, что значительный вклад в величину годовой ИПП может вносить “цветение” фитопланктона, которое отмечается подо льдом [9, 23, 42, 43, 51] и не регистрируется спутниковыми сканерами. Недоучет первичной продукции (ПП), создаваемой в этих условиях, может приводить к значительному занижению годовой ИПП АО [8] и свидетельствует о невозможности, оценить истинный вклад весеннего “цветения” в годовую величину ИПП, используя лишь дистанционные методы. С этой точки зрения, экспедиционные исследования продолжают оставаться одним из основных источников данных для оценки ИПП в этот период вегетационного сезона. Следует отметить, что существует очень мало данных о “цветении” фитопланктона у кромки льда и подо льдом в морях АО [6]. В частности, очень мало известно об этом явлении в Карском море.
Кроме оценки интегральных величин продукционных параметров фитопланктона, представляют большой интерес знания о его размерной структуре в период весеннего “цветения”. При изучении межгодовой изменчивости фитопланктона АО под воздействием климатических трендов дискуссионным является вопрос о смене доминирующей в его составе размерной группы. При этом выдвигается гипотеза о возрастании роли пикофитопланктона (<2–3 µm) (ПФ) в размерной структуре сообщества. Такая динамика рассматривается как следствие быстрого потепления и сокращения площади ледового покрова в АО [60, 61]. В этом аспекте высказывается гипотеза о том, что ПФ будет иметь преимущество перед микрофитопланктоном (>20 µm) (МФ) вследствие лучшей адаптации первого к повышению температуры и уменьшению солености воды в приповерхностных слоях [33, 55]. Известно, что различные размерные группы фитопланктона вносят разный вклад в интенсивность потока углерода в экосистеме [18, 25, 28, 31, 56, 58]. Таким образом, сдвиг размерной структуры фитоценоза в сторону доминирования ПФ может привести к существенным изменениям в биогеохимических процессах и уровне продуктивности АО. Следует отметить, что эта гипотеза выдвинута на основании данных, полученных, в основном, летом и осенью, когда в фитопланктоне доминирует мелкоразмерная фракция [13, 14, 20, 53, 60, 61]. В тоже время, известно, что весной в АО в составе фитопланктона часто преобладает МФ [37, 46]. Таким образом, оценивать межгодовую изменчивость размерной структуры фитопланктона, по-видимому, следует отдельно для разных сезонов.
В рамках настоящего исследования нами были сформулированы следующие цели: (1) – получить интегральные для столба воды величины ПП и хлорофилла “а” (хл “а”) в Карском море в весенний период; (2) – изучить особенности вертикального распределения ПП и хл “а” в этот сезон; (3) – оценить вклад различных размерных групп фитопланктона как в интегральные величины ПП и хл “а”, так и на разных горизонтах водного столба.
МАТЕРИАЛ И МЕТОДЫ
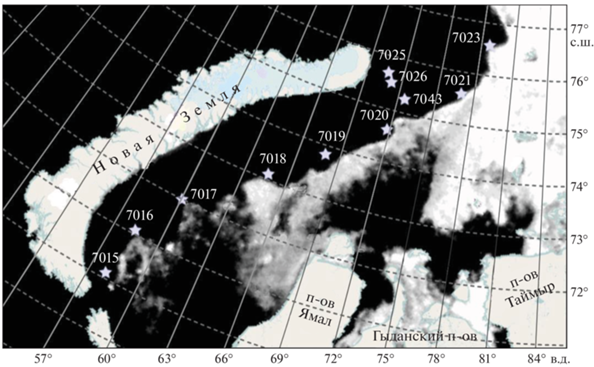
Характеристика исследованной акватории и отбор проб. Материал для настоящей статьи был получен в 83-м рейсе НИС “Академик Мстислав Келдыш”, проведенном по программе “Экосистемы морей Сибирской Арктики”, в Карское море в период с 22 по 30 июня 2021 г. На разрезе станции были расположены вдоль кромки сезонного льда (рис. 1). Еще две станции (ст. 7025 и 7026) были выполнены в западном отроге желоба Св. Анны. Ледовые карты были составлены по данным усовершенствованного микроволнового сканирующего радиометра AMSR2 (Advanced Microwave Scanning Radiometer) и получены с портала SIOWS: Arctic portal – Oceanographic investigations of the Arctic ocean (http://siows.solab.rshu.ru).
Рис. 1.
Расположение станций (звездочки) в 83-м рейсе НИС “Академик Мстислав Келдыш” в конце июня 2021 г. Представлена ледовая обстановка на 26 июня, середину рейса (по http://siows.solab.rshu.ru).
Горизонты отбора проб определялись после предварительного зондирования температуры, электропроводности и флуоресценции CTD-зондом SBE-911 Plus (Seabird Electronics). Для определения содержания хл “а” и ПП пробы воды отбирали 10- литровыми пластиковыми батометрами комплекса Carousel Water Sampler с 6–10 горизонтов верхнего 100-метрового слоя. На мелководных станциях отбор проб был проведен до дна. Проба с поверхности на всех станциях отбиралась пластиковым ведром одновременно с замыканием батометров на верхнем горизонте.
Определение ПП. ПП измерялась при помощи радиоуглеродной модификации метода светлых и темных склянок [49]. Постановка опытов осуществлялась по схеме имитации световых условий [34, 50]. Склянки предварительно обрабатывались 1 N HCl. Пробы воды объемом 250 мл помещались под нейтральные светофильтры с пропусканием, соответствующим облученности на глубине отбора. Предварительно проводилось зондирование подводной облученности в диапазоне фотосинтетически активной радиации (ФАР) (см. ниже). После добавления меченого по углероду гидрокарбоната натрия (NaH14CO3) активностью 0.05 μCi на 1 мл пробы экспонировали в течение половины светового дня (12 ч) в палубном инкубаторе при естественном освещении. Температура воды в инкубаторе в течение экспозиции поддерживалась близкой к температуре поверхностного слоя моря (Т0) во время отбора проб. Схема фильтрации описана ниже в разделе “Фракционирование хл “а” и ПП”. После фильтрации пробы промывали фильтрованной морской водой, высушивали при комнатной температуре в течение ночи 12-ти часов и помещали в сцинтилляционный флакон. После добавления 10 мл сцинтилляционного коктейля “Optiphase HiSafe III” (PerkinElmer) учет активности фильтров проводили через сутки на сцинтилляционном радиометре “Triathler” (Hidex). По результатам определения ПП на разных горизонтах строилась кривая вертикального распределения. Нижняя граница слоя фотосинтеза (Hфс) определялась как глубина, на которой ПП, измеренная радиоуглеродным методом, равнялась нулю. Площадь, ограниченная кривой вертикального распределения ПП, соответствовала ИПП.
Определение содержания хл “а”. Определение содержания хл “а” проводили флуориметрическим методом [29]. После фильтрации фильтры высушивали и хранили до анализа в морозильной камере при температуре –20°С не более суток в плотно закрытой емкости со свежепрокаленным силикагелем. Экстрагирование проводили 90%-м водным раствором ацетона в течение суток. Флуоресценцию полученных экстрактов измеряли на флуориметре Trilogy Turner Designs до и после подкисления водным 1 N раствором HCl. Калибровка флуориметра была проведена по спектрофотометрическому методу с использованием химически чистого хл “а” (Sigma) в качестве стандарта. Расчет концентрации хл “а” и феофитина “a” проводили согласно [30].
Фракционирование хл “а” и ПП. Автотрофный планктон включает следующие размерные классы: пикофитопланктон (ПФ) (<2 µm), нанофитопланктон (НФ) (2–20 µm) и микрофитопланктон (МФ) (>20 µm) [48]. В настоящей работе пикофитопланктон определяется, как клетки размером <3 µm [например, 59].
Для определения концентрации хл “а” во фракциях фитопланктона пробы воды объемом 1 л последовательно пропускали через нейлоновое сито с ячеей 20 µm, ядерные фильтры с размером пор 3 µm (Reatrack) и стекловолокнистые фильтры GF/F под вакуумом не более 0.1 атм. Для определения ПП пробы объемом 250 мл после экспозиции были последовательно профильтрованы через нейлоновое сито 20 µm, ядерные фильтры 3 µm и мембранные фильтры из нитроцеллюлозы “Владипор” МФАС-ОС-2 с размером пор 0.45 µm. Вакуум не более 0.1 атм применялся только на последней стадии фильтрации.
Методы определения надводной и подводной облученности. Интенсивность надводной облученности измеряли с использованием датчика падающей радиации в диапазоне ФАР LI-190SA (LI-COR), который каждую секунду фиксировал значения освещенности в диапазоне ФАР (µмоль квантов/м2 в сек). В последующем эти величины использовались для расчета интегральной величины падающей радиации за световой день.
Измерения подводной облученности осуществлялись в следующем режиме. Датчик подводной освещенности LI-192SA, укрепленный вертикально на тросе, в режиме зондирования опускался на глубину ∼60–80 м, а на мелководных стациях – до дна. В последующем для каждой глубины рассчитывались значения подводной освещенности в процентах от подповерхностной ФАР. На основе этих измерений восстанавливался профиль подводной освещенности и определялась глубина эвфотического слоя (1% ФАР) (Zeu).
Методы определения гидрохимических показателей. Пробы для определения рН, биогенных элементов (силикаты, фосфаты, формы азота) и щелочности отбирались в пластиковую посуду 0.5 л без консервации. Определение концентрации биогенных элементов проводилось непосредственно на борту согласно [24]. Колориметрические определения были выполнены на спектрофотометре DR 3900 (HACH-Lange).
Расчет содержания растворенного неорганического углерода проводилось pH-Alk методом по термодинамическим уравнениям карбонатного равновесия с применением концентрационных констант диссоциации угольной кислоты Роя [38] с поправками для вод со свойствами, отличными от морской воды [35].
Определение подповерхностных максимумов, границ верхнего перемешанного слоя и нитраклина. Подповерхностный хлорофильный максимум (ПХМ) определялся нами, как слой, в котором датчик флуоресценции Wet Labs ECO-AFL/FL, установленный на зондирующем комплексе SBE-911 Plus, фиксировал повышенные значения по сравнению с выше- и нижележащими слоями. Непосредственно в ПХМ выделялся горизонт с максимальной для столба воды концентрацией хл “а” (Хлм). Следует отметить, что, согласно работе [57], мы считали ПХМ хорошо выраженным, когда отношение Хлм/Хл0 ≥ 1.15, где Хл0 – концентрация хл “а” на поверхности.
За границу верхнего перемешанного слоя (ВПС) принимался горизонт, на котором плотность воды (σt) впервые превысила поверхностную величину на 0.3 кг/м3 [52]. Распределение суммы нитритного и нитратного азота (NO2 + NO3) в ВПС было гомогенным. Верхняя граница нитраклина определялась горизонтом, на котором происходило резкое повышение NO2 + NO3.
РЕЗУЛЬТАТЫ
Ледовая обстановка и абиотические факторы в районе работ. Станции, выполненные в рейсе можно разделить на две группы: освободившиеся ото льда в интервале 1–6 дней до проведения работ и свободные ото льда относительно длительное время (от 25 дней до полутора месяцев) (табл. 1). Станции из первой группы могут быть охарактеризованы низкой (от –1.5 до 1.5°С) Т0, поверхностной соленостью (S0) 30–33 и глубиной ВПС от 4 до 22 м. Концентрация основных биогенных элементов на поверхности, которая характеризует их содержание в ВПС, (за исключением ст. 7021) была ниже лимитирующих рост и фотосинтез фитопланктона [22, 54].
Таблица 1.
Значения некоторых абиотических факторов в поверхностном слое на станциях, выполненных в Карском море конце июня 2021 г.
| № ст. | Дата работ |
Дата без льда |
φ | λ | H | Параметр | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T0 | S0 | ВПС | NO2 + NO3 | NH4 | PO4 | Si | I0 | ||||||
| 7015 | 22.06 | 19.06 | 71.12 | 58.22 | 239 | 1.5 | 32.85 | 5 | 0.16 | 0.51 | 0.12 | 1.07 | 49.8 |
| 7016 | 23.06 | 17.06 | 72.05 | 58.43 | 243 | 0.9 | 33.03 | 15 | 0.05 | 0.11 | 0.07 | 1.01 | 30.2 |
| 7017 | 23.06 | 18.06 | 73.01 | 60.18 | 181 | –0.1 | 32.89 | 21 | 0.31 | 0.35 | 0.20 | 0.10 | 41.7 |
| 7018 | 24.06 | 20.06 | 74.1 | 64.73 | 147 | –0.9 | 32.90 | 13 | 0.49 | 0.05 | 0.11 | 0.51 | 41.7 |
| 7019 | 25.06 | 24.06 | 74.83 | 68.00 | 270 | –0.5 | 33.12 | 22 | 0.26 | 0.09 | 0.13 | 0.56 | 39.5 |
| 7020 | 26.06 | 25.06 | 75.65 | 72.3 | 150 | –1.6 | 32.95 | 14 | 0.16 | 0.20 | 0.13 | 0.86 | 37.2 |
| 7021 | 26.06 | 25.06 | 76.5 | 77.09 | 70 | –1.6 | 30.38 | 4 | 1.21 | 0.39 | 0.38 | 13.8 | 31.3 |
| 7023 | 27.06 | 26.06 | 77.51 | 78.93 | 85 | –1.5 | 31.32 | 11 | 0.05 | 0.05 | 0.22 | 5.26 | 31.3 |
| 7025 | 28.06 | 12.05 | 76.77 | 70.87 | 405 | –0.1 | 34.26 | 93 | 0.21 | 0.11 | 0.11 | 0.36 | 27.0 |
| 7026 | 28.06 | 13.05 | 76.57 | 71.33 | 151 | 0.0 | 34.30 | 103 | 0.12 | 1.09 | 0.17 | 0.36 | 36.4 |
| 7043 | 30.06 | 5.06 | 76.26 | 72.75 | 133 | 0.7 | 32.49 | 4 | 0.01 | 0.11 | 0.19 | 0.05 | 38.7 |
Примечание. Северная широта (φ) и восточная долгота (λ) даны в градусах, минуты представлены в виде дробной части числа. Дата без льда – время полного освобождения ото льда. Параметры: H – глубина станции, м; T0 – температура воды на поверхности, °С; S0 – соленость на поверхности; ВПС – глубина верхнего перемешанного слоя, м; NO2 + NO3, NH4, PO4, Si – концентрация на поверхности, соответственно, суммы нитритного и нитратного азота, аммонийного азота, фосфатов и растворенного кремния, μМ; I0 – подповерхностная облученность в диапазоне ФАР, моль квантов/м2 в день.
К особенностям станций, выполненных в желобе Св. Анны, (вторая группа станций), следует отнести отсутствие резкого пикноклина и глубокий (приблизительно до 100 м) ВПС. Исключением можно считать ст. 7043, на которой глубина ВПС составила 4 м. По другим гидролого-гидрохимическим характеристикам станции, освободившиеся ото льда значительно раньше, мало отличались от первой группы (табл. 1). В условиях полярного дня район работ характеризовался высоким уровнем ФАР (27–49.8 моль квантов/м2 в день).
Пространственное распределение продукционных параметров. В конце июня 2021 г. в Карском море было зарегистрировано “цветение” фитопланктона у отступающей кромки сезонного льда. В этот период в составе фитопланктона преобладали крупные диатомовые водоросли родов Thalassiosira, Bacterosira и Porosira, а также более мелкие формы родов Navicula, Fragillariopsis и Chaetoceros, которые формируют многоклеточные колонии. По размерному составу все эти группы относятся к МФ. Такое сообщество характерно для фитопланктона, развивающегося рядом с ледовой кромкой весной. Вывод о наличии “цветения” фитопланктона на большинстве станций (табл. 2) сделан нами на основе высоких величин продукционных характеристик, в первую очередь ИПП (>500 мгС/м2 в день) [10].
Таблица 2.
Величины продукционных характеристик размерных групп фитопланктона в Карском море в конце июня 2021 г.
| № ст. | Дата | Параметр | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Хлмикро | Хлнано | Хлпико | Хлтот | ИППмикро | ИППнано | ИППпико | ИППтот | АЧмикро | АЧнано | АЧпико | АЧтот | ||
| 7015 | 22.06 | 4.54 | 7.09 | 4.39 | 16.2 | 170 | 54 | 57 | 281 | 4.06 | 1.37 | 2.13 | 2.08 |
| 7016 | 23.06 | 72.16 | 6.2 | 5.81 | 84.17 | 474 | 5 | 26 | 505 | 4.86 | 0.26 | 2.03 | 4.04 |
| 7017 | 23.06 | 58.31 | 31.13 | 5.51 | 94.95 | 547 | 12 | 63 | 622 | 1.34 | 0.46 | 1.46 | 1.27 |
| 7018 | 24.06 | 133.64 | 10.39 | 5.7 | 151.53 | 677 | 15 | 21 | 713 | 1.11 | 0.21 | 0.27 | 0.95 |
| 7019 | 25.06 | 94.85 | 10.24 | 7.65 | 112.74 | 1254 | 65 | 33 | 1352 | 3.9 | 0.85 | 0.63 | 2.95 |
| 7020 | 26.06 | 58.16 | 11.38 | 7.41 | 76.95 | 1031 | 61 | 44 | 1136 | 2.37 | 0.53 | 0.54 | 1.88 |
| 7021 | 26.06 | 20.99 | 3.55 | 1.72 | 26.26 | 308 | 20 | 19 | 347 | 1.06 | 0.44 | 1.06 | 0.95 |
| 7023 | 27.06 | 69.51 | 8.83 | 2.08 | 80.42 | 907 | 22 | 18 | 947 | 1.76 | 0.36 | 1.76 | 1.63 |
| 7025 | 28.06 | 12.2 | 5.46 | 4.04 | 21.7 | 224 | 72 | 81 | 377 | 1.87 | 1.18 | 1.22 | 1.58 |
| 7026 | 28.06 | 8.2 | 4.58 | 2.73 | 15.51 | 118 | 31 | 54 | 203 | 2.38 | 1.10 | 2.47 | 2.04 |
| 7043 | 30.06 | 81.51 | 5.73 | 2.12 | 89.36 | 697 | 24 | 30 | 751 | 1.78 | 0.43 | 1.02 | 1.51 |
Примечание. Хлмикро, Хлнано, Хлпико и Хлтот – интегральное содержание хл “а” в слое фотосинтеза, соответственно, микро-, нано-, пикофитопланктона и суммарная величина, мг/м2; ИППмикро, ИППнано, ИППпико и ИППтот – интегральная в столбе воды первичная продукция, соответственно, микро-, нано-, пикофитопланктона и суммарная величина, мгС/м2 в день; АЧмикро, АЧнано, АЧпико и АЧтот – максимальные ассимиляционные числа, соответственно, микро-, нано-, пико- и всего фитопланктона мгС/мг хл “а” в час.
ИПП на разрезе вдоль кромки льда изменялась в 5 раз, от 281 до 1352 мгС/м2 в день, составив в среднем 740 мгС/м2 в день. Концентрация хл “а” в слое фотосинтеза (Хлфс) изменялась в 9 раз, от 16.20 до 151.53 мг/м2, составив в среднем 81.40 мг/м2 (табл. 2). Величины ИПП и Хлфс в целом возрастали с юга на север до середины разреза – станций 7018 (по Хлфс) и 7019 (по ИПП). Далее на север эти величины имели тенденцию к снижению. ИПП зависела от обилия фитопланктона в слое фотосинтеза, если в качестве этого показателя считать Хлфс (R = 0.56, N = 9) и в меньшей степени определялась его ассимиляционной активностью (АЧм) (R = 0.16, N = 9). Максимальное в слое фотосинтеза ассимиляционное число всех размерных групп фитопланктона (АЧтот) на разрезе варьировало от 0.95 до 4.04 мгС/мг хл “а” в час, составив в среднем 1.92 мгС/мг хл “а” в час.
Станции, выполненные в желобе Св. Анны (станции 7025 и 7026), находились вне зоны “цветения”. Об этом свидетельствуют пониженные по сравнению с большинством станций разреза вдоль ледовой кромки, значения ИПП и Хлфс. Средние значения ИПП и Хлфс в этом районе составили 290 мгС/м2 в день и 18.57 мг/м2 и были, соответственно, в 2.5 и 4 раза меньше, чем средние величины на разрезе. Среднее значение АЧтот на станциях в желобе Св. Анны практически не отличалось от средней величины этого параметра на разрезе (1.81 мгС/мг хл “а” в час).
Вертикальное распределение ПП и хл “а”. Рассматривая вертикальное распределение хл “а” в Карском море в конце июня, можно также выделить две группы станций. Первая из них характеризовалась отсутствием выраженного ПХМ (рис. 2). В свою очередь, в пределах этой группы выделялись два типа вертикального распределения хл “а”. Для первого типа значения Хл0 мало отличались от величин на границе ВПС (станции 7019 и 7020 на рис. 2), а отношение Хлм/Хл0 не превышало 1.15 (табл. 3). На этих станциях были зарегистрированы самые высокие значения ИПП (табл. 2). На станциях второго типа, выполненные в желобе Св. Анны, характерно убывание хл “а” с глубиной (ст. 7025 и 7026 на рис. 2). Эти станции оказались относительно низкопродуктивными в исследованный период (табл. 2).
Рис. 2.
Вертикальное распределение первичной продукции (ПП, мгС/м3 в день), концентрации хлорофилла “а” (Хл, мг/м3) и плотности воды (σt, кг/м3) на станциях без выраженного хлорофильного максимума. Горизонтальными линиями показаны граница эвфотической зоны (Zeu) и нитраклина (Znit).
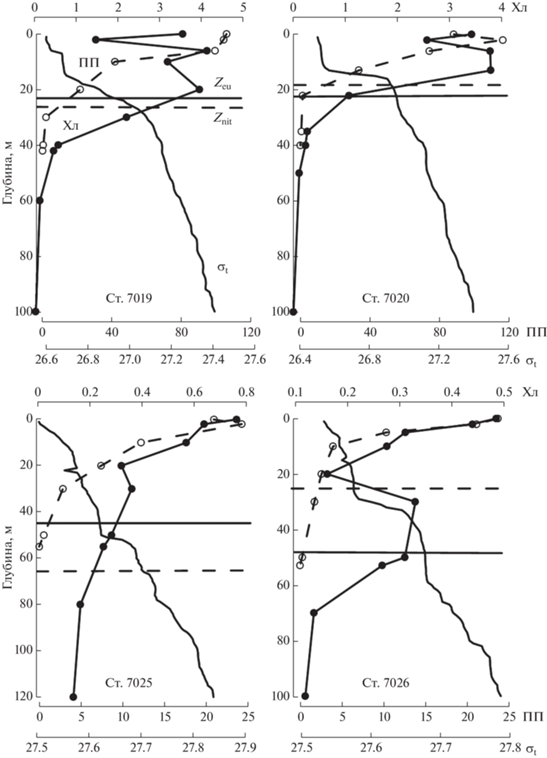
Таблица 3.
Биотические и абиотические параметры, характеризующие вертикальное распределение первичной продукции и хлорофилла “а” в Карском море в конце июня 2021 г.
| № ст. | Дата | Параметр | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ПХМ | Хлм | Хлм/Хл0 | Фео “а” | ПМ | Hфс | Tм | NO2 + NO3 пхм | Znit | Iz Хлм абсолют. |
Iz Хлм отн. |
Zeu | ||
| 7015 | 22.06 | 2 | 0.619 | 1.21 | 25 | 2 | 45 | 0.8 | 0.16 | 8 | 868.1 | 74 | 38 |
| 7016 | 23.06 | 20 | 3.999 | 6.25 | 8 | 0 | 37 | –1.4 | 3.40 | 17 | 6.0 | 0.7 | 18 |
| 7017 | 23.06 | 26 | 4.484 | 5.09 | 14 | 10 | 45 | –1.5 | 2.94 | 24 | 8.1 | 1.8 | 30 |
| 7018 | 24.06 | 19 | 6.839 | 1.64 | 7 | 2 | 32 | –1.5 | 0.30 | 22 | 4.4 | 0.4 | 18 |
| 7019 | 25.06 | – | 4.140 | 1.15 | – | 0 | 42 | – | – | 26 | – | – | 22 |
| 7020 | 26.06 | – | 3.806 | 1.11 | – | 2 | 40 | – | – | 19 | – | – | 22 |
| 7021 | 26.06 | – | 1.840 | 1.00 | – | 0 | 40 | – | – | 16 | – | – | 18 |
| 7023 | 27.06 | 15 | 3.679 | 1.36 | 12 | 2 | 32 | –1.1 | 0.72 | 23 | 9.3 | 1.6 | 17 |
| 7025 | 28.06 | – | 0.766 | 1.00 | – | 0 | 55 | – | – | 66 | – | – | 44 |
| 7026 | 28.06 | – | 0.486 | 1.00 | – | 0 | 53 | – | – | 26 | – | – | 48 |
| 7043 | 30.06 | 50 | 3.893 | 5.92 | 10 | 10 | 37 | –0.14 | 1.03 | 19 | 0.1 | 0.01 | 22 |
Примечание. ПХМ – глубина подповерхностного хлорофильного максимума, м; Хлм – максимальная концентрация хл “а” в столбе воды, мг/м3; Хлм/Хл0 – отношение максимальной и поверхностной величин концентрации хл “а”; Фео “а” – содержание феофитина “а” в % от суммы хл “а” и феофитина “а” на глубине ПХМ; ПМ – глубина максимума первичной продукции, м; Hфс – толщина слоя фотосинтеза, м; Tм – температура воды на глубине Хлм, °С; NO2 + NO3 пхм – сумма нитритов и нитратов на глубине Хлм, µМ; Znit – глубина верхней границы нитраклина, м; Iz Хлм абсолют. – абсолютное значение ФАР на глубине Хлм, моль квантов/м2 в день; Iz Хлм отн. – относительное значение ФАР на глубине Хлм, %; Zeu – граница эвфотического слоя, м; прочерк означает отсутствие ПХМ.
Для второй группы станций (рис. 3) характерно расположение ПХМ в слое максимальных градиентов пикноклина у границ Zeu и нитраклина (Znit) (станции 7016–7018). Отдельно следует рассматривать ст. 7015, на которой горизонт с Хлм располагался сразу под поверхностью (2 м) и совпадал с максимумом ПП (табл. 3). Такая картина могла быть следствием фотоингибирования фитопланктона очень высокой инсоляцией 26 июня (49.8 моль квантов/м2 в день), вследствие чего водоросли были сконцентрированы в подповерхностном слое. На ст. 7043, которая значительно раньше других на разрезе освободилась ото льда (табл. 1), и где, по-видимому, “цветение” фитопланктона развивалось уже длительное время, ПХМ опустился на глубину 50 м (рис. 3) и располагался, соответственно, на 21 и 28 м ниже Zeu и Znit.
Рис. 3.
Вертикальное распределение первичной продукции (ПП, мгС/м3 в день), концентрации хлорофилла “а” (Хл, мг/м3) и плотности воды (σt, кг/м3) на станциях с хорошо выраженным хлорофильным максимумом. Другие условные обозначения см. в подписях к рис. 2.
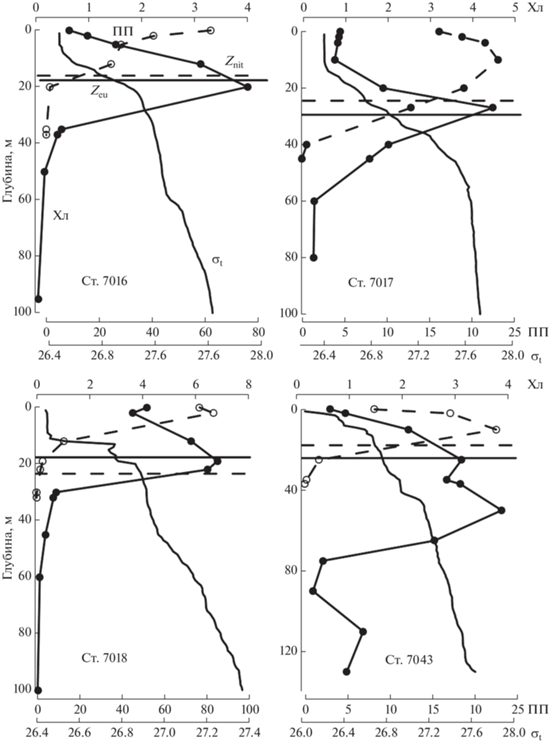
Таким образом, за исключением ст. 7043, ПХМ располагался довольно высоко (в среднем 12 м) в слое фотосинтеза. Глубина Hфс на разрезе вдоль ледовой кромки варьировала незначительно, от 32 до 45 м. На станциях, расположенных в желобе Св. Анны Hфс находился глубже (53 и 55 м).
Вертикальное распределение ПП в июне 2021 г. характеризовалось максимумами на горизонте 0 м или в подповерхностном слое (2–10 м) (рис. 2 и 3). Последние, по-видимому, объясняются световым угнетением скорости фотосинтеза высокой инсоляцией на поверхности моря. Вторичные максимумы, которые могли быть связаны с ПХМ, не были обнаружены.
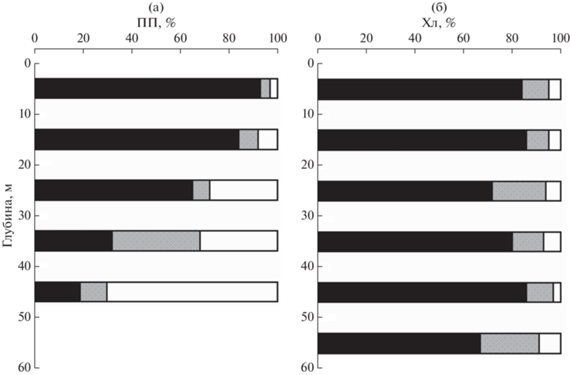
ПП и хл “а” размерных групп фитопланктона. Абсолютные значения продукционных характеристик размерных групп фитопланктона представлены в табл. 2. В конце июня 2021 г. размерная структура фитопланктонного сообщества, если ее индикаторами принимать ПП и содержание хл “а”, была характерна для весеннего состояния, главная черта которого доминирование МФ (рис. 4). На станциях в зоне “цветения” у границы сезонного льда средний вклад МФ в суммарные величины ИПП и Хлфс составил 92 и 82% соответственно. На ст. 7015 и в желобе Св. Анны (станции 7025 и 7026) доля мелкоразмерных фракций возрастала, но МФ при этом продолжал доминировать. Так, доля НФ в суммарных величинах ИПП и Хлфс на этих станциях составила, соответственно, 18 и 33%, а доля ПФ – 23 и 21% (рис. 4).
Рис. 4.
Вклад различных размерных групп фитопланктона в суммарные величины интегральной первичной продукции (ИПП) – (а) и хлорофилла “а” в столбе воды (Хлфс) – (б) на станциях, выполненных в 83-м рейсе НИС “Академик Мстислав Келдыш”. Черный цвет – микрофитопланктон (>20 µm), серый цвет – нанофитопланктон (3–20 µm), белый цвет – пикофитопланктон (<3 µm).
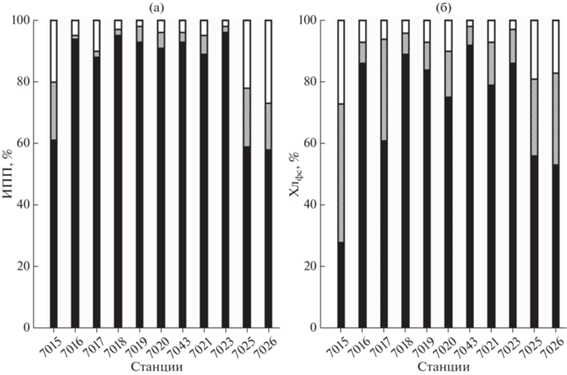
Вклад мелкоразмерных фракций в суммарные величины ПП возрастал с глубиной. Особенно такая тенденция заметна для ПФ (рис. 5). В среднем доля этой размерной группы возросла от поверхности до границы слоя фотосинтеза с 3 до 70%. При этом доля МФ снизилась с 93 до 19%. Для вертикального распределения вклада различных размерных фракций в суммарные величины хл “а” такой тенденции не наблюдалось. Вклад одной и той же размерной группы на разных горизонтах был примерно одинаков (табл. 4 ; рис. 5). Наблюдаемая картина свидетельствует, с одной стороны, об увеличении удельной ассимиляционной активности ПФ при уменьшении интенсивности света с глубиной и, с другой стороны, о снижении этого адаптивного показателя к низкой освещенности у МФ. Полученный результат подтверждается распределением средних для разных слоев величин АЧ размерных фракций (табл. 4 ). Средняя величина АЧ МФ была выше (в 1.5 раза), чем у ПФ только в слое 0–10 м. В слое 10–20 м АЧ ПФ оказалось в 1.3 выше, чем АЧ МФ. В слоях 20–30 м и 30–40 м это отношение увеличилось, соответственно, до 2.3 раз и 12.5 раз и снизилось в слое 40–50 м до 9 раз.
Рис. 5.
Распределение по глубинам среднего вклада различных размерных групп фитопланктона в суммарные величины первичной продукции (ПП) – (а) и хлорофилла “а” (Хл) – (б). Условные обозначения см. в подписях к рис. 4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Весеннее “цветение” фитопланктона в Карском море. Существует очень мало данных о первичной продукции в столбе воды Карского моря в весенний период. В апреле 1998 г. на севере Карского моря (76°–78° с. ш.) величины ИПП и Хлфс составили в среднем, соответственно, 219 мгС/м2 в день и 18.92 мг/м3. В мае средние значения этих параметров возрастали, соответственно, до 1250 мгС/м2 в день и 118.57 мг/м3. Еще бóльшие величины ИПП и Хлфс были зарегистрированы в июне (1791 мгС/м2 в день и 171.71мг/м3,соответственно) (https://www.nodc.noaa.gov/archive/arc0028/ 0063065/1.1/data/ARCSS-P_FGDCmetadata.htm). Такие высокие значения этих параметров свидетельствуют о “цветении” фитопланктона на севере Карского моря в мае–июне.
Зафиксированные нами в конце июня 2021 г. высокие величины ИПП и Хлфс в районах, недавно (в течение недели и менее) освободившихся ото льда, могут говорить о том, что весеннее “цветение” началось еще до полного схода сезонного льда. Этому могут способствовать многочисленные разводья в окраинной области тающего ледового поля, увеличивающие доступ света в водную толщу. Такое предположение подтверждают низкие на большинстве станций концентрации основных биогенных элементов в ВПС (табл. 1), что может быть следствием их потребления во время подледной фазы “цветения”. Однако не исключено, что малые концентрации биогенных элементов связаны со слабой вертикальной зимней конвекцией и, соответственно, их ограниченным поступлением в ВПС. Сезонная конвекция в Карское море в значительной степени блокируется выраженной стратификацией водной толщи, связанной с опреснением ВПС огромным по объему речным стоком, оказывающим влияние на большинство районов шельфа [44]. Малая концентрация биогенов в начале вегетационного сезона может являться причиной их быстрого истощения в ВПС за счет потребления фитопланктоном уже на ранней стадии “цветения”.
“Цветение” фитопланктона весной у отступающей кромки сезонного льда в АО часто регистрируется спутниковыми сканерами цвета океана и считается обычным явлением [45]. Этот феномен рассматривается как продолжение процесса массового развития фитопланктона подо льдом во время увеличения уровня приходящей солнечной радиации, уменьшения толщины ледового покрова и образования на нем проталин (ponds) [8, 9]. Тем не менее, во многих районах АО процессы массового развития фитопланктона подо льдом и у ледовой кромки практически не изучены [6].
Согласно имеющимся представлениям о временной динамике этого процесса в АО, на ранней стадии он охватывает толщу воды сразу под нижней границей льда, захватывая весь ВПС. Затем, по мере истощения биогенов в верхнем слое и освобождения акватории ото льда, “цветение” опускается в слой максимальных градиентов пикноклина, образуя ПХМ [9, 42]. Далее, эволюция ПХМ предполагает его опускание ниже слоя максимальных градиентов вслед за опусканием нитраклина и формирование классического глубинного максимума в слое высоких концентраций биогенов при еще достаточной для фотосинтеза освещенности у границы эвфотической зоны (1% ФАР) [5, 7, 15, 16]. В Карском море хорошо развитый ПХМ, образовавшийся, по-видимому, после “цветения” фитопланктона, был отмечен нами в июле [1, 19]. Таким образом, в конце июня 2021 г. в исследованных районах Карского моря “цветение” фитопланктона находилось на стадии образования ПХМ сразу под нижней границей ВПС.
На ст. 7043, полностью освободившейся ото льда за 25 дней до начала работ, наблюдалось опускание слоя Хлм на горизонт 50 м. При этом высокие (>1 мг/м3) величины концентрации хл “а” наблюдались во всем слое фотосинтеза (37 м), что являлось одной из причин высокой ИПП (751 мгС/м2 в день). Такая картина говорит о том, что “цветение” в этом районе могло продолжаться достаточно длительное время.
Влияние вертикального распределения хл “а” на ИПП. Высокие величины ИПП (>500 мгС/м2 в день), за исключением ст. 7021, были отмечены на станциях, где хл “а” равномерно распределялся в ВПС или был отмечен ПХМ ниже этого слоя (табл. 2 и 3). Главный вклад в ИПП вносила ПП, которая создавалась в ВПС (от 39 до 100%, в среднем 80%). Станция 7043 была исключением, из-за небольшой толщины ВПС (4 м). В предыдущих исследованиях отмечалось, что в середине лета вклад ВПС в ИПП составлял 26–74% [1], а в осенний период в водах разного трофического статуса он находился в пределах от 60 до 88% [2].
В конце июня ПХМ располагался довольно высоко в столбе воды (табл. 3), и фитопланктон в этом слое, по-видимому, находился в достаточно хороших условиях освещенности (за исключением ст. 7043). Клетки фитопланктона в этом слое находились в хорошем физиологическом состоянии, на что указывает низкое содержание феофитина (от 7 до 25%) (табл. 3). В тоже время, из-за положения ПХМ выше нитраклина содержание суммы нитритов и нитратов (NO2 + NO3) в ПХМ на некоторых станциях было ниже лимитирующих концентраций.
В последней декаде июня ПХМ находился в стадии формирования. Об этом свидетельствуют высокие значения Хл0 и концентрации хл “а” в ВПС, а также расположение Хлм на большинстве станций сразу под нижней границей ВПС в слое максимальных градиентов пикноклина (рис. 3). На станциях с выраженным ПХМ содержание хл “а” часто начинало возрастать сразу с поверхности, поэтому трудно корректно установить границы этого слоя. В связи с этим рассчитать величину ПП в ПХМ и оценить его вклад в ИПП по данным настоящей экспедиции не представляется возможным.
Вклад размерных групп фитопланктона в суммарные величины ПП и хл “а”, как индикатор сезонных изменений сообщества. В конце июня 2021 г. сообщество фитопланктона в исследованных районах Карского моря находилось в весенней стадии развития. Одним из показателей такого состояния является вклад различных размерных групп в суммарные величины ПП и хл “а”, в частности, доминирование МФ (рис. 4; табл. 2). Крупные фракции часто превалируют в фитопланктоне весной и в других районах АО [26, 37, 46]. Значительный вклад МФ в суммарные величины ПП и хл “а” в Карском море в июне 2021 г. соответствует “классическому” представлению о роли различных размерных групп в сообществе фитопланктона при изменении факторов среды. В настоящее время принятая точка зрения на пространственно-временнóе распределение размерных фракций фитопланктона в Мировом океане такова, что ПФ доминирует в олиготрофных районах при низком содержании биогенных элементов и высокой температуре, а МФ преобладает в районах и сезоны года с повышенной продуктивностью при благоприятных условиях минерального питания и низкой температуре [4, 11, 17, 32, 36, 39–41, 47, 56].
Известно, что многие экологические и физиологические процессы связаны с размером клеток степенной зависимостью. ПФ имеет бóльшее, чем МФ отношение площади поверхности к объему, что способствует большей эффективности поглощения биогенных элементов и света их клетками. Таким образом, ПФ имеет некоторые конкурентные преимущества перед МФ при недостатке минерального питания и в условиях светового лимитирования [21]. По-видимому, этим фактом можно объяснить увеличение вклада ПФ и, отчасти, НФ в суммарные величины ПП с глубиной (рис. 5; табл. 4 ).
Проведенные исследования позволили получить редкие данные о продукционных параметрах фитопланктона Карского моря в период схода сезонного льда в конце июня, необходимые для оценки сезонной динамики продуктивности экосистемы, расчетов интегральной годовой ПП, верификации данных, полученных по спутниковым наблюдениям и модельным расчетам [3]. Однако, истинную величину годовой ИПП можно получить, только оценив уровень ПП во время подледной фазы сезонного “цветения”.
Источники финансирования. Работа выполнена в рамках Государственного задания Министерства науки и высшего образования Российской федерации № FMWE-2021-0007. Анализ гидрохимических проб проведен при финансовой поддержке гранта РНФ № 19-17-00196. Экспедиционные исследования проведены при финансовой поддержке Министерства науки и высшего образования РФ (целевое финансирование на проведение морских экспедиционных исследований).
Список литературы
Демидов А.Б., Гагарин В.И., Еремеева Е.В. и др. Вертикальная изменчивость первичной продукции и хлорофилла в Карском море в середине лета: вклад подповерхностных максимумов в интегральные величины // Океанология. 2021. Т. 61. № 5. https://doi.org/10.31857/S003015742105004X
Демидов А.Б., Мошаров С.А. Вертикальное распределение первичной продукции и хлорофилла “а” в Карском море // Океанология. 2015. Т. 55. № 4. С. 577–591.
Демидов А.Б., Шеберстов С.В., Гагарин В.И. Оценка годовой величины первичной продукции Карского моря // Океанология. 2018. Т. 58. № 3. С. 391–403.
Agawin N.S.R., Duarte C.M., Agush S. Nutrient and temperature control of the contribution of picoplankton biomass and production // Limnol. Oceanogr. 2000. V. 45. № 3. P. 591–600.
Ardyna M., Babin M., Gosselin M. et al. Parameterization of vertical chlorophyll a in the Arctic Ocean: impact of the subsurface chlorophyll maximum on regional, seasonal and annual primary production estimates // Biogeosciences. 2013. V. 10. № 3. P. 1345–1399.
Ardyna M., Mundy C.J., Mayot N. et al. Under-ice phytoplankton blooms: shedding light on the “invisible” part of arctic primary production // Front. Mar. Sci. 2020. https://doi.org/10.3389/fmars.2020.608032
Arrigo K.R., Matrai P.A., van Dijken G.L. Primary productivity in the Arctic Ocean: Impacts of complex optical properties and subsurface chlorophyll maxima on large scale estimates // J. Geophys. Res. 2011. V. 116. C11022, https://doi.org/10.1029/2011JC007273
Arrigo K.R., Perovich D.K., Pickart R.S. et al. Massive phytoplankton blooms under arctic sea ice // Science. 2012. V. 336. P. 1408.
Arrigo K.R., Perovich D.K., Pickart R.S. Phytoplankton blooms beneath the sea ice in the Chukchi sea // Deep-Sea Res. II. 2014. V. 105. P. 1–16. https://doi.org/10.1016/j.dsr2.2014.03.018
Arrigo K.R., van Dijken G.L. Secular trends in Arctic Ocean net primary production // J. Geophys. Res. 2011. V. 116. C09011. https://doi.org/10.1029/2011JC007151
Acevedo-Trejos E., Brandt G., Merico A., Lan Smith S. Biogeographical patterns of phytoplankton community size structure in the oceans // Global Ecology and Biogeography. 2013. V. 22. P. 1060–1070.
Bélanger S., Babin M., Tremblay J.-E. Increasing cloudiness in Arctic damps the increase in phytoplankton primary production due to sea ice receding // Biogeosciences. 2013. V. 10. № 6. P. 4087–4101.
Bhavya P.S., Lee Jang H., Lee H.W. et al. First in situ estimations of small phytoplankton carbon and nitrogen uptake rates in the Kara, Laptev, and East Siberian seas // Biogeosciences. 2018. V. 15. № 18. P. 5503–5517.
Booth B.C., Horner R.A. Microalgae on the Arctic Ocean Section, 1994: species abundance and biomass // Deep-Sea Res. 1997. Part II. V. 44. N. 8. P. 1607–1622.
Bouman H.A., Jackson T., Sathyendranath S., Platt T. Vertical structure in chlorophyll profiles: influence on primary production in the Arctic Ocean // Phil. Trans. R. Soc. 2020. https://doi.org/10.1098/rsta.2019.0351
Brown Z.W., Lowry K.E., Palmer M.A. et al. Characterizing the subsurface chlorophyll a maximum in the Chukchi Sea and Canada Basin // Deep Sea Res II. 2015. V. 118. P. 88–104.
Chisholm S.W. Phytoplankton size. In. Primary productivity and biogeochemical cycles in the sea. P.G. Falkowski and A.D. Woodhead (eds.). Plenum Press, New York: 1992. P. 213–237.
Curran K., Brewin R.J.W., Tilstone G.H. et al. Estimation of size-fractionated primary production from satellite ocean colour in UK shelf seas // Remote Sens. 2018. V. 10. https://doi.org/10.3390/rs10091389
Demidov A.B., Gagarin V.I., Vorobieva O.V. et al. Spatial and vertical variability of primary production in the Kara Sea in July and August 2016: The influence of the river plume and subsurface chlorophyll maxima // Pol. Biol. 2018. V. 41. № 3. P. 563–578. https://doi.org/10.1007/s00300-017-2217-x
Demidov A.B., Sukhanova I.N., Belevich T.A. et al. Size-fractionated surface phytoplankton in the Kara and Laptev seas: environmental control and spatial variability // Mar. Ecol. Progr. Ser. 2021. https://doi.org/10.3354/meps13652
Finkel Z.V., Beardall J., Flynn K.J. et al. Phytoplankton in a changing world: cell size and elemental stoichiometry // J. Plankton Res. 2010. V. 32. № 1. P. 119–137. https://doi.org/10.1093/plankt/fbp098
Fisher T.R., Peele E.R., Ammerman J.W., Harding L.W.J. Nutrient limitation of phytoplankton in Chesapeake Bay // Mar. Ecol. Progr. Ser. 1992. V. 82. P. 51–63.
Fortier M., Fortier L., Michel C., Legendre L. Climatic and biological forcing of the vertical flux of biogenic particles under seasonal Arctic sea ice // Mar. Ecol. Prog. Ser. 2001. V. 225. P. 1–16. https://doi.org/10.3354/meps225001
Grasshoff K., Kremling K., Ehrhardt M. Methods of seawater analysis, 3rd edn. New York: Wiley, 1999.
Guidi L., Stemmann L., Jackson G.A. et al. Effects of phytoplankton community on production, size, and export of large aggregates: A world-ocean analysis // Limnol. Oceanogr. 2009. V. 54. P. 1951–1963. https://doi.org/10.4319/lo.2009.54.6.1951
Hill V., Cota G., Stockwell D. Spring and summer phytoplankton communities in the Chukchi and Eastern Beaufort Seas // Deep-Sea Res. II. 2005. V. 52. P. 3369–3385.
Hill V.J., Matrai P.A., Olson E. et al. Synthesis of integrated primary production in the Arctic Ocean: II. In situ and remotely sensed estimates // Progr. Oceanogr. 2013. V. 110. P. 107–125.
Hirata T., Hardman-Mountford N.J., Barlow R. et al. An inherent optical property approach to the estimation of size-specific photosynthetic rates in eastern boundary upwelling zones from satellite ocean colour: An initial assessment // Prog. Oceanogr. 2009. V. 83. P. 393–397.
Holm-Hansen O., Lorenzen C.J., Holmes R.W., Strickland J.D.H. Fluorometric determination of chlorophyll // J. Cons. Perm. Int. Explor. Mer. 1965. V. 30. P. 3–15.
Holm-Hansen O., Riemann B. Chlorophyll a determination: improvements in methodology // Oikos. 1978. V. 30. P. 438–447.
Jin X.,Gruber N., Dunne J.P. et al. Diagnosing the contribution of phytoplankton functional groups to the production and export of particulate organic carbon, CaCO3, and opal from global nutrient and alkalinity distributions // Global Biogeochemical Cycles. 2006. V. 20. https://doi.org/10.1029/2005GB002532
Kostadinov T.S., Siegel D.A., Maritorena S. Global variability of phytoplankton functional types from space: assessment via the particle size distribution // Biogeosciences. 2010. V. 7. P. 3239–3257.
Li W.K.W., McLaughlin F.A., Lovejoy C., Carmack E.C. Smallest algae thrive as the Arctic Ocean freshens // Science. 2009. V. 326. P. 539.
Lohrenz S.E. Estimation of primary production by the simulated in situ method // ICES mar. Sci. Symp. 1993. V. 197. P. 159–171.
Makkaveev P.N. The total alkalinity in the anoxic waters of the Black sea and in sea-river mixture zones. Intergovermental Oceanographic Commission. Joint IOC-JGOFS CO2 Advisory Panel Meeting. Seven Session. Annex V. UNESCO, 1998.
Marañón E., Cermeño P., Rodriguez J. et al. Scaling of phytoplankton photosynthesis and cell size in the ocean // Limnology and Oceanography. 2007. V. 52. P. 2190–2198.
Mei Z.-P., Legendre L., Gratton Y. et al. Phytoplankton production in the North Water Polynya: size-fractions and carbon fluxes, April to July 1998 // Mar, Ecol, Prog, Ser. 2003. V. 256. P. 13–27.
Millero F.J. Thermodynamics of the carbon dioxide system in oceans // Geochim. et Cosmochim. Acta. 1995. V.59. № 4. P.661–677.
Mousing E.A., Ellegaard M., Richardson K. Global patterns in phytoplankton community size structure—evidence for a direct temperature effect // Mar. Ecol. Progr. Ser. 2014. V. 497. P. 25–38. https://doi.org/10.3354/meps10583
Mousing E.A., Richardson K., Ellegaard M. Global patterns in phytoplankton biomass and community size structure in relation to macronutrients in the open ocean // Limnol. Oceanogr. 2018. V. 63. P. 1298–1312. https://doi.org/10.1002/lno.10772
Mouw C.B., Ciochetto A.B., Yoder J.A. A satellite assessment of environmental controls of phytoplankton community size structure // Global Biogeochemical Cycles. 2019. V. 33. P. 540–558. https://doi.org/10.1029/2018GB006118
Mundy C.J., Gosselin M., Ehn J. et al. Contribution of under-ice primary production to an ice-edge upwelling phytoplankton bloom in the Canadian Beaufort Sea // Geophys. Res. Lett. 2009. V. 36. https://doi.org/10.1029/2009GL038837
Mundy C.J., Gosselin M., Gratton Y. et al. Role of environmental factors on phytoplankton bloom initiation under landfast sea ice in Resolute Passage, Canada // Mar. Ecol. Prog. Ser. 2014. V. 497. P. 39–49. https://doi.org/10.3354/meps10587
Osadchiev A.A., Frey D., Shchuka S.A. et al. Structure of the freshened surface layer in the Kara Sea during ice-free periods //J. Geophys. Res. 2020. https://doi.org/10.1029/2020JC016486
Perrette M., Yool A., Quartly G.D., Popova E.E. Near-ubiquity of ice-edge blooms in the Arctic // Biogeosciences. 2011. V. 8. P. 515–524. https://doi.org/10.5194/bg-8-515-2011
Pesant S., Legendre L., Gosselin M et al. Size-differential regimes of phytoplankton production in the Northeast Water Polynya (77°–81° N) // Mar. Ecol. Prog. Ser. 1996. V. 142. P. 75–86. https://doi.org/10.3354/meps142075
Roy S., Sathyendranath S., Bouman H., Platt T. The global distribution of phytoplankton size spectrum and size classes from their light-absorption spectra derived from satellite data // Remote Sensing of Environment. 2013. V. 139. P. 185–197.
Sieburth J.M., Smetacek V., Lenz J. Pelagic ecosystem structure: heterotrophic compartments of the plankton and their relationship to plankton size fractions // Limnol. Oceanogr. 1978. V. 23. P. 1256–1263.
Steemann Nielsen E. The use of radioactive carbon (C14) for measuring organic production in the sea // J. Cons. Perm. Ins. Explor. Mer. 1952. № 18. P. 117–140.
Steemann Nielsen E. Experimental methods for measuring organic production in the sea // Rapp. P.-v. Réun. Cons. perm. int. Explor. Mer. 1958. V. 144. P. 38–46.
Strass V.H., Nöthig E.-M. Seasonal shifts in ice edge phytoplankton blooms in the Barents Sea related to the water column stability // Pol. Biol. 1996. V. 16. P. 409–422. https://doi.org/10.1007/BF02390423
Timmermans M.L., Cole S., Toole J. Horizontal density structure and restratification of the Arctic Ocean surface layer // J. Phys. Oceanogr. 2012. V. 42. P. 659–668.
Tremblay G., Belzile C., Gosselin M. et al. Late summer phytoplankton distribution along a 3500 km transect in Canadian Arctic waters: strong numerical dominance by picoeukaryotes // Aquat. Microb. Ecol. 2009. V. 54. P. 55–70. https://doi.org/10.3354/ame01257
Tremblay J-É., Michel C., Hobson K.A. et al. Bloom dynamics in early opening waters of the Arctic Ocean // Limnol. Oceanogr. 2006. V. 51. № 2. P. 900–912.
Tremblay J.-È., Robert D., Varela D.E. et al. Current state and trends in Canadian Arctic marine ecosystems: I. Primary production // Climatic Change. 2012. V. 115. Is. 1. P. 161–178. https://doi.org/10.1007/s10584-012-0496-3
Uitz J., Claustre H., Gentili B., Stramski D. Phytoplankton class-specific primary production in the world’s oceans: Seasonal and interannual variability from satellite observations // Global Biogeochem. Cycles. 2010. V. 24. GB3016. https://doi.org/10.1029/2009GB003680
Uitz J., Claustre H., Morel A., Hooker S.B. Vertical distribution of phytoplankton communities in open ocean: An assessment on surface chlorophyll // J. Geophys. Res. 2006. V. 111. C08005. https://doi.org/10.1029/2005JC003207
Uitz J., Huot Y., Bruyant F. et al. Relating phytoplankton photophysiological properties to community structure on large scales // Limnol. Oceanogr. 2008. V. 53. № 2. P. 614–630.
Vaulot D., Eikrem W., Viprey M., Moreau H. The diversity of small eukaryotic phytoplankton (<3 µm) in marine ecosystems // FEMS Microbiol. Rev. 2008. V. 32. P. 795–820.
Wang Yu., Kang J., Xiang P. et al. Phytoplankton communities and size-fractioned chlorophyll a in newly opened summer waters of the central Arctic Ocean // Mar. Ecol. Progr. Ser. 2019. V. 622. P. 67–82. https://doi.org/10.3354/meps13001
Zhang F., He J., Lin L., Jin H. Dominance of picophytoplankton in the newly open surface water of the central Arctic Ocean // Polar Biol. 2015. V. 38. P. 1081–1089. https://doi.org/10.1007/s00300-015-1662-7
Дополнительные материалы отсутствуют.


