Океанология, 2022, T. 62, № 3, стр. 416-427
Временнáя динамика биомассы фитопланктона в поверхностном слое Черного моря по данным спутниковых наблюдений
З. З. Финенко 1, И. М. Мансурова 1, *, В. В. Суслин 2
1 ФГБУН ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН”
Севастополь, Россия
2 ФГБУН ФИЦ “Морской гидрофизический институт РАН”
Севастополь, Россия
* E-mail: ira.mansurova2013@yandex.ua
Поступила в редакцию 04.06.2019
После доработки 28.12.2021
Принята к публикации 25.02.2022
- EDN: NEKDHS
- DOI: 10.31857/S0030157422030042
Аннотация
Получена оценка динамики биомассы фитопланктона в поверхностном слое, глубины верхнего перемешиваемого слоя и зоны фотосинтеза с использованием спутниковых данных в глубоководных и прибрежных районах Черного моря в течение 1998–2015 гг. Годовая динамика биомассы во всех районах имела одинаковый характер и описывалась кривой, форма которой была близка к U-образной с некоторым отклонением в весенний период. Максимальные среднесезонные значения наблюдались зимой, минимальные – летом, и они различались в среднем в 2.0–2.5 раза. “Цветения” фитопланктона средней продолжительностью 1.0–2.5 месяца наблюдались во все сезоны, но с разной частотой. Наибольшее их количество отмечено в весенний период, наименьшее – летом и осенью, во время “цветения” максимальные значения биомассы вдвое превышали фоновые величины. Осенью биомасса фитопланктона увеличивалась по мере снижения температуры воды и повышения глубины перемешиваемого слоя. В остальные сезоны такой связи не наблюдалось. В глубоководной части моря с 1998 по 2015 гг. динамика среднегодовой биомассы фитопланктона имела отрицательный тренд, в прибрежной зоне его не наблюдалось. Наиболее выраженное снижение биомассы в течение исследованного периода было зарегистрировано весной и летом, зимой и осенью оно не обнаружено.
ВВЕДЕНИЕ
Одной из важнейших задач экологии моря является исследование процессов, контролирующих динамику фитопланктонного сообщества. Она зависит от многих факторов среды, биологического развития отдельных видов водорослей и их взаимодействия с растительноядными организмами. Годовой цикл черноморского фитопланктона наиболее детально изучен в прибрежных районах и бухтах. Результаты исследований, выполненных в Одесском заливе [17], северо-западной части [12, 14], Севастопольской бухте [13], северо-восточной части моря [1, 38], показывают, что в зависимости от региональных условий в течение года развивается от двух до шести пиков биомассы фитопланктона. В глубоководном бассейне регулярных измерений биомассы фитопланктона крайне недостаточно, длительные ряды наблюдений практически отсутствуют, и по ним трудно судить о характере ее изменчивости [2, 3, 10]. Поэтому для анализа динамики биомассы фитоценоза часто привлекают данные по концентрации хлорофилла “а” (Хл), полученные с помощью контактных и дистанционных методов измерения [6, 25, 28, 37, 54]. Предполагается, что концентрация хлорофилла “а” в клетках водорослей изменяется в узких пределах, поэтому ее можно использовать как показатель биомассы фитопланктона. В то же время показано, что отношение органического углерода к хлорофиллу “а” в фитопланктоне (C:Хл отношение) может варьировать в пределах одного порядка величин в течение года и зависит от трофности водоема [20, 32, 49]. Основными факторами, влияющими на величину отношения C:Хл в водорослях, являются интенсивность света, концентрация биогенных веществ и таксономический состав водорослей [27, 31]. Поэтому есть все основания полагать, что временная динамика концентрации хлорофилла в поверхностном слое и биомассы фитопланктона может различаться. В данной работе биомасса фитопланктона рассчитана по разработанной ранее модели [18].
Цель работы – оценить мезомасштабную изменчивость динамики биомассы фитопланктона в поверхностном слое глубоководного бассейна и северной части шельфовой зоны Черного моря в течение 18-летнего периода.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования были выбраны четыре района: три района в глубоководной части моря, в которых находятся западный и восточный циклонические круговороты и юго-восточный антициклонический круговорот, а также район шельфа и континентального склона в северной части моря у берегов Крыма и Кавказа (рис. 1).
Рис. 1.
Карта-схема расположения районов: западный циклонический круговорот (1), восточный циклонический круговорот (2), юго-восточный антициклонический круговорот (3), район шельфа и континентального склона в северной части моря у берегов Крыма и Кавказа (4).

В этих районах расчет биомассы фитопланктона проводился с использованием модели, разработанной ранее в работе [18], согласно которой:
(1)
${\text{B}} = {{{\text{Х}}{{{\text{л}}}_{0}}} \mathord{\left/ {\vphantom {{{\text{Х}}{{{\text{л}}}_{0}}} {{\text{Хл}}{\kern 1pt} :{\kern 1pt} {\text{С}},}}} \right. \kern-0em} {{\text{Хл}}{\kern 1pt} :{\kern 1pt} {\text{С}},}}$где Хл0 – концентрация хлорофилла “а” в поверхностном слое, мг м3;
Хл:С – удельное содержание хлорофилла “а” в органическом углероде фитопланктона, безразмерная величина.
Концентрация хлорофилла была рассчитана по спутниковым наблюдениям за период с 1998 по 2015 гг. Был использован алгоритм, разработанный для Черного моря с использованием коэффициента яркости моря в трех спектральных каналах [51], который более точно восстанавливает Хл0 в поверхностном слое по сравнению с использованными ранее [35, 47], что показано в работе [15]. Данные второго уровня были получены с помощью приборов SeaWiFS (1998–2010 гг.) и MODIS-Aqua/Terra (2000–2015 гг.). Восстановление концентрации Хл0 по этим приборам дает одинаковые результаты [51]. Глубина сканирования слоя в глубоководной части составляла 5–15 м. В целом слой формирования сигнала равен обратной величине показателя диффузного ослабления света. Концентрация Хл0, полученная на пространственной сетке 0.025° по широте и 0.035° по долготе, усреднялась за двухнедельный период для каждого из районов. Средняя относительная ошибка восстановления Хл0 по использованному нами алгоритму для глубоководной части Черного моря по данным SeaWiFS и MODIS-Aqua/Terra составила 40% [15].
Удельное содержание хлорофилла “а” в органическом углероде фитопланктона рассчитывалось как в работе [18]:
(2)
${\text{Хл}}{\kern 1pt} :{\kern 1pt} {\text{С}} = r{{({{E}_{{{\text{ср}}}}}{{a}_{{{\text{ph}}}}})}^{{ - g}}},$Eср – средняя облученность в верхнем квазиоднородном слое, моль квантов м–2 сут–1;
aph – удельное поглощение света фитопланктоном, нормированное на хлорофилл “а”, м2 мг Хл0, рассчитанное как:
где коэффициент d = 0.015, коэффициент f = = 0.29 [24].Среднесуточная облученность в верхнем квазиоднородном слое рассчитана как:
(4)
${{E}_{{{\text{ср}}}}} = ((0.95{{{{Е}_{0}}} \mathord{\left/ {\vphantom {{{{Е}_{0}}} {{{k}_{d}}}}} \right. \kern-0em} {{{k}_{d}}}}){{({\text{exp}}( - {{k}_{d}}) - {\text{exp}}( - {{k}_{d}}{{z}_{p}})))} \mathord{\left/ {\vphantom {{({\text{exp}}( - {{k}_{d}}) - {\text{exp}}( - {{k}_{d}}{{z}_{p}})))} {{{z}_{p}},}}} \right. \kern-0em} {{{z}_{p}},}}$kd – коэффициент диффузного ослабления света водой, м–1;
zp – глубина перемешанного слоя, м.
Данные о ФАР, достигающей поверхности моря, взяты с сайта https://oceancolor.gsfc.nasa.gov/ для трех оптических сканеров SeaWiFS [41] и MODIS-Aqua/Terra [42, 43]. ФАР – это стандартный спутниковый продукт [30], качество которого проверено для Чёрного моря [16, 52].
Коэффициент kd рассчитывали, исходя из глубины эвфотической зоны (Zeu), которая рассчитана по упрощенной модели с использованием показателя вертикального ослабления света на длине волны 490 нм [53]:
(5)
${{Z}_{{{\text{eu}}}}} = {7 \mathord{\left/ {\vphantom {7 {{{k}_{d}}{{{(490)}}^{{0.69}}} + 3.}}} \right. \kern-0em} {{{k}_{d}}{{{(490)}}^{{0.69}}} + 3.}}$(6)
${{k}_{d}} = {{4.6} \mathord{\left/ {\vphantom {{4.6} {{{Z}_{{{\text{eu}}}}}.}}} \right. \kern-0em} {{{Z}_{{{\text{eu}}}}}.}}$Для оценки толщины верхнего квазиоднородного слоя (ВКС) и глубины верхнего перемешиваемого слоя (ГПС) использована модель, приведенная в работе Дорофеева и Сухих [26]. Толщина ВКС рассчитывалась как глубина, на которой потенциальная плотность воды увеличивалась на 0.1 кг м–3 от поверхностных значений, а ГПС – на 0.2 кг м–3. Модель основана на ассимиляции данных дистанционных измерений поверхностной температуры моря, возвышения свободной поверхности, среднегодовых профилей температуры, солености и циркуляции течений. В данной работе расчеты ГПС проведены с интервалом одни сутки для двух глубоководных районов, расположенных в западной (42.5°–43.5° с.ш.; 31°–33° в.д.) и восточной части моря (43°–44.5° с.ш.; 36°–38° в.д.).
Данные о температуре в поверхностном слое получены из спутниковых наблюдений: за период с 1998 по 2000 гг. взяты с сайта http://podaac.jpl. nasa.gov/sst/, за период с 2000 по 2015 гг. – с сайта https://oceancolor.gsfc.nasa.gov/ [44, 45].
При определении продолжительности “цветения” его началом считали увеличение биомассы более чем на 40% по сравнению с предыдущим значением, окончанием – уменьшение более чем на 40%.
Для статистической обработки данных и построения графиков использовали пакет программ Sigma Plot 12.5.
РЕЗУЛЬТАТЫ
Годовая динамика концентрации Хл, биомассы фитопланктона и Хл:C отношения за 18-летний период в исследованных районах приведена на рисунке 2. За весь период исследований в течение года различие между максимальными и минимальными значениями по Хл находилось в пределах от 8 до 19, 11–12 раз в среднем, а по биомассе – от 2 до 10, 4–5 раз в среднем. Динамика биомассы во всех районах имела одинаковый характер. В западном циклоническом круговороте максимальные среднесезонные значения наблюдались в зимне-весенний период, в остальных районах они были зимой (табл. 1). Во все годы во всех районах минимальные значения зарегистрированы в летний период, осенью они были примерно в 1.5 раза выше. Изменение отношения Хл:С в течение года имело вид вогнутой кривой с максимальными величинами в начале зимы и минимальными – в середине лета, различия между ними составляли от 3 до 5 раз (рис. 2). Во все сезоны величины Хл:С отношения между годами различались слабо. Сравнивая изменение среднесезонных величин Хл и биомассы фитопланктона от зимы к весне (табл. 1), можно констатировать, что увеличение концентрации хлорофилла на 50% зимой связано с ростом его внутриклеточной концентрации, а не с увеличением биомассы фитопланктона. Близкие значения получены, если рассчитать вклад фотоакклимации в увеличение хлорофилла от лета к весне и от лета к осени.
Рис. 2.
Годовая динамика концентрации хлорофилла “а” (слева), биомассы фитопланктона (в центре), относительного содержания хлорофилла “а” в фитопланктоне (справа) в 1998–2015 гг.: а, б, в – район западного циклонического круговорота, г, д, е – район восточного циклонического круговорота, ж, з, и – район юго-восточного антициклонического круговорота, к, л, м – район шельфа и континентального склона в северной части моря у берегов Крыма и Кавказа.
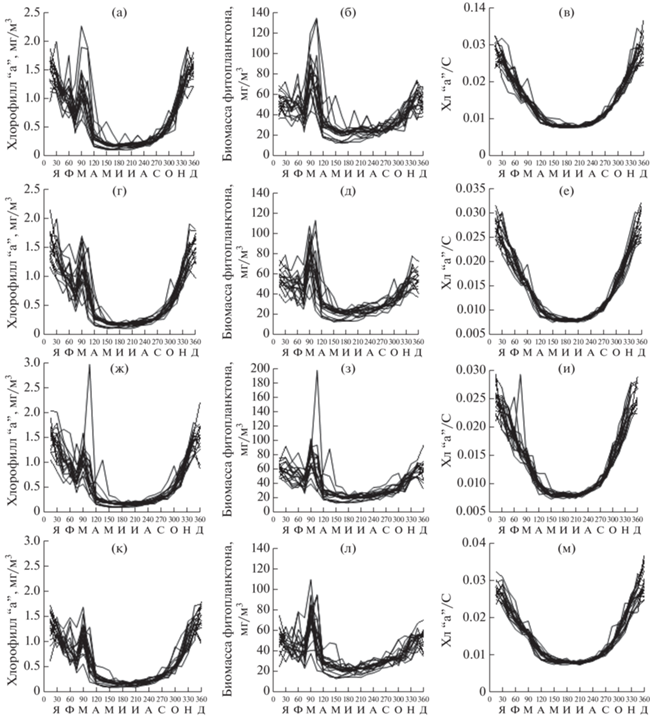
Таблица 1.
Среднесезонные значения концентрации хлорофилла “а”, биомассы и относительного содержания хлорофилла “а” в фитопланктоне с 1998 по 2015 гг.
| Район 1 | Район 2 | |||||
|---|---|---|---|---|---|---|
| хлорофилл “а”, мг м–3 |
биомасса, мг C м–3 |
Хл/С, мг Хл мг C–1 |
хлорофилл “а”, мг м–3 |
биомасса, мг C м–3 |
Хл/С, мг Хл мг C–1 |
|
| Зима | $\frac{{0.66{\kern 1pt} - {\kern 1pt} 1.99{\kern 1pt} *}}{{{\mathbf{1}}{\mathbf{.30}} \pm 0.29}}$ | $\frac{{28.5{\kern 1pt} - {\kern 1pt} 79.7}}{{{\mathbf{51}}{\mathbf{.4}} \pm 9.8}}$ | $\frac{{0.017{\kern 1pt} - {\kern 1pt} 0.037}}{{{\mathbf{0}}{\mathbf{.026}} \pm 0.004}}$ | $\frac{{0.56{\kern 1pt} - {\kern 1pt} 2.13}}{{{\mathbf{1}}{\mathbf{.29}} \pm 0.30}}$ | $\frac{{28.4{\kern 1pt} - {\kern 1pt} 78.6}}{{{\mathbf{53}}{\mathbf{.0}} \pm 9.9}}$ | $\frac{{0.017{\kern 1pt} - {\kern 1pt} 0.032}}{{{\mathbf{0}}{\mathbf{.024}} \pm 0.003}}$ |
| Весна | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 2.26}}{{{\mathbf{0}}{\mathbf{.61}} \pm 0.46}}$ | $\frac{{12.5{\kern 1pt} - {\kern 1pt} 133.9}}{{{\mathbf{46}}{\mathbf{.0}} \pm 26.6}}$ | $\frac{{0.008{\kern 1pt} - {\kern 1pt} 0.021}}{{{\mathbf{0}}{\mathbf{.012}} \pm 0.003}}$ | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 1.69}}{{{\mathbf{0}}{\mathbf{.57}} \pm 0.41}}$ | $\frac{{12.6{\kern 1pt} - {\kern 1pt} 113.3}}{{{\mathbf{43}}{\mathbf{.2}} \pm 23.6}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.019}}{{{\mathbf{0}}{\mathbf{.012}} \pm 0.003}}$ |
| Лето | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 0.39}}{{{\mathbf{0}}{\mathbf{.19}} \pm 0.05}}$ | $\frac{{12.3{\kern 1pt} - {\kern 1pt} 44.3}}{{{\mathbf{23}}{\mathbf{.3}} \pm 5.2}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.010}}{{{\mathbf{0}}{\mathbf{.008}} \pm 0.001}}$ | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 0.28}}{{{\mathbf{0}}{\mathbf{.18}} \pm 0.04}}$ | $\frac{{13.1{\kern 1pt} - {\kern 1pt} 31.9}}{{{\mathbf{22}}{\mathbf{.5}} \pm 4.2}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.009}}{{{\mathbf{0}}{\mathbf{.008}} \pm 0.001}}$ |
| Осень | $\frac{{0.17{\kern 1pt} - {\kern 1pt} 1.48}}{{{\mathbf{0}}{\mathbf{.57}} \pm 0.33}}$ | $\frac{{18.5{\kern 1pt} - {\kern 1pt} 61.0}}{{{\mathbf{34}}{\mathbf{.3}} \pm 10.0}}$ | $\frac{{0.009{\kern 1pt} - {\kern 1pt} 0.029}}{{{\mathbf{0}}{\mathbf{.016}} \pm 0.005}}$ | $\frac{{0.17{\kern 1pt} - {\kern 1pt} 1.31}}{{{\mathbf{0}}{\mathbf{.54}} \pm 0.30}}$ | $\frac{{18.3{\kern 1pt} - {\kern 1pt} 56.0}}{{{\mathbf{34}}{\mathbf{.7}} \pm 9.1}}$ | $\frac{{0.009{\kern 1pt} - {\kern 1pt} 0.025}}{{{\mathbf{0}}{\mathbf{.015}} \pm 0.004}}$ |
| Район 3 | Район 4 | |||||
| Зима | $\frac{{0.55{\kern 1pt} - {\kern 1pt} 2.18}}{{{\mathbf{1}}{\mathbf{.29}} \pm 0.33}}$ | $\frac{{32.2{\kern 1pt} - {\kern 1pt} 93.0}}{{{\mathbf{56}}{\mathbf{.6}} \pm 11.7}}$ | $\frac{{0.015{\kern 1pt} - {\kern 1pt} 0.029}}{{{\mathbf{0}}{\mathbf{.023}} \pm 0.003}}$ | $\frac{{0.54{\kern 1pt} - {\kern 1pt} 1.79}}{{{\mathbf{1}}{\mathbf{.20}} \pm 0.29}}$ | $\frac{{24.1{\kern 1pt} - {\kern 1pt} 78.1}}{{{\mathbf{47}}{\mathbf{.6}} \pm 10.1}}$ | $\frac{{0.017{\kern 1pt} - {\kern 1pt} 0.037}}{{{\mathbf{0}}{\mathbf{.025}} \pm 0.004}}$ |
| Весна | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 2.96}}{{{\mathbf{0}}{\mathbf{.55}} \pm 0.43}}$ | $\frac{{12.7{\kern 1pt} - {\kern 1pt} 197.8}}{{{\mathbf{43}}{\mathbf{.3}} \pm 26.8}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.029}}{{{\mathbf{0}}{\mathbf{.012}} \pm 0.003}}$ | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 1.69}}{{{\mathbf{0}}{\mathbf{.54}} \pm 0.38}}$ | $\frac{{12.9{\kern 1pt} - {\kern 1pt} 109.3}}{{{\mathbf{40}}{\mathbf{.3}} \pm 21.2}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.019}}{{{\mathbf{0}}{\mathbf{.012}} \pm 0.003}}$ |
| Лето | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 0.31}}{{{\mathbf{0}}{\mathbf{.18}} \pm 0.04}}$ | $\frac{{12.7{\kern 1pt} - {\kern 1pt} 34.6}}{{{\mathbf{21}}{\mathbf{.6}} \pm 4.3}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.009}}{{{\mathbf{0}}{\mathbf{.008}} \pm 0.001}}$ | $\frac{{0.10{\kern 1pt} - {\kern 1pt} 0.30}}{{{\mathbf{0}}{\mathbf{.18}} \pm 0.04}}$ | $\frac{{14.1{\kern 1pt} - {\kern 1pt} 33.4}}{{{\mathbf{22}}.{\mathbf{6}} \pm 4.1}}$ | $\frac{{0.007{\kern 1pt} - {\kern 1pt} 0.009}}{{{\mathbf{0}}{\mathbf{.008}} \pm 0.001}}$ |
| Осень | $\frac{{0.16{\kern 1pt} - {\kern 1pt} 1.27}}{{{\mathbf{0}}{\mathbf{.54}} \pm 0.30}}$ | $\frac{{17.2{\kern 1pt} - {\kern 1pt} 67.2}}{{{\mathbf{35}}{\mathbf{.5}} \pm 10.5}}$ | $\frac{{0.009{\kern 1pt} - {\kern 1pt} 0.024}}{{{\mathbf{0}}{\mathbf{.014}} \pm 0.004}}$ | $\frac{{0.19{\kern 1pt} - {\kern 1pt} 1.42}}{{{\mathbf{0}}{\mathbf{.57}} \pm 0.30}}$ | $\frac{{21.1{\kern 1pt} - {\kern 1pt} 56.7}}{{{\mathbf{35}}{\mathbf{.0}} \pm 8.4}}$ | $\frac{{0.009{\kern 1pt} - {\kern 1pt} 0.026}}{{{\mathbf{0}}{\mathbf{.015}} \pm 0.005}}$ |
Годовой цикл фитопланктона удобнее рассматривать, начиная с лета. В этот период наблюдается максимальная температурная и плотностная стратификация подповерхностного слоя. Средние значения ВКС варьируют от 6.5 м в июне до 10.6 м в августе, ГПС – от 9.0 до 11.4 м соответственно. Разница между глубинами ВКС и ГПС уменьшается от начала к концу лета, составляя в среднем в июне 2.5 м, в августе – 0.8 м. Таким образом, наибольшая плотностная стратификация и наибольшая глубина перемешиваемого слоя наблюдаются в конце лета. В целом в летний сезон фитопланктон развивается при относительно стабильных условиях, при которых уровень биомассы и ее вариабельность низкие. Количество вспышек фитопланктона минимально (табл. 2). Их продолжительность не превышает одного месяца, а средняя амплитуда для рассматриваемых районов находится в пределах 30.4–40.7 мг C м–3, что в 1.5–2.0 раза выше средних значений за весь летний период. Следует отметить, что начиная с 2012 г. в исследованной акватории моря биомасса фитопланктона уменьшилась примерно вдвое по сравнению с предыдущими годами. Это снижение не связано с изменением температурного и светового режимов.
Таблица 2.
Количество “цветений” фитопланктона, их продолжительность и амплитуда биомассы в различные сезоны c 1998 по 2015 гг.
| Зима | Весна | Лето | Осень | |
|---|---|---|---|---|
| Район 1 | ||||
| Общее количество “цветений” | 4 | 18 | 3 | 4 |
| Продолжительность, мес. | 1.0 | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 3.0{\kern 1pt} *}}{{1.9}}$ | 1.0 | 1.0 |
| Амплитуда, мг C м–3 | $\frac{{39.4{\kern 1pt} - {\kern 1pt} 79.7}}{{62.2 \pm 15.8}}$ | $\frac{{43.8{\kern 1pt} - {\kern 1pt} 133.9}}{{82.5 \pm 22.7}}$ | $\frac{{38.7{\kern 1pt} - {\kern 1pt} 44.3}}{{40.7 \pm 3.1}}$ | $\frac{{30.2{\kern 1pt} - {\kern 1pt} 54.2}}{{41.1 \pm 11.3}}$ |
| Район 2 | ||||
| Общее количество “цветений” | 1 | 17 | – | 1 |
| Продолжительность, мес. | 1.0 | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 2.5}}{{1.6}}$ | – | 2.0 |
| Амплитуда, мг C м–3 | 59.2 | $\frac{{50.0{\kern 1pt} - {\kern 1pt} 113.3}}{{81.0 \pm 17.9}}$ | – | 55.4 |
| Район 3 | ||||
| Общее количество “цветений” | 3 | 15 | – | 1 |
| Продолжительность, мес. | $\frac{{2.0{\kern 1pt} - {\kern 1pt} 3.0}}{{2.3}}$ | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 2.5}}{{1.7}}$ | – | 2.5 |
| Амплитуда, мг C м–3 | $\frac{{62.2{\kern 1pt} - {\kern 1pt} 82.8}}{{69.8 \pm 11.3}}$ | $\frac{{62.8{\kern 1pt} - {\kern 1pt} 197.8}}{{87.1 \pm 33.2}}$ | – | 54.1 |
| Район 4 | ||||
| Общее количество “цветений” | 4 | 17 | 1 | – |
| Продолжительность, мес. | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 2.5}}{{1.6}}$ | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 3.0}}{{1.9}}$ | 1.0 | – |
| Амплитуда, мг C м–3 | $\frac{{41.7{\kern 1pt} - {\kern 1pt} 78.1}}{{61.7 \pm 15.0}}$ | $\frac{{37.4{\kern 1pt} - {\kern 1pt} 109.3}}{{75.5 \pm 17.4}}$ | 30.4 | – |
В осенний период начинается конвективное перемешивание, температура воды и интенсивность солнечной радиации снижается, происходит постепенное разрушение температурного градиента, а ГПС изменяется от 13 м в сентябре, до 28 м в начале декабря. Эти глубины не выходят за пределы зоны фотосинтеза, и фитопланктонное сообщество находится в освещенной зоне. В западном и восточном круговоротах наблюдается тесная отрицательная корреляция между температурой и ГПС (R2 = 0.90). Осенью (сентябрь–ноябрь) “цветение” фитопланктона в западном циклоническом круговороте в течение 18-летнего периода наблюдалось четыре раза, в остальных глубоководных районах – по одному разу, в прибрежном оно отсутствовало (табл. 2). Продолжительность “цветения” во всех районах варьировала от 1.0 до 2.5 месяцев с максимумом в основном в сентябре–октябре; минимальная длительность зарегистрирована в западной части моря. Максимальные значения биомассы во время “цветения” находились в пределах от 30 до 55 мг C м–3. В восточной части моря и на шельфе они были примерно одинаковы – в среднем 54–55 мг C м–3, в западной – на 25% ниже.
Между биомассой фитопланктона и температурой с сентября до конца года наблюдалась обратная зависимость, которая лучше всего описывается экспоненциальной функцией для каждого из районов. Следующие уравнения получены с помощью программы Sigma Plot 12.5:
(7)
$\begin{gathered} {\text{Б}} = (93.0 \pm 5.1){\kern 1pt} {\text{exp((}}{\kern 1pt} - {\kern 1pt} 0.057 \pm 0.004{\text{)}}Т{\text{)}},~ \\ {{R}^{2}} = 0.66,\,\,\,\,n = 144, \\ \end{gathered} $(8)
$\begin{gathered} {\text{Б}} = (96.5 \pm 4.8){\kern 1pt} {\text{exp(}}( - 0.056 \pm 0.003)Т{\text{)}},~ \\ {{R}^{2}} = 0.71,\,\,\,\,n = 144, \\ \end{gathered} $(9)
$\begin{gathered} {\text{Б}} = (119.8 \pm 7.2){\kern 1pt} {\text{exp(}}( - 0.063 \pm 0.003)Т{\text{)}}, \\ {{R}^{2}} = 0.70,\,\,\,\,n = 144, \\ \end{gathered} $(10)
$\begin{gathered} {\text{Б}} = (81.6 \pm 4.8){\kern 1pt} {\text{exp(}}( - 0.046 \pm 0.004)Т{\text{)}},~ \\ {{R}^{2}} = 0.56,\,\,\,\,n = 144, \\ \end{gathered} $Т – температура, °C;
R 2 – коэффициент детерминации;
n – объем выборки.
Для западного и восточного циклонических круговоротов (уравнения (7) и (8) соответственно) численные коэффициенты были близки. Уравнение (9) описывает зависимость между биомассой фитопланктона и температурой воды для антициклонического круговорота, уравнение (10) – для шельфа у берегов Крыма и Кавказа. Как видно, в глубоководных районах коэффициенты детерминации между температурой и биомассой несколько выше, чем в прибрежном. Это может быть следствием более интенсивного поступления питательных веществ с береговым стоком в прибрежном районе. В западной и восточной частях моря между биомассой фитопланктона и ГПС наблюдалась прямая зависимость с коэффициентами детерминации 0.60 и 0.71 соответственно.
В зимний период температурный градиент в подповерхностном слое полностью разрушается, интенсивность конвективного перемешивания воды достигает максимума в феврале, а глубина перемешиваемого слоя увеличивается. Для этого периода не отмечено связи между температурой воды в поверхностном слое и ГПС, т.к. последняя ограничивается глубиной галоклина, которая зависит от взаимодействия опресненных и соленых вод и динамики течений. Средние значения ГПС в январе, феврале, первой половине марта достоверно не различаются. В западной и восточной частях моря они составляют 39 и 38 м, 42 и 41 м, 39 и 40 м соответственно, что превышает глубину, куда проникает 1% света на 1–5 м. В этот период биомасса фитопланктона изменяется слабо и достигает высоких значений. В отдельные годы значения ГПС в январе–феврале в течение 5–15 суток оставались одинаковыми, однако эти периоды не всегда сопровождались ростом биомассы. Несмотря на динамическую активность водных масс, общее количество “цветений” фитопланктона было больше, чем в осенний и летний периоды. Так, в западном циклоническом круговороте и в районе шельфа отмечено по четыре цветения за 18 лет, в антициклоническом – три, и в восточном циклоническом круговороте – одно (табл. 2). Короткопериодные вспышки в развитии фитопланктона встречены в основном в феврале и только в годы с теплыми зимами. Средняя для разных районов амплитуда составляла 60–70 мг C м–3, продолжительность “цветения” изменялась от 1 до 3 месяцев; наибольшая была отмечена в восточном антициклоническом районе. С начала января по первую половину марта связь биомассы фитопланктона с температурой и ГПС отсутствует. Возможно, это связано с узким диапазоном изменений температуры воды, ГПС и биомассы фитопланктона в это время.
В глубоководной части и шельфовой зоне весеннее “цветение” воды фитопланктоном встречалось почти ежегодно в конце марта–начале апреля, оно отсутствовало три раза в течение 18-летнего периода в антициклоническом круговороте (табл. 2). Продолжительность “цветения” во всех районах была примерно одинаковой, и ее средневзвешенные значения варьировали от полутора до двух месяцев. В годы с холодными зимами, которые наиболее часто наблюдались в западном циклоническом круговороте, амплитуда биомассы фитопланктона и продолжительность были на 25–30% выше, чем в годы с теплыми зимами, что, возможно, связано с разной степенью обогащения поверхностных вод питательными веществами в теплые и холодные зимы. В целом средняя амплитуда биомассы варьировала в узких пределах – от 76 до 87 мг C м–3, а перед началом “цветения” она была вдвое меньше.
Таким образом, цикл фитопланктона во все годы характеризуется минимальной биомассой в летний период, когда ее вариабельность низкая. Осенью наблюдается устойчивый рост биомассы водорослей. Она достигает максимальных значений в декабре, которые сохраняются в течение всей зимы. Во второй половине марта–начале апреля наблюдается весеннее “цветение” фитопланктона. В этот период уровень биомассы достигает максимума, превышая зимние значения в среднем в 1.4 раза. Затем она снижается, и в летний период составляет 22–23 мг C м–3. В течение года среднесезонные значения биомассы различаются в глубоководных районах в 2.5 раза, а в прибрежном – в 2 раза.
В циклонических и антициклоническом круговоротах изменение среднегодовых значений биомассы фитопланктона с 1998 по 2015 гг. имеет достоверный отрицательный тренд при уровне значимости p ≤ 0.02 (рис. 3). В течение этого периода биомасса в районах 1, 2, 3 уменьшилась на 7–8 мг C м–3, что составляет 17–19% от начальной величины. В то же время изменение температуры в поверхностном слое в западной и восточной части моря имело положительный тренд, но при разном уровне значимости. В западном круговороте температура в течение 18 лет повысилась на 0.66°C, и тренд был достоверен при p = 0.03. В восточном круговороте температура увеличилась на 0.57°C, но тренд был достоверным только при p = 0.10. В антициклоническом круговороте температурный тренд был недостоверен. В прибрежном районе достоверного изменения биомассы в течение исследуемого периода не зарегистрировано.
Рис. 3.
Тренды биомассы фитопланктона для районов западного (1), восточного (2) циклонических круговоротов и восточного антициклонического круговорота (3): среднегодовых (а), среднесезонных весенних (б) и среднесезонных летних значений (в).
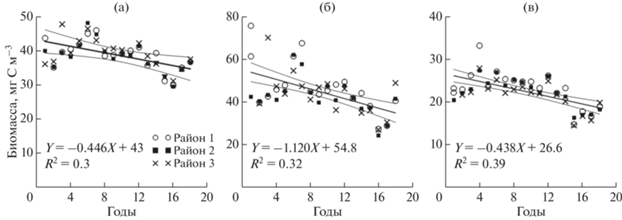
По многолетним данным изменение среднесезонных значений биомассы фитопланктона различно. Зимой и осенью не отмечено достоверных трендов биомассы, в то время как весной и летом они были отрицательными (рис. 3). Наибольшие изменения биомассы наблюдались в весенний период. Так, в глубоководной части моря она снижалась на 16–23 мг C м–3, что составляет 31–40% от начальных величин. Летом величины биомассы уменьшались на 25–33%. В шельфовой зоне весной и летом также наблюдался отрицательный достоверный тренд (p ≤ 0.06). Между многолетними изменениями биомассы и температуры в различные сезоны связи не обнаружено.
ОБСУЖДЕНИЕ
Черное море является одним из наиболее стратифицированных морей в Мировом океане [5]. Его отличительной чертой является наличие узких стратифицированных слоев с большим перепадом плотности. Физическая структура вод и биологические процессы, протекающие в водной толще, определяют гидрохимический режим водоема. В конце осени и зимой происходит охлаждение поверхностных вод и развивается конвективное перемешивание. Толщина ВКС изменяется в широких пределах, она минимальна в центре циклонических круговоротов, максимальна – на их периферии и в антициклонических вихрях. Результаты расчетов, проведенных по модели [26], показали, что зимой в западном и восточном круговоротах толщина ВКС варьирует в пределах от 17 до 25 м, в среднем 21 ± 1 м, а глубина ГПС – от 33 до 45 м, в среднем – 40 ± 3 м. Согласно контактным измерениям потенциальной плотности воды в центральной части моря средние значения толщины ВКС в январе–марте составляют 30–35 м [9]. В это время верхняя граница слоя максимальных градиентов концентрации нитратов и фосфатов находится на глубине 30–60 м [8]. В феврале и марте наблюдаются максимальные в течение года скорости восходящих потоков нитратов и фосфатов, которые находятся в пределах 1.2–1.8 мг-ат N м–2 сут–1 для нитратов и 0.20–0.26 мг-ат Р м–2 сут–1 для фосфатов. Таким образом, перемешивание достигает глубин, с которых осуществляется транспорт биогенных веществ из нижних слоев в верхние. В начале зимнего периода концентрация кремния максимальна и составляет в среднем около 3.5 мкМ, а в конце февраля в результате развития диатомовых водорослей она уменьшается до 1.5 мкМ [48]. Согласно проведенным нами расчетам, глубина зоны фотосинтеза в зимний период в глубоководной части моря и в районе шельфа и континентального склона варьирует от 18 до 65 м, ее средние значения составляют 34–37 м. Как видно, средние значения глубины перемешивания и зоны фотосинтеза практически совпадают. В результате фитопланктонное сообщество в течение всего зимнего периода находится в пределах освещенной зоны и может активно ассимилировать питательные вещества. Эта особенность является отличительной чертой Черного моря от других океанических районов умеренных и субполярных широт [21, 33]. В антициклональных вихрях толщина ВКС составляет 50–70 м, в северо-западной и северо-восточной частях моря она может достигать 70–100 м [9]. В этом случае в результате турбулентного обмена биомасса фитопланктона будет размываться в большем столбе воды, и около половины ее будет находиться за пределами зоны фотосинтеза. Как следствие, биомасса в поверхностном слое в зимний период увеличивается от периферии круговоротов к их центрам [28].
На фоне относительно слабой изменчивости концентрации фитопланктона зимой в среднем раз в 4 года наблюдаются достоверные короткопериодные вспышки в развитии фитопланктона. В годы с теплой зимой может формироваться временный подповерхностный градиент плотности, который ограничивает перемешивание и способствует росту фитопланктона при относительно высоких концентрациях питательных веществ. Такое явление наблюдается в некоторых районах океана, когда глубина перемешиваемого слоя достигает нескольких сот метров [22, 23, 29].
Во второй половине марта–апреле интенсивность конвективного перемешивания ослабевает [46], а толщина ВКС по сравнению с предыдущим периодом уменьшается как по проведенным нами модельным расчетам c 22 до 8 м, так и по контактным измерениям с 30 до 20 м [9]. Начало весеннего развития фитопланктона происходит либо при отсутствии температурной стратификации, либо в начале ее формирования. Весеннее “цветение” фитопланктона в Черном море имеет две особенности: небольшую продолжительность и слабое увеличение биомассы от фоновых значений к максимуму, которое в среднем не превышает двух раз. Рост биомассы начинается при общей концентрации неорганических азотных соединений около 1 мкМ, силикатов – 2.5 мкМ, а отношение между общим азотом и фосфатами 20 [48]. При таких значениях весеннее развитие фитопланктона продолжается в среднем 1.5–2.0 месяца. Этих концентраций недостаточно для достижения высоких величин биомассы фитопланктона и поддержания продолжительного массового развития водорослей весной. В умеренных районах Атлантического океана зимне-весеннее развитие фитопланктона начинается в начале февраля при концентрации нитратов около 4 мкМ и продолжается в течение четырех месяцев [34].
Летом устанавливается температурный градиент в глубоководных и прибрежных районах моря. В теплый период года механическое воздействие ветра является основным фактором, вызывающим изменчивость толщины ВКС, которая увеличивается с востока на запад [9]. В это время зона фотосинтеза четко разделена на два слоя: над температурным градиентом и под ним. Фитопланктон, обитающий в верхнем слое, адаптируется к низкой концентрации биогенных элементов, относительно высоким значениям интенсивности света и температуры; источником питания для него служит преимущественно аммоний [19]. Фитопланктон ниже температурного градиента обитает при слабой интенсивности светового потока, низкой температуре и более высоких концентрациях нитратов и аммония. В зоне ОЧТ в летне-осенний период образуются антициклональные вихри и меандры, которые переносят прибрежный фитопланктон и биогены в открытую часть моря, что может приводить к кратковременному локальному росту биомассы фитопланктона в открытой части [28]. Пространственные размеры таких вихрей обычно составляют несколько десятков миль, а время их жизни – несколько недель [7]. Сильное ветровое воздействие способно вызвать ослабление сезонного термоклина и увеличение глубины ВКС за счет турбулентного вовлечения [4], что может приводить к переносу биогенных веществ из слоя термоклина и кратковременному интенсивному росту фитопланктона в поверхностном слое. Последовательное влияние нескольких сильных ветровых явлений, наблюдаемых в юго-восточной части моря в августе 2015 г., привели к резкому нарушению физической структуры вод, изопикническому перемешиванию, вызванному сдвигом инерционных течений. Сильные ветра на локальных масштабах могут временно изменить систему течений и вертикальную физическую структуру водного столба [36]. В последние десятилетия в глубоководных и прибрежных районах моря в мае-июне часто доминируют Emiliania huxleyi [11, 40, 50], средняя биомасса которой в северо-восточной части моря в 2002, 2003–2007 гг. составила почти 200 мкг л–1 или 47% от общей биомассы водорослей [11]. Если по этим данным рассчитать биомассу в единицах органического углерода, то она в среднем составит 29.5 мг C м–3. По нашей модели для этих месяцев и лет она равна 24.7 мг C м–3. При обобщении результатов исследований, выполненных в глубоководной части моря с 1996 по 2008 гг. в мае–октябре средняя биомасса составила 10.6 ± 2.4 г м–2 [40]. Если принять, что фитопланктон в основном обитает в слое 0–50 м, то средняя биомасса в столбе воды будет равна 212 мг м–3 или 21.2 мг C м–3. По использованной нами модели для этих месяцев с 1998 по 2008 гг. она равна 27.6 ± 6.3 мг C м–3. Средние значения статистически различаются при уровне значимости p = 0.05. Однако необходимо иметь ввиду, что средние значения получены при совершенно разной численности выборок: малой (прямые измерения) и большой (спутниковые наблюдения).
В начале осеннего периода сохраняется летняя физико-химическая структура в столбе воды, которая во второй половине октября–ноябре начинает разрушаться, одновременно наблюдается рост биомассы фитопланктона. В данном случае температура выступает как косвенный фактор. С уменьшением температуры в поверхностном слое ослабевает температурный градиент, в результате чего скорость потока биогенных веществ с более глубоких слоев к поверхности возрастает. Поэтому можно предположить, что осенью и в начале зимы скорость потока питательных веществ является основным фактором, определяющим развитие фитопланктона. Это подтверждается данными по толщине ГПС и ВКС. Разница между ними в сентябре–октябре в разные годы составляла от 0 до 3 м, а в декабре – от 1 до 14 м. Как видно, градиент плотности воды ослабевает от осени к началу зимы. Ослабление температурного градиента также может быть связано с ветровой активностью. Показано, что сильный ветер (≥8 м с–1) положительно влияет на увеличение биомассы фитопланктона, которое определяется поступлением нитратов из нижних слоев в верхние [39]. Согласно нашим результатам, интенсивное развитие фитопланктона встречается в среднем для всех районов один раз в 9 лет.
Для прогноза развития “цветения” фитопланктона некоторые авторы используют модель турбулентной диффузии, в основу которой положены два механизма. Один из них применим для условий, когда водный столб хорошо перемешивается, и соответствует классической теории критической глубины Свердрупа. Второй подход основан на скорости турбулентного перемешивания. Если скорость турбулентного перемешивания меньше некоторой критической величины, скорость роста фитопланктона превышает скорость вертикального перемешивания, и “цветение” развивается независимо от глубины верхнего перемешиваемого слоя воды. Полученные результаты показывают, что “цветение” фитопланктона может развиваться в отсутствии вертикальной плотностной стратификации [34]. Таким образом, скорость турбулентной диффузии относится к важным параметрам, определяющим жизнедеятельность фитопланктонного сообщества.
Таким образом, осреднение величин на масштабах несколько сот миль показало, что несмотря на разную направленность течений в исследованных районах, наблюдается одинаковый характер годового цикла фитопланктона в поверхностном слое. Он описывается кривой, форма которой близка к U-образной. В течение года биомасса фитопланктона различается в среднем в 2.0–2.5 раза; максимальные среднесезонные величины отмечены для зимнего периода, минимальные – летом. Короткопериодные вспышки в развитии фитопланктона были отмечены во все сезоны, но с разной частотой. Наибольшее их количество за 18-летний период было весной и зимой, наименьшее – осенью и летом. Максимальные значения биомассы фитопланктона наблюдались во время весеннего “цветения”, и они были в среднем в 3.6 раз выше, чем летом. Динамика биомассы фитопланктона зависит от взаимодействия факторов в различные сезоны. Зимой она определяется поступлением биогенных веществ из нижних слоев в верхние, которое зависит от их концентрации на верхней границе галоклина, и коэффициента вертикальной диффузии и переноса. Весной уровень биомассы определяется ослаблением конвективного перемешивания, началом формирования температурного градиента и запасом биогенных веществ в поверхностном слое. Летом он зависит от температурных условий и пополнения биогенов в результате регенерации органического вещества и их переноса с вихрями от прибрежных районов в открытую часть моря. Осенью поток тепла становится отрицательным, начинается конвективное перемешивание и возрастает влияние ветровой активности. В результате ГПС увеличивается и фитопланктон, максимум которого располагался у основания сезонного термоклина, распределяется в перемешанном слое, что приводит к увеличению его биомассы в поверхностном слое.
ВЫВОДЫ
1. Годовая динамика биомассы фитопланктона в поверхностном слое в исследованных глубоководных и прибрежных районах Черного моря в 1998–2015 гг. имела одинаковый характер и, как правило, описывалась U-образной кривой. Максимальные среднесезонные значения наблюдались зимой, минимальные – летом, они различались в среднем в 2.0–2.5 раза. Во все сезоны отмечены некоторые отклонения от U-образной формы кривой, которые за 18-тилетний период встречались единично, кроме весеннего “цветения” фитопланктона, наблюдавшегося в каждом из исследованных районов почти ежегодно. При этом максимальные значения биомассы вдвое превышали фоновые величины.
2. Осенью биомасса фитопланктона увеличивалась по мере снижения температуры воды и повышения глубины перемешиваемого слоя. В остальные сезоны такой связи не наблюдалось.
3. В глубоководной части моря с 1998 по 2015 гг. динамика среднегодовых величин биомассы фитопланктона имела отрицательный тренд, в прибрежной зоне его не наблюдалось. Наиболее выраженное снижение биомассы в течение исследованного периода было зарегистрировано весной и летом, зимой и осенью оно не обнаружено.
Источники финансирования. Работа выполнена по темам гос. задания ФИЦ ИнБЮМ № 0556-2021-0003 “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”, номер гос. регистрации 121041400077-1 и ФГБУН ФИЦ МГИ № 0555-2021-0003 “Развитие методов оперативной океанологии на основе междисциплинарных исследований процессов формирования и эволюции морской среды и математического моделирования с привлечением данных дистанционных и контактных измерений”.
Список литературы
Арашкевич Е.Г., Луппова Н.Е., Никишина А.Б. и др. Судовой экологический мониторинг в шельфовой зоне Черного моря: оценка современного состояния пелагической экосистемы // Океанология. 2015. Т. 55. № 6. С. 964–964.
Берсенева Г.П., Чурилова Т.Я., Георгиева Л.В. Сезонная изменчивость хлорофилла и биомассы фитопланктона в западной части Черного моря // Океанология. 2004. Т. 44. № 3. С. 389–398.
Брянцев В.А., Брянцева Ю.В. Многолетние изменения в фитопланктоне глубоководной части Черного моря в связи с естественным и антропогенным факторами // Экология моря. 1999. Вып. 49. С. 24–28.
Зацепин А.Г., Кременецкий В.В., Пиотух В.Б. и др. Формирование прибрежного течения в Черном море из-за пространственно-неоднородного ветрового воздействия на верхний квазиоднородный слой // Океанология. 2008. Т. 48. № 2. С. 176–192.
Иванов В.А., Белокопытов В.Н. Океанография Черного моря. Севастополь: МГИ НАН Украины, 2011. 212 с.
Копелевич О.В., Салинг И.В., Вазюля С.В. и др. Биооптические характеристики морей, омывающих берега западной половины России, по данным спутниковых сканеров цвета 1998–2017 гг. М.: ООО “ВАШ ФОРМАТ”, 2018. 140 с.
Коротаев Г.К., Еремеев В.Н. Введение в оперативную океанографию Черного моря Севастополь: НПЦ “ЭКОСИ-Гидрофизика”, 2006. 382 с.
Кривенко О.В., Пархоменко А.В. Восходящий и регенерационный потоки неорганических соединений азота и фосфора в глубоководной области Чёрного моря // Журнал общей биологии. 2014. Т. 75. № 5. С. 394–408.
Кубряков А.А., Белокопытов В.Н., Зацепин А.Г. и др. Изменчивость толщины перемешанного слоя в Черном море и ее связь с динамикой вод и атмосферным воздействием // Морской гидрофизический журнал. 2019. Т. 35. № 5. С. 449–468.
Маштакова Г.П., Роухияйнен М.И. Сезонная динамика фитопланктона // Основы биологической продуктивности Чёрного моря. Ред. В.Н. Грезе. Киев: Наук. думка, 1979. С. 85–88.
Микаэлян А.С., Силкин В.А., Паутова Л.А. Развитие кокколитофорид в Черном море: межгодовые и многолетние изменения // Океанология. 2011. Т. 51. № 1. С. 45–53.
Нестерова Д.А. Развитие фитопланктона северо-западной части Черного моря в весенний, летний и осенний периоды // Биология моря. 1977. Вып. 43. С. 17–23.
Поликарпов И.Г., Сабурова М.А., Манжос Л.А. и др. Биологическое разнообразие микропланктона прибрежной зоны Черного моря в районе Севастополя (2001–2003 гг.) // Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор) / Под ред. В.Н. Еремеева, А.В. Гаевской. НАН Украины, ИнБЮМ. Севастополь: ЭКОСИ-Гидрофизика, 2003. С. 16–42.
Роухияйнен М.И. О сезонной динамике фитопланктона Черного моря // Биология моря. 1975. Вып. 34. С. 3–15.
Суслин В.В., Чурилова Т.Я., Ли М.Е. и др. Концентрация хлорофилла-а в Черном море: сравнение спутниковых алгоритмов // Фундаментальная и прикладная гидрофизика. 2018. Т. 11. № 3. С. 64–72.
Суслин В.В., Шокуров М.В., Чурилова Т.Я. и др. Фотосинтетически активная радиация в г. Севастополь: измерения и численные расчеты // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. 2014. № 28. С. 345–355.
Теренько Л.М. Сезонная динамика фитопланктона в прибрежных водах Одесского залива Черного моря (Украина) // Альгология. 2010. Т. 20. № 1. С. 73–85.
Финенко З.З., Ковалева И.В., Суслин В.В. Новый подход к оценке биомассы фитопланктона и ее вариабельности в поверхностном слое Черного моря по спутниковым данным // Успехи современной биологии. 2018. Т. 138. № 3. С. 294–307.
Финенко З.З., Чурилова Т.Я., Сосик Х.М. Вертикальное распределение фотосинтетических характеристик в Черном море // Океанология. 2004. Т. 44. № 2. С. 222–237.
Behrenfeld M.J., Boss E., Siegel D.A., Shea D.M. Carbon-based ocean productivity and phytoplankton physiology from space // Global biogeochemical cycles. 2005. № 19. GB1006. 14 p. https://doi.org/10.1029/2004GB002299
Boss E., Behrenfeld M. In situ evaluation of the initiation of the North Atlantic phytoplankton bloom // Geophysical Research Letter. 2010. № 37. L18603. 5 p. https://doi.org/10.1029/2010GL044174
Chiswell S.M. Annual cycles and spring blooms in phytoplankton: don’t abandon Sverdrup completely // Marine Ecology Progress Series. 2011 V. 443. P. 39–50. https://doi.org/10.3354/meps09453
Chiswell S.M., Calil P.H.R., Boyd P.W. Spring blooms and annual cycles of phytoplankton: a unified perspective // Journal of Plankton Research. 2015. V. 37. № 3. P. 500–508. https://doi.org/10.1093/plankt/fbv021
Churilova T., Berseneva G., Georgieva L. Variability in bio-optical characteristics of phytoplankton in the Black Sea // Oceanology. 2004. V. 44. № 2. P. 192–204.
Demidov A.B. Seasonal dynamics and estimation of the annual primary production of phytoplankton in the Black Sea // Okeanology. 2008. V. 48. № 5. P. 664–678. https://doi.org/10.1134/S0001437008050068
Dorofeev V.L, Sukhikh L.I. Study of long-term variability of Black Sea dynamics on the basis of circulation model assimilation of remote measurements // Izvestiya, Atmospheric and Oceanic Physics. 2017. V. 53. № 2. P. 224–232.
Finenko Z.Z., Hoepffner N., Williams R., Puiontkovski S.A. Phytoplankton carbon to chlorophyll a ratio: response to light, temperature, and nutrient limitation // Mar. Ecol. J. 2003. V. 2. № 2. P. 40–64.
Finenko Z.Z., Suslin V.V., Kovaleva I.V. Seasonal and long-term dynamics of the chlorophyll concentration in the Black sea according to satellite observations // Okeanology. 2014. V. 54. № 5. P. 596–605. https://doi.org/10.1134/S0001437014050063
Franks P.J.S. Has Sverdrup’s critical depth hypothesis been tested? Mixed layers vs. turbulent layers // ICES Journal of Marine Science. 2014. V. 72. № 6. P. 1897–1907. https://doi.org/10.1093/icesjms/fsu175
Frouin R., McPherson J., Ueyoshi K., Franz B.A. A time series of photosynthetically available radiation at the ocean surface from SeaWiFS and MODIS data. Remote Sensing of the Marine Environment II. 2012. https://doi.org/10.1117/12.981264
Geider R.J. Light and temperature dependence of the carbon to chlorophyll a ratio in microalgae and cyanobacteria: implications for physiology and growth of phytoplankton // New Phytologist. 1987. V. 106. P. 1–34.
Goericke R., Welschmeyer N.A. Response of Sargasso Sea phytoplankton biomass, growth rates and primary production to seasonally varying physical forcing // Journal of Plankton Research. 1998. V. 20. № 12. P. 2223–2249.
González-Gil R., González Taboada F., Cáceres C. et al. Winter-mixing preconditioning of the spring phytoplankton bloom in the Bay of Biscay // Limnology and Oceanography. 2018. V. 63. № 3. P. 1264–1282.
Huisman J.E.F., van Oostveen P., Weissing F.J. Critical depth and critical turbulence: two different mechanisms for the development of phytoplankton blooms. Limnology and oceanography. 1999. V. 44. № 7. P. 1781–1787.
Kopelevich O.V. et al. Application of SeaWiFS data for studing variability of bio-optical characteristics in the Barents, Black and Caspian Seas // Deep-Sea Research. Part II: Tropical Studies in Oceanography. 2004. V. 51, N 10–11. P. 1063–1091.
Kubryakov A.A., Zatsepin A.G., Stanichny S.V. Anomalous summer-autumn phytoplankton bloom in the Black Sea driven by several strong wind events // Journal of Marine Systems. 2019. V. 194. P. 11–24 https://doi.org/10.1016/j.jmarsys.2019.02.004
Mikaelyan A.S., Chasovnikov V.K., Kubryakov A.A., Stanichny S.V. Phenology and drivers of the winter-spring phytoplankton bloom in the open Black Sea: The application of Sverdrup’s hypothesis and its refinements // Progress in oceanography. 2017. V. 151. P. 163–176. https://doi.org/10.1016/j.pocean.2016.12.006
Mikaelyan A.S., Pautova L.A., Chasovnikov V.K. et al. Alternation of diatoms and coccolithophores in the north-eastern Black Sea: a response to nutrient changes // Hydrobiologia. 2015. V. 755. № 1. P. 89–105.
Mikaelyan A.S., Shapiro G.I., Chasovnikov V.K. et al. Drivers of the autumn phytoplankton development in the open Black Sea // Journal of Marine Systems. 2017. V. 174. P. 1–11. https://doi.org/10.1016/j.jmarsys.2017.05.006
Mikaelyan A.S., Zatsepin A.G., Chasovnikov V.K. Long-term changes in nutrient supply of phytoplankton growth in the Black Sea // Journal of Marine Systems. 2013. V. 117. P. 53–64.
NASA Goddard Space Flight Center, Ocean Ecology Laboratory, Ocean Biology Processing Group. Sea-viewing Wide Field-of-view Sensor (SeaWiFS) Ocean Color Data; 2018 Reprocessing. NASA OB.DAAC, Greenbelt, MD, USA. doi: . Accessed on 05/22/2019.https://doi.org/10.5067/ORBVIEW-2/SEAWIFS/L2/ OC/2018
NASA Goddard Space Flight Center, Ocean Ecology Laboratory, Ocean Biology Processing Group. Moderate-resolution Imaging Spectroradiometer (MODIS) Aqua Ocean Color Data; 2018 Reprocessing. NASA OB.DAAC, Greenbelt, MD, USA. Accessed on 05/22/2019.https://doi.org/10.5067/AQUA/MODIS/L2/OC/2018
NASA Goddard Space Flight Center, Ocean Ecology Laboratory, Ocean Biology Processing Group. Moderate-resolution Imaging Spectroradiometer (MODIS) Terra Ocean Color Data; 2018 Reprocessing. NASA OB.DAAC, Greenbelt, MD, USA. Accessed on 05/22/2019.https://doi.org/10.5067/TERRA/MODIS/L2/OC/2018
NASA Goddard Space Flight Center, Ocean Ecology Laboratory, Ocean Biology Processing Group. Moderate-resolution Imaging Spectroradiometer (MODIS) Aqua Sea Surface Temperature Data; 2014 Reprocessing. NASA OB.DAAC, Greenbelt, MD, USA. Accessed on 05/22/2019.https://doi.org/10.5067/AQUA/MODIS/L2/SST/2014
NASA Goddard Space Flight Center, Ocean Ecology Laboratory, Ocean Biology Processing Group. Moderate-resolution Imaging Spectroradiometer (MODIS) Terra Sea Surface Temperature Data; 2014 Reprocessing. NASA OB.DAAC, Greenbelt, MD, USA. Accessed on 05/22/2019.https://doi.org/10.5067/TERRA/MODIS/L2/SST/2014
Oguz T., Ducklow H., Malanotte-Rizzoli P. et al. Simulation of annual plankton productivity cycle in the Black Sea by a one-dimensional physical-biological model // Journal of Geophysical Research: Oceans. 1996. V. 101. № C7. P. 16 585–16 599.
O'Reilly J.E. et al. SeaWiFS Postlaunch Calibration and Validation Analyses, Part 3 // NASA Tech. Memo. 2000-206892. 2000. V. 11, S.B. Hooker and E.R. Firestone, Eds., NASA Goddard Space Flight Center. 49 p.
Pakhomova S., Vinogradova E., Yakushev E. et al. Interannual variability of the Black Sea Proper oxygen and nutrients regime: the role of climatic and anthropogenic forcing // Estuarine, Coastal and Shelf Science. 2014. V. 140. P. 134–145.
Sathyendranath S., Stuart V., Nair A. et al. Carbon-to-chlorophyll ratio and growth rate of phytoplankton in the sea // Marine Ecology Progress Series. 2009. V. 383. P. 73–84.
Stelmakh L., Gorbunova T. Emiliania huxleyi blooms in the Black Sea: influence of abiotic and biotic factors // Botanica. 2018. V. 24. № 2. P. 172–184.
Suslin V.V., Churilova T.Y. A regional algorithm for separating light absorption by chlorophyll-a coloured detrital matter in the Black Sea, using 480-560 nm bands from ocean colour scanners // International Journal of Remote Sensing. 2016. V. 37. № 18. P. 4380–4400. https://doi.org/10.1080/01431161.2016.1211350
Suslin V.V., Korolev S.N., Kucheryaviy A.A. et al. Photosynthetically available radiation on surface of the Black Sea based on ocean color data // Proc. of SPIE. 2015, Vol. 9680, 96800T. 21st International Symposium on Atmospheric and Ocean Optics: Atmospheric Physics, edited by G. G. Matvienko, O. A. Romanovskii. https://doi.org/10.1117/12.2203660.
Suslin V.V., Slabakova V.K., Churilova T.Ya. Diffuse attenuation coefficient for downwelling irradiance at 490 nm and its spectral characteristics in the Black Sea upper layer: modeling, in situ measurements and ocean color data, Proc. SPIE 10466, 23rd International Symposium on Atmospheric and Ocean Optics: Atmospheric Physics, 104663H (30 November 2017). https://doi.org/10.1117/12.2287367.
Yunev O.A., Vedernikov V.I., Basturk O. et al. Long-term variations of surface chlorophyll a and primary production in the open Black Sea // Marine ecology progress series. 2002. V. 230. P. 11–28. https://doi.org/10.3354/meps230011
Дополнительные материалы отсутствуют.


