Океанология, 2022, T. 62, № 3, стр. 428-438
Гетеротрофный бактериопланктон эстуария оби в вегетационный сезон: пространственная и временнáя изменчивость
Н. Д. Романова 1, *, М. А. Болтенкова 2, А. А. Полухин 1, Е. М. Беззубова 1, С. А. Щука 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Мурманский морской биологический институт Кольского научного центра РАН
Мурманск, Россия
* E-mail: NdRomanova@gmail.com
Поступила в редакцию 12.10.2021
После доработки 06.12.2021
Принята к публикации 16.12.2021
- EDN: QQPIIW
- DOI: 10.31857/S0030157422030108
Аннотация
Анализ распределения обилия и активности бактериопланктона в эстуарной области реки Оби в июле 2016 и сентябре 2013 гг., а также факторов среды, позволяет выделить речную, солоноватоводную и морскую зоны. Летом обилие бактериопланктона варьировало от 2604 ± 436 тыс. кл/мл в солоноватых водах до 468 ± 91 тыс. кл/мл в морких. Средние величины бактериальной продукции для вод соленостью менее 8 и более 22 psu составляли 17.43 и 4.91 мгС/м3 в сутки соответственно. Осенью обилие бактерий снижалось по направлению к морю с 1289 ± 385 тыс. кл/мл в распресненных водах до 85 ± 37 тыс. кл/мл в мористой части, величина продукции снижалась более чем на порядок. Доля клеток с активной электрон-транспортной цепью в численности бактериопланктона снижалась с увеличением солености с 5.8 до 0.6% численности. Таким образом, распространение речного стока, маркируемое показателем солености, оказалось основным фактором, влияющим на пространственное распределение и активность бактериопланктона, однако механизм такой регуляции пока не ясен.
ВВЕДЕНИЕ
Речные эстуарии характеризуются активным вкладом микробного сообщества в формирование “биологической помпы” в области маргинального фильтра [6]. В Арктический бассейн ежегодно поступает около 11% мирового речного стока, тогда как его объем составляет всего 1% объема Мирового океана [25]. Среднегодовой пресноводный сток в Карское море составляет около 41% всего арктического стока (1300–1400 км3; [2, 7]), а средняя величина стока в Обскую губу составляет 500 км3/год [32]. Таким образом, процессы, происходящие в зоне смешения на границе река-море эстуария Оби влияют не только на прибрежные экосистемы, но и на весь Арктический бассейн [31].
В большинстве работ, рассматривающих вклад выносимого реками органического вещества в эстуариях арктических рек, отмечена его высокая консервативность [23, 33]. Только в период половодья доля лабильного растворенного углерода в стоке рек может возрастать до величин порядка 20–40% [27]. Таким образом, в течение большей части вегетационного сезона основным источником углерода для гетеротрофного бактериопланктона эстуарных областей шельфовых морей Арктики является органическое вещество, синтезируемое первичными продуцентами. В свою очередь, биогенные элементы по всей видимости не являются лимитирующим фактором развития гетеротрофного микропланктона на протяжении большей части года, и только в период активного таяния снега их концентрация существенно снижается [23]. Тем не менее, гидрохимические параметры могут служить маркером активности гетеротрофного сообщества [5].
В условиях ярко выраженной сезонности, продолжительной полярной ночи и ограниченного как во времени, так и в пространстве “цветения” фитопланктона, характерных для морей Сибирской Арктики, микробная петля [24] и гетеротрофный бактериопланктон в частности становятся важнейшим участником пелагического сообщества. Даже в условиях низких температур бактериопланктон играет важнейшую роль в реминерализации биогенных элементов и трансформации органического вещества [17, 29 ]. Климатические изменения и активное промышленное освоение арктического шельфа спровоцировали рост интереса к микробным ценозам арктических морей. Несмотря на это, до сих пор нет общих представлений о динамике распределения и развития микроорганизмов, а также факторах, на них влияющих [10, 13, 14, 32, 36].
В данной работе сделана попытка оценить масштабы и характер изменчивости микробных сообществ в зоне активного фронтогенеза на границе река–море [18] на примере одной из крупнейших сибирских рек – Оби, а также выявить закономерности распределения и активности микроорганизмов в области эстуария и прилежащего шельфа на основании экспедиционных результатов и литературных данных.
МАТЕРИАЛЫ И МЕТОДЫ
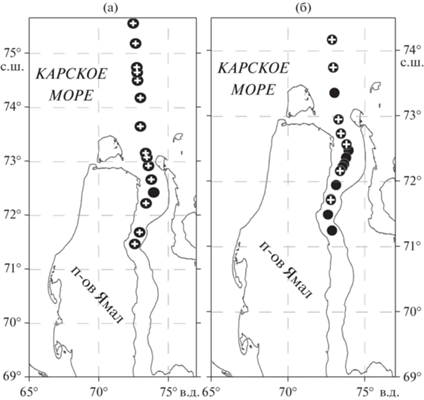
Материал был собран на разрезах от эстуария Оби до континентального шельфа в ходе 125 рейса НИС “Профессор Штокман” (4–7 сентября 2013 г.) и 66 рейса “Академик Мстислав Келдыш” (19–24 июля 2016 г.) в Карское море в рамках программы “Морские экосистемы Сибирской Арктики” (рис. 1). Пробы воды отбирали с помощью 5-литровых батометров Нискина в составе комплекса “Розетта”, оснащенного CTD-зондом (SBE 911 Plus by SeaBird Electronics, USA), с горизонтов, выбранных на основании профилей распределения температуры, солености и флуоресценции.
Рис. 1.
Карта-схема района работ в области эстуария Оби (а) летом 2016 г. и (б) осенью 2013 г. (⚫) – станции, на которых анализировали гидрохимические параметры воды, (+) – точки, на которых отбирали пробы для определения количественных параметров бактериопланктона.
Отбор проб для определения гидрохимических параметров проводился в соответствии с ГОСТ 51592–2000 “Общие требования к отбору проб”. Пробы на определение pH, биогенных элементов (силикаты, фосфаты, формы азота) и щелочности отбирали в пластиковую посуду объемом 0.5 л без фиксации. Из-за высокой концентрации взвеси в области смешения река–море пробы для определения содержания биогенных элементов предварительно фильтровали через фильтр с диаметром пор 0.45 мкм (Millero, 1995).
Содержание растворенного кислорода определяли методом Винклера [34]. Методика определения нитратного азота основана на восстановлении нитратов до нитритов и последующей колориметрии [34]. Содержание фосфатов определяли по методу Морфи и Райли [34]. Аммонийный азот определяли по [40].
Для учета общей численности бактерий и расчета биомассы бактериопланктона пробы воды фиксировали непосредственно после отбора нейтральным раствором формальдегида (конечная концентрация в пробе 1%) и хранили до последующей обработки. Осенью 2013 г. концентрацию бактериопланктона определяли окрашивая пробы флуорохромом DAPI на черных ядерных фильтрах (0.2 мкм, Трекпор Технолоджи) и анализируя под люминесцентным микроскопом [35]. Обработку фиксированных проб проводили не ранее трех месяцев после отбора [41]. Летом 2016 г. численность бактериопланктона определяли с помощью проточной цитометрии. Фиксированные пробы окрашивали флуоресцентным красителем SYBR GREEN I в течение 30 минут и просматривали на цитометре BD Accuri C6 в течение суток после отбора [28]. Для более точной оценки численности бактериопланктона одновременно просчитывали фильтрат, прошедший через фильтр с диаметром пор 0.2 мкм. На ряде станций пробы для цитометрического анализа также просматривали с помощью люминесцентной микроскопии. На основании результатов цитометрии рассчитывали соотношение клеток с высоким и низким содержанием нуклеиновых кислот – показатель, предположительно отражающий долю активных клеток [30]. Так как использованные методы учета численности микроорганизмов не позволяют различать архей и бактерий, в настоящей статье, используя термин бактерии, мы подразумеваем всех гетеротрофных прокариот.
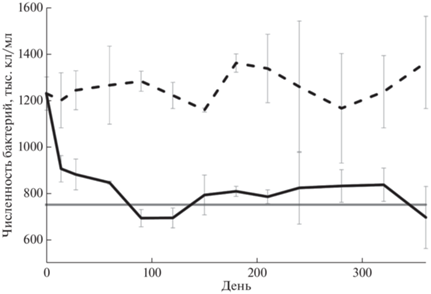
В связи с разницей времени, предшествовавшего обработке проб 2013 и 2016 гг нами дополнительно был поставлен эксперимент для оценки влияния хранения фиксированных проб на изменение концентрации бактерий в них. Существует несколько работ, свидетельствующих о снижении численности бактериальных клеток в пробах морской воды при хранении [26]. При этом время хранения не влияло на количество клеток с видимым нуклеоидом: величина обилия снижалась в течение 40–70 дней после фиксации, после чего выходила на плато, совпадая со значением числа клеток с видимым нуклеоидом [41]. На протяжении года мы сравнивали изменение обилия клеток в жидких фиксированных пробах и на отфильтрованных непосредственно после отбора и замороженных препаратах. Полученные данные сопоставлялись с величиной жизнеспособных клеток (с видимым нуклеоидом), определенной непосредственно после отбора. Все измерения проводились в трех повторностях.
Линейные размеры клеток измеряли с помощью программы анализа изображений “ImageScopeColor М”. Бактериальную биомассу в углеродных единицах вычисляли по [12].
Определение бактериальной продукции и выедания бактериопланктона потребителями проводили прямым методом с использованием антибиотиков-ингибиторов бактериального роста [37] в модификации для естественных местообитаний [42]. Непосредственно после отбора пробы воды разливали в 100-мл флаконы. Для учета выедания бактериопланктона нано- и микрофагами в пробы воды добавляли антибиотики (бензилпенициллин 1 мг/л, ванкомицин 200 мг/л), подавляющие размножение бактерий, но не оказывающие влияние на их потребителей [37]. В качестве контроля экспонировали пробы без антибиотиков. Подготовленные таким образом пробы экспонировали 8–10 ч в бассейне с морской водой, расположенном на верхней палубе судна. Время экспозиции было выбрано на основании предварительно поставленного эксперимента по динамике действия антибиотиков в полярных водах. Все эксперименты были выполнены в двух повторностях. Манипуляции, связанные с постановкой экспериментов, проводили на открытой палубе судна при температуре окружающей среды.
Долю клеток с активной электрон-транспортной цепью определяли экспериментально, экспонируя пробы с флуорохромом СТС (5-циано 2,3-дитолил тетразолиум хлорида) [38]. В каждую аликвоту морской воды объемом 5.4 мл вносили раствор флуорохрома СТС в дистиллированной воде в финальной концентрации 100 мкг/мл. Пробы экспонировали в течении 4 часов при температуре 4 °С, после чего фиксировали 37% формалином (финальная концентрация 1%), окрашивали флуорохромом DAPI и концентрировали на черный ядерный фильтр с диаметром пор 0.2 мкм (Трекпор Технолоджи). Препараты просматривали под микроскопом Leiсa DM 2500 при увеличении ×1000 на длине волны 450–490 нм для учета СТС-окрашенных клеток и в ультрафиолетовом излучении для подсчета общей численности бактерий, окрашенных DAPI.
Для выявления корреляций между показателями характеристик сообществ рассчитывали коэффициент ранговой корреляции Спирмена. Расчеты проводили с помощью пакета программ PAST 3.14.
РЕЗУЛЬТАТЫ
Эксперимент по оценке влияния хранения проб на изменение численности бактерий в них подтвердил выводы [41], что в течение года число бактериальных клеток в жидких фиксированных пробах снижается лишь в первые три месяца до значений обилия бактерий с видимым нуклеоидом, тогда как в сконцентрированных на фильтр пробах численность достоверно не изменяется в течение всего периода наблюдений (рис. 2).
Рис. 2.
Результаты эксперимента по длительному хранению проб. Динамика изменения числа клеток бактерий в (¦) пробах, сконцентрированных на фильтр; (|) пробах, хранившихся в жидком виде. Серой линией отмечено число клеток с видимым нуклеоидом.
Июль 2016 г. Работы 2016 г. пришлись на время высоких величин стока р. Оби вскоре после схода сезонного ледового покрытия [39]. В отличие от наблюдений предыдущих лет [13], воздействие речного стока на свойства поверхностного слоя Карского моря было ограничено южной, примыкающей к эстуариям, областью бассейна [20]. Эстуарная область Оби и прилежащий мелководный шельф характеризовались высоким уровнем горизонтальной неравномерности, прежде всего в распределении солености (рис. 3а). Локальные увеличения градиентов гидрофизических параметров имели масштаб 10–50 км и формировали ярко выраженную фронтальную зону в области взаимодействия речных и морских вод [20].
Рис. 3.
Разрез вдоль эстуария Оби (июль 2016). (а) Соленость, psu: (б) концентрация неорганического фосфора, µМ; (в) обилие бактерий, тыс.кл/мл; (г) концентрация аммонийного азота, µМ; (д) насыщение кислородом, %; (е) концентрация нитратов, µМ.

В период наших наблюдений разрез вдоль эстуария Оби представлял собой пример так называемого “сложного фронта” [7], состоящего из вертикального фронта в южной части разреза (станции № 5323 и 5324) и горизонтального фронта, протягивающегося от станции № 5319 в сторону открытого моря. Присутствие вод губы прослеживается в поверхностных водах практически на всем протяжении разреза.
Относительное содержание растворенного кислорода было достаточно высоким (рис. 3д). В поверхностных водах, несмотря на относительно высокую температуру (11–12°С и более), содержание растворенного кислорода достигало почти 9 мл/л. Насыщение воды кислородом доходило до 129% и нигде не опускалось ниже 80%. Наибольшее содержание растворенного кислорода и степень насыщения вод кислородом были отмечены у поверхности на станциях № 5320 и 5321, где положение фронта менялось с вертикального на горизонтальное. Наиболее высокое содержание фосфатов (рис. 3б) и нитратного азота (рис. 3е) наблюдалось на поверхности самой южной станции разреза (№ 5324). По мере продвижения на север их содержание быстро убывало. Севернее станции 5313 содержание растворенного неорганического фосфора в поверхностном слое воды могло опускаться до 0.02 µМ, а содержание нитратного азота – до аналитического нуля. Стоит также отметить необычно низкое содержание аммонийного азота на разрезе: от 0.04 до 0.52 µМ (рис. 3г). Содержание нитритного азота, напротив, достигало 0.8 µМ, в некоторых случаях его концентрация даже превышала содержание азота в нитратной и аммонийной формах. Типичный для работ предыдущих лет [1] придонный максимум фосфатов и нитратного азота не был обнаружен.
Обилие бактериопланктона на разрезе вдоль эстуария Оби изменялось от 98 до 4500 тыс.кл/мл (рис. 3в). В водах соленостью от 0.15 до 17 psu численность бактерий колебалась в пределах от 500 до 4467 тыс.кл/мл, составляя в среднем 2604 ± ± 436 тыс. кл/мл. При значениях солености более 22 psu этот показатель составлял в среднем 468 ± ± 91 тыс. кл/мл, изменяясь в пределах от 98 до 1263 тыс. кл/мл.
Доля клеток с высоким содержанием нуклеиновых кислот варьировала от 11 до 87%. В южной части разреза (вплоть до станции 5317) доля клеток с высоким содержанием нуклеиновых кислот не превышала 65%, составляя в среднем 44 ± 6%, тогда как севернее величины этого показателя варьировали от 48 до 81%, составляя в среднем 54 ± ± 6% в поверхностном слое воды и 76 ± 3% ниже пикноклина.
Величина бактериальной биомассы изменялась от 1.4 до 53.65 мгС/м3. В водах соленостью менее 17 psu среднее значение этого показателя составляло 28.7 ± 8.62 мгС/м3, тогда как при солености более 22 psu средняя величина биомассы бактериопланктона снижалась до 6.19 ± 1.06 мгС/м3.
Максимальная величина бактериальной продукции наблюдались в поверхностном горизонте станции 5313, где на фоне высоких показателей биомассы и удельной скорости роста (2.81 сут–1) ее значение достигало 150.73 мгС/м3 в сутки. В остальных точках величина продукции варьировала от 0.18 до 26.3 мгС/м3 в сутки, а удельная скорость роста от 0.05 до 3.29 сут–1. Средние величины бактериальной продукции для вод соленостью менее 8 и более 22 psu составляли 17.43 и 4.91 мгС/м3 в сутки соответственно, однако большой разброс значений не позволяет говорить о достоверности этих различий. Значения удельной продукции, усредненные для столба воды, напротив, возрастали по направлению к морю с 0.8 до 1.52 сут–1.
Сентябрь 2013 г. В первых числах сентября 2013 г. градиент солености на границе эстуария Оби и прилежащего шельфа Карского моря был относительно мал, поверхностная соленость в эстуарной фронтальной зоне возрастала от 0.1–0.2 psu до 9–10 psu (рис. 4а) [19]. Как и летом 2016 г. на разрезе наблюдались как вертикальный, так и горизонтальный фронты. Вертикальный фронт был расположен в районе станций 125-14 и 125-17, и выделялся достаточно резким скачком солености от пресной воды до 1 psu.
Рис. 4.
Разрез вдоль эстуария Оби (сентябрь 2013). (а) соленость, psu; (б) концентрация неорганического фосфора, µМ; (в) обилие бактерий, тыс. кл/мл; (г) концентрация аммонийного азота, µМ; (д) насыщение кислородом, %; (е) концентрация нитратов, µМ.

Максимальные величины концентрации растворенного кислорода были приурочены к вертикальной фронтальной зоне (рис. 4д). Его содержание на поверхности достигало 8.9 мл/л. Степень насыщения кислородом в этой точке составляла 105–110% в слое до 5 м. Минимальное содержание кислорода (менее 70%) было отмечено в холодном придонном слое на 73° северной широты (станция 125-24), а также глубже пикноклина в области обского бара (станция 125-17). В этих точках также наблюдались относительно высокие концентрации фосфатов (1.53–2.05 µМ), нитратного и аммонийного азота (2.82–3.44 µМ и 2.8–4.1 µМ соответственно).
Распределение концентрации биогенных элементов было достаточно консервативно. Максимумы концентрации фосфатов (рис. 4б) и нитратного азота (рис. 4е) соотносились с орографическими особенностями Обского разреза. Максимум концентрации нитритов в поверхностном слое (1.06 µМ, станция 125-16) был приурочен к речным водам. По мере приближения к фронтальной зоне (станция 125-17), их содержание уменьшалось до аналитического нуля. Второй, придонный, максимум (1.14 µМ) на станции 125-26 был приурочен к выделенной по показателю рН северной границе фронтальной зоны. В тех же точках поверхностного и придонного слоя были отмечены и максимумы концентрации аммонийного азота (4.32 и 3.46 µМ соответственно, рис. 4г).
В сентябре 2013 года обилие бактерий в области эстуария Оби варьировало от 29 до 1875 тыс. кл/мл (рис. 4в). Максимальные величины (994–1875 тыс.кл/мл) наблюдались в верхнем перемешанном слое в южной части разреза; минимальные (29–218 тыс. кл/мл) – в мористой части разреза в придонном слое холодной соленой воды. Распределение численности бактериопланктона согласовывалось с изменением солености: обилие бактерий при солености менее 2.5 psu в среднем составляло 1289 ± 385 тыс. кл/мл, в распресненных водах соленостью 3.5–22 psu этот показатель снижался до 652 ± 123 тыс. кл/мл, тогда как в водах соленостью выше 29 psu общая численность бактерий не превышала 218 тыс. кл/мл, в среднем составляя 85 ± 37 тыс.кл/мл. Распределение биомассы бактериопланктона на разрезе вдоль эстуария Оби имело сходную картину распределения, при этом различия между средними величинами этого показателя в водах разной солености были выражены еще ярче: при солености менее 2.5 psu средняя биомасса бактериопланктона составляла 22.7 ± 8.5мгС/м3, в распресненных водах соленостью 3.5–22 psu этот показатель снижался до 9.9 ± ± 2.5 мгС/м3, при солености выше 29 psu средняя величина биомассы снижалась до 1.2 ± 1 мгС/м3. В придонном слое воды на крайней северной станции разреза были отмечены высокие показатели биомассы бактериопланктона на фоне относительно низких значений его численности (7 мгС/м3 и 172 тыс. кл/мл соответственно). Высокий показатель биомассы вероятнее всего обусловлен значительной долей крупных палочковидных форм (38% общей численности), тогда как на остальных станциях их вклад не превышал 25%, большая часть клеток была представлена коккоидными формами.
Доля клеток бактериопланктона с активной ЭТЦ осенью 2013 г. также снижалась с увеличением солености: в водах соленостью менее 2.5 psu этот показатель составлял 5.8 ± 0.27%, в распресненных водах – 2.6 ± 0.5%, при значениях солености более 29 psu доля активно дышащих бактерий снижалась до 0.6 ± 0.4%.
ОБСУЖДЕНИЕ
Июль 2016 г. Отмеченные нами высокие величины относительного содержания кислорода в поверхностных водах не наблюдались при предыдущих съемках в Обской губе в июле–августе 2010 г. [1, 15]. Возможно это свидетельство активного развития фитопланктона [16], что косвенно подтверждается крайне низкими концентрациями фосфатов и нитратного азота на выходе из губы. По всей видимости, доступные формы биогенных элементов потреблялись фитопланктоном в водах с диапазоном солености от 1 до 10 psu. Низкие величины концентрации аммонийного азота и, напротив, высокий вклад нитритного азота в содержание растворенного неорганического азота может свидетельствовать о “молодости” и незавершенности процессов окисления органического вещества.
Анализируя данные по распределению обилия и активности бактериопланктона исходя из условно выделенных интервалов солености важно учитывать, что воды разной солености в эстуарной области могут быть приурочены к различным глубинам. Тем не менее, в солоноватых водах (3.5–22 psu), находившихся на разных станциях разреза как в верхнем фотическом, так и в придонном слоях, величины обилия бактериопланктона имели близкие значения, и связи этого параметра с глубиной не наблюдалось (r = 0.2, p > 0.5).
В июле 2016 в водах соленостью менее 17 psu значимых корреляций между распределением обилия бактериопланктона и рассматриваемыми параметрами среды обнаружено не было. Изменение состава и количественных характеристик фитопланктонного сообщества на градиенте река-море никак не отразилось на обилии бактериопланктона [16]. Значения численности бактерий, превышающие 1 млн кл/мл, наблюдались в эвфотическом слое при колебании концентрации хлорофилла “а” от 0.46 до 33 мкг/л, а значения ниже 600 тыс. кл/мл были отмечены на фоне изменения концентрации пигмента в пределах 0.04–27.3 мкг/л [22].
Ниже пикноклина на глубинах вплоть до 30 м (где проводились измерения концентрации растворенного кислорода) была отмечена отрицательная корреляция обилия бактериопланктона и насыщения воды кислородом (r = –0.64, p < 0.05). При этом средняя величина численности бактериопланктона при содержании кислорода менее 95% составляла 614 ± 128 тыс. кл/мл, тогда как при его концентрации более 98% среднее значение обилия бактерий снижалось до 303 ± 98 тыс. кл/мл. Этот факт позволяет предположить активное участие бактериопланктона в реминерализации органического вещества. На преобразование органического вещества автохтонного происхождения в растворенную форму на придонных горизонтах мористой части разреза указывали также изменения концентрации растворенного органического углерода и возрастание в его составе доли коллоидной формы [20]. Также, в мористой части разреза высокие показатели удельной продукции бактериопланктона (более 1 сут–1) были приурочены к областям повышенной концентрации коллоидного органического вещества. Максимальный вклад клеток с высоким содержанием нуклеиновых кислот, напротив, был приурочен к более богатым кислородом слоям воды (r = 0.74, p < 0.05) составляя в среднем 76 ± 6% против 54 ± 11% в водах с величиной насыщения кислородом менее 95%. Также была отмечена отрицательная корреляция между долей клеток с высоким содержанием нуклеиновых кислот и суммарной концентрацией растворенного неорганического азота (r = –0.77, p < 0.05).
Величина бактериальной продукции слабо коррелировала с численностью клеток с высоким содержанием нуклеиновых кислот (r = 0.45, p < < 0.05), а также с концентрацией хлорофилла “а” (r = 0.42, p < 0.05).
Сентябрь 2013 г. Максимум растворенного кислорода, приуроченный к вертикальному фронту на границе перехода от пресной воды к солености 1 psu свидетельствовал о повышенной активности первичных продуцентов. Концентрация биогенных элементов была достаточно консервативна и, по всей видимости, не служила лимитирующим фактором развития планктона. В то же время, снижение содержания нитритов в поверхностном слое по направлению к фронтальной зоне может свидетельствовать об активном их использовании. Также придонный максимум нитритов может свидетельствовать о незавершенном процессе окисления органического вещества.
Картина распределения обилия бактериопланктона сходна с изменчивостью концентрации хлорофилла “а” (r = 0.88, p < 0.05), также численность бактерий снижается с ростом доли феофитина (r = –0.83, p < 0.05) [3]. Однако заключить, влияет ли на распределение бактерий концентрация первичных продуцентов, или оба параметра регулируются одними факторами среды, на основании имеющихся данных не представляется возможным. Стоит отметить, что в то время как максимальные величины обилия бактериопланктона в поверхностном слое были отмечены при величинах солености менее 2.5 psu, область наиболее высоких концентраций фитопланктона совпадала с участком эстуарной фронтальной зоны, где соленость воды над пикноклином увеличивалась от 2.5 до 7 psu. С увеличением солености до 9.5 psu происходило резкое – на порядок – снижение обилия фитопланктона [16], тогда как обилие и продукция бактериопланктона в слое воды над пикноклином уменьшались всего в два раза.
В сравнении с данными наблюдений осени 2011 г. в области эстуария р. Енисея [9], доля клеток с активной ЭТЦ осенью 2013 г. в эстуарии Оби была на порядок ниже. К тому же, в 2011 г. было отмечено увеличение доли активно дышащих клеток в мористой части разреза по сравнению с речной, тогда как в период наших наблюдений ситуация была обратной. Тем не менее в области эстуария Оби увеличение доли клеток с высоким содержанием нуклеиновых кислот по направлению к морю было отмечено в июле 2016 г. Таким образом, можно заключить, что нет единой картины изменения распределения активных клеток бактериопланктона в эстуарной области.
Величины продукции бактериопланктона в ходе наших работ осенью 2013 г., как и показатели обилия, изменялись более чем на порядок с увеличением солености [4]. При значениях солености менее 2.5 psu средняя величина продукции бактерий была 26.8 ± 4.2 мгС/м3 в сутки, в распресненных водах (3.5–22 psu) этот показатель составлял в среднем 10 ± 4 мгС/м3 в сутки, а в водах с соленостью выше 29 psu суточная продукция бактерий не превышала 5 мгС/м3 в сутки, в среднем составляя 2.1 ± 0.9 мгС/м3 в сутки. Несмотря на это, значения удельной продукции были выше при солености более 29 psu, составляя в среднем 1.9 ± 0.5 сут–1, тогда как в более распресненных водах ее среднее значение было ниже: 1.1 ± ± 0.4 сут–1 [4]. В слое воды под пикноклином значения продукции снижались с уменьшением концентрации растворенного кислорода (r = 0.82, p < 0.05), что возможно свидетельствует об активном участии бактериопланктона в разложении органического вещества.
Количество вирусных частиц на разрезе вдоль эстуария Оби [4] существенно снижалось в слое воды под пикноклином, составляя в среднем 1794 ± 448 тыс. част/мл (изменяясь в пределах от 915 до 2917 тыс. част./мл) над градиентом солености, и снижаясь до 453 ± 153 тыс. част./мл (от 214 до 876 тыс. част./мл) глубже. Максимальные величины зараженных фагами бактериальных клеток приходились на верхний десятиметровый слой (12 ± 6% общей численности бактериопланктона), с глубиной этот показатель существенно снижался (3.5 ± 0.6%). В слое воды ниже пикноклина величина удельной скорости роста бактериопланктона снижалась при увеличении количества вирусных частиц (r = –0.66, p < 0.05), что позволяет предположить участие вирусного лизиса в регулировании скорости роста бактерий [4].
Таким образом, несмотря на наличие корреляций между распределением бактериопланктона и прочими биотическими и абиотическими параметрами среды, основным фактором, оказывающим влияние на распределение бактериопланктона в эстуарной области, является распространение речного стока, маркируемое в первую очередь изменением солености. Какие именно механизмы определяют это влияние, на основании имеющихся данных выявить не удалось.
Межгодовая изменчивость
Обобщая опубликованные на настоящее время данные по распределению бактериопланктона в области эстуария Оби в летне-осенний период [8, 11, 13, 32] уверенно можно говорить только о снижении обилия бактерий в направлении моря (рис. 5). Межгодовые колебания численности бактерий не объяснялись ни изменениями температуры, ни особенностями стока в рассмотренные годы [21, 39]. Осенью 1993 г. значения численности бактериопланктона в области эстуария Оби были относительно низкими, составляя 206 тыс. кл./мл в речной зоне и 173 тыс. кл./мл в области шельфа [8]. В конце лета 2001 г. в области эстуария Оби обилие бактериопланктона в водах поверхностного слоя составляло в среднем 1.4 млн. кл/мл в пресной (<1 psu), 2.1 млн. кл/мл в распресненной (5–15 psu) и менее 0.5 млн. кл/мл, в морской (>20 psu) зонах [32]. Средние величины бактериальной продукции также снижались в направлении моря, составляя в среднем 7.14, 5.06 и 3.21 мгС/м3 в сутки для пресноводной, распресненной и морской зон соответственно. Для всех зон отмечалось лимитирование бактериопланктона по доступному источнику углерода [32]. Осенью 2007 г. в области эстуария Оби численность бактериопланктона в пробах, хранившихся более чем три месяца (потенциально жизнеспособные клетки), в слое над пикноклином составляла 505 ± ± 197 тыс. кл/мл в “речной” части разреза (соленость менее 5 psu) и 723 ± 146 тыс. кл/мл в мористой части эстуария [13]. В слое воды под пикноклином общая численность бактериопланктона заметно снижалась, до 376 ± 64 тыс. кл/мл. Величина удельной продукции бактерий в слое над пикноклином составляла 0.54 сут–1 в “речных” водах против 0.18 сут–1 в мористой части эстуарной зоны. В слое вод по пикноклином показатели удельной продукции бактерий стремились к нулю, незначительно возрастая до 0.06 сут–1 в слое придонной воды [13]. Летом 2010 г. показатели обилия бактериопланктона в речных и морских водах различались не сильно, составляя 1400 ± ± 440 и 1200 ± 864 тыс. кл/мл соответственно [11]. Осенью того же года наблюдалась сходная картина: значения численности бактериопланктона в “речной” зоне оставались прежними, тогда как в морской части было отмечено незначительное ее снижение до 1000 ± 81 тыс. кл/мл [11].
Рис. 5.
Изменение общей численности бактерий (среднее значение для всех станций) поверхностного слоя в речной и морской зонах эстуарной области р. Обь в летний (а) и осенний (б) периоды.
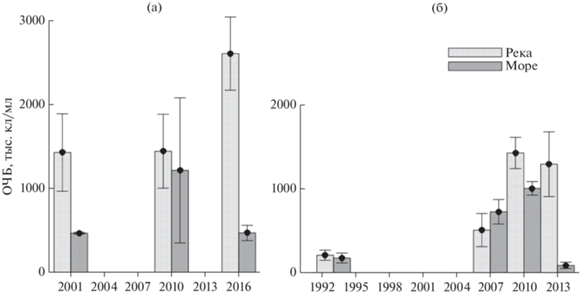
На основании вышеприведенных данных можно заключить, что в эстуарной области реки Обь основным фактором, определяющим распределение и активность бактериопланктона, является распространение речного стока, маркируемое в первую очередь соленостью. При этом, какой именно механизм играет ключевую роль в регуляции этих параметров, на имеющимся материале выявить не удалось. Учитывая дискретность изменений характеристик бактериопланктона, позволяющую условно выделить речную, распресненную и морскую области, можно предположить влияние геохимических процессов, происходящих на определенных градиентах солености.
ЗАКЛЮЧЕНИЕ
Основываясь на анализе литературных данных и собственных результатов следует отметить, что в большинстве случаев в эстуарной области р. Оби распределение количественных и продукционных характеристик бактериопланктона определяется в первую очередь распространением речного стока, которое оценивается на основании солености. При этом в период наших наблюдений границы смены гидрохимичесих характеристик среды, обилия и состава разных компонентов планктонного сообщества не совпадали между собой. Сравнение данных, полученных в середине и конце вегетационного сезона, указывает на более высокие количественные показатели бактериопланктона в летний период, тем не менее в оба сезона наблюдается сходная картина распределения обилия бактериопланктона на градиенте река–море. В зоне эстуария Оби практически всегда можно выделить существенно различающиеся по рассматриваемым параметрам области распресненных и морских вод, между которыми характеристики бактериопланктона в большинстве случаев меняются дискретно. Однако, если обилие бактерий в большинстве случаев снижается по направлению к морю, то показатели его активности не столь консервативны. Летом доля клеток с высоким содержанием нуклеиновых кислот, равно как и величина удельной продукции увеличивалась по направлению к морю, тогда как в осенний период для доли бактерий с активной ЭТЦ наблюдалась обратная картина. Связь с иными факторами среды была выражена гораздо менее ярко. По всей видимости, поиск факторов, регулирующих взаимодействия в микропланктонном сообществе, требует поиска и анализа дополнительных характеристик среды, включая геохимические процессы на границе река–море.
Источники финансирования. Работа выполнена в рамках Госзадания № 0128-2021-0007 при финансовой поддержке гранта РНФ 17-77-10 138 (обработка проб бактериопланктона); гранта РНФ 19-17-00196 (анализ гидрохимических параметров).
Список литературы
Артамонова К.В., Лапин С.А., Лукьянова О.Н. и др. Особенности гидрохимического режима Обской губы в период открытой воды // Океанология. 2013. Т. 53. № 3. С. 357–366. https://doi.org/10.7868/S0030157413030027
Добровольский А.Д., Залогин Б.С. Моря СССР. М.: Изд-во МГУ, 1982. 192 с.
Дриц А.В., Никишина А.Б., Семенова Т.Н. и др. Пространственное распределение и питание массовых видов зоопланктона в эстуарии реки Обь // Океанология. 2016. Т. 56. № 3. С. 414–428. https://doi.org/10.7868/S0030157416030047
Копылов А.И., Сажин А.Ф., Заботкина Е.А. и др. Вирио-и бактериопланктон в эстуарной зоне реки Обь и прилегающих районах шельфа Карского моря //Океанология. 2017. Т. 57. № 1. С. 118–127. https://doi.org/10.7868/S0030157417010051
Лапин С.А. Пространственно-временнáя изменчивость гидролого-гидрохимических характеристик Обской губы как основа оценки ее биопродуктивности: дис. … канд. географических наук: 25.00.27 М., 2012. 128 с.
Лисицын А.П. Маргинальный фильтр океанов // Океанология. 1994. Т. 34. № 5. С. 735–747
Михайлов В.Н. Устья рек России и сопредельных стран: прошлое, настоящее и будущее. М.: ГЕОС, 1997. 413 с.
Мицкевич И.Н., Намсараев Б.Б. Численность и распределение бактериопланктона в Карском море в сентябре 1993 г. // Океанология. 1994. Т. 34. № 5. С. 704–708.
Мошарова И.В., Ильинский В.В., Мошаров С.А. Состояние гетеротрофного бактериопланктона эстуария реки Енисей и зоны Обь-Енисейского речного выноса в осенний период в связи с факторами окружающей среды // Водные ресурсы. 2016. Т. 43. № 2. С. 202–215. https://doi.org/10.7868/S0321059616020097
Павлова М.А., Макаревич П.Р., Широколобова Т.И. Сообщества бактерий и вирусов в водах Обской и Тазовской губ // Доклады Академии наук. 2016. Т. 471. № 4. С. 503–507. https://doi.org/10.7868/S0869565216340284
Романова Н. Д. Структурно-функциональные характеристики бактериопланктона Карского моря: Дис. … канд. биологических наук: 03.02.10. М., 2012. 125 с.
Романова Н.Д., Сажин А.Ф. Взаимосвязь между объемом бактериальных клеток и содержанием в них углерода // Океанология. 2010. Т. 50. № 4. С. 556−565.
Романова Н.Д., Сажин А.Ф. Бактериопланктон шельфовой части Карского моря // Океанология. 2015. Т. 55. № 6. С. 949–954. https://doi.org/10.7868/S0030157415060179
Саввичев А.С., Захарова Е.Е., Веслополова Е.Ф. и др. Микробные процессы циклов углерода и серы в Карском море // Океанология. 2010. Т. 50. № 6. С. 942–957.
Стунжас П. А., Маккавеев П. Н. Объем вод Обской губы как фактор формирования гидрохимической неоднородности // Океанология. 2014. Т. 54. № 5. С. 622–622. https://doi.org/10.7868/S0030157414050128
Суханова И.Н., Флинт М.В., Сахарова Е.Г. и др. Фитоценозы Обского эстуария и Карского шельфа в поздневесенний сезон // Океанология. 2018. Т. 58. № 6. С. 882–898. https://doi.org/10.1134/S003015741806014X
Теплинская Н.Г. Бактериальная трансформация соединений азота, углерода, серы и фосфора в субантарктических донных отложениях // Экологическая безопасность прибрежной и шельфовой зон. 2007. Т. 15. С. 581–589.
Флинт М. В. Зацепин А.Г., Кучерук Н.В. и др. Комплексные исследования экосистемы Карского моря (54-й рейс научно-исследовательского судна “Академик Мстислав Келдыш”) // Океанология. 2008. Т. 48. №. 6. С. 947–951.
Флинт М.В. Отчет по морским экспедиционным работам НИС “Профессор Штокман”, 125 Научный Рейс. М.: ИО РАН, 2013. 38 с.
Флинт М.В., Анисимов И.М., Арашкевич Е.Г. и др. Экосистемы Карского моря и моря Лаптевых: экспедиционные исследования 2016 и 2018 гг. Институт океанологии им. П.П. Ширшова РАН. М.: Ерхова И.М., 2021. 368 с.
Alekseev G.V., Glok N.I., Vyazilova, A.E., Kharlanenkova N.E. 2020. Climate change in the Arctic: causes and mechanisms // IOP Conference Series: Earth and Environmental Science. V. 606. № 1. P. 012002. https://doi.org/10.1088/1755-1315/606/1/012002
Demidov A.B., Gagarin V.I., Vorobieva O.V. et al. Spatial and Vertical Variability of Primary Production in the Kara Sea in July and August 2016: The Influence of the River Plume and Subsurface Chlorophyll Maxima // Polar Biology 2018. V. 41. № 3. P. 563–578. https://doi.org/10.1007/s00300-017-2217-x
Dittmar T., Kattner G. The Biogeochemistry of the River and Shelf Ecosystem of the Arctic Ocean: A Review // Marine Chemistry. 2003. V. 83. № 3. P. 103–20. https://doi.org/10.1016/S0304-4203(03)00105-1
Fenchel T. The Microbial Loop – 25 Years Later // J. of Experimental Marine Biology and Ecology. 2008. V. 366. № 1. P. 99–103. https://doi.org/10.1016/j.jembe.2008.07.013
Gordeev V.V. River input of water, sediment, major ions, nutrients and trace metals from Russian territory to the Arctic Ocean //The freshwater budget of the Arctic Ocean. Dordrecht: Springer, 2000. P. 297–322.
Gundersen K., Bratbak G., Heldal M. Factors influencing the loss of bacteria in preserved seawater samples // Marine ecology progress series. 1996. V. 137. P. 305–310. https://doi.org/10.3354/meps137305
Holmes R.M., McClelland J.W., Raymond P.A. et al. Lability of DOC transported by Alaskan rivers to the Arctic Ocean // Geophysical Research Letters. 2008. V. 35. № 3. 5 p. https://doi.org/10.1029/2007GL032837
Kamiya E., Izumiyama S., Nishimura M. et al. Effects of fixation and storage on flow cytometric analysis of marine bacteria // J. Oceanology. 2007. V. 63. P. 101–112. https://doi.org/10.1007/s10872-007-0008-7
Kirchman D.L., Malmstrom R.R., Cottrell M.T. Control of bacterial growth by temperature and organic matter in the Western Arctic // Deep-Sea Res. Part II: Topical Studies in Oceanography. 2005. V. 52. № 24. P. 3386–95. https://doi.org/10.1016/j.dsr2.2005.09.005
Lebaron P., Servais P., Baudoux A.C. et al. Variations of bacterial-specific activity with cell size and nucleic acid content assessed by flow cytometry //Aquatic Microbial Ecology. 2002. V. 28. №. 2. P. 131–140. https://doi.org/10.3354/ame028131
McClelland J.W., Holmes R.M., Dunton K.H., Macdonald R.W. The Arctic Ocean Estuary // Estuaries and Coasts. 2011. V. 35. P. 353–368. https://doi.org/10.1007/s12237-010-9357-3
Meon B., Amon R.M.W. Heterotrophic bacterial activity and fluxes of dissolved free amino acids and glucose in the Arctic rivers Ob, Yenisei and the adjacent Kara Sea // Aquatic Microbial Ecology. 2004. V. 37. P. 121–135. https://doi.org/10.3354/ame037121
Osadchiev A.A., Izhitskiy A.S., Zavialov P.O. et al. Structure of the buoyant plume formed by Ob and Yenisei river discharge in the southern part of the Kara Sea during summer and autumn //Journal of Geophysical Research: Oceans. 2017. V. 122. №. 7. P. 5916–5935. https://doi.org/10.1002/2016JC012603
Parsons T.R. A Manual of Chemical & Biological Methods for Seawater Analysis. Elsevier: 2013. 173 p.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting aquatic microflora // Limnology and oceanography. 1980. V. 25. № 5. P. 943–948. https://doi.org/10.4319/lo.1980.25.5.0943
Saliot A., Cauwet G., Cahet G. et al. Microbial activities in the Lena River delta and Laptev Sea // Mar. Chem. 1996. V. 53. P. 247–254. https://doi.org/10.1016/0304-4203(96)00035-7
Sherr B.F., Sherr E.B., Andrew T.L. et al. Trophic interactions between heterotrophic protozoa and bacterioplankton in estuarine water analyzed with selective metabolic inhibitors. // Marine Ecology Progress Series. 1986. V. 32. P. 169–179.
Sherr B., Sherr E., del Giorgio P. Enumeration of Total and Highly Active Bacteria // Methods in Microbiology. 2001. V. 30. P. 129–160. https://doi.org/10.1016/S0580-9517(01)30043-0
Shiklomanov A.I., Holmes R.M., McClelland J.W., Tank S.E., Spencer R.G.M. 2021. Arctic Great Rivers Observatory. Discharge Dataset, Version 20210527. https://www.arcticrivers.org/data
Solorzano L. Determination of ammonia in natural waters by the phenolhypochlorite method // Limnology and oceanography. 1969. V. 14. № 5. P. 799–801. https://doi.org/10.4319/lo.1969.14.5.0799
Vosjan J.H., van Noort G.J. Enumerating nucleoid-visible marine bacterioplankton: bacterial abundance determined after storage of formalin fixed samples agrees with isopropanol rinsing method // Aquatic microbial ecology. 1998. V. 14. № 2. P. 149–154. https://doi.org/10.3354/ame014149
Weisse T. The microbial loop in the Red Sea: Dynamics of pelagic bacteria and heterotrophic nanoflagellates // Marine Ecology Progress Series. 1989. V. 55. P. 241–250.
Дополнительные материалы отсутствуют.


