Океанология, 2022, T. 62, № 4, стр. 598-610
Черноморский ихтиопланктон в период массового нереста теплолюбивых рыб
Т. Н. Климова 1, А. А. Субботин 1, П. С. Подрезова 1, *, С. В. Куршаков 1
1 Институт биологии южных морей имени А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: podrezova@ibss-ras.ru
Поступила в редакцию 23.11.2021
После доработки 11.02.2022
Принята к публикации 25.02.2022
- EDN: BKJGZE
- DOI: 10.31857/S0030157422040050
Аннотация
Представлены видовая структура и пространственное распределение ихтиопланктона в июле–августе 2019 г. в период массового нереста теплолюбивых видов рыб. Материал собран на шельфе и в глубоководных районах Черного моря у Крымского полуострова и берегов Кавказа. В ихтиопланктоне идентифицированы 29 видов икры и личинок рыб из 19 семейств. Показатели индекса видового богатства в открытых водах и в прибрежной акватории моря были сопоставимы. В ихтиопланктоне доминировала Engraulis encrasicolus (Linnaeus, 1758), максимальная численность ее икры достигала 260 экз/м2, а личинок 117 экз/м2. Наибольшая эффективность нереста E. encrasicolus наблюдалась в прогретых до 26–27°С водах прибрежной водной массы у Кавказского побережья и на западном шельфе Крымского полуострова, где отношение численности личинок к количеству икры в пробах составляло 30%. Повышенная плотность скоплений ихтиопланктона также отмечена в пределах Крымского антициклона – наиболее стабильного во времени шельфового термодинамического образования, где, вероятно, сформировались благоприятные условия для нереста и выживания рыб на ранних этапах развития.
ВВЕДЕНИЕ
Состояние ихтиопланктонных комплексов является определяющим фактором в формировании поколений естественных популяций рыб. Данные о видовом составе и пространственном распределении ихтиопланктона позволяют получить информацию о достоверно размножающихся видах рыб черноморской ихтиофауны. Видовой состав ихтиопланктона Черного моря в летний гидрологический сезон включает в себя в основном представителей тепловодных субтропических и тропических видов, обитающих в верхнем квазиоднородном слое (ВКС), и небольшую группу умеренноводных бореальных видов, которые летом встречаются в холодном промежуточном слое (ХПС), имеющем температуру, благоприятную для их эмбрионального и постэмбрионального развития [8, 28]. Глобальное потепление климата привело к пространственно-временны́м сдвигам ареалов нереста, а в морях с хорошо выраженной сезонностью, к каковым относится и Черное море – к пролонгированию результативного нереста некоторых массовых видов рыб на период межсезонья и одновременному присутствию в ихтиопланктоне личинок рыб умеренноводного и тепловодного комплексов [16, 17, 33–35, 38].
В последние годы в открытых водах шельфа Черного моря наблюдается увеличение количества видов в ихтиопланктоне за счет типичных представителей узкоприбрежной ихтиофауны вплоть до их доминирования. Если в 1960–1980 гг. в летнем ихтиопланктоне открытых вод Черного моря у Крымского полуострова в вертикальных ловах отмечали не более 15–20 видов, то в настоящее время уже в начале летнего нерестового сезона количество видов достигает тридцати [9, 17, 20, 31, 35].
Изменение преобладающего режима атмосферной циркуляции над Черноморским регионом, увеличение повторяемости ветров северных румбов в теплый период года на фоне сезонного ослабления общей циркуляции вод усиливают неустойчивость Основного Черноморского течения (ОЧТ), отжимая основной поток в сторону открытого моря вдоль всего континентального склона Крыма. При этом увеличивается вероятность образования квазистационарных антициклонических вихрей (АЦ) между берегом и струей ОЧТ и расширения зон их локализации [2, 4, 5, 22]. В восточной части моря усиление северных ветров создает “блокирующий” эффект, ослабляя северо-западный перенос вод в системе общей циркуляции, приближает к берегу или удаляет от него основную струю ОЧТ и, соответственно, сужает или расширяет зону локализации прибрежных АЦ [13, 25, 32]. Особенности циркуляции вод в АЦ (прежде всего их конвергентный характер) приводят к вовлечению в зону АЦ вод из соседних, более мелководных участков моря [27, 29]. Это может способствовать более равномерному распределению планктонных организмов как на шельфе, так и в прилегающих глубоководных участках моря, и создавать благоприятные условия для нереста и выживания рыб на ранних этапах развития.
Цель данного исследования: изучить структуру видового состава и пространственное распределение ихтиопланктона в северной части Черного моря в связи с особенностями летнего гидрологического сезона в период массового нереста тепловодных видов рыб и выделить акватории, благоприятные для выживания природных популяций рыб на ранних стадиях развития.
МАТЕРИАЛ И МЕТОДЫ
Материал собран с 11 июля по 3 августа 2019 г. в шельфовых и глубоководных районах Черного моря у Крымского полуострова и берегов Кавказа в 108-м рейсе НИС “Профессор Водяницкий”. Сбор проб ихтиопланктона осуществляли в режиме вертикальных ловов на глубоководных станциях от нижней границы кислородного слоя (σt = = 16.2 усл. ед. по данным CTD зондов SBE 911 plus и Indronaut Os320Plus) до поверхности, а на мелководных станциях – от дна до поверхности. Для анализа гидрологического режима моря в период исследований использовались данные инструментальных наблюдений за термохалинной структурой по данным CTD зонда Indronaut Os320Plus, космические снимки температуры поверхности моря (ТПМ) и альтиметрические данные за период с декабря 2018 г. до середины августа 2019 г. [22], а также соответствующие по времени данные океанологических наблюдений в различных прибрежных районах Крымского полуострова и Кавказа [10, 26].
Ихтиопланктонные пробы собирали на 67 станциях обратно-конической сетью БР-80/113, ячея сита 400 мкм, площадь входного отверстия 0.5 м2. Материал фиксировали 4% раствором формальдегида и обрабатывали в стационарных условиях в течение месяца после сбора. Применяемая методика сбора от нижней границы кислородного слоя до поверхности позволила облавливать как ВКС, где происходит эмбриональное и постэмбриональное развитие тепловодных рыб, так и ХПС, где обитают виды умеренноводного комплекса. Идентификацию ихтиопланктона проводили по монографиям [8, 37]. Видовые названия гидробионтов даны согласно WoRMS [39]. Индексы разнообразия рассчитаны по формулам, изложенным в [24]. Численность ихтиопланктона приведена под м2 морской поверхности. Статистическую обработку данных, анализ средних величин численности икры и личинок рыб (стандартное отклонение и доверительный интервал), построение графиков производили в программах Microsoft Excel и Past 4.0. При расчете доверительного интервала α = 0.05.
Всего были собраны и идентифицированы 2947 икринок и 837 личинок рыб.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидрологическая характеристика районов исследований. У большинства видов рыб Черного моря размножение происходит в летний сезон, причем, июль и август, как правило, соответствуют пику нереста теплолюбивых видов [8]. Вместе с тем его эффективность во многом определяется параметрами текущего и предшествующих гидрологических сезонов – зимнего и весеннего, а также динамической активностью вод в основных районах нереста: в мелководной северо-западной части моря (СЗЧ) и шельфовой зоне Крыма и Кавказа [31].
На фоне климатических изменений в гидрологическом режиме деятельного слоя Черного моря и параметров гидрологических сезонов с преобладанием теплых зим, зимний гидрологический сезон 2018–2019 гг. выделялся своей продолжительностью (с декабря 2018 по май 2019 гг.) и квазиоднородным пространственным распределением ТПМ от 9.0–9.5°С в западной части моря, южнее широты полуострова Тарханкут, до 10.0–10.5°С у берегов Кавказа. Весенний гидрологический сезон, соответствующий активному прогреву верхнего слоя моря и перестройке поверхностной циркуляции от зимнего типа к летнему, длился всего один месяц. Интенсивный прогрев моря по всей исследуемой акватории обеспечил повышение значений ТПМ от 10.5–12.5°С в начале мая до 20.0–22.5°С в первых числах июня [22].
Резкая смена основных гидрологических сезонов привела к установлению в июле–августе 2019 г. летнего типа поверхностной циркуляции, отличающейся от наблюдаемой в 2016, 2017 и 2018 гг., но близкой, однако, к ситуации 2013 г. [1–3, 20]. Как результат, в районе проведенных ихтиопланктонных исследований циркуляция поверхностных вод в летний сезон 2019 г. определялась активно меандрирующей вдоль континентального склона Крыма струей ОЧТ с двумя глубокими циклоническими меандрами: в прибрежно-шельфовой зоне к югу от Керченского полуострова и вдоль западного склона большой топографической ложбины (БТЛ). В ложбинах циклонических меандров обнаруживались АЦ, типичные для этого времени года [14]: Керченский АЦ – от Таманского полуострова до Новороссийска, обширный Крымский АЦ –от мыса Меганом до Гераклейского полуострова и находящийся на стадии заполнения Севастопольский АЦ –над северным склоном БТЛ (рис. 1в). В течение всего периода исследований оба циклонических меандра ОЧТ и Крымский АЦ сохраняли свое положение, а Севастопольский АЦ перемещался в пределах БТЛ в зависимости от синоптической ситуации. Кавказский АЦ, обычно активно проявляющий себя в это время года в юго-восточной части акватории вследствие прижатия к берегу струи ОЧТ, был локализован лишь в узкой прибрежной зоне, однако к периоду выполнения работ в этом секторе расширился в сторону открытого моря (рис. 1г).
Рис. 1.
Спутниковые карты распределения ТПМ и расчетные схемы геострофической циркуляции в период выполнения станций в секторе векового разреза (а, в – 13.07.2019) и Западного сектора исследований (б, г – 02.08.2019).
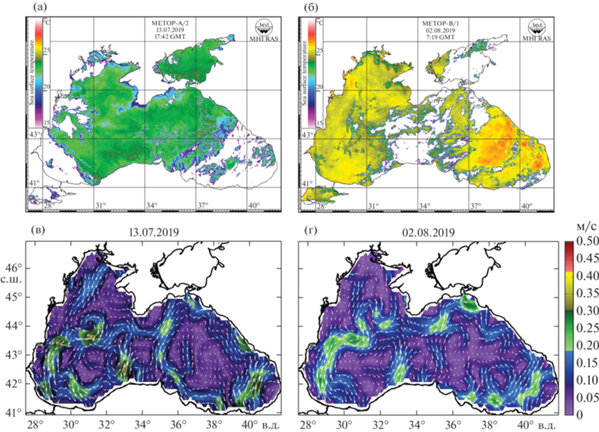
Резкое наступление летнего гидрологического сезона, а также длительный период активной ветро-волновой деятельности над всей акваторией Черного моря во второй половине июня–начале июля замедлили интенсивность прогрева поверхности моря и развитие ВКС. Как следствие, к началу съемки на большей части исследуемой акватории значения ТПМ (23–24°С) не превышали наблюдаемые ранее в третьей декаде июня [17, 20]. Кроме этого, узкая прибрежная зона Крыма (от полуострова Тарханкут до Феодосийского залива) оказалась под воздействием прибрежного апвеллинга (ПА), понизившего ТПМ до 17–18°С в районе от мыса Херсонес до мыса Сарыч и до 20–22°С вдоль всего Южного берега Крыма (ЮБК) до Феодосийского залива (рис. 1а). К концу съемки поверхностный слой моря равномерно прогрелся до 25–26°С. Незначительное увеличение ТПМ до 26.5–27°С наблюдалось лишь в юго-восточной части акватории, а остаточное проявление ПА с пониженными до 24°С значениями ТПМ –в районе полуострова Тарханкут (рис. 1б).
Толщина ВКС в соответствии с региональной инерционностью прогрева вод и особенностями циркуляции в различных прибрежных районах колебалась от 5–15 м на начальном этапе исследований до 20–25 м – к концу съемки. При этом минимальные значения толщины ВКС соответствовали зоне ПА, а максимальные – наиболее прогретым мелководным прибрежным акваториям.
ХПС с классическими границами по изотерме 8°С на акватории съемки не наблюдался. Минимальные значения температуры в ядре ХПС составляли 8.3–8.4°С, а средняя глубина залегания была близка к 60 м [21].
Соленость поверхностных вод (более 18‰) на большей части акватории соответствовала параметрам Верхней черноморской водной массы. Отдельные очаги распресненных вод с соленостью менее 17.8‰, соответствующие прибрежной водной массе, были приурочены к мелководным акваториям в районе Кавказа и к Каркинитскому заливу [14].
Ихтиопланктон. В период исследований у Крымского полуострова и берегов Кавказа термические условия в верхнем слое моря были благоприятны для нереста теплолюбивых видов рыб. В ихтиопланктоне идентифицированы икра и личинки 29 видов рыб из 19 семейств. Видовой состав и численность ихтиопланктона изменялись в зависимости от района исследований и удаленности от берега. Средняя численность икры составляла 83.8, а личинок 23.7 экз/м2. Минимальная средняя численность ихтиопланктона (13.8 экз/м2 икры и 2.5 экз/м2 личинок) была отмечена на траверзе Керченского полуострова в пределах циклонического меандра ОЧТ, а максимальная (176 экз/м2 икры и 56.8 экз/м2 личинок) – в мелководном северо-западном секторе исследований у полуострова Тарханкут. Пространственное распределение ихтиопланктона представлено на рис. 2.
Численность и количество видов в ихтиопланктоне возрастали от глубоководных районов исследований к шельфу. В глубоководных участках исследований были идентифицированы 16 видов икры и личинок рыб, а в шельфовой зоне – 24 вида, индекс видового сходства Соренсена [24] составлял 0.54. В глубоководных районах средняя численность икры была 62.4 экз/м2, личинок 18.3 экз/м2, а на шельфе – вдвое выше – 130.6 и 37.1 экз/м2 соответственно (табл. 1).
Таблица 1.
Структура видового состава (%) и средняя численность (экз/м2) икры и личинок рыб на шельфе и в глубоководных районах исследований
| Видовой состав | Глубина < 200 м | Глубина > 200 м | ||
|---|---|---|---|---|
| икра | личинки | икра | личинки | |
| Family: Engraulidae | ||||
| Engraulis encrasicolus Linnaeus, 1758 | 85.4 | 79.3 | 93.3 | 75.9 |
| Family: Clupeidae | ||||
| Sprattus sprattus (Linnaeus, 1758) | 0.4 | 0.1 | ||
| Clupeonella cultriventris (Nordmann, 1840) | 0.6 | |||
| Family: Gadidae | ||||
| Merlangius merlangus Linnaeus, 1758 | 0.3 | 0.1 | ||
| Trisopterus luscus (Linnaeus, 1758) | 0.2 | 1.3 | ||
| Family: Ophidiidae | ||||
| Ophidion rochei Muller, 1845 | 0.2 | |||
| Family: Mugilidae | ||||
| Mugil cephalus Linnaeus, 1758 | 0.2 | |||
| Mugil sp. | 0.3 | |||
| Family: Syngnathidae | ||||
| Syngnathus schmidti Popov, 1928 | 0.5 | 3.9 | ||
| Family: Gobiesocidae | ||||
| Lepadogaster candolii Risso, 1810 | 0.2 | |||
| Diplecogaster bimaculata (Bonnaterre, 1788) | 0.5 | |||
| Family: Blenniidae | ||||
| Parablennius tentacularis (Brunnich, 1768) | 0.5 | |||
| Blennius sp. | 0.3 | |||
| Family: Callionymidae | ||||
| Callionymus sp. | 0.3 | |||
| Family: Gobiidae | ||||
| Gobius niger Linnaeus, 1758 | 2.4 | 1.2 | ||
| Pomatoschistus marmoratus (Risso, 1810) | 0.3 | 0.2 | ||
| P. minutus (Pallas, 1770) | 0.8 | 0.6 | ||
| P. pictus Malm, 1865 | 0.3 | |||
| Aphia minuta (Risso, 1810) | 0.2 | |||
| Family: Labridae | ||||
| Symphodus cinereus (Bonnaterre, 1788) | 0.3 | |||
| Symphodus ocellatus (Linnaeus, 1758) | 0.3 | |||
| Family: Carangidae | ||||
| Trachurus mediterraneus (Steindachner, 1868) | 9.8 | 10.5 | 5.9 | 16.2 |
| Family: Mullidae | ||||
| Mullus barbatus Linnaeus, 1758 | 2.4 | 1.3 | 0.1 | 0.2 |
| Family: Pomatomidae | ||||
| Pomatomus saltatrix (Linnaeus, 1766) | 0.7 | |||
| Family: Sparidae | ||||
| Diplodus annularis (Linnaeus, 1758) | 0.2 | 0.3 | 0.1 | 0.6 |
| Family: Scombridae | ||||
| Sarda sarda Bloch, 1793 | 0.1 | |||
| Thunnus thynnus (Linnaeus 1758) | 0.1 | 0.3 | ||
| Family: Uranoscopidae | ||||
| Uranoscopus scaber Linnaeus, 1758 | 0.1 | |||
| Family: Bothidae | ||||
| Arnoglossus kessleri Schmidt, 1915 | 0.5 | 0.2 | ||
| Всего, экз/м2 | 130.6 | 37.1 | 62.4 | 18.3 |
| Стандартное отклонение | 95.36 | 42.55 | 58.99 | 31.85 |
| Максимальная численность | 330.0 | 148.0 | 230.2 | 137.7 |
| Количество видов | 24 | 16 | ||
Структура видового состава ихтиопланктона в глубоководных районах исследований не отличалась от таковой в 1950–70 гг. [9]. Теплолюбивые виды были представлены 6 видами икры и 12 видами личинок. Доминировала икра (93.3%) и личинки (75.9%) E. encrasicolus. На икру и личинок T. mediterraneus приходилось 5.9 и 16.2% соответственно. Личинки пелагической иглы S. schmidti составляли 4% общей численности личинок. Икра и личинки остальных видов рыб, в том числе пять видов личинок из демерсальной икры из семейств Gobiidae и Gobiesocidae, отмечены только единичными экземплярами и, по-видимому, были вынесены сюда с прибрежных акваторий. Погибшая икра доминирующих видов E. Encrasicolus и T. mediterraneus составляла около 50%, а икра остальных тепловодных видов вся была мертвой. Умеренноводные виды составляли всего 0.2% и были представлены мертвой икрой S. sprattus на траверзе Геленджика и живой икрой M. merlangus на траверзе м. Херсонес.
На шельфе были отмечены 9 видов икры и 18 видов личинок тепловодных рыб. В ихтиопланктоне появились представители семейств Labridae, Callionymidae, Scombridae, Uranoscopidae и Pomatomidae. Как и в глубоководных районах исследований доминировала E. encrasicolus, чья доля составляла 85.5% от численности икры и 79.3% от численности личинок. Икра и личинки T. mediterraneus составляли 9.8 и 10.5% соответственно. Остальные виды тепловодных рыб встречались единично (табл. 1). Из умеренноводных видов рыб нерест в шельфовой зоне продолжался у трех видов. Доля их икры по сравнению с пробами, отобранными на глубоководных станциях, увеличилась до 0.9%. Нерест T. luscus был результативным, доля ее личинок от общей численности всех видов составляла 1.3%.
В соответствии со сроками выполнения работ на отдельных акваториях было выделено 6 секторов исследований (рис. 3).
Рис. 3.
Средняя численность (экз/м2) и стандартное отклонение личинок (I) и икры (II) рыб по районам исследований: A – Западный сектор (01.08.–03.08.); B – вековой разрез (11.07.–14.07.); C – сектор ЮБК (14.07.–18.07.); D – Сектор Феодосии (20.07.); E – сектор Керченского полуострова (22.07.–23.07.); F – Кавказский сектор (26.07.–31.07.).
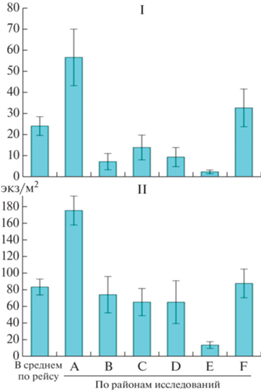
Вековой разрез (от мыса Херсонес в направлении к проливу Босфор) пересекал зону ПА и ориентированную в юго-западном направлении струю ОЧТ от ее внешней до внутренней границ. Значения ТПМ изменялись от 17.0°С в зоне ПА до 23–24°С – в зоне ОЧТ (рис. 1а, 1в). Толщина ВКС увеличивалась от 5 м в зоне ПА до 10 м в зоне ОЧТ. Здесь были отмечены 6 видов (4 вида тепловодных и 2 вида умеренноводных) икры и личинок рыб. Средняя численность икры составляла 74.5, а личинок – 7.3 экз/м2 (рис. 3). Икра была представлена тепловодными E. encrasicolus и T. mediterraneus. Умеренноводные виды: икра T. luscus и M. merlangus и личинки T. luscus были отмечены только на траверзе Севастополя над глубиной 84 м. Доминировали икра (93,2%) и личинки (70,6%) тепловодной E. encrasicolus.
В секторе ЮБК, от бухты Ласпи до Алушты, станции располагались на двух разрезах от берега до глубоководной части моря, пересекая зону ПА, занимающую прибрежную акваторию Крымского АЦ, и струю ОЧТ. Так же, как и на вековом разрезе, значения ТПМ возрастали от 17°С у берега в зоне ПА до 23–24°С в водах ОЧТ (рис. 4а, 4в). Толщина ВКС увеличивалась от 7–10 м в зоне ПА до 15–20 м в открытых районах. Здесь были отмечены уже 17 видов (9 икры и 11 личинок) рыб. Средняя численность икры была сопоставима с таковой на станциях векового разреза и составляла 65.6 экз/м2, а средняя численность личинок возросла до 14.0 экз/м2 (рис. 3), что свидетельствует об аккумулирующем эффекте циркуляции вод в пределах Крымского АЦ. Из умеренноводных видов были встречены только две личинки T. luscus в зоне ПА у Ялты и Алушты. Видовой состав тепловодных видов рыб был представлен семействами: Engraulidae, Gobiesocidae, Labridae, Callionymidae, Carangidae, Mullidae, Sparidae, Uranoscopidae, Pomatomidae, Scombridae. В пробах доминировали икра и личинки E. encrasicolus, доля ее икры составляла 83.7%, а личинок – 71.5%. Из редких видов, можно отметить T. thynnus, икра и личинки которого были пойманы на траверзе Ялты. До 1970-х годов взрослые особи T. thynnus регулярно заходили в Черное море на нерест и нагул, их икра и личинки встречались в ихтиопланктоне северо-западной части моря и у Крымского полуострова [6, 7, 11, 23].
Рис. 4.
Спутниковые карты распределения ТПМ и расчетные схемы геострофической циркуляции в период выполнения станций в секторе ЮБК (а, в – 17.07.2019) и Феодосии (б, г – 20.07.2019).
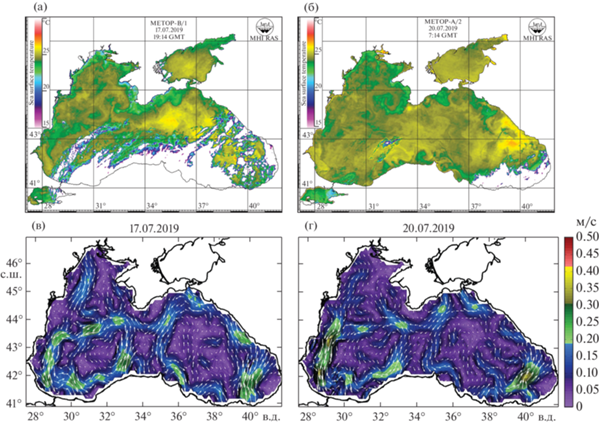
В секторе Феодосии прибрежные станции располагались в пределах восточной периферии Крымского АЦ, а глубоководные – в пределах струи циклонического меандра ОЧТ. Значения ТПМ изменялись от 23.2–23.6°С на прибрежных станциях в Феодосийском заливе до 24.5–25.0°С в глубоководной части района исследований. Толщина ВКС увеличивалась от 10–12 м у берега до 15–20 м – в пределах струи циклонического меандра (рис. 4б, 4г).
Были отмечены всего 7 видов икры и личинок тепловодных рыб. Средняя численность икры была сопоставима с таковой на ЮБК, а численность личинок сократилась до 9.5 экз/м2 (рис. 3). Умеренноводные виды в ихтиопланктонных пробах обнаружены не были. Представители тепловодных видов из семейств Carangidae, Mullidae, Sparidae, Pomatomidae, а также личинки Gobiidae встречались только на шельфе. В пробах доминировали икра (82.4%) и личинки (79.2%) E. encrasicolus.
На Керченском полигоне разрез ихтиопланктонных станций располагался в пределах циклонического меандра ОЧТ. Несмотря на благоприятную для нереста тепловодных видов рыб температуру поверхности воды (24,5°С), здесь были отмечены минимальные показатели количества видов (5), средней численности икры (13.8 экз/м2) и личинок (2.5 экз/м2) рыб (рис. 5а, 5в). Здесь же была отмечена и самая высокая доля мертвой икры в пробах – 60.5%, в то время как в среднем по всем районам исследований она была сопоставима с данными Т.В. Дехник [9] в разгар нереста и не превышала 44.5%. Икра была представлена только двумя видами: умеренноводным S. sprattus и тепловодной E. encrasicolus, которая доминировала в пробах, составляя 97.6%. Доля личинок E. encrasicolus не превышала 13.4%, в ихтиопланктоне преобладали личинки T. mediterraneus и Syngnathus schmidti, в сумме превышая 73% от общей численности всех видов.
Рис. 5.
Спутниковые карты распределения ТПМ и расчетные схемы геострофической циркуляции в период выполнения станций в секторе Керчи (а, в – 22.07.2019) и Кавказа (б, г – 29.07.2019).
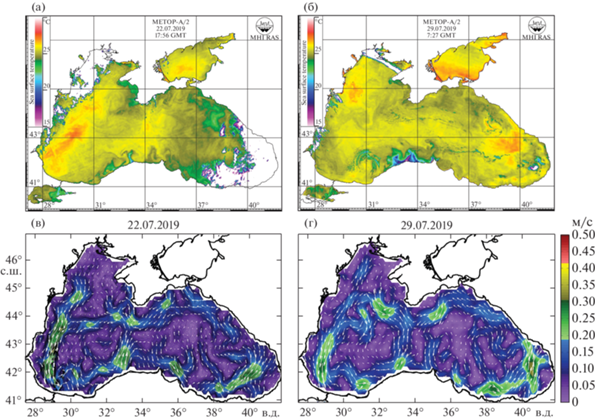
У Кавказского побережья станции располагались в открытых водах (большая часть), в зоне ОЧТ, а также у берега на небольших глубинах в пределах прибрежной водной массы. Значения ТПМ изменялись от 24.0–25.0°С в районе Анапы-Новороссийска до 26.0–27.0°С в районе Сочи (рис. 5б, 5г). Толщина ВКС повсеместно составляла 20–25 м.
В данном районе исследований нерестились 13 видов тепловодных рыб. Из умеренноводных видов, так же, как и в районе Керченского полуострова, были отмечены только икринки S. sprattus. Средняя численность икры и личинок у побережья Кавказа составляла 88.1 и 32.8 экз/м2 соответственно (рис. 3). Максимальная численность икры (330 экз/м2) и личинок (148 экз/м2) наблюдалась на станции над глубиной 90 м в пределах распространения распресненных вод прибрежной водной массы. В ихтиопланктоне доминировала E. encrasicolus. Доля ее икры составляла 90.1%, а личинок – 73.9%. В пробах были обнаружены молодь C. cultriventris, личинки бычка A. minuta и камбалы A. kessleri, которые у Крымского полуострова в ихтиопланктоне отсутствовали.
В западном секторе все станции были выполнены на шельфе в зоне слабых и неустойчивых течений. ТПМ достигала 26°С (рис. 1б, 1г). Толщина ВКС составляла 20–25 м. Были отмечены 10 видов икры и личинок тепловодных и 2 вида икры умеренноводных рыб, в том числе личинки бычка P. pictus и собачки P. tentacularis, которые в других районах исследований встречены не были. Средняя численность ихтиопланктона здесь была максимальной среди всех районов исследований (икра 175.8, а личинки –55.3 экз/м2) (рис. 2). Доминировала икра (92.6%) и личинки (88.6%) E. еncrasicolus. Если средняя численность икры хамсы была вполне сопоставима с данными по этому району исследований в 1957–1962 гг. [8], то средняя численность личинок оказалась более чем втрое выше. В 2019 г. в западном секторе исследований максимальная численность икры (224 экз/м2) наблюдалась в Каркинитском заливе над глубиной 33 м, а личинок (116 экз/м2) – чуть западнее, над глубиной 50 м (рис. 1). Следует отметить, что Каркинитский залив в середине ХХ века являлся районом массового размножения многих промысловых видов рыб, но к концу 1980-х годов практически потерял свою рыбохозяйственную значимость [12]. Интенсивная эксплуатация свалок грунтов в районах пос. Черноморское, пос. Хорлы и г. Скадовск привела к загрязнению залива токсичными веществами и заилению районов дампинга и сопредельной территории, а развитие рисосеяния в прибрежных районах привело к повышению концентраций хлорорганических соединений как в грунтах, так и в гидробионтах [30]. По результатам исследований, проведенных в 1987–1992 гг. этот район характеризовался “исключительной бедностью ихтиопланктона”, а в июле–августе 1990 г., в период интенсивного нереста теплолюбивых рыб, икра и личинки в вертикальных ловах отсутствовали [15, 31]. Показатели численности ихтиопланктона в пробах, отобранных летом 2019 г. в Каркинитском заливе, свидетельствуют о восстановлении этого района, как акватории, благоприятной для нереста природных популяций рыб и их выживания на ранних стадиях онтогенеза.
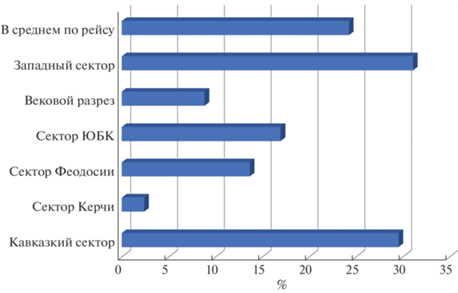
Во всех районах исследований, кроме сектора Керченского полуострова, в ихтиопланктоне доминировали икра (от 82.4 до 92.9%) и личинки (71.5 до 88.6%) E. еncrasicolus. Средняя численность икры E. encrasicolus колебалась от 13.5 до 162.8 экз/м2 а личинок – от 0.3 до 50.5 экз/м2. Максимальная численность икры E. еncrasicolus достигала 260, а личинок – 117 экз/м2. Погибшая икра E. еncrasicolus на шельфе в среднем не превышала 34%, а в глубоководных районах – 50%. Самая высокая доля мертвой икры E. еncrasicolus в пробах наблюдалась у Керченского полуострова (59%) и в секторе ЮБК, а самая низкая – в западном секторе (41.3%) и у Кавказа (42.1%). Эффективность нереста E. еncrasicolus была сопоставимой с данными [8] в 1957–1963 гг. В период наших исследований отношение численности личинок к количеству икры в среднем составляло 24.6% (в шельфовых водах – 26.1% а в глубоководных участках – 23.5%), а по районам исследований оно колебалась от 2.2% у Керченского полуострова до 30% – в районе Кавказа и западного сектора исследований (рис. 6).
Рис. 6.
Отношение численности личинок Engraulis encrasicolus к количеству икры (%) в пробах в различный районах исследований.
Отмеченные различия в ихтиопланктонных комплексах всех шести секторов исследований подтверждаются результатами проведенного кластерного анализа методом попарного внутригруппового невзвешенного среднего (UPGMA) [36], с построением дендрограммы на основе индекса сходства Брея-Кертиса (рис. 7).
Рис. 7.
Дендрограмма таксономического сходства ихтиопланктонных комплексов в 6 секторах исследований (метод UPGMA, индекс сходства Брея-Кертиса [36]). A – Западный сектор; B – вековой разрез; C – сектор ЮБК; D – сектор Феодосии; E – сектор Керченского полуострова; F – Кавказский сектор.

Наиболее вероятной причиной сходства и отличия выделенных кластеров является соответствие выполненных станций в отдельных секторальных акваториях региональным особенностям термодинамического состояния вод в процессе выполнения съемки, что определило различия в плотности распределения и видовом составе ихтиопланктона. Наибольшее сходство кластеров ЮБК и Феодосии объясняется последовательностью этапов исследования в пределах одного синоптического периода и локализацией большинства станций в водах квазистационарного Крымского АЦ. Таксономическое сходство ихтиопланктонных комплексов Векового разреза к кластерам ЮБК и Феодосии соответствует общей начальной фазе стабильного прогрева верхнего слоя моря на фоне сформировавшейся вертикальной термической структуры летнего типа, а также географии исследований, охватывающей как шельфовые, так и глубоководные зоны. Кавказский сектор близок по физико-географическим характеристикам к предыдущим, однако отличается повышенной гидродинамической активностью и усилением фактора распреснения в формировании термохалинной структуры прибрежных вод. Особенностью западного кластера является мелководность района исследований и влияние распресненных вод поверхностной водной массы, отличающейся наибольшей биологической продуктивностью. Обособленность Керченского кластера от основного блока дендрограммы объясняется тем, что все станции сектора исследований были выполнены в пределах устойчивого циклонического меандра ОЧТ в наиболее осолоненных водах верхней черноморской массы, что обусловило не только минимальные показатели количества видов и численности ихтиопланктона, но и отличные от остальных районов исследований доминантные виды.
Количество видов в ихтиопланктоне Черного моря в июле–августе 2019 г. было вполне сопоставимо с данными июля 2017 г. (96 рейс НИС “Пр. Водяницкий”), когда были отмечены икра и личинки 31 вида рыб. Средняя численность икры в обоих рейсах была одного порядка, а численность личинок в 2019 г. была почти вдвое выше, что, вероятно, связано с запаздыванием летнего гидрологического сезона в 2017 г. [3, 18]. Сравнение состояния ихтиопланктонных комплексов в летний нерестовый сезон 2017 и 2019 гг. с помощью индексов разнообразия [24] показало, что, благодаря большому количеству видов в ихтиопланктоне, показатели индексов видового богатства (~14) в открытых водах Черного моря в 2019 и 2017 гг. были сопоставимы с таковыми в прибрежной акватории моря у Севастополя [19] (табл. 2).
Таблица 2.
Индексы видового разнообразия ихтиопланктона в летний нерестовый сезон 2017 и 2019 гг.
| Индексы | 08.07–31.07 2017 г. |
11.07–03.08 2019 г. |
|---|---|---|
| Видового разнообразия | 2.13 | 0.84 |
| Видового богатства | 14.11 | 13.78 |
| Доминирования | 0.35 | 0.76 |
| Выровненности | 0.43 | 0.17 |
| Количество видов | 31 | 29 |
Если в июле 2017 г. доля икры E. еncrasicolus в среднем составляла 50.6%, а личинок 33.8%, то в 2019 г. она возросла до 90 и 80% соответственно. В результате индекс доминирования возрос с 0.35 в 2017 г. до 0.76 в 2019 г., что способствовало снижению показателей индексов видового разнообразия и выровненности более, чем вдвое (табл. 2) [18].
ЗАКЛЮЧЕНИЕ
В Черном море в июле–августе 2019 г. были идентифицированы 29 видов икры и личинок рыб из 19 семейств. В шельфовой зоне были отмечена икра и личинки 25 видов рыб, в глубоководной – 14 видов. Большое количество видов икры и личинок рыб в летний гидрологический сезон в открытых водах Черного моря, вероятно, обусловлено выносом икры и личинок рыб из прибрежной акватории в открытое море вследствие циркуляционных особенностей вод в системе прибрежных АЦ. Благодаря большому количеству видов в ихтиопланктоне показатели индекса видового богатства открытых вод в июле–августе 2019 г. были сопоставимы с таковыми в прибрежной акватории моря. Индекс видового сходства Соренсена ихтиопланктона на шельфе и в глубоководной части исследований составлял 0.54.
Средняя численность ихтиопланктона колебалась от 13.8 экз/м2 икры и 2.5 экз/м2 личинок в районе Керченского полуострова до 176.0 экз/м2 икры и 55.3 экз/м2 личинок в районе Каркинитского залива у мыса Тарханкут. Повышенная плотность скоплений ихтиопланктона также отмечена в пределах Крымского АЦ – наиболее стабильного во времени шельфового термодинамического образования, где, вероятно, сформировались благоприятные условия для нереста и выживания рыб на ранних этапах развития. Проведенный кластерный анализ подтвердил зависимость различий в таксономическом составе ихтиопланктона от региональных особенностей термодинамического состояния вод в отдельных секторах исследований.
В период исследований наблюдался массовый и результативный нерест E. encrasicolus с ее безусловным доминированием. Средняя численность икры и личинок E. encrasicolus достигала в западном секторе исследований 162.8 и 50.5 экз/м2 соответственно. Независимо от доли мертвой икры, отношение численности личинок E. encrasicolus к количеству икры в пробах колебалось незначительно. Эффективность нереста была сопоставима с данными середины прошлого века и составляла в среднем 24.6%. Максимальная численность икры (260 экз/м2) и личинок (117 экз/м2) хамсы отмечена в шельфовой зоне Кавказского сектора в пределах распространения распресненных вод прибрежной водной массы.
Высокие показатели видового разнообразия и численности ихтиопланктона в пробах, отобранных летом 2019 г. в Каркинитском заливе, свидетельствуют о восстановлении его рыбохозяйственной значимости в качестве акватории, благоприятной для нереста природных популяций рыб и их выживания на ранних стадиях онтогенеза после деградации экосистемы данного района в 90-х гг. прошлого века.
Источники финансирования. Работа выполнена в рамках бюджетных тем: № 121030100028-0 “Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана”, № 121030300149-0 “Исследование механизмов управления продукционными процессами в биотехнических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса” и № 121040500247-0 “Фундаментальные исследования популяционной биологии морских животных, их морфологического и генетического разнообразия”.
Список литературы
Артамонов Ю.В., Алексеев Д.В., Скрипалева Е.А. и др. Термохалинная структура вод у берегов Крыма и прилегающей открытой акватории Черного моря летом 2016 г. // Экологическая безопасность прибрежной и шельфовой зон моря. 2017. № 3. С. 20–31.
Артамонов Ю.В., Скрипалева Е.А., Федирко А.В. и др. Циркуляция вод в северной части черного моря летом–зимой 2018 года // Экологическая безопасность прибрежной и шельфовой зон моря. 2020. № 1. С. 69–90. https://doi.org/10.22449/2413-5577-2020-1-69-90
Артамонов Ю.В., Федирко А.В., Скрипалева Е.А. и др. Структура вод в зоне Основного Черноморского течения весной и летом 2017 г. (94-й, 95-й рейсы НИС “Профессор Водяницкий”) // Экологическая безопасность прибрежной и шельфовой зон моря. 2019. № 1. С. 16–28. https://doi.org/10.22449/2413-5577-2019-1-16-28
Белокопытов В.Н. Климатические изменения гидрологического режима Черного моря: Дис. … докт. геогр. наук. Севастополь, 2017. 377 с.
Белокопытов В.Н., Никольский Н.В. Устойчивые антициклонические вихри у южного и западного побережья Крыма // Экологическая безопасность прибрежной и шельфовой зон моря. 2015. Вып. 1. С. 47–53.
Водяницкий В.А. Наблюдение за пелагическими яйцами рыб Чёрного моря // Тр. Севастоп. биол. ст. 1936. Т. 5. М.: из-во Акад. Наук СССР. С. 3–18.
Голенченко А.П. Организовать лов тунца в Чёрном море // Рыбное хозяйство. Пищепромиздат. 1952. № 10. С. 18–19.
Дехник Т. В. Ихтиопланктон Черного моря. Киев: Наукова думка. 1973. 234 с.
Дехник Т. В., Павловская Р.М. Закономерности распределения, динамики численности и выживания рыб на ранних этапах онтогенеза // Основы биологической продуктивности Черного моря / АН УССР, Ин-т биологии юж. морей им. А. О. Ковалевского; под общ. ред. В. Н. Грезе. Киев: Наук. думка, 1979. С. 268–279.
Дьяков Н.Н., Мальченко Ю.А., Липченко А.Е. и др. Гидролого-гидрохимические характеристика прибрежных вод Крыма и необходимые мероприятия по снижению уровня загрязнения рекреационных зон // Тр. ГОИН, 2020. Вып. 221. С. 163–194.
Зайцев Ю.П. Экологическое состояние шельфовой зоны Черного моря у побережья Украины (обзор) // Гидробиол.журн. 1992. Т. 28. № 4. С. 3–18.
Зайцев Ю.П. Новi данi про iхтiопланктон пiвнiчно-захiдної частини Чорного моря // Наук. зап. Одеської биол. ст. 1959. Вип. 1. С. 77–90.
Зацепин А.Г., Ёлкин Д.Н., Корж А.О. и др. О влиянии изменчивости течения в глубоководной зоне Черного моря на динамику вод узкого северокавказского шельфа // Морской гидрофизический журнал. 2016. № 3. С. 16–25.
Иванов В.А., Белокопытов В.Н. Океанография Черного моря. Севастополь: ЭКОСИ-гидрофизика, 2011. 212 с.
Климова Т.Н. Влияние дампинга на структуру ихтиопланктонных сообществ в шельфовой зоне Черного моря // Вопросы ихтиологии. 2001. Т. 41. № 6. С. 804–815.
Климова Т.Н., Вдодович И.В., Аннинский Б.Е. и др. Влияние некоторых абиотических и биотических факторов на нерест европейского шпрота Sprattus sprattus (Linnaeus, 1758) в Черном море в ноябре 2016–2017 гг. // Океанология. Т. 61. № 1. 2021. С. 67–78. https://doi.org/10.31857/S0030157421010081
Климова Т.Н., Вдодович И.В., Субботин А.А. и др. Распределение ихтиопланктона в связи с особенностями гидрологического режима у берегов Крыма (Черное море) в весенне-летний сезон 2017 г. // Вопросы ихтиологии. 2021. Т. 61. № 2. С. 194–204. https://doi.org/10.31857/S0042875221020119
Климова Т.Н., Мельников В.В., Серебренников А. и др. Особенности видового разнообразия и распределения ихтиопланктона у берегов Крыма в июле–августе 2017 г. // Системы контроля окружающей среды. Севастополь: ИПТС, 2019. Вып. 1 (35). С. 97–105. https://doi.org/10.33075/2220-5861-2019-1-97-105
Климова Т.Н., Подрезова П.С. Видовое разнообразие ихтиопланктона в различных по степени антропогенной нагрузки районах прибрежной акватории Севастополя // V Балтийский морской форум. Всероссийская научная конференция “Водные биоресурсы, аквакультура и экология водоемов”, Труды Калининград, ФГБОУ ВО “Калининградский государственный технический университет” 2017. С. 183–187.
Климова Т.Н., Субботин А.А., Мельников В.В. и др. Пространственное распределение ихтиопланктона у Крымского полуострова в летний нерестовый сезон 2013 г. // Морской биолог. журнал. 2019. Том. 4. № 1. С. 63–80. https://doi.org/10.21072/mbj.2019.04.1.06
Морозов А.Н., Маньковская Е.В. Холодный промежуточный слой Черного моря по данным экспедиционных исследований 2016–2019 годов // Экологическая безопасность прибрежной и шельфовой зон моря. 2020. № 2. С. 5–16. https://doi.org/10.22449/2413-5577-2020-2-5-16
Морской портал МГИ. Архив данных по Черному морю. http://dvs.net.ru/mp/index_ru.shtml (Дата обращения 23.04.2021).
Овен Л.С. Пелагические икринки рыб в Чёрном море у Карадага // Тр. Карадагской биологической станции. 1959. Вып. 15. Киев: Из-во Акад. Наук УССР. С. 13−30.
Одум Ю. Экология. М.: Мир, 1996. 373 с.
Панов Б.Н., Спиридонова Е.О. Влияние течений и атмосферной циркуляции на эффективность промысла хамсы в период ее зимовки у Черноморского побережья Краснодарского края // Экологическая безопасность прибрежной и шельфовой зон моря. 2020. № 3. С. 17–30. https://doi.org/10.22449/2413-5577-2021-1-47-62
Подымов О.И., Зацепин А.Г., Очередник В.В. Рост солености и температуры в деятельном слое северо-восточной части Черного моря с 2010 по 2020 г. // Морской гидрофизический журнал. 2021. Т. 37. № 3. С. 279–287. https://doi.org/10.22449/0233-7584-2021-3-279-287
Попов Ю.П. Распространение шельфовых вод в северо-западной части Черного моря и их обмен с водами открытого моря // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. 2010. Вып. 23. С. 117–126.
Расс Т. С. Современные представления о составе ихтиофауны Черного моря и его изменениях // Вопросы ихтиологии. 1987. Т. 27. № 2. С. 179–187.
Репетин Л.Н., Романов А.С., Чурилова Т.Я. Апвеллинг в зоне антициклонической завихренности на шельфе южного Крыма // Экологическая безопасность прибрежной и шельфовой зон и комплексной использование ресурсов шельфа. 2010. Вып. 22. С. 205–227.
Севрикова С.Д., Болдырев М.А., Назаренко С.А., Горлатенко И.В. Об изменении качества морской среды под влиянием сбросов грунтов ремонтного и капитального дноуглубления в импактных зонах Черного моря // Ежегодник СОГОИН. 1987. Т. 1. С. 164–186.
Современное состояние ихтиофауны Черного моря / Под ред. Коновалова С.М. Севастополь: СО “ЭКОСИ-Гидрофизика”, 1995. 215 с.
Титов В.Б. Характеристики Основного черноморского течения и прибрежных антициклонических вихрей в российском секторе Черного моря // Океанология. 2002. Т.42. №5. С. 668–676.
Auth T.D., Daly E.A., Brodeur R.D., Fisher J.L. Phenological and distributional shifts in ichthyoplankton associated with recent warming in the northeast Pacific Ocean // Global Change Biology. 2017. V. 24 (11). P. 259–272. https://doi.org/10.1111/gcb.13872
Edwards M., Richardson A.J. Impact of climate change on marine pelagic phenology and trophic mismatch // Nature. 2004. 430. P. 881–884. https://doi.org/10.1038/nature 02808.
Klimova T., Podrezova P. Seasonal distribution of the Black Sea ichthyoplankton near the Crimean Peninsula // Regional studies in Marine Science. 2018. V. 24. P. 260–269. https://doi.org/10.1016/j.rsma.2018.08.013
Romesburg H.C. Cluster Analysis for Researchers. Robert E. Krieger Pub. Co. Florida, USA, 1990.
Russell F.S. The eggs and planktonic stages of British marine fishes. London; New York; San Francisco: Acad. Press, 1976. 524 p.
Visser M.E., Both C. Shifts in phenology due to global climate change: the need for a yardstick // Proceedings of the Royal Society of London, Series B, Biological Sciences. 2005. 272(1581), P. 2561–2569. https://doi.org/10.1098/rspb.2005.3356
World register of marine species (WoRMS) http://www.marinespecies.org/index.php.
Дополнительные материалы отсутствуют.



