Океанология, 2022, T. 62, № 5, стр. 743-753
Весенний пикофитопланктон Карского моря
Т. А. Белевич 1, 2, *, И. А. Милютина 2, А. Б. Демидов 3, М. В. Флинт 3
1 Биологический факультет, Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
2 НИИ Физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт Океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: belevich@mail.bio.msu.ru
Поступила в редакцию 22.03.2022
После доработки 18.04.2022
Принята к публикации 28.04.2022
- EDN: BTVESL
- DOI: 10.31857/S0030157422050021
Аннотация
По материалам 83-го рейса НИС “Академик Мстислав Келдыш” (июнь 2021 г.) в Карское море получены оценки численности, биомассы и содержания хлорофилла “a” пикофитопланктона (ПФ), вклада пикоформ в суммарное содержание хлорофилла и определен состав фотоавтотрофных пикоэукариот (<3 мкм) в период схода сезонного льда. Численность ПФ колебалась от 0.25 до 4.91 × × 109 кл/м3, биомасса – от 0.34 до 2.49 мг С/м3. Минимальное обилие выявлено в районах, непосредственно примыкающих к ледовой кромке. Вклад пикофракции в суммарный хлорофилл “a” в фотическом слое варьировал от 3 до 28%, достигая максимума на станциях, свободных ото льда более 5 суток. ПФ был представлен цианобактериями и эукариотическими водорослями. Доля цианобактерий в суммарной биомассе ПФ колебалась от 0.2 до 1.8%. Метагеномное секвенирование области V4 гена 18S рРНК показало, что в поверхностном слое у ледовой кромки при “цветении” крупного диатомового фитопланктона в составе пикоэукариот доминирует мелкая центрическая диатомовая водоросль Chaetoceros socialis; в районах свободных ото льда более 5 суток максимум микрофитопланктона опускается на нижний горизонт верхнего перемешанного слоя и в поверхностном слое развиваются мелкие флагелляты Micromonas polaris, Phaeocystis pouchetii и Pyramimonas diskoicola.
К пикофитопланктону (ПФ) относят фототрофные цианобактерии и эукариотические водоросли с размером клеток менее 2 мкм [45], или, согласно более поздним работам [37, 53] – менее 3 мкм. ПФ играет значительную роль в функционировании планктонных сообществ, давая существенный вклад в биомассу фитопланктона и первичную продукцию в разных районах Мирового океана [16].
Абиотические условия Арктики в последние десятилетия существенно меняются. В частности, увеличивается температура поверхностного слоя океана [25], уменьшается площадь и толщина ледового покрова, возрастает сток рек [35, 41]. Это сопровождается более ранним весенним таянием сезонного льда и поздним ледоставом, увеличением подводной освещенности и изменением сроков сезонного развития фитопланктона [49, 50, 55]. Увеличение освещенности может приводить к возрастанию первичной продукции планктона в основном за счет продукции диатомей [20]. В тоже время в поверхностных водах при низком содержании биогенных элементов прогнозируется сдвиг размерной структуры фитопланктона в сторону преобладания мелкоклеточных водорослей [38], что приведет к трансформации трофических цепей и потоков вещества в арктических экосистемах.
Карское море – типичный внутриконтинентальный арктический бассейн, большую часть года покрытый льдом и принимающий в себя большие объемы речного стока [6, 28]. Исследования Карского моря ранее охватывали в основном безледные периоды – лето и осень. Эти работы включали оценки обилия, видового состава и пространственного распределения фитопланктона, а также роли ПФ в фитоценозах [2–4, 9–13]. Период схода льда, несмотря на его важность для понимания годового цикла карской экосистемы, не был рассмотрен сколько-нибудь подробно и из-за труднодоступности моря весной. Единственные до настоящего времени исследования фитопланктона, охватывающие периоды поздней зимы (февраль–март 2017 г.) и ранней весны (март–апрель 2016 г.), были проведены в юго-западной части Карского моря и включали данные только по поверхностному слою [8, 14].
Цель настоящей работы – оценка численности и биомассы пикофитопланктона, содержания хлорофилла “a” пикофракции, вклада пикоформ в суммарную концентрацию хлорофилла, вертикального распределения и таксономического состава фототрофных пикоэукариот в Карском море в период схода сезонного льда.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы для настоящей работы получены в 83 рейсе НИС “Академик Мстислав Келдыш” в Карское море в третьей декаде июня 2021 г. На разрезе вдоль ледовой кромки было выполнено восемь станций (рис. 1).
Рис. 1.
Схема положения границы сезонного льда в период исследований и локализация станций в Карском море.

Данные о среде. Распределение температуры, электропроводности и флуоресценции оценивали на основании данных вертикального зондирования CTD-зондом SBE-911 Plus (Seabird Electronics). Интенсивность надводной и подводной облученности в диапазоне фотосинтетически активной радиации (ФАР) измеряли с использованием, соответственно, датчиков LI‑190 и LI‑192 (LI-COR, США). Подводная облученность определялась в режиме зондирования до глубин ~60–80 м, а на мелководных станциях – до дна. Данные зондирования подводной облученности были использованы для определения глубины фотической зоны (Zeu) (1% ФАР). Пробы для оценки содержания биогенных элементов отбирали их тех же батометров, что и пробы фитопланктона. Концентрацию P-PO4, N-NO3, N-NO2 и Si(OH)4 определяли согласно методам [30]. Данные по азоту нитратной и нитритной формам суммировали и далее в тексте обозначали как Nнеорг. Данные о ледовой обстановке получены с портала SIOWS: Arctic portal – Oceanographic investigations of the Arctic ocean (http://siows.solab.rshu.ru).
Отбор проб. Пробы воды на станциях отбирали 10-литровыми пластиковыми батометрами комплекса Carousel Water Sampler с нескольких горизонтов: в верхнем квазиоднородном слое, в пикногалоклине и/или в слое максимума флуоресценции и с глубин ниже пикноклина. Всего отобрано и проанализировано 44 пробы.
Определение количественных параметров ПФ. Подсчет численности фотосинтезирующих пикоформ (цианобактерий и эукариот) проводили с использованием люминесцентного микроскопа Leica DM1000 по методике, изложенной в работе [1]. Для расчета биомассы содержание углерода в клетках цианобактерий принимали равным 470 фг С/кл [54], а в клетках пикоэукариот определяли по клеточным объемам (Wкл) с использованием зависимости lg C = 0.941 lg W – 0.60 [27]. Объем клеток пикоэукариот рассчитывали, исходя из объема соответствующих стереометрических фигур [54].
Определение содержания хл “а”. При определении концентрации суммарного хлорофилла “a” (ХЛсум) пробы воды объемом 0.25–0.5 л фильтровали через фильтры GF/F. Для определения концентрации хл “a” пикофракции (ХЛпико) пробы воды объемом 0.5–1 л осаждали на фильтры с диаметром пор 3 мкм. Концентрацию ХЛпико вычисляли как разницу значений ХЛсум и фракции более 3 мкм, определенных флуориметрически в ацетоновом экстракте [17], используя флуориметр Trilogy Turner Designs (США).
Определение таксономического состава фототрофных пикоэукариот (ФПЭ). Оценка таксономического состава фотоавтотрофных пикоэукариот выполнена на двух станциях 7018 и 7021 в пробах воды объемом 3–5 л, отобранных с поверхностного горизонта, с горизонта максимума флуоресценции хлорофилла, а на ст. 7018 также с горизонта ниже фотической зоны. Для удаления нано- и микропланктона пробу воды предварительно пропускали через камеру обратной фильтрации (диаметр пор фильтра 3 мкм), фильтрат осаждали на картридж Sterivex (Millipore, США) с диаметром пор 0.2 мкм, заполняли его лизирующим раствором (50 мM Tris-HCl, 0.75 M сахарозы и 40 мM EDTA; pH 8.3), замораживали и хранили в жидком азоте до дальнейшего анализа.
Выделение, амплификация и секвенирование ДНК. Для выделения ДНК использовали набор “Nucleospin Plant” (Macherey-Nagel, Германия), амплификацию проводили с праймерами EuF-V4 (прямой) и picoR2 (обратный) на область V4 гена 18S рРНК [22]. Для амплификации использовали набор Encyclo Plus PCR Kit (ЗАО “Евроген”, Россия). Условия амплификации следующие: начальная денатурация 94° – 3 мин; 30 циклов: 94° – 20 с, отжиг праймеров 64° – 20 с, элонгация 72° – 40 с, заключительная элонгация 5 мин. Продукты амплификации были отделены от праймеров препаративным электрофорезом в 1% агарозном гелe c последующим выделением из агарозы с помощью набора MinElute Gel Extraction Kit (“Qiagen”, США). Секвенирование ПЦР продуктов осуществлялось ООО “БиоСпарк” (http://biospark.pro) на платформе “Illumina MiSeq” (США).
Биоинформационный анализ. Анализ полученных по результатам секвенирования нуклеотидных последовательностей, длина которых составляла около 250 н.о., был проведен с использованием алгоритма DADA2 в R (v3.5.2) [23]. Биоинформационная обработка включала фильтрацию по качеству и длине, объединение прямых и обратных прочтений, учет одинаковых последовательностей, исключение синглетонов, удаление химерных последовательностей. Дальнейшая классификация проводилась с использованием метода варианта последовательности ампликона (ASV) согласно протоколу (Vaulot 2018; Tutorial R Dada2 metabarcode analysis https://vaulot.github.io/tutorials/R_dada2_tutorial.html#load-the-necessary-libraries). Для таксономического анализа классификацию полученных ASVs проводили по базе Protist Ribosomal Reference database (PR2 version 4.12.0 https://github.com/pr2database/pr2database/releases/). Уровень сходства для всех таксономических уровней превышал 97%.
РЕЗУЛЬТАТЫ
Абиотические параметры и биогенные элементы. Анализ ледовых карт в период исследования позволил установить сроки освобождения ото льда районов, где выполнены станции разреза. Для разных станций они составили от одного до пяти дней (табл. 1). Температура поверхностного слоя воды на разрезе изменялась от 1.6°С на южной станции до –1.5°С на северных (табл. 1). Соленость поверхностного слоя на станциях 7015–7020 менялась незначительно и составляла 32–33 PSU. На двух северных станциях разреза – 7021 и 7023, соленость снижалась до 30 и 31 PSU соответственно (табл. 1). На станции 7021 граница пикногалоклина располагалась на глубине 4 м, на остальных станциях ее положение варьировало от 5 м (ст. 7015) до 22 м (ст. 7019). Глубина фотической зоны изменялась от 17 м (ст. 7023) до 38 м (ст. 7015) (табл. 1).
Таблица 1.
Время, прошедшее после схода сезонного льда в районе станции (t, сутки), глубина на станции (Н, м), глубина фотической зоны (Zeu, м), значения температуры (То, °С) и солености (Sо, PSU) поверхности моря, концентрации неорганических форм азота, фосфора и кремния (μМ), численность ПФ (N, ×109 кл/м3), биомасса ПФ (В, мг С/м3), общая концентрация хлорофилла “а” (ХЛсум, мг/м3), концентрация хлорофилла “а” пикофракции (ХЛпико, мг/м3); значения для поверхностного слоя (ПС), средние значения этих для фотического слоя (ФС) на станциях разреза
| Станция | Дата отбора |
t | Н | Zeu | ПС | ФС | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| То | Sо | PO4 | NО2 + NO3 | Si | N | B | ХЛсум | ХЛпико | PO4 | NО2 + NO3 | Si | N | B | ХЛсум | ХЛпико | |||||
| 7015 | 22.06 | 5 | 238 | 38 | 1.6 | 32.2 | 0.12 | 0.16 | 1.07 | 0.45 | 0.26 | 0.62 | 0.08 | 0.33 | 3.26 | 3.26 | 2.46 | 1.40 | 0.4 | 0.11 |
| 7016 | 23.06 | 5 | 242 | 18 | 1.3 | 32.5 | 0.07 | 0.05 | 1.01 | 3.24 | 0.77 | 0.99 | 0.06 | 0.12 | 0.55 | 0.96 | 4.92 | 1.50 | 2.77 | 0.20 |
| 7017 | 23.06 | 5 | 180 | 30 | 0.1 | 32.4 | 0.20 | 0.31 | 0.10 | 5.38 | 1.99 | 0.85 | 0.06 | 0.21 | 1.08 | 0.62 | 3.15 | 1.74 | 1.84 | 0.11 |
| 7018 | 24.06 | 3 | 147 | 18 | –0.8 | 32.0 | 0.11 | 0.49 | 0.51 | 1.09 | 0.83 | 3.64 | 0.18 | 0.14 | 0.54 | 0.52 | 1.65 | 1.62 | 5.22 | 0.17 |
| 7019 | 25.06 | 3 | 270 | 22 | –0.2 | 32.9 | 0.13 | 0.26 | 0.56 | 1.52 | 0.99 | 1.48 | 0.15 | 0.11 | 0.27 | 0.54 | 1.52 | 1.78 | 3.34 | 0.20 |
| 7020 | 26.06 | 1 | 151 | 22 | –1.4 | 32.5 | 0.13 | 0.16 | 0.86 | 3.18 | 1.47 | 2.58 | 0.27 | 0.16 | 0.90 | 1.34 | 3.76 | 2.38 | 3.08 | 0.24 |
| 7021 | 26.06 | 0 | 70 | 18 | –1.5 | 30.2 | 0.38 | 1.21 | 13.77 | 0.21 | 0.30 | 1.54 | 0.05 | 0.36 | 1.52 | 12.14 | 0.25 | 0.34 | 1.14 | 0.04 |
| 7023 | 27.06 | 0 | 85 | 17 | –1.3 | 31.3 | 0.22 | 0.05 | 5.26 | 0.43 | 0.27 | 2.73 | 0.08 | 0.21 | 0.40 | 4.63 | 0.81 | 0.54 | 2.82 | 0.07 |
Концентрация минеральных форм азота, фосфора и кремния в верхнем перемешанном слое на разрезе была низкая и составила в среднем 0.21 ± ± 0.16, 0.14 ± 0.05 и 1.34 ± 1.76 μМ/л, соответственно (табл. 1). Исключение составила ст. 7021 в северной части разреза, где содержание всех биогенных элементов было выше, и составило для азота – 1.11 μМ/л, фосфора – 0.38 μМ/л и кремния – 13.82 μМ/л. С глубиной на всех станциях концентрация азота и фосфора увеличивалась, достигая в слоях под пикногалоклином 6.37–9.90 и 0.52–0.69 μМ/л, соответственно. Такая же тенденция отмечена и для кремния – его концентрация с глубиной возрастает до значений 6.27–9.38 μМ/л за исключением ст. 7021, где его содержание, наоборот, снижается с глубиной более чем в 2 раза. На разных горизонтах соотношение минерального азота к фосфору (NO3 + NO2) : PO4 изменялось от 0.1 до 15.2, что ниже значений числа Редфильда, составляющего 16 : 1.
Таким образом, рост и развитие фитопланктона, в том числе его пикофракции в верхнем перемешанном слое в исследованный период скорее всего были лимитированы азотом.
Численность и биомасса ПФ. В июне в поверхностном слое Карского моря обилие ПФ колебалось в значительных пределах. Численность варьировала от 0.21 до 5.38 × 109 кл/м3, биомасса – от 0.26 до 1.99 мг С/м3 (табл. 1). Минимальные значения обоих параметров выявлены на самой южной (7015) и самых северных (7021, 7023) станциях разреза. В целом в фотическом слое средние значения численности и биомассы ПФ изменялись более, чем на порядок – от 0.25 до 4.91 × × 109 кл/м3 и от 0.34 до 2.49 мг С/м3, соответственно. Минимальные величины обилия ПФ в фотическом слое отмечены на северных станциях разреза (7021, 7023) (табл. 1).
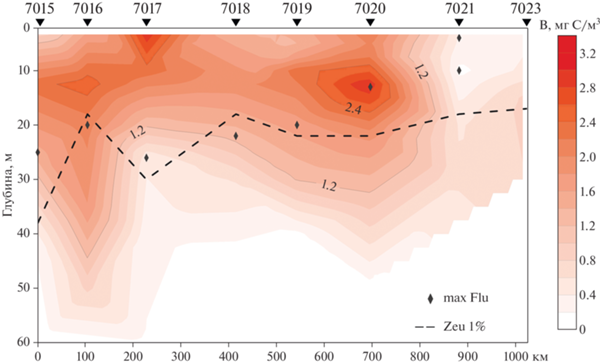
Анализ вертикального распределения биомассы ПФ на разрезе показал, что максимальные значения были приурочены к поверхностному горизонту (ст. 7017) или к верхнему 20-ти метровому слою и повсеместно располагались выше нижней границы Zeu (рис. 2).
Весенний ПФ был представлен цианобактериями и эукариотическими водорослями, последние доминировали в составе пикосообществ по численности и биомассе. Цианобактерии играли несущественную роль, были представлены одноклеточными формами и в основном были приурочены к поверхностному слою (ст. 7015, 7020, 7023), где их численность колебалась от 8 до 16 млн кл/м3. Исключение составила ст. 7021, где цианобактерии были выявлены на всех горизонтах. Их вклад в суммарную биомассу ПФ колебался от 0.2 до 1.8%.
Концентрация хлорофилла “а”. В поверхностном горизонте значения ХЛсум и ХЛпико составили в среднем 1.80 ± 1.06 и 0.12 ± 0.08 мг/м3 соответственно. В фотическом слое величины ХЛсум и ХЛпико варьировали от 0.40 до 5.22 мг /м3 и от 0.04 до 0.19 мг /м3, соответственно. На ст. 7015 отмечены наименьшие значения ХЛсум, в то время как минимальные величины ХЛпико выявлены на ст. 7021 (табл. 1). Вклад ХЛпико в ХЛсум в поверхностном горизонте колебался от 3 до 14%, в фотическом слое в целом – от 3 до 28%. Наибольший относительный вклад ХЛпико в суммарный хлорофилл был отмечен в фотическом слое самой южной ст. 7015 в районе свободном от сезонного льда наиболее продолжительное время, а также на станциях 7020 и 7021 ниже фотического слоя, где ледовый покров только начал сходить (рис. 3).
Состав пикоэукариот. Видовой состав ФПЭ включал представителей пяти крупных филогенетических групп: Ochrophyta, Chlorophyta, Cryptophyta, Haptophyta и Dinoflagellata. Наибольшим разнообразием характеризовались отделы Ochrophyta и Chlorophyta, представленные пятью (Chrysophyceae, Bacillariophyta, Bolidophyceae, Pelagophyceae и Dictyochophyceae) и четырьмя (Mamiellophyceae, Trebouxiophyceae, Pyramimonadales и Palmophyllophyceae) классами водорослей, соответственно.
В поверхностном горизонте ст. 7018 по числу прочтений доминировали гаптофитовые водоросли и зеленые водоросли класса Mamiellophyceae (рис. 4). Основной вклад вносили Micromonas polaris (Mamiellophyceae) и Phaeocystis pouchetii (Haptophyta), давая 31 и 30% от общего числа прочтений соответственно. Существенную роль в поверхностном слое играли Pyramimonas diskoicola (Chlorophyta) (10%) и диктиохофициевые водоросли (6%). На горизонте максимума флюоресценции (22 м) относительное число прочтений M. polaris, P. pouchetii и P. diskoicola падает до 10%, 13 и 3% соответственно, а доля Dictyochophyceae существенно возрастает – до 41%, основной вклад вносит некультивированный представитель рода Florenciella sp. (40%). Также в слое максимума флюоресценции выявлена относительно высокая доля криптофитовых водорослей – 13%, из которых большая часть (54%) относилась к Baffinella frigidus.
Рис. 4.
Вертикальное распределение вклада различных таксономических групп пикофитопланктона в общее число прочтений на ст. 7018 и ст. 7021.

Ниже Zeu, на горизонте 45 м, в составе ФПЭ доминировали диатомовые водоросли, составляя более 40% от общего числа прочтений. Основной вклад вносили последовательности рода Detonula (23%) и Fragilariopsis cylindrus (9%). Гаптофитовые водоросли были второй по обилию группой, их доля в общем числе прочтений достигала 32%. Основную роль среди Haptophyta играли неидентифицированные представители этой группы, отнесенные к кладе НАР4 и составляющие более 80% от всех последовательностей этого таксона. Помимо диатомовых и гаптофитовых водорослей следует отметить присутствие Dinophyceae и Chrysophyceaе, их вклад составил 8 и 9%, соответственно. В составе динофитовых водорослей доминировал Prorоcentrum sp. (5%), в составе Chrysophyceaе – неидентифицированный представитель (unc. Chrysophyceae) – 7%.
На ст. 7021 в поверхностном горизонте и на глубине 10 м в составе ФПЭ преобладали диатомовые водоросли (рис. 4). Доля прочтений Bacillariophyta в поверхностном слое составила 46% и увеличивалась с глубиной, достигая 63% на горизонте 10 м (рис. 4). Основной вклад вносили последовательности Chaetoceros socialis, относительное обилие которого на горизонтах 0 м и 10 м составило 40% и 59% от общего числа прочтений соответственно. Dinophyceae была второй по численности группой, доля динофлагеллят с глубиной снижалась от 17% на поверхности до 11% на горизонте 10 м. В отличие от ст. 7018 на ст. 7021 доля гаптофитовых водорослей и зеленых водорослей класса Mamiellophyceae была низкая, последовательности этих групп в сумме давали лишь 17% от всех прочтений на обоих исследуемых горизонтах. В составе Mamiellophyceae основной вклад в число прочтений вносили последовательности Mantoniella squamata, составляя 10% всех прочтений, в то время как доля M. polaris не превышала 1%.
Проведенный филогенетический анализ также выявил представителей Palmophyllophyceae, Trebouxiophyceae, Bolidophyceae и Pelagophyceae. Суммарный вклад последовательностей водорослей этих классов на станциях 7018 и 7021 варьировал по горизонтам от 0.5% до 1.5%. До уровня рода и/или вида идентифицированы Picochlorum sp. и Trebouxia jamesii (Trebouxiophyceae), Pelagomonas calceolate (Pelagophyceae) и Triparma strigata (Bolidophyceae).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные характеристики пространственного распределения численности и биомассы ПФ, вертикального распределения видового состава эукариотных водорослей, входящих в состав пикофракции планктона в Карском море во время схода сезонного льда, а также оценка содержания хл “a” ПФ и вклада пикоформ в суммарное содержание хл “а” в фотической зоне показали следующее. В период исследования сообщество фитопланктона находилось в стадии весеннего развития – у отступающей кромки льда выявлены высокие значения суммарной первичной продукции и хлорофилла “а” за счет доминирования в фитопланктоне крупных диатомовых водорослей родов Thalassiosira, Bacterosira и Porosira [5].
Полученные для весеннего периода оценки ХЛпико в фотическом слое (0.14 мг/м3) сопоставимы с концентрацией хлорофилла “а” пикофракции, выявленной в исследованном районе Карского моря в августе-сентябре 2017 г. (0.12 мг/м3) [2]. В поверхностных водах центральной части Арктического бассейна в августе 2010 г. при плотности ледового покрова 70% отмечены близкие величины ХЛпико (0.11 мг/м3) [57]. Средняя для фотического слоя величина ХЛсум, полученная нами в последней декаде июня 2021 (2.58 мг/м3), была более, чем в три раза выше таковой, зарегистрированной в августе–сентябре (0.74 мг/м3) 2017 г. [2]. В период наблюдений среднее значение концентрации ХЛсум в поверхностном слое было существенно выше чем в юго-западной части Карского моря в марте–апреле 2016 г (0.13 мг /м3) [8] и в феврале–марте 2017 г (0.62 мг /м3) [14]. Сопоставление данных показывает, что весной средний вклад пикофракции в суммарное содержание хлорофилла “a” (8%) в Карском море существенно ниже, чем осенью 2017 г. (29%) [2].
Данные по обилию ПФ весной в период схода сезонного льда в морях российской Арктики отсутствуют. Сравнение полученных нами значений с величинами, известными для других сезонов в Карском море показали, что биомасса ПФ в третьей декаде июня 2021 г. была ниже значений, полученных в августе–сентябре 2017 (0.19–4.27 мг С/м3) [2] и существенно ниже величин, полученных для западного района моря в сентябре 2011 г. (3.2–7.9 мг С/м3) [13]. Весной в период цветения микрофитопланктона численность ПФ и его доля в суммарной концентрации хлорофилла “а” невелики.
В составе ПФ были выявлены одноклеточные цианобактерии, их численность и вклад в суммарную биомассу были низкими и сопоставимы с таковыми, полученными в сентябре 2017 г для северо-западной части Карского моря (20 × 106 кл/м3 и 1%) [2]. В тоже время выявленные значения обилия были на порядок ниже зафиксированных в районе 80°С с.ш. во фьордах Шпицбергена в июне 2019 г. (80–8300 × 106 кл/м3) [40]. В морских арктических водах пикоцианобактерии представлены родом Synechococcus. Некоторые авторы предполагают, что основным источником цианобактерий является речной сток или перенос в результате адвекции из прилегающих морей [29, 56], в то время как другая гипотеза говорит о существовании автохтонных для арктических вод и адаптированных к низким температурам Synechococcus [26, 33]. Приуроченность цианобактерий к поверхностному горизонту водной толщи ранее была показана для осеннего ПФ Карского моря и была связана с регулярно регистрирующейся поверхностной опресненной “линзой”, формирующейся стоком рек Оби и Енисея [3, 7]. Весной в период схода сезонного льда источником цианобактерий может служить присутствие в этом районе “прошлогодних” вод материкового происхождения, что подтверждается высокими значениями концентрации кремния и пониженной соленостью в поверхностных водах ст. 7021 и 7023. Также источником Synechococcus может служить тающий лед, при разрушении которого происходит обогащение поверхностного слоя ледовыми цианобактериями [40].
Применение фракционной фильтрации для анализа разнообразия пикофитопланктона метагеномным подходом не дает полного отделения пикофракции от нано- и микроорганизмов [48, 53]. Присутствие последовательностей крупных диатомовых водорослей (Detonula sp., Fr. cylindrus и др.) в составе пикофракции объясняется их высоким обилием в период исследований и, как следствие, присутствием в воде пула растворенной ДНК этих организмов. Однако использование фракционирования способствует снижению риска недоучета пикоформ из-за малого числа копий их генов [58].
Состав доминирующих видов и вертикальное распределение пикоэукариот на двух исследованных станциях существенно различался. На ст. 7018, где с момента полного схода льда прошло более 3-х суток, “цветение” крупного диатомового планктона на фоне низкого содержания биогенных элементов в поверхностном было приурочено к глубинам 19–22 м, о чем свидетельствуют характер вертикального распределения суммарного хлорофилла “а”. В верхнем обедненном биогенными элементами слое начинают развиваться мелкие фотосинтезирующие жгутиковые водоросли M. polaris, P. pouchetii и P. diskoicola. Первые два вида являются типичными представителями ПФ арктических морей. Высокое обилие M. polaris ранее было отмечено в пикофракции осеннего планктона Карского моря [4], летнего планктона моря Бофорта [21], во время весеннего цветения в центральной части Арктического океана [44]. В проливе Фрама вклад вида в число последовательностей класса Mamiellophyceae достигал 66% [51]. “Цветение”, вызванное примнезиофитовой водорослью Ph. pouchetii, ранее уже было отмечено в апреле 2017 г. в проливе Карские ворота [8], в июле-августе 2007 и 2013 гг. в канадских фьордах моря Лабрадора [46], в мае 1989 г. в Гренландском море [47], в море Баффина в апреле 2011 г. [31]. Клеточные размеры P. diskoicola выходят за рамки пикофракции (длина 8.26 ± 2.6 мкм, ширина 5.14 ± 0.8 мкм) [31], его относительно высокое обилие в пикофракции вероятно связано с особенностями методики получения проб – клетки этой водоросли имеют эластичную клеточную стенку и могут проходить через 3-х микронные поры фильтра. Арктическая флагеллята P. diskoicola обитает преимущественно во льду и ранее была выявлена в период весеннего цветения в море Баффина [31, 43]. При том, что с глубиной обилие этой водоросли значительно снижается, можно предположить, что основным источником поступления P. diskoicola в поверхностные воды служит растаявший лед.
На ст. 7021, где отбор проходил непосредственно у ледовой кромки, “цветение” фитопланктона наблюдалось в условиях высокого уровня освещенности [5] и относительно высоких концентраций биогенных элементов. Проведенный метагеномный анализ показал, что в размерный состав центрических диатомовых водорослей, формирующих “цветение”, входил мелкоклеточный Ch. socialis, вносивший основной вклад в пикофракцию фитопланктона. Высокое обилие Ch. socialis было выявлено во всем верхнем 10-ти метровом слое.
Согласно концепции “драйверов цветения” фитопланктона видовой состав и размерные группы, вызывающие его весеннее “цветение”, определяются такими факторами как освещенность, температура, доступность азота и кремния [19]. Весной в арктическом океане в составе сообществ фитопланктона доминируют диатомовые водоросли [36, 42]. Такая картина наблюдается при росте освещенности в условиях полярного дня и высоком содержании биогенных элементов, в особенности растворенного кремния, критически необходимого для их роста. При истощении биогенных элементов в результате “цветения” диатомового фитопланктона и последующем его опускании на нижние горизонты в поверхностном слое начинают развиваться мелкие флагелляты, такие как Phaeocystis sp. [18]. С одной стороны, показанные различия в составе и распределении пикофитопланктона на станциях 7018 и 7021 укладываются в данную концепцию. С другой стороны, нельзя не учитывать особенности Карского моря, которое, являясь внутриконтинентальным водоемом, находится под воздействием мощного речного стока. Вследствие этого гидрологические и гидрохимические условия в Карском море существенно отличаются от таковых в открытых водах арктического бассейна. Эти условия отражаются, прежде всего, на характере снабжения биогенными элементами фотического слоя. Сезонная конвекция и, как следствие, поступление биогенов в приповерхностный продуцирующий слой, в Карском море в значительной степени блокируется выраженной стратификацией водной толщи, связанной с опреснением верхнего перемешанного слоя речным стоком, оказывающим влияние на большинство районов шельфа [39]. При этом воздействие речного стока может прослеживаться круглый год, в том числе и весной. Причинами тому могут быть, по-видимому, как сохранение прошлогодних речных вод в приповерхностном слое [15], так и их поступление в зимний период [32, 34]. Таким образом, реки могут быть источником минерального питания, в первую очередь растворенного кремния, для весеннего развития диатомового фитопланктона.
При наблюдаемом климатическом тренде в целом происходит более раннее освобождение акваторий северных морей ото льда. Как следствие этого процесса, сроки “цветения” фитопланктона будут наступать раньше, и, соответственно, в ходе сезонной сукцессии размерная структура фитопланктонных сообществ будет сдвинута в сторону доминирования мелкоклеточных форм в поверхностных слоях моря в более ранние сроки. Такие изменения в структуре звена первичных продуцентов могут сказаться на функционировании всех последующих трофических уровней, и привести к соответствующей перестройке экосистем шельфовых арктических морей [18, 24, 52].
Благодарности. Авторы благодарят А.А. Полухина и С.А. Щуку за предоставленные материалы по гидрофизическим и гидрохимическим данным.
Источники финансирования. Работа выполнена в рамках тем Государственного МГУ имени М.В. Ломоносова часть 2 (тема №№ 121032300135-7 и АААА-А17-117120540067-0) и Программы развития Междисциплинарной научно-образовательной школы Московского государственного университета имени М.В. Ломоносова “Будущее планеты и глобальные изменения окружающей среды”. Экспедиционные исследования проведены при финансовой поддержке Министерства науки и высшего образования РФ (целевое финансирование на проведение морских экспедиций).
Список литературы
Белевич Т.А., Ильяш Л.В., Милютина И.А. и др. Обилие и видовой состав фототрофных пикоэукариот Онежского залива Белого моря // Вест. Моск. ун-та. Серия 16: Биология. 2017. Т. 72. № 3. С. 128–134.
Белевич Т.А., Ильяш Л.В., Демидов А.Б. и др. Распределение пикофитопланктона на Обском разрезе и в западной части Карского моря // Океанология. 2019. Т. 59. С. 964–973.
Белевич Т.А., Милютина И.А., Троицкий А.В. и др. Пикофитопланктон залива Благополучия (архипелаг Новая Земля) и прилегающего района Карского моря // Океанология. 2020. Т. 60. № 4. С. 545–555.
Белевич Т.А., Милютина И.А. Видовое разнообразие фототрофного пикопланктона морей Карского и Лаптевых // Микробиология. 2022. Т. 91. № 1. С. 75–85.
Демидов А.Б., Сергеева В.М., Гагарин В.И. и др. Первичная продукция и хлорофилл размерных групп фитопланктона Карского моря в период схода сезонного льда // Океанология. 2022. Т. 62. № 3. С. 403–415.
Добровольский А.Д., Залогин Б.С. Моря СССР. М.: Изд-во МГУ, 1982. 192 с.
Зацепин А.Г., Завьялов П.О., Кременецкий В.В. и др. Поверхностный опресненный слой в Карском море // Океанология. 2010. Т. 50. № 5. С. 698–708.
Сажин А.Ф., Мошаров С.А., Романова Н.Д. и др. Планктонное сообщество Карского моря ранней весной // Океанология. 2017. Т. 57. № 1. С. 246–248.
Сергеева В.М., Суханова И.Н., Дружкова Е.И. и др. Структура и распределение фитопланктона в глубоководных районах северной части Карского моря // Океанология. 2016. Т. 56. № 1. С. 113–119.
Суханова И.Н., Флинт М.В., Мошаров С.А. и др. Структура сообществ фитопланктона и первичная продукция в Обском эстуарии и на прилежащем Карском шельфе // Океанология. 2010. Т. 50. № 5. С. 785–800.
Суханова И.Н., Флинт М.В., Сергеева В.М. и др. Фитопланктон юго-западной части Карского моря // Океанология. 2011. Т. 51. № 6. С. 1039–1053.
Суханова. И. Н., Флинт М. В., Сергеева В. М. Фитопланктон поверхностной опресненной линзы Карского моря // Океанология. 2012. Т. 52. № 5. С. 688–699.
Суханова И.Н., Флинт М.В., Дружкова Е.И. и др. Фитопланктон северо-западной части Карского моря // Океанология. 2015. Т. 55. №4. С. 605–619.
Федулов В.Ю., Беляев Н.А., Колоколова А.Н., Сажин А.Ф. Базовые геохимические параметры верхнего слоя вод юго-западной части Карского моря в зимний период 2018 // Океанологические исследования. 2018. Т. 46. № 1. С. 115–122.
Флинт М.В. 54-й экспедиционный рейс научно-исследовательского судна “Академик Мстислав Келдыш” в Карское море // Океанология. 2010. Т. 50. № 5. С. 677–682.
Agawin N.S.R., Duarte C.M., Agusti S. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production // Limnol. Oceanogr. 2000. V. 45. № 8. P. 1891–1899.
Arar E.J., Collins G.B. Method 445.0. in vitro determination of chlorophyll “a” and pheophytin “a” in marine and freshwater algae by fluorescence. Revision 1.2. Cincinnati: U.S. Environmental Protection Agency. 1997. 22 p.
Ardyna M., Babin M., Gosselin M. et al. Recent Arctic Ocean seaice loss triggers novel fall phytoplankton blooms // Geophys. Res. Lett. 2014. 41(17). P. 6207–6212. https://doi.org/10.1002/2014GL061047
Ardyna M., Mundy C. J., Mills M.M. et al. Environmental drivers of under-ice phytoplankton bloom dynamics in the Arctic Ocean // Elem. Sci. Anth. 2020. 8. P. 30. https://doi.org/10.1525/elementa.430
Arrigo K.R., Perovich D.K., Pickart R.S. et al. Massive Phytoplankton Blooms Under Arctic Sea Ice // Science. 2012. V. 336. № 6087. P. 1408.
Balzano S., Marie D., Gourvil P., Vaulot D. Composition of the summer photosynthetic pico and nanoplankton communities in the Beaufort Sea assessed by T-RFLP and sequences of the 18S rRNA gene from flow cytometry sorted samples // ISME J. 2012. V. 6. № 8. P. 1480–1498.
Belevich T.A., Ilyash, L.V., Milyutina, I.A. et al. Photosynthetic picoeukaryotes in the land-fast ice of the White Sea, Russia // Microb. Ecol. 2018. 75. P. 582–597.
Callahan B.J., McMurdie P.J., Rosen M.J. et al. Bioconductor Workflow for Microbiome Data Analysis: from raw reads to community analyses [version 2; peer review: 3 approved] F1000Research. 2016. 5. P. 1492–1541.
Carmack E.C., Williams W., Zimmerman S. et al. The Arctic Ocean warms from below // Geophys. Res. Lett. 2012. 39. L07604. https://doi.org/10.1029/2012GL050890
Comiso J.C., Hall D.K. Climate Trends in the Arctic // WIREs Clim. Change. 2014. V. 5. P. 389–409.
Cottrell M.T., Kirchman D.L. Photoheterotrophic microbes in the arctic ocean in summer and winter // Appl. Environ. Microbiol. 2009. V. 75. № 15. P. 4958–4966.
DuRand M.D., Olson R.J., Chisholm S.W. Phytoplankton population dynamics at the Bermuda Atlantic time-series station in the Sargasso Sea // Deep-Sea Research II. 2001. V. 48. P. 1983–2003.
Gordeev V.V., Martin J.M., Sidorov I.S., Sidorova M.V. A reassessment of the Eurasian river input of water, sediment, major elements and nutrients to the Arctic Ocean // Am. J. Sci. 1996. V. 296. № 6. P. 664–691.
Gradinger R., Lenz J. Seasonal occurrence of picocyanobacteria in the Greenland Sea and central Arctic Ocean // Polar Biol. 1995. 15. P 447–452. https://doi.org/10.1007/BF00239722
Grasshoff K., Kremling K., Ehrhardt M. Methods of seawater analysis, 3rd edn. New York: Wiley, 1999.
Harðardóttir S., Lundholm N., Moestrup Ø. et al. Description of Pyramimonas diskoicola sp. nov. and the importance of the flagellate Pyramimonas (Prasinophyceae) in Greenland Sea ice during the winter–spring transition // Polar Biol. 2014. 37. P. 1479–1494. https://doi.org/10.1007/s00300-014-1538-2
Holmes R.M., McClelland J.W., Peterson B.J. et al. Seasonal and annual fluxes of nutrients and organic matter from large rivers to the Arctic Ocean and surrounding seas // Estuaries and Coasts. 2012. V. 35. P. 369–382.
Huang S., Wilhelm S.W., Harvey R. et al. Novel lineages of Prochlorococcus and Synechococcus in the global oceans // ISME J. 2012. V. 6. N 2. P. 285–297.
Le Fouest V., Babin M., Tremblay J.-É. The fate of riverine nutrients on Arctic shelves // Biogeosciences. 2013. V. 10. № 6. P. 3661–3677.
Macdonald R.W., Harner T., Fyfe J. Recent climate change in the Arctic and its impact on contaminant pathways and interpretation of temporal trend data // Science of The Total Environment. 2005. V. 342. № 1–3. P. 5–86.
Mei Z.P., Legendre L., Gratton Y. et al. Phytoplankton production in the North Water Polynya: size-fractions and carbon fluxes, April to July 1998 // Mar. Ecol. Prog. Ser. 2003. V. 256. P. 13–27.
Moon-van der Staay S.Y., De Wachter R., Vaulot D. Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity // Nature. 2001. V. 409. P. 607–610.
Moran X.A.G., Lopez-Urrutia A., Calvo-Diaz A. et al. Increasing importance of small phytoplankton in a warmer ocean // Glob Change Biol. 2010. 16(3). P. 1137–44.
Osadchiev A.A., Frey D., Shchuka S.A. et al. Structure of the freshened surface layer in the Kara Sea during ice-free periods //J. Geophys. Res. 2020. https://doi.org/10.1029/2020JC016486
Parli B.V., Bhaskar J.T., Jawak S. et al. Mixotrophic plankton and Synechococcus distribution in waters around Svalbard, Norway during June 2019 // Polar Science. 2021. V. 30. 100697.
Peterson B.J., Holmes R.H., McClelland J.W., et al. Increasing river discharge to the Arctic Ocean // Science. 2002. 289. P. 2171–2173.
Pesant S., Legendre L., Gosselin M. et al. Size-differential regimes of phytoplankton production in the Northeast Water Polynya (77°–81° N) // Mar. Ecol. Prog. Ser. 1996. V. 142. P. 75–86.
Ribeiro C.G., Lopes dos Santos A., Gourvil P. et al. Culturable diversity of Arctic phytoplankton during pack ice melting // Elem. Sci. Anth. 2020. 8: 6. https://doi.org/10.1525/elementa.401
Sherr E.B., Sherr B.F., Wheeler P.A. et al. Temporal and spatial variation in stocks ofautotrophic and heterotrophic microbes in the upper water column of the central Arctic Ocean // Deep-Sea Research I. 2003. V. 50. P. 557–571.
Sieburth J.M., Smetacek V., Lenz J. Pelagic ecosystem structure: heterotrophic compartments of the plankton and their relationships to plankton size fractions // Limnol. Oceanogr. 1978. V. 23. P. 1256–1263.
Simo-Matchim A.G., Gosselin M., Poulin M. et al. Summer and fall distribution of phytoplankton in relation to environmental variables in Labrador fjords, with special emphasis on Phaeocystis pouchetii // Mar. Ecol. Prog. Ser. 2017. 572. P. 19–42.
Smith W., Codispoti L., Nelson D. et al. Importance of Phaeocystis blooms in the high-latitude ocean carbon cycle // Nature. 1991. 352. P. 514–516. https://doi.org/10.1038/352514a0
Sørensen N., Daugbjerg N., Richardson K. Choice of pore size can introduce artefacts when filtering Picoeukaryotes for molecular biodiversity studies // Microb. Ecol. 2013. V. 65. P. 964–968.
Stroeve J., Notz D. Changing state of Arctic sea ice across all seasons // Environ. Res. Lett. 2018. 13. 103001. https://doi.org/10.1088/1748-9326/aade56
Tedesco L., Vichi M., Scoccimarro E. Sea-ice algal phenology in a warmer Arctic // Sci. Adv. 2019. 5. eaav4830.
Tragin M., Vaulot D. Novel diversity within marine Mamiellophyceae (Chlorophyta) unveiled by metabarcoding // Sci. Rep. 2019. 9. 5190.
Tremblay J.É., Robert D., Varela D.E. et al. Current state and trends in Canadian Arctic marine ecosystems: I. Primary production // Climatic Change 2012. 115. P. 161–178. https://doi.org/10.1007/s10584-012-0496-3
Vaulot D., Eikrem W., Viprey M., Moreau H. The diversity of small eukaryotic phytoplankton (≤3 µm) in marine ecosystems // FEMS Microb. Rev. 2008. V. 32. № 5. P. 795–820.
Verity P.G., Robertson C.Y., Tronzo C.R. et al. Relationship between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton // Limnol. Oceanogr. 1992. 37. P. 1434–1446.
Voosen P. New feedbacks speed up the demise of Arctic sea ice // Science. 2020. 369. 6507. P. 1043–1044. https://doi.org/10.1126/science.369.6507.1043
Waleron M., Waleron K., Vincent W.F. et al. Allochthonous inputs of riverine picocyanobacteria to coastal waters in the Arctic Ocean // FEMS Microbiol. Ecol. 2007. 59. P. 356–365.
Zhang F., He J., Lin L., Jin H. Dominance of picophytoplankton in the newly open surface water of the central Arctic Ocean // Polar Biol. 2015. 38. P. 1081–1089. https://doi.org/10.1007/s00300-015-1662-7
Zhu F., Massana R., Not F. et al. Mapping of picoeucaryotes in marine ecosystems with quantitative PCR of the 18S rRNA gene // FEMS Microbiol. Ecol. 2005. V. 52. P. 79–92.
Дополнительные материалы отсутствуют.