Океанология, 2023, T. 63, № 2, стр. 224-242
Влияние регионального потепления на первичную продукцию Карского моря в последние две декады (2002–2021 гг.)
А. Б. Демидов 1, *, В. И. Гагарин 1, С. В. Шеберстов 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: demspa@rambler.ru
Поступила в редакцию 15.08.2022
После доработки 23.08.2022
Принята к публикации 16.12.2022
- EDN: NUGIZY
- DOI: 10.31857/S0030157423020028
Аннотация
Межгодовая изменчивость первичной продукции (ПП) и влияющих на нее абиотических факторов исследована в Карском море с 2002 по 2021 г. по данным сканера цвета океана MODIS-Aqua и модельным расчетам. За 20 лет температура воды на поверхности (T0) возросла на 3.55°С при тренде 10% в год, а площадь акватории, свободной ото льда (S) увеличилась на 110 × 103 км2 при тренде 1.4% в год. ПП в столбе воды (ИПП) статистически достоверно (p < 0.05) уменьшалась во всех районах моря (R 2 = 0.22–0.59). Для всего Карского моря за две декады ИПП уменьшилась на 38 мгС/м2 в день при тренде 1.1% в год (R2 = 0.37). Средняя за вегетационный сезон величина фотосинтетически активной радиации (ФАР) слабо, но статистически достоверно (p < 0.05) уменьшалась во всех исследованных районах (R2 = 0.20–0.31). Во всех районах зарегистрированы достоверные слабые или умеренные отрицательные тренды содержания хлорофилла “а” на поверхности (Хл0) (R2 = = 0.24–0.38). Вместе с увеличением S на 0.7% в год увеличивалась годовая ПП всей акватории (ППтот) (R2 = 0.08). ИПП наиболее интенсивно снижалась в весенний период (R2 = 0.28). В осенний период отмечен статистически значимый положительный тренд S (R2 = 0.24). За счет этого осенью отмечено относительно быстрое увеличение ППтот. Сдерживающим рост ППтот фактором являлось снижение ИПП, вызванное сокращением поступления ФАР и уменьшением содержания Хл0. Незначительное увеличение ППтот происходило за счет осеннего периода. В основном оно происходило в северных районах моря. Снижение ИПП Карского моря должно отразиться на продуктивности высших трофических звеньев пищевой цепи.
ВВЕДЕНИЕ
Происходящее в последние декады быстрое потепление Арктики [19, 25, 27, 70] отражается на межгодовых изменениях экосистем Арктического океана (АО), в частности, на межгодовом тренде величине первичной продукции (ПП) всей акватории (ППтот) [2, 18–21, 33, 55, 56, 60, 61, 72]. Принято считать, что в АО годовая величина ППтот возрастает за счет уменьшения площади ледового покрова, происходящего из-за смещения сроков таяния льда весной и осеннего ледостава, соответственно, к началу и концу календарного года и, как следствие увеличения сроков вегетационного сезона [20, 25, 27, 29, 50, 54, 68–70, 77]. В тоже время, следует отметить, что интенсивность и направленность изменений ПП носят региональный характер [56, 60].
Карское море представляет собой эпиконтинентальный, изолированный островами с запада и востока от открытых акваторий АО бассейн, расположенный на евразийском шельфе. Его экосистема функционирует в условиях воздействия на нее интенсивного речного стока, главным образом Оби и Енисея [37, 39, 42, 53, 67]. Мелководный характер, частичная изолированность и речной сток сказываются на сезонной и межгодовой динамике ледового покрова и, как следствие, на долговременной изменчивости ППтот Карского моря [5, 19, 60].
Говоря о влиянии межгодовой динамики ледового покрова на долговременную изменчивость ППтот, не стоит забывать еще об одном, возможно основном, факторе, определяющем ее годовую величину. Речь идет о ПП, интегрированной в столбе воды до границы слоя фотосинтеза (ИПП, мгС/м2 в день). Этот показатель, собственно, и измеряется при проведении полевых исследований. При оценке годовой величины ППтот, а также исследованиях сезонной и межгодовой изменчивости этого показателя, ИПП рассчитывается с помощью моделей, входящими параметрами которых служат данные дистанционного зондирования, полученные сканерами цвета океана, установленными на спутниках [например, 51]. При этом, величина ИПП зависит от входящих параметров, которыми, при простейшем подходе, выступают концентрация хлорофилла “а” (хл “а”) на поверхности океана (Хл0) и фотосинтетически активная радиация (ФАР) [23]. Межгодовая изменчивость величин этих показателей является ключевым фактором, определяющим долговременную динамику ИПП. Следует отметить, что в настоящее время существуют противоречивые данные о знаке и величине межгодовых трендов ИПП в различных районах АО, а также о ее влиянии на ППтот [4–6, 18, 48, 60].
В эпоху потепления АО происходят изменения абиотических и биотических факторов, которые влияют на величины ИПП и ППтот. К ним относятся, в частности, температура поверхности океана (T0), площадь, свободная ото льда (S), количество фитопланктона в поверхностном слое, индексом которого принято считать величину Хл0, ФАР, годовая величина речного стока. Результаты исследования связей величин абиотических факторов с ИПП и ППтот призваны дать ответ на вопрос увеличивается или уменьшается первичная продуктивность Карского моря в эпоху потепления АО. Ответ на этот вопрос, в свою очередь, позволит дать прогноз относительно динамики продуктивности высших трофических звеньев в пелагиали и бентали моря, изменчивости вертикальных потоков органического вещества, а также характере обмена углекислым газом между океаном и атмосферой в этом регионе АО.
Исходя из сказанного выше, нами были сформулированы следующие цели настоящей работы: (1) – изучить межгодовую изменчивость продукционных параметров и влияющих на них факторов среды в Карском море в последние две декады (2002–2021 гг.); (2) – определить степень влияния в этот период различных абиотических и биотических факторов на величины ИПП и ППтот.
МАТЕРИАЛ И МЕТОДЫ
Районирование Карского моря. Границы Карского моря были определены, исходя из предыдущих работ по оценке ПП АО [45]. Опираясь на разработанную ранее классификацию водных масс [62] и подходы к районированию Карского моря [5, 32] на его открытой акватории мы выделили Юго-западный район (I), Район речного выноса (II) и Северный район, включающий желоба Св. Анны и Воронина (III). На рис. 1 границы районов Карского моря показаны на фоне среднемноголетней картины распределения ИПП. По сравнению с предыдущей работой [32] южная граница Района речного выноса, ориентированная на среднемноголетнее положение изогалины 25 на поверхности [62], была скорректирована, исходя из данных о положении квазистационарной распресненной линзы в районе Новой Земли [8, 49].
Региональные модели ИПП и хл “а”. Оценка ИПП фитопланктона проводилась с использованием эмпирических моделей. Эти модели были разработаны и верифицированы на основе базы данных, созданной по материалам экспедиций в Карское море в конце августа–начале октября [31, 32]. В качестве коэффициентов модели использованы средние для всей акватории величины эффективности утилизации солнечной энергии в столбе воды
(1)
$\psi = {{{\text{ДА}}{{{\text{Ч}}}_{{\text{с}}}}} \mathord{\left/ {\vphantom {{{\text{ДА}}{{{\text{Ч}}}_{{\text{с}}}}} {{\text{ФАР}},}}} \right. \kern-0em} {{\text{ФАР}},}}$(2)
$k = {{{\text{Х}}{{{\text{л}}}_{{{\text{фс}}}}}} \mathord{\left/ {\vphantom {{{\text{Х}}{{{\text{л}}}_{{{\text{фс}}}}}} {{\text{Х}}{{{\text{л}}}_{0}},}}} \right. \kern-0em} {{\text{Х}}{{{\text{л}}}_{0}},}}$Входящими в модель параметрами являются спутниковые данные о величинах содержания Хл0 и дневной приходящей ФАР. Таким образом, при использовании формул (1), (2), а также Хл0 и ФАР итоговое уравнение принимает вид
Известно, что стандартный алгоритм MODIS дает большую ошибку в определении концентрации хл “а” в водах второго оптического типа (Case II), к которым относятся значительные площади акватории АО, в частности, Карское море [46, 47, 55]. Для того, чтобы избежать больших ошибок в определении ИПП, мы использовали региональный алгоритм расчета Хл0 [11], где наилучшая корреляция измеренных и расчетных величин хл “а” (R2 = 0.47; N = 185) была получена при использовании отношения выходящего из моря излучения на длинах волн 531 и 547 нм Rrs(531)/ Rrs(547):(4)
${\text{ln}}({\text{Х}}{{{\text{л}}}_{0}}) = - 3.66{\text{ln(}}{{{{R}_{{{\text{rs}}}}}(531)} \mathord{\left/ {\vphantom {{{{R}_{{{\text{rs}}}}}(531)} {{{R}_{{{\text{rs}}}}}(547)}}} \right. \kern-0em} {{{R}_{{{\text{rs}}}}}(547)}}{\text{)}} + 0.116.$Спутниковые данные MODIS-Aqua. Данные сканера цвета океана MODIS-Aqua L2 уровня с разрешением 9 × 9 км за период с 2002 по 2021 г., получены с сайта National Aeronautics and Space Administration (NASA) www.oceancolor.gsfc.nasa.gov/. Данные по ФАР использовались как стандартный продукт MODIS-Aqua [35]. Как было отмечено в этой работе, модельные величины ФАР превышали измеренные. Анализ данных ФАР Карского моря также показал систематическое завышение спутниковых значений [31]. В среднем отношение измеренных и спутниковых величин оказалось равным 0.64 (N = 30; cv = 20%). Основываясь на этом эмпирическом отношении, при расчете ИПП мы использовали полученное значение как поправочный коэффициент для спутниковой ФАР.
Величины ИПП рассчитывались для каждого пикселя, где имелись данные по Хл0 и ФАР. Площади акваторий, занятых водами одной цветовой градации рассчитывались с помощью программного обеспечения, алгоритм использования которого описан в работе [15]. Данные по концентрации Хл0 и ФАР усреднялись по месяцам, с апреля по октябрь, за период 2002–2021 гг. Бóльшая часть акватории Карского моря покрыта льдом приблизительно с конца октября до середины апреля. По этой причине и вследствие большого количества дней со сплошной облачностью в октябре и апреле спутниковыми наблюдениями в эти месяцы охвачена незначительная площадь моря. Поэтому, результаты расчетов по доступным спутниковым данным за эти месяцы были экстраполированы на акватории, которые могли бы быть открыты для сканера цвета в отсутствие облачности.
Известно, что данные MODIS-Aqua доступны с июля 2002 г. Данные за апрель, май и июнь 2002 г. были восстановлены путем осреднения величин ИПП и хл “а” в этот период времени за 2003–2021 гг. Сумма величин ИПП в период с апреля по октябрь представляет собой годовую первичную продукцию за конкретный год.
Данные по температуре, ледовому покрову и речному стоку. Температурные файлы OI SST (Optimum Interpolation Sea Surface Temperature) c пространственным разрешением 0.25° × 0.25° и усредненные за 1 день загружались с сайта ftp://ftp. solab.rshu.ru/data/allData/OISST-AVHRR-AMSR-V2. При создании этих файлов использовались данные датчиков Advanced very-high-resolution radiometer (AVHRR), установленных на спутниках National Oceanic and Atmospheric Administration (NOAA), а также судовые данные и данные метеорологических буев [66].
Площадь акватории, покрытой льдом, рассчитывалась с помощью упомянутого выше программного обеспечения [15] по первичным данным с сайта ftp://sidads.colorado.edu/pub/DATASETS/ NOAA/G02202_v2/north/daily [28]. Использовались данные, полученные Special Sensor Microwave Imager/Sounder (SSMIS) с разрешением 25 × 25 км. В среднем за месяц свободной ото льда считалась площадь моря, на которой концентрация льда была < 15%. Расчеты концентрации льда, площадей покрытых льдом и свободных ото льда основаны на алгоритме NASA [24]. Величины годового стока Оби и Енисея (2002–2019 гг.) получены с сайта Arctic Great Rivers Observatory (https://arcticgreatrivers.org/) [65].
РЕЗУЛЬТАТЫ
Межгодовая изменчивость абиотических факторов. В последние две декады (2002–2021 гг.) зарегистрированы статистически достоверные (p < 0.05) положительные умеренные и заметные, согласно шкале Чеддока (R2 = 0.38–0.66), тренды средней за вегетационный сезон T0 во всех районах открытой акватории и для Карского моря в целом (рис. 2а–2г). Величины T0 с 2002 по 2021 г. возрастали в среднем от 5% в год в Северном районе (рис. 2в) до 15% в год в Юго-западном районе (рис. 2а). В среднем для Карского моря (рис. 2г) T0 возросла на 3.55°С, в 4.8 раза, при тренде 10% в год.
Рис. 2.
Межгодовые изменения и линейные тренды средней за вегетационный сезон (апрель–октябрь) температуры воды на поверхности (Т0) в различных районах Карского моря в период с 2002 по 2021 гг. (а) – Юго-западный район; (б) – Район речного выноса; (в) – Северный район; (г) – Карское море. R2 – коэффициент детерминации; p – уровень значимости.

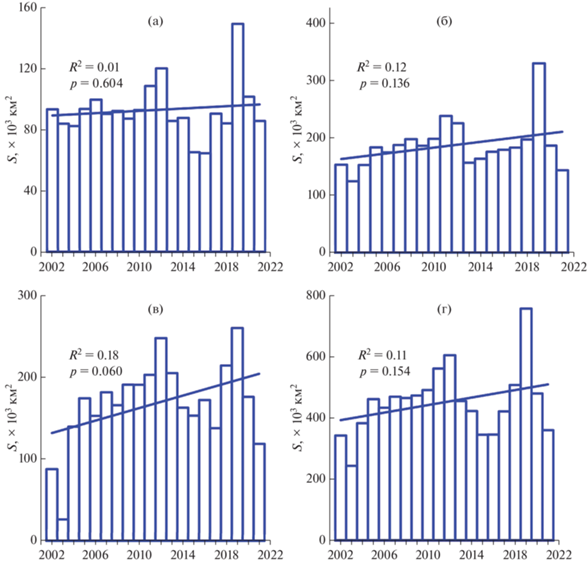
Возрастание T0 сопровождалось увеличением средней за вегетационный сезон площади свободной ото льда (S) (рис. 3а–3г). Следует отметить, что положительный тренд межгодовых изменений S в различных районах моря был слабым и статистически недостоверным (p < 0.05) (R2 = = 0.01–0.18). В исследованные две декады S увеличивалась со скоростью от 0.02% в год в Юго-западном районе (рис. 3а) до 2.8% в год в Северном районе (рис. 3в). Для Карского моря в среднем за исследованный период S возросла в 1.3 раза. Увеличение происходило на 1.4% в год.
Рис. 3.
Межгодовые изменения и линейные тренды средней за вегетационный сезон (апрель–октябрь) площади, свободной ото льда (S), в различных районах Карского моря в период с 2002 по 2021 гг. Условные обозначения см. в подписях к рис. 2.
Один из основных параметров, определяющих величину ИПП в Карском море, средняя за вегетационных сезон величина ФАР [32], статистически достоверно (p < 0.05) уменьшалась во всех районах и на акватории моря в целом (рис. 4а–4г). Это уменьшение можно охарактеризовать как слабое или умеренное. Наиболее тесная связь ФАР с годом исследования зарегистрирована в Северном районе (R2 = 0.31, p = 0.010) (рис. 4в), а минимальная отмечена в Районе речного выноса (R2 = 0.20, p = 0.046) (рис. 4б). Уменьшение поступления ФАР в подповерхностный слой Карского моря происходило в среднем на 2% в год. В целом с 2002 по 2021 г. величина средней за вегетационный сезон ФАР сократилась в 1.6 раза.
Рис. 4.
Межгодовые изменения и линейные тренды средней за вегетационный сезон величины фотосинтетически активной радиации (ФАР) в различных районах Карского моря в период с 2002 по 2021 гг. Условные обозначения см. в подписях к рис. 2.

Межгодовая изменчивость ИПП и ППтот в Карском море может зависеть от годовой величины суммарного стока Оби и Енисея, который обогащает поверхностный слой биогенными элементами, главным образом, в приустьевых районах [12, 13]. Данные о речном стоке, полученные с 2002 по 2019 г., свидетельствуют об очень слабой межгодовой изменчивости (R 2 = 0.03, p = 0.519) (рис. 5). Тем не менее, следует отметить, что в последние две декады происходило незначительное сокращение суммарного стока Оби и Енисея в среднем на 0.35% в год.
Рис. 5.
Межгодовые изменения и линейный тренд годового объема речного выноса Оби и Енисея в период с 2002 по 2019 гг. Условные обозначения см. в подписях к рис. 2.

Межгодовая изменчивость продукционных показателей. С 2002 по 2021 г. во всех районах открытой акватории и в Карском море в целом зарегистрированы достоверные (p < 0.05), но слабые или умеренные отрицательные тренды содержания Хл0 (рис. 6а–6г). Наиболее ярко межгодовая изменчивость этого параметра проявилась в Юго-западном районе моря (R2 = 0.38, p = 0.003) (рис. 6а). Наименее тесная связь с годом исследования отмечена в Северном районе (R2 = 0.24, p = 0.029) (рис. 6в). Концентрация Хл0 на всей акватории Карского моря уменьшилась в 1.1 раза, сокращение происходило на 0.5% в год.
Рис. 6.
Межгодовые изменения и линейные тренды средней за вегетационный сезон концентрации хлорофилла “а” на поверхности (Хл0) в различных районах Карского моря в период с 2002 по 2021 гг. Условные обозначения см. в подписях к рис. 2.

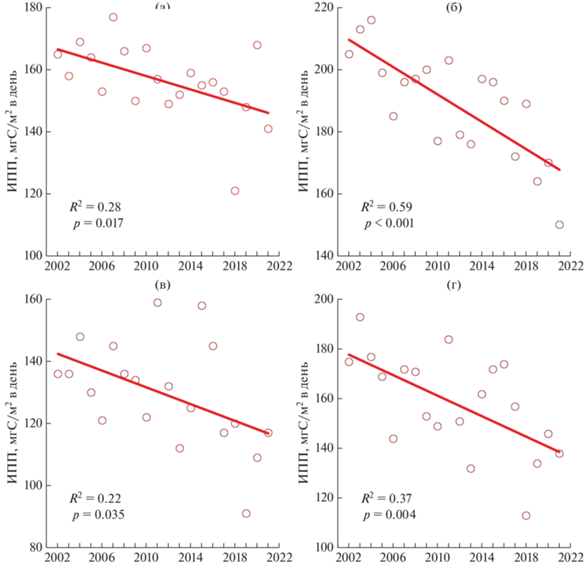
В последние две декады среднегодовые величины ИПП Карского моря статистически достоверно (p < 0.05) слабо или умеренно уменьшались (R2 = 0.22–0.59) (рис. 7а–7г) во всех районах открытой акватории. Наибольшее уменьшение ИПП отмечено в Районе речного выноса (41 мгС/м2 в день) (рис. 7б), наименьшее – в Юго-западном районе (20 мгС/м2 в день) (рис. 7а). Для всего Карского моря (рис. 7г) среднегодовая величина ИПП с 2002 по 2021 г. уменьшилась в 1.3 раза, на 38 мгС/м2 в день (R2 = 37, p = 0.004). Сокращение происходило со скоростью 1.1% в год.
Рис. 7.
Межгодовые изменения и линейные тренды первичной продукции в столбе воды (ИПП), в различных районах Карского моря в период с 2002 по 2021 гг. Условные обозначения см. в подписях к рис. 2.
Вместе с увеличением площади свободной ото льда увеличивалась и ППтот, рассчитанная для вегетационного сезона (апрель–октябрь). Следует отметить, что это увеличение было слабым и статистически недостоверным (p < 0.05) во всех районах Карского моря (R2 = 0.01–0.05) (рис. 8а–8г). Тем не менее, в исследованный период годовая ППтот возросла от 0.15 × 1012 гС в Районе речного выноса (рис. 8б) до 1.05 × 1012 гС в Северном районе (рис. 8в). Для всего Карского моря (рис. 8г) с 2002 по 2021 г. ППтот увеличилась в 1.2 раза, на 2 × 1012 гС (R2 = 0.08, p = 0.236) при тренде 0.7% в год.
Рис. 8.
Межгодовые изменения и линейные тренды годовой первичной продукции (ППтот), рассчитанной для акваторий различных районов и Карского моря в целом, в период с 2002 по 2021 гг. Условные обозначения см. в подписях к рис. 2.

Зависимость ИПП и ППтот от факторов среды. В табл. 1 и 2 приведены показатели статистической связи ИПП и ППтот Карского моря с факторами среды. Среднегодовые величины ИПП наиболее тесно и, в большинстве случаев статистически достоверно (p < 0.05), были связаны с концентрацией Хл0 и ФАР (табл. 1). Такая зависимость была ожидаемой, так как эти переменные непосредственно входят в расчетную формулу (3) модели ИПП. Следует отметить, что повышение T0 в Карском море в последние две декады негативно сказалось на среднегодовых величинах ИПП во всех районах (табл. 1). Отмечена положительная связь ИПП c годовым объемом суммарного стока Оби и Енисея для всех районов и моря в целом (R = 0.31–0.35).
Таблица 1.
Статистические показатели связи средних за вегетационный сезон (апрель–октябрь) величин первичной продукции в столбе воды (ИПП) с абиотическими и биотическими факторами, рассчитанных за период с 2002 по 2021 гг., в различных районах Карского моря
| Параметр | Статистический показатель | Юго-западный район | Район речного выноса | Северный район | Карское море |
|---|---|---|---|---|---|
| ППтот | R | 0.31 | 0.07 | 0.21 | –0.16 |
| p | 0.176 | 0.783 | 0.364 | 0.513 | |
| Хл0 | R | 0.79 | 0.61 | 0.81 | 0.64 |
| p | <0.001 | 0.005 | <0.001 | 0.002 | |
| ФАР | R | 0.50 | 0.42 | 0.53 | 0.47 |
| p | 0.026 | 0.068 | 0.015 | 0.038 | |
| Т0 | R | –0.19 | –0.44 | –0.24 | –0.30 |
| p | 0.419 | 0.05 | 0.311 | 0.201 | |
| S | R | –0.06 | –0.32 | –0.27 | –0.48 |
| p | 0.800 | 0.173 | 0.241 | 0.033 | |
| Речной вынос | R | 0.35 | 0.32 | 0.31 | 0.33 |
| p | 0.151 | 0.190 | 0.217 | 0.185 |
Примечание. ППтот – годовая первичная продукция свободной ото льда акватории; Хл0 – концентрация хл “а” на поверхности; ФАР – фотосинтетически активная радиация; Т0 – температура воды на поверхности; S – площадь свободная ото льда; R – коэффициент корреляции; p – уровень значимости. Выделены значимые корреляции при p < 0.05; N = 20.
Таблица 2.
Статистические показатели связи средних за вегетационный сезон (апрель–октябрь) величин первичной продукции свободной ото льда акватории (ППтот) с абиотическими и биотическими факторами, рассчитанных в период с 2002 по 2021 гг. в различных районах Карского моря
| Параметр | Статистический показатель | Юго-западный район | Район речного выноса | Северный район | Карское море |
|---|---|---|---|---|---|
| ИПП | R | 0.31 | 0.07 | 0.21 | –0.16 |
| p | 0.176 | 0.783 | 0.364 | 0.513 | |
| Хл0 | R | 0.01 | –0.23 | 0.27 | –0.43 |
| p | 0.977 | 0.333 | 0.259 | 0.058 | |
| ФАР | R | 0.03 | 0.11 | 0.17 | –0.17 |
| p | 0.904 | 0.629 | 0.468 | 0.483 | |
| Т0 | R | 0.21 | 0.08 | 0.01 | 0.21 |
| p | 0.371 | 0.745 | 0.965 | 0.369 | |
| S | R | 0.93 | 0.92 | 0.87 | 0.86 |
| p | <0.001 | <0.001 | <0.001 | <0.001 | |
| Речной вынос | R | –0.18 | –0.11 | –0.29 | –0.21 |
| p | 0.480 | 0.655 | 0.248 | 0.394 |
Примечание. ИПП – первичная продукция в столбе воды. Другие условные обозначения см. в примечании к табл. 1. Выделены значимые корреляции при p < 0.05; N = 20.
Межгодовая изменчивость ППтот строго определялась размером площади свободной ото льда с высокими значениями коэффициента корреляции (R = 0.86–0.93, p < 0.001) (табл. 2). Интересно отметить, что влияние ИПП на ППтот было слабым и статистически недостоверным (p < 0.05) (R = –0.16–0.31). Из табл. 2 видно, что другие абиотические факторы, помимо S, также незначительно определяли величину ППтот.
Межгодовая изменчивость в различные сезоны. Межгодовые (2002–2021 гг.) изменения абиотических факторов весной (апрель–июнь) характеризовались слабым и статистически недостоверным (p < 0.05) уменьшением ФАР (R2 = 0.15, p = = 0.088) и S (R2 = 0.07, p = 0.264) (рис. 9б, в). В этот период практически не менялись значения T0 и Хл0 (рис. 9а, 9г).
Рис. 9.
Межгодовые изменения и линейные тренды температуры воды на поверхности (Т0) – (а), фотосинтетически активной радиации (ФАР) – (б), площади, свободной ото льда (S) – (в), концентрации хлорофилла “а” на поверхности (Хл0) – (г), первичной продукции в столбе воды (ИПП) – (д) и годовой первичной продукции всей акватории (ППтот) – (е) в Карском море в весенний период (апрель – июнь). Представлены средние за сезон величины. Другие условные обозначения см. рис. 2.
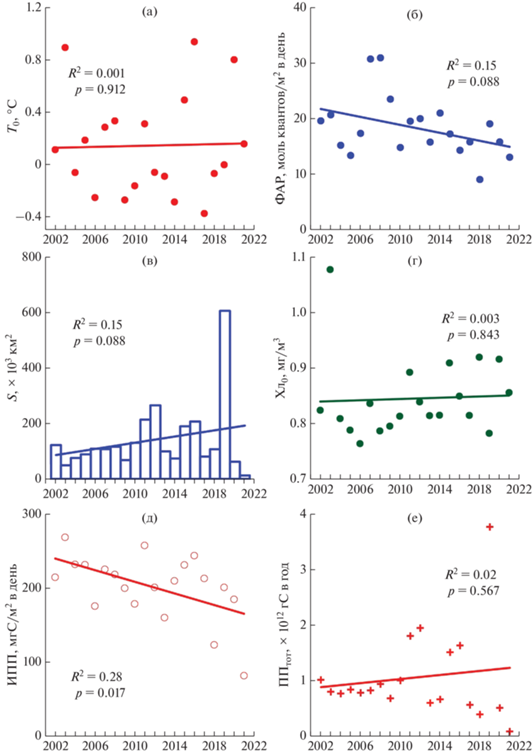
В весенний период зарегистрирован статистически достоверный (p < 0.05), но довольно слабый, отрицательный тренд ИПП (R2 = 0.28, p = = 0.017). ИПП снизилась в 1.5 раза, на 75 мгС/м2 в день. Сокращение происходило на 1.6% в год. ППтот весной в последние две декады увеличивалась вслед за увеличением S (рис. 9е). Следует отметить, что это увеличение было статистически незначимым (p < 0.05) (R2 = 0.02, p = 0.567). Тем не менее, стоит зафиксировать, что весной ППтот в исследованный период возросла в 1.4 раза, на 0.35 × 1012 гС, что составляло 2.1% в год.
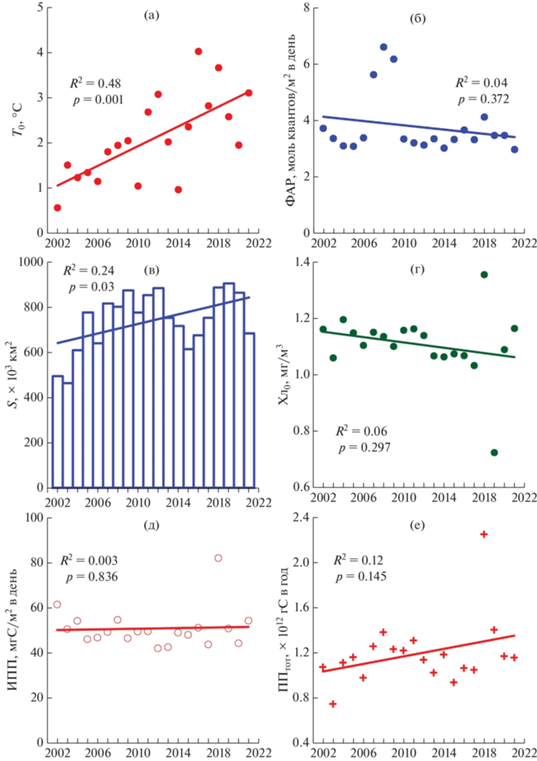
В отличие от весеннего периода, летом (июль, август) отмечается заметный достоверный тренд T0 (R2 = 0.62, p < 0.001) (рис. 10а). Также, отмечены отличия от весны в межгодовой изменчивости Хл0, которые проявляются в наличие незначительного отрицательного тренда этого показателя (R2 = 0.12, p = 0.135) (рис. 10г). Долговременная динамика остальных абиотических параметров в летний период была схожа с картиной, полученной весной. Значения ФАР имели тенденцию к снижению (R2 = 0.03, p = 0.479) (рис. 10б), а площадь свободная ото льда слабо увеличивалась (R2 = 0.08, p = 0.216) (рис. 10в).
Рис. 10.
Межгодовые изменения и линейные тренды абиотических и продукционных параметров в Карском море в летний период (июль, август). Представлены средние за сезон величины. Условные обозначения см. в подписях к рис. 2 и 9.

Уменьшение значений ИПП летом происходило в 5 раз медленнее, чем весной (R2 = 0.06, p = = 0.309) (рис. 10д). В целом в летний период с 2002 по 2021 г. ИПП в Карском море уменьшилась в 1.08 раза, на 15 мгС/м2 в день. Снижение происходило на 0.35% в год. ППтот по сравнению с весной увеличивалась в 2 раза быстрее (R2 = = 0.06, p = 0.281) (рис. 10е). За исследованные две декады летом ППтот возросла в 1.2 раза, на 0.75 × × 1012 гС, что соответствовало ежегодному приращению на 1.05%.
Межгодовые изменения абиотических факторов в осенний сезон (сентябрь, октябрь) характеризуются, как и летом, хорошо выраженным положительным трендом T0 (R2 = 0.48, p = 0.001) (рис. 11а). Снижение значений ФАР происходило приблизительно с такой же интенсивностью, как и летом (R2 = 0.04, p = 0.372) (рис. 11б). Наиболее заметные отличия от весеннего и летнего сезонов отмечены в межгодовой динамике S. Площадь, свободная ото льда, осенью увеличивалась слабо, но статистически значимо (R2 = 0.24, p = 0.030) (рис. 11в). Также, как и летом, содержание Хл0 продолжало снижаться (R2 = 0.06, p = 0.297) (рис. 11г).
Рис. 11.
Межгодовые изменения и линейные тренды абиотических и продукционных параметров в Карском море в осенний период (сентябрь, октябрь). Представлены средние за сезон величины. Условные обозначения см. в подписях к рис. 2 и 9.
Особенностью межгодовой изменчивости продукционных параметров осенью было практически полное отсутствие какого-либо тренда ИПП (R2 = 0.003, p = 0.836) (рис. 11д). ППтот осенью продолжала увеличиваться вслед за увеличением площади свободной ото льда (R2 = 0.12, p = 0.145) (рис. 11е). Общее увеличение ППтот в этот сезон года с 2002 по 2021 г. составило 0.36 × 1012 гС, в 1.4 раза, при ежегодном приращении на 1.75%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Уменьшение ИПП на фоне потепления Карского моря. Потепление Карского моря в последние две декады характеризуется заметным положительным трендом среднегодовых значений T0, сопровождающимся слабым увеличением площади акватории свободной ото льда. Для всего Карского моря увеличение T0 проходило со скоростью 0.17°С в год, что хорошо согласуется с характеристиками положительного тренда этого показателя в этом регионе (0.085°С в год) в период с 1998 по 2018 гг. [56]. По другим данным в период с 1982 по 2018 г. Т0 для августа возрастала в разных регионах АО со скоростью приблизительно от 0.03 до 0.1°С в год [72]. Увеличение температуры воды в АО связывают, в первую очередь, не с увеличением количества солнечной радиации, а с усиливающимся поступлением в этот регион атлантических и тихоокеанских вод из субполярных широт [64]. Другой причиной является возрастание скорости меридионального переноса тепла из более южных широт и, связанного с этим увеличением температуры воздуха в Арктике [57].
Следует отметить, что в АО интенсивность фотосинтеза в поверхностном слое воды напрямую практически не связана с T0 [31]. В других работах также отмечено, что при потеплении климата уменьшение площади ледового покрова будет иметь большее влияние на ПП, чем прямые изменения температуры [36]. В настоящей работе показано, что межгодовую изменчивость ИПП и ППтот определяют, прежде всего, долговременные изменения ФАР, S и Хл0.
В период с 1988 по 2012 гг. средняя скорость сокращения площади ледового покрова Карского моря составляла 9% за декаду [14]. Исследования в другой период времени (1998–2018 гг.) показали, что S в Карском море увеличивалась со скоростью 3.6% в год [56]. Бóльшее значение по сравнению с предыдущими исследованиями, полученное в этой работе, может объясняться общим возрастанием скорости сокращения площади ледового покрова в АО в 1998–2008 гг. [16, 74]. В исследованный нами период (2002–2021 гг.) средняя скорость освобождения акватории ото льда оказалась несколько ниже (1.4% в год), что подтверждает вывод, сделанный в [56], об уменьшении скорости сокращения площади ледового покрова в этом регионе в период с 2009 по 2018 гг. По всей видимости, такая тенденция в Карском море продолжает сохраняться.
При используемом нами подходе, спутниковые данные, являющиеся входящими параметрами в модель расчета ИПП, ограничиваются Хл0 и ФАР. В последние две декады величины этих параметров в Карском море слабо или умеренно, но статистически значимо уменьшались, что и сказалось на долговременной динамике ИПП в исследуемый период.
Межгодовая изменчивость концентрации Хл0 в АО имеет региональный характер. Ранее отмечено, что на фоне общего увеличения содержания Хл0 и ПП в АО, в Карском море происходило их уменьшение [56]. Существует точка зрения, что ФАР является главным фактором, лимитирующим ИПП в АО весной, летом [17, 44, 52] и осенью [22, 41, 63, 75]. Для Карского моря в осенний период получена строгая зависимость скорости фотосинтеза от приходящей ФАР [32]. В исследованиях, касающихся оценки ППтот АО, отмечалось, что увеличение облачности и, как следствие, сокращение поступления ФАР на поверхность моря, может снижать темпы увеличения ППтот [21]. Одной из причин уменьшения ФАР в арктических широтах в эпоху потепления и сокращения площади ледового покрова является увеличение облачности над свободной ото льда поверхностью моря [26, 40, 73]. Другой причиной сокращения поступления ФАР является усиление циклонической активности над Северной Атлантикой и Западной Арктикой, о чем свидетельствует увеличение положительных аномалий индекса североатлантической осцилляции (САО) в последние две декады (https://www.ncei.noaa.gov/access/monitoring/nao/).
В настоящей работе показано, что ИПП в последние две декады уменьшалась главным образом в весенний период (рис. 9–11). Этот факт может свидетельствовать о сокращении интенсивности весеннего развития фитопланктона в Карском море, что существенным образом снижает годовую величину ППтот.
Межгодовая изменчивость ППтот. Исследования характера долговременной динамики ППтот Карского моря показали, что величины этого параметра строго зависят от площади, свободной ото льда в тот или иной год (табл. 2). Увеличение ППтот в течение последних двух декад было незначительным. По всей видимости, сдерживающим рост ППтот фактором являлось уменьшение ИПП, вызванное, в свою очередь, сокращением поступления ФАР и уменьшением содержания Хл0.
Ранее было проведено подробное сравнение полученной нами картины межгодовой изменчивости ППтот в Карском море с литературными данными [5]. Отмечено, что некоторые различия были связаны с временными рамками исследований, выбором границ исследованной акватории, а также подходом к моделированию и оценкам ППтот. В работах [18, 60] было отмечено, что в регионе Карского моря сокращение площади ледового покрова и увеличение ППтот в период с 1998 по 2009 г. происходило наиболее быстро по сравнению с другими акваториями АО. В настоящей работе также прослеживается заметное увеличение ППтот в совпадающий с литературными данными временнóй интервал (2002–2009 гг.). Однако, продление времени исследования межгодовой изменчивости до 2021 г. показало, что увеличение ППтот интенсивно проходило только до 2012 г. Далее величины ППтот снизились приблизительно до уровня 2002–2006 гг. (рис. 8).
Площадь моря, свободная ото льда, статистически достоверно и наиболее быстро (на 210 × × 103 км2, 1.7% в год) увеличивалась в осенний сезон. Таким образом, и годовая величина ППтот возрастала, главным образом, осенью. Следует отметить, что подобное приращение носит исключительно экстенсивный характер. Интенсивность фотосинтеза в Карском море в осенний период снижается в условиях сокращения поступления ФАР [7] и ПП характеризуется как наиболее низкая в году.
Роль речного стока в межгодовой динамике ИПП и ППтот. Ранее отмечалось, что, влияние рек на продуктивность Карского моря противоречиво [7]. С одной стороны, речной сток является причиной наличия резкого плотностного градиента в приповерхностном слое и затрудняет конвективное поступление биогенов из нижележащих слоев. Кроме того, большое количество растворенного и взвешенного органического вещества, выносимого реками, создает неблагоприятные световые условия для фотосинтеза из-за увеличения мутности воды и уменьшения глубины эвфотической зоны [32]. С другой стороны, снабжение биогенами и органическим веществом, которое с разными скоростями, но все же реминирализуется [30, 38, 43, 58, 59] частично компенсирует слабый поток минеральных веществ снизу.
Позитивное влияние аллохтонных речных биогенов (о котором косвенно можно судить, опираясь на данные по годовому объему стока) на величины ИПП подтверждается проведенным нами корреляционным анализом (табл. 1). Следует отметить, что в межгодовом аспекте это влияние было статистически незначимым. Тем не менее, интересно, что положительная корреляция ИПП с объемом речного стока зарегистрирована для всех районов открытой акватории Карского море, а не только для приустьевых областей (табл. 1). Примечательным также представляется наличие отрицательной связи объема речного стока с ППтот. Объяснением этого факта можно считать полученные нами обратные зависимости между S и объемом речного стока во всех районах и для Карского моря в целом. R при этом варьировал от –0.20 в Районе речного выноса до –0.41 в Северном районе. Для всего моря его величина была равной –0.35. По всей видимости, при увеличении объема речного выноса происходит усиленное опреснение поверхностных вод, что способствует интенсификации льдообразования, увеличению площади ледового покрытия и, следовательно, уменьшению ППтот.
С 2002 по 2019 гг. годовой объем стока Оби и Енисея в Карское море варьировал незначительно (рис. 5). Следует отметить тенденцию к его уменьшению в последние две декады по нашим данным, которые хорошо согласуются с результатами моделирования, представленными в работе [9].
ЗАКЛЮЧЕНИЕ
В настоящей работе показано, что годовая величина ППтот Карского моря в последние две декады (2002–2021 гг.) слабо возрастала на фоне значимого уменьшения ИПП. В итоге возникает вопрос, возрастает или уменьшается первичная продуктивность Карского моря с точки зрения ее влияния на снабжение органическим веществом организмов более высоких трофических уровней пищевой цепи? По результатам данного исследования мы можем констатировать, что увеличение ППтот не может в настоящее время быть причиной существенного возрастания продуктивности Карского моря по двум причинам. Во-первых, увеличение ППтот носит экстенсивный характер и происходит, в основном, за счет освобождающихся ото льда акваторий, главным образом, в низкопродуктивных северных районах моря. Во-вторых, это увеличение достигается, в основном, в осенний период, когда интенсивность новообразования органического вещества в процессе фотосинтеза мала, в основном, из-за низкого уровня ФАР.
В тоже время, снабжение органикой конкретных биотопов обеспечивается за счет ИПП, которая статистически значимо снижалась в последние две декады по всех открытых районах Карского моря. Особенно примечателен тот факт, что во многом это снижение происходило за счет весеннего, наиболее продуктивного сезона. Таким образом, следует заключить, что интенсивное потепление региона, происходящее в последние две декады, привело к снижению, в целом, продуктивности Карского моря, что неизбежно должно негативно отразиться на численности и биомассе представителей более высоких трофических звеньев пелагиали [1] и бентали [3, 10], а также бентосных вселенцев [76].
Благодарности. Авторы благодарят GSFC DAAC (Goddard Space Flight Center, Distributed Active Archiv-e Center) NASA за возможность использования спутниковой информации сканера MODIS-Aqua, NODC (National Oceanographic Data Center) NOAA за предоставленные гидрофизические данные, а также NSIDC (National Snow and Ice Data Center) NOAA за данные по площади ледового покрытия.
Источники финансирования. Работа выполнена в рамках Государственного задания Министерства науки и высшего образования Российской федерации FMWE-2022-0003.
Список литературы
Антонов Н.П., Кузнецов В.В., Кузнецова Е.Н. и др. Сайка Boreogadus saida (Gadiformes, Gadidae) как ключевой вид и потенциальный объект рыбного промысла в Карском море // Вопросы рыболовства. 2016. Т. 17. № 2. С. 203–212.
Ветров А.А., Романкевич Е.А. Первичная продукция и потоки органического углерода на дно в арктических морях Евразии в 2003–2012 гг. // Докл. РАН. 2014. Т. 454. № 1. С. 97–99.
Галкин С.В. Исследования макробентоса Карского моря в 49м рейсе НИС “Дмитрий Менделеев” // Бентос высокоширотных районов / Отв. ред. Кузнецов А.П., Зезина О.Н. М.: ИОРАН, 1998. С. 34–41.
Демидов А.Б., Гагарин В.И., Шеберстов С.В. Межгодовая изменчивость первичной продукции Восточно-Сибирского моря // Океанология. 2020. Т. 60. № 6. С. 876–888. https://doi.org/10.31857/S0030157420050044
Демидов А.Б., Шеберстов С.В., Гагарин В.И. Межгодовая изменчивость ледового покрова и первичной продукции Карского моря // Океанология. 2018. Т. 58. № 4. С. 578–592. https://doi.org/10.1134/S0030157418040019
Демидов А.Б., Шеберстов С.В., Гагарин В.И. Межгодовая изменчивость первичной продукции моря Лаптевых // Океанология. 2020. Т. 60. № 1. С. 60–73. https://doi.org/10.31857/S0030157420010074
Демидов А.Б., Шеберстов С.В., Гагарин В.И., Хлебопашев П.В. Сезонная изменчивость первичной продукции фитопланктона Карского моря по спутниковым данным // Океанология. 2017. Т. 57. № 1. С. 103–117. https://doi.org/10.7868/S0030157417010026
Зацепин А.Г., Завьялов П.О., Кременецкий В.В. и др. Поверхностный опресненный слой в Карском море // Океанология. 2010. Т. 50. № 5. С. 698–708.
Кузин В.И., Платов Г.А., Лаптева Н.А. Оценка влияния межгодовой изменчивости стока сибирских рек на циркуляцию Северного ледовитого океана // Известия РАН. Физика атмосферы и океана. 2015. Т. 51. № 4. С. 437–447. https://doi.org/10.7868/S0002351515040069
Кузнецов А.П. Трофическая структура донной фауны Карского моря // Донная фауна краевых морей СССР / Отв. ред. Кузнецов А.П. М.: ИОАН, 1976. С. 32–60.
Кузнецова О.А., Копелевич О.В., Шеберстов С.В. и др. Оценка концентрации хлорофилла в Карском море по данным спутникового сканера MODIS-AQUA // Исслед. Земли из космоса. 2013. № 5. С. 21–31.
Маккавеев П.Н., Стунжас П.А. Гидрохимическая характеристика вод Карского моря // Океанология. 1994. Т. 34. № 5. С. 662–667.
Флинт М.В., Анисимов И.М., Арашкевич Е.Г. и др. Экосистемы Карского моря и моря Лаптевых. Материалы экспедиционных исследований 2016 и 2018 гг. / ИО РАН, М.: 2021. 368 с.
Шалина Е.В. Сокращение ледяного покрова Арктики по данным спутникового пассивного микроволнового зондирования // Современные проблемы дистанционного зондирования Земли из космоса. 2013. Т. 10. № 1. С. 328–336.
Шеберстов С.В. Система пакетной обработки океанологических спутниковых данных // Современные проблемы дистанционного зондирования Земли из космоса. 2015. Т. 12. № 6. С. 154–161.
Юлин А.В., Вязигина Н.А., Егорова Е.С. Межгодовая и сезонная изменчивость площади льдов в Северном ледовитом океане по данным спутниковых наблюдений // Российская Арктика. 2019. Т. 7. С. 28–40. https://doi.org/10.24411/2658-4255-2019-10073
Ardyna M., Gosselin M., Michel C. et al. Environmental forcing of phytoplankton community structure and function in the Canadian High Arctic: contrasting oligotrophic and eutrophic regions // Mar. Ecol. Progr. Ser. 2011. V. 442. P. 37–57.
Arrigo K.R., van Dijken G.L. Secular trends in Arctic Ocean net primary production // J. Geophys. Res. 2011. V. 116. C09011. 15 p. https://doi.org/10.1029/2011JC007151
Arrigo K.R., van Dijken G.L. Continued increases in Arctic Ocean primary production // Progr. in Oceanogr. 2015. V. 136. P. 60–70.
Arrigo K.R., van Dijken G.L., Pabi S. Impact of a shrinking Arctic ice cover on marine primary production // Geophys. Res. Lett. 2008. V. 35. № 19. L19603. 6 p. https://doi.org/10.1029/2008GL035028
Bélanger S., Babin M., Tremblay J.-E. Increasing cloudiness in Arctic damps the increase in phytoplankton primary production due to sea ice receding // Biogeosciences. 2013. V. 10. № 6. P. 4087–4101.
Brugel S., Nozais C., Poulin M. et al. Phytoplankton biomass and production in the southeastern Beaufort Sea in autumn 2002 and 2003 // Mar. Ecol. Progr. Ser. 2009. V. 377. P. 63–77.
Campbell J., Antoine D., Armstrong R. et al. Comparison of algorithms for estimating ocean primary production from surface chlorophyll, temperature, and irradiance // Global Biogeochemical Cycles. 2002. V. 16. 1035. 9 p. https://doi.org/10.1029/2001GB001444
Cavalieri D.J., Parkinson C.L., Gloersen P., Zwally H.J. Arctic and Antarctic Sea Ice Concentrations from Multichannel Passive-Microwave Satellite Data Sets: October 1978-September 1995 // User’s Guide. NASA TM 104647. 1997. Goddard Space Flight Center, Greenbelt. 17 p.
Cavalieri D.J., Parkinson C.L. Arctic sea ice variability and trends, 1979–2010 // Cryosphere. 2012. V. 6. P. 881–889.
Chernokulsky A., Mokhov I. Climatology of Total Cloudiness in the Arctic: An Intercomparison of Observations and Reanalyses // Advances in Meteorology. 2012. Art. ID 542093, 15 p. https://doi.org/10.1155/2012/542093
Comiso J.C. The rapid decline of multiyear ice cover // J. Clim. 2012. V. 25. № 4. P. 1176–1193. https://doi.org/10.1175/JCLI-D11-00113.1
Comiso J.C., Nishio F. Trends in the Sea Ice Cover Using Enhanced and Compatible AMSR-E, SSM/I, and SMMR Data // J. Geophys. Res. 2008. V. 113. C02S07. https://doi.org/10.1029/2007JC0043257
Comiso J.C., Parkinson C.L., Gersten R., Stock L. Accelerated decline in the Arctic sea ice cover // Geophys. Res. Lett. 2008. V. 35. L01703. https://doi.org/10.1029/2007GL031972
Cooper L.W., Benner R., McClelland J.W. et al. Linkages among runoff, dissolved organic carbon and the stable oxygen isotope composition of seawater and other water mass indicators in the Arctic Ocean // J. Geophys. Res. 2005. V. 110. G02013. https://doi.org/10.1029/2005JG000031
Demidov A.B., Kopelevich O.V., Mosharov S.A., Sheberstov S.V., Vazyulya S.V. Modelling Kara Sea phytoplankton primary production: development and skill assessment of regional algorithms // J. Sea Res. 2017. V. 125. P. 1–17. https://doi.org/10.1016/j.seares.2017.05.004
Demidov A.B., Mosharov S.A., Makkaveev P.N. Patterns of the Kara Sea primary production in autumn: Biotic and abiotic forcing of subsurface layer // J. Mar. Sys. 2014. V. 132. P. 130–149.
Dupont F. Impact of sea-ice biology on overall primary production in a biophysical model of the pan-Arctic Ocean // J. Geophys. Res. 2012. V. 117. C00D17, https://doi.org/10.1029/2011JC006983
Falkowski P. Light-shade adaptation and assimilation numbers // J. Plankton Res. 1981. V. 3. P. 203–216.
Frouin R., McPherson J., Ueyoshi K., Franz B.A. A time series of photosynthetically available radiation at the ocean surface from SeaWiFS and MODIS data // Proc. SPIE 12. https://doi.org/10.1117/1112.981264
Gibson G., Weijer W., Jeffery N., Wang S. Relative impact of sea ice and temperature changes on Arctic marine production // J. Geophys. Res.: Biogeosciences. 2020. V. 125. https://doi.org/10.1029/2019JG005343
Gordeev V.V., Martin J.M., Sidorov I.S., Sidorova M.V. A reassessment of the Eurasian river input of water, sediment, major elements and nutrients to the Arctic Ocean // Am. J. Sci. 1996. V. 296. № 6. P. 664–691.
Hansell D.A., Kadko D., Bates N.R. Degradation of terrigenous dissolved organic carbon in the Western Arctic Ocean // Science. 2004. V. 304. P. 858–861.
Hanzlick D., Aagaard K. Freshwater and Atlantic water in the Kara Sea // J. Geophys. Res. 1980. V. 85. № C9. P. 4937–4942.
He M., Hu Y., Chen N. et al. High cloud coverage over melted areas dominates the impact of clouds on the albedo feedback in the Arctic // Scientific Reports. 2019. https://doi.org/10.1038/s41598-019-44155-w
Hegseth E.N. Phytoplankton of the Barents Sea–the end of a growth season // Pol. Biol. 1997. V. 17. № 3. P. 235–241.
Holmes R.M., McClelland J.W., Peterson B.J. et al. Seasonal and annual fluxes of nutrients and organic matter from large rivers to the Arctic Ocean and surrounding seas // Estuaries and Coasts. 2012. V. 35. P. 369–382.
Holmes R.M., McClelland J.W., Raymond P.A. et al. Lability of DOC transported by Alaskan rivers to the Arctic Ocean // Geophys. Res. Lett. 2008. V. 35. L03402. https://doi.org/10.1029/2007GL032837
Hill V., Cota G. Spatial patterns of primary production on the shelf, slope and basin of the Western Arctic in 2002 // Deep-Sea Res. II. 2005. V. 57. № 24–26. P. 3344–3354.
Hill V.J., Matrai P.A., Olson E. et al. Synthesis of integrated primary production in the Arctic Ocean: II. In situ and remotely sensed estimates // Progr. in Oceanogr. 2013. V. 110. P. 107–125.
IOCCG, 2000. Remote sensing of ocean colour in coastal and other opticall-complex waters. Sathyendranath, S. (Ed.). Reports of the International Ocean-Colour Coordinating Group. 3, IOCCG, Dartmouth, Canada. 140 p.
IOCCG, 2015. Ocean Colour Remote Sensing in Polar Seas. Babin M. et al. (Eds.) Reports of the International Ocean-Colour Coordinating Group. 16, IOCCG, Dartmouth, Canada. 130 p.
Kahru M., Lee Z., Mitchell G., Nevison C. Effects of sea ice cover on satellite detected primary production in the Arctic Ocean // Biol. Lett. 2016. V. 12. https://doi.org/10.1098/rsbl.2016.0223
Kubryakov A., Stanichny S., Zatsepin A. River plume dynamics in the Kara Sea from altimetry-based lagrangian model, satellite salinity and chlorophyll data // Rem. Sens. Env. 2016. V. 176. P. 177–187.
Kwok R., Cunningham G.F., Wensnahan M. et al. Thinning and volume loss of Arctic sea ice: 2003–2008 // J. Geophys. Res. 2009. V. 114. C07005. https://doi.org/10.1029/2009JC005312
Lee Y.J., Matrai P.A., Friedrichs M.A.M. et al. An assessment of phytoplankton primary productivity in the Arctic Ocean from satellite ocean color/in situ chlorophyll-a based models // J. Geophys. Res. 2015. V. 120. https://doi.org/10.1002/2015/JC11018
Lee S.H., Whitledge T.E. Primary and new production in the deep Canada Basin during summer 2002 // Pol. Biol. 2005. V. 28. № 3. P. 190–197.
Le Fouest V., Babin M., Trembley J.-É. The fate of riverine nutrients on Arctic shelves // Biogeosciences. 2013. V. 10. № 6. P. 3661–3677.
Leu E., Søreide J.E., Hessen D.O. et al. Consequences of changing sea-ice cover for primary and secondary producers in the European Arctic shelf seas: Timing, quantity, and quality // Progr. Oceanogr. 2011. V. 90. P. 18–32.
Lewis K.M., Mitchell B.G., van Dijken G.L., Arrigo K.R. Regional chlorophyll a algorithms in the Arctic Ocean and their effect on satellite-derived primary production estimates // Deep-Sea Res. II. 2016. V. 130. P. 14–27.
Lewis K.M., van Dijken G.L., Arrigo K.R. Changes in phytoplankton concentration now drive increased Arctic Ocean primary production // Science. 2020. V. 369. P. 198–202.
Mewes B., Jacobi C. Heat transport pathways into the Arctic and their connections to surface air temperatures // Atmos. Chem. Phys. 2019. V. 19. P. 3927–3937. https://doi.org/10.5194/acp-19-3927-2019
Opsahl S., Benner R., Amon R.W. Major flux of terrigenous dissolved organic matter through the Arctic Ocean // Limnol. Ocenogr. 1999. V. 44. № 8. P. 2017–2023.
Osburn C.L., Retamal L., Vincent W.F. Photoreactivity of chromophoric dissolved organic matter transported by the Mackenzie River to the Beaufort Sea // Mar. Chem. 2009. V. 115. № 1–2. P. 10–20.
Pabi S., van Dijken G.L., Arrigo K.R. Primary production in the Arctic Ocean, 1998–2006 // J. Geophys. Res. 2008. V. 113. C08005. https://doi.org/10.1029/2007/JC004578
Petrenko D., Pozdnyakov D., Johannessen J. et al. Satellite-derived multi-year trend in primary production in the Arctic Ocean // Inter. J. Rem. Sens. 2013. V. 34. P. 3903–3937.
Pivovarov S., Schlitzer R., Novikhin A. River run-off influence on the water mass formation in the Kara Sea // Siberian river run-off in the Kara Sea / Eds. Stein R. et al. Amsterdam: Elsevier, 2003. P. 9–25.
Platt T., Harrison W.G., Horne E.P.W., Irwin B. Carbon fixation and oxygen evolution by phytoplankton in the Canadian High Arctic // Pol. Biol. 1987. V. 8. № 2. P. 103–113.
Polyakov I.V., Alkire M.B., Bluhm B.A. et al. Borealization of the Arctic Ocean in response to anomalous advection from sub-arctic seas // Front. Mar. Sci. 2020. V. 7. № 491.https://doi.org/10.3389/fmars.2020.00491
Shiklomanov A.I., Holmes R.M., McClelland J.W. et al. Arctic Great Rivers Observatory // Discharge Dataset, Version 20220425. 2021.
Reynolds R.W., Smith T.M., Liu C. et al. Daily High-Resolution-Blended Analyses for Sea Surface Temperature // J. Clim. 2007. V. 20. № 22. P.5473–5496.
Stein R. Circum Arctic river discharge and its geological record // Int. J. Earth Science. 2000. V. 89. P. 447–449.
Stroeve J., Holland M., Meier W. et al. Arctic sea ice decline: Faster than forecast // Geophys. Res. Lett. 2007. V. 34. L09501. https://doi.org/10.1029/2007GL029703
Stroeve J.C., Kattsov V., Barrett A.P. et al. Trends in Arctic sea ice extent from CMIP5, CMIP3 and observations // Geophys. Res. Lett. 2012. V. 39. L16502. https://doi.org/10.1029/2012GL052676
Stroeve J.C., Serreze M.C., Holland M.M. et al. The Arctic’s rapidly shrinking sea ice cover: A research synthesis // Clim. Change. 2012. V. 110. P. 1005–1027.
Timmermans M.-L., Ladd C. Sea surface temperature // Arctic Report Card: Update for 2018 https://arctic.noaa.gov/Report-Card-2018/ArtMID/7878/ArticleID/779/Sea-Surface-Temperature.
Vancoppenolle M., Bopp L., Madec G. et al. Future Arctic Ocean primary productivity from CMIP5 simulations: Uncertain outcome, but consistent mechanisms // Global Biogeochem. Cycle. 2013. V. 27. P. 605–619. https://doi.org/10.1002/gbc.20055
Vavrus S., Holland M.M., Bailey D.A. Changes in Arctic clouds during intervals of rapid sea ice loss // Clim. Dyn. 2011. V. 36. P. 1475–1489. https://doi.org/10.1007/s00382-010-0816-0
Wu Z., Wang X. Variability of Arctic Sea Ice (1979–2016) // Water. 2019. V. 11. № 23. https://doi.org/10.3390/w11010023
Yun M.S., Chung K.H., Zimmermann S. et al. Phytoplankton productivity and its response to higher light levels in the Canada Basin // Pol. Biol. 2012. V. 35. № 2. P. 257–268.
Zalota A.K., Spiridonov V.A., Vedenin A.A. Development of snow crab Chionoecetes opilio (Crustacea: Decapoda: Oregonidae) invasion in the Kara Sea // Pol. Biol. 2018. doi.org/.https://doi.org/10.1007/s00300-018-2337-y
Zhang J., Spitz Y.H., Steele M. et al. Modeling the impact of declining sea ice on the Arctic marine planktonic ecosystem // J. Geophys. Res. 2010. V. 115. C10015. https://doi.org/10.1029/2009/JC005387
Дополнительные материалы отсутствуют.



