Океанология, 2023, T. 63, № 2, стр. 243-254
Гетеротрофный нано- и микропланктон Карского моря в осенний период
А. Ф. Сажин 1, *, Н. Д. Романова 1, А. И. Копылов 2, А. В. Романенко 2, Е. А. Заботкина 2
1 Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
2 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская область, пос. Борок, Россия
* E-mail: andreysazhin@yandex.ru
Поступила в редакцию 11.07.2022
После доработки 10.10.2022
Принята к публикации 16.12.2022
- EDN: NQOHAH
- DOI: 10.31857/S0030157423020119
Аннотация
На основании полученных и всех имеющихся литературных данных показано, что обилие гетеротрофных флагеллят в Карском море в конце вегетационного сезона относительно стабильно в разные годы, тогда как в других арктических морях (Восточно-Сибирское и Чукотское) описанные значения этого показателя выше в 1.5–2 раза. Показатели обилия гетеротрофных нанофлагеллят в наддонной воде меняются в существенно меньших пределах, чем в водной толще. Обилие гетеротрофных нанофлагеллят в наддонной воде заливов архипелага Новая Земля существенно ниже, чем в таких же биотопах восточной и западной частей Карского моря. Большую часть организмов составляют свободноживущие формы. С частицами детрита связаны около трети простейших. Отношение биомассы гетеротрофных жгутиковых к биомассе бактерий возрастает в слое наддонной воды и в верхнем слое осадков по сравнению с водной толщей более чем в два раза. Для водного столба Карского моря рассчитанная величина выедания бактериопланктона жгутиконосцами не превышает 2% их биомассы. Отношение выедаемой биомассы бактериопланктона к биомассе потребителей в большинстве случаев снижается с глубиной.
ВВЕДЕНИЕ
Микробная петля, в состав которой входят прокариоты и гетеротрофный нано- и микропланктон, является важнейшим компонентом планктонного сообщества, обеспечивающим реминерализацию органического вещества [12, 18, 19]. Особенно велико значение микробной компоненты планктона в полярных экосистемах, где в течение длительного срока развитие фотосинтезирующих организмов ограничено недостатком света, и ярко выраженная сезонность определяет время “цветения” фитопланктона. В периоды развития автотрофного пикопланктона микрозоопланктон активно участвует в его выедании, передавая эту продукцию на более высокие трофические уровни, и этот вклад может превышать 80% [34]. Также показано, что крупные гетеротрофные протисты могут преобладать в рационе копепод, что описано для арктических экосистем в период связанный с окончанием “цветения” диатомовых водорослей [24].
Ярко выраженная сезонная изменчивость арктических экосистем, в первую очередь изменения температуры, освещенности и ледового покрова, влияют, в том числе, на развитие планктонного микрогетеротрофного сообщества. Как показывают исследования в разных районах Арктики, динамика изменений в сообществах гетеротрофов может контролироваться как “снизу” доступностью пищи, так и “сверху” благодаря присутствию копепод, или обоими факторами [23, 30, 32]. В свою очередь, различается и вклад “микробной петли”: если на протяжении большей части года она в основном поддерживает рециклинг биогенных элементов для других компонентов экосистемы, то в период “цветения” фитопланктона наблюдается активное развитие и существенный ее вклад в поток углерода [29]. В бентосных системах, напротив, сезонная изменчивость гораздо менее выражена по сравнению с пелагическими сообществами благодаря наличию и доступности органического вещества осадков и, следовательно, относительно постоянному росту микроорганизмов и созданию бактериальной продукции [13].
В настоящей работе мы рассмотрим характеристики сообществ гетеротрофных микроорганизмов в воде и верхнем слое осадков в конце вегетационного сезона в разных районах Карского моря. Эта акватория во многих отношениях является наиболее исследованной из всех морей Российской Арктики, тем не менее, в вопросах структуры и функционирования микробной петли существует много пробелов, часть из которых мы и восполним.
МАТЕРИАЛЫ И МЕТОДЫ
Материал был собран в ходе 63-го рейса НИС “Академик Мстислав Келдыш” 26 августа–09 октября 2015 г. в открытых районах Карского моря, а также в заливах Седова, Ога и Степового архипелага Новая Земля (рис. 1).
Пробы воды отбирали с помощью 5-литровых батометров Нискина, в составе комплекса “Rozett”, оснащенного CTD-зондом (SBE 911 Plus by SeaBird Electronics, USA), с горизонтов, выбранных на основании профилей распределения температуры, солености и флуоресценции. Пробы наддонной воды (20 см слой воды над поверхностью донных осадков) и верхнего 2-см слоя донных отложений отбирали из трубки Неймисто.
Для учета общей численности бактерий и расчета биомассы бактериопланктона пробы воды фиксировали непосредственно после отбора нейтральным раствором формальдегида (конечная концентрация в пробе 1%) и хранили до последующей обработки не ранее трех месяцев после отбора [33]. Концентрацию бактериопланктона определяли, окрашивая пробы флуорохромом DAPI на черных ядерных фильтрах (0.2 мкм, Трекпор Технолоджи) и анализируя под люминесцентным микроскопом Leica DM 5000B [28]. Биомассу бактериопланктона вычисляли по [22]. Так как использованные методы учета численности микроорганизмов не позволяют различать архей и бактерий, в настоящей статье, используя термин бактерии, мы подразумеваем всех гетеротрофных прокариот.
Для учета нано- и микропланктона в воде пробы объемом 50–75 мл окрашивали флуорохромом примулином и фиксировали 3.6% раствором глютарового диальдегида, после чего осаждали на черные ядерные фильтры с диаметром пор 0.4 мкм. Препараты хранили при температуре –24°С до последующей обработки под люминесцентным микроскопом Leica DM 5000B [15, 26]. Объем клеток рассчитывали, исходя из объема соответствующих стереометрических фигур. Биомассу флагеллят и инфузорий в углеродном эквиваленте вычисляли исходя из объемов клеток по [25].
Пробы грунта для микроскопических исследований сразу после отбора фиксировали 25% глутаровым диальдегидом до конечной концентрации в пробе 3% и хранили в темноте при температуре 4°С до последующей обработки. В лаборатории к пробам донных осадков в качестве детергента добавляли Na4P2O7 до конечной концентрации 1 мМ и подвергали действию ультразвука [17, 21]. Численность и размеры бактерий и гетеротрофных нанофлагеллят определяли методом эпифлуоресцентной микроскопии с использованием флуорохромов DAPI и примулин [15, 28]. Содержание углерода в бактериальных клетках (С, фг/кл) рассчитывали с использованием аллометрического уравнения: С = 120 V 0.72 [27]. Для вычисления углеродной биомассы гетеротрофных нанофлагеллят использовали коэффициент 220 фг C/мкм3 [14].
Активность питания гетеротрофного нано- и микропланктона определяли экспериментально, методом добавления концентрированных флуоресцентно меченых бактерий [16]. Для приготовления флуоресцентно меченых бактерий пять литров воды из поверхностного слоя фильтровали через ядерный фильтр с диаметром пор 2 мкм, концентрировали до объема 100 мл с помощью камеры обратной фильтрации (фильтр с диаметром пор 0.2 мкм). В полученный концентрат добавляли 20 мг DTAF (5-(4,6-дихлортриазин-2-ил) аминофлуоресцеин) и окрашивали в течение трех часов при температуре +60°С. Для избавления от избыточного красителя концентрат трижды центрифугировали в течение 25 минут на 7000 оборотов в минуту, удаляли супернатант и доводили до исходного объема. Концентрацию окрашенных бактериальных клеток определяли с помощью люминесцентной микроскопии. Для определения активности питания гетеротрофного нано- и микропланктона в пробу воды объемом 50–75 мл добавляли флуоресцентно меченых бактерий из расчета, чтобы их концентрация в пробе составляла 5-30% общей численности бактериальных клеток. Пробы инкубировали в течение 1.5–2.5 часов при температуре 4°С, после чего фиксировали холодным 10% раствором глютарового диальдегида в безбактериальной воде (финальная концентрация 1%). Пробу окрашивали флуорохромом DAPI, осаждали на черный ядерный фильтр с диаметром пор 0.4 мкм и замораживали при температуре –25°С. Концентрацию окрашенных бактерий в клетках жгутиконосцев и инфузорий определяли с помощью люминесцентной микроскопии (Leiсa DM 2500B, увеличение ×1000). Величину потребления бактерий нано- и микрогетеротрофами рассчитывали исходя из исходной концентрации бактериопланктона в пробе и доли добавленных в нее флуоресцентно меченых бактерий.
РЕЗУЛЬТАТЫ
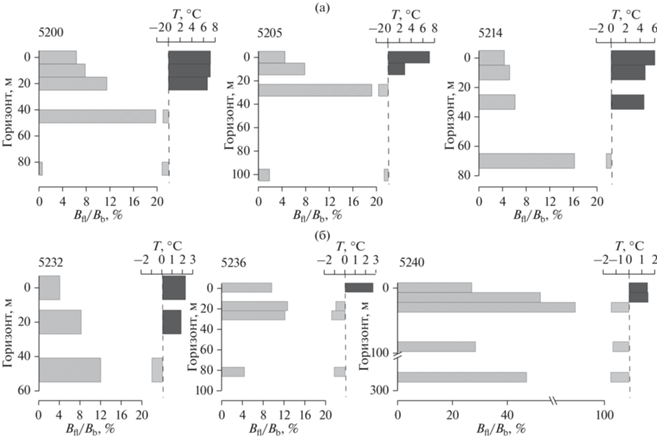
Гетеротрофный пико-, нано- и микропланктон водной толщи. Численность гетеротрофных нанофлагеллят в водах Карского моря варьировала на разных станциях и горизонтах от 0.2 до 394 тыс. кл/л. Высокие величины этого показателя по всей водной толще наблюдались над склоном желоба Воронина (ст. 5240), составляя в среднем 251 тыс. кл/л (175–385 тыс. кл/л). Максимальная величина численности (394 тыс. кл/л) была отмечена в поверхностном распресненном слое в центральной части моря (ст. 5205) в области влияния речного стока [11]. Минимальные показатели обилия были приурочены к придонному слою воды в юго-западной части моря (ст. 5200) и составляли 0.2 тыс. кл/л. Средние значения численности гетеротрофных нанофлагеллят для столба воды варьировали в небольшом диапазоне от 74 до 118 тыс. кл/л, исключение составляла только уже упомянутая станция над склоном желоба Воронина, где этот показатель был выше более чем в два раза. Более 97% численности планктонных жгутиконосцев составляли организмы размером 1.5–6 мкм.
Рис. 2.
Биомасса гетеротрофных нанофлагеллят (Bfl) и бактериопланктона (Bb), мг С/м3 в толще воды на разрезах в западной (а) и восточной (б) частях Карского моря.

Биомасса гетеротрофных нанофлагеллят на разных горизонтах варьировала от 0.01 до 2.85 мг С/м3 (рис. 2). Минимальные величины были приурочены к придонному горизонту (0.01–0.67 мг С/м3), тогда как наибольшие значения этого показателя были отмечены в верхнем 30-метровом слое над склоном желоба Воронина (ст. 5240, 2.38–2.85 мг С/м3) а также в распресненном поверхностном слое воды (ст. 5205, 1.56 мг С/м3). На остальных станциях и горизонтах значения биомассы гетеротрофных нанофлагеллят были более чем в два раза ниже этих значений. Большая часть гетеротрофных организмов, как по численности, так и по биомассе представляла собой округлые клетки без ярко выраженных видовых признаков. Корректное определение видового состава этих форм было невозможно.
Численность бактериопланктона на разных горизонтах открытых районов Карского моря варьировала от 61 до 1762 тыс. кл/мл, что соответствовало значениям биомассы 1.22 –35.2 мг С/м3 (рис. 2). Максимальная величина обилия также наблюдалась в поверхностном распресненном слое ст. 5205. Высокие показатели обилия были отмечены и на более северной станции 5214, которая также находилась под влиянием речного стока, величина обилия бактериопланктона в поверхностном слое составляла 895 тыс. кл/мл (17.9 мг С/м3). В западной части моря была заметна тенденция снижения обилия прокариот с глубиной, тогда как в восточной его части минимальные значения наблюдались в подповерхностном слое на глубинах 18–30 м. Между биомассой флагеллят в воде и концентрацией бактериопланктона была отмечена положительная корреляция (r = = 0.45, p < 0.05). Также обилие бактерий снижалось с глубиной (r = –0.77, p < 0.05).
На большинстве станций соотношение численности гетеротрофных жгутиконосцев и бактериопланктона в водном столбе не превышало 0.15%, при этом значения более 0.1% были приурочены к слою под термоклином. Средние для столба величины составляли 0.04–0.07%. Сходное распределение наблюдалось и для соотношения биомассы гетеротрофных жгутиконосцев и бактериопланктона, средние величины для столба воды варьировали в пределах 6.3–10.5%. Исключение составила станция 5240 над склоном желоба Воронина. Здесь соотношение численности гетеротрофных жгутиконосцев и бактериопланктона достигало 0.25%, а биомассы не опускалось ниже 27%, достигая максимальной величины 94% на горизонте под термоклином (рис. 3).
Рис. 3.
Соотношение биомассы гетеротрофных нанофлагеллят и бактериопланктона в толще воды в западной (а) и восточной (б) частях Карского моря.
По данным, полученным нами в море Лаптевых в это же время, величина выедания бактерий гетеротрофным нанопланктоном была невысока. Максимальная величина составляла 5% от общей численности бактериопланктона в сутки и наблюдалась в поверхностном слое воды в области влияния речного стока. На остальных станциях величина выедания изменялась от 1.4 до 2.1% общей численности бактерий в сутки в поверхностном слое и снижалась с глубиной до 0.1–0.2% общей численности бактерий в сутки в придонных слоях воды. Скорость осветления воды варьировала от 0.5 до 4.65 нл/экз в час (в среднем 2.2 ± ± 1 нл/экз в час) и только в поверхностном слое воды над краем шельфа этот показатель достигал 11.1 нл/экз в час. Потребление бактерий составляло от 0.2 до 9 кл/экз в час, максимальный показатель этого параметра также наблюдался в поверхностном слое воды над краем шельфа, несмотря на отсутствие пика численности бактериопланктона в этой точке.
Используя эти данные для оценки выедания гетеротрофного бактериопланктона нанофлагеллятами и приняв величину скорости осветления равной 2.2 нл/экз в час, для Карского моря были получены величины выедания от 0 до 2% бактериальной биомассы в сутки. Эти величины составляли от 0.1 до 47% биомассы жгутиконосцев. Отношение выедаемой биомассы бактериопланктона к биомассе потребителей в большинстве случаев снижалось с глубиной, наибольшие его значения отмечены на станции 5205 в поверхностном слое воды и на глубине 100 м (47 и 24% соответственно). В северо-западной части моря этот показатель не превышал 10%.
Гетеротрофные микроорганизмы наддонного 20-см слоя воды и верхнего 2 см слоя осадка. Численность бактерий в наддонном слое воды составляла 7468–8881 тыс. кл/мл в западной части Карского моря и 5635–6924 тыс. кл/мл в восточной. Значения биомассы также изменялись в небольших пределах, составляя 173–246.6 мг С/м3 в западной части моря и 111–150.5 мг С/м3 – в восточной. Вклад свободных бактерий, бактерий ассоциированных с детритными частицами размером от 2 до 25 мкм и нитей (длиной от 3 до 10 мкм) в формировании общей численности бактериопланктона составил, в среднем, соответственно, 43.6 ± 6.7% (диапазон: 31.5–54.2%), 55.9 ± ± 6.6% (диапазон: 45.6–68.1%) и 0.5 ± 0.2% (диапазон: 0.2–0.8%), а их доля в суммарной биомассе бактериопланктона составила, в среднем, соответственно, 56.0 ± 7.9% (диапазон: 39.8–62.6%), 41.5 ± 7.9% (диапазон: 35.3–58.0%) и 2.5 ± 1.0% (диапазон: 1.5–4.5%). Численность бактериопланктона в наддонной воде заливов Новой земли в среднем была ниже, чем в аналогичных биотопах восточной и западной частей моря, составляя 3520, 5569 и 3362 тыс. кл/мл, а биомасса – 108, 174 и 95 мг С/м3 соответственно, в заливах Седова, Ога и Степового. Доля свободных бактерий, бактерий ассоциированных с детритными частицами и нитей в общей численности (общей биомассе) бактериопланктона колебалась в пределах, соответственно, 59.0–85.3% (63.0–91.7%), 14.7–40.1% (8.3–32.0%) и 0–0.9% (0–4.1%). В 20 см слое воды над поверхностью донных осадков численность детритных частиц, заселенных бактериями, размером 2–10 мкм и размером 10–30 мкм составила, в среднем, соответственно, 300 ± 106 × 103 частиц/мл и 168 ± 58 × 103 частиц/мл. На одной детритной частице находилось, в среднем, 6–15 бактерий.
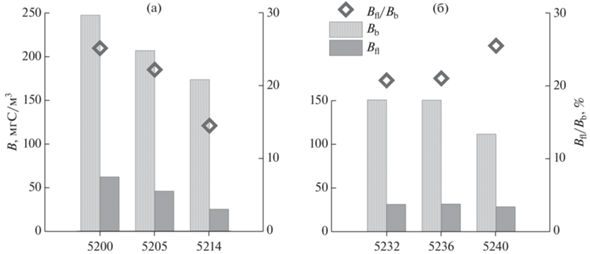
Показатели обилия гетеротрофных нанофлагеллят в наддонной воде варьировали в гораздо меньших пределах, чем в водной толще: в западной части Карского моря этот показатель составлял 6803–9943 кл/мл, в восточной – 4598–6172 кл/мл. Биомасса гетеротрофных нанофлагеллят варьировала в большем диапазоне: в западной части моря ее значения снижались в северном направлении с 61.8 25 до мгС/м3, в восточной части ее величины колебались в пределах 28.4–31.6 мг С/м3 (рис. 4).
Рис. 4.
Биомасса и соотношение биомасс гетеротрофных нанофлагеллят и бактериопланктона в наддонной воде в западной (а) и восточной (б) частях Карского моря.
Численность гетеротрофных нанофлагеллят в наддонной воде заливов Новой земли была существенно ниже, чем в таких же биотопах восточной и западной частей Карского моря, составляя 3504, 1775 и 4050 кл/мл, а биомасса 14.2, 12.5 и 25.8 мг С/м3, соответственно, в заливах Седова, Ога и Степового.
В открытой части моря в 20 cм слое воды над поверхностью донных осадков доли свободных и ассоциированных с детритными частицами гетеротрофных нанофлагеллят в их общей численности составили, соответственно, в среднем 65.6 ± ± 13.2% (диапазон 47–82%) и 34.4 ± 13.2% (диапазон: 18–53%). Доли свободных и ассоциированных с детритными частицами гетеротрофных нанофлагеллят в их общей биомассе составили, соответственно, 70.3 ± 13.9% (диапазон 46–84%) и 29.7 ± 13.9% (диапазон 16–54%). В заливах Новой Земли вклад свободных и прикрепленных к детритным частицам гетеротрофных нанофлагеллят в их общую численность колебался в пределах, соответственно, 53.0–70.2% и 29.8–47.0%, а в их общую биомассу – 64.8–90.3% и 9.7–35.2%, соответственно. Средняя величина численности детритных частиц размером более 10 мкм с прикрепленными гетеротрофными нанофлагеллятами (3.7 ± 2.0 × 103 частиц/мл) была в 45 раз ниже таковой с прикрепленными бактериями, а численность свободных гетеротрофных нанофлагеллят (в среднем 7.8 ± 3.8 × 103 клеток/мл) в 38 раз ниже численности детритных частиц с прикрепленными бактериями размером 2–10 мкм. На одной крупной детритной частице находилось 1–2 жгутиконосца.
Отношение численность гетеротрофных нанофлагеллят/численность бактерий не превышало 0.11%, а отношение биомасса гетеротрофных нанофлагеллят/биомасса бактерий варьировало от 21 до 25% снижаясь до 14% лишь на склоне желоба Св. Анны (ст. 5214) (рис. 4). В заливах Новой Земли отношение численность гетеротрофных нанофлагеллят/численность бактерий находилось в пределах 0.03–0.1%, а отношение биомасса гетеротрофных нанофлагеллят/биомасса бактерий варьировало от 7 до 13%.
В наддонной воде наблюдалась высокая корреляция между численностью гетеротрофных флагеллят и бактерий: r = 0.98, p < 0.05.
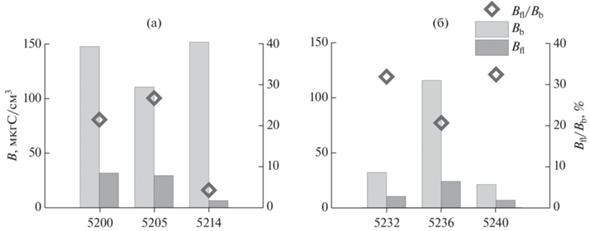
В открытой части моря в верхнем 2-см слое осадка численность гетеротрофных нанофлагеллят варьировала от 1044 до 4407 тыс. кл/мл. Минимальные показатели численности были приурочены к склонам желобов Св. Анны и Воронина (1044 и 1256 тыс. кл/мл соответственно). Сходная картина наблюдалась и для распределения биомассы гетеротрофных нанофлагеллят, ее значения варьировали от 6.4 до 31.5 мкг С/см3. Численность гетеротрофных нанофлагеллят в верхнем 2-см слое осадка заливов Новой земли, как и в наддонной воде, была ниже, чем в таких же биотопах восточной и западной частей Карского моря, составляя 1044, 615 и 2072 тыс. кл/мл, а биомасса 8.6, 5.1 и 18.4 мкг С/см3, соответственно, в заливах Седова, Ога и Степового.
Численность бактерий в верхнем 2-см слое осадка открытых районов Карского моря варьировала от 771 млн. кл/мл до 6168 млн. кл/мл. Биомасса бактерий изменялась от 21 до 151 мкг С/см3 (рис. 5).
Рис. 5.
Биомасса и соотношение биомасс гетеротрофных нанофлагеллят и бактерий верхнего 2-см слоя осадка в западной (а) и восточной (б) частях Карского моря.
В заливах Седова, Ога и Степового обилие бактерий в верхнем 2-см слое осадка составляло, соответственно, 3142, 510 и 14631 млн кл/мл при биомассе 100, 12 и 264 мкг С/см3.
Отношение численность гетеротрофных нанофлагеллят/численность бактерий не превышало 0.16%, тогда как доля биомассы жгутиконосцев от суммарной биомассы бактерий в большинстве случаев варьировала от 21 до 32%, снижаясь до 4% лишь в области склона желоба Св. Анны (ст. 5214). Отношение численность гетеротрофных нанофлагеллят/ численность бактериопланктона в заливах Новой Земли составляло 0.1–3.32%, а соотношение их биомасс варьировало от 8.6 до 42.5%.
ОБСУЖДЕНИЕ
Водная толща. Большинство имеющихся сведений по количественным характеристикам микрогетеротрофов Карского моря относятся к концу вегетационного сезона. Так в августе–сентябре 2007 и 2011 гг. в северо-западной части Карского моря были получены данные по обилию и составу гетеротрофного нанопланктона [8].
В 2007 г. численность гетеротрофных нанофлагеллят в августе–сентябре варьировала в пределах 9 до 424 тыс. кл/л, достигая величин более 100 тыс. кл/л только в верхнем 20–30 метровом слое. Максимальные величины, как численности, так и биомассы (307–369 тыс. кл/л и 7–10.2 мг С/м3) как и в ходе наших наблюдений были приурочены к водам соленостью менее 20 psu. Основной вклад в численность гетеротрофных флагеллят (более 65%) вносили не поддающиеся определению формы. Виды Gyrodinium sp.1, Gyrodinium spp., Gyrodinium spirale, Leucocryptos marina и Monosiga marina наблюдались на всех рассматриваемых акваториях. Также в 2007 г. были многочисленны инфузории, их обилие достигало наиболее высоких значений в верхнем слое 50–80 метров, составляя в среднем 307 ± 250 кл/л или 0.48 ± 0.39 мг С/м3 в южной части района и 108 ± ± 33 кл/л или 0.39 ± 0.19 мг С/м3 в северной. Глубже численность инфузорий в абсолютном большинстве случаев не превышала 40 кл/л, а биомасса – 0.04 мг С/м3.
В августе–сентябре 2011 г. средняя для верхнего 150-метрового слоя воды численность гетеротрофных нанофлагеллят была выше и варьировала от 267 до 694 тыс. кл/л, тогда как величины биомассы сохраняли относительную стабильность, изменяясь от 3 до 3.9 мг С/м3 [8]. Основную долю гетеротрофных жгутиконосцев также представляли не поддающиеся определению клетки. Семь видов гетеротрофных жгутиконосцев: Gyrodinium lachryma, Gyrodinium sp.1, Gyrodinium spirale, Gyrodinium spp., Leucocryptos marina, Monosiga marina, Telonema subtilis были отмечены на всех рассматриваемых станциях. Численность инфузорий в 2011 г. в верхнем 150-метровом слое была крайне низкой и составляла не более 1.9 кл/л; биомасса колебалась от 0 до 9.5 мг С/м3. Глубже инфузории практически не встречались. Число видов инфузорий на разных станциях колебалось от семи до четырнадцати, на всех станциях разреза наблюдались Laboea strobila, Strombidium spp. и тинтиннида Acanthostomella norvegica или ее пустые домики.
В прибрежных водах Карского моря по данным августа-сентября 2009 г. соотношение гетеротрофных жгутиконосцев и бактериопланктона существенно отличалось от наблюдавшегося в открытом море: средние значения численности и биомассы бесцветных жгутиконосцев составляли в морских водах в среднем 91 ± 15 тыс. кл/л и 1.4 ± 0.3 мг/м3, тогда как общая численность бактериопланктона варьировала от 1.05–1.15 до 2.86–3.06 млн кл./мл и составила в среднем 1.94 млн кл./мл [5].
Заливы восточной стороны архипелага Новая Земля изучены относительно хорошо. На данный момент опубликовано 18 работ, материалом для которых послужили данные, собранные в заливах Благополучия, Седова, Ога, Цивольки, Степового, Абросимова. Больше всего публикаций по заливу Благополучия, где рассматриваются гидрофизические и гидрохимические показатели, пикофитопланктон, зоопланктон, мейо- и макробентос, зооперифитон. Бентос и зооперифитон Новой Земли изучен лучше всего, работы опубликованы по всем 6 заливам, в которых проводились исследования. Зоопланктон рассматривается также в заливе Цивольки, химический состав бурых водорослей известен для заливов Благополучия, Цивольки, Степового, Абросимова. Приводимые в нашей работе сведения по бактериопланктону и гетеротрофным флагеллятам заливов Седова, Ога и Степового, являются первыми и пока единственными.
Особенности гидрофизической и гидрохимической структуры заливов Новой Земли, связанные с режимом пресного и ледникового стока, обменом с прибрежными водами Карского моря, поступлением биогенных элементов в воды заливов при растворении пород берегов, определяют существование биоты, в том числе, бактерий и гетеротрофных жгутиковых. При этом характерной чертой пресноводного стока является выраженная сезонность и крайне высокое содержание минеральной фракции, что несомненно сказывается на обилии, структуре и функционировании пико-, нано-, и микропланктона.
Данные по количественным характеристикам гетеротрофных флагеллят других районов Арктики довольно скудны. В планктоне шельфа и континентального склона моря Лаптевых в составе гетеротрофных нанофлагеллят в конце вегетационного сезона 2015 г. наиболее широко были представлены виды Bodo saltans, Paraphysomonas imperforata, Paraphysomonas sp. и Procryptobia sorokini [7]. Относительно высокие количественные показатели гетеротрофных нанофлагеллят (1.6–4.6 мг С/м3) были отмечены на внутреннем и срединном шельфе. В области внешнего шельфа и континентального склона этот показатель снижался до 0.8–2.4 мг С/м3. Максимальные количественные показатели обилия нанофлагеллят по вертикали были приурочены либо к поверхностному слою, либо к придонной воде.
На шельфе Восточно-Сибирского моря в сентябре 2017 г. численность гетеротрофных нанофлагеллят варьировала от 251 до 1227 тыс. кл/мл, наибольшие значения обилия наблюдались в придонных горизонтах. Величины биомассы изменялись в пределах от 1.6–10.2 мг С/м3 и составляли от 6 до 59% биомассы бактериопланктона [6].
В Чукотском море летом 2010 г. численность гетеротрофных нанофлагеллят в воде составляла от 73 до 2700 тыс. кл/л, составляя в среднем 520 кл/мл. В области шельфа Чукотского моря высокие величины обилия гетеротрофных нанофлагеллят наблюдались в подповерхностном слое с максимумом хлорофилла. Гетеротрофные нанофлагелляты размерной фракции 2–6 мкм составляли меньшую часть микрозоопланктонного сообщества (9–18% общей биомассы). Обилие инфузорий варьировало от 17 до 5620 кл/л, составляя в среднем 763 ± 840 кл/л. Гетеротрофный нано- и микрозоопланктон вносили больший вклад в выедание автотрофного пико- и нанопланктона (выедая 89.37 ± 20.5 и 82.37 ± 22.5% первичной продукции, соответственно), чем диатомовых (62.57 ± 20.5% первичной продукции) [34].
По данным, полученным в центральной Арктике основная биомасса гетеротрофных флагеллят была приурочена к верхнему слою толщиной 40–60 м. От 72 до 95% гетеротрофных флагеллят было представлено размерной фракцией менее 5 мкм. При этом участие в выедании фитопланктона принимали все гетеротрофные организмы от крупных инфузорий и динофлагеллят до 2-мкм нанофлагеллят. В летний период биомасса гетеротрофных простейших в верхнем 40-метровом слое воды составляла 4.5 ± 2.7 и 3.3 ± 1.6 мгС/м3 для размерных групп 2–20 и 20–200 мкм, соответственно. Глубже биомасса гетеротрофных простейших снижалась до 1.3 ± 0.4 и 0.83 ± 0.3 мгС/м3 для размерных групп 2–20 мкм и 20–200 мкм, соответственно, в слое воды 80–120 м [32].
Наддонная вода. В Карском море в 20 см слое воды над поверхностью донных осадков обнаружены высокие величины численности и биомассы бактерий и гетеротрофных нанофлагеллят. Причем доля жгутиковых ассоциированных с детритными частицами заселенными бактериями размером 10–25 мкм составляла около 30% их общей численности и биомассы. Присутствие гетеротрофных нанофлагеллят на большом количестве крупных детритных частицах свидетельствует, что они в составе этих частиц могут потребляться не только тонкими, но и грубыми фильтраторами. Более высокая численность гетеротрофных нанофлагеллят в пограничном слое вода-дно по сравнению с вышерасположенными слоями, возможно, также связана с меньшим их выеданием благодаря высокой концентрацией в этом слое детритных частиц с прикрепленными бактериями, сопоставимого со жгутиковыми размера.
В сентябре 2007 г. также был проанализирован количественный и видовой состав гетеротрофных организмов в слое наддонной воды и наилка Карского моря [9]. В наддонном слое воды большая часть гетеротрофных организмов представляла собой округлые клетки без выраженных видовых признаков, размером 2–5 мкм. Жгутиковые формы в суммарной численности этих клеток составляли менее 5%. Идентифицированные виды относились к планктонным формам, главным образом это были представители рода Gyrodinium, размером от 6 до 20 мкм. Максимальные значения численности и биомассы гетеротрофного нанопланктона в наддонной воде составляли 13 экз/мл и 0.62 мг С/м3 соответственно. Численность инфузорий в наддонном слое воды также была крайне низка и превышала 1 кл/мл только в устье Оби. В слое наилка с придонной взвесью было обнаружено 33 вида гетеротрофных жгутиконосцев. Численность и разнообразие видов инфузорий в слое наилка была крайне низка на всех станциях. Максимальные значения плотности инфузорий наблюдались в эстуарной области р. Обь и достигали 48 кл/см3. В основном же в пробах были отмечены единичные представители немногочисленных видов. По данным 2007 г. численность гетеротрофных жгутиконосцев в наддонной воде положительно коррелировала с биомассой бактерий, равно как и обилие инфузорий в осадках и в наддонной воде коррелировало с бактериальной численностью (r = 0.52 и 0.53, p < < 0.05) [9].
Значения численности и биомассы гетеротрофных нанофлагеллят в наддонной воде моря Лаптевых в конце вегетационного сезона составляли 851 ± 400 кл/мл и 14.2 ± 7.1 мг С/м3, соответственно, а бактерий: 2.07 ± 1.04 × 106 кл/мл и 25.4 ± 13.0 мг С/м3, соответственно [7]. Эти показатели превышали значения концентрации клеток в придонной воде (горизонт 1–3 метра над дном) в несколько раз.
Верхний 2-см слой осадка. Полученные в нашей работе величины численности гетеротрофных нанофлагеллят в верхнем слое донных осадков в Карском море (0.6–4.4 млн. кл/мл) выше численности бентосных флагеллят в Северном море (максимальные значения 0.8–1.1 млн. кл/мл) и соизмеримы с концентрацией бентосных гетеротрофных нанофлагеллят в верхнем слое донных осадков в море Лаптевых (1.3–5.5 млн. кл/мл) [7, 20].
Видовой состав гетеротрофных жгутиконосцев верхнего 0.5-см слоя осадка сублиторали и батиали Карского моря в сентябре 2007 г., как мы уже говорили, был представлен 33 видами и формами с преобладанием Kinetoplasta, Stramenopiles, Apusomonadida и Choanoflagellata, при этом общее видовое богатство флагеллят снижалось с глубиной [10]. В составе сообществ из наилка и из грунтов по обилию и частоте встречаемости преобладали одни и те же виды гетеротрофных жгутиконосцев (Salpingoeca ruttneri, Paraphysomonas sp., Cafeteria roenbergensis). При этом трофическая структура сообществ наилка упрощалась по сравнению с сообществами грунтов, что выражалось в отсутствии хищных эукариотрофных видов.
Потребление бактерий. Анализ характеристик потребления бактерий нано- и микрогетеротрофами показал, что полученная нами средняя величина осветления воды 2.2 нл/экз в час (от 0.5 до 4.65 нл/экз в час) оказалась чуть ниже значений, описанных летом 1994 года в центральной Арктике: 2.5–5.6 нл/кл в час для размерной группы 2–10 мкм [31]. Доля выедаемой в час гетеротрофными нанофлагеллятами биомассы бактериопланктона на большинстве горизонтов находилась в пределах 0.01–0.5% биомассы потребителей, и даже в поверхностном слое этот показатель не превышал 2%. Эта величина сильно ниже значений часовых рационов флагеллят, описанных нами для юго-восточной части Тихого океана (7.2–36%) [4], а также величин выедания, полученных для Восточно-Сибирского моря [6]. Можно предположить, что в момент наших исследований в Карском море значительную часть рациона гетеротрофных флагеллят составлял автотрофный пикопланктон. Косвенно это можно подтвердить и тем фактом, что величина выедания фитопланктона мезозоопланктоном составляла около 5–7% первичной продукции в западной части и до 25% в восточной части Карского моря [11], тогда как содержание нанофлагеллят в столбе воды составляло единицы процентов от биомассы зоопланктона [3].
Существуют и данные по потреблению жгутиконосцами бактериопланктона в сентябре 2017 г. в Восточно-Сибирском море, где выедание бактерий было основным фактором снижения их концентрации, а убыль бактерий за сутки составляла в среднем 25.6% численности бактериопланктона или 64.4% бактериальной продукции [6].
Основываясь на обилии простейших в наддонном слое воды, расчет их рационов показал, что в прибрежных районах Карского моря биомасса бактерий практически всегда превышала суммарный рацион гетеротрофных жгутиковых и инфузорий. В открытых же районах Карского моря биомасса бактерий либо ниже, либо находится в пределах величин суммарного рациона простейших. Рационы, рассчитанные только для гетеротрофных жгутиконосцев, в большинстве случаев компенсируются наличной биомассой бактерий [9].
ЗАКЛЮЧЕНИЕ
Таким образом, на основании всех имеющихся данных можно заключить, что обилие гетеротрофных флагеллят в Карском море в конце вегетационного сезона относительно стабильно в разные годы, тогда как в других морях (Восточно-Сибирское и Чукотское моря) описанные значения этого показателя выше в 1.5–2 раза. Различия в характеристиках нано- и микропланктона между западной и восточной частями Карского моря иногда довольно существенны. Картина вертикального распределения гетеротрофных нанофлагеллят также варьирует в разных районах и морях, в значительной степени в зависимости от распределения источников питания: максимумы обилия могут быть приурочены как к слою над пикноклином или горизонтам с наибольшей флуоресценцией, где наблюдается максимум численности и биомассы пико- и мелкого нанопланктона, так и к придонному слою, где возрастает концентрация ассоциированных со взвесью бактерий и мелких жгутиконосцев. Показатели обилия гетеротрофных нанофлагеллят в наддонной воде меняются в существенно меньших пределах, чем в водной толще.
Обилие гетеротрофных нанофлагеллят в наддонной воде заливов Седова, Ога и Степового архипелага Новая Земля существенно ниже, чем в таких же биотопах восточной и западной частей Карского моря. Большую часть организмов составляют свободноживущие формы. С частицами детрита связаны около трети простейших.
В открытых районах Карского моря более высокая численность гетеротрофных нанофлагеллят в воде наблюдается у дна. Присутствие здесь большого количества детритных частиц близких размеров, вероятно, снижает их выедание мелкими организмами. Присутствие же флагеллят на крупных детритных частицах способствует тому, что они в составе этих частиц могут потребляться крупными планктонными и бентосными фильтраторами.
Отношение биомассы гетеротрофных жгутиковых к биомассе бактерий возрастает в слое наддонной воды и в верхнем слое осадков по сравнению с водной толщей более чем в два раза, что указывает на увеличение вклада бактерий в рацион гетеротрофных жгутиконосцев в донных сообществах. Для водного столба Карского моря рассчитанная величина выедания бактериопланктона жгутиконосцами не превышает 2% их биомассы, что гораздо ниже значений, описанных для других районов Арктики. Отношение выедаемой биомассы бактериопланктона к биомассе потребителей в большинстве случаев снижается с глубиной.
Низкая величина выедания бактериопланктона жгутиконосцами косвенно может указывать на пикофитопланктон как один из основных источников пищи гетеротрофных жгутиковых в исследуемый период. Например, в аналогичный сезон вклад автотрофного пикофитопланктона в суммарную величину хлорофилла на станциях залива Благополучия колебалась от 12 до 24% и с глубиной существенно не менялся. В открытых районах Карского моря доля пикофитопланктона значительно возрастает с глубиной, достигая 46–54% на глубинах 20–25 м [1, 2].
Источник финансирования. Экспедиционные исследования проведены при целевой финансовой поддержке ФАНО РФ и выполнены в рамках многолетней программы “Экосистемы морей Сибирской Арктики”. Пребывание на борту судна и сбор материала оплачены из Гранта РФФИ Кар_А №14-05-05003 и темы Госзадания № FMWE-2021-0007. Подготовка и обработка проб выполнена за счет гранта Российского научного фонда № 22-17-00011, http://rscf.ru/project/22-17-00011.
Список литературы
Белевич Т.А., Ильяш Л.В., Демидов А.Б., Флинт М.В. Распределение пикофитопланктона на Обском разрезе и в западной части Карского моря // Океанология. 2019. Т. 59. № 6. С. 964–973.
Белевич Т.А., Милютина И.А., Троицкий А.В., Флинт М.В. Пикофитопланктон залива Благополучия (Архипелаг Новая Земля) и прилегающего района Карского моря // Океанология. 2020. Т. 60. № 4. С. 545–555.
Дриц А.В., Кравчишина М.Д., Пастернак А.Ф. и др. Роль зоопланктона в вертикальном потоке вещества в Карском море и море Лаптевых в осенний сезон // Океанология. 2017. Т 57. № 6. С. 934–948.
Копылов А.И. Роль гетеротрофных нанофлагеллят в функционировании морских и пресноводных эко систем. Автореф. дис. дра биол. наук. М.: Ин-т океанологии им. П.П. Ширшова РАН, 2003. 40 с.
Копылов А.И., Косолапов Д.Б., Заботкина Е.А. и др. Планктонные вирусы, гетеротрофные бактерии и нанофлагелляты в пресных и морских водах бассейна Карского моря (Арктика) // Биология внутренних вод. 2012. № 3. С. 15–25.
Копылов А.И., Косолапов Д.Б., Заботкина Е.А. и др. Распределение и взаимоотношения гетеротрофных микроорганизмов и вирусов на шельфе Восточно-Сибирского моря // Океанология. 2021. Т. 61. № 2. С. 250–263.
Косолапова Н.Г., Косолапов Д.Б., Копылов А.И., Романенко А.В. Гетеротрофные нанофлагелляты в пелагиали и донных отложениях восточной части моря Лаптевых // Океанология. 2019. Т. 59. № 6. С. 974–986.
Романова Н.Д., Сажин А.Ф. Гетеротрофный микропланктон южной оконечности желоба Святой Анны в осенний период (Карское море) // Океанологические исследования. 2018. Т. 46. № 3. С. 116–129.
Романова Н.Д., Мазей Ю.А., Тихоненков Д.В. и др. Сообщества гетеротрофных микроорганизмов на границе “вода дно” в Карском море // Океанология. 2013. Т. 53. № 3. С. 375–375.
Тихоненков Д.В., Бурковский И.В., Мазей Ю.А. Свободноживущие гетеротрофные жгутиконосцы сублиторали и батиали Карского моря // Биология моря. 2015. Т. 41. № 3. С. 196–204.
Флинт М.В., Арашкевич Е.Г., Артемьев В.А. и др. Экосистемы морей Сибирской Арктики. Материалы экспедиционных исследований 2015 и 2017 гг. // М.: ИО РАН. 2018. 232 с.
Azam F., Fenchel T., Field J.G. et al. The ecological role of water-column microbes in the sea // Marine Ecology Progress Series. 1982. V. 10. P. 257–263.
Boenigk J., Arndt H. Bacterivory by heterotrophic flagellates: community structure and feeding strategies // Antonie van Leeuwenhoek. 2002. V. 81. P. 465–480.
Borsheim K.Y., Bratbak G. Cell volume to carbon conversion factors for a bacterivorous Monas sp. enriched from seawater // Mar. Ecol. Prog. Ser. 1987. V. 36. P. 171–175.
Caron D.A. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy, and comparison with other procedures // Appl. Environ. Microbiol. 1983. V. 46. № 2. P. 491–498.
Caron D.A. Protistan Herbivory and Bacterivory // Marine Microbiology. 2001. V. 30. P. 289–315.
Danovaro R., Middelboe M. Separation of free virus particles from sediments in aquatic systems. In: Steven Wilhelm, Markus Weinbauer, Curtis Suttle (Eds.) // Manual of Aquatic Viral Ecology. 2010. P. 74–81.
Fenchel T. Ecology of heterotrophic microflagellates. II. Bioenergetics and growth // Mar. Ecol. Prog. Ser. 1982. V. 8. P. 225–231.
Fenchel T. The microbial loop – 25 years later // Journal of Experimental Marine Biology and Ecology. 2008. V. 366. P. 99–103.
Hondeveld B.J.M., Nieuwland G., Van Duyl F.C., Bak R.P.M. Temporal and spatial variations in heterotrophic nanoflagellate abundance in North Sea sediments // Mar. Ecol. Prog. Ser. 1994. V. 109. P. 235–243.
Kopylov A.I., Zabotkina E.A., Romanenko A.V. et al. Viruses in the water column and the sediment of the eastern part of the Laptev Sea. Estuarine, Coastal and Shelf Science. 2020. 242: Art. 106836. https://doi.org/10.1016/j.ecss.2020.106836
Lee S., Fuhrman J.A. Relationships between biovolume and biomass of naturally derived marine bacterioplankton //Applied and environmental microbiology. 1987. V. 53. № 6. P. 1298–1303.
Levinsen H., Nielsen T.G. The trophic role of marine pelagic ciliates and heterotrophic dinoflagellates in arctic and temperate coastal ecosystems: A cross-latitude comparison // Limnol.Oceanogr. 2002. V. 47. № 2. P. 427–439.
Levinsen H., Turner J.T., Nielsen T.G., Hansen B.W. On the trophic coupling between protists and copepods in arctic marine ecosystems // Marine Ecology Progress Series. 2000. V. 204. P. 65–77.
Menden-Deuer S., Lessard E.J. Carbon to volume relationship for dinoflagellates, diatoms, and other protist plankton // Limnol.Oceanogr. 2000. V. 45. P. 569–579.
Nejstgaard J.C., Naustvoll L–J., Sazhin A. Correcting for underestimation of microzooplankton grazing in bottle incubation experiments with mesozooplankton // Mar. Ecol. Progr. Ser. 2001. V. 221. P. 59–75.
Norland S. The relationship between biomass and volume of bacteria // Handbook of Methods in Aquatic Microbial Ecology. Boca Raton: Lewis Publ., 1993. P. 303–308.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting aquatic microflora // Limnol. Oceanog. 1980. V. 25. № 5. P. 943–948.
Rokkan K.I., Lena Seuthe L. Seasonal microbial processes in a high-latitude fjord (Kongsfjorden, Svalbard): I. Heterotrophic bacteria, picoplankton and nanoflagellates // Polar. Biol. 2011. V. 34. P. 731–749.
Rysgaard S., Nielsen T.G., Hansen B.W. Seasonal variation in nutrients, pelagic primary production and grazing in a high-Arctic coastal marine ecosystem, Young Sound, Northeast Greenland // Marine Ecology Progress Series. 1999. V. 179. P. 13–25.
Sherr E.B., Sherr B.F., Fessenden L. Heterotrophic Protists in the Central Arctic Ocean // Deep-Sea Res. II. 1997. V. 44. P. 1665–1682.
Sherr E.B., Sherr B.F., Wheeler P.A., Thompson K. Temporal and spatial variation in stocks of autotrophic and heterotrophic microbes in the upper water column of the central Arctic Ocean // Deep Sea Research Part I: Oceanographic Research Papers. 2003. V. 50. № 5. P. 557–571.
Vosjan J.H., van Noort G.J. Enumerating nucleoid-visible marine bacterioplankton: bacterial abundance determined after storage of formalin fixed samples agrees with isopropanol rinsing method // Aquatic microbial ecology. 1998. V. 14. №. 2. P. 149–154.
Yang E.J., Ha H.K., Kang S.H. Microzooplankton community structure and grazing impact on major phytoplankton in the Chukchi sea and the western Canada basin, Arctic ocean // Deep Sea Research Part II: Topical Studies in Oceanography. 2015. V. 120. P. 91–102.
Дополнительные материалы отсутствуют.