Океанология, 2023, T. 63, № 3, стр. 405-417
Оценка качества донных отложений Финского залива по составу мейобентоса в сочетании с биотестированием и химическим анализом
Н. А. Березина 1, *, В. А. Петухов 1
1 Зоологический институт РАН
Санкт-Петербург, Россия
* E-mail: nadezhda.berezina@zin.ru
Поступила в редакцию 26.07.2022
После доработки 29.09.2022
Принята к публикации 16.12.2022
- EDN: SRMJFR
- DOI: 10.31857/S0030157423030024
Аннотация
Для оценки потенциальной загрязненности донных отложений в Финском заливе Балтийского моря был применен триадный подход – по составу загрязнений в донных отложениях, показателям донной фауны и биотестированию. Объектом исследований был выбран мейобентос, в целом менее чувствительной к естественным нарушениям природной среды. Комплексный подход, основанный на химическом анализе, биотестировании с использованием амфипод и биоиндикации по составу мейобентоса, подкреплённый анализом главных компонент, позволил выделить группы станций, сходных по условиям и степени загрязнения. Предложенный метод перспективен для дальнейшего развития и возможного применения в мониторинге.
ВВЕДЕНИЕ
Донные отложения – важный компонент водных экосистем, они могут накапливать вредные вещества и быть источником вторичного загрязнения воды, что влияет на продуктивность морских биоценозов. Для оценки загрязненности донных отложений токсичными химическими веществами предложено использовать комплексный триадный подход [18]. Он включает химический анализ, биоиндикацию по донному сообществу и лабораторное биотестирование. Бентосные беспозвоночные используются в качестве индикаторов для обнаружения, в связи с их быстрой реакцией как на острые, так и на длительные множественные стрессоры антропогенного происхождения [38]. Причем в каждом конкретном регионе для такой оценки требуется выбор чувствительных к тому или иному типу антропогенного загрязнения групп-индикаторов из бентоса.
Многие бентосные ракообразные-амфиподы тесно связаны с донными отложениями благодаря своей роющей активности и/или проглатыванию их частиц при питании, поэтому они обладают высоким индикационным потенциалом для проверки токсичности донных отложений. Различные виды амфипод широко используются в биотестировании донных отложений по их выживаемости [16, 34], в том числе, в Балтийском регионе [17, 28, 43]. Они хорошо выявляют наличие загрязнения водной среды тяжелыми металлами, оловоорганическими соединениями и сточными водами [20, 25, 26].
В Финском заливе Балтийского моря зообентос обеднен, что связано с естественными гидрометеорологическими процессами, уменьшением речного стока и ухудшением кислородного режима глубинных вод и интенсивной хозяйственной деятельностью [6, 11]. Мейофауна, в целом, менее чувствительна, чем макрофауна к такого рода нарушениям природной среды [7, 8]. В морских экосистемах основную долю численности групп многоклеточного мейобентоса обычно формируют нематоды (Nematoda) и гарпактициды (Copepoda). Эти группы животных чувствительны к изменяющимся физическим и химическим условиям среды, что привело к использованию их показателей в оценке качества водных экосистем, особенно в случае органического загрязнения (эвтрофирования) и мультикомпонентного загрязнения [2, 5, 14, 16, 44, 45].
Значимость мейобентоса в прибрежных и эстуарных зонах Балтийского моря определяется, прежде всего, относительно высоким таксономическим разнообразием и активным участием этой функциональной группы в круговороте веществ и трансформации потока энергии [7]. В 2008–2009 гг. в восточной части Финского залива (не включая пресную Невскую губу) был обнаружен богатое сообщество мейобентоса: 26 видов нематод, несколько видов гарпактицид (Canthocamptus staphylinus (Jurine, 1820), Harpacticidae gen. sp.) и других копепод (Cyclocypris ovum (Jurine, 1820), Limnocythere inopinata (Baird, 1843), Eucyclops sp.) [7]. Средние биомассы эвмейобентоса составили 0.2–0.5 г/м2 на глубинах 20–30 м, заметно снижаясь на глубинах свыше 40 м.
Вопрос о возможности использования мейобентоса в целях мониторинговой оценки состояния донных отложений в Балтийском море, где показатели донной макрофауны крайне нестабильны из-за периодически возникающей придонной гипоксии, вызывает особый интерес.
Настоящая работа посвящена оценке качества донных отложений в Финском заливе по выживаемости амфипод, биоиндикационным показателям мейобентоса и аналитическому измерению содержания тяжелых металлов и нефтепродуктов в донных отложениях из зон повышенного риска накопления загрязняющих веществ и из чистых местообитаний. Как известно, нематоды более устойчивы к загрязнению, чем бентосные копеподы, что приводит к изменению соотношения между ними [34, 36]. Соотношение нематод и копепод (известное как индекс Раффаэлли и Мейсона [35]) меняется в условиях эвтрофикации различной природы в различных морях; как правило, по мере эвтрофикации доля нематод в мейобентосе растет, а гарпактицид снижается [36]. В данной работе мы рассчитали это соотношение в числе других показателей мейобентоса с целью ответить на вопрос: может ли соотношение между численностью нематод и копепод служить показательным индикатором состояния окружающей среды, в частности, в случае загрязнения среды металлами и нефтепродуктами, которые относятся к приоритетным загрязнениям в Финском заливе?
МАТЕРИАЛ И МЕТОДЫ
Месторасположение и особенности акватории. Финский залив – один из крупнейших заливов Балтийского моря – глубоко вдается в сушу, вытягиваясь с запада на восток на 420 км (рис. 1). По гидрохимическим и биологическим особенностям рассматриваемый водоем подразделяется на два естественных района – пресноводную Невскую губу и солоноватоводную восточную часть Финского залива, разделенных искусственной дамбой (Комплексом защитных сооружений г. Санкт-Петербурга от наводнений). Особенностью гидрологического режима Финского залива является ярко выраженная вертикальная стратификация водной толщи в течение большей части года, затрудняющая аэрацию придонной воды. Вследствие этого бенталь залива четко разделяется на две зоны с различным газовым режимом с границей на глубине 20–30 м, слое залегания летнего термоклина. Участки, расположенные выше этих глубин, характеризуются благоприятными для бентоса условиями, а для районов глубже 40–50 м может формироваться выраженный дефицит кислорода, ведущих в отдельные годы к замору и гибели всех донных животных [7]. Залив находится под влиянием человеческой деятельности, действует несколько портов (Санкт-Петербург, Усть-Луга), нефтеналивной терминал (Приморск), Ленинградская АЭС (Копорская губа). Масштабные дноуглубительные работы были ранее проведены в Лужской губе, а в настоящее время проводятся в Невской губе, в районе строительства порта Бронка и развития новых территорий – морского фасада г. Санкт-Петербурга. Они сопровождаются увеличением мутности и вторичным выделением многих химических веществ из осадков. В последние десятилетия большая часть сточных вод г. Санкт-Петербурга проходит очистку перед сбросом в залив. Тем не менее, сохраняется вторичное загрязнение вод от исторических сбросов (в 1970–1990-е гг.).
Рис. 1.
Карта-схема расположения 11 станций отбора проб донных отложений и станции отбора амфипод Gmelinoides fasciatus (Ref) в восточной части Финского залива.
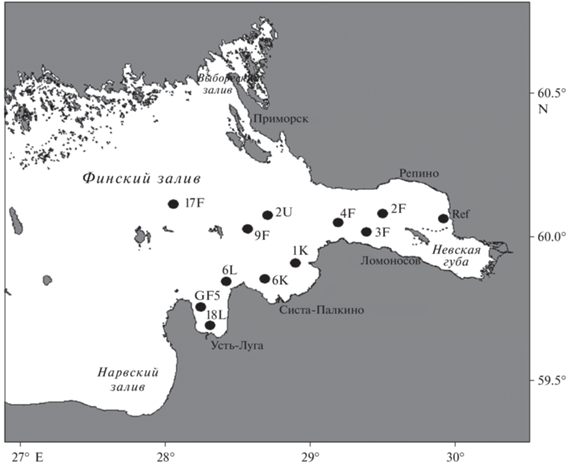
Методы отбора проб. Отбор проб донных отложений и мейобентоса проводили 7–14 сентября 2020 г. на 11 станциях в российской части Финского залива (рис. 1). С целью сбора сравнимого материала использовали разработанный гидравлический дночерпатель ДГ-0.08 (производитель ФГУНПП “СЕВМОРГЕО”, площадь захвата 0.08 м2) типа дночерпателя Ван-Вина. Дночерпатель имеет гидравлический закрывающий механизм, срабатывающий сразу при соприкосновении с грунтом. Верхняя панель дночерпателя оборудована двумя откидными крышками, через которые после подъема прибора на борт судна были отобраны пробы мейобентоса и донных отложений для биотестирования и анализа металлов и нефтепродуктов. Мейобентос отбирали с помощью трубчатого пробоотборника диаметром 5 см заглублением 5 см (площадь 20 см2) по три повтора на каждой станции. Учитывая, что при отборе мейобентоса из дночерпателя некоторыми авторами отмечены потери в количестве, и для определения адекватности использованного нами метода дополнительно на четырех станциях (17F, 2U, 2F и 4F) пробы мейобентоса были собраны стратометром, оснащенным 40-см трубками (диаметр 3 см, площадь 14 см2) по 4 трубки с каждой станции со слоем осадка около 5 см. В дальнейшем было проведено сравнение численности групп мейобентоса, собранного разными методами.
Кроме этого, отбиралась придонная вода и проводились измерения вертикальных профилей солености и температуры воды с помощью океанологического зонда CTD SBE 19plus V2 с пробоотборной системой карусельного типа SBE32SC (Sea-Bird Scientific, США).
Химический анализ. Химический анализ воды и донных отложений выполнялись в аккредитованной аналитической лаборатории (ООО “ЛАБОРАТОРИЯ”, ecolabspb.ru). Все образцы донных отложений перед анализом высушивали в печи при 30°С и просеивали через пластиковое сито с диаметром пор 1 мм. Проходящую фракцию измельчали в агатовой ступке и расщепляли, используя комбинацию сверхчистых кислот HCl/ HF/HNO3 (1 : 1 : 1) в микроволновой печи Mars 5 (CEM, США). Продукты расщепления переносили в полипропиленовые флаконы, разбавляли до 50 мл деионизированной водой (ISO 3696). Анализ содержания металлов Cu, Zn, Pb и Cd проводили методом ИСП-ОЭС – оптической эмиссионной спектрометрии с индуктивно связанной плазмой на спектрометре серии iCAP6300 по методике М-МВИ 80-2008. Точность измерений (<5% извлечения) контролировали с помощью сертифицированного стандарта (CRM 5365-90). Ртуть определяли экстракционно-фотоколориметрическим методом. Точность измерения контролировалась с использованием сертифицированного стандарта (CRM 5365-90) и обеспечивала подходящее извлечение (<5%).
Анализ содержания полициклических ароматических гидрокарбонатов (ПАУ) проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на флуоресцентном детекторе (метод ФР.1.31.2004.01279). Анализ соединений ПАУ в отложениях в основном включает экстракцию органическими растворителями, очистку и разделение с помощью ВЭЖХ с ультрафиолетовым излучением.
Содержание кислорода в придонной воде определяли методом Винклера. Содержание общего фосфора определяли фотометрическим методом. Гранулометрический состав донных отложений определяли стандартным методом [12]. Содержание органического углерода в процентах на сухой вес донных отложений измеряли на анализаторе АН-7529М методом колориметрического титрования, предел обнаружения 0.03–9.99%.
Показатели мейобентоса. Согласно общепринятым правилам и возможности дальнейшего сравнения с литературными данными, все значения численности мейобентосных организмов приведены к единой размерности – экз./10 см2 [9]. Соотношение нематод/копепод (N/C индекс) было предложен Раффаэлли и Мэнсон [35] в качестве быстрого и простого метода первичной оценки влияния обогащения органическим веществом прибрежных отложений. Позднее [40] при расчете этого индекса предложили рассматривать только интерстициальные формы копепод (т.е. в основном, Harpacticoida). Эта условие учтено в последней модификации индекса [34]. Мы следовали стандартной методологии обработки проб [39], обеспечивающей получение надежных данных для расчета N/C индекса. В частности, индекс рассчитывали индивидуально для каждого из трех повторов, взятых на каждой станции. Если вариабельность между образцами была приемлемой (менее двух порядков), то рассчитывали среднее значение индекса для этого участка. Индекс вычислялся по формуле: N/C = (Nnem + + Nmin)/(Ncop + Nmin), где значения Ni – значения численности нематод или копепод на i-ой станции, а Nmin – минимальная численность из зарегистрированных для данной выборки.
Биотестирование. Амфиподы Gmelinoides fasciatus были собраны из природной популяции в восточной части Финского залива в районе парка Дубки (Сестрорецк, станция Ref, рис. 1) и перевезены в изотермических контейнерах в лабораторию. Они использованы в десятисуточном тесте на выживаемость, который основан на процедурах, описанных в таблице 1. Исследуемые донные отложения перед тестированием просеивали через сито с ячеей 0.25 мм для устранения попадания других беспозвоночных. После трехсуточного периода уравновешивания сред в каждый стакан (объемом 0.5 л) вводили по 20 экз. тестовых животных. Во время проверочных экспериментов воду в стаканах осторожно аэрировали аквариумным насосом через наконечник пипетки, закрепленной в 2 см выше осадка. При этой экспериментальной процедуре концентрация растворенного кислорода и рН поддерживались на одном уровне от начала до конца экспозиции. Амфипод ежедневно кормили смесью корма для рыб (TetraMin®) и сушеных водорослей (1 : 3).
Таблица 1.
Протокол проведения биотестирования с использованием амфипод Gmelinoides fasciatus (острая токсичность донных отложений)
| Испытательная камера | Стакан, объем 1 л |
|---|---|
| Температура и освещение | 20°C; День : ночь = 12 : 12 |
| Объем осадка | Не менее 60 мл (до 100 мл) до глубины отложения осадка 1.5–2 см в стакане |
| Уровень вышележащей воды | 700 мл (потери на испарение замещаются деионизированной водой) |
| Аэрация | Да, наконечник пипетки расположен на 2 см выше поверхности осадка |
| Методы добавления воды | Отложения следует добавлять так, чтобы свести к минимуму смешивание отложений с вышележащей водой |
| Время уравновешивания | Не менее 3 дней до добавления животных |
| Плотность подопытных животных | 20 взрослых особей (самцов) |
| Количество повторов | Три |
| Кормление | Сухие водоросли и хлопья для рыб Тетра-Мин из расчета 3 мг два раза в неделю |
| Завершение теста | Вышележащую воду следует тщательно декантировать, а осадок промывать через мелкое сито, затем подопытных животных промывают в стеклянной посуде для подсчета и анализа состояния |
После 10-дневного периода воду осторожно декантировали, а осадок просеивали через сито с отверстиями 0.5 мм для удержания амфипод, которых затем промывали в стеклянной посуде, подсчитывали и взвешивали. Выживаемость амфипод в каждом варианте рассчитывали, как процент живых особей в конце опыта по отношению к исходной численности, затем рассчитывали среднюю величину для каждой станции.
Полученные величины индексов и уровня загрязнения различными веществами для всех станций были ранжированы по наибольшему значению эффекта или измеренной концентрации (принято как 100%). Ранжированные данные были использованы в анализе главных компонент на основе корреляций. Кроме этого был рассчитан ранговый коэффициент корреляции Спирмена. Вычисления проводили в программе Statistica 10.
РЕЗУЛЬТАТЫ
Гидрохимические условия. Гипоксийные явления в восточной части Финского залива появляются эпизодически в период летней стагнации на глубинах свыше 30 м. В исследованный период кислородный режим практически на всех глубинах был благоприятным, гипоксия в придонном слое не обнаружена. Пониженное содержание кислорода отмечено на одной станции 17F с глубиной >50 м (табл. 2). Глубина насыщенного кислородом слоя (отложения серого цвета) составляла около 5 см. Общий органический углерод в отложениях колебался в пределах 0.5–7.1% (табл. 3). По уровню загрязнения металлами выделялись станции 2U, 4F, 9F и 17F, где уровни кадмия достигали и превышали порог допустимых концентраций (1 мг/кг). Здесь же обнаружены повышенные содержания ртути (табл. 3). Также, ст. 4F и ст. 6L выделялись повышенным уровнем ПАУ. Высокие концентрации общего фосфора были отмечены на ст. 2F и 4F, этот район залива можно охарактеризовать как один из более эвтрофируемых. Хозяйственно-бытовые и канализационные стоки от точечных источников на берегу залива (дачи, кафе) содержат азот и фосфор, которые вызывают “цветение” воды и эвтрофикацию водоема.
Таблица 2.
Физико-химические характеристики условий и значения общей численности мейобентоса (N meio, экз./10 см2), числа видов (SR), индекса N/C и выживаемости амфипод (Surv, %) на станциях отбора и донных отложений в период отбора проб.
| Показатель | Станции | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2F | 3F | 4F | 2U | 9F | 1K | 6K | 6L | 18L | GF5 | 17F | |
| H | 23 | 24 | 28 | 36 | 35 | 15 | 26 | 28 | 10 | 22 | 52 |
| S | 2.1 | 1.4 | 2.3 | 2.6 | 3.0 | 2.7 | 3.0 | 3.1 | 2.9 | 3.2 | 3.6 |
| T | 15.0 | 17.3 | 16.0 | 15.3 | 15.0 | 15.3 | 14.9 | 14.9 | 15.5 | 14.9 | 11.5 |
| O2 | 7.3 | 8.0 | 7.2 | 6.8 | 7.4 | 7.5 | 6.7 | 7.2 | 8.0 | 6.6 | 4.8 |
| НП | 22 | 16 | 20 | 7 | 14 | 22 | 9 | 10 | 21 | 19 | 8 |
| P общ | 34 | 10 | 30 | 15 | 18 | 10 | 10 | 10 | 10 | 11 | 10 |
| Hg | 0.10 | 0.01 | 0.26 | 0.11 | 0.19 | 0.02 | 0.12 | 0.02 | 0.03 | 0.04 | 0.22 |
| Cd | 0.40 | 0.28 | 1.00 | 3.40 | 1.00 | 0.10 | 0.60 | 0.35 | 0.20 | 0.80 | 1.40 |
| Cu | 32 | 0 | 51 | 36 | 42 | 4 | 38 | 31 | 12 | 35 | 50 |
| Pb | 26 | 12 | 65 | 68 | 50 | 4 | 41 | 25 | 8 | 42 | 51 |
| Zn | 113 | 87 | 100 | 590 | 180 | 20 | 150 | 119 | 55 | 138 | 190 |
| 16 ПАУ | 1.55 | 1.34 | 3.33 | 0.21 | 0.21 | 0.22 | 0.32 | 2.76 | 0.44 | 0.36 | 0.12 |
| TOC | 2.61 | 0.65 | 0.52 | 4.31 | 5.89 | 4.84 | 4.67 | 0.5 | 5.28 | 4.81 | 7.07 |
| Sand | 5.0 | 7.1 | 7.2 | 2.8 | 3.8 | 13.0 | 8.0 | 2.0 | 15.0 | 1.0 | 0.8 |
| N meio (*) | 46 (49) | 7 | 58 (38) | 22 (29) | 13 | 21 | 2 | 3 | 1 | 19 | 11 (15) |
| SR | 5 | 5 | 4 | 7 | 14 | 21 | 3 | 14 | 1 | 9 | 5 |
| N/C | 33 | 28 | 35 | 76 | 40 | 10 | 4 | 8 | 4 | 40 | 4 |
| Surv | 70 | 50 | 50 | 30 | 50 | 100 | 100 | 100 | 70 | 40 | 50 |
H – глубина (м), S – соленость (г/л), T – температура в градусах, O2 – содержание кислорода (мл/л), Pобщ – общего фосфора (мкг/л) и НП – нефтепродуктов (мкг/л) в слое придонной воды. TOC – содержание органического углерода в донных отложениях (%), Sand – песка (%), Hg –ртути, Cd – кадмия, Cu – меди, Pb – свинца и Zn – цинка в мг/кг с.в. (сухого вещества) и 16ПАУ – полиароматических углеводородов в мкг/кг с.в. донных отложений. Звездочкой отмечены данные при сборе стратометром.
Таблица 3.
Критерии для оценки экологического состояния донных отложений по показателю выживаемости амфипод и индекса N/C
| Показатель/Класс качества | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| Состояние | Отличное | Хорошее | Удовлетворительное | Критическое | Плохое |
| high | good | moderate | poor | bad | |
| Выживаемость амфипод, % | 100–90 | 89–70 | 69–50 | 49–30 | ≤29 |
| N/C | 0–10 | 11–24 | 25–40 | 41–70 | 71–100 |
Мейобентос. Эвмейобентос был представлен группами: Nematoda, Harpacticoida, Cyclopoida, Ostracoda (рис. 2). С небольшой частотой (1–3 экз./ 10 см2) отмечены представители Oligochaeta и Chironomidae, относящиеся к псевдомейобентосу. Основу мейофауны составляли нематоды. Большая часть видов нематод представлена солоноватоводными и морскими эвригалинными видами (таблица 4), среди которых доминировали Daptonema setosa (Butsch.), Chromadorita leuckarti (de Man), Sphaerolaimus gracilis, Axonolaimus spinosus (Butsch.), Pseudoncholaimus sp. Также, на большинстве станций отмечен Brevitobrilus stefanskii (Micol.).
Рис. 2.
Вклад по численности (экз./10 см2) основных групп мейобентоса на изученных станциях в Финском заливе.
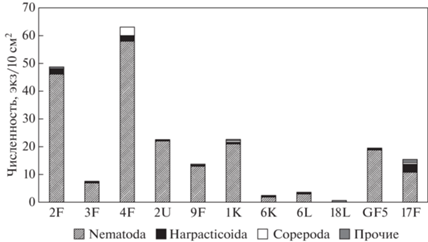
Таблица 4.
Список видов мейобентоса в глубоководной зоне Финского залива по сборам 2020 г.
| Nematoda | Ostracoda | Harpacticoida | Cyclopoida |
|---|---|---|---|
| Aphanolaimus aquaticus Daday, 1894 | Cyclocypris ovum
(Jurine, 1820) Limnocythere inopinata (Baird, 1843) |
Canthocamptus
staphylinus (Jurine, 1820) Harpacticidae gen sp. |
Eucyclops sp. Mesocyclops leukarti (Claus, 1857) |
| Axonolaimusspinosus (Bütschli, 1874) | |||
| Brevitobrilusstefanski (Micoletzky, 1925) | |||
| Chromadoritaleuckarti (de Man, 1876) | |||
| Daptonemasetosum (Bütschli, 1874) | |||
| Dorylaimusstagnalis Dujardin, 1845 | |||
| Epitobrilusmedius (Schneider, 1916) | |||
| Ethmolaimuspratensis de Man, 1880 | |||
| Eutobrilusgrandipapillatus (Brakenhof, 1914) | |||
| Eudorylaimuscarteri (Bastian, 1865) | |||
| Ironustenuicaudatus De Man, 1876 | |||
| Ironusignavus Bastian, 1965 | |||
| Monhystera sp. | |||
| Mononchusniddensis Skwarra, 1921 | |||
| Neotobriluslongus (Leidy, 1852) | |||
| Odontophoraarmata (Dilevsen, 1918) | |||
| Paracanthonchuscaecus (Bastian, 1865) | |||
| Paraplectonemapedunculatum (Hofmanner, 1913) | |||
| Plectustenuis Bastian, 1865 | |||
| Plectuscirratus Bastian, 1865 | |||
| Prismatolaimusintermedius (Butschli, 1873) | |||
| Pseudoncholaimus sp. | |||
| Raritobrilusallophysis Steiner 1919 | |||
| Sphaerolaimusgracilis de Man, 1876 | |||
| Tobrilusbrevisetosus (W. Schneider, 1925) | |||
| Tobrilusgracilis (Bastain, 1865) | |||
| Tripylafilipjevi Altherr, 1972 |
Плотность эвмейобентосных животных в целом была низка, составляя от 1 до 54 экз./10 см2 (=тыс. экз./м2). Особенно низка численность мейобентосных животных в сообществе на станциях 6К и 6L (<2 экз./10 см2), где отмечен один вид C. leuckarti. На ст. 18L нематоды и другие представители эвмейобентоса отсутствовали, эта станция считалась непригодной для характеристики сообщества, возможно, что в этом районе бентосное сообщество было нарушено при строительстве порта Усть-Луга и дноуглубительных работах.
Сравнение численности, полученной при сборе разными методами, то есть трубкой из дночерпателя и со дна водоема, не выявило значимых различий по численности мейобентоса (табл. 2), а также его основных групп. Наибольшим богатством видов нематод характеризовались район ст. 1К (всего здесь отмечен 21 вид), а наибольшей численностью нематод – ст. 4F (рис. 2). Доля нематод в сообществе на большинстве станций варьировала от 4 до 53 экз./10 см2, составляя 76–98% в общей численности, а веслоногие ракообразные (гарпактициды Canthocamptus staphylinus Jur., циклопоида Mesocyclops leucarti (Claus), Eucyclops sp.) были немногочисленны, составляя 2–10%. Индекс N/C был высоким (76) на ст. 2U и достигал критического уровня (40) на ст. GF5 и 9F (табл. 2). Согласно критериям оценки по пятибалльной шкале (табл. 3) по этому индексу экологическое состояние исследуемых участков можно классифицировать: от хорошего до критического.
Биотестирование. Значительные различия в уровне выживания амфипод G. fasciatus были обнаружены между контролем и половиной исследованных образцов донных отложений, из которых только для ст. 2U донные отложения были оценены как потенциально токсичные и сильно загрязненные. Состояние донных отложений здесь было неблагоприятно для G. fasciatus (низкая выживаемость, 30%). Согласно классификации качества донных отложений [16] (табл. 3) около 50% станций попали в 3й класс качества, перейдя порог хорошего состояния (выживаемость составила от 40 до 60%), то есть состояние донных отложений в этих районах тестировалось как удовлетворительное. В контроле и на донных отложениях со станций 1K, 6К и 6L выживаемость G. fasciatus достигла 100%, их состояние отличное. По уровню выживаемости амфипод (70%) донные отложения на ст. 2F и 18L можно охарактеризовать как находящиеся в хорошем состоянии.
Анализ главных компонент и корреляции. Общая численность мейобентоса показала высокую корреляцию с глубиной, содержанием песка, и концентрацией общего фосфора в придонной воде (табл. 5). Индекс N/C положительно связан с глубиной, концентрацией металлов в донных отложениях и долей илистой фракции/песка. Анализ главных компонент выявил два фактора, объясняющих >67% вариабельности переменных (рис. 3, табл. 6). Фактор 1 объединял девять взаимосвязанных переменных, таких как глубина, концентрации металлов и доля фракции песка в донных отложениях, соотношение численности нематод и копепод (индекс N/C) и выживаемость амфипод, а фактор 2 – четыре переменные (% органического вещества, концентрацию фосфатов и полиароматических углеводородов в среде и численность организмов мейобентоса).
В изученном районе Финского залива этот анализ позволил выделить группы станций, сходных по состоянию донных отложений. Четыре станции (2U, 9F, GF6 и 17F) выделялись в одну группу как загрязненные металлами, на одной станции (4F) донные отложения были загрязнены как металлами, так и нефтепродуктами. Также в отдельную группу выделились наиболее чистые участки (1K, 6K, 18L, рис. 3б).
Таблица 5.
Корреляционные связи между физико-химическими показателями донных отложений и биотическими характеристиками (численностью мейобентоса, индексом N/C и выживаемостью амфипод). Обозначения как в табл. 2
| Показатель | Correlations are significant at p < 0.05, n = 11 | ||
|---|---|---|---|
| Nmeio | N/C | Surv | |
| H | 0.01 | 0.19 | –0.41 |
| S | –0.38 | –0.31 | 0.16 |
| T | 0.14 | 0.30 | 0.00 |
| O2 | 0.02 | 0.09 | 0.21 |
| НП | 0.46 | –0.10 | 0.09 |
| P общ | 0.89 | 0.37 | –0.20 |
| Hg | 0.48 | 0.17 | –0.37 |
| Cd | 0.15 | 0.74 | –0.63 |
| Cu | 0.36 | 0.22 | –0.31 |
| Pb | 0.39 | 0.58 | –0.58 |
| Zn | 0.02 | 0.74 | –0.54 |
| 16 ПАУ | 0.50 | –0.03 | 0.14 |
| TOC | –0.34 | –0.11 | –0.13 |
| N meio | 1.00 | 0.43 | –0.29 |
| N/C | 0.43 | 1.,00 | –0.73 |
| Surv | –0.29 | –0.73 | 1.00 |
Таблица 6.
Вклад на основе корреляций различных переменных в факторы 1 и 2 по результатам анализа главных компонент. Выделены жирным значения вклада значимых переменных. Обозначения как в табл. 2
| Переменная | Факторные нагрузки на основе корреляций | |
|---|---|---|
| фактор 1 | фактор 2 | |
| Hg | –0.67 | –0.28 |
| Cd | –0.88 | 0.29 |
| Cu | –0.76 | –0.23 |
| Pb | –0.95 | –0.11 |
| Zn | –0.79 | 0.35 |
| 16 ПАУ | 0.03 | –0.95 |
| Sand | 0.70 | 0.06 |
| TOC | –0.15 | 0.81 |
| N meio | –0.40 | –0.70 |
| N/C | –0.75 | 0.01 |
| Surv | 0.74 | –0.11 |
| H | –0.70 | 0.09 |
| S | –0.15 | 0.42 |
| T | 0.28 | –0.31 |
| О2 | 0.50 | –0.22 |
| НП | 0.47 | –0.34 |
| Pобщ | –0.35 | –0.70 |
ОБСУЖДЕНИЕ
В изученной солоноватой части Финского заливе нематоды формировали основу мейобентоса, отмеченные показатели их развития, как и других меойбентосных животных, были низки. Наибольшие плотности нематод в Финском заливе были 53 экз./10 см2, что для сравнения в 4–9 раз ниже их численности в глубоководных районах Ладожского озера (107–441 экз./10 см2 в 2014 г., [5]). Наибольшие из известных значений развития мейобентоса в пресных водах были зафиксированы в гиперэвтрофном оз. Вишневском (Карельский перешеек) – численность до 1460 экз./10 см2 [4]. Такие уровни развития мейобентоса в целом были характерны для изученной акватории и ранее, в 2008–2009 гг. [7]. Отчасти это определяется особенностями гидрологического режима, типом донных отложений на достаточно большой глубине и повышенной соленостью акватории. Предыдущие исследования показали, что тип донных отложений может влиять на пространственное распределение мейобентоса [23, 29]. Большинство организмов мейофауны могут находиться в песчаных, а не в илистых, отложениях из-за необходимости в интерстициальном пространстве [19]. Общая численность мейобентоса показала высокую корреляцию с содержанием общего фосфора в придонной воде (табл. 5), то есть с трофическим условиями донных биотопах.
Количество органического вещества может зависеть от размера частиц осадка, что также оказывало влияние на численность мейобентоса в данном исследовании и других случаях [14, 27]. Для свободноживущих нематод (как самой массовой группы многоклеточного мейобентоса) найдена связь численности с трофическими условиями [10]. Снижение роли мейобентоса также может быть связано с протеканием благоприятного для развития макробентоса периода из-за отсутствия явлений гипоксии на дне и климатическим потеплением. В последние годы наблюдается увеличении роли макробентоса за счет доминирования полихет-вселенцев [32] и восстановления популяций донных ракообразных, амфипод Monoporeia affinis [1], что может привести к обеднению мейобентоса. Согласно наблюдениям В.О. Мокиевского с соавторами [9], сходные взаимосвязи обилия мейо- и макробентоса отмечены в Черном море, когда средние значения плотности поселения нематод существенно увеличились (с 85 экз./ 10 см2 в 1991 г. до 1167 экз./10 см2 в 1999 г.) в результате падения биомассы макробентоса и увеличения доступного органического вещества в донных экосистемах. В Финском заливе в настоящее время наблюдается обратная тенденция: доминирующая повсеместно полихета-спионида Marenzelleria arctia, будучи селективным детритофагом-собирателем и выедая тонкий слой пелитового ила и микроводоросли [3], существенно обедняет кормовую базу для нематод и другого мейобентоса.
На большом материале было показано, что значения индекса N/C в загрязненных биотопах на илистых грунтах варьирует в пределах от 40 до 100, а на песчаных – >10. Некоторые из исследователей [19, 30, 41] обсуждали, что этот индекс не является надежным индикатором загрязнения металлами, хотя веслоногие рачки оказывались очень чувствительны к отдельным металлам. В данной работе получены высокие корреляции между содержанием цинка, кадмия и индексом N/C (табл. 5). Однако, содержания этих металлов также коррелировали положительно с долей илистой фракции в донных отложениях, то есть увеличение доли нематод с увеличением концентрации цинка и кадмия может быть обусловлено и увеличением доли илистой фракции. Ранее [16] для прибрежной зоны Финского залива было обнаружено, что количество бентосных Cyclopoida и Harpacticoida (Copepoda) уменьшалось по мере увеличения содержания цинка в донных отложениях, в то время как нематоды были устойчивы к увеличению содержания этого металла и сохраняли высокую численность при его высоких концентрациях. Чувствительность отдельных видов и групп мейобентоса к загрязнению донных осадков железом, цинком, медью и кадмием показана и в других исследованиях [21, 22]. Тяжелые металлы (хром, никель, цинк, кадмий, свинец и ртуть) были основными драйверами, формирующими сообщество мейофауны [36]. Таким образом, соотношение между численностью нематод и копепод можно считать индикатором состояния морской среды на участках с выраженным влияния загрязнения металлами. Результаты биоиндикации по мейобентосу и биотестирования коррелировали (табл. 5).
Применение индекса N/C в целях мониторинга загрязнения имеет множество ограничений и требует комплексного подхода в каждом случае. Изменения в отношении между нематодами и гарпактикоидными копеподами могут быть результатом каскадных перестроек в экосистеме [9], а не загрязнения. В то же время, значительная часть работ об индексе N/C рекомендует его как информативный показатель для первичного выделения состояния загрязнения донных отложений органическими соединениями [31, 37], поскольку значения N/C как правило возрастают в градиенте органического обогащения. Sciberras et al. [41] на основе метаанализа данных, полученных из 46 исследований за последние 39 лет, по отношению обилия нематод и копепод к эффектам органического обогащения, загрязнения нефтью и металлами в морской среде заключили, что применение соотношения нематод и копепод нецелесообразно в целях мониторинга. Ими не выявлено общей тенденции в реакции численности нематод и веслоногих ракообразных на эти типы загрязнения, единственная значимая реакция этих показателей мейобентоса обнаружена для загрязнения нефтью [41]. Вместе с тем, показатели мейобентоса были нечувствительны к присутствию нефтепродуктов в нашем исследовании и другой работе [16]. Некоторые виды нематод (Oncholaimium ramosum (Smolyanko, Belogurov)) в загрязненных водоемах оказались способными поглощать углерод нефтеуглеводородов, используя его как дополнительный источник органического вещества [22]. К тому же показано, что различные углеводороды в донных отложениях оказывали воздействие на мейофауну в долговременном масштабе, приводя к их снижению ее роли на десятки лет [42]. Отклик разных групп мейобентоса на присутствие нефтепродуктов и других типов загрязнения, по-видимому, специфичен, что требует дальнейшего экспериментального изучения.
Примененный комплекс методов – биоиндикация, биотестирование и химический анализ – показали хорошую сопоставимость результатов и позволил выявить несколько участков с повышенным риском накопления загрязняющих веществ в восточной части Финского залива. Индекс N/C оказался информативным для экологической оценки в эстуарной части Балтийского моря и для отслеживания состояния донных отложений, загрязненных металлами. При этом общие показатели мейобентоса были тесно связаны с уровнем эвтрофирования (содержанием фосфора) участков в районе исследования.
Благодарности. Авторы выражают благодарность А.А. Максимову за сбор проб.
Источники финансирования. Работа поддержана проектом ER90 HAZLESS Программы приграничного сотрудничества “Россия-Эстония” на период 2014–2020 гг. и Минобрнауки и высшего образования Российской Федерации, госзадание № 122031100274-7.
Список литературы
Березина Н.А., Максимов А.А. Количественные характеристики и пищевые предпочтения бокоплавов (Crustacea: Amphipoda) в восточной части Финского залива Балтийского моря // Ж. Сиб. Фед. Ун-та. Биология. 2016. № 4. С. 409–426.
Воробьева Л.В., Кулакова И.И. Мейобентос в системе биологического мониторинга контактных зон моря // Сист. контроля окр. среды. 2013. № 19. С. 262–267.
Кочешкова О.В., Ежова Е.Е., Ланге Е.К. Особенности питания двух массовых видов полихет Вислинского залива Балтийского моря // Морской Экологический журнал. 2012. Т. 11. № 2. С. 45–51.
Курашов Е.А. Мейобентос как компонент озерной экосистемы. СПб: “Алга-Фонд”, 1994. 224 с.
Курашов Е.А., Дудакова Д.С. Мейобентос литоральной зоны Ладожского озера и его использование для диагностики состояния среды // Российский журнал прикладной экологии. 2018. № 4 (16). С. 22–29.
Максимов А.А. Влияние климатических факторов на динамику макрозообентоса // Экосистема эстуария реки Невы: биологическое разнообразие и экологические проблемы. А.Ф. Алимов и С.М. Голубков (ред.). Москва: Товарищество научных изданий КМК, 2008. С. 346–355.
Максимов А.А., Петухов В.А. Роль макро- и мейобентоса в донных сообществах вершины Финского залива // Тр. Зоол. Ин-та РАН. 2011. Т. 315. № 3. С. 289–310.
Мокиевский В.О. Экология морского мейобентоса. Москва: Товарищество научных изданий КМК, 2009. 286 с.
Мокиевский В.О., Воробьева Л.В., Гарлицкая Л.А. и др. Многолетние изменения в мейобентосе Восточной части Черного моря // Океанология. 2010. Т. 50. № 6. С. 994–1001.
Мокиевский В.О., Удалов А. А., Азовский А. И. О количественном распределении мейобентоса глубоководных зон в Мировом океане // Океанология. 2007. Т. 47. № 6. С. 857–874.
Рыбалко А.Е., Федорова Н.К., Максимов А.А. Влияние гидротехнических работ на формирование геохимической структуры донных осадков (на примере восточной части Финского залива в 2006–2008 гг.) // Геология морей и океанов: Материалы XVIII Международной научной конференции (Школы) по морской геологии. Т. 4. А.П. Лисицын (ред.). Москва: ГЕОС, 2009. С. 147–149.
Alekseeva T.N., Politova N.V., Kozina N.V. Grain size distribution of the surface layer of bottom sediments in the Barents Sea // Oceanology. 2020. Vol. 60. № 6. P. 803–816.
Amjad S., Gray J.S. Use of the Nematode-Copepod Ratio as an index of organic pollution // Mar. Pollut. Bull. 1983. V. 14. P. 178–181.
Arya D.B., Vincent S.G.T., Godson P.S. Benthic biotopes: abiotic and biotic factors in the sediment // Ecology and Biodiversity of Benthos. Elsevier, 2022. P. 21–31.
Bat L. A review of sediment toxicity bioassays using the amphipods and polychaetes // Turk. J. Fish. Aquat. Sci. 2005. V. 5. P. 119–139.
Berezina N.A., Gubelit Y.I., Polyak Y.M. et al. An integrated approach to the assessment of the eastern Gulf of Finland health: A case study of coastal habitats // J. Marine Syst. 2017. V. 171. 159–171.
Berezina N., Strode E., Lehtonen K. et al. Sediment quality assessment using Gmelinoides fasciatus and Monoporeia affinis (Amphipoda, Gammaridea) in the northeastern Baltic Sea // Crustaceana. 2013. V. 86. № 7–8. P. 780–801.
Chapman P.A. Decision-making framework for sediment assessment developed for the Great Lakes // Human and Ecological Risk Assessment. 2002. V. 8. № 7. P. 1641–1655.
Coull B.C., Hicks G.R.F., Wells J.B.J. Nematode/Copepod ratios for monitoring pollution: A rebuttal // Mar. Pollut. Bull. 1981. V. 12. P. 378–381.
De-La-Ossa-Carretero J.A., Del-Pilar-Ruso Y., Gimenez-Casalduero F. et al. Sensitivity of amphipods to sewage pollution // Estuarine, Coastal and Shelf Science. 2012. V. 96. P.129–138.
Fadeeva N.P., Bezverbnaja I.P., Tazaki K.et al. Composition and structure of marine benthic community regarding conditions of chronic harbour pollution // Ocean. Polar Res. 2003. V. 25. № 1. P. 21–30.
Fadeeva N.P., Davydkova I.L. Some aspects of ecology and life history of Oncholaimium ramosum (Nematoda: Oncholaimidae) in polluted cove from the Sea of Japan // Russ. J. Nematol. 2005. V. 13. № 2. P. 101–110.
Galope-Bacaltos D.G. Composition and spatial distribution of infauna in a river estuary affected by fishpond effluents // Mar. Pollut. Bull. 2002. V. 44. P. 816–819.
Gee J.M., Warwick R.M., Schaanning M.et al. Effects of oganic enrichment on meiofaunal abundance and community structure in sublittoral soft sediments // J. Exp. Mar. Biol. Ecol. 1985. V. 91. P. 247–262.
Guerra-García J.M., Baeza-Rojano E., Cabezas M.P. et al. The amphipods Caprella penantis and Hyale schmidtii as biomonitors of trace metal contamination in intertidal ecosystems of Algeciras Bay, Southern Spain // Mar. Pollut. Bull. 2009. V. 58. № 5. P. 783–786.
Jacobson T., Sundelin B., Yang G., Ford A. Low dose TBT exposure decreases amphipod immunocompetence and reproductive fitness // Aquatic toxicology. 2010. V. 101. P. 72–77.
Jeshma P., Suresh Gandhi M., Rajeshwara Rao N. Benthic foraminifera and geochemical assessment of Puravadaiyanar and Vettar estuaries, Karaikal, south east coast of India – Implication for pollution monitoring studies // Region. Stud. Mar. Sci. 2016. V. 9. P. 76–88.
Kalinkina N.M., Berezina N.A., Sidorova A.I. et al. Toxicity bioassay of bottom sediments in large water bodies in Northwestern Russia with the use of crustaceans // Water Resources. 2013. V. 40. P. 657–666.
Kim H.G., Song S.J., Bae H. et al. Natural and anthropogenic impacts on long-term meiobenthic communities in two contrasting nearshore habitats // Environ Int. 2020. V. 134. 105200.
Lee M., Correa J., Castilla J. An assessment of the potential use of the Nematode to Copepod Ratio in the monitoring of metals pollution. The Chañaral case // Mar. Pollut. Bull. 200142. 696–701.
Marin V., Moreno M., Vassallo P. et al. Development of a multistep indicator-based approach (MIBA) for the assessment of environmental quality of harbours // ICES J. Mar. Sci. 2008. V. 65. Iss. 8. P. 1436–1441.
Maximov A. The long-term dynamics and current distribution of macrozoobenthos communities in the Eastern Gulf of Finland, Baltic Sea // Russ. J. Mar. Biol. 2015. V. 41. P. 300–310.
Prato E., Di Leo A., Biandolino F., Cardellicchio N. Sediment toxicity tests using two species of marine amphipods: Gammarus aequicauda and Corophium insidiosum // Bull. Environ. Contam. Toxicol. 2006. V. 76. № 4. P. 629–636.
Raffaelli D. The behaviour of the Nematode/Copepod ratio in organic pollution studies // Marine Environmental Research. 1987. V. 23. P. 135–152.
Raffaelli D., Mason C.F. Pollution monitoring with meiofauna, using the ratio of nematodes to copepods // Mar. Pollut. Bull. 1981. V. 12. P. 158–163.
Rao M.N., Gaikwad S., Ram A. et al. Effects of sedimentary heavy metals on meiobenthic community in tropical estuaries along eastern Arabian Sea // Environ. Geochem. Health. 2022. https://doi.org/10.1007/s10653-022-01239-3
Riera R., Sanchez-Jerez P., Rodríguez M. et al. Long-term monitoring of fish farms: application of Nematode/Copepod index to oligotrophic conditions // Mar. Pollut. Bull. 2012. V. 64. № 4. P. 844–850.
Rosenberg R., Blomqvist M., Nilsson H.C. et al. Marine quality assessment by use of benthic species-abundance distributions: a proposed new protocol within European Union Water Framework Directive // Mar. Pollut. Bull. 2004. V. 49. P. 728–739.
Rubal M., Veiga P., Besteiro C. 2009. Nematode/copepod index: Importance of sedimentary parameters, sampling methodology and baseline values // Thalassas. V. 25. P. 9–18.
Shiels G.M., Anderson K.J. Pollution monitoring using the Nematode/Copepod ratio. A practical application // Mar. Pollut. Bull. 1985. V. 16. N 2. P. 62–68.
Sciberras M., Menechella A., Rucci K. et al. Nematode/copepod ratio and nematode and copepod abundances as bioindicators of pollution: a meta-analysis. Ecologia Austral. 2022. V. 32. P. 516–525.
Stark J.S., Mohammad M., McMinn A., Ingels J. The effects of hydrocarbons on meiofauna in marine sediments in Antarctic // J. Exp. Mar. Biol. Ecol. 2017. V. 496. P. 56–73.
Strode E., Jansons M., Purina I. et al. Sediment quality assessment using survival and embryo malformation tests in amphipod crustaceans: The Gulf of Riga, Baltic Sea as case study // J. Mar. Syst. 2017. V. 172. P. 93–103.
Warwick R.M. The nematode/copepod ratio and its use in pollution ecology // Mar. Pollut. Bull. 1981. V. 12. № 10. P. 329–333.
Wojtasik B. 2009. Evaluation of the stage of development of the littoral of Czorsztyński and Sromowiecki reservoirs (Pieniny Mountains, Poland) on the basis of analyses of meiobenthos assemblages // Ecohydrol. Hydrobiol. V. 9. № 2–4. P. 149–157.
Дополнительные материалы отсутствуют.



