Океанология, 2023, T. 63, № 4, стр. 677-688
Встречаемость и Распределение финвалов (Balaenoptera physalus) и горбачей (Megaptera novaeangliae) в Атлантическом секторе Антарктики
А. Д. Чернецкий 1, *, П. В. Чукмасов 2, В. В. Краснова 1, А. В. Третьяков 2, Л. Г. Третьякова 2, Д. Г. Битютский 3, С. А. Мошаров 1, П. А. Салюк 4
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
3 Керченский отдел Азово-Черноморского филиала ФГБНУ “ВНИРО” (“АзНИИРХ”)
Керчь, Россия
4 Тихоокеанский океанологический институт ДВО РАН
Владивосток, Россия
* E-mail: adcher@ocean.ru
Поступила в редакцию 28.11.2022
После доработки 08.02.2023
Принята к публикации 16.02.2023
- EDN: YIFZZW
- DOI: 10.31857/S0030157423040032
Аннотация
Исследовались встречаемость и распределение финвалов и горбачей по маршруту следования НИС “Академик Мстислав Келдыш” в Атлантическом секторе Антарктики в январе–феврале 2022 г. Рассматривались особенности распределения китов в зависимости от глубины акватории, концентрации и половозрелости антарктического криля, содержания хлорофилла “а” в воде. Самая высокая встречаемость финвалов была обнаружена в глубоководных районах бассейна Пауэлла и Оркнейского желоба, где было зарегистрировано преобладание взрослого криля, а горбатых китов – в мелководном проливе Брансфилда, где преобладала молодь антарктического криля. Зависимость встречаемости китов от концентрации хлорофилла “а” не подтвердилась.
ВВЕДЕНИЕ
Южный океан является высокопродуктивной морской экосистемой, важное место в которой занимают китообразные, особенно усатые киты [4, 10, 29, 33, 44]. Наибольшая численность усатых китов в Антарктике наблюдается в январе–апреле в период нагула, но время их прибытия в регион имеет видовую специфику [23]. Киты демонстрируют различные модели пространственного распределения [40], которые зависят не только от параметров окружающей среды, таких как течения, лед, батиметрия, океанография [4, 10, 42], но и от наличия и доступности пищи [14, 27, 32, 37]. За немногими исключениями главным объектом питания практически всех усатых китов признан антарктический криль Euphausia superba [15, 22]. Именно Атлантический сектор Южного океана является районом, где обнаруживаются самые крупные скопления криля [2, 3]. В последнее время наблюдается увеличение численности китов, кормящихся крилем у Антарктического полуострова [30]. Считается, что репродуктивный успех китов во многом зависит от обилия кормовых объектов в окружающей среде, поэтому они могут быть индикаторами состояния морских ресурсов [29].
В настоящее время Южный океан подвергается различным природным и антропогенным факторам воздействия. Изменение климата, вызванное высокими темпами потепления [8, 9, 24], увеличение промысловой добычи криля [28] и возрастающая туристическая активность [43] могут негативно сказываться на морской экосистеме Антарктики. В связи с чем этот регион и его обитатели, такие как усатые киты, все больше привлекают к себе внимание исследователей, а комплексный подход в его изучении становится приоритетным [1, 25].
В январе и феврале 2022 года в 87 рейсе НИС “Академик Мстислав Келдыш” в Антарктике в ходе реализации “Комплексной экспедиционной программы выполнения ресурсных исследований криля и исследований экосистемы Южного океана (Атлантический сектор Антарктики)” проводились наблюдения за морскими млекопитающими по маршруту следования судна. Результаты этих наблюдений показали разницу в распределении некоторых видов китообразных, а именно финвалов (Balaenoptera physalus) и горбатых китов (Megaptera novaeangliae), что и послужило поводом для дальнейшего анализа обнаруженных различий, являющегося целью данной работы.
Необходимо отметить, что исследования усатых китов крайне важны, так как многие из них пострадали во время интенсивного китобойного промысла в XX веке, после которого до сих пор не восстановились и находятся под угрозой исчезновения. Так, например, финвалы в водах Антарктики (внесены в Красную Книгу IUCN в категории VN – “Уязвимые”) в последние годы хотя и показывают тенденцию к восстановлению, но их численность все еще остается значительно ниже того уровня, которая была у них до начала промысла [19]. Полученная информация о современном распространении морских млекопитающих имеет решающее значение для понимания их роли в экосистеме этого региона [11].
МАТЕРИАЛ И МЕТОДЫ
Визуальные наблюдения за китообразным. Судовые наблюдения за китообразными в Атлантическом секторе Антарктики проводились на маршруте следования НИС “Академик Мстислав Келдыш” с 18 января по 15 февраля 2022 г. Наблюдения велись в светлое время суток двумя специалистами, одновременно с левого и правого бортов в секторе 180° по ходу судна с пеленгаторной палубы, расположенной на высоте 17 м над уровнем моря. При ухудшении погодных условий наблюдения не прекращались и продолжались из ходовой рубки или с крыльев мостика (14 м над уровнем моря). Работы приостанавливались при ветре более 5 баллов по шкале Бофорта и видимости менее 50 м. Время наблюдений было разбито на четырехчасовые вахты, соответствующие судовым. В период работ на океанологических станциях или нахождения судна в дрейфе, исследования велись одним специалистом. Наблюдатели были оснащены скоростными фотоаппаратами с длиннофокусными объективами и биноклями. Каждая встреча с китообразными отмечалась точкой на портативном GPS-навигаторе. Расстояние до китов определяли визуально или по углу между объектом наблюдений и горизонтом [20]. Угол определялся с помощью бинокля с ретикулярной сеткой или измерялся впоследствии по фотографиям. Известные расстояние до животного и пеленг на него позволяли получить координаты его местонахождения в момент наблюдения для последующей обработки и картирования. Общее время наблюдений составило 423 ч 35 мин. Учитывая физико-географические характеристики, маршрут наблюдений был разбит на несколько районов (табл. 1, рис. 1).
Таблица 1.
Характеристика районов работ и продолжительность визуальных наблюдений за антарктическими китообразными на маршруте следования судна “Академик Мстислав Келдыш” в январе–феврале 2022 г.
| Район наблюдений | Характеристика глубин | Дата наблюдений | Продолжительность наблюдений | |
|---|---|---|---|---|
| 1 | Пролив Брансфилда и акватория к востоку от него до линии о. Мордвинова–о. Жуэнвиль | Шельфовая зона и впадина глубиной до 3000 м | 21.01–27.01; 31.01–1.02; 14.02 | 150 ч 55 мин |
| 2 | Пролив Антарктик | До 1000 м | 27.01–28.01 | 17 ч 50 мин |
| 3 | Море Уэдделла, северо-западная часть к востоку от п-ова Тринити до 53° з.д. | Шельфовая зона с глубинами около 400 м | 28.01–29.01 | 27 ч 10 мин |
| 4 | Бассейн Пауэлла | Более 3000 м и ограничивающая его мелководная часть с глубинами около 500 м | 19.01–20.01; 30.01–31.01; 2.02–7.02; 13.02 | 128 ч 15 мин |
| 5 | Оркнейский шельф | Шельфовая зона с глубинами около 300 м | 8.02 | 15 ч 35 мин |
| 6 | Оркнейский желоб | До 6000 м | 9.02–12.02 | 65 ч 30 мин |
| 7 | Море Скотия, южная часть | Более 4000 м | 18.01; 15.02 | 18 ч 20 мин |
Рис. 1.
Районы наблюдений и встречи китообразных в Атлантическом секторе Антарктики в январе – феврале 2022 г. Цифрами показаны районы: 1 – пролив Брансфилда, 2 – пролив Антарктик, 3 – море Уэдделла, 4 – бассейн Пауэлла, 5 – Оркнейский шельф, 6 – Оркнейский желоб, 7 – Море Скотия.

Оценка встречаемости финвалов и горбачей в районе исследований. Для оценки встречаемости китообразных район исследований был поделен на участки, в проекции Меркатора имеющие вид прямоугольников со сторонами 30′ по долготе и 15′ по широте. Длина стороны такого прямоугольника по меридиану равнялась 27.8 км, а по параллели – варьировала в зависимости от географической широты и составляла, например, 27.8 км на 60° ю.ш. и 24.4 км – на 64° ю.ш. Такие размеры и форма участков, близкая к квадрату, для решения поставленной задачи были признаны оптимальными. Для каждого участка было посчитано количество зарегистрированных финвалов и горбачей, и определена длина пути, пройденного судном. В расчет брались только те отрезки пути, на которых проводились наблюдения за китообразными в светлое время суток и при благоприятной погоде. Общая длина эффективных участков пути составила 3594 км. Для каждого участка была рассчитана встречаемость особей данного вида на 1 км пути.
Оценка встречаемости финвалов и горбачей в зависимости от концентрации и половозрелости криля. Данные о биомассе и половозрелости антарктического криля были получены по результатам 36 ловов сетью Бонго, двойной квадратной сетью (DSN) и тралом РТАКСА, при этом глубина лова варьировала от 130 до 1900 м. Из полученного материала отбирались пробы для промеров и биологического анализа [5]. Для оценки биомассы и численности антарктического криля использовались количественные данные о каждом улове из расчета на единицу объема профильтрованной воды (1000 м3) [39].
Оценка зависимости встречаемости финвалов и горбачей от количества и возраста криля проводилась методом картирования полученных данных с использованием пакета ArcGIS 10.4.1 для дальнейшего их сопоставления по семи районам исследований.
Оценка встречаемости усатых китов в зависимости от концентрации хлорофилла “а”. Оценка зависимости встречаемости усатых китов от концентрации хлорофилла “а” (Chl-a) проводилась без учета их видовой принадлежности. Поскольку фитопланктон не является непосредственным объектом питания китов, использование данных по встречаемости отдельно по видам было принято нецелесообразным. Кроме того, такой подход позволил значительно увеличить размер выборки за счет неопределенных до вида китов.
Для определения концентрации Chl-a в воде использовались два взаимодополняющих метода: (1) прямое измерение концентрации хлорофилла “а” в воде стандартным экстрактным методом в пробах, полученных на станциях с разных глубинных горизонтов; (2) расчет по лазерно-индуцированной флуоресценции, измеренной с помощью проточного флюориметра по ходу движения судна и калиброванной на стандартные определения в мг/м3. Интегральные по глубине значения Chl-aint в водной толще (мг/м2) экстрактным методом были получены на 29 станциях в проливе Брансфилда и на разрезе через бассейн Пауэлла от о. Сноу-Хилл до Южных Оркнейских островов. Результаты измерений Chl-a по флюоресценции были представлены в виде средней концентрации в мг/м3 для каждого отрезка пути внутри выделенных участков, для которых была рассчитана встречаемость усатых китов. При этом для оценки их встречаемости использовалась не сумма всех длин отрезков пути внутри участка, а отдельно каждый отрезок, что диктовалось необходимостью приведения данных по китам в соответствие с данными по хлорофиллу. В данных по встречаемости не учитывались нулевые значения, т.е. отрезки с отсутствием китов игнорировались.
Влияние концентрации Chl-a на встречаемость усатых китов для каждого метода измерения хлорофилла анализировалось независимо. В анализе использовался непараметрического коэффициент корреляции Спирмена (р = 0.05),
Оценка встречаемости усатых китов в зависимости от глубины. Для анализа глубин в точках, где были зарегистрированы встречи с финвалами и горбачами, применялась графическая база данных GEBCO (https://download.gebco.net). Для каждой встречи китов использовались батиметрические данные в соответствии с географическими координатами их расположения.
Поскольку распределение данных в этом исследовании отличалось от нормального, для сравнения встречаемости финвалов и горбачей в зависимости от глубины применялся U-критерий Манна–Уитни (р = 0.05). Статистический анализ проводили с использованием статистического пакета Statistica 12 StatSoft Inc.
РЕЗУЛЬТАТЫ
Видовой и количественный состав китообразных на маршруте следования судна по визуальным наблюдениям. В районе исследования было зарегистрировано 13 видов китообразных (472 встречи/ 966 особей) (табл. 2). Самыми массовыми видами были финвал (51.7% встреч/52.38% особей) и горбач (30.1% встреч/27.23% особей).
Таблица 2.
Видовой состав и количество китообразных, зарегистрированных по маршруту следования судна в Атлантическом секторе Антарктики в январе–феврале 2022 г.
| Вид | количество | соотношение (%) | ||
|---|---|---|---|---|
| встреч | особей | встреч | особей | |
| Инфраотряд Китообразные Cetacea | ||||
| П/отряд Усатые киты Mysticeti | ||||
| Семейство Полосатики Balaenopteridae | ||||
| Синий кит Balaenoptera musculus | 3 | 4 | 0.64 | 0.41 |
| Финвал Balaenoptera physalus | 244 | 506 | 51.69 | 52.38 |
| Сейвал Balaenoptera borealis | 3 | 6 | 0.64 | 0.62 |
| Горбатый кит Megaptera novaeangliae | 142 | 263 | 30.08 | 27.23 |
| Южный малый полосатик Balaenoptera bonaerensis | 3 | 3 | 0.64 | 0.31 |
| Полосатик н/о, Balaenopteridae sp. | 20 | 34 | 4.24 | 3.52 |
| Семейство Гладкие киты Balaenidae | ||||
| Южный гладкий кит Eubalaena australis | 2 | 2 | 0.42 | 0.21 |
| Семейство Клюворылые Ziphiidae | ||||
| Плосколобый бутылконос Hyperoodon planifrons | 2 | 2 | 0.42 | 0.21 |
| Семейство Дельфиновые Delphinidae | ||||
| Длинноплавниковая гринда Globicephala melas | 2 | 65 | 0.42 | 6.73 |
| Косатка Orcinus orca | 2 | 8 | 0.42 | 0.83 |
| Крестовидный дельфин Lagenorhynchus cruciger | 1 | 6 | 0.21 | 0.62 |
| Кит н/о Cetacea gen. sp. | 48 | 67 | 10.17 | 6.94 |
| ВСЕГО: | 472 | 966 | 100.00 | 100.00 |
Встречаемость финвалов и горбачей по расчетным участкам. Путь судна во время проведения наблюдений проходил через 142 расчетных участка. Количество визуально зарегистрированных финвалов и горбачей для каждого района наблюдений представлено в табл. 3.
Таблица 3.
Количество и встречаемость финвалов и горбачей по районам наблюдений в январе–феврале 2022 г. Для характеристики встречаемости представлены Me – медиана; Min–Max – минимум и максимум; M ± CD – средняя и стандартное отклонение
| № | Район работ | Количество расчетных участков (n) | Финвалы | Горбачи | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| кол-во (встречи/особи) | встречаемость (ос./км) | кол-во (встречи/особи) | встречаемость (ос./км) | |||||||
| Me | Min–Max | M ± SD | Me | Min–Max | M ± SD | |||||
| 1 | Пролив Брансфилда | 40 | 25/45 | 0 | 0–0.143 | 0.025 ± 0.043 | 76/123 | 0 | 0–0.665 | 0.067 ± 0.122 |
| 2 | Пролив Антарктик | 5 | 2/3 | 0 | 0–0.028 | 0.011 ± 0.014 | 9/21 | 0.076 | 0–0.125 | 0.072 ± 0.045 |
| 3 | Море Уэдделла | 13 | 29/69 | 0.103 | 0–1.702 | 0.276 ± 0.487 | 46/101 | 0.248 | 0–1.22 | 0.339 ± 0.367 |
| 4 | Бассейн Пауэлла | 48 | 113/199 | 0.049 | 0–1.25 | 0.178 ± 0.297 | 4/10 | 0 | 0–0.380 | 0.007 ± 0.055 |
| 5 | Оркнейский шельф | 8 | 0/0 | 0 | 0 | 0 | 2/2 | 0 | 0–0.053 | 0.007 ± 0.019 |
| 6 | Оркнейский желоб | 15 | 71/185 | 0.362 | 0–2.33 | 0.482 ± 0.598 | 5/6 | 0 | 0–0.089 | 0.015 ± 0.028 |
| 7 | Море Скотия | 13 | 4/5 | 0 | 0–0.036 | 0.005 ± 0.013 | 0/0 | 0 | 0 | 0 |
Распределение китов в районах наблюдений имело существенные различия.
В проливе Брансфилда преобладали горбачи. Они были встречены на 19 участках из 40 и в основном в центральной части пролива. Финвалы были зарегистрированы лишь на 14 участках из 40 (табл. 3, рис. 2).
Рис. 2.
Встречаемость финвалов и горбачей по расчетным участкам в семи районах наблюдений в январе– феврале 2022 г. (порядок участков с юго-запада на северо-восток).
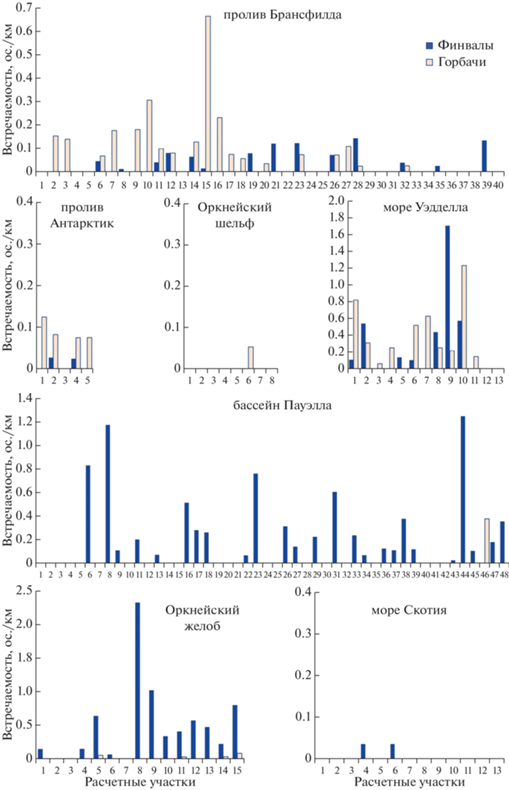
В проливе Антарктик также доминировали горбачи. Они зарегистрированы на 4 участках из 5 при встречаемости от 0.075 до 0.1 ос./км, а финвалы только на двух участках (0.027 ос./км).
На северо-западе моря Уэдделла оба вида китов были представлены практически по всему маршруту следования. Горбачи отмечались на 10 расчетных участках из 13 с очень высокой встречаемостью – до 1.2 ос./км. Финвалы отмечены на 7 участках с максимумом встречаемости 1.7 ос./км.
В районе бассейна Пауэлла наблюдалась абсолютно противоположная картина. Было отмечено полное преобладание финвалов (табл. 3). Они были зарегистрированы на 25 расчетных участках из 48, причем в основном в районах с резким перепадом глубин по периферии бассейна. Горбачи были отмечены только на одном участке в северо-восточной части бассейна.
В районе Оркнейского желоба, для которого также характерен резкий перепад глубин, преобладали финвалы с высокой встречаемостью – до 1.02 ос./км, отмечены на 12 расчетных участках из 15. Горбачи зарегистрированы только на 4 участках.
В мелководном районе к югу от Оркнейских островов киты практически не встречались. Зарегистрировано только 2 горбача на одном участке из 8.
Из 13 расчетных участков в южной части моря Скотия только на 2 было отмечено по одному финвалу (0.036 ос./км) (рис. 2).
Встречаемость китов в зависимости от концентрации и половозрелости криля. В проливе Брансфилда, где преобладали горбачи (табл. 3, рис. 2), была обнаружена самая высокая концентрация неполовозрелого криля (от 31 до 73 г/1000 м3) (рис. 3).
Рис. 3.
Встречаемость финвалов (a) и горбачей (b) и станции отбора проб криля разной половозрастной структуры с 18 января по 15 февраля 2022 г. в районе исследований. Цифрами показаны районы: 1 – пролив Брансфилда, 2 – пролив Антарктик, 3 – море Уэдделла, 4 – бассейн Пауэлла, 5 – Оркнейский шельф, 6 – Оркнейский желоб, 7 – Море Скотия.
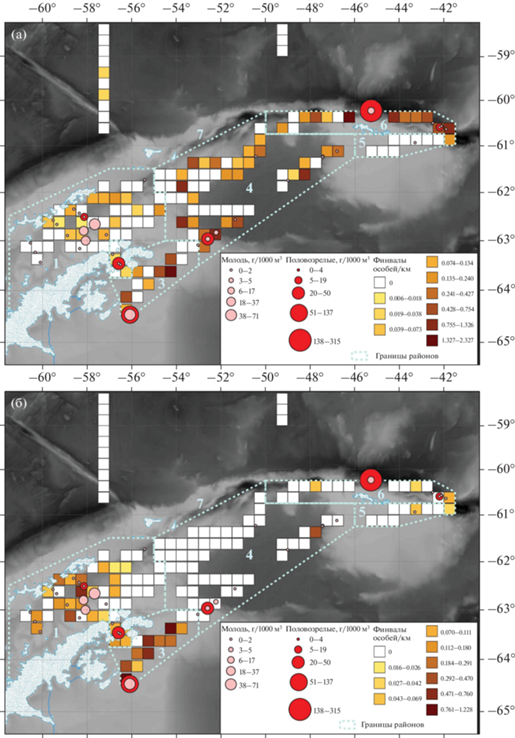
Районы бассейна Пауэлла и Оркнейского желоба характеризуются полным преобладанием финвалов (табл. 3, рис. 2) и взрослого криля (рис. 3). Так, на самой результативной станции района бассейна Пауэлла концентрация взрослого криля составила 50 г/1000 м3, а неполовозрелого криля – 5 г/1000 м3. Максимальное количество взрослого половозрелого антарктического криля было поймано в Оркнейском желобе – 315 г/1000 м3, при этом доля неполовозрелого криля составила 17 г/1000 м3.
В северо-западной части моря Уэдделла, где было выявлено большое скопление криля обеих возрастных групп (173 г/1000 м3 половозрелых и 73 г/1000 м3 молоди), наблюдалась высокая встречаемость, как горбачей, так и финвалов (рис. 3).
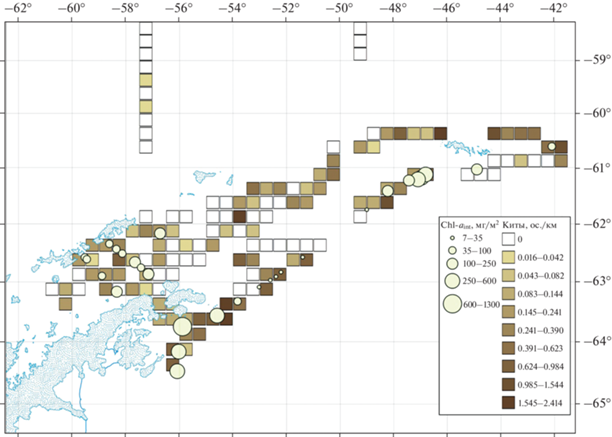
Встречаемость китов в зависимости от концентрации хлорофилла “a”. Статистически значимой корреляции между значениями концентрации хлорофилла, полученного обоими методами измерения, и встречаемостью китов не обнаружено. Так в случае прямых измерений самое низкое (7.0 мг/м2) и самое высокое (1291 мг/м2) количество Chl-aint отмечены в районах с низкой встречаемостью китов (менее 0.15 ос./км). Измерения в участках с высокой встречаемостью китов (более 0.75 ос./км) также показали широкий диапазон значений количества хлорофилла (от 15.7 до 374 мг/м2) (рис. 4). Аналогичная картина наблюдалась при сравнении значений встречаемости китов с данными проточного флюориметра. Значения Chl-a колебались от 0.339 до 4.325 мг/м3, при этом минимальное количество животных (менее 0.1 ос./км) отмечено и при 0.339 мг/м3, и при 3.157 мг/м3 хлорофилла, а максимальное (2.4 ос./км) при 2.084 мг/м3.
Рис. 4.
Количество хлорофилла “а”, полученное методом прямых измерений, и встречаемость усатых китов по расчетным участкам в районе исследований, 21.01–9.02.22 г.
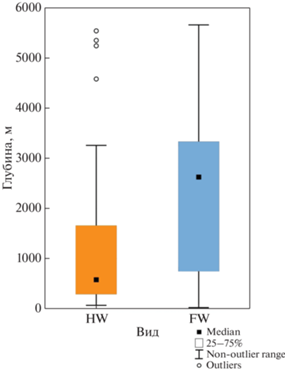
Встречаемость финвалов и горбачей в зависимости от глубин. Обнаружено, что горбачи предпочитают более мелководные районы в основном шельфовой зоны, в то время как финвалы тяготеют к более глубоководным пелагическим водам (Mann–Whitney U-test: U = 31 756, N1 = 263, N2 = = 506, P = 0.00) (рис. 5).
ОБСУЖДЕНИЕ
Настоящее исследование показало, что среди китообразных в районе наблюдений чаще всего встречались горбачи и финвалы, что было вполне ожидаемо. Действительно, наряду с антарктическими малыми полосатиками (Balaenoptera bonaerensis), эти усатые киты являются самыми многочисленными и широко распространенными в различных антарктических и субантарктических районах [12, 13, 30, 32, 35]. Малые полосатики в этом исследовании практически не наблюдались, что понятно, так как известно, что их распределение тесно связано со льдами [17, 34].
По результатам анализа высокая встречаемость финвалов и горбачей была выявлена в разных районах наблюдений. Финвалы преобладали в водах с резким перепадом глубин в районе желобов и глубоководных бассейнов. Основная часть горбачей, наоборот, отмечена в относительно мелководных проливах и районах с более или менее ровным рельефом. Зависимость распределения от глубины у этих видов китов было описано ранее [4, 14, 16]. Наши исследования являются подтверждением данной закономерности. Предположительно, такое горизонтальное разделение ниш между финвалами и горбачами может быть связано с различиями в их трофических предпочтениях [32]. Так, Santora J.A. с соавторами [36] обнаружили, что горбатые киты предпочитают более мелкий неполовозрелый криль, обитающий на мелководье. Напротив, финвалы, являясь быстро плавающими хищниками, выбирают для кормления глубоководные районы со сложными батиметрическими и гидрографическими схемами циркуляции воды с преобладанием крупного и взрослого криля [36, 37]. Авторы отмечают, что первоочередную важность для китов при поиске добычи имеет не биомасса криля в воде, а именно его половозрелость [37]. Действительно, репродуктивно зрелый криль богат липидами [26] и, таким образом, может стать источником энергетически богатой пищи для китов [37]. В связи с этим, вполне закономерно, что в нашем исследовании самая высокая встречаемость финвалов была обнаружена в глубоководных районах бассейна Пауэлла и Оркнейского желоба, где было зарегистрировано преобладание половозрелых особей антарктического криля. Самая же высокая встречаемость горбатых китов наблюдалась в достаточно мелководном проливе Брансфилда, где преобладала молодь антарктического криля. Примечательно, что исследования последних двадцати лет показали привязанность финвалов и горбачей к определенным районам кормления, которые остаются примерно постоянными во времени и пространстве [6, 31, 32, 38]. Одним из таких мест для горбатых китов является именно пролив Брансфилда, куда они ежегодно мигрирует для нагула с западного побережья Южной Америки [7, 41]. Для финвалов, очевидно, к постоянным районам нагула можно отнести бассейн Пауэлла, так как здесь их регистрируют в летний период регулярно [16].
В море Уэдделла в большом количестве наблюдались оба вида китов, что вероятно, можно объяснить отсутствием у них межвидовой конкуренции за пищевые ресурсы, так как в этом районе были обнаружены большие уловы разновозрастного криля (рис. 3). Высокая встречаемость горбачей в проливе Антарктик (до 1.125 особей/км) при наличии там только взрослого криля (20 г/ 1000 м3), может быть обусловлена тем, что в узком проливе молодой криль мог быть уже съеден или вынесен течением, и киты вовсе не кормились, а мигрировали. Также необходимо учитывать, что на распределение усатых китов влияют не только глубина, обилие и состав пищи, но и другие факторы окружающей среды, которые в данном исследовании не рассматривались.
Особенностью антарктической экосистемы является короткая пищевая цепь от первичных продуцентов (фитопланктона) через зоопланктон к морским млекопитающим. Хлорофилл “а” является существенным активным компонентом биомассы фитопланктона, поэтому он служит как критерием первичной продуктивности, так и удобным для количественной оценки показателем обилия фитопланктона. Не являясь непосредственными потребителями фитопланктона, морские млекопитающие занимают верхний уровень этой трофической цепи. Таким образом, вполне допустимо рассматривать взаимосвязь концентрации хлорофилла “a” (Chl-a) в воде и встречаемости китов в этом районе. Кроме того, в некоторых исследованиях было обнаружено значительное влияние Chl-a на распределение китов [7, 18, 21]. В наших исследованиях зависимость встречаемости китов от концентрации хлорофилла “а” не подтвердилась. Вероятно, отсутствие легко идентифицируемой корреляции между концентрацией фитопланктона и присутствием китов в данном конкретном месте в данное время связано с тем, что точная количественная оценка этой взаимосвязи требует динамического подхода. Необходимо принимать во внимание время, за которое биомасса хлорофилла “а” переходит в биомассу планктона, который затем потребляется китами, а также разные масштабы жизненных процессов у этих организмов. При таком подходе тот факт, что при текущей концентрации хлорофилла “а” зафиксированы разные показатели встречаемости китов, не только объясним, но и закономерен. Мы считаем, что требуется больше данных, чтобы лучше понять эти взаимодействия китообразных и океанографических параметров в районе исследования.
Наблюдения, собранные на 26-дневном отрезке 87 рейса НИС “Академик Мстислав Келдыш” в Антарктике предоставляют вспомогательную информацию о встречаемости финвалов и горбачей в Атлантическом секторе Южного океана и расширяют знания об их текущем состоянии. Вопрос зависимости распределения усатых китов от таких биологических параметров, как концентрация криля различной степени зрелости и содержание хлорофилла в воде требует дальнейших исследований с применением современных методов математического анализа и большего количества станций по их отбору. Эти исследования являются важным вкладом в изучение особенностей современного распределения этих китов в условиях глобального изменения климата.
Благодарности. Авторы благодарят за содействие команду НИС “Академик Мстислав Келдыш” во главе с капитаном Л.В. Сазоновым, а также коллег – участников рейса за помощь и поддержку.
Источники финансирования. Работа выполнена по Государственным заданиям FMWE-2021-0008, FFER-2019-0021 и FWMM-2022-0033.
Список литературы
Antarctic Peninsula Region of the Southern Ocean. Oceanography and Ecology [Eds.: E.G. Morozov, M.V. Flint, V.A. Spiridonov] // Advances in Polar Ecology (AVPE), V. 6. 2021. Springer, Cham. 455 p.
Atkinson A., Siegel V., Pakhomov E., Rothery P. Long-term decline in krill stock and increase in salps within the Southern Ocean // Nature. 2004. V. 432. P. 100–103.
Atkinson A., Hill S.L., Pakhomov E.A. et al. KRILLBASE: a circumpolar database of Antarctic krill and salp numerical densities, 1926–2016 // Earth Syst. Sci. Data. 2017. V. 9. P. 193–210.
Bassoi M., Acevedo J., Secchi E.R. et al. Cetacean distribution in relation to environmental parameters between Drake Passage and northern Antarctic Peninsula // Polar Biol. 2020. V. 43. P. 1–15. https://doi.org/10.1007/s00300-019-02607-z
Bitiutskii D.G., Samyshev E.Z., Minkina N.I. et al. Distribution and Demography of Antarctic Krill and Salps in the Atlantic Sector of the Southern Ocean during Austral Summer 2021–2022 // Qatar. 2022, 14, 3812. https://doi.org/10.3390/w14233812
Dalla Rosa L., Secchi E.R., Kinas P.G. et al. Photo-identification of humpback whales, Megaptera novaeangliae, off the Antarctic Peninsula from 1997/98 to 1999/2000 // Memoirs of the Queensland Museum. 2001. V. 47. P. 555–561.
Dalla Rosa L. Modeling the foraging habitat of Humpback whales // Ph.D. Thesis, The Faculty of Graduate Studies (Zoology) the University of British Columbia (Vancouver), 2010. 170 p.
Ducklow H., Clarke A., Dickhut R. et al. The marine system of the Western Antarctic Peninsula // In: Rogers A.D. (eds) Antarctic ecosystems: an extreme environment in a changing world, 1st edn. Blackwell, Hoboken. 2012. P. 121–159.
Friedl P., Seehaus T.C., Wendt A. et al. Recent dynamic changes on Fleming Glacier after the disintegration of Wordie Ice Shelf, Antarctic Peninsula // Cryosphere. 2018. V. 12. P. 1347–1365.
Friedlaender A.S., Halpin P.N., Qian S.S. et al. Whale distribution in relation to prey abundance and oceanographic processes in shelf waters of the Western Antarctic Peninsula // Mar. Ecol. Prog. Ser. 2006. V. 317. P. 297–310.
Gedamke J., Robinson S.M. Acoustic survey of marine mammal occurrence and distribution of East Antarctica (30–80oE) in January‑February 2006 // Deep Sea Res. II. 2010. V. 57. P. 968–981.
Joiris C.R. Spring distribution and ecological role of seabirds and marine mammals in the Weddell Sea, Antarctica // Polar Biol. 1991. V. 11. P. 415–424. https://doi.org/10.1007/BF80233076
Joiris C.R., Dochy O. A major autumn feeding ground for fin whales, southern fulmars and grey-headed albatrosses around the South Shetland Islands, Antarctica // Polar Biol. 2013. V. 36. P. 1649–1658.
Kasamatsu F., Matsuoka K., Hakamada T. Interspecific relationships in density among the whale community in the Antarctic // Polar Biol. 2000. V. 23. V. 466–473.
Kawamura A. A review of baleen whale feeding in the Southern Ocean // Rep. Int. Whal. Comm. 1994. V. 44. P. 261–272.
Kharitonov S.P., Tretyakov A.V., Mischenko A.L. et al. Spatial Distribution, Species Composition, and Number of Marine Mammals in the Argentine Basin, Drake Passage, East of Antarctic Peninsula, and Powell Basin in January–March 2020 // In: Morozov E.G., Flint M.V., Spiridonov V.A. (eds) Antarctic Peninsula Region of the Southern Ocean. Advances in Polar Ecology, vol 6. Springer, Cham. 2021. P. 379–398.
Kock K-H., Scheidat M., Boebel O. et al. The Occurrence of Cetaceans along two Transects from 57° S to Atka Bay (70°29.6′ S/07°57.6′ W). SC/61/IA11 // International Whaling Commission, Cambridge, UK. 2009.
Laran S., Gannier A. Spatial and temporal prediction of fin whale distribution in the northwestern Mediterranean Sea // ICES J Mar Sci. 2008. V. 65. V. 1260–1269.
Leaper R., Miller C. Management of Antarctic baleen whales amid past exploitation, current threats and complex marine ecosystems // Antarct Sci. 2011. V. 23. P. 503–529.
Lerczak J.A., Hobbs R.C. Calculation Sighting distances from angular readings during shipboard, aerial, and shore based marine mammal surveys // Mar. Mamm. Sci. 1998. V. 14, 3. P. 590–599.
Loeb V.J., Hofmann E.E., Klinck J.M. et al. ENSO and variability of the Antarctic Peninsula pelagic marine ecosystem // Antarct Sci. 2009. V. 21. P. 135–148.
Mackintosh N.A. The stocks of whales // Fishing News (Books), London. 1965. 232 p.
Mackintosh N.A., Brown S.G. Preliminary estimates of the southern populations of the larger baleen whale // Norsk Hvalfangstmus. 1953. V. 45. P. 469–480.
Meredith M.P., King J.C. Rapid climate change in the ocean west of the Antarctic Peninsula during the second half of the 20th century // Geophys. Res. Lett. 2005. 32:L19604. https://doi.org/10.1029/2005gl024042
Murphy E.J., Watkins J.L., Trathan P.N. et al. Spatial and temporal operation of the Scotia Sea ecosystem: a review of large‑scale links in a krill centred food web // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2007. V. 362. P. 113–148.
Nicol S., De la Mare W.K., Stolp M. The energetic cost of egg production in antarctic krill (Euphausia superba Dana) // Antarct. Sci. 1995. V. 7. P. 25–30.
Nicol S., Worby A., Leaper R. Changes in the Antarctic sea ice ecosystem: potential effects on krill and baleen whales // Mar. Freshw. Res. 2008. V. 59. P. 361–382.
Nicol S., Foster J., Kawaguchi S. The fishery for Antarctic krill – recent developments // Fish and Fisheries. 2012. V. 13. P. 30–40.
Nøttestad L., Krafft B.A., Søiland H., Skaret G. Observations of cetaceans in the south-east Atlantic sector of the Southern Ocean, during summer 2008 // Polar. Biol. 2014. V. 37. P. 891–895. https://doi.org/10.1007/s00300-014-1477-y
Nowacek D.P., Friedlaender A.S., Halpin P.N. et al. Super-aggregations of krill and humpback whales in Wilhelmina Bay, Antarctic Peninsula // PLoS ONE. 2011. 6(4):e19173. https://doi.org/10.1371/journal.pone.0019173
Orgeira J.L., Alderete M.C., Jiménez Y.G., González J.C. Long-term study of the at-sea distribution of seabirds and marine mammals in the Scotia Sea, Antarctica // Advances in Polar Science. 2015. V. 26. P. 158–167. ISSN 1674–9928.https://doi.org/10.13679/j.advps.2015.2.00158
Orgeira J.L., González J.C., Jiménez Y.G., Benítez L.M. Occurrence of fin and humpback whales in the Scotia Sea and the Protected Marine Area of the South Orkney islands, Antarctica // Mastozool. Neotrop. 2017. V. 24. P. 135–143.
Reid K., Brierley A.S., Nevitt G.A. An initial examination of relationships between the distribution of whales and Antarctic krill Euphausia superba at South Georgia // J. Cetacean Res. Manag. 2000. V. 2. P. 143–149.
Reid K., Croxall J.P., Briggs D.R., Murphy E.J. Antarctic ecosystem monitoring: quantifying the response of ecosystem indicators to variability in Antarctic krill // ICES J. Mar. Sci. 2005. V. 62. P. 366–373. https://doi.org/10.1016/j.icesjms.2004. 11.003
Rossi-Santos M.R., Baracho C., Cipolotti S., Marcovaldi E. Cetacean sightings near South Georgia islands, South Atlantic Ocean // Polar Biol. 2007. V. 31. P. 63–68. https://doi.org/10.1007/s00300-007-0333-8
Santora J.A., Reiss C.S., Loeb V.J., Veit R.R. Spatial association between hotspots of baleen whales and demographic patterns of Antarctic krill Euphausia superba suggests size-dependent predation // Mar Ecol Prog Ser. 2010. V. 405. P. 255–269. https://doi.org/10.3354/ meps08513
Santora J.A., Schroeder I.D., Loeb V.J. Spatial assessment of fin whale hotspots and their association with krill within an important Antarctic feeding and fishing ground // Mar. Biol. 2014. V. 161. P. 2293–2305. https://doi.org/10.1007/s00227-014-2506-7
Secchi E.R., Dalla Rosa L., Kinas P.G. Encounter rates of whales around the Antarctic Peninsula with special reference to humpback whales, Megaptera novaeangliae, in the Gerlache Strait: 1997/98 to 1999/2000 // Mem. Queensl. Mus. 2001. V. 47(2). P. 571–578.
Siegel V., Kawaguchi S., Ward P. et al. Krill demography and large-scale distribution in the southwest Atlantic during January/February 2000 // Deep Sea Research II. 2004. V. 51. P. 1253–1273. https://doi.org/10.1016/j.dsr2.2004.06.013
Sirovic A., Hildebrand J., Thiele D. Baleen whales in the Scotia Sea during January and February 2003 // J. Cetacean Res. Man. 2006. V. 8. P. 161–171.
Stevick P.T., Aguayo A., Allen J. et al. Migrations of individually identified humpback whales between the Antarctic Peninsula and South America // The Journal of Cetacean Research and Management. 2004. V. 6. P. 109–113.
Thiele D., Chester E.T., Gill P.C. Cetacean distribution off Eastern Antarctica (80°–150° E) during the austral summer of 1995/96 // Deep Sea Res. II. 2000. V. 47. P. 2543–2572.
Tin T., Fleming Z.l., Hughes K.A. et al. Impacts of local human activities on the Antarctic environment // Antarct. Sci. 2008. V. 21. P. 3–33.
Tynan C.T. Ecological importance of the Southern Boundary of the Antarctic circumpolar current // Nature. 1998. V. 392. P. 708–710.
Дополнительные материалы отсутствуют.