Океанология, 2023, T. 63, № 4, стр. 660-676
Пространственная структура глубоководных пелагических ихтиоценов северной части моря Уэдделла (бассейн Пауэлла) и пролива Брансфилда в летний период 2020 и 2022 г.
С. Г. Кобылянский 1, *, А. В. Мишин 1, А. М. Орлов 1, 2, 3, Н. В. Гордеева 1, 4, Р. З. Мухаметьянов 1
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
3 Томский государственный университет
Томск, Россия
4 Институт общей генетики имени Н.И. Вавилова РАН
Москва, Россия
* E-mail: kobylianskysg@gmail.com
Поступила в редакцию 01.12.2022
После доработки 14.02.2023
Принята к публикации 16.02.2023
- EDN: YMPZBU
- DOI: 10.31857/S003015742304007X
Аннотация
Приведен обзор состава и структуры глубоководных пелагических ихтиоценов пролива Брансфилда и северной части моря Уэдделла (бассейн Пауэла) Атлантического сектора Южного океана. Материал получен летом 2020 и 2022 гг. на 26 станциях на горизонтах от 120–0 до 2200–0 м. Был собран 901 экз. молоди и взрослых рыб 19 видов из 10 семейств. Статистический анализ позволил выделить 4 достоверно различающихся района, доминирующие ихтиоцены в которых располагались в водах различного происхождения. Эти ихтиоцены бедны по числу выявленных видов, но зачастую довольно многочисленны. В районе Антарктического пролива и на шельфе Антарктического полуострова преобладали относительно мелководные, эндемичные для шельфа и склона Антарктиды представители семейств Bathydraconidae, Channichthyidae, Liparidae, Nototheniidae, тогда как в проливе Брансфилда, абиссальной котловине бассейна Пауэлла, а также в пелагиали над глубоководными хребтами и желобами, окаймляющими его с севера – мезо- и батипелагические рыбы из сем. Mycthophidae, Bathylagidae, Gonostomatidae, Paralepididae и Scopelarchidae. Вблизи северной границы бассейна Пауэлла число пойманных мезо- батипелагических видов и средняя их численность оказались выше, чем в его центральной части (11 против 7 видов и 63.5 против 84.1 экз./100 м2). В центральной части бассейна доминировал Bathylagus antarcticus, доля которого в уловах в среднем составляла 40%, а численность – 28.8 экз./100 м2, тогда как в северной его части преобладала Electrona antarctica, доля которой в уловах была в среднем 33%, а численность – 27.4 экз./100 м2.
ВВЕДЕНИЕ
Современный облик ихтиофауны Южного океана сформировался около 30 млн лет назад вместе c появлением пролива Дрейка и последующим формированием системы Антарктического циркумполярного течения (АЦТ), что привело к изоляции и охлаждению антарктических водных масс, а также к возникновению массивного ледяного щита над антарктическим континентом [3, 22]. Данные процессы вызвали исчезновение многих таксономических групп рыб, характерных для прочих районов Мирового океана, и способствовали эволюции уникальной ихтиофауны с крайне высоким уровнем эндемизма и доминированием представителей подотряда Notothenioidei. Ихтиофауна Антарктики менее разнообразна, чем можно было бы ожидать, учитывая ее значительный возраст и обширные объемы водной толщи, занимаемые ихтиоценами. Согласно последним данным описано 374 вида антарктических морских рыб из 19 семейств, которые при этом составляют лишь чуть более 1% мировой морской ихтиофауны. Четверть всех известных видов рыб данного региона обитает в пределах мезо- и батипелагиали [25]. Глубоководная пелагическая ихтиофауна Южного океана также характеризуется низким видовым разнообразием и высокой степенью видового эндемизма [14, 16]. Наиболее многочисленные таксономические группы обитающих здесь глубоководных мезо- и батипелагических рыб относятся к семействам Myctophidae, Bathylagidae, Paralepididae, Gonostomatidae и Scopelarchidae [4, 17, 25, 26]. Виды из этих семейств составляют более 95% биомассы всей мезопелагической ихтиофауны верхнего километрового слоя, обитающей в регионе морей Уэдделла-Скотия [29]. Сюда же также относится и антарктическая серебрянка Pleuragramma antarcticum – единственный представитель семейства Nototheniidae с пелагическим жизненным циклом [11, 45].
При изучении особенностей состава и структуры морских пелагических экосистем Антарктики как правило центральная роль и основное внимание отводится эвфаузиидам (Euphausiidae) и, в частности, антарктическому крилю Euphausia superba, как основному источнику пищи для антарктических птиц и морских млекопитающих, а также важнейшему объекту промышленного рыболовства. Однако, по мере накопления знаний становится все более очевидным, что трофические связи в этом регионе намного сложнее, чем изначально предполагалось концепцией “фитопланктон–криль–высшие хищники” и для понимания целостной картины их функционирования также необходимо адекватно учитывать вклад мезо- и батипелагической ихтиофауны, как ключевого трофического компонента морских сообществ [7]. Являясь потребителями мелкоразмерного растительноядного зоопланктона, мезо- и батипелагические рыбы, в свою очередь, играют важную роль в качестве промежуточного звена между первичными консументами и хищниками высшего трофического уровня [18, 42], обеспечивая тем самым стабильность антарктических экосистем за счет создания в них альтернативных трофических путей, в которых роль криля не столь существенна. В тех районах Антарктики, где численность криля низка, сообщества пелагических рыб вносят основной вклад в биомассу в верхнем 1000-метровом слое как в океанических, так и в глубоководных прибрежных районах под паковыми льдами [29, 30, 32]. Таким образом, изучение видового состава, распределения и условий существования антарктической ихтиофауны необходимо для прогнозирования влияния возможного снижения численности криля, вызванного антропогенными и/или климатическими факторами, на трофическую структуру сообществ Южного океана.
Акватория вокруг Антарктического полуострова, а также пограничный район между морями Соктия и Уэдделла являются одним из наиболее изученных районов Антарктики. Несмотря на большое число исследований, посвященных различным сторонам функционирования глубоководных пелагических экосистем данного региона, лишь небольшая их доля касается непосредственно особенностей распределения и видового состава пелагических сообществ рыб [36, 40, 43]. Судя по литературным данным, при изучении антарктических ихтиоценов в указанных районах, помимо взрослых рыб, много внимания уделялось исследованию видового состава и численности ранних пелагических стадий нототениевых рыб из приловов тралений антарктического криля [6, 23, 24]. При этом, как правило, облавливался верхний 200–400-м слой, что приводило к заметному недоучету вклада мезопелагических видов. Часто сведения о составе рыбных сообществ района приводятся совместно с данными о макрозоопланктоне [12, 29, 30, 35], значительно усложняющими их интерпретацию и сравнение. В ходе предыдущих исследований установлены состав и общие закономерности распределения видов, принадлежащих к пелагическим ихтиоценам [10]. Показано, что над шельфом пелагическая ихтиофауна представлена главным образом молодью демерсальных нототений и белокровных щук (Notothniidae, Channichtyidae) и в меньшей степени различными стадиями развития мезопелагических видов [21, 23, 24], тогда как над шельфовым склоном и в открытом океане преобладают молодь и взрослые особи мезопелагических видов с явным доминированием по численности и биомассе представителей семейств Myctophidae, Bathylagidae и Paralepididae [12, 29, 30, 39]. Лишь на акватории западной части Антарктического полуострова, где циркумполярные глубинные воды выходят на шельф, данная закономерность нарушается, что способствует выносу мезопелагических рыб в прибрежные районы [13]. Помимо рельефа дна, другим важным фактором, определяющим структуру сообществ, является широтная зональность. По мере удаления от материка на север ближе к центральной части Антарктического циркумполярного течения (АЦТ) заметно возрастает численность и расширяется видовой состав мезопелагических рыб [42].
Основной целью настоящего исследования являлось изучение биоразнообразия глубоководных ихтиоценов и закономерностей распределения популяций массовых видов пелагических рыб в летний период в проливе Брансфилда и мало изученной северной части моря Уэдделла (бассейн Пауэлла) в зависимости от структуры водных масс.
МАТЕРИАЛ И МЕТОДИКА
Материал для настоящей работы собран в 79 и 87 рейсах НИС “Академик Мстислав Келдыш”, которые были проведены соответственно 24.01–22.02.2020 г. и 22.01–12.02.2022 г. Район работ в обоих рейсах охватывал пролив Брансфилда, северную часть моря Уэдделла (Бассейн Пауэлла), а также район Южных Оркнейских о-вов (воды над Оркнейским желобом и желобом Лори) (рис. 1). Для сбора ихтиологических материалов использовался не замыкающийся разноглубинный пелагический трал Айзекса-Кидда в модификации Самышева-Асеева (РТАКСА), оснащенный двойным мешком длиной 25 м; наружный мешок был изготовлен из узловой капроновой дели из нити диаметром 1 мм с ячеей 50 мм; внутренний – из узловой дели с ячеей 5 мм и кутовой вставкой из капронового сита № 15. Площадь устья трала 6 м2. Всего в 2020 г было выполнено 16 траловых станций, на которых было отобрано 17 проб, а в 2022 г. – 10 траловых станций, на которых отобрано 10 проб (табл. 1). Ловы проводились как в прибрежных, так и в удаленных от берегов районах на горизонтах от 120–0 до 2212–0 м при скорости судна 3 узла без длительной экспозиции трала на каком-либо из проходимых горизонтов. Нижняя граница горизонта лова определялась по показаниям датчика температуры и давления Senti DT фирмы Star-Oddyi. Расстояние, пройденное судном между точками начала и конца траления, рассматривалось, как расстояние по ортодромии [48] и рассчитывалось в интернет-калькуляторе [38].
Рис. 1.
Схема расположения станций в районе работ в 79 и 87 рейсе НИС “Академик Мстислав Келдыш”.
⚫ – 2020, ◆ – 2022, цветом показаны горизонты лова:  – 400–0,
– 400–0,  – 500–0,
– 500–0,  – 1000–0,
– 1000–0,  – 1500–0,
– 1500–0,  – 2000–0 м.
– 2000–0 м.
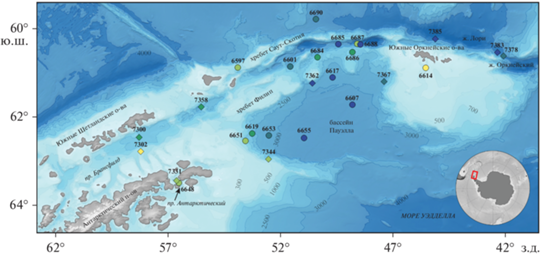
Таблица 1.
Положение станций, на которых были отобраны пробы РТАКСА в 79 и 87 рейсах НИС “Академик Мстислав Келдыш” в январе–феврале 2020 и 2022 гг.
| Номер станции | Дата | Координаты начало ю.ш.; з.д |
Координаты конец ю.ш.; з.д |
№ пробы | Горизонт лова (м) | Объем профильтро-ванной воды (м3) |
|---|---|---|---|---|---|---|
| 6597 | 24.01.2020 | 60°52′58″; 53°54′15″ | 60°53ʹ22ʹʹ; 53°52ʹ52ʹʹ | 1 | 507–0 | 30 886 |
| 6601 | 25.01.2020 | 60°51ʹ40ʹʹ; 51°34ʹ19ʹʹ | 60°54ʹ25ʹʹ; 51°20ʹ37ʹʹ | 2 | 1432–0 | 80 460 |
| 6601 | 25.01.2020 | 60°56ʹ01ʹʹ; 51°13ʹ01ʹʹ | 60°56ʹ57ʹʹ; 51°08ʹ02ʹʹ | 3 | 305–0 | 28 920 |
| 6607 | 28.01.2020 | 61°43ʹ30ʹʹ; 48°48ʹ47ʹʹ | 61°41ʹ04ʹʹ; 48°47ʹ01ʹʹ | 4 | 1752–0 | 92 400 |
| 6614 | 29.01.2020 | 60°53ʹ20ʹʹ; 45°32ʹ30ʹʹ | 60°53ʹ28ʹʹ; 45°33ʹ28ʹʹ | 5 | 120–0 | 5460 |
| 6617 | 31.01.2020 | 61°06 ʹ24ʹʹ; 49°41ʹ12ʹʹ | 61°06ʹ24ʹʹ; 49°28ʹ48ʹʹ | 6 | 2212–0 | 66 840 |
| 6619 | 01.02.2020 | 62°22ʹ34ʹʹ; 53°15ʹ54ʹʹ | 62°18ʹ54ʹʹ; 53°09ʹ04ʹʹ | 7 | 1100–0 | 54 060 |
| 6648 | 13.02.2020 | 63°29ʹ47ʹʹ; 56°31ʹ21ʹʹ | 63°31ʹ58ʹʹ; 56°27ʹ17ʹʹ | 8 | 650–0 | 31 680 |
| 6651 | 15.02.2020 | 62°32ʹ27ʹʹ; 53°33ʹ54ʹʹ | 62°35ʹ55ʹʹ; 53°33ʹ43ʹʹ | 9 | 505–0 | 38 640 |
| 6653 | 16.02.2020 | 62°25ʹ21″; 52°31ʹ37ʹʹ | 62°27ʹ10ʹʹ; 52°15ʹ55ʹʹ | 10 | 1626–0 | 83 580 |
| 6655 | 17.02.2020 | 62°28ʹ46ʹʹ; 50°57ʹ07ʹʹ | 62°17ʹ58ʹʹ; 50°52ʹ11ʹʹ | 11 | 2143–0 | 123 060 |
| 6684 | 21.02.2020 | 60°38ʹ53ʹʹ; 50°21ʹ21ʹʹ | 60°35ʹ20ʹʹ; 50°27ʹ29ʹʹ | 12 | 1153–0 | 51 900 |
| 6685 | 22.02.2020 | 60°21ʹ16ʹʹ; 49°25ʹ51ʹʹ | 60°19ʹ15ʹʹ; 49°11ʹ26ʹʹ | 13 | 2062–0 | 82 740 |
| 6686 | 22.02.2020 | 60°32ʹ03ʹʹ; 48°48ʹ06ʹʹ | 60°32ʹ35ʹʹ; 48°37ʹ57ʹʹ | 14 | 1318–0 | 56 040 |
| 6687 | 22.02.2020 | 60°20ʹ55ʹʹ; 48°35ʹ12ʹʹ | 60°21ʹ14ʹʹ; 48°29ʹ10ʹʹ | 15 | 634–0 | 33 480 |
| 6688 | 22–23.02.2020 | 60°21ʹ29ʹʹ; 48°27ʹ17ʹʹ | 60°21ʹ16ʹʹ; 48°04ʹ39ʹʹ | 16 | 1765–0 | 124 980 |
| 6690 | 24.02.2020 | 59°47ʹ24ʹʹ; 50°25ʹ32ʹʹ | 59°41ʹ37ʹʹ; 50°38ʹ27ʹʹ | 17 | 1400–0 | 97 080 |
| 7300 | 22.01.2022 | 62°28ʹ43ʹʹ; 58°12ʹ30ʹʹ | 62°26ʹ19ʹʹ; 58°21ʹ23ʹʹ | 18 | 1160–0 | 53 004 |
| 7302 | 23.01.2022 | 62°45ʹ46″; 58°15ʹ10″ | 62°48ʹ10ʹʹ; 58°09ʹ30ʹʹ | 19 | 440–0 | 32 892 |
| 7331 | 28.01.2022 | 63°25ʹ31″; 56°39ʹ42″ | 63°27ʹ52ʹʹ; 56°35ʹ19ʹʹ | 20 | 590–0 | 32 114 |
| 7344 | 30.01.2022 | 62°58ʹ8″; 52°35ʹ51″ | 62°56ʹ13ʹʹ; 52°29ʹ14ʹʹ | 21 | 550–0 | 39 559 |
| 7358 | 02.02.2022 | 61°48ʹ36″; 55°39ʹ22″ | 61°44ʹ'16ʹʹ; 55°25ʹ24ʹʹ | 22 | 1000–0 | 87 896 |
| 7362 | 05.02.2022 | 61°15ʹ26″; 50°43ʹ11″ | 61°14ʹ10ʹʹ; 50°26ʹ18ʹʹ | 23 | 1700–0 | 90 896 |
| 7367 | 07.02.2022 | 61°14ʹ53″; 47°26ʹ50″ | 61°09ʹ37ʹʹ; 47°20ʹ37ʹʹ | 24 | 1500–0 | 67 339 |
| 7378 | 10.02.2022 | 60°35ʹ58″; 42°11ʹ32″ | 60°38ʹ47ʹʹ; 41°54ʹ39ʹʹ | 25 | 1520–0 | 97 452 |
| 7383 | 11.02.2022 | 16°03ʹ57″; 46°41ʹ03″ | 16°12ʹ32; 46°41ʹ03ʹʹ | 26 | 1750–0 | 99 119 |
| 7385 | 12.02.2022 | 60°13ʹ41″; 44°58ʹ22″ | 60°14ʹ8ʹʹ; 45°16ʹ21ʹʹ | 27 | 1900–0 | 99 564 |
Расстояние, пройденное тралом на каждой станции, вычислялось с использованием опубликованных ранее уравнений [46]. Объем профильтрованной воды определялся умножением площади устья трала на расстояние между начальной и конечной точками траления. Численность пойманных рыб в каждом трале рассчитывалась исходя из объёма профильтрованной воды. Биомасса пойманных рыб приведена в тексте для тех станций, где в 2022 г. были проведены соответствующие измерения, но не учитывалась в сравнительных целях, поскольку при отборе проб не замыкающимся орудием лова неизбежна ее недооценка, связанная с эффектом уклонения от орудия лова отдельных наиболее крупных и/или подвижных экземпляров пелагических рыб [15], какими в Антарктических водах являются, например, виды Paralepididae. Оказывая небольшое влияние на общую численность рыб в улове, этот эффект в значительной мере может занижать суммарную биомассу пробы. Первоначально пробы фиксировались 2−4% формалином, нейтрализованным морской водой, затем они переводились в 75%-й этанол.
Статистический анализ проводили с помощью пакета программ PRIMER ver. 6 [8]. Обработка данных базировалась на матрице видового сходства проб, рассчитанной на основе индекса Брея−Кёртиса; в качестве исходных данных использовали процентное соотношение видов и число рыб в пробе. Для уменьшения влияния вклада доминирующих видов, перед построением матрицы сходства данные были трансформированы путем извлечения квадратного корня. При проведении статистического анализа результатов была выполнена кластеризация методом попарного внутригруппового невзвешенного среднего (UPGMA) [41] и ординация методом неметрического многомерного шкалирования (MDS) [28]. Для оценки надежности результатов кластеризации проводили перестановочный тест SIMPROF (число повторов 999, p = 0.05). Стандартизация и трансформация данных не применялась.
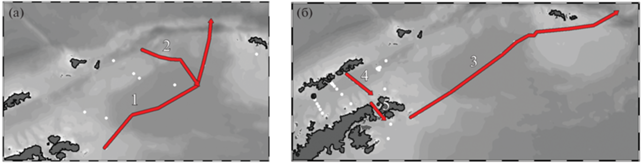
Сведения о гидрофизических параметрах среды (температуры и солености в толще воды) получены в процессе вертикальных зондирований. В 2020 г. для получения профилей температуры и солености применялся гидрофизический зонд SBE 19plus; были использованы данные 11 зондирований. В 2022 г. гидрологические измерения велись с помощью зонда Idronaut OCEAN SEVEN 320Plus, опускаемого на кабель-тросе от поверхности до дна. Для построения разрезов использовались данные 34 зондирований. Для описания структуры вод в 2020 и 2022 г. было выбрано в общей сложности 5 гидрофизических разрезов (рис. 2).
Рис. 2.
Схема расположения гидрофизических разрезов в 2020 (а) и 2022 (б) (⚪ – гидрофизические станции, 1 – разрез через бассейн Пауэлла, 2 – разрез над подводными поднятиями бассейна Пауэлла, 3 – разрез через шельф Антарктического п-ва, котловину бассейна Пауэлла и Южно-Оркнейское плато, 4 – пролив Брансфилд, 5 – Антарктический пролив).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Особенности структуры вод на исследованных полигонах работ. Для описания гидрофизических условий в районе съемки 2020 г. были выбраны разрезы, проходившие через шельф и центральную часть бассейна Пауэлла, а также район хребтов Филип и Саут-Скотия (рис. 3, 4).
Рис. 3.
Распределение температуры и солености в районе исследований на разрезе через шельф и котловину бассейна Пауэлла в 2020 г. (AASW – Antarctic Surface Water (антарктическая поверхностная водная масса), WDW – Warm Deep Water (теплый глубинный слой), CIL – Cold Intermediate Layer (холодный промежуточный слой).

Рис. 4.
Распределение температуры и солености на разрезе над подводными поднятиями в северной части бассейна Пауэлла в 2020 г. (расшифровка латинской аббревиатуры как в рис. 3).
Гидрологическая структура вод на станциях в юго-восточной части разреза (ст. 6651–6653, 6656) (рис. 3) характеризовалась наличием переохлажденного верхнего слоя толщиной от 300 до 200 м с отрицательной температурой –1.5…–2°С и относительно низкой соленостью 33.2–34.4 psu, что являлось следствием летнего таяния ледяного покрова, препятствующего прогреву поверхностного слоя вод. На шельфе данный переохлажденный слой располагался от поверхности до дна, тогда как на станциях в центральной части бассейна Пауэлла ниже него располагался слой относительно теплой (0–0.6°С, 34.6 psu) глубинной воды (WDW), которая занимала горизонты примерно от 300 до 1500–1700 м. На станциях в северо-восточной части разреза (ст. 6607–6610) структура вод была типичной для моря Уэдделла в летний период [2]. В верхних 100–150 м располагался прогретый летний поверхностный слой с сильным вертикальным градиентом температуры. Под ним на глубине около 200 м был расположен летний холодный промежуточный слой (CIL) с подповерхностным минимумом температуры с отрицательными значениями около –0.5°С (рис. 3). Далее залегал слой теплой глубинной воды с температурой до 0.6°С на глубине около 500 м; далее ко дну температура уменьшалась. На станциях в северо-западной части района исследований (ст. 6601, 6602) (рис. 4), наблюдалась несколько другая гидрофизическая картина: воды, поступающие из западной части моря Уэдделла вместе с дрейфующим льдом и большим количеством айсбергов (шельфовые воды моря Уэдделла), подвергались здесь перемешиванию на подводных поднятиях за счет внутренних волн, генерируемых приливно-отливными течениями. В результате формировалась слабо стратифицированная вертикальная структура, где глубинный максимум температуры не был выражен.
В январе 2022 г. распределение основных гидрофизических характеристик в бассейне Пауэлла также в целом соответствовало среднемноголетней норме [34] и отличалось от 2020 г. лишь более выраженным прогревом поверхностного слоя, чему способствовало отсутствие тающего льда и отступления ледовой кромки южнее границы 2020 г. На разрезе можно выделить три слоя: верхний слой мощностью от 20 до 100 м занимала Антарктическая поверхностная вода, образующаяся при летнем нагреве. Температура увеличивалась с юга на север от 0.5 до 2°C. В распределении солености присутствовали локальные минимумы, вероятно, связанные с таянием льдов; в основном их значения находились в пределах 34.40–34.50 psu. Ниже располагался холодный промежуточный слой (CIL) – результат зимней конвекции. Его толщина варьировала от 50 до 150 м (рис. 5). Минимальные значения потенциальной температуры наблюдались на склоновых станциях (ст. 7345–7348) и достигали –1.69°C, соленость при этом плавно увеличивалась с глубиной без значительных градиентов. Начиная с глубин 200 м в центральной глубоководной части бассейна Пауэлла наблюдалось присутствие теплых глубинных вод, хорошо определявшихся по нулевой изотерме [5, 31] и соответствовавших солености 34.70 psu. Поднятию изолиний температуры и солености в центральной части бассейна Пауэлла способствовало наличие здесь циклонической циркуляции.
Рис. 5.
Распределение температуры и солености на разрезе через бассейн Пауэлла (1), Южно-Оркнейское плато (2) и Оркнейский желоб (3) в 2022 г. (расшифровка латинской аббревиатуры как в рис. 3, SW – Shelf Water (шельфовые воды)).

В 2022 г. в проливе Брансфилда наблюдалась типичная для данного района термохалинная структура вод [20, 27, 44]: большую часть пролива занимала холодная, соленая с отрицательной температурой, модифицированная вода моря Уэдделла (TWW). При этом вдоль Южных Шетландских о-вов с течением Брансфилда узкой струей также распространялась теплая и опресненная модифицированная вода моря Беллинсгаузена (TBW), которая в верхних 50 м заходила и на середину пролива (рис. 6). Нижняя часть струи течения Брансфилда представляла собой модифицированную циркумполярную глубинную воду (mCDW) – более теплую и соленую с ядром на глубине 300 м.
Рис. 6.
Распределение температуры и солености на разрезе через пролив Брансфилда летом 2022 г. (TBW – Transitional Zonal Water with Bellingshausen influence (модифицированная вода моря Белинсгаузена), TWW – Transitional Zonal Water with Weddell Sea influence (модифицированная вода моря Уэдделла), mCDW – modified Circumpolar Deep Water (модифицированная циркуполярная вода)).
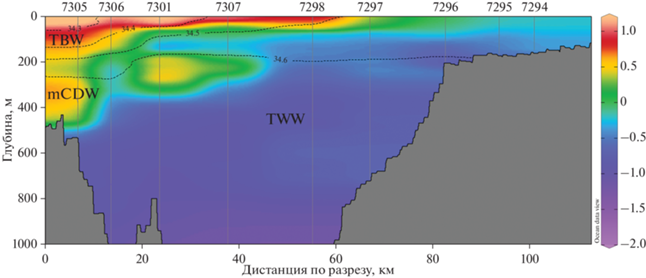
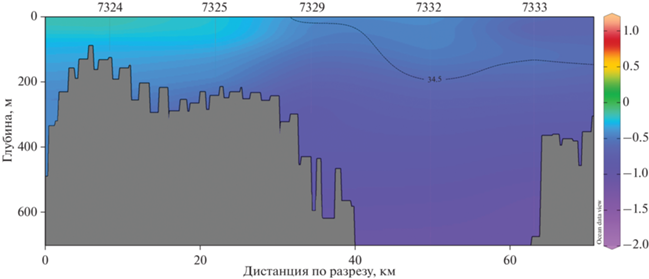
Разрез через Антарктический пролив (Antarctic Sound) (рис. 7) был характерен уменьшением температуры и солености с севера на юг. Северная мелководная часть пролива (ст. 7324, 7325), вероятно, была заполнена водами из пролива Брансфилда, которая отличалась более высокой потенциальной температурой, с ее максимумом –0.10°C в верхнем 60 м слое. Здесь же наблюдалась и повышенная соленость воды, только, в отличие от температуры, ее максимум находился в придонном слое и составлял 34.55 psu на глубинах около 150 м. Глубоководная центральна часть пролива была подвержена влиянию вод из моря Уэдделла с более низкой температурой и относительным опреснением за счет таяния льда в верхнем 100 м слое.
Ловы РТАКСА на разных полигонах работ. Коллекция молоди и взрослых рыб, собранная с помощью РТАКСА в 2020 и 2022 г. включала в себя 901 экз., в сумме относящихся к 19 видам из 10 семейств (табл. 2).
Таблица 2.
Число экземпляров молоди и взрослых рыб в уловах РТАКСА 79 и 87 рейсах НИС “Академик Мстислав Келдыш” в январе–феврале 2020 и 2022 г.
| Номер станции | 6601 | 6607 | 6617 | 6619 | 6597 | 6651 | 6648 | 6653 | 6655 | 6684 | 6685 | 6686 | |
| Семейство/вид | |||||||||||||
| Bathylagidae | |||||||||||||
| Bathylagus antarcticus | 22 | 11 | 7 | 23 | 20 | 7 | 3 | 7 | 11 | ||||
| Bathydraconidae | |||||||||||||
| Bathydraco marri | |||||||||||||
| Racovitzia cf. glacialis | 1 | ||||||||||||
| Channichthyidae | |||||||||||||
| Cryodraco antarcticus | |||||||||||||
| Chaenodroco rastrospinosus | |||||||||||||
| Champsocephalus gunnari | 6 | 1 | |||||||||||
| Gonostomatidae | |||||||||||||
| Cyclothone microdon | 9 | 7 | 4 | 2 | 13 | 6 | 3 | 12 | 1 | ||||
| Liparidae | |||||||||||||
| Paraliparis cf. gracilis | 2 | ||||||||||||
| Paraliparis sp. | |||||||||||||
| Macrouridae | |||||||||||||
| Cynomacrurus pirei | 1 | 1 | |||||||||||
| Macrouridae gen. sp. | |||||||||||||
| Myctophidae | |||||||||||||
| Electrona antarctica | 13 | 5 | 4 | 11 | 5 | 3 | 4 | 11 | 7 | 8 | 9 | ||
| Gymnoscopelus braueri | 4 | 1 | 1 | 4 | 1 | ||||||||
| G. nicholsi | 2 | ||||||||||||
| G. opisthopterus | 3 | 1 | 4 | 2 | 3 | 2 | 8 | 1 | 1 | ||||
| Gymnoscopelus sp. | |||||||||||||
| Krefftichthys andersoni | |||||||||||||
| Protomyctophum bolini | 2 | ||||||||||||
| P. choriodon | 1 | ||||||||||||
| Protomyctophum sp. | |||||||||||||
| Notothenidae | |||||||||||||
| Pleuragramma antarctica | 15 | ||||||||||||
| Paralepididae | |||||||||||||
| Notolepis coatsorum | 4 | ||||||||||||
| Scopelarchidae | |||||||||||||
| Benthalbella elongata | 1 | 1 | |||||||||||
| Номер станции | 6687 | 6688 | 6690 | 7300 | 7302 | 7331 | 7344 | 7358 | 7362 | 7367 | 7378 | 7383 | 7385 |
| Семейство/вид | |||||||||||||
| Bathylagidae | |||||||||||||
| Bathylagus antarcticus | 1 | 15 | 21 | 10 | 20 | 10 | 17 | 7 | |||||
| Bathydraconidae | |||||||||||||
| Bathydraco marri | |||||||||||||
| Racovitzia cf. glacialis | |||||||||||||
| Channichthyidae | |||||||||||||
| Cryodraco antarcticus | 1 | ||||||||||||
| Chaenodroco rastrospinosus | 3 | ||||||||||||
| Champsocephalus gunnari | |||||||||||||
| Gonostomatidae | |||||||||||||
| Cyclothone microdon | 1 | 15 | 6 | 3 | 4 | 6 | 6 | 5 | |||||
| Liparidae | |||||||||||||
| Paraliparis cf. gracilis | |||||||||||||
| Paraliparis sp. | 5 | ||||||||||||
| Macrouridae | |||||||||||||
| Cynomacrurus pirei | |||||||||||||
| Macrouridae gen. sp. | 1 | ||||||||||||
| Myctophidae | |||||||||||||
| Electrona antarctica | 11 | 16 | 14 | 16 | 21 | 1 | 24 | 10 | 3 | 25 | 21 | 28 | |
| Gymnoscopelus braueri | 10 | 8 | 3 | 3 | 3 | 4 | 3 | 2 | 1 | 4 | 7 | 14 | |
| G. nicholsi | 2 | 1 | 1 | 1 | |||||||||
| G. opisthopterus | 1 | 11 | 1 | 2 | 3 | 2 | 1 | 2 | 1 | ||||
| Gymnoscopelus sp. | 2 | ||||||||||||
| Krefftichthys andersoni | 1 | 1 | 3 | ||||||||||
| Protomyctophum bolini | 1 | ||||||||||||
| P. choriodon | |||||||||||||
| Protomyctophum sp. | 1 | ||||||||||||
| Notothenidae | |||||||||||||
| Pleuragramma antarctica | 26 | ||||||||||||
| Paralepididae | |||||||||||||
| Notolepis coatsorum | 2 | 1 | 1 | 13 | 17 | 10 | 7 | ||||||
| Scopelarchidae | |||||||||||||
| Benthalbella elongata | |||||||||||||
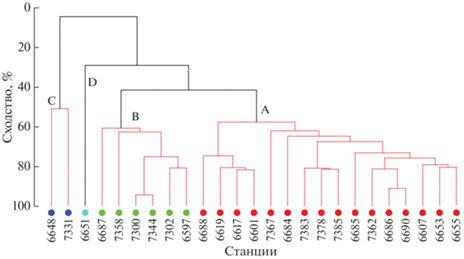
В результате кластерного анализа собранных материалов, включающего в себя перестановочный тест SIMPROF, были выявлены 4 основные группы проб (А, B, C и D) на уровне сходства 4.7% (π = 7.0, р = 0.001), 29.3% (π = 3.3, р = 0.009) и 41.6% (π = 2.5, р = 0.032); на более высоком уровне статистически значимая структура данных не наблюдалась (рис. 8).
Рис. 8.
Результаты кластерного анализа проб РТАКСА в районе работ в 79 и 87 рейсе НИС “Академик Мстислав Келдыш” летом 2020 и 2022 г. А, В, С, D− значимые (р = 0.05) группы проб, установленные с помощью теста SIMPROF. (A – бассейн Пауэлла и воды над желобами и подводными поднятиямим, окаймляющими его северную часть, B – пролив Брансфилда и сопредельные воды в зоне влияния течения Брансфилда, C – Антарктический пролив, D – шельфовые воды в западной части Бассейна Пауэлла.
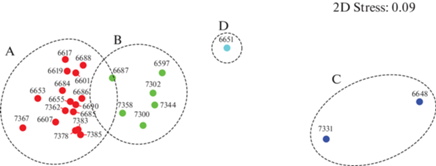
Графически все выделенные группы на MDS-диаграмме представлены в виде облака точек, или отдельных точек, которые, тем не менее, хорошо обособленны друг от друга (рис. 9).
Рис. 9.
MDS-диаграмма с результатами ординации станций на основе видового состава и численности глубоководных рыб, пойманных РТАКСА районе работ в 79 и 87 рейсе НИС “Академик Мстислав Келдыш” летом 2020 и 2022 гг.: овалами обозначены основные ихтиоцены мезо- и батипелагиали, выделяемые на уровне сходства 10%; 2D-стресс − 0.1; ост. обозначения см. на рис. 8.
Пробы группы A охватывали подавляющее большинство ихтиологических сборов, выполненных летом 2020 и 2022 гг. в глубоководных районах бассейна Пауэлла моря Уэдделла, а также над желобами и подводными поднятиями, окаймляющими с северо-запада и северо-востока данный бассейн. Материалы были собраны на 17 станциях на горизонтах от 634–0 (ст. 6687) до 2212–0 м (ст. 6617). Всего в пелагиали здесь было поймано 718 экз.емпляров молоди и взрослых рыб, принадлежавших к 12 видам из 6 семейств. Наибольшее число таксонов было зафиксировано в составе мезопелагического семейства Myctophidae, где на полигоне было отмечено в общей сложности 7 видов (Electrona antarctica, Gymnoscopelus braueri, G. opisthopterus, G. nicholsi, Krefftichthys andersoni, Protomyctophum bolini и P. choriodon) (рис. 10), или 58% от общего числа пойманных видов. Каждое из 5 прочих семейств, отмеченных в глубоководных частях бассейна Пауэлла и прилегающих водах (Bathylagidae, Gonostomatidae, Scopelarchidae, Paralepididae, Macrouridae) были представлены в сборах лишь одним видом (см. табл. 2). Величины уловов на станциях в районе бассейна Пауэлла и окаймляющих его северную часть глубоководных желобов и подводных поднятий варьировали от 41.8 (ст. 7362) до 123.5 (ст. 7385) экз./100 м2 (рис. 11). Все результативные траления были выполнены ловами от 634–0 до 2143–0 м. При этом необходимо отметить, что в уловах 2-х мелководных тралений, выполненных на глубинах 305–0 (ст. 6601) и 120–0 м (ст. 6614) (см. табл. 1) молодь и взрослые рыбы отсутствовали вообще. Численность глубоководных рыб, пойманных на станциях в центральной глубоководной котловине бассейна Пауэлла, а также вблизи западного и восточного ее склонов (ст. 6607, 6617, 6619, 6653, 6655, 7362, 7367) составила 41.8–84.4 (в среднем 63.5) экз./100 м2, тогда как в траловых уловах на станциях, расположенных в северной части круговорота Уэдделла, над глубоководными желобами и подводными поднятиями (ст. 6601, 6684, 6685, 6686, 6687, 6688, 6690, 7378, 7383, 7385) их численность была заметно выше и варьировала между 49.4 и 123.5 экз./100 м2, в среднем составив 84.1 экз./100 м2. Данные 2022 г. по биомассе глубоководных рыб из уловов РТАКСА в бассейна Пауэлла и сопредельных вод показали ее варьирование на полигоне между 369.3 (ст. 7378) и 942.1 (ст. 7383) г/100 м2 (в среднем она была равна 684.7 г/100 м2). Существенных различий в значениях биомассы глубоководных рыб в различных частях данного полигона обнаружено не было. Наиболее многочисленными в уловах были два мезопелагических вида – Electrona antarctica (Myctophidae) и Bathylagus аntarcticus (Bathylagidae) (рис. 12). Суммарная доля первого и второго вида в уловах РТАКСА летом 2020 и 2022 составляла по численности около 55%, а по биомассе – 53%. Данные виды были встречены практически на всех выполненных станциях, за исключением самых мелководных и/или расположенных в прибрежной шельфовой зоне и имели схожий характер распределения по исследованной акватории.
Рис. 10.
Соотношение доминирующих по численности таксонов пелагических рыб в уловах РТАКСА районе работ в 79 и 87 рейсе НИС “Академик Мстислав Келдыш” летом 2020 и 2022 г., в выделенных на основе кластерного анализа группах проб из различных районов исследованной акватории. Обозначения районов как на рис. 11. (1 – Bathylagus antarcticus; 2 – Electrona antarctica; 3 – Notolepis coatsorum; 4 – Gymnoscopelus braueri; 5 – G. opisthopterus; 6 – Pleuragramma antarctica; 7 – Cyclothone microdon; 8 – Champsocephalus gunnari; 9 – Прочие).
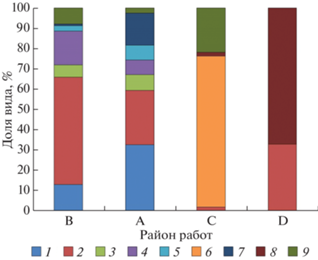
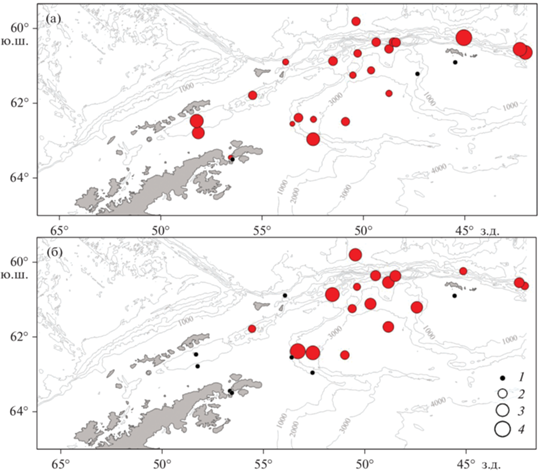
Рис. 11.
Распределение общей численности пелагических рыб по результатам ловов РТАКСА на разных
полигонах работ в 79 и 87 рейсе НИС “Академик Мстислав Келдыш” (цветом показаны районы,
выделенные на основе кластерного анализа видового состава улов:  – A,
– A,  – B,
– B,  – C,
– C,  – D, цифры – численность: 1 – 10 экз./100 м2, 2 – 50 экз./100 м2, 3 – 100 экз./100 м2).
– D, цифры – численность: 1 – 10 экз./100 м2, 2 – 50 экз./100 м2, 3 – 100 экз./100 м2).
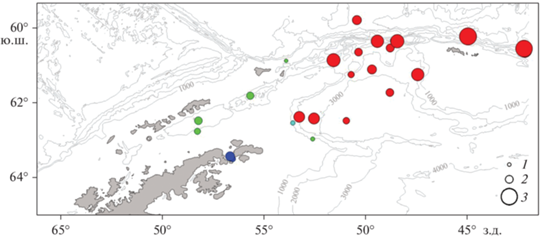
Рис. 12.
Распределение антарктической электроны Electrona antarctica (а) и батилага Bathylagus antarcticus (б). (1 – 0, 2 – 10, 3 – 20, 4 – 50 экз/100 м2).
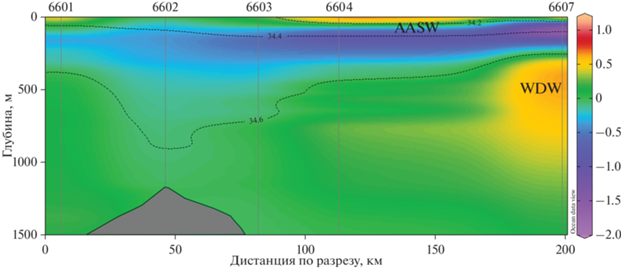
Группа B – включает в себя все станции из пролива Брансфилда и северо-западной части шельфа и склона Антарктического п-ова. Траловые работы в проливе Брансфилда и сопредельных водах были проведены летом 2020 и 2022 г. на 5 станциях, охватывающих глубины лова между 400–0 и 1160–0 м. Всего здесь было поймано 119 экз. рыб 10 видов из 4-х семейств. Наибольшим числом таксонов на полигоне были представлены светящиеся анчоусы (Myctophidae), к которым относились 6 видов, или 60% от общего числа видов в уловах, тогда как пойманные экземпляры всех прочих семейств принадлежали к 1 (Paralepididae, Bathylagidae) или 2 видам (Channichthyidae); их суммарная доля в уловах составляла на полигоне 40%. Величины уловов глубоководных рыб в районе пролива Брансфилда изменялись на разных станциях от 13.0 (ст. 6597) до 87.5 экз./100 м2 (ст. 7358) (см. рис. 11), причем на горизонтах траления 440–550–0 м численность рыб в уловах была несколько меньше нежели на более глубоководных горизонтах 1160–1000–0 м, составляя соответственно 13.0–33.8 (в среднем 21.4) и 46.2–87.5 (в среднем 66.9) экз./100 м2. Имеющиеся данные 2022 г. по биомассе глубоководных рыб из уловов РТАКСА на данном полигоне также показали схожие тенденции: в мелководных тралах, охватывающих горизонты 440–550–0 м, биомасса улова составляла 131.5–386.7 г/100 м2, а в глубоководных, облавливающих горизонты 1160–1000–0 м – 455.6–1703.0 г/100 м2. Наиболее часто встречающимися видами глубоководных рыб в траловых уловах группы B были два вида светящихся анчоусов – Electrona antarctica и Gymnoscopelus braueri, присутствовавшие на этом полигоне в каждой из отобранных проб. Численность этих видов составляла соответственно 8.2–35.2 (в среднем 22.0) и 1.6–7.5 (в среднем 4.4) экз./100 м2.
В группу C вошли траловые сборы 2020 и 2022 г., сделанные в Антарктическом проливе, отделяющем о-ва Жуэнвиль от северо-восточной оконечности Антарктического полуострова, на 2 станциях (ст. 6648 и 7331) с горизонтами траления 650–0 и 590–0 м. Видовой состав рыб в уловах был несколько беднее, нежели в проливе Брансфилда. Всего здесь было поймано 55 экз. молоди и взрослых рыб 7 видов из 5 семейств, причем собственно мезопелагические рыбы в уловах практически отсутствовали и были представлены лишь 1 экз. Electrona antarctica (Myctophidae). Все прочие рыбы из уловов (86%) относились к видам, эндемичным для антарктических вод, из семейств Bathydraconidae, Channichthyidae, и Nototheniidae, или высоко специализированным видам (сем. Liparidae), хорошо приспособленным к условиям существования при низких и даже отрицательных температурах. Уловы глубоководных рыб в Антарктическом проливе варьировали между 32.3 и 64.8 экз./100 м2, а биомасса на единственной станции, где были проведены измерения (ст.7331) равнялась 2120.6 г/100 м2. Доминирующее положение в уловах в Антарктическом проливе занимала антарктическая серебрянка – Pleuragramma antarcticum (Nototheniidae), доля которой по численности и биомассе составляла соответственно 72–79 и 78%.
В группу D выделилась единственная проба (ст. 6651), сделанная на относительно мелководном шельфе западной части бассейна Пауэлла на глубинах 505–0 м. Улов пойманных рыб в ней был очень скудным как по видовому составу, так и по численности. Всего на станции было поймано 9 экз. рыб, относящихся к 2 видам из 2 семейств: щуковидная белокровка Champsocephalus gunnari (Channichthyidae) и антарктическая электрона Electrona antarctica (Myctophidae). Причем лишь последний вид может быть отнесен к собственно мезопелагическим видам. Общая численность рыб в улове равнялась 14.3 экз./100 м2, из которых 67% приходилось на Champsocephalus gunnari. Изначально кажется, что рассматриваемая станция должна быть отнесена, скорее, к группе В (по местоположению, наличию миктофид и отсутствию циклотон и батилагов). Но малое число видов (всего 2) и доминирование щуковидной белокровки заставили алгоритм программы поместить ее в отдельный кластер, поддерживаемый статистически значимыми различиями.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты обработки наших материалов показывают, что пелагические ихтиоцены в водах к югу от южной границы Антарктического циркумполярного течения и фронта Скотия, разделяющих воды морей Скотия и Уэдделла, представляют собой довольно бедные по биоразнообразию, но зачастую многочисленные (за счет высокой численности и биомассы доминирующих видов) сообщества, как относительно мелководных, эндемичных для шельфа и склона Антарктиды представителей семейств Bathydraconidae, Channichthyidae, Liparidae, Nototheniidae, так и более глубоководных мезо- и батипелагических рыб, по большей части состоящих из видов сем. Mycthophidae, Bathylagidae, Gonostomatidae, Paralepididae и Scopelarchidae. Их местообитания, главным образом, были локализованы в толще вод над морскими желобами и глубоководными котловинами северной части моря Уэдделла. Полученные данные хорошо согласуются и с исследованиями пелагической антарктической ихтиофауны предыдущих авторов [9, 19, 42, 47]. Изучение таксономического состава, численности, а также характера горизонтального и вертикального распределения сообществ пелагических рыб на разных полигонах акватории, где выполнялись работы, на наш взгляд, показывает их тесную связь с гидрофизическими характеристиками и структурой водных масс, присутствующих на данных полигонах. Действительно, глубоководные сообщества мезо- и батипелагических рыб, отмеченные главным образом в центральной абиссальной котловине и окружающей периферии бассейна Пауэлла, а также отчасти в глубоководной части пролива Брансфилда, в летнее время, по-видимому, тесно связаны со слоем теплой (0–0.6°С, 34.6 psu) глубинной воды (WDW), занимающим горизонты примерно от 300 до 1500–1700 м. При этом максимальной своей численности мезо- батипелагические рыбы, видимо, достигают на горизонтах ниже 400 м; в вышележащих горизонтах присутствуют лишь личиночные их стадии, а молодь и половозрелые экз.емпляры, судя по нашим данным, здесь очень немногочисленны, или отсутствовали вообще. Естественным лимитирующим фактором окружающей среды в бассейне Пауэлла и глубоководных частях пролива Брансфилда, препятствующим проникновению мезо- и батипелагических рыб в более мелководные горизонты, служит наличие здесь переохлажденного, образующегося в результате зимней конвекции, вышележащего слоя вод толщиной 200–300 м, с отрицательной температурой –1.5…–2°С и относительно низкой соленостью 33.2–34.4 psu. Глубоководные рыбы, возможно, избегают вод с подобными характеристиками, и/или заносятся в них лишь случайным образом. В верхнем слое толщиной 20–100 м, занимаемом теплой и относительно распресненной Антарктической поверхностной водой (AASW), образующейся при летнем нагреве, присутствуют лишь немногочисленные личинки мезопелагических рыб, главным образом сем. Paralepididae [1]. По мере продвижения в пределах бассейна Пауэлла с юга на север в район хребта Саут-Скотия и глубоководных желобов, служащих естественной границей, разделяющей воды морей Уэдделла и Скотия, видовой состав и численность глубоководных сообществ рыб становится несколько выше. На станциях вблизи северной границы бассейна Пауэлла число пойманных видов и средняя численность мезо- батипелагических рыб оказались выше, чем на станциях над его центральной частью, западным и восточным склонами (соответственно в среднем 11, против 7 видов и 63.5, против 84.1 экз./100 м2). Кроме того, на станциях в центральной части бассейна в уловах заметно доминировал Bathylagus antarcticus (в среднем 40 против 24% от всего числа рыб в улове, или 28.8, против 20.2 экз./100 м2), а численность Electrona antarctica, напротив, была заметно меньше (в среднем 25, против 33% или 12.9, против 27.4 экз./100 м2). В сборах на склонах и в центральной части бассейна Пауэлла также отсутствовали такие виды мезо- батипелагических рыб, как Gymnoscopelus nicholsi, Krefftichthys andersoni, Protomyctophum choriodon, Protomyctophum bolini и Benthalbella elongata. Согласно полученным ранее данным, наибольшие величины первичной продукции, биомассы и видового состава, фито- и зоопланктона наблюдались на северной периферии бассейна Пауэлла, а минимальные – в области его абиссальной котловины. Высокая численность и разнообразие сообществ зоопланктона в этом районе, превосходящая таковую в других исследованных районах в 5–10 раз, свидетельствует о том, что эта акватория служит важной областью для нагула различных антарктических планктоноядных видов – от рыб до китов [1]. Повышенное биоразнообразие сообществ глубоководных рыб вдоль северной границы моря Уэдделла может быть также обусловлено и тем, что лишь меньшая часть мезо- и батипелагических видов рыб, таких, как например, Electrona antarctica, Bathylagus antarcticus, Notolepis coatsorum полностью проходит в море Уэдделла свой жизненный цикл, тогда как большинство из отмеченных здесь видов существуют только как экспатрианты в антарктические воды, которые для них, в этом случае, можно рассматривать, как зону стерильного выноса, где взрослые особи не могут провести икрометание, а икра и личинки пройти процесс развития и метаморфоза [9, 11, 37, 39]. Подобные виды обычно не достигают высокой численности, поскольку подпитка местной популяции осуществляется лишь за счет внесения извне молоди или половозрелых особей. По мере приближения к границам, разделяющим воды различного генезиса, число подобных видов-экспатриантов должно увеличиваться, а их роль в экосистеме возрастать. Судя по результатам наших исследований, рыбные сообщества, отмеченные в Антарктическом проливе и на относительно мелководном шельфе Антарктического п-ова, по своему таксономическому составу и численности кардинально отличаются от таковых из более глубоководных областей исследованной акватории. Они, по-видимому, также определяются гидрофизическими параметрами среды и структурой водных масс, занимающих эти области моря. На наш взгляд, наличие в данных районах в летний период южного полушария переохлажденных вод с отрицательными температурами (–1.5…–2°С) и относительно низкой соленостью (33.2–34.4 psu), занимающих практически все пространство от поверхности до дна, главным образом, и служит причиной преобладания в пелагиали тех видов, которые в процессе эволюции антарктической ихтиофауны выработали адаптивные приспособления к подобным условиям существования. Это, прежде всего, различные виды белокровных щук (Channichthyidae), антарктических плосконосов (Bathydraconidae), нототений (Nototheniidae) и морских слизней (Liparidae). Некоторые виды из этих семейств, например, антарктическая серебрянка Pleuragramma antarcticum, могут занимать в ихтиоценах доминирующее положение и достигать в уловах относительно высокой численности [33], в то время, как более глубоководные представители “истинно” мезопелагической ихтиофауны появляются в них лишь спорадически, в виде единичных экземпляров.
ВЫВОДЫ
1. В летний период 2020 и 2022 гг. в проливе Брансфилда, Антарктическом проливе, а также в шельфовых и глубоководных частях бассейна Пауэлла, были отмечено 19 видов молоди и взрослых пелагических рыб, относящихся к 10 семействам.
2. Анализ численности и биоразнообразия глубоководной пелагической ихтиофауны, позволили выявить на изученной акватории 4 основных ихтиоцена (А, B, C и D), поддерживаемые статистически значимыми различиями и приуроченные соответственно к глубоководным районам бассейна Пауэлла, проливу Брансфилда и северо-западной части шельфа и склона Антарктического п-ова, к Антарктическому проливу, а также к глубоководному шельфу западной части бассейна Пауэлла.
3. Глубоководные пелагические ихтиоцены в водах к югу от южной границы Антарктического циркумполярного течения и фронта Скотия, представляют собой довольно бедные по биоразнообразию, но зачастую многочисленные (за счет высокой численности и биомассы доминирующих видов) сообщества, как относительно мелководных, эндемичных для шельфа и склона Антарктиды представителей семейств Bathydraconidae, Channichthyidae, Liparidae, Nototheniidae, так и более глубоководных мезо- и батипелагических рыб, по большей части состоящих из видов сем. Mycthophidae, Bathylagidae, Gonostomatidae, Paralepididae и Scopelarchidae.
4. Изучение таксономического состава, численности, а также характера горизонтального и вертикального распределения выделенных сообществ пелагических рыб на разных полигонах акватории, где выполнялись работы, показало их тесную связь с гидрофизическими характеристиками и структурой водных масс, присутствующих на данных полигонах.
Источник финансирования. Работа выполнена в рамках государственного задания № FMWE-2022-0001.
Список литературы
Морозов Е.Г., Фрей Д.И., Полухин А.А. и др. Мезомасштабная изменчивость океана в северной части моря Уэдделла // Океанология. 2020. Т. 60. № 5. С. 663–679. https://doi.org/10.31857/S0030157420050184
Морозов Е.Г., Спиридонов В.А., Молодцова Т.Н. и др. Исследования экосистемы атлантического сектора Антарктики (79-й рейс НИС “Академик Мстислав Келдыш”) // Океанология. 2020. Т. 60. № 5. С. 823–825. https://doi.org/10.31857/S0030157420050172
Anderson M.E. The Origin and Evolution of the Antarctic Ichthyofauna // Fishes of the Southern Ocean. Grahamstown: J.L.B. Smith Institute of Ichthyology. Gon O., Heemstra P.C. (eds.). 1990. P. 28–33.
Andriashev A.P. A general review of the Antarctic fish fauna // Biogeography and ecology of Antarctica. The Hague: Junk Publisher. 1965. P. 491–550.
Carmack E.C., Foster T.D. On the flow of water out of the Weddell Sea // Deep-Sea Res. 1975. V. 22. P. 711–724. https://doi.org/10.1016/0011-7471(75)90077-7
Catalán I.A., Morales-Nin B., Company J.B. et al. Environmental influences on zooplankton and micronekton distribution in the Bransfield Strait and adjacent waters //Polar Biology. 2008. V. 31. P. 691–707. https://doi.org/10.1007/s00300-008-0408-1
Chunlin L., Chi Z., Yang L. et al. Age and growth of Antarctic deep-sea smelt (Bathylagus antarcticus), an important mesopelagic fish in the Southern Ocean // Deep-Sea Res. Part II. 2022. V. 201. P. 1–11. https://doi.org/10.1016/j.dsr2.2022.105122
Clarke K.R., Warwick R.M. 2005. Primer-6 computer program // Natural Environment Research Council. Plymouth. 2005. (http://refhub.elsevier.com/S0079-6611(16)30145-8/h0110 01/11/2020).
Collins M.A., Stowasser G., Fielding S. et al. Latitudinal and bathymetric patterns in the distribution and abundance of mesopelagic fish in the Scotia Sea // Deep-Sea Res. Part II. 2012. V.59. P. 189–198. https://doi.org/10.1016/j.dsr2.2011.07.003
De Broyer C., Koubbi P., Griffths H.J. et al. (eds.), Biogeographic Atlas of the Southern Ocean. Scientifc Committee on Antarctic Research, Cambridge 2014.XII + 498 pp.
Dewitt H.H., Heemstra P.C., Gon O. Nototheniidae // Fishes of the Southern Ocean. Grahamstown: J.L.B. Smith Institute of Ichthyology. Gon O., Heemstra P.C. (eds.). 1990. P. 279–331.
Donnelly J., Sutton T.T., Torres J.J. Distribution and abundance of micronekton and macrozooplankton in the NW Weddell Sea: relation to a spring ice-edge bloom // Polar Biol. 2006. V. 29. P. 280–293. https://doi.org/10.1007/s00300-005-0051-z
Donnelly J., Torres J.J. Pelagic fishes in the Marguerite Bay region of the West Antarctic Peninsula continental shelf // Deep-Sea Res. Part II. 2008. V. 55. P. 523–539. https://doi.org/10.1016/j.dsr2.2007.11.015
Eastman J. T. The nature of the diversity of Antarctic fishes // Polar Biol. 2005. V. 28. P. 93–107. https://doi.org/10.1007/s00300-004-0667-4
Gjøsaeter J., Kawaguchi K. A review of the world resources of mesopelagic fish // FAO Fish. Tech. Pap. 1980. № 193. 151 p.
Greely T.M., Gartner Jr J.V., Torres J.J. Age and growth of Electrona antarctica (Pisces: Myctophidae) the dominant mesopelagic fish of the Southern Ocean // Marine Biol. 1999. V. 133. P. 145–158.https://doi.org/10.1007/s002270050453
Hempel G. Antarctic marine food webs // Antarctic Nutrient Cycles. Berlin: Springer. 1985. P. 266–276.
Hopkins T.L., Torres J.J. Midwater food web in the vicinity of a marginal ice zone in the western Weddell Sea // Deep Sea Res. Part A. Oceanographic Research Papers. 1989. V. 36. Is. 4. P. 543–560. https://doi.org/10.1016/0198-0149(89)90005-8
Hulley P.A. Results of the research cruises of FRV “Walther Herwig” to South America. 58. Family Myctophidae (Osteichthyes, Myctophiformes) // Arch. Fischereiwiss. 1981. V. 31. P. 1–300.
Huneke W.G., Huhn O., Schroeder M. Water masses in the Bransfield Strait and adjacent seas, austral summer 2013 // Polar Biol. 2016. V. 39. P. 789–798. https://doi.org/10.1007/s00300-016-1936-8
Jones C.D., Koubbi P., Catalano B. et al. Mesopelagic and larval fish survey // NOAA Technical Memorandum NMFS SWFSC. 2014. V. 524. P. 28–40.
Kennett J.P. Paleoceanographic and biogeographic evolution of the Southern Ocean during the Cenozoic, and Cenozoic microfossil datums // Palaeogeogr., Palaeoclimatol., Palaeoecol. 1980. V. 31. P. 123–152. https://doi.org/10.1016/0031-0182(80)90017-6
Kellermann A., Kock K. H. Patterns of spatial and temporal distribution and their variation in early life stages of Antarctic fish in the Antarctic Peninsula region // In: Antarctic Ocean and resources variability. Springer Berlin Heidelberg. 1988. P. 147–159.
Kellermann A., Schadwinkel S. Winter aspects of the ichthyoplankton community in Antarctic Peninsula waters //Polar Biol. 1991. V. 11. P. 117–127.
Kock K.H. Antarctic fish. Key environments // Oxford: Pergamon Press. 1985. P. 173–192.
Kock, K. H. Antarctic fish and fisheries // Cambridge University Press. 1992. 359 p.
Krechik V.A., Frey D.I., Morozov E.G. Peculiarities of water circulation in the central part of the Bransfield Strait in January 2020 // Doklady Earth Sciences. 2021. V. 496. Pt. 1. P. 92–95. https://doi.org/10.1134/S1028334X21010116
Kruskal J.B. Wish M. Multidimensional scaling (Quantitative Application in the Social Sciences). Beverly Hills: Sage Univ. Press. 1978. 96 p.
Lancraft T.M., Torres J.J., Hopkins T.L. Micronekton and macrozooplankton in the open waters near Antarctic Ice Edge Zones (AMERIEZ 1983 and 1986) // Polar Biology. 1989. V. 9, № 4. P. 225–233. https://doi.org/10.1007/BF00263770
Lancraft T.M., Hopkins T.L., Torres J., Donnelly J. Oceanic micronektonic/macrozooplanktonic community structure and feeding in ice covered Antarctic waters during the winter (AMERIEZ 1988) // Polar Biology. 1991. V. 11. P. 157–167. https://doi.org/10.1007/BF00240204
Morozov E. G., Krechik V. A., Frey D. I. et al. Frontal Zone Between Relatively Warm and Cold Waters in the Northern Weddell Sea // Antarctic Peninsula Region of the Southern Ocean. Springer Nature. 2021. P. 31–53. https://doi.org/10.1007/978-3-030-78927-5_3
Murphy E.J., Watkins J.L., Trathan P.N. et al. Spatial and temporal operation of the Scotia Sea ecosystem: a review of large-scale links in a krill centred food web // Phil. Trans. R. Soc. B. 2007. V. 362. P. 113–148. https://doi.org/10.1098/rstb.2006.1957
O'Driscolla R.L., Macaulaya G.J., Gauthier S. et al. Distribution, abundance and acoustic properties of Antarctic silverfish (Pleuragramma antarcticum) in the Ross Sea // Deep Sea Res. II. 2011. V.58. P. 181–195. https://doi.org/10.1016/j.dsr2.2010.05.018
Orsi A. H., Nowlin W. D., Whitworth III T. On the circulation and stratification of the Weddell Gyre // Deep-Sea Res. I. 1993. V. 40. P. 169–203. https://doi.org/10.1016/0967-0637(93)90060-G
Parker M. L., Fraser W. R., Ashford J. et al. Assemblages of micronektonic fishes and invertebrates in a gradient of regional warming along the Western Antarctic Peninsula // Journal of Marine Systems. 2015. V. 152. P. 18–41. https://doi.org/10.1016/j.jmarsys.2015.07.005
Piatkowski U., White M., Dimmler W. Micronekton of the Weddell Sea: distribution and abundance // Berichte zur Polarforschung. Alfred-Wegener-Institut für Polar-und Meeresforschung. 1990. S. 73–81.
Piatkowski U., Rodhouse P.G., White M.G. et al. Nekton community of the Scotia Sea as sampled by the RMT 25 during austral summer // Mar. Ecol. Prog. Ser. 1994. V. 112. P. 13–28. https://doi.org/10.3354/meps112013
Planetcаlc. Каталог онлайн калькуляторов. (https://planetcalc. Version 3.0.4170.0. 11/2022)
Pusch C., Hulley P.A., Kock K.H. Community structure and feeding ecology of mesopelagic fishes in the slope waters of King George Island (South Shetland Islands, Antarctica) // Deep-Sea Res. I. 2004. V. 51. P. 1685–1708.
Rembiszewski J.M., Krzeptowski M., T.B. Linkowski T.B. Fishes (Pisces) as by-catch in fisheries for krill Euphausia superba Dana (Euphausiacea, Crustacea) // Pol. Arch. Hydrobiol. 1978. V. 25. P. 677–693.
Romesburg H.C. 2004. Cluster analysis for researchers // Morrisville, NC: Lulu.com. (Reprint of 1984 edition, with minor revisions.). 334 p.
Saunders R.A., Collins M.A., Stowasser G., Tarling G.A. Southern Ocean mesopelagic fish communities in the Scotia Sea are sustained by mass immigration // Mar. Ecol. Prog. Ser. 2017. V.569. P. 173–185. https://doi.org/10.3354/meps12093
Skóra K. E., Sosiński J. Observations on the ichthyofauna distribution in the regions of the Scotia Sea and Antarctic Peninsula //Polish Polar Research. 1983. V. 4. № 1–4. P. 49–55.
Tokarczyk R. Classification of water masses in the Bransfield Strait and Southern part of the Drake Passage using a method of statistical multidimensional analysis // Polish Polar Research. 1987. V. 8. P. 333–336.
Vacchi M., Pisano E., Ghigliotti L. (eds.). The Antarctic silverfish: a keystone species in a changing ecosystem. Cham: Springer International Publishing. 2017. 314 p. https://doi.org/10.1007/978-3-319-55893-6
Wenneck T.de L., Falkenhaug T., Bergstad O.A. Strategies, methods, and technologies adopted on the R.V. G.O. Sars MAR-ECO expedition to the Mid- Atlantic Ridge in 2004 // Deep-Sea Res. II. 2008. V. 55. P. 6–28. https://doi.org/10.1016/j.dsr2.2007.09.017
White M.G., Piatkowski U. Abundance, horizontal and vertical distribution of fish in eastern Weddell Sea micronekton // Polar Biol. 1993. V. 13. P. 41–53. https://doi.org/10.1007/BF00236582
Wikipedia. Grtat-circle distance (https://en.wikipedia. org/w/index.php?title=Great-circle_dist.
Дополнительные материалы отсутствуют.