Онтогенез, 2019, T. 50, № 1, стр. 53-64
Регуляция активности апопластной инвертазы в камбиальной зоне карельской березы
Н. А. Галибина a, *, Л. Л. Новицкая a, К. М. Никерова a, Ю. Л. Мощенская a, М. Н. Бородина a, И. Н. Софронова a
a Федеральный исследовательский центр “Карельский научный центр Российской академии наук”
Институт леса КарНЦ РАН
185910 Республика Карелия, Петрозаводск, Пушкинская ул., д. 11, Россия
* E-mail: galibina@krc.karelia.ru
Поступила в редакцию 11.07.2018
После доработки 27.09.2018
Принята к публикации 11.07.2018
Аннотация
Установлено, что в период камбиального роста регуляция активности апопластной инвертазы (АпИнв) у карельской березы (Betula pendula var. carelica) осуществляется на уровне экспрессии кодирующих ее генов. У безузорчатых растений карельской березы содержание транскриптов генов CWIN1, CWIN1.1, CWIN4 в ксилеме меньше, по сравнению с узорчатыми растениями. Регуляция активности АпИнв у обычной березы (B. pendula var. pendula) происходит в основном на посттрансляционном уровне через белковые ингибиторы (CIF, cell-wall inhibitor of β-fructosidase). В тканях ствола обычной березы уровень экспрессии генов, кодирующих АпИнв, примерно такой же, как у карельской березы, но увеличено количество транскриптов гена Cif, экспрессия которого возрастает при снижении концентрации сахарозы в апопласте. Высокая активность АпИнв у карельской березы поддерживает акцепторную силу камбиальной зоны, а образующиеся при этом в большом количестве гексозы интенсивно расходуются на синтез запасного метаболита – крахмала. Увеличение узорчатости древесины коррелирует с возрастанием метаболизации сахарозы по апопластному пути. В стволе узорчатых растений в период камбиального роста изменение соотношения активностей сахарозосинтазы и АпИнв в сторону последней наблюдаются локально, только в местах аномалий.
ВВЕДЕНИЕ
Карельская береза (B. pendula Roth var. carelica (Mercl.) Hämet-Ahti), форма березы повислой, представляет собой уникальный объект исследования для познания механизмов морфогенеза древесных растений. Из всех древесных пород структурные аномалии древесины выражены у карельской березы наиболее ярко, характеризуются большим разнообразием проявления в онтогенезе и высоким уровнем эндогенной изменчивости; их появление, развитие и затухание зависят от воздействия факторов среды (Новицкая, 2008; Novitskaya et al., 2016). Оригинальная текстура древесины карельской березы формируется в результате отклонений в деятельности латеральной меристемы – камбия (Барильская, 1978; Коровин и др., 2003; Новицкая, 2008; Novitskaya, Kushnir, 2006). В зонах развития структурных аномалий не запускается программа гибели клеток, приводящая к формированию сосудов и волокон ксилемы и ситовидных элементов флоэмы, дифференцирующиеся камбиальные производные сохраняют протопласт и превращаются в клетки запасающей паренхимы, которые накапливают большие количества запасных веществ (Novitskaya, Kushnir, 2006).
В результате предыдущих исследований выявлены пути утилизации основного субстрата для синтеза элементов древесины – сахарозы – при нормальном и аномальном ксилогенезе березы повислой (Галибина и др., 2015а, 2015б, 2016; Мощенская и др., 2016, 2017). При типичном для Betula pendula строении тканей ствола (“норма”) в период активного камбиального роста утилизация сахарозы в растущих и дифференцирующихся клетках ксилемы идет преимущественно с участием сахарозосинтазы (СС) (Галибина и др., 2015а, 2016; Мощенская и др., 2017). В результате сахарозосинтазного расщепления сахарозы образуется УДФ-глюкоза, играющая важную роль в синтезе полимерных компонентов клеточных стенок (Sturm, Tang, 1999; Winter, Huber, 2000; Ruan et al., 2003; Tuskan et al., 2006; An et al., 2014; Gerber et al., 2014). В аномальных по строению тканях ствола карельской березы активность СС в ксилеме понижена, в то же время имеет место высокая активность апопластной инвертазы (АпИнв) в ксилеме и, особенно, во флоэме (Галибина и др., 2015б, 2016), что ведет к усиленной генерации в них гексоз.
С одной стороны, высокая АпИнв в течение длительного времени смещает соотношение гексозы/сахароза в сторону накопления гексоз и, тем самым, способствует индукции клеточных делений (Cheng et al., 1999; Koch, Zeng, 2002; Koch, 2004; Roitsch, Gonzalez, 2004). В данной связи, можно предположить, что высокая активность АпИнв у узорчатых растений, возможно, является причиной увеличения числа клеток в зоне проводящей флоэмы (Барильская, 1978; Новицкая, 2008). С другой стороны, увеличение активности АпИнв может, в свою очередь, повышать акцепторную силу флоэмы и способствовать еще большему притоку сахарозы в зону аномалий. Известно, что сверхэкспрессия инвертазы клеточной стенки в листьях приводит к подавлению в них донорной функции и переходу листьев в состояние акцепторов ассимилятов (Stitt, Sonnewald, 1995).
Возникает вопрос, что может быть причиной изменения пути метаболизации сахарозы, а именно, перехода от преимущественного ее расщепления с участием СС на преимущественное расщепление АпИнв? На двух формах березы повислой было показано, что регуляция активности СС в камбиальной зоне осуществляется на уровне экспрессии кодирующих ее генов. Высокая активность СС в ксилеме обычной березы поддерживается за счет изоформы SuSy1, о чем свидетельствует высокая транскрипционная активность кодирующего ее гена Sus1 (Мощенская и др., 2017). Усиление паренхиматизации ксилемы у узорчатых растений карельской березы приводит к резкому снижению активности СС в этой ткани (Галибина и др., 2015а, 2016; Мощенская и др., 2017), вследствие снижения уровня транскрипции генов Sus1, Sus2, Sus3 (Мощенская и др., 2017).
Экспрессия генов, кодирующих АпИнв, ткане- и органоспецифична, зависит от стадии развития растения (Lorenz et al., 1995; Sturm et al., 1995; Weber et al., 1995; Davies, Robinson, 1996), присутствия сахаров (Roitsch et al., 1995; Xu et al., 1995), возбудителей инфекций и ранений (Sturm, Chrispeels, 1990), а также воздействия низких температур (Zhou et al., 1994). Белок АпИнв является устойчивым благодаря гликозилированию (Rausch, Greiner 2004; Ruan et al., 2010; Ruan, 2014), в связи с чем быстрая регуляция активности АпИнв осуществляется на посттрансляционном уровне через белковые ингибиторы (CIF, cell-wall inhibitor of β‑fructosidase) (Rausch, Greiner, 2004; Bocock et al., 2008; Ruan, 2014; Wang et al., 2014). CIF – это низкомолекулярные белки (меньше 20 кДа), которые связываются непосредственно с активным сайтом инвертазы, конкурируя, тем самым, с сахарозой (Hothorn et al., 2010). Ингибиторы АпИнв достаточно хорошо изучены в растениях табака (Greiner et al., 1998), кукурузы (Bate et al., 2004), томатов (Qin et al., 2016), картофеля (Liu et al., 2010), сои (Tang et al., 2017) и Arabidopsis (Su et al., 2016). Показано, что уровень экспрессии кодирующих их генов зависит от количества сахарозы в апопласте: появление избытка дисахарида снижает уровень экспрессии генов Cif, приводя к возрастанию активности АпИнв (Ruan, 2014).
Несмотря на большое количество работ, посвященных исследованию разных форм инвертазы, сведений о регуляции активности АпИнв в процессе ксилогенеза практически нет. В этой связи, в задачи нашего исследования входило изучение регуляции активности АпИнв на транскрипционном и посттрансляционном уровнях в камбиальной зоне у двух форм березы повислой при разных сценариях ксилогенеза (формирование типичной для вида прямослойной древесины со слабо выраженной текстурой у обычной березы и изменение программы развития производных камбия у карельской березы, а именно, дифференцировка клеток паренхимы вместо волокон и сосудов ксилемы и ситовидных трубок флоэмы).
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал
Основными объектами исследования были две формы березы повислой разного возраста: обычная береза повислая (далее обычная береза) – Betula pendula Roth var. pendula и карельская береза – B. pendula var. carelica (Mercl.) Hämet-Ahti.
25-летние растения B. pendula var. carelica с разной степенью узорчатости древесины ствола. Растения карельской березы произрастали в лесных культурах на территории Республики Карелия. Возраст деревьев на момент отбора материала составлял 25 лет. Все растения были выращены из сеянцев, полученных из семян от контролируемого опыления плюсовых деревьев карельской березы. Узорчатые особи карельской березы на исследуемых участках обладали высоким уровнем индивидуальной изменчивости по расположению и плотности рисунка на стволе. Поэтому все растения были поделены на группы по степени проявления узорчатости, согласно способу диагностики узорчатой текстуры древесины (Галибина и др., 2016). Каждой группе растений был присвоен балл от 0 до 3. К первой группе (0 баллов) отнесли растения, не имеющие углублений на поверхности древесины (деревья с прямослойной древесиной), ко второй (1 балл) – имеющие 1–3 углубления на 1 см2 (редкий рисунок), в третью группу (2 балла) попали растения с 4–6 углублениями на 1 см2 (плотный рисунок) и в четвертую (3 балла) особи с 7 и более углублениями на 1 см2 (очень плотный рисунок). Число растений в 1–4 группе составило 10, 7, 7 и 6 соответственно. Отбор образцов проводили в период активного камбиального роста (начало июля 2017 г.).
11-летние растения B. pendula var. pendula и B. pendula var. carelica. Посадки растений созданы на Биологической станции Карельского научного центра РАН. Растения выращены из семян, полученных от контролируемого опыления (Forelia OY, Финляндия). Среди опытных деревьев карельской березы подбирали экземпляры с высокой степенью узорчатости древесины. Отбор образцов проводили в период активного функционирования камбия (начало июля 2016 г.). Образцы для анализа отбирали с: 1) деревьев обычной березы, 2) безузорчатой части ствола узорчатых деревьев карельской березы, 3) узорчатой части ствола тех же деревьев. В каждой группе было по пять растений.
Отбор образцов
Образцы тканей ствола для биохимического анализа брали на высоте 1.3 м от земли. У карельской березы выбирали участки с наибольшей степенью проявления структурных аномалий. На стволе березы вырезали окошки 4 × 6 см и отделяли кору от древесины. С обнаженной поверхности древесины бритвенным лезвием соскабливали ткани ксилемы, куда входили материнские клетки ксилемы и наружные слои прироста ксилемы текущего года. С внутренней поверхности коры препарировали комплекс тканей, включающий камбиальную зону, проводящую флоэму и самые внутренние слои непроводящей флоэмы. Отбор образцов тканей ствола контролировали под световым микроскопом. Весь растительный материал замораживали в жидком азоте и хранили в низкотемпературной морозильной камере при –80°C.
Биохимические исследования
Анализ активности ферментов. Для определения активности ферментов растительные ткани растирали в жидком азоте до однородной массы и гомогенизировали при 4°С в буфере следующего состава: 50 мМ Hepes (pH 7.5), 1 мМ ЭДТА, 1 мМ ЭГТА, 3 мМ DTT, 5 мМ MgCl2, 0.5 мМ PMSF. После 20-минутной экстракции гомогенат центрифугировали при 10000 g в течение 20 минут (центрифуга MPW-351R, Польша). Осадок троекратно промывали буфером. Осадок и объединенный супернатант диализовали при 4°С в течение 18–20 ч против буфера для гомогенизации, разбавленного в 10 раз. В осадке определяли активность АпИнв, в супернатанте – СС. Активности ферментов определяли после инкубации полученного препарата при 30°С в течение 30 мин.
Инкубационная среда для определения активности АпИнв содержала 100 мМ ацетатный буфер, рН 4.7, 25 мМ сахарозу. Количество образовавшейся в процессе инкубации глюкозы определяли глюкозооксидазным методом. Активность АпИнв выражали в мкмоль распавшейся сахарозы на г сырой ткани. Инкубационная среда для определения активности СС в сторону распада сахарозы содержала 70 мМ Hepes (рН 7.4), 5 мМ MgCl2, 1 мМ уридиндифосфат, 1 мМ пирофосфат, 1 мМ НАДФ, 50 мМ сахарозу, 1 U глюкозо-6-фосфатдегидрогеназы, 2 U фосфоглюкомутазы. Активность СС в направлении распада сахарозы определяли спектрофотометрически по восстановлению НАДФ при λ = 340 нм (спектрофотометр СФ-2000, “ОКБ Спектр”, Россия). Активность СС выражали в мкмоль распавшейся сахарозы на мг белка. Суммарное содержание белка в тканях определяли по методу Бредфорд.
Определение крахмала. Крахмал из тканей извлекали 56% хлорной кислотой по методу Пьючера. Содержание крахмала определяли глюкозооксидазным методом по количеству глюкозы, образовавшейся в результате кислотного гидролиза.
Определение целлюлозы. Целлюлозу выделяли по методу Кюршнера–Хоффера смесью концентрированной азотной кислоты и этилового спирта в соотношение 1 : 4 (по объему). Содержание целлюлозы определяли гравиметрическим методом.
Определение уровня экспрессии генов
Накопление транскриптов генов анализировали при помощи полимеразной цепной реакции (ПЦР) в режиме реального времени. Для анализа были выбраны гены, кодирующие изоформы АпИнв (CWIN 1, CWIN 1.1, CWIN 4), белковый ингибитор АпИнв (Cif).
Подбор праймеров. Специфические праймеры (Евроген, Россия) для амплификации участков исследуемых генов (табл. 1) конструировали с помощью программного обеспечения Primer Express Software (Applied Biosystems) на основе последовательностей генов (https://genomevolution.org/CoGe/ GenomeInfo.pl?gid=35079), идентифицированных для Betula pendula Roth (Salojärvi et al., 2017). Эффективность ПЦР для праймеров референсных и целевых генов определяли путем проведения ПЦР с последовательными разбавлениями исследуемого образца кДНК (Ребриков и др., 2011). Специфичность полученных продуктов ПЦР была оценена с помощью кривых плавления. В качестве референсного гена для расчета относительной экспрессии использовали ген актина (табл. 1). Для оценки пригодности данного транскрипта в качестве референсного определяли стабильность экспрессии гена при помощи прикладной программы для Microsoft Excel – BestKeeper (Pfaffl et al., 2004).
Таблица 1.
Нуклеотидная последовательность праймеров для проведения ПЦР в режиме реального времени
| Ген | Прямой праймер (5' → 3') | Обратный праймер (5' → 3') | Локус (Salojärvi et al., 2017) |
|---|---|---|---|
| Actin | GGTGGTGAATGAGTAGCC | TTCTTTCCCTTTATGCC | Bpev01.c0427.g0027 |
| CWIN1 | TATCAGACTCAAGCACCCAG | ATTACACGCCCAGAACAGAC | Bpev01.c0237.g0050 |
| CWIN1.1 | AGTGCCCCGATTTCTTCCCTG | GTCCACCTGCCCCTTGTCCG | Bpev01.c0333.g0031 |
| CWIN4 | GCTCTACCACAATCCTCCCA | GCACTCGCATTCATCCCCTC | Bpev01.c0516.g0006 |
| Cif | GCAAGCAGACACCCTTTTAT | GTTTAGTTTTGGGCTACCGT | Bpev01.c0932.g0004 |
Выделение тотальной РНК и синтез комплементарной ДНК. Процедуру выделения тотальной РНК (тРНК) проводили с помощью реагента Extract RNA (Евроген, Россия), согласно протоколу производителя. Комплементарную ДНК (кДНК) синтезировали, используя набор реактивов для обратной транскрипции MMLV RT kit (Евроген, Россия), содержащий обратную транскриптазу (MMLV ревертаза), случайные праймеры (Randoom (dN)10-primer) и 5× буфер для синтеза первой цепи кДНК (280 мМ Трис-HCl, pH 8.7; 375 мМ КСl; 30 мМ MgCl2). Количество и качество выделенной РНК и синтезированной кДНК проверяли спектрофотометрически с помощью прибора SmartSpecPlus (“Bio-Rad”, США).
ПЦР в режиме реального времени. Амплификацию образцов проводили в приборе iCycler с оптической приставкой iQ5 (“Bio-Rad”, США), используя наборы для амплификации с интеркалирующим красителем SYBR Green. Смесь для ПЦР объемом 25 мкл содержала 100 нг кДНК (2 мкл), 5 мкл реакционной смеси qPCRmix-HS SYBR (“Евроген”, Россия), прямой и обратный праймеры (конечная концентрация 0.4 мкМ) и 16 мкл деионизованной воды, свободной от нуклеаз. Протокол ПЦР: 5 мин при 95°С, далее 45 циклов 15 с при 95°С, 15 с при 48–60°С. Специфичность продуктов амплификации проверяли плавлением ПЦР-фрагментов: 30 с при 72°С, 1 мин при 95°С, 1 мин при 50°С.
Данные, полученные в результате ПЦР, анализировали при помощи программного инструмента Relative Expression Software Tool 2009 V.2.0.13 (REST 2009).
Эффективность ПЦР (Е) вычисляли по формуле (1):
где a – коэффициент уравнения зависимости порогового цикла (Сt) от логарифма исходной концентрации ДНК-матриц. ПЦР для референсного и целевых генов протекала со сходной эффективностью, примерно равной 2.Относительный уровень транскриптов генов (RQ) вычисляли по формуле (2):
где ΔCt – разница значений пороговых циклов для референсного и целевого генов, 2 – эффективность ПЦР. Уровень экспрессии специфичных генов выражали в относительных единицах (отн. ед.), нормализованных к уровню экспрессии референсного гена.Статистическая обработка
Статистическая обработка данных проводилась в среде StatGraphics для Windows и PAST. Данные на диаграммах представлены в виде средних значений и стандартных ошибок. Различия в распределении показателей между группами растений определяли двухвыборочным t-тест с различными дисперсиями. Для оценки наличия связи между степенью узорчатости и активностью ферментов был использован коэффициент ранговой корреляции Спирмена (ρ). Статистически значимыми считали различия при р < 0.05.
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Метаболизация сахарозы в ксилеме 25-летних растений карельской березы, произрастающих в лесных культурах
У безузорчатых растений карельской березы (0 баллов) утилизация сахарозы в ксилеме происходила преимущественно по сахарозосинтазному пути (активность СС 1.9 мкмоль сахарозы/мг белка), при этом активность АпИнв не превышала 0.4 мкмоль сахарозы/г сырой ткани (рис. 1а, 1б). С увеличением степени узорчатости древесины активность СС в зоне формирования ксилемы снижалась (1.2, 1.2 и 0.8 мкмоль сахарозы/мг белка у растений со степенью узора 1, 2 и 3 балла соответственно) (рис. 1а). На фоне снижения активности СС повышалась активность АпИнв в ксилеме (1.0, 1.3 и 1.8 мкмоль сахарозы/г ткани у растений со степенью узора 1, 2 и 3 балла соответственно) (рис. 1б).
Рис. 1.
Активность сахарозосинтазы, СС (а), апопластной инвертазы, АпИнв (б), содержание крахмала (в) и целлюлозы (г) в ксилеме 25-летних деревьев карельской березы с разной степенью узорчатости древесины (от 0 до 3 баллов), произрастающих на лесосеменной плантации. По оси абсцисс – степень узорчатости древесины (баллы). Представлены средние значения десяти (0 баллов), семи (1, 2 балла) и шести (3 балла) повторностей и их стандартные ошибки. Различия значимы при p < 0.05.
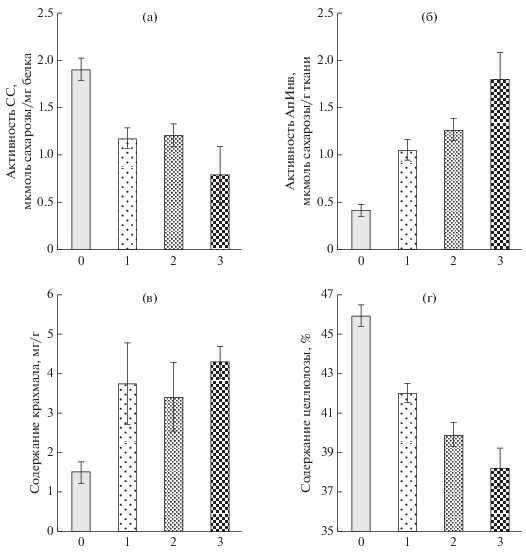
Корреляция между баллом узорчатости и активностью ферментов метаболизации сахарозы была обнаружена только для АпИнв (ρ = 0.97, при p < 0.05). Активность СС была выше у безузорчатых растений, по сравнению с узорчатыми. Существенных отличий между растениями с разной степенью узорчатости древесины по активности СС не обнаружено.
В ксилеме узорчатых растений возрастало содержание запасного полисахарида крахмала. Количество его изменялось от 1.5 мг/г у безузорчатых растений (0 баллов) до 3.7, 3.4 и 4.3 мг/г у растений со степенью узорчатости 1, 2 и 3 балла соответственно. Следует отметить, что достоверных отличий по содержанию крахмала между узорчатыми растениями обнаружено не было (рис. 1г).
Увеличение степени узорчатости древесины сопровождалось снижением содержания целлюлозы в формирующейся ксилеме с 45.9% у безузорчатых растений до 42.0, 39.9 и 38.2% у узорчатых растений со степенью узорчатости 1, 2 и 3 балла соответственно (рис. 1в).
Метаболизация сахарозы в камбиальной зоне узорчатых и безузорчатых участков одного ствола 11-летних растений карельской березы
В ксилеме обычной березы активность СС (1.2 мкмоль сахарозы/мг белка) была в 4 раза выше по сравнению с узорчатой частью ствола карельской березы (0.3 мкмоль сахарозы/мг белка) (рис. 2а). При этом активность АпИнв составила 1.1 мкмоль сахарозы/г сырой ткани, что в 1.6 раз ниже, по сравнению с узорчатой частью ствола карельской березы (1.8 мкмоль сахарозы/г сырой ткани) (рис. 2б).
Рис. 2.
Активность сахарозосинтазы (СС) в ксилеме (а), апопластной инвертазы (АпИнв) в ксилеме (б) и во флоэме (в), содержание крахмала (г) и целлюлозы (д) в ксилеме 11-летних растений обычной березы (1), безузорчатой (2) и узорчатой (3) частях ствола карельской березы. Представлены средние значения пяти повторностей и их стандартные ошибки. Различия значимы при p < 0.05.

В безузорчатой части ствола карельской березы утилизация сахарозы по СС-пути в ксилеме (1.5 мкмоль/мг белка) превосходила таковую не только в узорчатой части (в 5 раз), но и у обычной березы (в 1.3 раза) (рис. 2а). При этом активность АпИнв (0.9 и 16.1 мкмоль сахарозы/г сырой ткани в ксилеме и флоэме соответственно) достоверно не отличалась от таковой у обычной березы, что в 2 раза ниже, по сравнению с узорчатой частью ствола карельской березы (рис. 2б, 2в).
В ксилеме безузорчатой части ствола карельской березы происходило накопление крахмала, количество его (0.5 мг/г) было выше, чем у обычной березы (0.16 мг/г) и в узорчатой части ствола карельской березы (0.35 мг/г) (рис. 2г). Еще одна особенность безузорчатой части ствола узорчатых растений – это высокое содержание целлюлозы (42%), что значимо выше, по сравнению с обычной березой (41%) и узорчатой частью ствола карельской березы (38.4%) (рис. 2д).
Уровень экспрессии генов CWIN1, CWIN1.1, CWIN4 и Cif в тканях ствола у растений B. pendula в период камбиального роста
У безузорчатых 25-летних растений карельской березы содержание транскриптов генов CWIN1, CWIN1.1, CWIN4 в ксилеме составило 0.04, 0.03 и 0.01 отн. ед. соответственно. У узорчатых растений карельской березы уровень экспрессии генов, кодирующих АпИнв, в аномальных участках превышал таковой в нормальных тканях ксилемы безузорчатых растений в 4.5, 4.3 и 6 раз для CWIN1, CWIN1.1, CWIN4 соответственно. Между растениями с разной степенью узорчатости древесины не было обнаружено отличий по количеству транскриптов генов CWIN1, CWIN1.1, CWIN4 (рис. 3а).
Рис. 3.
Относительный уровень экспрессии генов, кодирующих апопластную инвертазу (CWIN1, CWIN1.1, CWIN4) и белковый ингибитор апопластной инвертазы (Cif) в ксилеме 25-летних деревьев карельской березы с разной степенью узорчатости древесины (от 0 до 3 баллов), произрастающих на лесосеменной плантации. 1 – безузорчатые растения карельской березы; 2 – растения карельской березы со степенью узорчатости 1 балл; 3 – растения карельской березы со степенью узорчатости 2 балла; 4 – растения карельской березы со степенью узорчатости 3 балла. Представлены средние значения десяти (0 баллов), семи (1, 2 балла) и шести (3 балла) повторностей и их стандартные ошибки. Различия значимы при p < 0.05.

Уровень экспрессии гена, кодирующего белковый ингибитор АпИнв (Cif), в камбиальной зоне и формирующейся ксилеме у 25-летних растений карельской березы был низким и не превышал 0.004 отн. ед. При этом, у узорчатых растений уровень экспрессии гена Cif был выше, по сравнению с безузорчатыми растениями (рис. 3б).
В период активного камбиального роста содержание транскрипта гена CWIN1 у 11-летних растений обычной березы составило 0.37 и 0.64 отн. ед. в ксилеме и флоэме соответственно (рис. 4а, 4в). Появление узорчатой древесины у карельской березы сопровождалось повышением количества транскрипта гена CWIN1 до 0.69 и 0.97 отн. ед. в ксилеме и флоэме соответственно (рис. 4а, 4в). В камбиальной зоне безузорчатой части ствола растений карельской березы содержание транскриптов гена CWIN1 было значительно меньше, как относительно узорчатой части того же дерева, так и по сравнению с обычной березой. В ксилеме уровень мРНК гена CWIN1 (0.08 отн. ед.) был в 8.6 раз ниже, чем в узорчатой части, и в 4.6 раз ниже, чем у обычной березы. Во флоэме уровень экспрессии CWIN1 (0.16 отн. ед.) – в 6 раз ниже, чем в узорчатой части, и в 4 раза ниже, чем у обычной березы (рис. 4а, 4в).
Рис. 4.
Относительный уровень экспрессии генов, кодирующих апопластную инвертазу (CWIN1) и белковый ингибитор апопластной инвертазы (Cif) в ксилеме (а, б) и во флоэме (в, г) 11-летних растений обычной березы (1), безузорчатой (2) и узорчатой (3) частях ствола карельской березы. Представлены средние значения пяти повторностей и их стандартные ошибки. Различия значимы при p < 0.05.
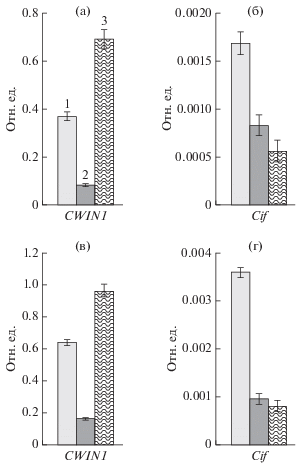
У 11-летних растений карельской березы уровень экспрессии гена, кодирующего белковый ингибитор АпИнв, в безузорчатой и узорчатой части ствола не отличался между собой. У обычной березы содержание транскриптов гена Cif было больше в ксилеме в 1.9 и 2.8 раза, а во флоэме в 4 раза, по сравнению с безузорчатой и узорчатой частью ствола карельской березы (рис. 4б, 4г).
ОБСУЖДЕНИЕ
Развитие ксилемы (особенно стадия отложения вторичной клеточной стенки) требует больших субстратных и энергетических затрат (Антонова, 1999). Транспорт сахарозы из проводящей флоэмы к камбиальной зоне возможен через апопластный и симпластный пути. В первом случае сахароза из ситовидных элементов флоэмы попадает в клеточную стенку, откуда благодаря переносчикам транспортируется в клетку. Во втором случае пассивная (без затрат энергии) разгрузка по градиенту концентрации происходит из ситовидных трубок через плазмодесмы прямо в эндоплазматические сети окружающих паренхимных клеток (Гамалей, 2004). При изучении механизмов дифференцировки клеток камбиальной зоны древесных растений важным вопросом является наличие или отсутствие плазмодесменных связей между клетками проводящей флоэмы и камбиальной зоны. Исследования, проведенные на сосне скрученной, показали, что в камбиальной зоне ни в веретеновидных инициалях, ни в радиальных стенках недифференцированных камбиальных клеток плазмодесменных связей и поровых полей не обнаружено. Авторы предполагают, что до начала роста растяжением, когда уже наблюдается появление поровых полей, в транспорте ассимилятов основная роль принадлежит апопласту (Barnett, Harris, 1975). Электронно-микроскопическое исследование камбиальной зоны березы повислой, проведенное Л.А. Барильской показало, что при отложении камбием клеток, преобразующихся в ходе последующей дифференциации в сосуды и волокна древесины, имеет место полная изоляция их протопластов уже в процессе формирования клеточной пластинки, поскольку плазмодесмы в них не закладываются. Вместе с тем при образовании будущих паренхимных клеток древесины заложение плазмодесм во время деления происходит, вследствие чего цитоплазматическая непрерывность в этих клетках сохраняется (Барильская, 1978). Таким образом, можно заключить, что в камбиальной зоне в транспорте ассимилятов между флоэмой и прозенхимными элементами ксилемы апопласту принадлежит основная роль. Обязательное участие апопластного пути в транспорте сахарозы на определенном этапе развития является общей особенностью большинства репродуктивных органов (Patrick, Offler, 2001; Jin et al., 2009; Ruan et al., 2010).
При поступлении сахарозы в апопласт в количестве, превосходящем производительность переносчиков, она дольше находится в контакте с АпИнв, в связи с чем большее ее количество метаболизируется. Проведенное исследование показало, что в период активного камбиального роста усиление расщепления сахарозы по апопластному пути возрастает с увеличением степени узорчатости растения (рис. 1б). При этом повышенная активность АпИнв у растений карельской березы наблюдается локально, в местах образования узора. Так, в узорчатых участках 11-летних растений карельской березы активность АпИнв была выше, не только по сравнению с растениями обычной березы, но и с безузорчатыми участками того же ствола (рис. 2б, 2в). Можно предположить, что при разных сценариях ксилогенеза прозенхимные ксилемные производные камбия получают ассимиляты в разной форме. При формировании аномальных тканей, в которых преобладают паренхимные клетки, сахароза в апопласте активно метаболизируется АпИнв (рис. 1б, 2б, 2в), и в клетку, в основном, поступают образующиеся гексозы. Последовательная ко-экспрессия генов, кодирующих АпИнв и транспортеры гексоз, наблюдается во многих системах (Roitsch, Gonzalez, 2004), включая образование фруктов (Hayes et al., 2007) и семян (Weber et al., 2005). Образующиеся гексозы являются субстратом для внутриклеточных синтезов, что коррелирует с накоплением в паренхимных клетках проводящей флоэмы узорчатых растений большого количества липидов, таннинов (Барильская, 1978; Novitskaya, Kushnir, 2006; Новицкая, 2008) и крахмала (рис. 1в, 2в). Таким образом, высокая активность инвертазы, очевидно, может приводить к усилению функции запасания через образование запасных веществ и дифференцировку клеток запасающей паренхимы.
Возрастание активности АпИнв и, как следствие, снижение поступления сахарозы в клетку может стать причиной снижения активности СС (рис. 1а, 2а). СС относится к ферментам, деятельность которых жестко обусловлена статусом углеводного обмена растения, в частности, метаболизма сахарозы. Метаболизация сахарозы по сахарозосинтазному пути происходит только в условиях высоких концентраций дисахарида, так Кm для сахарозы составляет 63.5 мМ, в то время как для УДФ, УДФ-глю и фруктозы – 0.45, 5.0 и 2.0 мМ соответственно (Курсанов и др., 1989). При меньшей концентрации сахарозы СС в клетке начинает работать в направлении синтеза дисахарида (Hardin et al., 2006; Dunkan, Huber, 2007).
У 25-летних растений карельской березы регуляция активности АпИнв осуществляется на уровне экспрессии кодирующих ее генов CWIN. Более высокая активность АпИнв в ксилеме узорчатых растений (рис. 1б) обусловлена большим в 4.5–6 раз уровнем экспрессии генов CWIN1, CWIN1.1, CWIN4 (рис. 3а). Более тонкая регуляция активности АпИнв осуществляется на посттрансляционном уровне. Белковый ингибитор АпИнв растений, кодируемый геном Cif, участвует в регуляции транспорта сахарозы и ее метаболизма. Появление избытка сахарозы в апопласте снижает уровень экспрессии генов Cif, приводя к возрастанию активности АпИнв, и, наоборот, снижение концентрации сахарозы в апопласте активирует белковые ингибиторы АпИнв, что сопровождается инактивацией фермента (Rausch, Greiner, 2004; Roitsch, Gonzalez, 2004; Ruan et al., 2010; French et al., 2014; Ruan, 2014; Tang et al., 2017). Низкий уровень экспрессии Cif в камбиальной зоне и формирующейся ксилеме у 25-летних растений карельской березы (рис. 3б) свидетельствует о довольно высоком количестве сахарозы в апопласте, что согласуется с высказанным предположением о преимущественном апопластном транспорте сахарозы между клетками радиальных лучей и прозенхимными ксилемными производными камбия.
В данной связи, представляет интерес рассмотрение путей регуляции активности АпИнв в тканях ствола обычной березы с нормальным строением ксилемы и флоэмы и карельской березы с разной степенью аномальности вторичных проводящих тканей (узорчатая и безузорчатая части ствола). В безузорчатой части ствола карельской березы, как и у безузорчатых растений карельской березы, меньшая в 2 раза активность АпИнв (рис. 2б, 2в), по сравнению с узорчатой частью, была обусловлена низким уровнем экспрессии гена CWIN1 (рис. 4а, 4в) как в ксилеме, так и во флоэме. В тканях ствола обычной березы, по сравнению с безузорчатыми участками ствола карельской березы, несмотря на то, что активность АпИнв была такая же низкая (рис. 2б, 2в), уровень экспрессии CWIN1 был в 4–5 раз выше (рис. 4а, 4в). То есть, в нормальной по строению древесине обычной березы уровень экспрессии генов, кодирующих АпИнв, существенно не отличается от такового у карельской березы, а регуляция активности фермента происходит, в основном, на посттрансляционном уровне через белковые ингибиторы (CIF). Так, уровень экспрессии гена, кодирующего белковый ингибитор АпИнв, у обычной березы, по сравнению с карельской березой, был выше (рис. 4б и 4г). Особенно высокое количество транскриптов гена Cif во флоэме обычной березы (рис. 4г) позволяет предположить, что у нее внутриклеточная сахароза по симпласту поступает в камбиальную зону, выходит в апопласт и, быстро передвигаясь к прозенхимным ксилемным производным камбия, не накапливается во внеклеточном пространстве. Тот факт, что уровень экспрессии генов CWIN у обычной березы близок к таковому у карельской березы (рис. 3а, 3в) свидетельствует о том, что в период активного оттока ассимилятов в ствол растение потенциально готово повысить активность АпИнв в случае увеличения содержания сахарозы в апопласте. В наших предыдущих экспериментах было показано, что введение экзогенной сахарозы в камбиальную зону (неопубликованные данные Н.А. Галибина, Л.Л. Новицкая) или снижение расходования сахарозы на ростовые процессы вследствие временного торможения камбиального роста (Галибина и др., 2015б) приводит к увеличению у обычной березы активности АпИнв.
Таким образом, высокая акцепторная сила тканей ствола в местах формирования узорчатой древесины карельской березы поддерживается за счет метаболизации притекающей сахарозы с участием АпИнв. Образующиеся при этом в большом количестве гексозы интенсивно расходуются на синтез запасного метаболита – крахмала, количество которого увеличивается на фоне снижения содержания целлюлозы в ксилеме. Если активный биосинтез целлюлозы, сопровождающийся необратимым выведением большого количества сахаров из обмена веществ, происходит при формировании основных структурных элементов ксилемы (волокон и сосудов), то временное выведение избытка сахаров в виде крахмала приурочено к формированию паренхимных клеток. То есть, апопластный путь утилизации сахарозы в камбиальной зоне березы можно рассматривать как критерий возрастания паренхиматизации древесины. Мы получили, что степень насыщенности узора древесины у карельской березы коррелирует с увеличением активности АпИнв в ксилеме. Уровень экспрессии кодирующих АпИнв генов у обычной березы существенно не отличается от такового в узорчатых участках карельской березы. Более тонкая регуляция активности апопластной инвертазы происходит на посттрансляционном уровне через белковые ингибиторы апопластной инвертазы. На основе вышесказанного можно предположить, что у карельской березы наблюдается высокое содержание сахарозы в апопласте, в то время как у обычной березы большая часть сахарозы является цитоплазматической и расходуется на синтез компонентов клеточной стенки ксилемы. Причины, приводящие к увеличению дисахарида в апопласте аномальных участков карельской березы, пока не известны. Связано ли увеличение сахарозы в апопласте у карельской березы с производительностью переносчиков сахаров предстоит выяснить в дальнейших исследованиях.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (Институт леса КарНЦ РАН) и при финансовой поддержке РФФИ (проекты № 16-04-100639_р_а и 16-04-01191).
Список литературы
Антонова Г.Ф. Рост клеток хвойных. Новосибирск: Сибирская издательская фирма “Наука” РАН, 1999. 232 с.
Барильская Л.А. Сравнительный структурный анализ древесины березы повислой и карельской березы: дис. … канд. биол. наук. Петрозаводск, 1978. 157 с.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность сахарозосинтазы в тканях ствола карельской березы в период камбиального роста // Физиология растений. 2015а. Т. 62. № 3. С. 1–10.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность инвертазы в тканях ствола карельской березы // Физиология растений. 2015б. Т. 62. № 6. С. 804–813.
Галибина Н.А., Новицкая Л.Л., Никерова К.М. Избыток экзогенных нитратов подавляет формирование аномальной древесины у карельской березы // Онтогенез. 2016. Т. 47. № 2. С. 83–91.
Гамалей Ю.В. Транспортная система сосудистых растений. СПб.: Изд-во Санкт-Петербургского государственного университета, 2004. 422 с.
Коровин В.В., Новицкая Л.Л., Курносов Г.А. Структурные аномалии стебля древесных растений. 2-е изд. М.: МГУЛ, 2003. 280 с.
Курсанов А.Л., Прасолова М.Ф., Павлинова О.А. Пути ферментативного превращения сахарозы в корне сахарной свеклы в связи с его атрагирующей функцией // Физиология растений. 1989. Т. 36. № 4. С. 629–640.
Мощенская Ю.Л., Галибина Н.А., Никерова К.М., Новицкая Л.Л. Активность ферментов диссимиляции сахарозы в раннем онтогенезе разных форм березы повислой // Труды КарНЦ РАН. Серия Экспериментальная биология. 2016. № 11. С. 78–87.
Мощенская Ю.Л., Галибина Н.А., Топчиева Л.В., Новицкая Л.Л. Экспрессия генов, кодирующих изоформы сахарозосинтазы, в ходе аномального ксилогенеза карельской березы // Физиология растений. 2017. Т. 64. № 3. С. 301–310.
Новицкая Л.Л. Карельская береза: механизмы роста и развития структурных аномалий. Петрозаводск: Verso, 2008. 144 с.
Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др. ПЦР “в реальном времени”. М.: БИНОМ. Лаборатория знаний, 2011. 223 с.
An X., Chen Zh., Wang J., Ye M., Ji l., Wang J., Liao W., Ma H. Identification and characterization of the Populus sucrose synthase gene family // Gene. 2014. V. 539. № 1. P. 58–67.
Barnett J.R., Harris J.M. Early stages of bordered pit formation in radiata pine // Wood Sci. Techn. 1975. V. 9. № 3. P. 233–241.
Bate N.J., Niu X., Wang Y., Reimann K.S., Helentjaris T.G. Aninvertase inhibitor from maize localizes to the embryo surrounding region during early kernel development // Plant Physiol. 2004. V. 134. № 1. P. 246–254.
Bocock P.N., Morse A.M., Dervinis C. Davis J.M. Evolution and diversity of invertase genes in Populus trichocarpa // Planta. 2008. V. 227. № 3. P. 565–576.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding // Anal. Biochem. 1976. V. 72. № 1–2. P. 248–254.
Cheng W.-H., Taliercio E.W., Chourey P.S. Sugars modulate an unusual mode of control of the cell-wall invertase gene (Incw1) through its 3' untranslated region in a cell suspension culture of maize // PNAS. 1999. V. 96. № 18. P. 10512–10517.
Davies C., Robinson S.P. Sugar accumulation in grape berries. Cloning of two putative vacuolar invertase cDNAs and their expression in grapevine tissues // Plant Physiol. 1996. V. 111. № 1. P. 275–283.
Duncan K.A., Huber S.C. Sucrose synthase oligomerization and F-actin association are regulated by sucrose concentration and phosphorylation // Plant Cell Physiol. 2007. V. 48. № 11. P. 1612–1623.
French A.D. Idealized powder diffraction patterns for cellulose polymorphs // Cellulose. 2014. V. 21. № 2. P. 885–896.
Gerber L., Zhang B., Roach M., Rende U., Gorzsas A., Kumar M., Burgert I., Niittylla T., Sundberg B. Deficient sucrose synthase activity in developing wood does not specifically affect cellulose biosynthesis, but causes an overall decrease in cell wall polymers // New Phytol. 2014. V. 203. № 4. P. 1220–1230.
Greiner S., Krausgrill S., Rausch T. Cloning of a tobacco apoplasmic invertase inhibitor: proof of function of the recombinant protein and expression analysis during plant development // Plant Physiol. 1998. V. 116. № 2. P. 733–742.
Hardin S.C., Duncan K.A., Huber S.C. Determination of structural requirements and probable regulatory effectors for membrane association of maize sucrose synthase1 // Plant Physiol. 2006. V. 141. № 3. P. 1106–1119.
Hayes M.A., Davies C., Dry I.B. Isolation, functional characterization, and expression analysis of grapevine (Vitis vinifera L.) hexose transporters: differential roles in sink and source tissues // J. Exp. Bot. 2007. V. 58. № 8. P. 1985–1997.
Hothorn M., Van den Ende W., Lammens W., Rybin V., Scheffzek K. Structural insights into the pH-controlled targeting of plant cell-wall invertase by a specific inhibitor protein // PNAS. 2010. V. 107. № 40. P. 17427–17432.
Jin Y., Ni D.A., Ruan Y.L. Posttranslational elevation of cell wall invertase activity by silencing its inhibitor in tomato delays leaf senescence and increases seed weight and fruit hexose level // Plant Cell. 2009. V. 21. № 7. P. 2072–2089.
Koch K.E. Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development // Curr. Opin. Plant Biol. 2004. V. 7. № 3. P. 235–246.
Koch K.E., Zeng Y. Molecular approaches to altered C partitioning: genes for sucrose metabolism // J. Amer. Soc. Hort. Sci. 2002. V. 127. № 4. P. 474–483.
Liu X., Song B., Zhang H., Li X.Q., Xie C., Liu J. Cloning and molecular characterization of putative invertase inhibitor genes and their possible contributions to cold-induced sweetening of potato tubers // Mol. Gen. Genomics. 2010. V. 284. № 3. P. 147–159.
Lorenz K., Lienhard S., Sturm A. Structural organization and differential expression of carrot β-fructofuranosidase genes: identification of a gene coding for a flower bud-specific isozyme // Plant Mol. Biol. 1995. V. 28. № 1. P. 189–194.
Novitskaya L., Nikolaeva N., Galibina N., Tarelkina T., Semenova L. The greatest density of parenchyma inclusions in Karelian birch wood occurs at confluences of phloem flows // Silva Fennica. 2016. V. 50. № 3. P. 1461–1478.
Novitskaya L.L., Kushnir F.V. The role of sucrose in regulation of trunk tissue development in Betula pendula Roth // J. Plant Growth Regul. 2006. V. 25. № 1. P. 18–29.
Patrick J.W., Offler C.E. Compartmentation of transport and transfer events in developing seeds // J. Exp. Bot. 2001. V. 52. № 356. P. 551–564.
Pfaffl M.W., Tichopad A., Prgomet C., Neuvians T.P. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper –Excel-based tool using pair-wise correlations // Biotechnol. Lett. 2004. V. 26. № 6. P. 509–515.
Qin G., Zhu Z., Wang W.H., Cai J.H., Chen Y., Li L., Tian S.P. A tomato vacuolar Invertase inhibitor mediates sucrose metabolism and influences fruit ripening // Plant Physiol. 2016. V. 172. № 3. P. 1596–1611.
Rausch T., Greiner S. Plant protein inhibitors of invertases // BBA – Proteins and Proteomics. 2004. V. 1696. № 2. P. 253–261.
Roitsch T., Bittner M., Codt D.E. lnduction of apoplastic invertase of Chenopodium rubrum by D-glucose and a glucose analog and tissue-specific expression suggest a role in sink-source regulation // Plant Physiol. 1995. V. 108. № 1. P. 285–294.
Roitsch T., González M.-C. Function and regulation of plant invertases: sweet sensations // Trends Plant Sci. 2004. V. 9. № 12. P. 606–613.
Ruan Y.L. Sucrose metabolism: gateway to diverse carbon use and sugar signaling // Annu. Rev. Plant Biol. 2014. V. 65. P. 33–67.
Ruan Y.L., Jin Y., Yang Y.J., Li G.J., Boyer J.S. Sugar input, metabolism, and signaling mediated by invertase: roles in development, yield potential, and response to drought and heat // Mol. Plant. 2010. V. 3. № 6. P. 942–955.
Ruan Y.L., Llewellyn D.J., Furbank R.T. Suppression of sucrose synthase gene expression represses cotton fiber cell initiation, elongation, and seed development // Plant Cell. 2003. V. 15. № 4. P. 952–964.
Salojärvi J., Smolander O.-P., Nieminen K. et al. Genome sequencing and population genomic analyses provide insights into the adaptive landscape of silver birch // Nat. Genet. 2017. V. 49. P. 904–912.
Stitt M., Sonnewald U. Regulation of metabolism in transgenic plants // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1995. V. 46. P. 341–368.
Sturm A., Chrispeels M.J. cDNA cloning of carrot extracellular beta-fructosidase and its expression in response to wounding and bacterial infection // Plant Cell. 1990. V. 2. № 11. P. 1107–1119.
Sturm A., Sebkova V., Lorenz K., Hardegger M., Lienhard S., Unger C. Developmental-specific and organ-specific expression of the genes for sucrose synthase and three isoenzymes of acid beta-fructofuranosidase in carrot // Planta. 1995. V. 195. № 4. P. 601–610.
Sturm A., Tang G.Q. The sucrose-cleaving enzymes of plants are crucial for development, growth and carbon partitioning // Trends Plant Sci. 1999. V. 4. № 10. P. 401–407.
Su T., Wolf S., Han M., Zhao H., Wei H., Greiner S., Rausch T. Reassessment of an Arabidopsis cell wall invertase inhibitor AtCIF1 reveals its role in seed germination and early seedling growth // Plant Mol. Biol. 2016. V. 90. № 1–2. P. 137–155.
Tang X.F., Su T., Han M., Wei L., Wang W.W., Yu Z.Y., Xue Y.G., Wei H.B., Du Y.J., Greiner S., Rausch T., Liu L.J. Suppression of extracellular invertase inhibitor gene expression improves seed weight in soybean (Glycine max) // J. Exp. Bot. 2017. V. 68. № 3. P. 469–482.
Tuskan G.A., DiFazio S., Jansson S. et al. The genome of black cottonwood, Populus trichocarpa (Torr. & Gray) // Science. 2006. V. 313. № 5793. P. 1596–1604.
Wang L., Cook A., Patrick J.W., Chen X.Y., Ruan Y.L. Silencing the vacuolar invertase gene GhVIN1 blocks cotton fiber initiation from the ovule epidermis, probably by suppressing a cohort of regulatory genes via sugar signaling // Plant J. 2014. V. 78. № 4. P. 686–696.
Weber H., Borisjuk L., Heim U., Buchner P., Wobus U. Seed coat-associated invertases of fava bean control both unloading and storage functions: cloning of cDNAs and cell type-specific expression // Plant Cell. 1995. V. 7. № 11. P. 1835–1846.
Weber H., Borisjuk L., Wobus U. Molecular physiology of legume seed development // Annu. Rev. Plant Biol. 2005. V. 56. P. 253–279.
Winter H., Huber S.C. Regulation of sucrose metabolism in higher plants: localization and regulation of activity of key enzymes // Crit. Rev. Plant Sci. 2000. V. 19. № 1. P. 31–67.
Xu J., Pemberton G.H., Almira E.C., McCarty D.R., Koch K.E. The Ivr1 gene for invertase from maize // Plant Physiol. 1995. V. 108. № 3. P. 1293–1294.
Zhou J., Fritz L. Okadaic acid antibody localizes to chloroplasts in the DSP-toxin-producing dinoflagellates Prorocentrum lima and Prorocentrum maculosum // Phycologia. 1994. V. 33. № 6. P. 455–461.
Дополнительные материалы отсутствуют.


