Онтогенез, 2019, T. 50, № 1, стр. 41-52
Использование антимикробных пептидов микромицетов рода Trichoderma для выхода эмбриогенной культуры Larix sibirica
И. Н. Третьякова a, *, М. Э. Пак a, А. А. Баранова b, И. А. Лисецкая c, А. С. Шуклина a, Е. А. Рогожин b, d, В. С. Садыкова b
a Институт леса им. В.Н. Сукачева Сибирского отделения Российской академии наук –
обособленное подразделение ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок 50, стр. 28, Россия
b Федеральное государственное бюджетное научное учреждение “Научно-исследовательский институт
по изысканию новых антибиотиков имени Г.Ф. Гаузе”
119021 Москва, ул. Большая Пироговская, дом 11, строение 1, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
660041 г. Красноярск, пр. Свободный, 79, Россия
d Федеральное государственное бюджетное учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, ГСП-7, улица Миклухо-Маклая, дом 16/10, Россия
* E-mail: culture@ksc.krasn.ru
Поступила в редакцию 26.02.2018
После доработки 09.04.2018
Принята к публикации 26.02.2018
Аннотация
Проводили выращивание эмбриогенных культур лиственницы сибирской на питательной среде АИ с различными концентрациями антимикробных пептидов микроспориального происхождения двух видов рода Trichoderma: T. citirnoviride (штамм TYVI 4/11) и T. vivide (штамм 346) in vitro для достижения прямого антимикробного эффекта, а также запуска механизмов индуцированной устойчивости (регуляторной функции эмбриогенных культур), изучение морфогенеза и ростовой активности регенерантов. Для эксперимента были отобраны четыре клеточные линии: Кл4, Кл5, Кл6, Кл12, отличающиеся по эмбриогенной активности. Под влиянием пептидов триходермального происхождения в клеточных культурах лиственницы наблюдалась значительная стимуляция роста пролиферирующих эмбриогенных клеточных линий и стимуляция роста корней и образование каллусных наплывов на регенерантах. Проростки, обработанные пептидами триходермального происхождения, не отличались от контрольных вариантов. Можно предположить, что обработка пептидами будет способствовать повышению иммунитета сеянцев при выращивании в почве лесопитомника. Исследование действия биоконтрольных штаммов в плантационном лесовосстановлении для стимуляции роста каллусов и зародышей и получения растений-регенерантов хвойных, устойчивых к заболеваниям, будет способствовать развитию нового направления в лесной науке в России – “клонального лесоводства”, которое появилось в последнее время за рубежом (Park 2002, 2014).
ВВЕДЕНИЕ
Соматический эмбриогенез является одним из перспективных направлений в создании сортового плантационного лесовыращивания. Технология соматического эмбриогенеза широко используется за рубежом в программе MVF, основанной на вводе в культуру улучшенных, генетически тестированных деревьев (Park et al., 2002, 2006, 2014, 2016). В России биотехнология соматического эмбриогенеза была разработана нами у хвойных видов (Третьякова и др., 2013, 2016, 2017 и др.). По технологии соматического эмбриогенеза лиственницы сибирской был получен патент в 2012 http://www.freepatent.ru/images/patents/5/2456344/ patent-2456344.pdf). В настоящее время у лиственницы сибирской получены длительно пролифирирующие эмбриогенные клеточные культуры. Периодически из пролиферирующих клеточных линий (Кл) на среде с АБК соматические зародыши доводились до созревания и прорастающие регенеранты выращивались в ростовой камере, где проходила их акклиматизация. Затем сеянцы высаживались в теплицу.
Для повышения выхода клонированных соматических сеянцев одним из ключевых моментов технологии соматического эмбриогенеза является получение полноценных регенерантов. В процессе морфогенеза соматических зародышей в период созревания происходит ряд нарушений (мутаций) в развитии доменов зародыша (апикального центрального и базального). Особенно часто мутации возникают в базальном домене, что выражается в образовании наплывов (каллуса на месте корешка или в области корневой шейки) (Пак и др., 2016). Причины данного феномена остаются неизвестными.
Ранее нами проводились эксперименты по влиянию штаммов грибов рода Trichoderma в период инициации каллусных культур ряда хвойных видов (лиственницы сибирской, кедра сибирского, сосны обыкновенной, кедрового стланика) (Третьякова и др., 2009). При этом было установлено, что метаболиты штаммов способны увеличивать скорость роста каллусов и зародышей хвойных растений. Однако действие метаболита на растительный организм оказалось видоспецифично, что согласуется с данными других исследователей, показавших существенные различия по увеличению массы у разных видов и сортов злаковых растений и в ответных реакциях на воздействие отдельных видов рода Trichoderma. Стимуляция культур в этом случае, вероятно, связана с активацией механизма системной резистентности у растений. Известно, что штаммы грибов рода Trichoderma образуют 3 типа веществ, которые индуцируют резистентность растений. Это белки с ферментативной активностью или с другой биологической активностью, продукты генов Avr (антивирулентные белки), олигосахариды и низкомолекулярные вещества, которые выделяются из клеточных стенок грибов и растений в результате воздействия на них ферментов Trichoderma (Громовых и др., 2014, Садыкова и др., 2015).
Изучение запуска механизмов индуцированной устойчивости, исследования морфогенеза и ростовой активности растений, обработанных пептидами микроспориального происхождения, является перспективным направлением для хвойных, введенных в культуру тканей, где можно ожидать возможного повышения выхода устойчивых к патогенам регенерантов и соматических сеянцев.
В данной работе мы описываем ряд экспериментов по воздействию антимикробных пептидов микроскопических грибов рода Trichoderma в процессе выращивания. Мы проводили культивирование эмбриогенных культур лиственницы сибирской на питательной среде АИ с различными концентрациями защитных пептидов микроспориального происхождения in vitro для достижения прямого антимикробного эффекта, а также запуска механизмов индуцированной устойчивости (регуляторной функции), изучение морфогенеза и ростовой активности соматических зародышей и проростков.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили незрелые семена дерева № А4 лиственницы сибирской, произрастающего в дендрарии Института леса (Красноярск) (Пак и др., 2016; Третьякова и др., 2016), от которого в разные годы было получено более 42 пролиферирующих Кл.
Инициация эмбриогенных культур проводилась из незрелых зиготических зародышей данного дерева лиственницы на среде АИ (патент). В среду добавляли регуляторы роста 2,4-Д (2 мг/л), БАП (1–0.5 мг/л). Для поддержания пролиферирующих эмбриогенных культур через каждые две недели проводили субкультивирование на свежие питательные среды.
Эксперименты по созреванию соматических зародышей лиственницы сибирской выполняли на базовой питательной среде АИ, содержащей сахарозу (40 г/л), абсцизовую кислоту (АБК) (32 мг/л), индолилмасляную кислоту (ИМК) (0.2 мг/л) и полиэтиленгликоль (ПЭГ 8000) (10%). В качестве желирующего агента использовали Gelrite (4 г/л). Культивирование осуществляли в темноте при температуре 24 ± 1°С. В охлажденную питательную среду после автоклавирования добавляли регуляторы роста (АБК и ИМК), а также L-глутамин (500 мг/л) и аскорбиновую кислоту (400 мг/л) методом холодной стерилизации с использованием бактериальных фильтров (ТРР, Швейцария, размер пор 0.22 мкм). Созревшие зародыши переносили на базовую среду АИ для прорастания, свободную от растительных регуляторов роста.
Для оценки влияния пептидного комплекса грибов рода Trichoderma на эмбриогенные культуры Larix sibirica были отобраны два штамма: Trichoderma citrinoviride TYVI 4/11 ВКПМ F-1228 (запатентован как продуцент антибиотиков-пептаиболов с антигрибной и антибактериальной активностью. Патент РФ № 2564577 зарегистрирован в Государственном реестре изобретений РФ 07.09.2015) и штамм 346 Trichoderma viride.
Проверку антибиотической активности штаммов проводили на наиболее часто используемых для изучения роста и синтеза антибиотических веществ жидких средах – синтетической (среда Чапека), и полусинтетических (Сабуро и 3% неохмеленное сусло).
Обработку пролиферирующих эмбриогенных культур лиственницы проводили пептидными фракциями, выделенными из штаммов микроскопических грибов T. citirnoviride TYVI 4/11 (ВКПМ) и T. vivide 346. Для эксперимента были отобраны четыре клеточные линии: Кл4, Кл5, Кл6, Кл12. Для пролиферации ЭСМ использовали среду АИ, дополненную регуляторами роста 2,4-Д (2 мг/л) и 6БАП (0.5 мг/л). Варианты среды АИ: контроль, с добавлением комплекса пептидов TYVI 4/11 и 346 (10 мкл/диск). Влияние комплекса пептидов на эмбриогенные культуры Larix sibirica оценивали по (1) динамике пролиферации эмбрионально-суспензорной массы, (2) морфометрии глобулярных зародышей и (3) динамике роста регенерантов в течение 21 сут.
В экспериментах по обработке пептидами, выделенными из триходермы T. citirnoviride (штамм TYVI 4/11) и T. vivide (штамм 346), пролиферирующих эмбриогенных культур лиственницы в питательную среду АИ вводили стерильные бумажные диски 4 мм (фильтровальная бумага), с концентрацией пептидов 2 мкг/диск, предварительно высушенные в стерильных условиях при температуре 24 ± 1°С. Культивировали в пенициллиновых флаконах и колбах в темноте при 24 ± 1°С. Субкультивирование на свежую питательную среду того же состава проводили каждые 14 дней, сопровождая взвешиванием. Массу сырой ЭСМ оценивали на основании взвешивания не менее 10 трансплантов. Влияние комплекса пептидов на эмбриогенные культуры Larix sibirica оценивали по динамике пролиферации эмбрионально-суспензорной массы и морфометрии глобулярных зародышей.
Влияние обработки пептидами микроскопических грибов на рост регенерантов
При прорастании соматических зародышей лиственницы сибирской в безгормональную среду АИ добавляли пептиды в концентрациях 2, 7, 15, 30, 60 мкг/диск. Культивировали созревшие зародыши на экспериментальных средах по 10 шт на чашку Петри (по 3 повторности). Влияние комплекса пептидов на прорастание соматических зародышей Larix sibirica оценивали по динамике роста регенерантов в течение 21 сут. Длину проростков измеряли в первый пассаж, на 7, 14 и 21 сут проращивания.
Для проведения цитологического анализа готовили давленые препараты по стандартной методике (Круглова и др., 2013). ЭСМ помещали на предметное стекло, взвешивали, окрашивали сафранином в течение 3–5 мин, добавляли каплю глицерина, накрывали предметным стеклом, после чего слегка придавливали.
Препараты просматривали на микроскопе “МИКРОМЕД-6” ЛОМО, при увеличении 10 × 4, 10 × 10 и 10 × 40. Замеры клеток и эмбриональных структур проводили при помощи системы ScopePhoto, с последующим переводом полученных единиц в мкм. Статистическая обработка данных проводилась по стандартным методикам (Лакин, 1973) при помощи программы Microsoft Excel 2003.
РЕЗУЛЬТАТЫ
Получение пептидных комплексов штаммов микромицетов рода Trichoderma и характеристика их фунгицидной активности
Для установления антибиотической активности пептидного комплекса штаммов рода Trichoderma в отношении фитопатогенных микромицетов первоначально проводили оценку диско-диффузионным методом. Штаммы секретировали антибиотики в культуральную жидкость (проверка по этилацетатным и бутанольным экстрактам), а метанольные и этанольные экстракты из их мицелия были не активны вне зависимости от среды выращивания. Максимальная фунгицидная активность для обоих штаммов установлена при культивировании на среде Сабуро (табл. 1).
Таблица 1.
Диаметр зоны подавления роста тест-культур при культивировании штаммов на различных средах, мм
| Тест-культура микромицетов |
Среда Сабуро | Среда Чапека | Неохмеленное сусло 3% | |||
|---|---|---|---|---|---|---|
| 346 | TYVI 4/11 | 346 | TYVI 4/11 | 346 | TYVI 4/11 | |
| A. fumigatus | 14 ± 0.1 | 19 ± 0.1 | 10 ± 0.2 | 10 ± 0.1 | 12 ± 0.1 | 10 ± 0.2 |
| A. oryzae 1К | 17 ± 0.2 | 14 ± 0.2 | 10 ± 0.1 | 10 ± 0.1 | 10 ± 0.3 | 15 ± 0.2 |
| A. ustus 6К | 15 ± 0.1 | 17 ± 0.3 | 18 ± 0.2 | 12 ± 0.2 | 14 ± 0.2 | 12 ± 0.2 |
| A. terreus 4К | 11 ± 0.1 | 16 ± 0.1 | 15 ± 0.3 | 10 ± 0.3 | 12 ± 0.1 | 14 ± 0.1 |
| A. fisheri 3К | 12 ± 0.2 | 17 ± 0.2 | 14 ± 0.3 | 14 ± 0.1 | 10 ± 0.1 | 16 ± 0.4 |
| A. niger 2К | 11 ± 0.1 | 22 ± 0.1 | 16 ± 0.2 | 14 ± 0.2 | 11 ± 0.3 | 16 ± 0.3 |
| A. flavus 7К | 10 ± 0.2 | 21 ± 0.4 | 10 ± 0.1 | 10 ± 0.2 | 11 ± 0.2 | 22 ± 0.1 |
| A. nidulans | 14 ± 0.1 | 17 ± 0.6 | 11 ± 0.3 | 17 ± 0.1 | 10 ± 0.1 | 19 ± 0.1 |
| C. albicans АТСС 2091 | 16 ± 0.1 | 16 ± 0.1 | 14 ± 0.2 | 12 ± 0.3 | 10 ± 0.1 | 15 ± 0.1 |
| F. oxysporum VKMF-140 | 10 ± 0.1 | 21 ± 0.2 | 12 ± 0.1 | 11 ± 0.1 | 10 ± 0.1 | 21 ± 0.2 |
Была разработана схема выделения антимикробных пептидных фракций (Патент РФ № 2564577). Пять индивидуальных соединений – пептаиболов T. citrinoviride ВКПМ F-1228, соответствующие времени удержания на аналитической ОФ – ВЭЖХ, установленном ранее для активных компонентов (соединение № 28 – 44 мин; № 29 – 48 мин; № 30 – 53 мин; № 31 – 55 мин и № 32 – 62 мин), были накоплены с помощью полупрепаративной высокоэффективной жидкостной хроматографии (рис. 1).
Рис. 1.
Полупрепаративная ОФ-ВЭЖХ пептидного комплекса, продуцируемого штаммом T. citrinoviride ВКПМ F-1228.

Активные пептидныe комплексы обоих штаммов были переданы для тестирования на зародышах.
Пролиферация эмбриогенных культур, обработанных активными пептидными комплексами микромицетов рода Trichoderma
Результаты анализа эмбриогенной продуктивности четырех клеточных линий лиственницы сибирской (Кл4, Кл5, Кл6, Кл12) приведены в табл. 2. Наиболее высокопродуктивной по формированию зрелых соматических зародышей являлась Кл4 (табл. 2, рис. 2), а Кл5 характеризовалась массовым образованием глобулярных зародышей, которые не созревали.
Таблица 2.
Продуктивность эмбриогенных клеточных линий Larix sibirica
| Число глобулярных зародышей на 1 г сырой ЭСМ | Число зрелых зародышей (на 45 сут) на 1 г сырой ЭСМ | Частота созревания зародышей относительно числа глобулярных зародышей, % | |
|---|---|---|---|
| Кл2 | 2180 ± 228.6 | 110.4 ± 5.77 | 5.1 |
| Кл4 | 3700 ± 249.0 | 1220.7 ± 137.93 | 33 |
| Кл5 | 3750 ± 163.0 | 0 | 0 |
| Кл6 | 2040 ± 189.2 | 12.5 ± 2.65 | 0.6 |
При всех вариантах обработки пролиферационная активность ЭСМ сохранялась в течение всего периода культивирования на средах с добавлением пептидов (4 нед.) (из данных табл. 3). Мультипликация зародышей продолжалась (рис. 3).
Таблица 3.
Влияние АМП на интенсивность роста ЭСМ клеточных линий за 24 дня
| Клеточная линия | Длительность культивирования, недели | Вес ЭСМ, г | ||
|---|---|---|---|---|
| контроль | TYVI 4/11 | 346 | ||
| Кл4 | 0 | 0.057 ± 0.03 | 0.057 ± 0.03 | 0.057 ± 0.003 |
| 2 | 1.285 ± 0.05 | 1.181 ± 0.36 | 1.543 ± 0.16 | |
| 4 | 3.101 ± 0.28 | 3.203 ± 1.27 | 3.956 ± 0.66 | |
| Кл5 | 0 | 0.058 ± 0.06 | 0.058 ± 0.03 | 0.058 ± 0.05 |
| 2 | 0.364 ± 0.09 | 2.114 ± 0.1 | 0.323 ± 0.001 | |
| 4 | 0.608 ± 0.09 | 4.065 ± 0.07 | 0.399 ± 0.04 | |
| Кл 6 | 0 | 0.021 ± 0.01 | 0.021 ± 0.07 | 0.021 ± 0.03 |
| 2 | 0.118 ± 0.03 | 0.156 ± 0.3 | 0.286 ± 0.2 | |
| 4 | 0.198 ± 0.02 | 0.281 ± 0.06 | 0.480 ± 0.05 | |
| Кл 12 | 0 | 0.044 ± 0.04 | 0.044 ± 0.008 | 0.044 ± 0.007 |
| 2 | 0.725 ± 0.06 | 1.029 ± 0.12 | 1.725 ± 0.07 | |
| 4 | 1.886 ± 0.25 | 3.231 ± 0.59 | 6.18 ± 0.36 | |
Рис. 3.
Мультипликация глобулярных СЗ Larix sibirica, обработанных АМП штаммов 346 (T. vivide) и TYVI 4/11. Масштаб 200 мкм.

Интенсивность роста значительно варьирует у исследуемых Кл. Высокая пролиферативная активность отмечена у Кл4 как в контрольном варианте, так и под действием АМП. У Кл5, у которой зародыши не созревают, резко усиливается прирост ЭСМ под действием АМП штамма TYVI 4/11 – сырая масса трансплантов увеличилась за 4 нед. в 70, тогда как в контрольном варианте и при обработке АМП штамма 346 только в 10 и 6.8 раз соответственно (табл. 3). У Кл12 прирост ЭСМ еще более усиливается: при обработке АМП штамма 346 сырая масса трансплантов увеличилась в 140 раз. Низкая пролиферативная активность отмечена у Кл6, однако прослеживается такая же тенденция увеличения интенсивности прироста ЭСМ в опытных вариантах, как у Кл4 и Кл12. Несмотря на низкую интенсивность прироста, как будет указано ниже, у данной Кл идет стабильное созревание зародышей и их прорастание. Клонированные деревья от этой линии в течение 5 лет растут на стационаре “Погорельский бор” ИЛ СО РАН.
В пролиферирующей ЭСМ всех четырех клеточных линий формировались за счет активного кливажа глобулярные зародыши с глобулой стандартной величины от 40 до 420 мкм (Третьякова и др. 2016), как в обработанных АМП, так и в контроле (рис. 4). Размеры глобул соматических зародышей исследуемых эмбриогенных клеточных линий, культивируемых на контрольной питательной среде и средах с добавлением комплекса пептидов штаммов TYVI 4/11 и 346 (10 мкл/диск), достоверно не различаются. Это отмечено на 7 и на 14 сут пролиферации (рис. 4).
Морфогенез и гистодифференцировка соматических зародышей, обработанных пептидами микроскопических грибов при созревании
Через семь дней после субкультивирования на пролиферационной питательной среде кусочки активно растущей ЭСМ весом 100–300 мг переносили на безгормональную базовую среду АИ с активированным углем (10 г/л) и повышенным содержанием сахарозы (34 г/л) на 5–7 сут для остановки пролиферации и перехода соматических зародышей к созреванию.
После перемещения пролиферирующей ЭСМ Кл, обработанной пептидами на питательную среду АИ с АБК, кливаж, почкообразование и мультипликация эмбриональных трубок суспензора прекращались, как в вариантах, обработанных пептидами, так и в контроле. Через 1 нед. культивирования каждое эмбрио становилось самостоятельной структурой: происходило формирование оси зародыша, и начиналась программированная клеточная смерть суспензора. Во вторую неделю как у контрольных, так и обработанных пептидами образцах шла активная гистодифференцировка и происходило образование апикальных меристем. В начале третьей недели обозначалось семядольное кольцо. В это же время суспензор полностью отмирал. Процесс созревания соматических зародышей Кл завершался в течение 20–60 сут (рис. 5). Размеры созревших соматических зародышей и их число в вариантах, обработанных пептидами и контроле данной линии не различались. Длина зародыша составляла 1.2–1.5 мм. Число созревших соматических зародышей у Кл4 в контроле составило 1220 ± 37.9, обработанных пептидами 1200 ± 42.1.
Влияние обработки пептидами микроскопических грибов на рост регенерантов
Исследования по влиянию пептидов триходермального происхождения на рост регенерантов лиственницы сибирской штамма 346 (T. vivide) и штамма TYVI 4/11 (T. citirnoviride) показали, что на 14 сут культивирования был отмечен стимулирующий эффект биопептидов штамма 346 (T. vivide) на прорастание соматических зародышей Кл4 Larix sibirica при концентрации 2 мкг/диск (9.47 мм) (рис. 6). На 21 сут культивирования достоверных различий по общей длине регенерантов не выявлено. Наблюдалась тенденция увеличения длины корня у вариантов, обработанных биопептидами по сравнению с контролем (рис. 7). Длина корня регенерантов Кл4 в контрольном варианте достигала длины 0.8 ± 0.3, тогда как при обработке пептидами штамма 346 (T. vivide) (7 мкг/диск) составила 1.9 ± 0.3, а при обработке пептидами штамма TYVI 4/11 (7 мкг/диск) – 2.1 ± 0.5. Однако при данной концентрации у части проростков на 21 сут наблюдалось отмирание корня и происходило каллусообразование в области корешка (рис. 8, 9).
Рис. 6.
Динамика роста регенерантов Кл4 Larix sibirica на контрольной среде АИ и средах АИ, дополненных АМП штаммов TYVI 4/11 и 346.
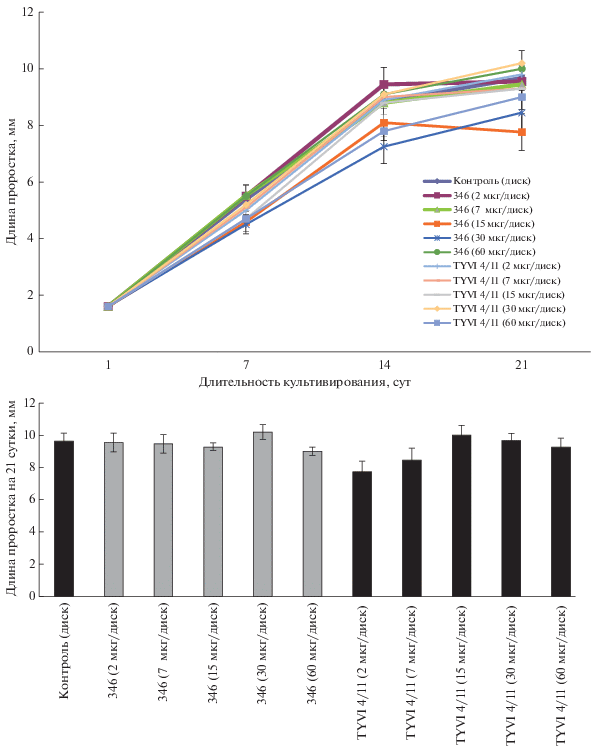
Рис. 8.
Частота (%) формирования регенерантов с семядолями, гипокотилем и корнем без утолщений (регенеранты без отклонений), регенерантов с каллусными наплывами и регенерантов, формирующих корень (без учета утолщений), при проращивании на контрольной среде АИ и средах, дополненных АМП штаммов TYVI 4/11 и 346.

Рис. 9.
Регенеранты клеточной линии 4 Larix sibirica на стадии прорастания: (а, б) контрольная среда АИ; (в, г, д) обработка АМП штамма TYVI 4/11; е – обработка АМП штамма 346. Каллусные наплывы обозначены стрелками.

При прорастании СЗ Кл4 часть регенерантов (15% на контрольной среде) формировали семядоли, стебель и корень без морфологических отклонений, такие растения в дальнейшем успешно укоренялись. У 85% регенерантов наблюдались различные отклонения: уменьшение числа семядолей, утолщения и каллусные наплывы (КН, рис. 8).
Регенеранты без отклонений в развитии в опытных вариантах и контроле составляли 5–15% и были пересажены в грунт (условия ростовой камеры) (рис. 10).
ОБСУЖДЕНИЕ
Способность грибов рода Trichoderma непосредственно влиять на рост и развитие растений была отмечена еще много десятилетий назад разными исследователями. Установлено, что грибы рода Trichoderma могут индуцировать локальную (induced systemic resistance – ISR) и системную (systemic acquired resistance – SAR) устойчивость растений к ряду патогенов.
Грибы этого рода вырабатывают различные химические соединения, участвующие в защите и стимуляции роста растений, в частности корневой системы. Продуцируемые ими биологические вещества могут действовать как элиситоры или индукторы сопротивления. Эти молекулы включают: 1) белки с ферментативной деятельностью, такие как ксиланазы и антимикробные пептиды; 2) продукты, подобные авирулентным генам, способные вызвать оборонные реакции на растениях; 3) вещества низкой молекулярной массы из клеточной стенки гриба, в основном олигосахариды, состоявшие из двух типов мономеров, без остатка аминокислоты (Woo, Lorito, 2007).
Наиболее важную роль в стимуляции роста и индукции механизмов защиты растения от патогенов играют антимикробные пептиды, продуцируемые некоторыми видами рода Trichoderma. Присутствие пептабиотиков активизировало оборонный ответ у табака (Viterbo et al., 2006). Влияние антимикробных пептидов этих грибов хорошо изучено для сельскохозяйственных культур, на древесных растениях, особенно голосеменных, таких работ сравнительно немного. Из штаммов T. virens был получен и очищен пептабиотик, влияющий на стимуляцию роста злаковых растений (Vinale et al., 2008). С. Джонович с коллегами (Djonovic et al., 2006) идентифицировал маленький белок (Sml) элиситор у T. virens и продемонстрировал его причастность к активации механизмов защиты растения и индукции системного сопротивления и формировании корневой системы растений.
Ранее нами было выявлено ростстимулирующее действие культуральной жидкости на каллусы сосны и лиственницы сибирской для штаммов двух видов T. harzianum “M99/5” и T. asperellum “Mg-6”, рекомендованных для биоконтроля фитопатогенов, вызывающих фузариозы хвойных. При внесении 1%-й концентрации культуральной жидкости, содержащей ауксины (ИУК) и комплекс антибиотиков в питательную среду объем каллусов сосны сибирской превышал контрольный в 1.3 раза (Третьякова и др., 2009).
При добавлении очищенных пептидных фракций в клеточные культуры лиственницы также наблюдается стимуляция роста пролиферирующих эмбриогенных каллусов. На четвертую неделю культивирования у Кл 5, Кл12 и Кл6 значительно увеличился прирост ЭСМ. Наблюдалась стимуляция корнеообразования у регенерантов Кл4 на 21 сут прорастания. В то же время происходила и стимуляция образования каллусных наплывов на проростках. Сеянцы, обработанные пептидами триходермального происхождения не отличались от контрольных вариантов.
Можно предположить, что обработка пептидами будет способствовать повышению иммунитета сеянцев при выращивании в почве лесопитомника. Исследование действия биоконтрольных штаммов в плантационном лесовосстановлении для стимуляции роста каллусов и зародышей и получения растений-регенерантов хвойных, устойчивых к заболеваниям, будет способствовать развитию нового направления в лесной науке в России – “клонального лесоводства”, которое появилось в последнее время за рубежом (Park 2002, 2014).
Исследование выполнено при финансовой поддержке РФФИ, Правительства Красноярского края, Красноярского краевого фонда науки в рамках научных проектов № 16-44-240509 и № 18-44-243004.
Список литературы
Громовых Т.И., Садыкова В.С., Алимова Ф.К. Микромицеты рода Trichoderma Pers.: Научное обоснование использования в технологиях агропромышленного комплекса / Под ред. академика Рогова И.А. М.: Издательско-полиграфический центр МГУПП, 2014. 189 с. ISBN 978-5-9920-0227-0.
Круглова Н.Н., Егорова О.В., Сельдимирова Д.Ю. и др. Световой микроскоп как инструмент в биотехнологии растений / Ин-т биологии Уфимского НЦ РАН; ООО “Консалтинговая фирма “Микроскоп Плюс”. Уфа: Гилем, Башк. энцикл., 2013. 128 с.
Лакин Г.Ф. Биометрия. М.: Высш. школа, 1973. 343 с.
Пак М.Э., Иваницкая А.С., Двойнина Л.М., Третьякова И.Н. Эмбриогенный потенциал длительно пролиферирующих клеточных линий Larix sibirica in vitro // Сибирский лесной журнал. 2016. № 1. С. 27–38.
Садыкова В.С., Кураков А.В., Коршун В.А., Рогожин Е.А. Громовых Т.И., Куварина А.Е., Баранова А.А. Антимикробная активность штамма T. citrinoviride ВКПМ F-1228: оптимизация лабораторного культивирования и спектр действия индивидуальных пептаиболов // Антибиот. химиотер. 2015. № 11–12. С. 34–42.
Садыкова В.С., Кураков А.В., Куварина А.Е. Штамм микромицета Trichoderma citrinoviride Bissett ВКПМ F-1228 – продуцент мембраноактивных антибиотиков пептаиболов, обладающих антигрибной и антибактериальной активностью. Патент РФ № 2564577 от 07.09.2015.
Третьякова И.Н. Способ микроклонального размножения лиственницы сибирской в культуре in vitro через соматический эмбриогенез на среде АИ для плантационного лесовыращивания. Патент РФ RU 2456344 C2. М.: Федеральная служба по интеллектуальной собственности, 2012.
http://www.freepatent.ru/images/patents/5/2456344/patent-2456344.pdf.
Третьякова И.Н. Эмбриогенные клеточные линии и соматический эмбриогенез в культуре in vitro у лиственницы сибирской // ДАН. 2013. Т. 450. № 1. С. 122–126.
Третьякова И.Н., Пак М.Э., Иваницкая А.С., Орешкова Н.В. Особенности соматического эмбриогенеза длительно пролиферирующих клеточных линий Larix sibirica in vitro // Физиол. раст. 2016. Т. 63. № 6. С. 812–822.
Третьякова И.Н., Садыкова В.С., Носкова Н.Е., Бондарь П.Н., Гайдашева И.И., Громовых Т.И., Иваницкая А.С., Ижболдина М.В., Барсукова А.В. Ростстимулирующая активность штаммов рода Streptomyces lateritius и Trichoderma и перспективы их использования для микроклонального размножения хвойных // Биотехнология. 2009. № 1. С. 39–41.
Tretyakova I., Ivanitskaja A., Park M. Somatic embryogenesis in culture in vitro of Larix sibirica // The International J. Plant Reproductive Biology. 2017. V. 9. № 2. P. 93–100.
Djonovic S., Pozo M.J., Dangott L.J., Howell C.R., Kenerley C.M. Sm1, a proteinaceous elicitor secreted by the biocontrol fungus Trichoderma virens induces plant defense responses and systemic resistance // Molecular Plant Microbe Interaction. 2006. V. 19. P. 838–853.
Park Y.-S. Implementation of conifer somatic embryogenesis in clonal forestry: technical requirements and deployment considerations // Ann. For. Sci. 2002. V. 59. P. 651–656.
Park Y.-S., Lelu-Walter M.A., Harvengt L., Trontin J.F., MacEacheron I., Klimaszewska K., Bonga J.M. Ion of Somatic Embryogenesis in Pinus banksiana, P. strobus, P. pinaster, and P. sylvestris at Three Laboratories in Canada and France // Plant Cell Tissue Organ Cult. 2006. V. 87. P. 87–101.
Park Y.-S., Bonga J., McCartney A., Adams G. Integration of tree biotechnologies into multivarietal forestry // Proc. Third Int. Conf. IUFRO Unit 2.09.02 on Woody Plant Production Integrating Genetic and Vegetative Propagation Technologies, Vitoria – Gasteiz, Spain, 2014. P. 95–97.
Park Y.-S., Beaulieu J., Bousquet J. Multi-varietal forestry integrating genomic selection and somatic embryogenesis // In: Vegetative Propagation of Forest Trees / Eds. Park Y.-S., Bonga J.M., Moon H.-K. Seoul: National Institute of Forest Science (NiFos), 2016. P. 302–322.
Viterbo A.M., Shoresh Y. Brotman I. Chet towards understanding the molecular basis for induced resistance in the Trichoderma – plant interaction / Viterbo A. // In: Proceedings of the Ninth International workshop on Trichoderma and Gliocladium. Vienna, Austria, April, 2006. KS6. P. 6–8.
Woo S.L., Lorito M., Vurro M., Gressel J. Exploiting the interactions between fungal antagonists, pathogens and the plant for biocontrol / Woo S.L. // Novel Biotechnologies for Biocontrol Agent Enhancement and Management. IOS, Springer Press, Amsterdam, the Netherlands. 2007. P. 107–130.
Дополнительные материалы отсутствуют.







