Онтогенез, 2019, T. 50, № 1, стр. 13-27
Эндогенные клеточные источники регенерации сетчатки глаза позвоночных животных и человека
Э. Н. Григорян *
Институт биологии развития им. Н.К. Кольцова, РАН
119334, Москва, ул. Вавилова 26, Россия
* E-mail: leonore@mail.ru
Поступила в редакцию 15.05.2018
После доработки 20.09.2018
Принята к публикации 17.09.2018
Аннотация
Известен ряд различных заболеваний сетчатки, приводящих к снижению зрения и слепоте. В этой связи перед биологией стоит задача с использованием современных методов и различных животных моделей выявить и максимально детально охарактеризовать эндогенные популяции клеток, являющиеся потенциальными источниками регенерации сетчатки. Это позволит найти способы регуляции их поведения, регенерационной активности с целью замещения поврежденных нейронов сетчатки, в частности, фоторецепторов, либо естественным образом, либо при помощи трансплантации. В обзоре суммированы последние данные литературы и собственные сведения автора о локализации, биологии и молекулярно-генетических особенностях клеток источников восстановления сетчатки, выявленных в ряду всех классов позвоночных животных, от рыб до млекопитающих. Обнаружена универсальность существующего набора этих клеточных популяций у позвоночных, их определенное сходство в терминах экспресии генов, а также разнообразие способов использования разными животными для восстановления поврежденной сетчатки глаза.
Ростовая зона глаза, так называемая цилиарная, краевая или маргинальная зона (ЦМЗ) (ciliary marginal zone, CMZ) сетчатки, у низших позвоночных представлена стволовыми клетками и малодифференцированными клетками-предшественниками (Hitchcock, Raymond, 2004) (рис. 1а, 1б). У рыб, личинок амфибий и зародышей птиц в этой области имеет место персистентный нейрогенез, что обеспечивает рост сетчатки с периферии, а также участие этих клеток в регенерации сетчатки (Straznicky, Gaze, 1971; Harris, Perron, 1998; Миташов и др., 2004; Fisher et al., 2013). Клетки этой области способны дифференцироваться во все типы нейронов сетчатки и глиальные клетки. Основные сведения получены на моделях отдельных видов рыб, у взрослых особей которых поддерживается постоянный рост сетчатки (Otteson, Hitchcock, 2003; Raymond et al., 2006; Stenkamp, 2007). В соответствии с ранними данными Памелы Джонс, у золотой рыбки (Carassius auratus) в этой области производится до 12 000 клеток в день и растущая сетчатка оказывается сформирована в основном за счет клеток ЦМЗ (Johns, 1977). Позже клеткам ЦМЗ были даны дополнительные характеристики, полученные в основном на рыбе Danio rerio (Whehman et al., 2005; Raymond et al., 2006). Выяснилось, что в ЦМЗ локализованы не только стволовые клетки, но и клетки-предшественники малого (но разного) уровня дифференцировки, со своими, отражающими этот уровень молекулярными особенностями. Кроме того, эта область представляет собой нишу, способную поддерживать и регулировать активность ретинальных стволовых клеток и их амплифицирующихся потомков в глазу. Выяснено также, что в ЦМЗ Данио-рерио клетки делятся асимметрично в радиальной ориентации (по оси от периферии к центру), что в результате добавляет “кольца” новых клеток в предсуществующую структуру сетчатки (Wan et al., 2016).
Рис. 1.
Строение глаза позвоночных и его цилиарной зоны. (a) – ткани глаза. Задний отдел: МБ – мембрана Бруха, Х – хороид, РПЭ – ретинальный пигментный эпителий, НС – нейральная сетчатка, ВМ – васкулярная мембрана; передний отдел: ЦМЗ – цилиарная маргинальная зона, Хр – хрусталик, ЦТ – цилиарное тело, Р – радужка. (б) – цилиарная зона; I – область локализации стволовых клеток, II – область локализации амплифицирующихся клеток-предшественников, III – область их выхода в дифференцировку в нейроны сетчатки (из Ail, Perron, 2017 с изменениями).

Уровень пролиферативной активности в ЦМЗ является отражением индивидуальных особенностей ростовых процессов глаза у низших позвоночных. У амфибий, как и у рыб, эта зона гетерогенна не только по уровню дифференцировки клеток, но и по такому критерию как продолжительность клеточного цикла (Миташов и др., 2004). У хвостатых амфибий популяция этих клеток (объединенно pars ciliaris и ora serrata) невелика, а их ограниченная пролиферация вносит вклад в медленный рост сетчатки, а также в регенерацию, осуществляемую в основном за счет ретинального пигментного эпителия (РПЭ) (см. ниже). При этом доля участия ЦМЗ в восстановлении сетчатки у тритонов зависит от способа ее повреждения (Григорян, 1998). Если коротко, то максимальный вклад клеток ЦМЗ тритона наблюдается в случае дегенерации сетчатки при перерезке зрительного нерва и кровеносных сосудов, а минимальный – при ретиноэктомии, когда восстановление сетчатки происходит в основном за счет клеток РПЭ. При нормальном очень медленном и незначительном росте глаза у половозрелых тритонов уровень клеточной пролиферации в краевой зоне сетчатки невелик, даже при длительном насыщении клеток зоны тимидиновой меткой выявляется 8–12% меченых клеток (Миташов и др., 2004). В тоже время, при использовании модели длительного культивирования линзэктомированного целого глаза взрослого иглистого тритона Pleurodeles waltli мы наблюдали очень активный рост клеток с периферии, из ЦМЗ на фоне дегенерации центральных областей нейральной сетчатки, происходящей в результате перерезки зрительного нерва и сосудов при выделении глаз (рис. 2а) (неопубликованные данные). Вероятно сравнение в дальнейшем ниш ЦМЗ на этих моделях поможет дать ответ на вопрос, что регулирует активность клеток ЦМЗ.
Рис. 2.
Участие клеток разных тканей глаза взрослого тритона Pleurodeles waltlii в регенерации сетчатки. (а) – рост клеток цилиарной зоны (pars ciliaris + ora serrata) с периферии в сторону центральной сетчатки для замещения дегенерирующих клеток при ротационном 3D культивировании in vitro. Увел.: об. 6.3×, об. 6.4×; (б) – образование дополнительной сетчатки (2) благодаря трансдифференцировке клеток РПЭ и клеточному росту со стороны цилиарной зоны после отслойки исходной (1) сетчатки. Увел.: об. 3.2×, об. 6.4×; (в) – образование стратифицированной сетчатко-подобной структуры из клеток радужки. Увел. об. 6.3×, об. 6.4×.

Безхвостые амфибии, в частности шпорцевые лягушки Xenopus laevis, давно являются широко эксплуатирумой моделью для изучения свойств клеток ЦМЗ и их роли в росте и регенерации сетчатки глаза (Harris, Perron, 1998; Perron et al., 1998). Было показано, что гены, экспрессия которых присуща ранним стадиям развития глаза и ретиногенеза, характерны для наиболее периферической части ЦМЗ, тогда как гены, начинающие свою работу на более продвинутых стадий развития глаза, экспрессируются в клетках, расположенных в ЦМЗ более центрально. Это свидетельствует о том, что события, происходящие в развитии во времени, повторяются пространственно при нейрогенезе в ЦМЗ в уже сформированном глазу (рис. 1б) (Harris, Perron, 1998; Perron et al., 1998). Для бесхвостых амфибий существуют также свидетельства, существующего в ЦМЗ перехода от клеток, экспрессирующих транскрипционный фактор (ТФ) c-myc (фактор плюрипотентности) к n-myc+ (ТФ также развитийный, но более поздний) клеткам по оси от крайней периферии к более центральной области ЦМЗ, от медленно делящихся стволовых клеток к быстро амплифицирующимся клеткам-предшественникам (Xue, Harris, 2012). Исследование экспрессии гомологичных генов в клетках ЦМЗ Danio rerio свидетельствует о том, что переход в экспрессии генов от c-myc к n-myc возможно является универсальным событием для тех низших позвоночных, чья сетчатка растет в течение всей жизни. Таким образом, сохраняющееся кольцо пролиферирующих клеток на периферии сетчатки и есть ЦМЗ, а ее самая крайняя периферическая часть представляет собой ничто иное как область локализации стволовых клеток (рис. 1б). Ключевым отличием хода дифференцировки сетчатки в эмбриональном развитии и росте в постэмбриональный период является разнонаправленность: в развитии дифференцировка сетчатки происходит от центра к периферии, а у взрослых животных в сформированном глазу в ЦМЗ – от периферии к центру (He et al., 2012).
Вклад краевой зоны в развитие и рост сетчатки, а также ее объемы сокращаются в эволюционном ряду. Если у представителей рыб и амфибий клетки крайней периферии сетчатки имеют отчетливые характеристики стволовых клеток и недифференцированных предшественников, а также весьма значительные объемы популяций, то у рептилий, птиц и млекопитающих эта область значительно редуцируется, однако ее клетки все же сохраняют отдельные молекулярные признаки низкого уровня дифференцировки (Fischer et al., 2013).
Относительно недавно появилась работа, которая дает первые свидетельства присутствия у рептилий области подобной ЦМЗ рыб и амфибий (Todd et al., 2016). У взрослых черепах в краевой области сетчатки обнаруживаются пролиферирующие PCNA+ (маркер, ядерный антиген пролиферирующих клеток) клетки. Исследование только начато и пока нет ответа на вопрос об их участии в росте сетчатки глаза или ее регенерации у черепах (Todd et al., 2016).
Область ЦМЗ глаза цыпленка подобна таковой рыб и амфибий, однако формируется почти полностью до вылупления, а вклад ее в рост сетчатки незначителен (Prada et al., 1991; Fischer, 2005). У птиц во взрослом состоянии, несмотря на то, что эта зона сетчатки полностью не исчезает, продукция ею новых дополнительных нейронов и глии также очень ограничена (Fischer, Reh, 2000; Fischer et al., 2002; Kubota et al., 2002). При этом стимулирование пролиферации клеток ЦМЗ у цыпленка после вылупления с помощью ростовых факторов IGF-1, EGF, а также инсулина способно увеличить их число (Fisher, Reh, 2000).
На протяжении длительного времени полагали, что ЦМЗ в сетчатке взрослых млекопитающих и человека полностью отсутствует, также как и возможность участия клеток этой зоны в росте сетчатки при ее развитии или регенерации. Однако, недавнее тщательное исследование поведения клеток краевой зоны сетчатки в эмбриональном развитии мышей показало наличие в ней ограниченного нейрогенеза с формированием ганглиозных клеток (Marcucci et al., 2016). Зависимый от циклина Д2 (Cyclin D2) процесс образования новых клеток, имеет двунаправленный характер, т.е. в результате деления происходит смещение образующихся клеток в сторону ганглиозного слоя и в сторону края сетчатки.
Есть работа, свидетельствующая о том, что краевая область сетчатки взрослых млекопитающих, представленная pars plana, плоским слоем клеток, прилежащих к сетчатке с одной стороны и контактирущим с цилиарным телом – с другой, сохраняет нейрогенный потенциал (Kiyama et al., 2012). Образующиеся при этом в pars plana клетки являются непигментированными, и, таким образом, хорошо отличимы от пигментированных клеток цилиарного тела. Результаты исследования дополнительно показали, что эта область сетчатки взрослых мышей содержит клетки, обладающие экспрессией гена Atoh7, надежного маркера нейрогенеза, что, как предполагается, является отражением автономного ответа этих клеток на потери ганглиозных клеток в ходе развития сетчатки (Kiyama et al., 2012). В развивающейся сетчатке ген Atoh7 активируется непосредственно перед и в процессе М фазы клеточного цикла (Le et al., 2006). При направленном устранении части клеток ганглиозного слоя сетчатки потенциал клеток к продолжающемуся нейрогенезу в pars plana реализуется, что приводит к пополнению популяции ганглиозных клеток (Kiyama et al., 2012).
В целом же регенерационная активность тканей так называемого “угла глаза” у млекопитающих крайне ограничена (Karl et al., 2008): в норме клетки цилиарного тела и прилежащего к нему края сетчатки глаза взрослых млекопитающих находятся в покое (рис. 1а). Однако, в условиях изоляции и пермиссивных условиях in vitro могут быть активированы к входу в S-фазу и проявить свой потенциал к нейрогенезу. В начале века вышли громкие работы, свидетельствующие о наличии стволовых клеток глаза у млекопитающих и человека (Ahmad et al., 2000; Tropepe et al., 2000; Coles et al., 2004). Авторы этих работ обнаружили, что эпителиальные клетки, расположенные в пигментированном листке цилиарного тела глаза млекопитающих, в эксперименте могут демонстрировать свойства “стволовости”. В условиях in vitro эти клетки формировали сфероиды (свойство характерное для нейральных стволовых леток), пролиферировали, экспрессировали маркерный белок стволовых клеток – нестин и ТФ Pax6. Ген Pax6 является ключевым мастер геном в развитии глаза и его морфогенезе у всех без исключения позвоночных животных (см. например обзор: Shaham et al., 2012). Известно также, что Pax6 опосредованная трансдифференцировка пигментированного эпителия может быть индуцирована как на ранних, так и поздних стадиях развития глаза (Azuma et al., 2005). В работах с цилиарным телом взрослых млекопитающих помимо Pax6 в отдельных случаях обнаруживались клетки, экспрессирующие белки маркеры ретинальных нейронов, в частности, фоторецепторов. Однако, крайне низкое число пигментированных эпителиальных клеток цилиарного тела с признаками “стволовости”, а также еще более низкая продукция ими ретинальных предшественников, разрушили возникшие было большие надежды на их использование в практических целях (Gualdoni et al., 2010). Тем не менее попытки молекулярно-генетической регуляции их поведения, с целью увеличения числа получаемых нейронов для последующей трансплантации все еще имеют место (Inoue et al., 2010; Ballios et al., 2012).
Появились также строгие доказательства того, что эти клетки обладают только отдельными свойствами стволовых (см. выше), но истинно стволовыми клетками не являются (Cicero et al., 2009). Согласно данным работы Цицеро и соавт. даже в сфероидах in vitro, несмотря на то, что все клетки пролиферируют, они не теряют молекулярных, клеточных свойств в разной степени дифференцированных пигментированных эпителиальных клеток цилиарного тела. Они сохраняют пигмент, а также интердигитацию и эпителиальный характер простых контактов, т.е. свойства, присущие дифференцированному пигментированному эпителию цилиарного тела. При добавлении in vitro ростовых факторов, эти клетки экспрессируют нестин и ßIII-тубулин (пан-нейрональный маркер), и даже (абберантно) нейральные маркеры, но не дифференцируются в ретинальные нейроны ни in vitro, ни in vivo. В других работах (Frøen et al., 2013) факт присутствия истинно стволовых клеток в цилиарном теле высших позвоночных и человека также ставится под сомнение. Подчеркивается, что в свете существующих сегодня данных, цилиарный эпителий взрослого человека не содержит “bona fide” стволовых клеток, а имеет только популяцию эпителиальных клеток, обладающих пластичностью in vitro, в свою очередь отражающей их нейроэпителиальное происхождение (Frøen et al., 2013).
В последнее десятилетие клетки ЦМЗ низших позвоночных и гомологичной ей области у высших (цилирное тело и ряд прилежащих к нему клеток края сетчатки) интенсивно изучались в отношении их генетического профиля, в частности исследовалась экспрессия ассоциированных с нейрогенезом ТФ. Параллельно изучались регуляторные сигнальные пути, активирующие и блокирующие нейрогенез (Moshiri et al., 2004; Raymond et al., 2006; Borday et al., 2012; Cerveny et al., 2012). В настоящее время выяснено, что к выявленным в этих областях ТФ, ответственным за проявление нейрогенного потенциала, принадлежат в основном те, что присущи клеткам области глазного поля в развитии (Zuber et al., 2003). Их спектр кодируется гомеобоксными генами Pax6 и Rx, членами семейства гомеобоксных генов sine oculis, Six3, а также LIM-гомеобоксным геном Lhx. Этот список может быть дополнен генами Chx10 (vsx2 у рыб), Crx, Pitx и некоторыми другими, также работающим на ранних этапах развития глаза (Wang, Harris, 2005). Таким образом, ЦМЗ и цилиарное тело, как гомологичные структуры, формирующиеся поздно в органогенезе глаза позвоночных, в той или иной степени сохраняют онтогенетические черты, в частности черты молекулярно-генетического профиля, присущего развитию тканей глаза позвоночных.
РЕТИНАЛЬНЫЙ ПИГМЕНТНЫЙ ЭПИТЕЛИЙ И РАДУЖКА ГЛАЗА ПОЗВОНОЧНЫХ ЖИВОТНЫХ
В специальном исследовании потенций ретинального пигментного эпителия (РПЭ) было показано отсутствие его участия в регенерации сетчатки у рыб (Knight, Raymond, 1995). Точка зрения о неучастии РПЭ в регенерации сетчатки у взрослых рыб сохраняется и до сих пор (Ail, Perron, 2017), хотя нельзя исключить появления в будущем новых сведений при использовании других модельных объектов животных этого класса.
РПЭ амфибий, напротив, обладает очень высокой способностью к регенерации сетчатки и демонстрирует яркий, ставший уже классическим, пример трансдифференцировки (естественного репрограммирования) in vivo. Эта ткань, располагающаяся между нейральной сетчаткой и сосудистой оболочкой (рис. 1а) и участвующая в зрительной функции сетчатки, способна конвертироваться в нейроны и глиальные клетки. После повреждения и даже удаления исходной сетчатки РПЭ способен стать источником для воспроизводства новой, структурно и функционально полноценной сетчатки (см. обзоры: Keefe, 1973; Stroeva, Mitashov, 1983; Mitashov, 1996; Григорян, 1998; Chiba, Mitashov, 2007; Yasumuro et al., 2017). Основными событиями на пути этого превращения являются: выход клеток из слоя РПЭ, их репрограммирование – постепенная потеря исходных фенотипических черт, клеточная амплификация, формирование промежуточной популяции нейроэпителиальных клеток (нейробластов) и затем дифференцировка – приобретение клетками этой транзитной популяции черт всех типов нейронов и глии. Все этапы описаны не только морфологически, но и с позиций молекулярно-генетических изменений (Маркитантова и др., 2004; Sakami et al., 2005; Chiba, Mitashov, 2007; Авдонин и др., 2008, 2010; Nakamura et al., 2014; Casco-Robles et al., 2016; Yasumuro et al., 2017). Мы проанализировали клеточные свойства и молекулярно-генетический профиль РПЭ взрослых тритонов (Григорян, 2015; Grigoryan, Markitantova, 2016) и пришли к заключению, что эти клетки морфологически полностью специализированные для выполнения своей зрительной функции, с точки зрения профиля экспрессии ряда генов и белков, могут быть отнесены к категории клеток с “молодым” фенотипом. В них поддерживается экспрессия генов раннего развития глаза (Рах6, Pitx1, Hes1) наряду cо генами, специфичными для специализации РПЭ (RPE65, Otx2, Mitf). В РПЭ присутствуют некоторые эпигенетические признаки клеток-предшественников, например, экспрессия кодируемого геном Ns нуклеостемина, регулятора транскрипционной активности, характерного для стволовых и малодифференцированных клеток (Маркитантова и др., 2014, 2015; Grigoryan, Markitantova, 2016). При отслойке сетчатки у взрослого тритона, клетки РПЭ в некоторых случаях способны как к формированию дополнительной сетчатки (рис. 2б), так и локальному клеточному замещению индивидуальных, погибающих фоторецепторов исходной сетчатки (Григорян, Миташов, 1985; Grigoryan, 2012).
Потенции клеток РПЭ в качестве клеток предшественников для восстановления сетчатки были изучены также на моделях бесхвостых амфибий и только недавно было выяснено, что и у взрослых лягушек эти потенции сохраняются, однако способ регенерации сетчатки за счет РПЭ – иной. Так, ранее полагали, что у шпорцевой лягушки Xenopus laevis способность клеток РПЭ к репрограммированию после метаморфоза теряется. Но позже выяснилось, что при сохранении васкулярной мембраны сетчатки (ВМ) (богатая капиллярами базальная мембрана, ограничивающая внутренний край сетчатки) (рис. 1а) трансдифференцировка РПЭ и формирование сетчатки оказываются возможны (Yoshii et al., 2007; Araki et al., 2007). Клетки покидают слой РПЭ мигрируют в сторону ВМ, экспрессируют ТФ Pax6, пролиферируют и формируют нейроэпителиальный слой, который в результате роста и дифференцировки клеток формирует новую сетчатку.
Несомненно утеря связи со слоем РПЭ и мембраной Бруха является в этом и других случаях событием, промотирующим регенеративный ответ клеток РПЭ. Интересно, что у млекопитающих и человека это событие провоцирует эпителиомезенхимный переход клеток РПЭ, появление клеток с признаками мезенхимной дифференцировки, формирующими наряду с глиальными клетками структуру, напоминающую рубец, – причину патологии сетчатки при пролиферативной витреоретинопатии (PVR) у млекопитающих (Kirchhoff, Sorgente, 1989; Grigoryan, 2012; Nabeshima et al., 2013; Chiba, 2014). У альбиносов шпорцевой лягушки после удаления сетчатки РПЭ способен к ограниченной пролиферации в отдельных сайтах слоя с формированием сетчатко-подобных структур, групп клеток, демонстрирующих морфологические особенности фоторецепторов и ганглиозных клеток (Свистунов, Миташов, 1983). У другого вида лягушек X. tropicalis, регенерация сетчатки происходит за счет клеток ЦМЗ (Miyaki, Araki, 2014). Все это свидетельствует о разнообразии используемых механизмов регенерации и в то же время о единообразии существующих источников не только в разных классах животных, но и у разных видов одного класса.
У цыпленка процесс регенерации сетчатки из РПЭ был вначале описан морфологически в работе Куломбров (Coulombre, Coulombre, 1965). Значительно позже было показано, что в присутствии ростового фактора фибробластов (FGF2) клетки РПЭ цыпленка депигментируются, пролиферируют, формируют нейроэпителий, а затем и слой нейробластов, экспрессирующих пронейральные маркеры, ТФ – Pax6 и Chx10, регулируемые FGF2-FGFR/MEK/Erk сигнальным каскадом (Spence et al., 2007). При естественном репрограммировании РПЭ, как и у тритона (Chiba, Mitashov, 2007), у цыпленка происходит down-регуляция специфического белка RPE65 и ответственного за меланогенную дифференцировку ТФ Mitf, являющихся специфическими маркерами этой ткани (Spence et al., 2007). Ранее на той же модели в процессах конверсии РПЭ выявлено участие Shh (Spence et al., 2004), а позже – BMP и Wnt сигнальных путей (Steinfeld et al., 2017). В последней работе интересно то, что на стадии сформированных двух проспективных листков зачатка заднего отдела глаза цыпленка (РПЭ и нейральной сетчатки) низкая концентрация BMP приводит к репрограммированию РПЭ, а высокая, напротив, к конверсии клеток эмбриональной сетчатки в РПЭ (Steinfeld et al., 2017).
На модели регенерации сетчатки у цыпленка в еще не начавших пролиферацию клетках РПЭ обнаружены факторы плюрипотентности (Sox2, c-myc и Klf4), наряду с ТФ глазного поля в развитии, в том числе Pax6. Однако, как выяснилось, для репрограммирования РПЭ и регенерации сетчатки у цыпленка дополнительно требуется связывающийся с РНК белок Lin-28 в качестве мишени для действия FGF2. Однако сверхэкспрессия Lin-28 приводит к трансформации клеточного фенотипа РПЭ и в отсутствие FGF2 (Luz-Madrigal et al., 2014).
Известно, что в РПЭ взрослых млекопитающих, так же как и в РПЭ тритонов в норме имеет место низкий уровень пролиферативной активности, приуроченный, как правило к периферии слоя (см. обзор: Григорян, 2015). Но если у тритонов на 4–7 дни после любого вида разобщения РПЭ с нейральной сетчаткой клетки еще в слое РПЭ входят в S-фазу, то у высших позвоночных этого не происходит. РПЭ взрослых млекопитающих и человека не способен к восстановлению сетчатки, а провоцирующий репрограммирование выход клеток из слоя, как мы упомянули выше, приводит у человека к патологическим изменениям, в частности пролиферативной ретинопатии (Kirchhoff, Sorgente, 1989; Grigoryan, 2012; Chiba, 2014). Недавно с помощью техники нокдауна гена Pax6 у личинок тритона показана его значительная роль в выборе пути: в нейральном у тритона или мезенхимном направлении при патологии у млекопитающих и человека (Casco-Robles, 2016).
Изучение РПЭ взрослых грызунов (Engelgardt et al., 2005) и человека (Милюшина и др., 2009; Кузнецова и др., 2011) в условиях in vitro демонстрирует сохранение потенций к дедифференцировке, репрограммированию, пролиферации и продукции нейронов. В работе Салеро и др. (Salero et al., 2015) в условиях in vitro дополнительно показано, что клетки РПЭ человека способны не только к продукции нейронов сетчатки, но и клеток мезенхимной дифференцировки, демонстрируя тем самым заложенную в них компетенцию, приводящую у человека к развитию патологий сетчатки. Эта широкая и плодотворная область исследований РПЭ in vitro находится за пределами данного обзора, так как здесь мы придерживаемся изложения поиска эндогенных потенциальных источников регенерации сетчатки in vivo.
Основываясь на результатах экспериментов in vitro, пигментированные эпителиальные клетки радужки (топологически – продолжение РПЭ в передней части глаза) млекопитающих также принято рассматривать в качестве эндогенного ресурса для восстановления (рис. 1а). Эти клетки, как и РПЭ, в условиях культивирования демонстрируют отдельные свойства стволовых клеток и ранних прогениторов (Engelgard et al., 2005; Sun et al., 2006). Изолированные клетки радужки постнатальных грызунов способны формировать сфероиды, где они пролиферируют и экспрессируют маркеры ретинальных клеток-предшественников, а при переносе на ламининовый субстрат дедифференцированные клетки радужки приобретают нейрональный, в том числе ретинальный, а также РПЭ – подобный клеточные фенотипы (Sun et al., 2006). Это дало основание для аргументации и попыток трансплантации этих клеток для замещения клеток РПЭ, в том числе у пациентов, страдающих макулярной дегенерацией сетчатки (Abe et al., 2007). Аутологичные клетки радужки были обнаружены в субретинальном пространстве, где приобретали дифференцировку, характерную для РПЭ, и были способны к поглощению наружных сегментов фоторецепторов. Для получения клеток с фоторецепторным фенотипом делались попытки переноса в клетки радужки гомеобоксных, ассоциированных с фоторецепторной дифференцировкой, генов (Abe et al., 2007).
В условиях in vivo процесс конверсии клеток радужки взрослого глаза в клетки сетчатки у позвоночных не был отмечен. Однако хорошо известный факт общего происхождения РПЭ, радужки и сетчатки в развитии дает основания предполагать такую вероятность. Однако при этом следует упомянуть также, что в развитии радужки (как и других тканей глаза), в разной степени принимает участие окологлазная мезенхима и клетки нервного гребня (Soules, Link, 2005; Williams, Bohnsack, 2015), что может иметь влияние на проявление пластических свойств клеток радужки. Только однажды нам удалось наблюдать формирование сетчатко-подобной стратифицированной структуры из клеток радужки у тритонов с подсаженным в полость линзэктомированного глаза фрагментом РПЭ. Образование таких “сетчаткоидов” происходило благодаря конверсии клеток внутреннего листка радужки и участию клеток ее цилиарной зоны (рис. 2в) (Григорян, Миташов, 1985).
НЕДОДИФФЕРЕНЦИРОВАННЫЕ КЛЕТКИ ПРЕДШЕСТВЕННИКИ В СЕТЧАТКЕ ГЛАЗА ПОЗВОНОЧНЫХ
В настоящее время постепенно рушится догма, в соответствии с которой все нейроны сетчатки являются постмитотическими, высоко специализированными клетками, достигшими терминальной стадии дифференцировки. Однако даже при рассмотрении сетчатки взрослых позвоночных, где дифференцировка клеток жестко закреплена окружением, и отсутствуют возможности для пролиферации и миграции, мы находим примеры т.н. фенотипической недодифференцировки (underdifferentiated cells), делающей клетки потенциально способными к клеточному замещению и участию в восстановлении сетчатки. В ходе наблюдений за развитием сетчатки Danio rerio, процессами нейрогенеза, миграции и дифференцировки клеток, показано, что для некоторых типов биполяров данная последовательность процессов не соблюдается когортно с другими типами интернейронов. Их предшественники претерпевают последние митотические деления на фоне далеко зашедшей дифференцировки других типов клеток внутренней сетчатки и находятся в фактически зрелой сетчатке среди нейронов, давно осуществивших специализацию (Engerer et al., 2017). Помимо этих данных, полученных на костистой рыбке Danio rerio, есть некоторые свидетельства присутствия недодифференцированных клеток и у представителя хрящевых рыб – акулы. Сообщается о присутствии в дифференцированных слоях сетчатки акулы Scyliorhinus canicula клеток, обладающих экспрессией белка цитоскелета даблкортина (doublecortin, DCX), известного как “золотой стандарт” при маркировании нейрональных предшественников и молодых мигрирующих нейронов. Эти клетки обнаруживаются как у молодых, так и взрослых акул во внутренней сетчатке, среди клеток, уже покинувших клеточный цикл (Sanchez-Farias, Candal, 2015). Для тритонов, помимо рассмотренного выше РПЭ, источником восполнения фоторецепторов (например, при отслойке сетчатки) могут служить биполяро-подобные клетки, с колбой Ландольта (дендрит), локализующиеся на границе между наружным и внутренним ядерными слоями сетчатки. С помощью электронной микроскопии и на серийных полутонких срезах, а также при окрашивании антителами против фоторецепторого маркера рековерина (recoverin) мы показали возможность миграции этих клеток в фоторецепторный слой, формирование фоторецепторного наружного сегмента благодаря дальнейшей дифференцировке дендрита, колбы Ландольта в наружный сегмент палочек, с последующим замещением дегенерирующих в результате отслойки фоторецепторов этого типа (Григорян и др., 1996; Grigoryan, 2007).
В недавней работе Чен и соавторам (Chen et al., 2015) при использовании маркера тканевых стволовых клеток – связывающего G-белок рецептора 5, Lgr5 (leucine-rich repeat-containing G-protein-coupled receptor 5), удалось обнаружить экспрессирующие Lgr5 клетки во внутренней сетчатке мыши. Маркированные клетки можно было увидеть на поздних стадиях ретиногенеза, а также в сетчатке взрослых особей в популяциях амакриновых клеток (интернейроны внутреннего ядерного слоя). Более того, как утверждают авторы, Lgr5+ клетки способны вносить вклад в численность популяции нейронов, в частности, ганглиозных и глиальных клеток. Число их очень мало (выявлено 94 клетки на 62 среза сетчатки), они отсутствуют в краевых областях сетчатки, обладают всеми атрибутами специализированных нейронов, а замещение осуществляют за счет конверсии через дедифференцированное состояние (Chen et al., 2015). Экспрессия в постнатальный период Lgr5+ клеток среди дифференцированных амакриновых интернейронов была выявлена и в другой работе, где была прослежена связь экспрессии рецептора Lgr5 с Wnt сигнализированием, но не обсуждался вопрос клеточного замещения за счет экспрессирующих клеток Lgr5 (Sukhdeo et al., 2014). В нестратифицированной, периферической сетчатке обезьян и человека также выявлены клетки, фенотип которых различается по глубине дифференцировки. Это позволяет авторам работы (Martínez-Navarrete et al., 2008) предполагать возможность замещения за счет некоторых из них поврежденных нейронов сетчатки. Отметим, что доминирующей областью обнаружения клеток, претендующих на роль дополнительных источников восстановления нейронов сетчатки, является ее внутренний ядерный слой (слой интернейронов), который у многих позвоночных является последней, формирующейся в процессе ретиногенеза, то есть наиболее молодой, стратой. Однако пока нет никаких сведений о молекулярно-генетическом профиле таких клеток, подтверждающем их статус предшественников.
ГЛИАЛЬНЫЕ КЛЕТКИ МЮЛЛЕРА СЕТЧАТКИ ГЛАЗА ПОЗВОНОЧНЫХ
Наблюдения за нейральными стволовыми клетками, обнаруженными в областях взрослого мозга и имеющими свойства стволовых, но при этом фенотип близкий глиальным клеткам (Götz et al., 2015), дали основание для активного изучения регенеративного потенциала глиальных клеток сетчатки (рис. 3а, 3б). Ими являются широко исследуемые в настоящее время клетки Мюллеровской глии (МГ) (Lenkowski, Raymond, 2014; Goldman, 2014; Hamon et al., 2016). Они известны как источник восстановления сетчатки у рыб, птиц до и сразу после вылупления. У высших позвоночных в ответ на повреждение сетчатки МГ как правило отвечает реактивным глиозом, проявляющимся в пролиферации, увеличении своей популяции и размеров длинных отростков этих клеток (см. обзор: deHoz et al., 2017). Реактивный глиоз является сопровождением очень многих патологических состояний сетчатки (Bringmann et al., 2009). В норме клетки МГ высоко специализированы, выполняют ряд важных функций (структурную, нейротрофическую, включены в систему очистки сетчатки и процесс проведения света), обладают большим числом связей со всеми типами нейронов сетчатки. У рыб при росте глаза они поддерживают линию фоторецепторов палочек; при регенерации способны дать популяцию предшественников для фоторецепторов и ганглиозных клеток (рис. 3б) (Lenkowski, Raymond, 2014). История выявления участия клеток Мюллера в образовании фоторецепторов (палочек) у рыб интересна сама по себе. Вначале полагали, что во внутреннем ядерном слое сетчатки рыб находятся клетки-предшественники, так называемая линия фоторецепторов палочек (rod photoreceptor lineage) (см. обзор Stenkamp, 2007). Эти клетки были способны пролиферировать и мигрировать в наружный ядерный слой (слой локализации тел фоторецепторных клеток), продуцируя новые фоторецепторы – палочки. Помимо этого отмечалось присутствие пролиферирующих клеток в близкой к клеткам родоначальньцам локализации, экспрессирующих ТФ Pax6. Пролиферация клеток – основы линии была медленной и выявлялась только при насыщении маркерными предшественниками синтеза ДНК – BrdU или 3H-тимидином (Otteson et al., 2001). Именно эти клетки были позднее идентифицированы как глиальные клетки Мюллера, а линия Pax6+ пролиферирующих клеток – их потомками (Bernados et al., 2007). При обсуждении источника регенерации также вначале полагали, что клетки, являющиеся предшественниками палочек не только служат пополнению популяции палочек растущего глаза рыб, но и являются уникальным резервом для восстановления сетчатки после повреждения (Raymond et al., 1988), однако в настоящее время и на эту роль претендуют клетки Мюллера (Lenkowski, Raymond, 2014).
Рис. 3.
Клетки Мюллеровской глии как потенциальный источник роста и регенерации сетчатки позвоночных животных. (a) – клетки Мюллера среди других нейронов в структуре сетчатки глаза позвоночных. РПЭ – ретинальный пигментный эпителий, П – палочка, К – колбочка, М – клетка Мюллера, Г – горизонтальная клетка, Б – биполяр, Г – ганглиозная клетка, А – астроцит, МИ – микроглиальная клетка. (б) – шаги конверсии клеток Мюллера при росте и регенерации сетчатки. 1 – нативная клетка Мюллера, 2 – клетка, вступившая на путь конверсии и начавшая пролиферацию с образованием клеток предшественников, 3 – формирование новых клеток из клеток предшественников в возможных пяти направлениях: 4 – фоторецепторов, интернейронов, ганглиозных клеток, а также новых клеток Мюллера и клеток предшественников (из Ail, Perron, 2017 с изменениями).
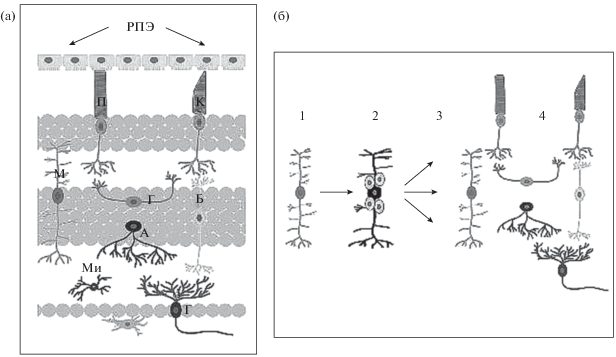
У тритонов популяция клеток МГ в сетчатке выявляется легко, благодаря большим размерам клеток и их характерной морфологии. В ряде экспериментов с отслойкой сетчатки (микрохирургической, либо в результате линзэктомии) и в условиях низкой дозы гравитации мы наблюдали явления, имеющие отношение к реактивному глиозу: пролиферацию, увеличение численности, увеличение толщины длинных отростков и усиление экспрессии в них специфического глиального белка GFAP (Grigoryan et al., 2012). Регенерации сетчатки у тритонов, где источником были бы клетки Мюллера, наблюдать не удалось. Высокая регенерационная активность клеток РПЭ, а также ЦМЗ при повреждении сетчатки у хвостатых амфибий возможно приводили к работе молекулярного сигнального механизма, блокирующего регенерационные ответы клеток Мюллера. Взаимная конкуренция в участии в регенерации сетчатки различных клеточных источников в разных классах и даже у разных видов животных, а также разных способах ее повреждения, зависит от факторов, регулирующих поведение клеток и их мобилизацию к регенеративным ответам. Этот вопрос представляет в целом большой научный и практический интерес.
У птиц после вылупления можно наблюдать регенерационную активность клеток, МГ, но уже при направленной индукции такого ответа (Fisher et al., 2002). Стимулирующим эффектом в направлении фенотипических изменений и пролиферации клеток МГ обладали введенные вовнутрь нормального глаза цыпленка FGF2 и инсулин (Fisher et al., 2002). У млекопитающих эти клетки способны экспрессировать “пронейральные” гены и ТФ нейральных предшественников (Roesch et al., 2008). Недавно c помощью создания адекватных эпигенетических условий и сверхэкспрессии гена Ascl1 в разрушенной нейротоксином сетчатке удалось индуцировать нейрогенез в популяции МГ у взрослых мышей (Jorstad et al., 2017). Другими словами авторы добились регенеративного ответа клеток МГ в сетчатке мышей, чей нейрогенный потенциал был исчерпан. Было выяснено также, что зависимость от возраста связана с потерей доступа специально трансфицированного для активации клеток МГ гена Ascl1 к хроматину из-за некоего эпигенетического фактора, что и лимитировало регенерацию. Ингибитор деацетилазы гистонов увеличил доступ к ключевым участкам генов клеток МГ. Тем самым была обеспечена возможность продукции недифференцированными потомками клеток МГ нейронов для регенерации сетчатки. Последние не только демонстрировали спектр маркерных белков интернейронов, но и формировали синапсы с предсуществующими нейронами, а также отвечали на стимуляцию светом (Jorstad et al., 2017). Эта и другие работы последних лет в данном направлении (Pollak et al., 2013; Zhao et al., 2017), связанные с популяцией МГ как потенциального источника восстановления сетчатки у взрослых млекопитающих и человека, дают надежду на решение вопроса репарации сетчатки за счет рекрутирования данного эдогенного ресурса.
In vitro клетки МГ репрограммируются в предшественники ретинальных нейронов и фоторецепторов (Giannelli et al., 2011). In vivo, под влиянием со стороны экзогенно добавленных компонентов EGF, FGF, Notch, Wnt и Shh сигнальных путей, большое число клеток Мюллера сетчатки высших позвоночных может быть активировано к входу в S-фазу и проявлению отдельных свойств ретинальных прогениторов (Fisher et al., 2002; Close et al., 2006; Osakada et al., 2007; Wan et al., 2007; Del Debbio et al., 2010; Liu et al., 2013). Данные, полученные, в частности, на сетчатке человека, свидетельствуют о том, что в ответ на повреждение сетчатки и стимуляцию пролиферации возможна экспрессия в клетках МГ некоторых генов проретинальных клеток-предшественников, в том числе Pax6 и Sox2 (Bhatia et al., 2011).
С помощью иммунохимии и электронной микроскопии у рыб (Bernardos et al., 2007) и кролика (Lewis, 2010) был детально описан и способ деления ядра клеток МГ. Этими работами была показана возможность асимметричного митоза дифференцированных, глубоко специализированных клеток в системе жестко закрепленных межклеточных связей в нейральной ткани.
Возможность конверсии клеток МГ сетчатки в пронейральные предшественники и даже нейроны не является неожиданностью, если учесть общность происхождения этих типов клеток в развитии. Еще в 1987 г. было выяснено, что в развитии сетчатки мыши в ее ткани долго сохраняется присутствие общего предшественника для нейронов и макроглиальных клеток Мюллера (Turner, Cepko, 1987). Известно также, что МГ является одним из последних клеточных типов, созревающих в развитии сетчатки (Jadhav et al., 2009), т.е. “молодым фенотипом”, несмотря на глубокую и завершенную их специализацию.
КЛЕТКИ КОСТНОГО МОЗГА КАК ВОЗМОЖНЫЙ УЧАСТНИК ВОCСТАНОВЛЕНИЯ СЕТЧАТКИ ПОСЛЕ ПОВРЕЖДЕНИЯ
Совсем недавно обнаружено, что клетки МГ мыши способны претерпевать конверсию в нейроны при участии стволовых эндогенных клеток костного мозга (КМ) (Pesaresi et al., 2018). В этом исследовании была использована модель повреждения сетчатки нейротоксином NMDA (N-метил-D-аспартат), при котором гибнут ганглиозные и амакриновые клетки сетчатки. Это в свою очередь приводит к мобилизации клеток КМ и параллельно к дедифференцировке и пролиферации клеток МГ. Эти клеточные типы претерпевали слияние, образуя гибриды, способные к дифференцировке и замещению претерпевших апоптоз нейронов сетчатки. Ранее также появлялись (однако до сих пор строго не подтверждены) свидетельства того, что клетки КМ способны и сами по себе дифференцироваться в ретинальные клетки в поврежденной сетчатке крысы (Tomita et al., 2002). Помимо этого, выяснено, что клетки РПЭ при повреждении продуцируют хемоаттрактанты, способствующие миграции стволовых клеток КМ в область клеточной гибели, в субретинальное пространство. В этой локализации возможна их дифференцировка в РПЭ, регистируемая в свою очередь с помощью выявления экспресси специфических маркеров РПЭ, для замещения погибших клеток слоя (Li et al., 2006, 2007). Эти данные подтверждаются и работой (Machalinska et al., 2011), также оценивающей рекрутирование клеток КМ при повреждении слоя РПЭ, как один из способов обеспечения регенерации РПЭ.
ЗАКЛЮЧЕНИЕ
Последние 20 лет на волне большого интереса к стволовым клеткам был осуществлен активный их поиск в тканях глаза. В результате стало понятно, что не одна, а несколько популяций клеток сетчатки глаз позвоночных являются (или претендуют) на эту роль. Они могут быть стволовыми, либо иметь отдельные признаки “стволовости” или малой дифференцировки, либо являться латентными дифференцированными прогениторами. Эти популяции и составляют пулы эндогенных клеток источников для регенерации сетчатки после ее повреждения. Они обнаружены в дифференцированной части сетчатки (клетки Мюллеровской глии), в краевой нестратифицированной зоне сетчатки, в цилиарной области глаза, в ретинальном пигментном эпителии и радужке глаз позвоночных животных. Для высших позвоночных и человека наиболее охарактеризованной и перспективной для практического использования на сегодня является популяция глиальных клеток Мюллера, тела которых расположены во внутреннем ядерном слое сетчатки среди интернейронов (рис. 3а, 3б). Следующими по перспективности использования являются клетки РПЭ, однако их изучение у высших позвоночных в данном аспекте ведется в основном in vitro, а у низших – на недостаточном числе моделей in vivo. Потенции клеток пигментного эпителия цилиарного тела высших позвоночных и человека, способные проявить отдельные свойства стволовых клеток in vitro, оказались очень ограничены как в отношении самообновления, так и проявления ретинальной дифференцировки. Тем не менее попытки молекулярно-генетической регуляции их поведения, с целью увеличения числа получаемых нейронов для последующей трансплантации все еще имеют место. Изучение резидентных клеток КМ в отношении возможности их участия в восстановлении сетчатки пока изучено не достаточно и требует использования большего числа моделей и методов.
Все изученные эндогенные клетки-предшественники, в условиях in vivo у низших и in vitro (выделенные) у высших позвоночных демонстрируют пролиферацию и нейрогенные свойства. При этом они обнаруживают идентичность в экспрессии маркеров ретинальных клеток-предшественников, в частности генов и ТФ – маркеров “глазного поля” в развитии глаза и пролиферативную активность. Эти регенеративные ответы могут быть активированы разными способами: введением стимуляторов, в том числе компонентов сигнальных путей, участвующих в ретиногенезе, или генетически, путем трансфекции генов, характерных для раннего развития глаза, а также путем изменения эпигенетических условий.
Надо также подчеркнуть, что все же имеет место не широкое разнообразие различных потенциальных клеток источников, но, напротив, ограниченный и универсальный их ряд. Он обусловлен сходным ходом развития тканей задней стенки глаза всех позвоночных, где клетки имеют разные скорости созревания. Как результат, те клетки, что задержаны в развитии, могут сохранять отдельные молекулярно-генетичекие и эпигенетические свойства, способствующие к входу в S-фазу, пролиферации, репрограммированию и формированию нейронов сетчатки, в том числе фоторецепторов. При восстановлении сетчатки в разных классах животных и даже у разных видов можно наблюдать разные способы регенерации с участием тех или иных, но ограниченых приведенным выше спектром клеток-предшественников. Дальнейшие исследования вряд ли пополнят этот ряд, но обязательно, благодаря все более глубокому изучению молекулярно-генетических особенностей клеток-предшественников для регенерации и разработке способов регуляции их поведения, дадут ключи к практическому их использованию.
Работа выполнена в рамках раздела Государственного задания ИБР РАН, № 0108-2018-0003.
Список литературы
Авдонин П.П., Григорян Э.Н., Маркитантова Ю.В. Транскрипционный фактор Pitx2: локализация при регенерации сетчатки тритона // Изв. РАН. Сер. биол. 2010. Т. 435. № 3. С. 283–288.
Авдонин П.П., Маркитантова Ю.В., Зиновьева Р.Д., Миташов В.И. Экспрессия регуляторных генов Pax6, Otx2, Six3 и FGF2 в процессе регенерации сетчатки у тритона // Изв. РАН. Сер. биол. 2008. № 4. С. 414–421.
Григорян Э.Н. Цитологические основы трансдифференцировки в тканях глаза позвоночных. Дис. … докт. биол. наук. М.: ИБР РАН, 1998. 504 с.
Григорян Э.Н. Факторы компетенции клеток ретинального пигментного эпителия для репрограммирования в нейрональном направлении при регенерации сетчатки у тритонов // Известия РАН. Сер. биол. 2015. № 1. С. 5–16.
Григорян Э.Н., Иванова И.П., Поплинская В.А. Обнаружение новых, внутренних источников регенерации нейральной сетчатки после ее отслойки у тритонов. I. Морфологическое и количественное исследования // Изв. РАН. Сер. биол. 1996. № 3. С. 319–332.
Григорян Э.Н., Миташов В.И. Культивирование пигментного эпителия сетчатки в полости линзэктомированного глаза тритонов // Онтогенез. 1985. Т. 16. № 1. С. 34–43.
Кузнецова А.В., Григорян Э.Н., Александрова М.А. Ретинальный пигментный эпителий глаза взрослого человека – потенциальный источник клеток для восстановления сетчатки // Цитология. 2011. Т. 53. С. 505–512.
Милюшина Л.А., Кузнецова А.В., Григорян Э.Н., Александрова М.А. Фенотипическая пластичность клеток ретинального пигментного эпителия глаза взрослого человека in vitro // Клеточные технол. биол. мед. 2009. Т. 2. С. 71–76.
Миташов В.И., Панова И.Г., Коуссоулакос С. Трансдифференцировочные потенции клеток цилиарного и пигментного эпителиев низших позвоночных и млекопитающих // Онтогенез. 2004. Т. 4. С. 395–403.
Свистунов С.А., Миташов В.И. Радиоавтографическое исследование пролиферации клеток пигментного эпителия сетчатки у альбиносов шпорцевых лягушек // Онтогенез. 1983. Т. 14. С. 382–389.
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Экспрессия нуклеостемина в процессе репрограммирования in situ клеток пигментного эпителия глаза при регенерации сетчатки у взрослого тритона // Цитология. 2014. Т. 56. № 9. С. 671–672.
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Идентификация гена нуклеостемина в тканях глаза взрослого тритона Pleurodeles waltl // Известия РАН. Сер. биол. 2015. Т. № 5. С. 453–460.
Маркитантова Ю.В., Макарьев Е.О., Смирнова Ю.А., Зиновьева Р.Д., Миташов В.И. Исследование паттерна экспрессии регуляторных генов Pax6, Prox1 и Six3 в ходе регенерации структур глаза тритона // Известия РАН. Сер. биол. 2004. № 5. С. 522–531.
Abe T., Yoshida M., Yoshioka Y. et al. Iris pigment epithelial cell transplantation for degenerative retinal diseases // Prog. Retin. Eye Res. 2007. V. 26. № 3. P. 302–321.
Ahmad I., Tang L., Pham H. Identification of neural progenitors in the adult mammalian eye // Biochem. Biophys. Res. Commun. 2000. V. 270. P. 517–521.
Ail D., Perron M. Retinal degeneration and regeneration – lessons from fishes and amphibians // Curr. Pathobiol. Rep. 2017. V. 5. P. 67–78.
Araki M. Regeneration of the amphibian retina: role of tissue interaction and related signaling molecules on RPE transdifferentiation // Develop. Growth Differ. 2007. V. 49. № 2. P. 109–120.
Azuma N., Tadokoro K., Asaka A. et al. Transdifferentiation of the retinal pigment epithelia to the neural retina by transfer of the Pax6 transcriptional factor // Hum. Mol. Genet. 2005. V. 12. P. 1059–1068.
Ballios B.J., Clarke L., Coles B.L.K. et al. The adult retinal stem cell is a rare cell in the ciliary epithelium whose progeny can differentiate into photoreceptors // Biology Open. 2012. V. 1. P. 237–246.
Bernardos R.L., Barthel L.K., Meyers J.R., Raymond P.A. Late- stage neuronal progenitors in the retina are radial Müller glia that function as retinal stem cells // J. Neurosci. 2007. V. 27. P. 7028–7040.
Bernardos R.L., Lentz S.I., Wolfe M.S., Raymond P.A. Notch-Delta signaling is required for spatial patterning and Muller glia differentiation in the zebrafish retina // Dev. Biol. 2005. V. 278. № 2. P. 381–395.
Bhatia B., Jayaram H., Singhal S. et al. Differences between the neurogenic and proliferative abilities of Muller glia with stem cell characteristics and the ciliary epithelium from the adult human eye // Exp. Eye Res. 2011. V. 93. № 6. P. 852–861.
Borday C., Cabochette P., Parain K. et al. Antagonistic cross-regulation between Wnt and Hedgehog signalling pathways controls post-embryonic retinal proliferation // Development. 2012. V. 139. P. 3499–3509.
Bringmann A., Iandiev I., Pannicke T. et al. Cellular signaling and factors involved in Muller cell gliosis: neuroprotective and detrimental effects // Prog. Retin. Eye Res. 2009. V. 28. № 6. P. 423–451.
Casco-Robles M.M., Islam M.R., Inami W. et al. Turning the fate of reprogramming cells from retinal disorder to regeneration by Pax6 in newts // Sci. Rep. 2016. V. 6: 33761.
Cerveny K.L., Varga M., Wilson S.W. Continued growth and circuit building in the anamniote visual system // Dev. Neurobiol. 2012. V. 72. P. 328–345.
Chen M., Tian S., Glasgow N.G. et al. Lgr5+ amacrine cells possess regenerative potential in the retina of adult mice // Aging Cell. 2015. V. 14. № 4. P. 635–643.
Charteris D.G. Proliferative vitreoretinopathy: pathobiology, surgical management, and adjunctive treatment // Br. J. Ophthalmol. 1995. V. 79. № 10. P. 953–960.
Chiba C. The retinal pigment epithelium: an important player of retinal disorders and regeneration // Exp. Eye Res. 2014. V. 123. P. 107–114.
Chiba C., Mitashov V.I. Cellular and molecular events in the adult newt retinal regeneration, in: Strategies for retinal tissue repair and regeneration in vertebrates: from fish to human (Chiba Ch., ed.), Research Signpost, Kerala, India. 2007. P. 15–33.
Cicero S.A., Johnson D., Reyntjens S. et al. Cells previously identified as retinal stem cells are pigmented ciliary epithelial cells // Proc. Natl. Acad. Sci. U S A. 2009. V. 106. P. 6685–6690.
Close J.L., Liu J., Gumuscu B., Reh T.A. Epidermal growth factor receptor expression regulates proliferation in the postnatal rat retina // Glia. 2006. V. 54. № 2. P. 94–104.
Coles B.L., Angenieux B., Inoue T. et al. Facile isolation and the characterization of human retinal stem cells // Proc. Natl. Acad. Sci. U S A. 2004. V. 101. P. 15772–15777.
Coulombre J.L., Coulombre A.J. Regeneration of neural retina from the pigmented epithelium in the chick embryo // Dev. Biol. 1965. V. 12. P. 79–92.
Del Debbio C.B., Balasubramanian S., Parameswaran S. et al. Notch and Wnt signaling mediated rod photoreceptor regeneration by Muller cells in adult mammalian retina // PLoS One. 2010. V. 5. № 8: e12425.
Engelhardt M., Bogdahn U., Aigner L. Adult retinal pigment epithelium cells express neural progenitor properties and the neuronal precursor protein doublecortin // Brain Res. 2005. V. 1040. P. 98–111.
Engerer P., Suzuki S.C., Yoshimatsu T. et al. Uncoupling of neurogenesis and differentiation during retinal development // EMBO J. 2017. V. 36. P. 1134–1146.
Fischer A.J. Neural regeneration in the chick retina // Prog. Retin. Eye Res. 2005. V. 24. № 2. P. 161–182.
Fisher A.J., Reh T.A. Identification of a proliferating marginal zone of retinal progenitors in postnatal chickens // Dev. Biol. 2000. V. 220. P. 197–210.
Fischer A.J., Bosse J.L., El-Hodiri H.M. The ciliary marginal zone (CMZ) in development and regeneration of the vertebrate eye // Exp. Eye Res. 2013. V. 116. P. 199–204.
Fischer A.J., McGuire C.R., Dierks B.D., Reh T.A. Insulin and fibroblast growth factor 2 activate a neurogenic program in Müller glia of the chicken retina // J. Neurosci. 2002. V. 22. P. 9387–9398.
Frøen R., Johnsen E.O., Nicolaissen B. et al. Does the adult human ciliary body epithelium contain “True” retinal stem cells? // Biomed. Res. Int. 2013. 2013: 531579.
Gao J., Cheon K., Nusinowitz S. et al. Progressive photoreceptor degeneration, outer segment dysplasia, and rhodopsin mislocalization in mice with targeted disruption of the retinitis pigmentosa-1 (Rp1) gene // Proc. Natl. Acad. Sci. U S A. 2002. V. 99. P. 5698–5703.
Giannelli S.G., Demontis G.C., Pertile G. et al. Adult human Muller glia cells are a highly efficient source of rod photoreceptors // Stem Cells. 2011. V. 29. № 2. P. 344–356.
Götz M., Sirko S., Beckers J., Irmler M. Reactive astrocytes as neural stem or progenitor cells: in vivo lineage, in vitro potential, and genome-wide expression analysis // Glia. 2015. V. 63. № 8. P. 1452–1468.
Goldman D. Müller glial cell reprogramming and retina regeneration // Nat. Rev. Neurosci. 2014. V. 15. P. 431–442.
Grigoryan E.N. Alternative intrinsic cell sources for neural retina regeneration in adult urodelean amphibians. In: Strategies for retinal tissue repair and regeneration in vertebrates: From fish to human. (Chiba Ch., ed.). Research Signpost. Kerala. India. 2007. P. 35–62.
Grigoryan E.N. Shared triggering mechanisms of retinal regeneration in lower vertebrates and retinal rescue in higher ones. In: Tissue regeneration – from basic biology to clinical application. (Ed. Davies J.). In Tech. Croatia. 2012. P. 145–164.
Grigoryan E.N., Anton H.J., Poplinskaya V.A. et al. Signs of Müller cell gliotic response found in the retina of newts exposed to real and simulated microgravity // Adv. Space Res. 2012. V. 49. № 10. P. 1465–1471.
Grigoryan E.N., Markitantova Y.V. Cellular and molecular preconditions for retinal pigment epithelium (RPE) natural reprogramming during retinal regeneration in Urodela // Biomedicines. 2016. V. 4. P. 10–28.
Gualdoni S., Baron M., Lakowski J. et al. Adult ciliary epithelial cells previously identified as retinal stem cells with potential for retinal repair, fail to differentiate into new rod photorecepors // Stem Cells. 2010. V. 28. P. 1048–1059.
Hamon A., Roger J.E., Yang X.J., Perron M. Müller glial cell dependent regeneration of the neural retina: An overview across vertebrate model systems // Dev. Dyn. 2016. V. 245. P. 727–738.
Harris W.A., Perron M. Molecular recapitulation: the growth of the vertebrate retina // Int. J. Dev. Biol. 1998. V. 42. № 3. P. 299–304.
He J., Zhang G., Almeida A.D. et al. How variable clones build an invariant retina // Neuron. 2012. V. 75. P. 786–798.
Hitchcock P.F., Raymond P.A. The teleost retina as a model for developmental and regeneration biology // Zebrafish. 2004. V. 1. № 3. P. 257–271.
de Hoz R., Rojas B., Ramírez A.I. et al. Retinal macroglial responses in health and disease // Biomed. Res. Int. 2016. 2016: 2954721.
Jadhav A.P., Roesch K., Cepko C.L. Development and neurogenic potential of Muller glial cells in the vertebrate retina // Prog. Ret. Eye Res. 2009. V. 28. P. 249–262.
Johns P.R. Growth of the adult goldfish eye. III. Source of the new retinal cells // J. Comp. Neurol. 1977. V. 176. P. 343–357.
Johnson P.T., Lewis G.P., Talaga K.C. et al. Drusen-associated degeneration in the retina // Invest. Ophthalmol. Vis. Sci. 2003. V. 44. P. 4481–4488.
Jorstad N.L., Wilken M.S., Grimes W.N. et al. Stimulation of functional neuronal regeneration from Müller glia in adult mice // Nature. 2017. V. 548. P. 103–107.
Inoue T., Coles B.L.K., Dorval K. et al. Maximizing functional photoreceptor differentiation from adult human retinal stem cells // Stem Cells. 2010. V. 28. № 3. P. 489–500.
Karl M.O., Hayes S., Nelson B.R. et al. Stimulation of neural regeneration in the mouse retina // Proc. Natl. Acad. Sci. U S A. 2008. V. 105. № 49. P. 19508–19513.
Keefe J.R. An analysis of urodelean retinal regeneration // J. Exp. Zool. 1973. V. 184. P. 185–257.
Kirchhof B., Sorgente N. Pathogenesis of proliferative vitreoretinopathy. Modulation of retinal pigment epithelial cell functions by vitreous and macrophages // Dev. Ophthalmol. 1989. V. 16. P. 1–53.
Kiyama T., Li H., Gupta M. et al. Distinct neurogenic potential in the retinal margin and the pars plana of mammalian eye // J. Neurosci. 2012. V. 32. № 37. P. 12 797–12 807.
Knight J.K., Raymond P.A. Retinal pigmented epithelium does not transdifferentiate in adult goldfish // J. Neurobiol. 1995. V. 27. P. 447–456.
Kubota R., Hokoc J.N., Moshiri A. et al. A comparative study of neurogenesis in the retinal ciliary marginal zone of homeothermic vertebrates // Brain. Res. Dev. Brain Res. 2002. V. 134. № 1–2. P. 31–41.
Lakowski J., Gonzalez-Cordero A., West E.L. et al. Transplantation of photoreceptor precursors isolated via a cell surface biomarker panel from embryonic stem cell-derived self-forming retina // Stem Cells. 2015. V. 33. № 8. P. 2469–2482.
Le T.T., Wroblewski E., Patel S. et al. Math5 is required for both early retinal neuron differentiation and cell cycle progression // Dev. Biol. 2006. V. 295. № 2. P. 764–778.
Lenkowski, J.R., Raymond P.A. Müller glia: Stem cells for generation and regeneration of retinal neurons in teleost fish // Prog. Retin. Eye Res. 2014. V. 0. P. 94–123.
Lewis G.P., Chapin E.A., Luna G. et al. The fate of Müller’s glia following experimental retinal detachment: nuclear migration, cell division, and subretinal glial scar formation // Molecular Vision. 2010. V. 16. P. 1361–1372.
Lewis G.P., Charteris D.G., Sethi C.S. et al. The ability of rapid retinal reattachment to stop or reverse the cellular and molecular events initiated by detachment // Invest. Ophthalmol. Vis. Sci. 2002. V. 43. P. 2412–2420.
Li Y., Atmaca-Sonmez P., Schanie C.L. et al. Endogenous bone marrow derived cells express retinal pigment epithelium cell markers and migrate to focal areas of RPE damage // Invest. Ophthalmol. Vis. Sci. 2007. V. 48. № 9. P. 4321–4327.
Li Y., Reca R.G., Atmaca-Sonmez P. et al. Retinal pigment epithelium damage enhances expression of chemoattractants and migration of bone marrow-derived stem cells // Invest. Ophthalmol. Vis. Sci. 2006. V. 47. № 4. 1646–1652.
Liu B., Hunter D.J., Rooker S. et al. Wnt signaling promotes Muller cell proliferation and survival after injury // Invest. Ophthalmol. Vis. Sci. 2013. V. 54. № 1. P. 444–453.
Luz-Madrigal A., Grajales-Esquivel E., McCorkle A. et al. Reprogramming of the chick retinal pigmented epithelium after retinal injury // BMC Biol. 2014. V. 12. P. 28–34.
Machalinska A., Klos P., Baumert B. et al. Stem cells are mobilized from the bone marrow into the peripheral circulation in response to retinal pigment epithelium damage – a pathophysiological attempt to induce endogenous regeneration // Curr. Eye Res. 2011. V. 36. № 7. P. 663–672.
Maeda T., Lee M.J., Palczewska G. et al. Retinal pigmented epithelial cells obtained from human induced pluripotent stem cells possess functional visual cycle enzymes in vitro and in vivo // J. Biol. Chem. 2013. V. 288. № 48. P. 34 484–34 493.
Marcucci F., Murcia-Belmonte V., Coca Y. et al. The ciliary margin zone of the mammalian retina generates retinal ganglion cells // Cell Rep. 2016. V. 17. № 12. P. 3153–3164.
Martínez-Navarrete G.C., Angulo A., Cuenca N. Gradual morphogenesis of retinal neurons in the peripheral retinal margin of adult monkeys and humans // J. Comp Neurol. 2008. V. 511. P. 557–580.
Mitashov V.I. Retinal regeneration in amphibians // Int. J. Dev. Biol. 1997. V. 41. P. 893–905.
Miyake A., Araki M. Retinal stem/progenitor cells in the ciliary marginal zone complete retinal regeneration: a study of retinal regeneration in a novel animal model // Dev. Neurobiol. 2014. V. 74. № 7. P. 739–756.
Moshiri A., Close J., Reh T.A. Retinal stem cells and regeneration // Int. J. Dev. Biol. 2004. V. 48. P. 1003–1014.
Nabeshima A., Nishibayashi C., Ueda Y. et al. Loss of cell-extracellular matrix interaction triggers retinal regeneration accompanied by Rax and Pax6 activation // Genesis. 2013. V. 51. № 6. P. 410–419.
Nakamura K., Rafiqul M.R., Takayanagi M. et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster // PLoS One. 2014. V. 9. e10983.
Ooto S., Akagi T., Kageyama R. et al. Potential for neural regeneration after neurotoxic injury in the adult mammalian retina // Proc. Natl. Acad. Sci. U S A. 2004. V. 101. № 37. P. 13654–13659.
Osakada F., Ooto S., Akagi T. et al. Wnt signaling promotes regeneration in the retina of adult mammals // J. Neurosci. 2007. V. 27. № 15. P. 4210–4219.
Otteson D.C., Hitchcock P.F. Stem cells in the teleost retina: persistent neurogenesis and injury-induced regeneration // Vision Res. 2003. V. 43. P. 927–936.
Otteson D.C., D’Costa A.R., Hitchcock P.F. Putative stem cells and the lineage of rod photoreceptors in the mature retina of the goldfish // Dev. Biol. 2001. V. 232. № 1. P. 62–76.
Perron M., Kanekar S., Vetter M.L., Harris W.A. The genetic sequence of retinal development in the ciliary margin of the Xenopus eye // Dev. Biol. 1998. V. 199. P. 185–200.
Pesaresi M., Bonilla-Pons S.A., Simonte G. et al. Endogenous mobilization of bone-marrow cells into the murine retina induces fusion-mediated reprogramming of Müller glia cells // EbioMedicine. 2018. V. 30. P. 38–51.
Pollak J., Wilken M.S., Ueki Y. et al. ASCL1 reprograms mouse Muller glia into neurogenic retinal progenitors // Development. 2013. V. 140. P. 2619–2631.
Prada C., Puga J., Perez-Mendez L. et al. Spatial and temporal patterns of neurogenesis in the chick retina // Eur. J. Neurosci. 1991. V. 3. № 6. P. 559–569.
Raymond P.A., Barthel L.K., Bernardos R.L., Perkowski J.J. Molecular characterization of retinal stem cells and their niches in adult zebrafish // BMC Dev. Biol. 2006. V. 6. P. 36.
Raymond P.A., Reifler M.J., Rivlin P.K. Regeneration of goldfish retina: Rod precursors are a likely source of regenerated cells // J. Neurobiol. 1988. V. 19. № 5. P. 431–463.
Roesch K., Jadhav A.P., Trimarchi J.M. et al. The transcriptome of retinal Muller glial cells // J. Comp. Neurol. 2008. V. 509. № 2. P. 225–238.
Sakami S., Hisatomi O., Sakakibara S. et al. Downregulation of Otx2 in the dedifferentiated RPE cells of regenerating newt retina // Brain Res. Dev. Brain Res. 2005. V. 12. P. 49–59.
Salero E., Blenkinsop T.A., Corneo B. et al. Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives // Cell Stem Cell. 2012. V. 10. P. 88–95.
Sanchez-Farias A., Candal E. Doublecortin is widely expressed in the developing and adult retina of sharks // Exp. Eye Res. 2015. V. 134. P. 90–100.
Shaham O., Menuchin Y., Farhy C., Ashery-Padan R. Pax6: a multi-level regulator of ocular development // Prog. Retin. Eye Res. 2012. V. 31. № 5. P. 351–376.
Sluch V.M., Zack D.J. Stem Cells, Retinal Ganglion Cells, and Glaucoma // Dev. Ophthalmol. 2014. V. 53. P. 111–121.
Soules K.A., Link B.A. Morphogenesis of the anterior segment in the zebrafish eye // BMC Dev. Biol. 2005. V. 5. P. 12.
Spence J.R., Madhavan M., Ewing J.D. et al. The hedgehog pathway is a modulator of retina regeneration // Development. 2004. V. 12. P. 4607–4621.
Spence J.R., Madhavan M., Aycinena J.C., Del Rio-Tsonis K. Retina regeneration in the chick embryo is not induced by spontaneous Mitf downregulation but requires FGF/FGFR/MEK/Erk dependent upregulation of Pax6 // Mol. Vis. 2007. P. 12. P. 57–65.
Steinfeld J., Steinfeld I., Bausch A. et al. BMP-induced reprogramming of the neural retina into retinal pigment epithelium requires Wnt signalling // Biol. Open. 2017. V. 6. № 7. P. 979–992.
Stenkamp D.L. Neurogenesis in the Fish Retina // Int. Rev. Cytol. 2007. V. 259. P. 173–224.
Straznicky K., Gaze R.M. The growth of the retina in Xenopus laevis: an autoradiographic study // J. Embryol. Exp. Morphol. 1971. V. 26. P. 67–79.
Stroeva O.G., Mitashov V.I. Retinal pigment epithelium: proliferation and differentiation during development and regeneration // Int. Rev. Cytol. 1983. V. 83. P. 221–293
Sukhdeo K., Koch C.E., Miller T.E. et al. The Lgr5 transgene is expressed specifically in glycinergic amacrine cells in the mouse retina // Exp. Eye Res. 2014. V. 119. P. 106–110.
Sun G., Asami M., Ohta H. et al. Retinal stem/progenitor properties of iris pigment epithelial cells // Dev. Biol. 2006. V. 289. № 1. P. 243–252.
Todd L., Suarez L., Squires N. et al. Comparative analysis of glucagonergic cells, glia and the circumferential marginal zone in the reptilian retina // J. Comp. Neurol. 2016. V. 524. V. 1. P. 74–89.
Todd L., Suarez L., Quinn C., Fischer A.J. Retinoic acid-signaling regulates the proliferative and neurogenic capacity of Müller glia-derived progenitor cells in the avian retina // Stem Cells. 2017. V. 65. P. 1640–1655.
Tomita M., Adachi Y., Yamada H. et al. Bone marrow-derived stem cells can differentiate into retinal cells in injured rat retina // Stem Cells. 2002. V. 20. P. 279–283.
Tomoyuki I., Coles B.L.K., Dorval K. et al. Maximizing functional photoreceptor differentiation from adult human retinal stem cells // Stem Cells. 2010. V. 28. № 3. P. 489–500.
Tropepe V., Coles B.L., Chiasson B.J. et al. Retinal stem cells in the adult mammalian eye // Science. 2000. V. 287. P. 2032–2036.
Turner D.L., Cepko C.L. A common progenitor for neurons and glia persists in rat retina late in development // Nature. 1987. V. 328. P. 131–136.
Wan Y., Almeida A.D., Rulands S. et al. The ciliary marginal zone of the zebrafish retina: clonal and time-lapse analysis of a continuously growing tissue // Development. 2016. V. 143. № 7. P.1099–1107.
Wan J., Zheng H., Xiao H.L. et al. Sonic hedgehog promotes stem-cell potential of Muller glia in the mammalian retina // Biochem. Biophys. Res. Commun. 2007. V. 363. № 2. P. 347–354.
Wang J.C., Harris W.A. The role of combinational coding by homeodomain and bHLH transcription factors in retinal cell fate specification // Dev. Biol. 2005. V. 285. P. 101–115.
Wehman A.M., Staub W., Meyers J.R. et al. Genetic dissection of the zebrafish retinal stem-cell compartment // Dev. Biol. 2005. V. 281. № 1. P. 53–65.
Williams A.L., Bohnsack B.L. Neural crest derivatives in ocular development: discerning the eye of the storm // Birth Defects Res C Embryo Today. 2015. V. 105. № 2. P. 87–95.
Xu S., Sunderland M.E., Coles B.L. et al. The proliferation and expansion of retinal stem cells require functional Pax6 // Dev. Biol. 2007. V. 304. P. 713–721.
Xue X.Y., Harris W.A. Using myc genes to search for stem cells in the ciliary margin of the Xenopus retina // Dev. Neurobiol. 2012. V. 72. P. 475–490.
Yasumuro H., Sakurai K., Toyama F. et al. Implications of a multi-step trigger of retinal regeneration in the adult newt // Biomedicines. 2017. V. 5. № 2. P. 25.
Yoshii C., Ueda Y., Okamoto M., Araki M. Neural retinal regeneration in the anuran amphibian Xenopus laevis post-metamorphosis: transdifferentiation of retinal pigmented epithelium regenerates the neural retina // Dev. Biol. 2007. V. 303. № 1. P. 45–50.
Yu H., Vu T.H.K., Cho K-S. et al. Mobilizing endogenous stem cells for retinal repair // Transl. Res. 2014. V. 163. № 4. P. 387–398.
Zhao C., Tao Z., Xue L. et al. Lin28b stimulates the reprograming of rat Müller glia to retinal progenitors // Exp. Cell Res. 2017. V. 1. № 352. P. 164–174.
Zhang J., Jiao J. Molecular Biomarkers for Embryonic and Adult Neural Stem Cell and Neurogenesis // Biomed. Res. Int. 2015. V. 2015: 727542.
Zuber M.E., Gestri G., Viczian A.S. et al. Specification of the vertebrate eye by a network of eye field transcription factors // Development. 2003. V. 130. № 21. P. 5155–5167.
Дополнительные материалы отсутствуют.


