Онтогенез, 2019, T. 50, № 1, стр. 3-12
Дрозофила, как модельная система для поиска генов, сигнальных путей и механизмов, контролирующих формирование цитоскелета
Ю. Е. Воронцова a, Е. Л. Заволока a, Р. О. Черезов a, О. Б. Симонова a, *
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, д. 26, Россия
* E-mail: osimonova@hotmail.com
Поступила в редакцию 25.03.2018
После доработки 16.05.2018
Принята к публикации 04.05.2018
Аннотация
Исследования регуляторных факторов и биохимических свойств актинового цитоскелета успешно проводятся на моделях in vitro или с использованием культуры клеток. Однако, как такие факторы функционируют in vivo, создавая невероятное многообразие цитоскелетных структур в процессе развития организма, остается до конца не понятым. Для полного понимания того, как формируются и функционируют цитоскелетные структуры, необходимо, во-первых, установить полный список факторов, регулирующих сборку структуры, во-вторых, установить пространственно-временной механизм, с помощью которого координируется активность этих факторов, в-третьих, определить, как эти регуляторы и подконтрольные им структуры влияют на динамику развития. В обзоре рассмотрены инновационные методики, сделавшие дрозофилу мощным инструментом в изучении этих вопросов.
“… я бы, прежде всего, воспел дрозофилу, сочинил бы нечто вроде оды этому насекомому… Оду за ее откровенность. Или за ее болтливость. Болтливый объект, который хорош тем, что так плохо хранит тайны природы”.
Даниил Гранин “Зубр”
У дрозофилы, как модельного объекта, есть очевидные преимущества: дешевая питательная среда, быстрый цикл развития, высокий консерватизм ее генов с генами млекопитающих при отсутствии избыточности их гомологов в геноме, визуально доступные эмбрионы и сложное, но легко контролируемое, развитие. Ученые использовали эти преимущества для скрининга ключевых генов, кодирующих цитоскелетные белки и их регуляторы (Nusslein-Volhard, Wieschaus, 1980; Schupbach, Wieschaus, 1989). В результате, в лабораториях и мировых коллекционных центрах были собраны коллекции мутантных дрозофил, доступные любому исследователю. Далее, используя высокопроизводительный метод РНК-интерференции в культивируемых клетках дрозофилы, было идентифицировано много новых потенциальных факторов, контролирующих формирование цитоскелета (Rogers et al., 2003; Kiger et al., 2003). В генетических экспериментах можно не только идентифицировать конкретные гены, но и устанавливать их функциональные взаимодействия, основываясь на принципе: мутации во взаимодействующих генах приводят к схожему мутантному фенотипу. Например, схожие фенотипические дефекты механосенсорных щетинок способствовали открытию генов forked и singed/фасцин, кодирующих молекулы кросслинкеров (сшивающих белков) актина (Tilney, DeRosie, 2005).
Другие ключевые регуляторы актина были идентифицированы при поиске генов, необходимых для роста и созревания ооцита (Hudson, Cooley, 2002). Ооцит созревает благодаря направленному течению цитоплазмы, обеспечивающему транспорт цитоплазматических органелл, белков и мРНК от трофоцитов (питающих клеток) к ооциту, через особые актин-содержащие цитоплазматические мостики – кольцевые каналы (рис. 1а). Помимо этого, трофическим клеткам необходимы пучки актиновых филаментов, чтобы удерживать ядра от закупорки ими кольцевых каналов во время тока цитоплазмы. Поиск причин нарушения созревания ооцита привели к идентификации двух групп регуляторных белков цитоскелета: группы белков с пучкующим эффектом, гомологов виллина и фасцина – Quail и Singed – необходимых для организации актиновых филаментов в пучки, и группы сшивающих (кросслинкерных) белков Filamin и Kelch – компонентов кольцевых каналов (Hudson, Cooley, 2002). Эти данные стали первым шагом на пути к разгадке того, как специфические группы белков-регуляторов могут координировать свою работу в процессе создания актин-содержащих структур цитоскелета. Дополнительно, удалось идентифицировать новые регуляторы F-актина, которые появляются в группе клеток или ткани только в определенный период времени, в момент перехода от одной стадии развития дрозофилы к другой.
Рис. 1.
(а) – схема этапов развития и клеточных процессов дрозофилы, которые способствовали открытию механизмов формирования цитоскелетных структур in vivo. Структуры F-актина выделены красным цветом. Кольцевые каналы в развивающейся яйцевой камере и миграция бордюрных клеток служат важными моделями для исследования механизмов сборки сложных F-актиновых структур и коллективной миграции клеток, соответственно. Контроль времени цитоплазматического течения и формирования полярности ооцита осуществляется при участии F-актиновой сетки. Эмбриогенез дрозофилы является модельной системой для изучения процесса слияния миобластов, приводящего к формированию многоядерных мышечных волокон. В частности, в этой системе исследуются “фокусы” F-актина и координирующая активность разных нуклеаторов актина. Актомиозиновые кабели способствуют сортировке клеток на границе эмбрионального парасегмента, в крыловом имагинальном диске личинки и в брюшном эпидермисе куколки (не показаны). Эти же структуры способствуют движению эпителиальных пластов клеток во время эмбрионального дорсального закрытия. Механосенсорная щетинка взрослого насекомого явилась удобной системой для идентификации генов, контролирующих формирование пучков F-актина – структур, подобных тем, которые были обнаружены в микроворсинках щеточной каймы и стереоцилиях волосковых клеток. Таким образом, эти модели позволяют изучать in vivo сложный контроль активности цитоскелетных регуляторных белков и способствуют пониманию подобных процессов во время формирования схожих структур у позвоночных животных (табл. 1). (б) – инструментарий, с помощью которого можно управлять функцией генов в разных тканях и на разных стадиях развития дрозофилы. Слева представлена система GAL4/UAS, которая состоит из дрожжевого транскрипционного активатора GAL4 и изучаемого целевого гена, поставленного под контроль активирующей последовательности (UAS). В центре и справа представлены системы FLP/FRT и MARCM, которые применяют для индукции митотических клонов. Обе системы используют рекомбиназу FLP и целевые FRT-сайты (отмечены красным) для индукции клонов гомозиготных мутантных клеток и клеток дикого типа у гетерозиготных особей, но отличаются маркировкой клонов. В системе FLP/FRT гетерозиготные клетки маркированы одной копией GFP (зеленый фон). После рекомбинации одна из дочерних клеток получает две копии мутантного аллеля (желтая звезда) и ни одной копии GFP-маркера (зеленый овал). Поэтому зеленое свечение у нее отсутствует (белый фон). Другая дочерняя клетка получает два нормальных аллеля изучаемого гена и две копии GFP (темно-зеленый фон). В системе MARCM все клетки содержат повсеместно экспрессируемый ген GAL4, UAS-GFP и одну копию GAL4-ингибитора GAL80 (оранжевый овал). После рекомбинации одна дочерняя клетка получает две копии мутантного аллеля и ни одной копии GAL80, в результате чего идет индукция GFP и получается маркированный гомозиготный мутантный клон клеток (темно-зеленый фон). Все остальные клетки не экспрессируют GFP из-за подавления экспрессии его активатора (GAL4) белком GAL80. По: Rodal et al., 2015; с изменениями. (в) – примеры использования системы GAL4/UAS и FLP/FRT. Слева: специфическая экспрессия репортерного гена UAS-GFP под контролем драйверной конструкции Tj-GAL4 в соматических клетках половой системы самки дрозофилы. Справа: мозаичная яйцевая камера в результате индукции митотических клонов в системе FRT/FLP. Клоны маркированы отсутствием свечения зеленого флуоресцентного белка (GFP–).
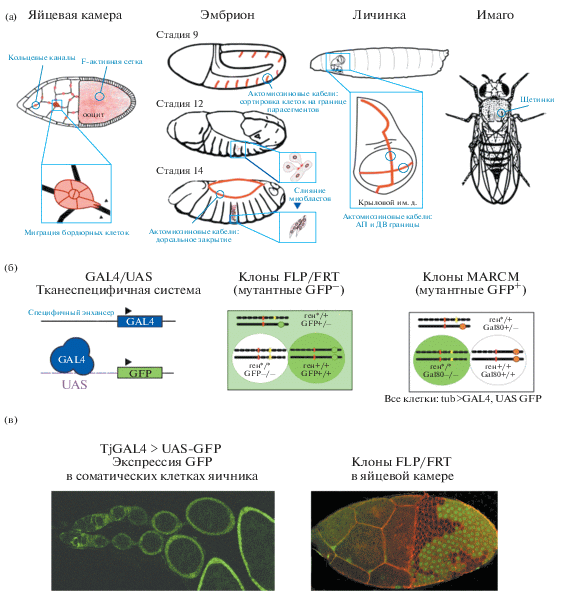
Во время генетического скрининга мутантов с нарушением миграции бордюрных клеток (процесс в оогенезе, используемый для изучения групповой миграции клеток), в лаборатории Монтелля (Montell et al., 2012) был идентифицирован ген psidin, кодирующий новый, F-актин-связывающий белок, необходимый для нормальной скорости миграции бордюрных клеток (рис. 1а). Оказалось, что у млекопитающих гомолог этого белка – C12orf30 – обладает схожей функцией и необходим для коллективной миграции монослоя клеток MCF10A при раневом повреждении (Kim et al., 2011).
Легкость, с которой можно использовать дрозофилу для открытия новых сигнальных путей и механизмов, очевидна, однако ценность ее, как инструмента в биомедицинских исследованиях, зависит исключительно от возможности экстраполяции этих открытий на млекопитающих (табл. 1). Невероятное количество работ постоянно демонстрирует то, как открытия, сделанные на дрозофиле, значительно продвинули наше понимание процессов развития человека, его физиологии и болезней (Wangler et al., 2015). Кроме самих молекул цитоскелетных белков и их регуляторов консервативны также некоторые структуры цитоскелета (Rohn et al., 2011). Например, пучки F-актина, наблюдаемые у механосенсорных щетинок и в кабель-подобных структурах у трофоцитов, имеют много общего с пучками актина микроворсинок кишечного эпителия (щеточная кайма) и стереоцилий (микроворсинок волосковой клетки) внутреннего уха (DeRosier, Tilney, 2000). При этом формирование каждой структуры зависит от согласованных действий, по крайней мере, двух актин-пучкующих белков, каждый из которых эволюционно консервативен от мух до человека. Стоит отметить, что эти же белки используются и для формирования особых клеточных структур. Например, для формирования динамичных трехмерных актиновых конусов, которые отвечает за индивидуализацию (разделение) сперматоцитов, исходно объединенных в 64-клеточную цисту, необходимы согласованные действия высоко консервативных регуляторов как разветвленного, так и линейного F-актина (Fabian, Brill, 2012). Подобные примеры формирования различных структур одними и теми же регуляторами организации цитоскелета говорят об их эволюционной адаптивности и пластичности. Также как и сходство механизмов регуляции формирования похожих структур в разных тканях у разных организмов, участие одних и тех же регуляторов в построении разных структур имеет не меньшую ценность для клеточного биолога. Таким образом, исследование формирования разнообразных цитоскелетных структур может пополнить наши знания о молекулярных механизмах, контролирующих функции цитоскелета.
Таблица 1.
Примеры цитоскелетных актиновых структур у Drosophila и их аналогов у млекопитающих
| Процесс у Drosophila | Актиновая структура | Соответствующая система млекопитающих | Ссылки |
|---|---|---|---|
| Слияние миобластов | Подосома-подобные структуры | Слияние миобластов | (Abmayr, Pavlath, 2012; Kim et al., 2015) |
| Инвадоподии | (Linder et al., 2011) | ||
| Подосомы | (Schachtner et al., 2013) | ||
| Цитоплазматическое течение в оогенезе | Актиновая сеть | Позиционирование веретена деления ооцита | (Hudson, Cooley, 2002; Pfender et al., 2011) |
| Быстрый транспорт цитоплазмы трофоцитов в ооцит | Кольцевые каналы | Межклеточные мостики | (Hudson, Cooley, 2002; Haglund et al., 2011) |
| Пучки F-актина | Позиционирование ядра | (Luxton et al., 2010) | |
| Компартментализация | Актомиозиновые кабель-подобные структуры | Сегментация заднего мозга | (Lye, Sanson, 2011) |
| Спинное смыкание | Актомиозиновые кабель-подобные структуры | Заживление ран | (Roper, 2013) |
| Механо-чувствительные щетинки | Пучки F-актина | Щеточная кайма | (Tilney, DeRosier, 2005) |
| Стереоцилия волосковой клетки | |||
| Миграция бордюрных клеток | Группа мигрирующих клеток | Миграция клеток нервного гребня | (Montell et al., 2012) |
| Раковые метастазы |
ТЕХНИЧЕСКИЙ ПРОГРЕСС В ИСПОЛЬЗОВАНИИ ДРОЗОФИЛЫ
Инструментарий для анализа молекулярных механизмов in vivo
Основные белки-регуляторы актинового цитоскелета были изолированы с помощью генетических скринингов новых мутантов и анализу их фенотипа. Тем не менее, для детального изучения роли этих регуляторов в развитии были нужны новые прогрессивные методики в области генно-инженерных манипуляций с геномом дрозофилы и по получению слитых (гибридных) белковых молекул.
Гомологичная рекомбинация у дрозофилы в норме идет с низкой эффективностью, что являлось препятствием для проведения направленного мутагенеза и получения серий аллельных вариантов гена. Однако открытые возможности модифицировать геном дрозофилы, сделали этот организм совершенной системой для сайт-направленного мутагенеза. Во-первых, была разработана сайт-специфическая интегративная система с использованием интегразы бактериофага ΦC31, позволяющая исследователям направлено встраивать трансгены в определенную область генома, свободную от хозяйских генов, не опасаясь нарушений, к которым могла приводить случайная инсерция конструкции. Это позволило получать серии аллелей, несущих делетированные или модифицированные районы изучаемого гена, сравнивать их влияние на развитие органов и тканей. Подобным образом недавно был выполнен структурно-функциональный анализ гена α-катенина дрозофилы (Desai et al., 2013). Во-вторых, используя библиотеку бактериальных искусственных хромосом (Bacterial Artificial Chromosomes – BACs), стало возможным модифицировать геномные локусы дрозофилы в бактериях. Редактированные геномные области размером 120 т.п.н. можно затем встраивать обратно в геном дрозофилы, используя ΦC31-опосредованное интеграцию. В-третьих, на дрозофиле разработан эффективный метод сайленсинга генов in vivo. Этот метод основан на использовании РНК-интерференции, часто сопровождаемой дополнительной экспрессией гена Dicer, повышающей ее эффективность (Mohr, Perrimon, 2012). Наконец, объединение вышеперечисленных методик с новыми технологиями, такими, как TALENs и CRISPR, способствует развитию направленного редактирования эндогенных локусов, делая из дрозофилы еще более мощную систему для анализа функций белковых молекул (Liu et al., 2012; Ren et al., 2013; Port et al., 2014).
Технологии для манипуляции временной и тканеспецифической экспрессией генов
Многие мутации проявляют тканеспецифический фенотип, или фенотип, зависимый от стадии развития, который не проявляется в других тканях, или в другое время. Особенно это касается мутаций генов-регуляторов цитоскелета. Гибель мутантов по этим генам на эмбриональной стадии препятствует исследованию их функции на более поздних стадиях развития. Кроме того, многие гены у дрозофилы проявляют материнский эффект, когда их продукты (РНК или белки) поступают в эмбрион из организма матери. В этом случае манипулирование геномом эмбриона (например, получение “ноль”-фенотипа) не приведут к желаемой цели, поскольку материнская экспрессия не позволит полностью убрать из организма потомка продукт исследуемого гена. Чтобы это преодолеть, было разработано несколько подходов, позволяющих манипулировать экспрессией генов и трансгенов с высокой пространственно-временной специфичностью. Один из них – широко используемая модульная система GAL4-UAS, которая применяется для индукции ткане- и/или стадия-специфической экспрессии трансгенов (рис. 1б, Brand, Perrimon, 1993). В этой системе дрожжевой активатор транскрипции GAL4, поставленный под контроль эндогенных энхансеров, управляет трансгенными конструкциями, экспрессирующими изучаемый ген под контролем последовательности UAS (Upstream Activating Sequence for GAL4), являющейся мишенью белка GAL4 (рис. 1б). В настоящее время созданы тысячи общедоступных GAL4-драйверных и UAS-репортерных линий. Их использование делает эксперименты по манипулированию генной экспрессией более гибкими, при этом достаточно просто скрестить между собой мух из этих двух линий.
Экспрессия белка GAL4 может подавляться температурочувствительным дрожжевым белком GAL80ts. Учитывая это в своих экспериментах, можно контролировать временную экспрессию желаемого продукта (McGuire et al., 2003). Кроме того, дополнительно были разработаны модульные системы, обеспечивающие одновременное манипулирование экспрессией UAS-трансгена в разных тканях у одного организма (Venken et al., 2011). Система GAL4/UAS также позволяет проводить тканеспецифическое РНКи-опосредованное подавление экспрессии гена (генетический нокдаун). Для этого нужно под контроль последовательности UAS подставить фрагмент, формирующий РНК-шпильку, комплементарную транскриптам исследуемого гена. В помощь этим экспериментам были созданы общедоступные коллекции линий дрозофил, несущих конструкции, способные под контролем UAS генерировать различные РНК-шпильки (Dietzl et al., 2007; Ni et al., 2011). Конструкции UAS-РНКи способны подавлять как материнскую экспрессию гена, так и зиготическую (Sopko et al., 2014). Этими же методами можно проводить направленные скрининги по выявлению регуляторов конкретных онтогенетических процессов или структур цитоскелета. Например, используя драйверную линию, специфически экспрессирующую GAL4 в механосенсорных щетинках в сочетании с UAS-управляемой доминантно-негативной конструкцией, был идентифицирован новый регулятор актинового кросслинкерного белка Singed/фасцина – Rab35. Оказалось, что функция Rab35 рекрутировать фасцин является консервативной, поскольку обнаруживается у этого белка при формировании филоподий в фибробластах линии NIH 3T3 (Zhang et al., 2009).
Другим широко используемым подходом является метод получения гомозиготных мутантных клонов при помощи FLP-опосредованной рекомбинации (рис. 1б). Рекомбиназа FLP (флипаза) специфически узнает сайты FRT и с высокой частотой индуцирует по ним рекомбинацию ДНК. Если у дрозофил, гетерозиготных по летальной мутации, индуцировать митотическую рекомбинацию по сайтам FRT, локализованным возле центромары, то можно получить гомозиготные по летальной мутации клоны клеток внутри гетерозиготной (фенотипически нормальной) ткани (Xu, Rubin, 1993). При дальнейшей модернизации этого метода была создана система MARCM (Mosaic Analysis with a Repressible Cell Marker), которая заключается в комбинировании систем FLP/FRT и GAL4/UAS (Lee, Luo, 2001). В чем ее преимущества? Во-первых, система MARCM позволила значительно улучшить прижизненную визуализацию мутантных клеток, что особенно ценно при исследовании цитоскелета во время роста и ветвления аксонов (Ng et al., 2002). Во-вторых, система MARCM позволила исследователям комбинировать клональный анализ мутаций с потерей функции с индуцибельным UAS-РНКи-опосредованным подавлением экспрессии гена. Также FLP-опосредовательная рекомбинация позволила получать клоны мутантных герминативных клеток в яичниках, что способствовало преодолению материнского эффекта через формирование мутантных ооцитов (а, следовательно, и эмбрионов) без белка или РНК материнского происхождения (Chou et al., 1993).
Наконец, в последнее время стали доступны методы тонкой манипуляции функцией белка в живом организме мухи. Эти методы используют для фотоактивации белка, в которых нативный белок сшит с фоточувствительным ингибиторным доменом растительного белка фототропина, например, paRac1 (Wang et al., 2010), или фотодеградации изучаемого тетрациклин-меченого белка (хромофор-ассоциированная световая инактивация, CALI) (Marek, Davis, 2002). Наконец, можно точно контролировать концентрацию исследуемого GFP-меченого белка с помощью индуцибельной экспрессии антител против GFP, к которым пришит убиквитин, запускающий механизм убиквитин-опосредованной протеолитической белковой деградации (Caussinus et al., 2012). Таким образом, исследования на дрозофиле можно проводить, располагая целым рядом инструментов, позволяющих манипулировать функцией гена в организме через управление его экспрессией в разных тканях и на разных стадиях развития.
Микроскопия: взаимодействия молекул, клеток и тканей
Улучшение качества микроскопов и разработка флуоресцентных зондов для выявления клеточных структур сделали возможным визуализировать динамичные морфогенетические процессы на клеточном и молекулярном уровне (рис. 2).
Благодаря тому, что диаметр эмбриона дрозофилы около 200 мкм, а длина примерно 500 мкм, его можно эффективно анализировать с помощью конфокальной микроскопии. Конфокальная микроскопия, таким образом, стала рабочей лошадкой в исследованиях на дрозофиле. В прошлом исследователи использовали в микроскопии только фиксированные образцы, но развитие новых модальностей в этой области, доступность получения однофотонных и мультифотонных конфокальных снимков и разнообразие флуоресцентных белков сместили акцент на получение изображений в живых клетках (Winter, Shroff, 2014). Прижизненная визуализация процессов, уже изученных на фиксированных образцах, позволила выявить новые морфогенетические механизмы, например такие, как: пульсирующее сокращение клеток, приводящее к сокращению ткани и движению эпителиального пласта в эмбриогенезе (Martin et al., 2009; Solon et al., 2009; Rauzi et al., 2010; He et al., 2010), поляризованная миграция и полный оборот эпителиального пласта (Haigo, Bilder, 2011) и динамика формирования синапсов (Schmid et al., 2008). Множество флуорофоров с различными длинами волн, используемых для получения многоканальных изображений, позволило сопоставлять формообразование и динамические события в клетке со специфическими структурами цитоскелета (Kremers et al., 2011). Так, в режиме реального времени было показано, что клеточные перегруппировки, которые способствуют элонгации эмбриона и удлинению зародышевой полоски, сопровождаются полярным распределением внутри клетки миозиновых моторных белков и белков стыковых контактов (адгерентных связей) (Симонова, Бурдина, 2009; Bertet et al., 2004; Blankenship et al., 2006; Simoes et al., 2010; Rauzi et al., 2010). Применение других нововведений, таких как фото-активируемые и фото-обратимые флуорофоры (Фотоактивируемые GFP (PA-GFP), mEOS, Dendra и Dronpa) позволили проанализировать динамику распределения белков адгерентных связей во время эпителиальной элонгации и белков плазматических мембран во время ранних делений дробления (Cavey et al., 2008; Mavrakis et al., 2009). Сочетание генетических методов и прижизненных съемок у дрозофилы продвинули понимание роли актинового цитоскелета в таких процессах, как цитокинез и миграция клеток, ранее изучаемых в культивируемых клетках. Изучая поведение клеток эпителия во время деления с использованием широкого спектра флуоресцентных белков, было показано, что цитокинез это не просто процесс, управляемый исключительно цитокинетическим контрактильным кольцом, а сложная последовательность событий, во время которых идет формирование трех разных актин-содержащих структур (Founounou et al., 2013; Guillot, Lecuit, 2013; Herszterg et al., 2013).
Еще одним ярким примером скоординированного поведения клеток является групповая миграция бордюрных клеток (рис. 1а). В этой системе динамика движения группы клеток в значительной степени определяется ведущей (лидирующей) клеткой. Создание биосенсоров, работа которых основывается на явлении Ферстеровского переноса энергии (Förster resonance energy transfer, FRET), способствовало выявлению определенных событий, происходящих в живых клетках. Используя эту биосенсорную стратегию, было показано, что лидирующие клетки по сравнению с остальными демонстрируют более высокие уровни активности Rac. Пространственно-временная манипуляция Rac-активностью с использованием фотоактивируемых конструкций подтвердили, что для поляризации всего кластера бордюрных клеток достаточно, чтобы Rac был активен в одной клетке (Wang et al., 2010). Для того чтобы понять, каким образом поляризация кластера бордюрных клеток координируется среди других клеток, окружающих кластер, использовали специфические генетические манипуляции в системе GAL4/UAS. В результате было показано, что эта координация осуществляется по механизму формирования петли обратной связи между Rac и E-кадгериновой адгезией пограничных клеток мигрирующего кластера и окружающих их трофоцитов (Ramel et al., 2013; Cai et al., 2014).
В дополнение к конфокальной микроскопии, исследования на дрозофиле можно проводить с помощью новых методов микроскопии, расширяющей границы разрешения обычных оптических микроскопов (рис. 2). Недавно для анализа процесса резорбции микроворсинок эмбрионального эпителия применили метод флуоресцентной микроскопии полного внутреннего отражения (total internal reflection fluorescence microscopy – TIRFM) (Fabrowski et al., 2013), который позволяет детектировать флуоресцентные объекты в пограничном слое толщиной ~100 нм с разрешением до 10 нм (т.н. флуоресцентная наноскопия). Для изучения структур цитоскелета в стыковых контактах, а также крупных рибонуклеопротеин-содержащих органелл, транспортируемых по “рельсам” цитоскелета в эмбрион, использовали методы сверхвысокого разрешения на основе технологии структурированного освещения (SIM), позволяющей улучшить пространственное разрешение по сравнению с обычными световыми микроскопами примерно до 115 нм (Roper, 2012; Weil et al., 2012).
Применение новых технологий флуоресцентной микроскопии сверхвысокого разрешения, таких как STORM (STochastic Optical Reconstruction Microscopy – микроскопия стохастической оптической реконструкции) или STED (STimulated Emission Depletion microscopy – микроскопия истощения стимулированной эмиссии) позволяет ученым связать события, происходящие на молекулярном уровне с поведением клеток и тканей во время морфогенеза. И, наконец, появление микроскопии выборочного освещения плоскостей (SPIM) и микроскопии светового листа с дискретным освещением (lattice-light-sheet microscopy) помогает увеличить масштаб изображения, позволяя с достаточным разрешением рассматривать и регистрировать перемещения одной биомолекулы, увидеть процессы, происходящие внутри клетки, проследить поведение отдельных клеток в окружающем матриксе, а также взаимодействие клеток в многоклеточных системах (Keller et al., 2010; Rebollo et al., 2014; Chen et al., 2014). Это очень щадящие по отношению к клетке методы съемки прижизненных образцов, поскольку освещается только та область, которая фотографируется, при этом минимизируются фототоксичность и обесцвечивание. К тому же данная методика обеспечивает оптическое разрешение за счет освещения только тех областей, которые находятся строго в фокусе, поскольку внефокусное освещение, как правило, приводит к размытости изображения. Подобные достижения в области анализа и моделирования живого изображения позволили исследователям накопить данные и функционально связать взаимодействия между сигнальными молекулами, которые устанавливают полярность, действуя на субклеточном уровне, и механическими силами, которые контролируют динамику морфогенеза, действуя на тканевом уровне (Aigouy et al., 2010; Bosveld et al., 2012).
ЗАКЛЮЧЕНИЕ
Низкая стоимость содержания дрозофилы и возможность использовать ее в исследованиях инновационными методами позволяют проводить как широкомасштабные, так и направленные скрининги новых генов, описывать сигнальные пути, контролирующие формирование и функционирование цитоскелета. Используя новые молекулярно-генетические методы, можно вносить нужные изменения в конкретные гены, а также детально анализировать их функции точно в определенной ткани и в нужный период развития. И, наконец, достижения в области визуализации и количественного анализа делают из дрозофилы уникальный инструмент, как для понимания функций отдельных регуляторов цитоскелета, так и для оценки эффекта, который они производят на клетки и ткани.
Данная работа финансировалась Российским фондом фундаментальных исследований (проекты 16-04-00829-a, 18-34-00162 мол-а) и выполнена в рамках раздела Государственного задания ИБР РАН, № 0108-2019-0001.
Список литературы
Симонова О.Б., Бурдина Н.В. Морфогенетическое движение клеток в эмбриогенезе Drosophila: механизмы и генетический контроль // Онтогенез. 2009. Т. 40. № 5. С. 355–372.
Abmayr S.M., Pavlath G.K. Myoblast fusion: lessons from flies and mice // Development. 2012. V. 139. № 4. P. 641–656.
Aigouy B., Farhadifar R., Staple D.B. et al. Cell flow reorients the axis of planar polarity in the wing epithelium of Drosophila // Cell. 2010. V. 142. P. 773–786.
Bertet C., Sulak L., Lecuit T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation // Nature. 2004. V. 429. P. 667–671.
Blankenship J.T., Backovic S.T., Sanny J.S. et al. Multicellular rosette formation links planar cell polarity to tissue morphogenesis // Dev Cell. 2006. V. 11. P. 459–470.
Bosveld F., Bonnet I., Guirao B. et al. Mechanical control of morphogenesis by Fat/Dachsous/Four-jointed planar cell polarity pathway // Science. 2012. V. 336. № 6082. P. 724–727.
Cai D., Chen S.C., Prasad M. et al. Mechanical feedback through E-cadherin promotes direction sensing during collective cell migration // Cell. 2014. V. 157. P. 1146–1159.
Caussinus E., Kanca O., Affolter M. Fluorescent fusion protein knockout mediated by anti-GFP nanobody // Nat. Struct. Mol. Biol. 2012. V. 19. P. 117–121.
Cavey M., Rauzi M., Lenne P.F. et al. A two-tiered mechanism for stabilization and immobilization of E-cadherin // Nature. 2008. V. 453. P. 751–756.
Chen B.C., Legant W.R., Wang K. et al. Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution // Science. 2014. V. 46. № 6208. P. 1257998.
Chou T.B., Noll E., Perrimon N. Autosomal P[ovoD1] dominant female-sterile insertions in Drosophila and their use in generating germ-line chimeras // Development. 1993. V. 119. P. 1359–1369.
DeRosier D.J., Tilney L.G. F-actin bundles are derivatives of microvilli: What does this tell us about how bundles might form? // J. Cell Biol. 2000. V. 148. P. 1–6.
Desai R., Sarpal R., Ishiyama N. et al. Monomeric alpha-catenin links cadherin to the actin cytoskeleton // Nat. Cell Biol. 2013. V. 15. P. 261–273.
Dietzl G., Chen D., Schnorrer F. et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila // Nature. 2007. V. 448. № 7150. P. 151–156.
Fabian L., Brill J.A. Drosophila spermiogenesis: Big things come from little packages // Spermatogenesis. 2012. V. 2. P. 197–212.
Fabrowski P., Necakov A.S., Mumbauer S. et al. Tubular endocytosis drives remodelling of the apical surface during epithelial morphogenesis in Drosophila // Nat. Commun. 2013. V. 4. P. 2244.
Founounou N., Loyer N., Le Borgne R. Septins regulate the contractility of the actomyosin ring to enable adherens junction remodeling during cytokinesis of epithelial cells // Dev. Cell. 2013. V. 24. P. 242–255.
Guillot C., Lecuit T. Adhesion disengagement uncouples intrinsic and extrinsic forces to drive cytokinesis in epithelial tissues // Dev. Cell. 2013. V. 24. P. 227–241.
Haigo S.L., Bilder D. Global tissue revolutions in a morphogenetic movement controlling elongation // Science. 2011. V. 331. P. 1071–1074.
Haglund K., Nezis I.P., Stenmark H. Structure and functions of stable intercellular bridges formed by incomplete cytokinesis during development // Commun. Integr. Biol. 2011. V. 4. P. 1–9.
He L., Wang X., Tang H.L. et al. Tissue elongation requires oscillating contractions of a basal actomyosin network // Nat. Cell Biol. 2010. V. 12. P. 1133–1142.
Herszterg S., Leibfried A., Bosveld F. et al. Interplay between the dividing cell and its neighbors regulates adherens junction formation during cytokinesis in epithelial tissue // Dev. Cell. 2013. V. 24. P. 256–270.
Hudson A.M., Cooley L. Understanding the function of actin-binding proteins through genetic analysis of Drosophila oogenesis // Annu. Rev. Genet. 2002. V. 36. P. 455–488.
Keller P.J., Schmidt A.D., Santella A. et al. Fast, high-contrast imaging of animal development with scanned light sheet-based structured-illumination microscopy // Nat. Methods. 2010. V. 7. P. 637–642.
Kiger A.A., Baum B., Jones S. et al. A functional genomic analysis of cell morphology using RNA interference // J. Biol. 2003. V. 2. P. 27.
Kim J.H., Cho A., Yin H. et al. Psidin, a conserved protein that regulates protrusion dynamics and cell migration // Genes Dev. 2011. V. 25. P. 730–741.
Kim J.H., Jin P., Duan R., Chen E.H. Mechanisms of myoblast fusion during muscle development // Curr. Opin. Genet. Dev. 2015. V. 32. P. 162–170.
Kremers G.J., Gilbert S.G., Cranfill P.J. et al. Fluorescent proteins at a glance // J. Cell Sci. 2011. V. 124. P. 157–160.
Lee T., Luo L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development // Trends Neurosci. 2001. V. 24. P. 251–254.
Linder S., Wiesner C., Himmel M. Degrading devices: invadosomes in proteolytic cell invasion // Annu. Rev. Cell Dev. Biol. 2011. V. 27. P. 185–211.
Liu J., Li C., Yu Z. et al. Efficient and specific modifications of the Drosophila genome by means of an easy TALEN strategy // J. Genet. Genomics. 2012. V. 39. P. 209–215.
Luxton G.W., Gomes E.R., Folker E.S. et al. Linear arrays of nuclear envelope proteins harness retrograde actin flow for nuclear movement // Science. 2010. V. 329. P. 956–959.
Lye C.M., Sanson B. Tension and epithelial morphogenesis in Drosophila early embryos // Curr. Top. Dev. Biol. 2011. V. 95. P. 145–187.
Marek K.W., Davis G.W. Transgenically encoded protein photoinactivation (FlAsH-FALI): acute inactivation of synaptotagmin I // Neuron. 2002. V. 36. P. 805–813.
Martin A.C., Kaschube M., Wieschaus E.F. Pulsed contractions of an actin-myosin network drive apical constriction // Nature. 2009. V. 457. P. 495–499.
Mavrakis M., Rikhy R., Lippincott-Schwartz J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo // Dev. Cell. 2009. V. 16. P. 93–104.
McGuire S.E., Le P.T., Osborn A.J. et al. Spatiotemporal rescue of memory dysfunction in Drosophila // Science. 2003. V. 302. P. 1765–1768.
Montell D.J., Yoon W.H., Starz-Gaiano M. Group choreography: mechanisms orchestrating the collective movement of border cells // Nat. Rev. Mol. Cell Biol. 2012. V. 13. P. 631–645.
Mohr S.E., Perrimon N. RNAi screening: new approaches, understandings, and organisms // Wiley Interdiscip Rev. RNA. 2012. V. 3. P. 145–158.
Ni J.Q., Zhou R., Czech B. et al. A genomescale shRNA resource for transgenic RNAi in Drosophila // Nat. Methods. 2011. V. 8. P. 405–407.
Nusslein-Volhard C., Wieschaus E. Mutations affecting segment number and polarity in Drosophila // Nature. 1980. V. 287. P. 795–801.
Ng J., Nardine T., Harms M. et al. Rac GTPases control axon growth, guidance and branching // Nature. 2002. V. 416. P. 442–447.
Port F., Chen H.M., Lee T. et al. Optimized CRISPR/Cas tools for efficient germline and somatic genome engineering in Drosophila // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. E2967–2976.
Pfender S., Kuznetsov V., Pleiser S. et al. Spire-type actin nucleators cooperate with Formin-2 to drive asymmetric oocyte division // Curr. Biol. 2011. V. 21. P. 955–960.
Ramel D., Wang X., Laflamme C. et al. Rab11 regulates cell-cell communication during collective cell movements // Nat. Cell Biol. 2013. V. 15. P. 317–324.
Rauzi M., Lenne P.F., Lecuit T. Planar polarized actomyosin contractile flows control epithelial junction remodeling // Nature. 2010. V. 468. P. 1110–1114.
Rebollo E., Karkali K., Mangione F. et al. Live imaging in Drosophila: The optical and genetic toolkits // Methods. 2014. V. 68. P. 48–59.
Ren X., Sun J., Housden B.E. et al. Optimized gene editing technology for Drosophila melanogaster using germ line-specific Cas9 // Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 47. P. 19012–19017.
Rodal A.A., Del Signore S.J., Martin A.C. Drosophila comes of age as a model system for understanding the function of cytoskeletal proteins in cells, tissues, and organisms // Cytoskeleton (Hoboken, NJ). 2015. V. 72. № 5. P. 207–224.
Rogers S.L., Wiedemann U., Stuurman N. et al. Molecular requirements for actin-based lamella formation in Drosophila S2 cells // J. Cell Biol. 2003. V. 162. P. 1079–1088.
Rohn J.L., Sims D., Liu T. et al. Comparative RNAi screening identifies a conserved core metazoan actinome by phenotype // J. Cell Biol. 2011. V. 194. P. 789–805.
Roper K. Anisotropy of Crumbs and aPKC drives myosin cable assembly during tube formation // Dev. Cell. 2012. V. 23. P. 939–953.
Roper K. Supracellular actomyosin assemblies during development // Bioarchitecture. 2013. V. 3. P. 45–49.
Schachtner H., Calaminus S.D., Thomas S.G. et al. Podosomes in adhesion, migration, mechanosensing and matrix remodeling // Cytoskeleton (Hoboken). 2013. V. 70. P. 572–589.
Schmid A., Hallermann S., Kittel R.J. et al. Activity-dependent site-specific changes of glutamate receptor composition in vivo // Nat. Neurosci. 2008. V. 11. P. 659–666.
Schupbach T., Wieschaus E. Female sterile mutations on the second chromosome of Drosophila melanogaster. I. Maternal effect mutations // Genetics. V. 1989. P. 101–117.
Simoes S., Blankenship J.T., Weitz O. et al. Rho-kinase directs Bazooka/Par-3 planar polarity during Drosophila axis elongation // Dev. Cell. 2010. V 19. P. 377–388.
Solon J., Kaya-Copur A., Colombelli J. et al. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure // Cell. 2009. V. 137. P. 1331–1342.
Sopko R., Foos M., Vinayagam A. et al. Combining genetic perturbations and proteomics to examine kinase-phosphatase networks in Drosophila embryos // Dev. Cell. 2014. V. 31. P. 114–127.
Tilney L.G., DeRosier D.J. How to make a curved Drosophila bristle using straight actin bundles // Proc. Natl. Acad. Sci. USA. 2005. V. 102. P. 18785–18792.
Venken K.J., Simpson J.H., Bellen H.J. Genetic manipulation of genes and cells in the nervous system of the fruit fly // Neuron. 2011. V. 72. P. 202–230.
Wang X., He L., Wu Y.I. et al. Light-mediated activation reveals a key role for Rac in collective guidance of cell movement in vivo // Nat. Cell Biol. 2010. V. 12. P. 591–597.
Wangler M.F., Yamamoto S., Bellen H.J. Fruit flies in biomedical research // Genetics. 2015. V. 199. № 3. P. 639–653.
Weil T.T., Parton R.M., Herpers B. et al. Drosophila patterning is established by differential association of mRNAs with P bodies // Nat. Cell Biol. 2012. V. 14. № 12. P. 1305–1313.
Winter P.W., Shroff H. Faster fluorescence microscopy: advances in high speed biological imaging // Curr. Opin. Chem. Biol. 2014. V. 20. P. 46–53.
Xu T., Rubin G.M. Analysis of genetic mosaics in developing and adult Drosophila tissues // Development. 1993. V. 117. P. 1223–1237.
Zhang J., Fonovic M., Suyama K. et al. Rab35 controls actin bundling by recruiting fascin as an effector protein // Science. 2009. V. 325. P. 1250–1254.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез



