Онтогенез, 2019, T. 50, № 3, стр. 170-180
Мейоз при микроспорогенезе у ели сибирской (Picea obovata Ledeb.) в условиях юга Средней Сибири
Е. В. Бажина a, *, М. И. Седаева a, **, Е. Н. Муратова a, ***
a Институт леса им. В.Н. Сукачева Сибирского отделения Российской академии наук – обособленное подразделение Федерального государственного бюджетного научного учреждения Федерального исследовательского центра “Красноярский научный центр СО РАН”
660036 Красноярск, Академгородок, 50, строение 28, Россия
* E-mail: genetics@ksc.krasn.ru
** E-mail: msedaeva@ksc.krasn.ru
*** E-mail: elena-muratova@ksc.krasn.ru
Поступила в редакцию 15.06.2018
После доработки 15.06.2018
Принята к публикации 21.07.2018
Аннотация
Представлены результаты исследований мейоза при микроспорогенезе у ели сибирской (Picea obovata Ledeb.) в лесных экосистемах юга Средней Сибири. Выявлены особенности мейоза, на разных стадиях мейоза отмечены различные типы нарушений. Особенности развития мужских репродуктивных структур показывают высокую степень адаптации ели сибирской к резко континентальному климату Сибири.
ВВЕДЕНИЕ
Ель сибирская (Picea obovata Ledeb.) – занимает обширный ареал от границы лесотундры (59°–72° с.ш.) на севере до степной зоны (53°–56° с.ш.) на юге (Правдин, 1975; Соколов и др., 1977; Бобров, 1978). В пределах ареала еловые леса распределены крайне неравномерно – в основном приурочены к влажным экотопам Европейского севера и гор Урала и Сибири (Атлас лесов СССР, 1973).
Развитие репродуктивных органов в значительной степени определяется воздействием различных факторов среды. Известно, что у хвойных мейоз является одним из наиболее уязвимых и восприимчивых к воздействию факторов внешней среды периодов в онтогенезе (Christiansen, 1960; Mergen, Lester, 1961; Andersson, 1965, 1980; Chandler, Mavrodineanu, 1965; Eriksson, 1968; Andersson et al., 1969; Ekberg et al., 1970, 1972; Eriksson et al., 1970; Козубов, 1974; Круклис, 1974; Некрасова, 1976; Luomajoki, 1977, 1986; Яковлев, 1978; Рождественский, 1981; Муратова, 1995; Романова, Третьякова, 2005; Deng, Zhang, 2005; Бажина и др., 2007а, 2007б; Носкова и др., 2009; Bazhina et al., 2011; Goryachkina, Muratova, 2016 и др.).
От характера прохождения мейоза зависит качество мужских гамет и успешность оплодотворения; нарушения мейоза часто приводят к стерильности пыльцы и семян. Установлено, что мужских гамет (пыльцевых зерен) у хвойных формируется на несколько порядков больше, чем женских, и они более подвержены воздействию внешних факторов (Andersson, 1965; Козубов, 1974; Некрасова, 1976, 1983 и др.). Процесс мейоза и поведение хромосом в мейозе находятся под генетическим контролем и определяются взаимодействием между генотипом и окружающей средой (Голубовская, 1975а, 1975б, 1985; Соснихина и др., 1994, 2003; Симановский, Богданов, 2018 и др.).
Среди представителей рода Picea процессы мейоза и формирования пыльцы наиболее полно изучены у ели обыкновенной P. abies (L.) Karst. в нескольких местообитаниях Европы (Sax, Sax, 1933; Andersson, 1947a, 1947b, 1965, 1980; Ekberg et al., 1970; Eriksson et al., 1970; Козубов, 1974). Кроме различных нарушений мейоза, влияющих на качество пыльцы, у этого вида обнаружена асинаптическая мутация (Andersson, 1947a, 1947b). Имеется краткое описание хода мейоза при микроспорогенезе североамериканских видов ели P. mariana и P. pungens (Sax, Sax, 1933); исследован мейоз у P. sitchensis с добавочными хромосомами (Moir, Fox, 1975). Кроме того, изучен микроспорогенез и мейоз трех восточноазиатских видов – P. meyeri, P. smithiana, P. wilsonii (Deng, Zhang, 2005).
В настоящем сообщении рассматриваются особенности мейоза ели сибирской (P. obovata) в естественных популяциях юга Средней Сибири. Данных по мейозу ели сибирской на территории Сибири в литературе почти нет, за исключением краткого сообщения М.В. Круклис (1982) о поведении хромосом в мейозе у деревьев с В-хромосомами. Подробнее мейоз у ели изучался Ю.Ф. Рождественским (1981) на Северном Урале, в зоне лесотундры (окр. Салехарда, Ямало-Ненецкий автономный округ). Анализ нарушений мейоза у ели сибирской в условиях природного и техногенного стресса, а также аномалий пыльцы при промышленном загрязнении на Южном Урале проведен Н.А. Калашник с соавторами (Калашник и др., 2008; Калашник, 2011; Калашник, Ясовиева, 2012). Территория Урала входит в зону интрогрессивной гибридизации ели сибирской и ели европейской (Правдин, 1975; Бобров, 1978; Попов, 2005).
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования являлись деревья ели сибирской, произрастающие на юго-восточной окраине Западно-Сибирской равнины в долине р. Еловка (Емельяновский р-н Красноярского края, 56°08′ с.ш. и 92°32′ в.д.). Для территории исследований характерен холмисто-увалистый рельеф. Почвенный покров по склонам и вершинам увалов представлен темно-серыми и серыми лесными почвами. Климат резко континентальный, с господствующим юго-западным направлением ветров, с холодной зимой и жарким летом (Атлас лесов СССР, 1973). Среднегодовая температура воздуха составляет +0.5°С, среднегодовое количество осадков – 485 мм/год. Средняя продолжительность безморозного периода – 120 дней, средняя дата последнего заморозка весной – 22 июня, первого осенью – 20 сентября. Влияние вредных выбросов промышленных центров (в основном г. Красноярска) на территории незначительное, ввиду удачного географического положения и господствующего направления ветров.
Материалом для исследования послужили мужские генеративные почки 16 средневозрастных (90–150 лет) деревьев ели сибирской из различных биоценотических условий: в центре насаждения – пробная площадь (п/п) № 1, на опушке (п/п № 2), на северном склоне (п/п № 3). Микростробилы фиксировали ежедневно с 26 по 30 апреля 2017 г. в спиртово-уксусной смеси (3 : 1). Материал выдерживали в фиксаторе 1–2 сут, затем переводили в 70%-й спирт на хранение. В качестве красителя использовали ацетогематоксилин. При проведении работы было проанализировано около 8000 делящихся микроспороцитов, подсчитано их количество на разных стадиях мейоза, определены размеры, отмечены типы и частота нарушений. Исследования проводили с помощью микроскопа Микромед-2 (ЛОМО, Россия) с видеокамерой DCM-510 (Scoptek, КНР), статистическую обработку данных проводили по общепринятым методикам.
Таблица 1.
Частота встречаемости аномальных мейоцитов (минимум–максимум), %
| Аномалии мейоза | Частота встречаемости на разных стадиях, % | ||
|---|---|---|---|
| п/п № 1 | п/п № 2 | п/п № 3 | |
| Профаза I | |||
| Агглютинация хроматина | – | – | 0–33.3 |
| Хаотическое расположение бивалентов | – | 0–4.8 | – |
| Метафаза I | |||
| Хромосомы за пределами экваториальной пластинки | 0–2.5 | 0–1.4 | – |
| Агглютинация | – | 0–6.9 | – |
| Образование двух групп хромосом | 0–1.3 | – | – |
| Хаотическое расположение хромосом | – | 0–1.4 | – |
| Ана-телофаза I | |||
| Отставание | 0–1.5 | 0–1.9 | 1.3–2.7 |
| Образование трех полюсов | – | – | 0–1.4 |
| Растяжение хромосом | – | – | 0–2.7 |
| Мосты | – | – | 0–1.4 |
| Диады | |||
| Триады | – | 0–3.3 | – |
| Метафаза II | |||
| Расположение хромосом за пределами метафазной пластинки | 0–2.4 | 0–1.5 | 0–4.9 |
| Хаотическое расположение | 0–1.2 | – | – |
| Агглютинация | – | 0–5.8 | – |
| Образование трех групп хромосом | – | 0–2.9 | – |
| Ана-телофаза II | |||
| Отставание | 0–1.3 | – | 0–0.7 |
| Хаотическое расположение хромосом | – | 0–2.5 | 0–0.7 |
| Агглютинация | – | 0–2.5 | – |
| Мосты | 0–1.3 | 0–2.5 | – |
| Образование трех полюсов | 0–2.2 | – | – |
| Асинхронное деление в одном мейоците | 0.2–2.5 | 0.7–1.9 | – |
| Тетрады | |||
| Триады | 3.5–45.0 | 0–28.6 | 0–13.6 |
| Пентады | – | 0–6.9 | – |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мейоз у ели сибирской начинается и заканчивается весной. В лесных экосистемах юга Средней Сибири мейоз у данного вида проходит в последней декаде апреля (рис. 1). Сумма эффективных температур на начало мейоза – $\sum {{{t}_{{{\text{э ф > 5}}}}}} $ = 55.6°, что составило 3.4% от суммы эффективных температур за 2017 г. На рис. 2 показано первое мейотическое деление, на рис. 3 – второе деление и формирование пыльцевого зерна ели сибирской.
Рис. 1.
Сроки прохождения мейоза ( ) у ели сибирской Picea obovata Ledeb. в условиях юга Средней Сибири в зависимости от температуры воздуха (по оси
ординат, °С).
) у ели сибирской Picea obovata Ledeb. в условиях юга Средней Сибири в зависимости от температуры воздуха (по оси
ординат, °С).
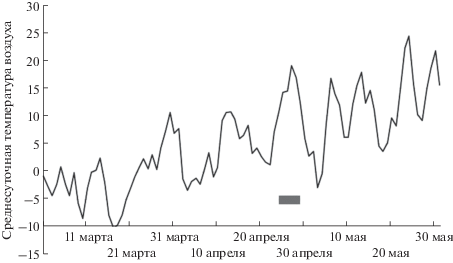
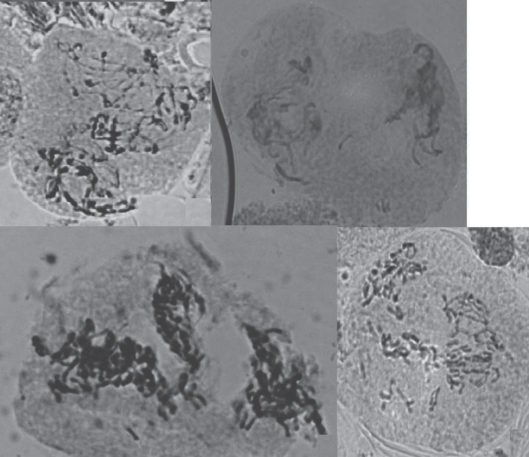
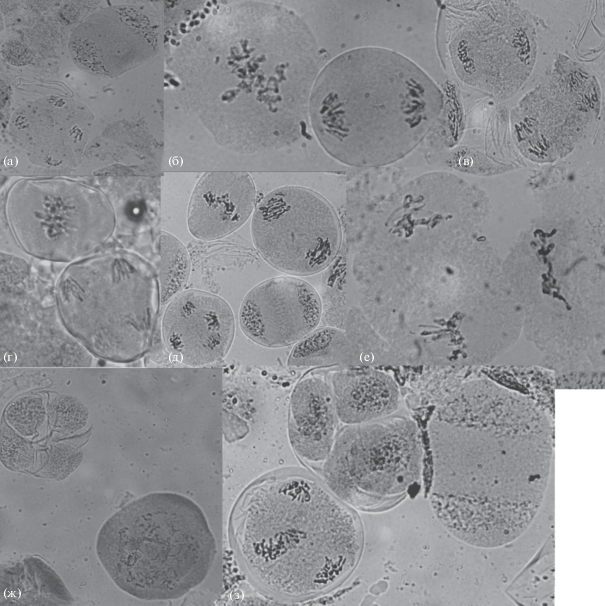
Рис. 2.
Первое деление мейоза у ели сибирской: а – материнская клетка микроспоры; б – лептотена; в – зиготена; г – пахитена; д – диплотена; е – диакинез; ж – метафаза I; з – анафаза I; и – телофаза I. Увел.: об. 100×, ок. 10×.
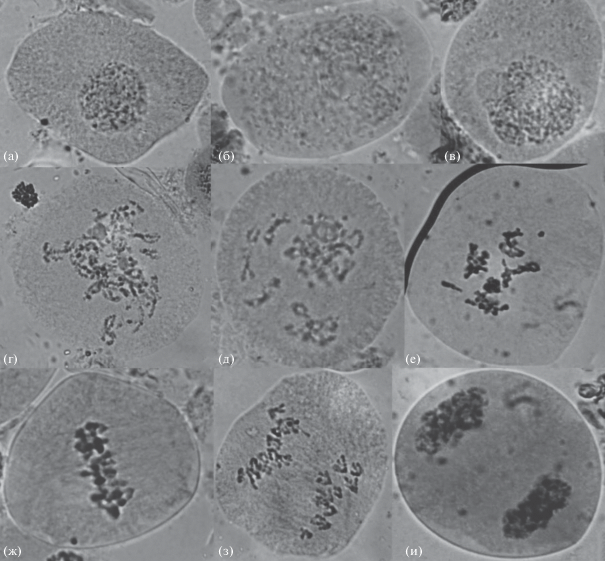
Рис. 3.
Второе деление мейоза и формирование пыльцевого зерна у ели сибирской: а – диада; б –профаза II; в – метафаза II; г – анафаза II; д – телофаза II; е – формирующаяся тетрада микроспор; ж – микроспора; з – одноклеточное пыльцевое зерно; и – трехклеточное пыльцевое зерно. Увел.: об. 100×, ок. 10×.
В третьей декаде апреля в микроспорангиях видны микроспороциты (материнские клетки пыльцы) округлой формы на стадии профазы первого деления (рис. 2б–2е). Диаметр мейоцитов на этой стадии составлял 35.1 × 32.5 (±1.61–1.96) мкм, что несколько больше, чем у окружающих клеток тапетума – 28.8 × 33.9 (±1.44–1.73) мкм. Размеры мейоцитов ели сибирской на стадии профазы I в условиях юга Средней Сибири меньше, чем в зоне лесотундры в районе Салехарда (Рождественский, 1981). Размах варьирования размеров у изученных деревьев достигает 30.4%; это выше, чем у северной границы распространения вида (8–11%).
Мейоз у ели сибирской проходит по классическому типу. Все стадии профазы первого деления (лептотена, зиготена, пахитена, диплотена и диакинез) хорошо идентифицируются. В мейоцитах насчитывается до четырех ядрышек (чаще 1–2) практически одинакового размера. У ели сибирской образуется 12 бивалентов; их морфология определяется расположением и числом хиазм, которых насчитывается от 1 до 4 на бивалент.
Профаза первого деления у ели сибирской является наиболее длительной стадией, как и у других хвойных (Mergen, Lester, 1961; Andersson et al., 1969; Круклис, 1974; Буторина и др., 1982, 1989; Муратова, 1995; Deng, Zhang, 2005; Бажина и др., 2007а, 2007б; Goryachkina, Muratova, 2016). Далее, начиная с метафазы первого деления, мейоз проходит очень быстро, в течение 1–3 суток. Скорость прохождения мейоза различается в зависимости от условий произрастания. Так, например, у отдельных деревьев, растущих на опушке (п/п № 2), уже 26 апреля лишь в 2.7% проанализированных клеток наблюдались стадии второго деления мейоза, остальные 97.3% представляли собой одноклеточные пыльцевые зерна. В клетках тапетума насчитывалось до 6 ядер.
В то же время у деревьев, растущих на северном склоне (п/п № 3), 56.4% мейоцитов находились на стадии лептотены (П I), а 9.4% мейоцитов – еще на стадии материнских клеток микроспор (МКМ). Ранее было показано, что в районах Крайнего Севера мейоз у ели сибирской проходит в течение 3–4 дней (Рождественский, 1981). Увеличение продолжительности мейоза в экстремальных условиях было отмечено также у пихты сибирской Abies sibirica (Бажина и др., 2007б; Bazhina et al., 2011).
Исследования показали, что у ели сибирской в мейозе четко идентифицируется профаза второго деления, как и у видов рода Abies (Mergen, Lester, 1961; Бажина и др., 2007а, 2007б; Bazhina et al., 2011). У некоторых видов хвойных, например, у сосны обыкновенной, она отсутствует и после интеркинеза сразу начинается метафаза II (Буторина и др., 1982; Муратова, 1995).
После распада тетрад микроспор до первых проталлиальных делений у хвойных, как правило, наблюдается период покоя, который может продолжаться около 6 дней (Козубов, 1974; Бажина и др., 2007а, 2007б; Bazhina et al., 2011). Однако, у ели сибирской в условиях Сибири уже 27 апреля (на следующее утро после начала активных делений мейоцитов) наблюдались митотические деления в пыльцевых зернах.
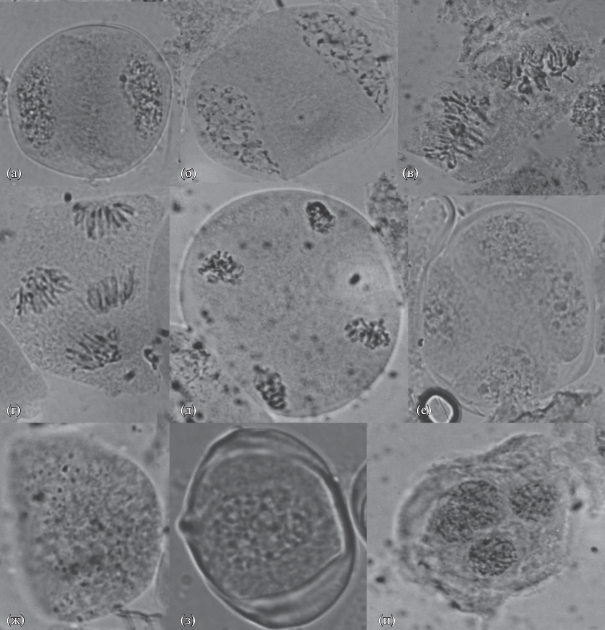
Для мейоза ели сибирской характерна высокая степень асинхронности (рис. 4). В пределах одного дерева в микростробилах можно было наблюдать и профазы первого деления, и формирующиеся пыльцевые зерна. В одном микроспорангии одновременно наблюдались профазы первого деления и тетрады (рис. 4ж). Отмечены также следующие сочетания: МКМ – метафаза II, пахитена – метафаза I, метафаза II, или анафаза II, или телофаза II – одноклеточные пыльцевые зерна (рис. 4). Частота встречаемости таких мейоцитов достигала 0.23–1.92% у разных деревьев. Максимальная степень асинхронности отмечена на п/п № 1 (центр насаждения). Крайне редко (0.23–0.46% клеток) асинхронное развитие наблюдалось в пределах одного мейоцита, например, на одном полюсе – метафаза II, на другом – ана-телофаза II, либо профаза II и ана-телофаза II.
Рис. 4.
Асинхронное развитие мейоцитов: а – профаза II–анафаза II; б – метафаза I–анафаза I; в – телофаза I–анафаза II; г – метафаза I–анафаза II; д – метафаза I и профаза II–анафаза II; е – метафаза I–метафаза II; ж – профаза I–тетрада; з – профаза II–анафаза II–тетрада. Увел.: об. 100×, ок. 10×.
В большинстве изученных клеток ели сибирской мейоз проходил довольно регулярно, хромосомы в основном правильно расходились к противоположным полюсам, однако были обнаружены мейотические нарушения. К ним относятся: агглютинация на стадиях метафазы I и II, хаотическое расположение бивалентов в диакинезе, расположение хромосом вне веретена деления, образование трех групп хромосом на стадии метафазы II, мосты на стадиях анафазы I и II, растяжение хромосом на стадии ана-телофазы I, хаотическое расположение хромосом на стадиях метафазы II и ана-телофазы II, отставание хромосом на стадии ана-телофазы II, образование трех полюсов в ана-телофазе II, образование триад на стадии диад, а также диад, триад и пентад на стадии тетрад (рис. 5). Кроме того, у исследованных деревьев были обнаружены множественные нарушения второго деления мейоза (рис. 6).
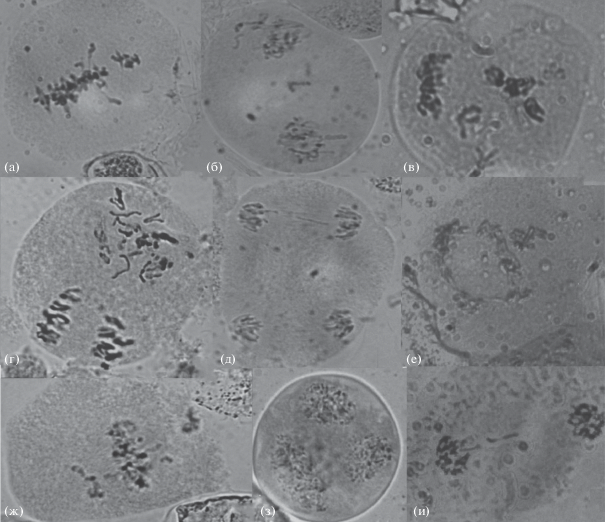
Рис. 5.
Аномалии мейоза у ели сибирской: а – две группы хромосом в М I; б – хромосомы вне экваториальных пластинок в М II; в – хаотическое расхождение в А I; г – хаотическое расхождение на одном из полюсов в А II; д – мост в А II; е – агглютинация в М II; ж – хромосомы за пределами пластинки в М I; з – триада; и – телофаза I с разорванным мостом. Увел.: об. 100×, ок. 10×.
Частота нарушений в мейозе у разных деревьев варьирует (табл. 1). Каждое дерево характеризуется определенным уровнем нарушений, что может быть связано с их генетическими особенностями. Значительное число нарушений (до 33.3%) отмечено в первом делении мейоза у одного из деревьев, растущих на п/п № 3. Многие нарушения, как правило, элиминируются до стадии тетрад, и не влияют на жизнеспособность пыльцы. Тем не менее, максимальное число нарушений у ели сибирской наблюдалось именно на стадии тетрад (45.0%). У всех деревьев отмечены триады (характеризуются нередуцированным числом хромосом – 2n вместо n), у одного – из исследованных деревьев – пентады (являются нежизнеспособными, т.к. имеют неполное число хромосом).
При микроспорогенезе у ели сибирской наряду с пыльцой нормальной морфологии (с двумя воздушными мешками), были обнаружены пыльцевые зерна с аномальным числом воздушных мешков – с одним воротничковым мешком (0.2–1.01%), четырьмя воздушными мешками (0.28%), а также со сросшимися мешками (0.1%). Однако, в отличие от ели сибирской в районах Крайнего Севера и Южного Урала (Рождественский, 1981; Калашник, 2011), частота аномалий пыльцы крайне низкая – не превышает 1.94%.
Некоторые из аномалий позволяют предположить наличие хромосомных мутаций у ели сибирской. Появление хроматидных мостов с фрагментами в АI и АII мейоза свидетельствует о гетерозиготности по парацентрической инверсии или гомозиготности по инвертированной дупликации (Соснихина, 1973; Хвостова, Ячевская, 1975). Наличие мостов без фрагментов обусловлено запоздалой терминализацией хиазм, разрывами хромосом на разных стадиях мейоза, кроссинговером между гомологичными хромосомами.
Поскольку процесс мейоза находится под генетическим контролем, часть нарушений может быть связана с мутациями мейотических генов. Такая аномалия, как агглютинация или слипание хромосом, обнаружена у многих растений, в том числе хвойных (Beadle, 1937; Johnson, 1944; Mehra, Rai, 1970; Соснихина, 1973; Муратова, 1995 и др.). Явление может быть обусловлено мутациями, вызывающими блокаду профазы I мейоза (Голубовская, Ситникова, 1980; Голубовская, 1985).
Хромосомные аномалии в анафазе I могут вызываться генами, контролирующими образование веретена деления и расхождение хромосом. К ним относится ген dv у кукурузы и mei-4 у Potentilla anserina, действие которых приводит к повреждению ахроматического веретена (Голубовская, 1975а, 1975б, 1985; Голубовская, Ситникова, 1980; Шамина и др., 1981). При полном повреждении хромосомы беспорядочно распределяются по клетке или концентрируются в центре; при частичном – отдельные хромосомы или их группы отстают, неравномерно распределяются между двумя или, при расщеплении веретена, тремя полюсами. Подобные цитологические картины описаны также у сосны обыкновенной (Буторина и др., 1988; Пожидаева, Исаков, 1989).
Отставание и агглютинация хромосом могут наблюдаться также при моно- или дигенных рецессивных мутациях (Соснихина и др., 1994; Mehra, Rai 1970). После цитокинеза при этом образуются полиады с микро- и макроядрами различного размера и хромосомного состава, что приводит к формированию неоднородных по размеру и форме пыльцевых зерен и вызывает снижение фертильности пыльцы. Аномалии мейоза, связанные с потерей генетического материала (фрагменты, выбросы, отставания хромосом), как правило, ведут к формированию гамет с анеуплоидным числом хромосом, образованию мелкой фракции пыльцы или дефектных пыльцевых зерен.
У ели сибирской встречалась параллельная, линейная или перпендикулярная ориентация веретена деления в мета- анафазе II. Частота встречаемости мейоцитов с отмеченными особенностями составляла 0.7–24.1%. Исследования ряда авторов (Mok, Peloquin, 1975; Буторина и др., 1985; Andreuzza, Siddiqi, 2008) показали, что в норме во втором делении мейоза веретена должны быть ориентированы по отношению друг к другу под углом 60°. Параллельное расположение может быть обусловлено мутацией ps и привести к слиянию одной или двух групп хромосом на противоположных полюсах и формированию пыльцевых зерен с диплоидным числом хромосом. Процесс слияния веретен в значительной степени зависит от факторов внешней среды (Veileux et al., 1982).
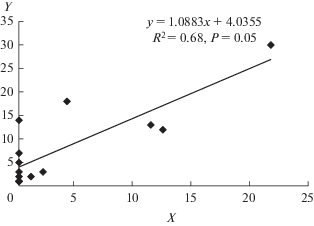
Впервые эта мутация была описана у представителей рода Solanum (Mok, Peloquin, 1975), затем была обнаружена у сосны обыкновенной (Буторина и др., 1985; Пожидаева, Исаков, 1989). Регрессионный анализ показал, что частота встречаемости триад у ели сибирской коррелирует с частотой встречаемости мейоцитов с аномальной ориентацией веретен деления (рис. 7) и, возможно, является причиной их формирования у данного вида.
Рис. 7.
Регрессия между числом мейоцитов с аномальной ориентацией веретен деления (X) и частотой встречаемости триад (Y), %.
Большинство стадий мейоза у хвойных очень чувствительно к изменениям температуры (Christiansen, 1960; Chandler, Mavrodineanu, 1965; Eriksson, 1968; Andersson et al., 1969; Ekberg et al., 1970, 1972; Eriksson et al., 1970; Козубов, 1974; Круклис, 1974; Luomajoki, 1977, 1986; Andersson, 1980; Яковлев, 1978 и др.). Критическая температура, способная вызвать хромосомные нарушения в мейозе при микроспорогенезе у видов Picea, составляет – 2–4°С (Andersson et al., 1969). Температурные экстремумы, характерные весной для резко континентального климата Сибири, могут оказать негативное влияние на мейотическое деление, вызывая нарушения мейоза и стерильность пыльцы.
Ранее было показано, что увеличение продолжительности мейоза у хвойных повышает вероятность мейотических повреждений вследствие воздействия низких температур (Bazhina et al., 2011). Можно предположить, что стремительное прохождение мейоза у ели сибирской снижает вероятность воздействия на клетки неблагоприятных факторов и тем самым уменьшает число аномальных клеток. Вполне вероятно, это является одним из механизмов адаптации видов к резко континентальному климату Сибири.
Способность адаптироваться к экстремальным условиям, возможно, проявляется также в высокой степени асинхронности развития мейоцитов. Асинхронность мейоза наблюдается у многих видов хвойных (Козубов, 1974; Рождественский, 1981; Муратова, 1995; Бажина и др., 2007а, 2007б; Bazhina et al., 2011). В отдельных случаях асинхронность развития мейоцитов в одном пыльнике может быть проявлением мутации mei8, как у гибридов ржи (Соснихина и др., 2003). Предполагается также, что асинхронность может отражать неравные температурные и иные условия развития в разных спорангиях, либо различия в питании микростробилов. Однако такой значительной асинхронности развития в пределах одного микроспорангия как в настоящих исследованиях, у ели сибирской не наблюдалось даже в экстремальных условиях Крайнего Севера (Рождественский, 1981).
Таким образом, при анализе мейоза в микроспорогенезе у ели сибирской в условиях юга Средней Сибири выявлены следующие особенности: стремительное прохождение мейотических делений, значительная асинхронность развития мейоцитов и достаточно узкий спектр аномалий. Особенности онтогенеза мужских репродуктивных структур показывают высокую приспособленность ели сибирской к резко континентальному климату Сибири.
Работа выполнена в рамках бюджетного проекта ФГБНУ ИЛ СО РАН, ФИЦ КНЦ СО РАН (проект № 0356-2016-0301) и при финансовой поддержке РФФИ–Беларусь (проект № 18-54-00010).
Список литературы
Атлас лесов СССР. М.: Главное управление геодезии и картографии при Совете министров СССР, 1973. 222 с.
Бажина Е.В., Квитко О.В., Муратова Е.Н. Мейоз при микроспорогенезе и жизнеспособность пыльцы у пихты сибирской в среднегорье Восточного Саяна // Лесоведение. 2007а. № 1. С. 57–64.
Бажина Е.В., Квитко О.В., Муратова Е.Н. Мейоз при микроспорогенезе у пихты сибирской в условиях дендрария // Онтогенез. 2007б. Т. 38. № 4. С. 299–306.
Бобров Е.Г. Лесообразующие хвойные СССР. М.: Наука, 1978. 188 с.
Буторина А.К., Высоцкий А.А., Мурая Л.С. Сравнительный цитогенетический анализ форм сосны обыкновенной разной смолопродуктивности // Генетика. 1982. Т. 18. № 12. С. 2019–2029.
Буторина А.К., Мурая Л.С., Машкина О.С. и др. Новый тип мейотической мутации у сосны // Генетика. 1985. Т. 21. № 1. С. 103–111.
Буторина А.К., Мурая Л.С., Рязанцева Л.А., Высоцкий А.А. Цитогенетическая и биохимическая характеристика деревьев сосны обыкновенной, контрастных по смолопродуктивной способности // Генетика. 1988. Т. 24. № 5. С. 889–899.
Буторина А.К., Кирбиса М., Дерюжкин Р.И. и др. Исследование мейоза у лиственницы европейской // Цитология. 1989. Т. 31. № 9. С. 1040–1043.
Голубовская И.Н. Генетический контроль поведения хромосом в мейозе // Цитология и генетика мейоза. М.: Наука, 1975а. С. 312–343.
Голубовская И.Н. Генетический контроль поведения хромосом в мейозе // Онтогенез. 1975б. Т. 6. № 2. С. 127–139.
Голубовская И.Н. Экспериментальное исследование генного контроля мейоза у кукурузы // Теоретические основы селекции. Новосибирск: Наука, 1985. С. 119–135.
Голубовская И.Н., Ситникова Д.В. Три мейотические мутации кукурузы, вызывающие расхождения хромосом в первом делении мейоза // Генетика. 1980. Т. 16. № 4. С. 656–666.
Калашник Н.А. Аномалии пыльцы у ели сибирской в различных экологических условиях // Научные ведомости Белгородского государственного университета. Серия: естественные науки. 2011. Т. 14. № 3–1(98). С. 105–109.
Калашник Н.А., Ясовиева С.М. Изучение нарушений в процессе мейоза у ели сибирской в условиях природного и техногенного стресса // Экология. 2012. № 6. С. 418–426.
Калашник Н.А., Ясовиева С.М., Преснухина Л.П. Аномалии пыльцы хвойных видов деревьев при промышленном загрязнении на Южном Урале // Лесоведение. 2008. № 2. С. 33–40.
Козубов Г.М. Биология плодоношения хвойных на Севере. Л: Наука, Ленингр. отд., 1974. 136 с.
Круклис М.В. Мейоз и формирование пыльцы у лиственницы Чекановского (Larix czekanowskii Sz.) // Изменчивость древесных растений Сибири. Красноярск, 1974. С. 20–34.
Круклис М.В. Мейотическое поведение и характер наследования В-хромосом ели сибирской // 4-й съезд ВОГИС им. Н.И. Вавилова: Тез. докл. Кишинев: Штиинца, 1982. Ч. 2. С. 47–248.
Муратова Е.Н. Особенности мейоза сосны обыкновенной около северной границы ее ареала // Онтогенез. 1995. Т. 26. № 2. С. 158–169.
Некрасова Т.П. Влияние температуры воздуха на формирование пыльцы хвойных древесных пород // Лесоведение. 1976. № 6. С. 37–43.
Некрасова Т.П. Пыльца и пыльцевой режим хвойных Сибири / Отв. ред. Ирошников А.И. Новосибирск: Наука: Сиб. отд-ние, 1983. 169 с.
Носкова Н.Е., Третьякова И.Н., Муратова Е.Н. Микроспорогенез и формирование пыльцы у сосны обыкновенной (Pinus sylvestris L.) в условиях современного климата Сибири // Известия РАН. Сер. биол. 2009. № 3. С. 379–384.
Пожидаева И.М., Исаков Ю.Н. Цитогенетический анализ деревьев сосны обыкновенной, контрастных по уровню самофертильности // Генетика. 1989. Т. 25. № 4. С. 674–682.
Попов П.П. Ель европейская и сибирская: структура, интеграция и дифференциация популяционных систем. Новосибирск: Наука, 2005. 231 с.
Правдин Л.Ф. Ель европейская и ель сибирская в СССР. М.: Наука, 1975. 176 с.
Рождественский Ю.Ф. О развитии мужских генеративных органов ели сибирской в районах Крайнего Севера // Лесоведение. 1981. № 3. С. 35–42.
Романова Л.И., Третьякова И.Н. Особенности микроспорогенеза у лиственницы сибирской, растущей в условиях техногенной нагрузки // Онтогенез. 2005. Т. 36. № 2. С. 128–133.
Симановский С.А., Богданов Ю.Ф. Генетический контроль мейоза у растений // Генетика. 2018. Т. 54. № 4. С. 397–411.
Соколов С.Я., Связева О.С., Кубли В.А. Ареалы деревьев и кустарников СССР. Л.: Наука, 1977. T. 1. 163 с.
Соснихина С.П. Генетический контроль поведения хромосом в мейозе у гибридных линий диплоидной ржи (Secale cereale L.). Сообщение II. Аномалии на стадиях А I, А II и тетрад // Генетика. 1973. Т. 9. № 8. С. 21–30.
Соснихина С.П., Кириллова Г.А., Михайлова Е.И., Тихолиз О.А., Смирнов В.Г., Немцова Н.С. Нарушение конденсации мейотических хромосом, вызываемое мутацией mei8 у ржи // Генетика. 2003. Т. 39. № 3. С. 362–369.
Соснихина С.П., Федотова Ю.С., Смирнов В.Г., Михайлова Е.И., Богданов Ю.Ф. Изучение генетического контроля мейоза у ржи // Генетика. 1994. Т. 20. № 8. С. 1043–1056.
Хвостова В.В., Ячевская Г.Л. Перестройки хромосом в мейозе // Цитология и генетика мейоза. М.: Наука, 1975. С. 232–262.
Шамина Н.В., Голубовская И.Н., Груздев А.Д. Морфологические нарушения веретена у некоторых мейотических мутантов кукурузы // Цитология. 1981. Т. 23. № 3. С. 275–283.
Яковлев А.В. О влиянии низких температур на микроспорогенез сосны обыкновенной // Лесоведение. 1978. № 6. С. 51–55.
Andersson E. A case of asyndesis in Picea abies // Hereditas. 1947a. Bd 33. Hf. 3. S. 301–347.
Andersson E. Pollen and seed setting of an asyndetic spruce and some normal spruce; and a progeny test of spruce // Medd. Foreningen. Vaxtlordling Skogstrad. 1947b. Bd 45. S. 1–22.
Andersson E. Cone and seed studies in Norway spruce (Picea abies (L.) Karst.) // Stud. Forest. Suec. 1965. № 23. P. 1–214.
Andersson E. Temperature-conditioned irregularities in pollen mother cells of Picea abies (L.) Karst. // Hereditas. 1980. V. 92. № 1. S. 27–35.
Andersson E., Ekberg I., Eriksson G. A summary of meiotic investigation in conifers // Stud. For. Suecica. 1969. № 70. 20 p.
Andreuzza S., Siddiqi I. Spindle positioning, meiotic nonreduction, and polyploidy in plants // PLoS Genetics. 2008. V. 4. № 11. e1000272.
Bazhina E.V., Kvitko O.V., Muratova E.N. Specific features of meiosis in the Siberian fir (Abies sibirica) in the forest Arboretum of the V.N. Sukachev Institute, Russia // Biodiversity and Conservation. 2011. V. 20. № 2. P. 415–428.
Beadle G.W. Chromosome aberration and the gene mutation in sticky chromosome plants of Zea mays // Cytologia. 1937. Fujii jubilee. V. 1. P. 43–56.
Chandler C., Mavrodineanu S. Meiosis in Larix laricina Koch // Contrib. Boyce Thompson Inst. 1965. V. 23. № 4. P. 67–76.
Christiansen H. On the effect of low temperature on meiosis and pollen fertility in Larix decidua Mill. // Silvae Genet. 1960. Bd 9. Hf. 3. S. 72–78.
Deng H.-Sh., Zhang D.-M. Microsporogenesis and meiotic behavior in three species of the genus Picea (Pinaceae) // J. Hechi University. 2005. V. 25. № 5. S. 23–27.
Ekberg I., Eriksson G., Jonsson A. Meiotic investigations in pollen mother cells of larch and Norway spruce // IUFRO. Section 22. Working group meeting on the sexual reproduction of forest trees. Varparanta, 1970. 7 p.
Ekberg I., Eriksson G., Jonsson A. Meiosis in pollen mother cells of Pinus contorta // Hereditas. 1972. B. 71. H. 2. S. 313–324.
Eriksson G. Temperature response of pollen mother cells in Larix and its importance for pollen formation // Stud. Forest. Suec. 1968. № 63. 131 p.
Eriksson G., Ekberg I., Jonsson A. Meiotic investigations in pollen mother cells of Norway spruce cultivated in a plastic greenhouse // Hereditas. 1970. Bd 66, Hf. 1. S. 1–20.
Goryachkina O.V., Muratova E.N. Meiosis at microsporogenesis in Gmelin larch [Larix gmelinii (Rupr.) Rupr.] at the V.N. Sukachev Institute of Forest Arboretum // The International Journal of Plant Reproductive Biology. 2016. V. 8. № 2. P. 139–144.
Johnsson H. Meiotic aberrations and sterility in Alopecurus myosuroides (Huds.) // Hereditas. 1944. V. 30. № 4. P. 469–566.
Luomajoki A. Timing of microsporogenesis in trees with reference to climatic adaptation // Acta Forestalia Fennica 1986. V. 196. P. 1–33.
Luomajoki A. Effects of temperature on spermatophyte male meiosis // Hereditas. 1977. V. 85. № 1. P. 33–48.
Mehra P.N., Rai K.S. Cytogenetic studies of meiotic abnormalities in Collinsia tinctoria. I. Chromosomal stickiness // Canad. J. Genet. and Cytol. 1970. V. 12. № 4. P. 560–569.
Mehra R.C., Rai K.S. Cytogenetic studies of meiosis abnormalities in Collinsia tinctoria. II. Desynapsis // Can. J. Genet. and Cytol. 1972. V. 14. P. 637–644.
Mergen F., Lester D.T. Microsporogenesis in Abies // Silvae Genet. 1961. Bd 10. Hf. 5. S. 146–156.
Moir R.B., Fox D.P. Male meiosis in Sitka spruce Picea sitchensis (Bong.) Carr. // Silvae Genet. 1975. Bd 24. Hf. 5–6. S. 187–192.
Mok D.W.S., Peloquin S.J. Three mechanisms of 2n pollen formation in diploid potatoes // Canad. J. Genet. and Cytol. 1975. Bd 17. Hf. 2. S. 217–225.
Sax K., Sax H.J. Chromosome number and morphology in the conifer // J. Arnold Arboretum. 1933. V. 14. № 4. P. 356–374.
Veileux R.E., McHale N.A., Lauer F.I. 2n Gametes in diploid Solanum: frequency and types of spindle abnormalities // Canad. J. Genet. Cytol. 1982. V. 24. № 3. P. 301–314.
Дополнительные материалы отсутствуют.