Онтогенез, 2019, T. 50, № 3, стр. 181-193
Способность к соматическому эмбриогенезу in vitro в каллусах пшеницы и ячменя определяется балансом содержания в них ИУК и АБК
О. А. Сельдимирова a, *, Г. Р. Кудоярова a, Н. Н. Круглова a, И. Р. Галин a, Д. С. Веселов a
a Уфимский Институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Россия
* E-mail: o_seldimirova@mail.ru
Поступила в редакцию 09.11.2018
После доработки 18.12.2018
Принята к публикации 24.12.2018
Аннотация
Изучено влияние соотношения содержания ряда фитогормонов (ИУК, АБК и цитокининов) на индукцию соматического эмбриогенеза в каллусных культурах in vitro пшеницы сорта Башкирская 26, ячменя сорта Steptoe и его АБК-дефицитного мутанта AZ34. Установлено, что способность/отсутствие способности к соматическому эмбриогенезу в каллусах как пшеницы, так и ячменя определяется соотношением содержания ИУК : АБК в них, при достаточно сходных показателях содержания цитокининов и в эмбриогенных, и неэмбриогенных типах каллусов каждого изученного объекта. На примере каллусов АБК-дефицитного мутанта AZ34 ячменя выявлена стимулирующая роль АБК как в индукции соматического эмбриогенеза, так и в формировании зародышей нормального строения.
ВВЕДЕНИЕ
Полученная в 1950-х гг. информация о том, что добавление гормонов в питательную среду при культивировании растений in vitro влияет на морфогенез, является базовой при разработке различных биотехнологий, ведущих к формированию полноценных растений-регенерантов. Основное внимание в этом плане уделяется ауксинам и цитокининам (обзоры: Krikorian, 1995; Gaspar et al., 1996; Jimenez, Thomas, 2006; Plant Tissue …, 2013; Егорова, 2014). Установлено, в частности, что добавление в среду адекватных концентраций этих гормонов обеспечивает образование из различных эксплантов каллусов – интегрированных систем тканей, состоящих из групп гетерогенных клеток с морфогенетическими потенциями, которые реализуются различными путями морфогенеза in vitro (по: Ikeuchi et al., 2013; Sugiyama, 2015; Круглова и др., 2018в).
Один из путей морфогенеза in vitro в каллусах – непрямой соматический эмбриогенез, состоящий в формировании и развитии соматических зародышей (синоним: эмбриоиды) из клетки/групп клеток эмбриогенных каллусов в ответ на экзогенные и/или эндогенные сигналы (обзоры: Somatic Embryogenesis …, 2016; Winkelmann, 2016; Horstman et al., 2017). (Заметим, что известен и другой тип соматического эмбриогенеза в условиях культуры in vitro – прямой, связанный с образованием и развитием зародышей из детерминированных эмбриогенных клеток эксплантов, без этапа формирования каллусов. Прямой соматический эмбриогенез выявлен, хотя и в достаточно редких случаях, также и в естественных условиях in vivo при адвентивной эмбрионии и апомиксисе (Hand et al., 2016). – Авт.)
Соматический эмбриогенез как асексуальное формирование зародышей в контролируемых экспериментатором условиях культуры in vitro привлекает большое внимание не только как надежный биотехнологический способ формирования качественных регенерантов у различных видов покрытосеменных и голосеменных, но и как модельная система для изучения ряда сложных проблем морфогенеза растений, таких как приобретение соматической клеткой эмбриогенной компетентности, индукция и детерминация такой клетки к эмбриогенезу, клеточные и молекулярно-генетические механизмы дифференциации и дедифференциации, плюри- и тотипотентность.
Хорошо установлено, что формирование и развитие соматических зародышей в каллусах зависит от концентрации ауксинов и цитокининов в составе питательных сред (обзоры: Krikorian, 1995; Jimenez, Thomas, 2006; Nic-Can, Loyola-Vargas, 2016; Seldimirova et al., 2016b; Круглова и др., 2017; а также Круглова, Сельдимирова, 2013; Seldimirova et al., 2016а и др.). В то же время такому важному гормону, как абсцизовая кислота (АБК), уделяется меньше внимания при исследовании этих вопросов, хотя роль АБК, так называемого гормона стресса (Tuteja, 2007; Phytohormones …, 2012), в условиях in vitro трудно переоценить (обзоры: Ochatt, Revilla, 2016; Круглова и др., 2018б). Действительно, экспланты, отделенные от донорного растения, переносятся в условия in vitro на синтетические среды, содержащие, как правило, нефизиологические концентрации регуляторов роста, органических и неорганических компонентов, что приводит к созданию значительных стрессов для них.
Данные о влиянии АБК на индукцию формирования и развитие соматических зародышей in vitro касаются главным образом прямого соматического эмбриогенеза, и эти данные достаточно противоречивы. В обзорной работе (Rai et al., 2011) сообщается, что АБК в основном ингибирует индукцию соматического эмбриогенеза, тогда как однозначно положительное действие этого гормона отмечено лишь в отдельных случаях (Nishiwaki et al., 2000; Zhang et al., 2010). Выявлена стимуляция соматического эмбриогенеза на фоне низких концентраций АБК в культуральной среде in vitro и ингибирование – высокой ее концентрацией (Gaspar et al., 1996; Lema-Ruminska, 2013). В то же время следует подчеркнуть, что в абсолютном большинстве проанализированных работ приводятся данные именно о стимулирующем влиянии АБК на индукцию прямого формирования и развития соматических зародышей из компетентных клеток эксплантов (Stasolla et al., 2002; Stasolla, Yeung, 2003; Mauri, Manzanera, 2004; Vales et al., 2007; Al-Khayri, Al-Bahrany, 2012; Al-Khayri, 2013; Alwael et al., 2017; Круглова и др., 2018а, 2018б), на отложение в соматических зародышах запасных веществ, необходимых для их прорастания (von Arnold et al., 2002; Sharma et al., 2004), а также на повышение выживаемости полученных регенерантов в почвенных условиях (Aguilar et al., 2000) и качество “искусственных семян” (инкапсулированных соматических зародышей) (Rai et al., 2008). Положительное влияние АБК на прямой соматический эмбриогенез in vitro связывают с влиянием этого гормона на повышение активности ферментов антиоксидантной системы и снижение уровня активных форм кислорода в клетках соматических зародышей (Zhang et al., 2010).
Сведения же об участии АБК в непрямом соматическом эмбриогенезе в каллусах in vitro немногочисленны, однако во всех работах приводятся данные о стимулирующей роли этого фитогормона. Так, изучая развитие соматических зародышей в каллусной культуре in vitro бархатцев на различных средах, авторы выявили индукцию их формирования только в случае введения в среду АБК (Bespalhok, Hattori, 1998). Показано, что АБК способствовала регенерации растений из соматических зародышей банана в полученной из каллуса суспензионной культуре (Sholi et al., 2009) и синхронизации развития “искусственных семян” апельсина, сформировавшихся через непрямой соматический эмбриогенез in vitro (Souza et al., 2011). Добавление в среду АБК и полиэтиленгликоля приводило к созреванию полученных в эмбриогенных каллусах in vitro соматических зародышей и последующему их прорастанию у трех видов лиственницы (Третьякова, Барсукова, 2012).
Особое внимание следует уделить такой важной проблеме, как зависимость между содержанием эндогенных гормонов в эксплантах и успехом применения экзогенных гормонов в индукции и процессе соматического эмбриогенеза, с учетом поправок на условия культивирования in vitro и индивидуальные особенности эксплантов (генотип донорного растения, гистологический статус экспланта в момент инокуляции), а также взаимодействие между эндогенными и экзогенными гормонами. Такого рода исследования выполнены на примере прямого (Ribnicky et al., 1996; Jimenez, 2001, 2005; Dolgikh et al., 2003; Jimenez, Thomas, 2006) и непрямого (От микроспоры …, 2010; Сельдимирова, Круглова, 2015; Seldimirova et al., 2016а) соматического эмбриогенеза с выявлением участия эндогенных/экзогенных ауксинов и цитокининов в этих процессах.
Данные же о зависимости соматического эмбриогенеза от баланса эндогенной и экзогенной АБК в литературе крайне ограничены и касаются только его прямого типа. Так, лишь в одной работе представлены сведения о влиянии эндогенного уровня этого гормона в исходных зиготических зародышах подсолнечника на индукцию прямого соматического эмбриогенеза в течение первых часов культивирования in vitro (Charrière et al., 1999). Сведений о влиянии баланса эндогенной/экзогенной АБК на индукцию и процесс непрямого соматического эмбриогенеза в каллусах in vitro нами не встречено.
В связи с вышесказанным цель данной работы состояла в оценке содержания ряда гормонов (ИУК, АБК, цитокининов) в эмбриогенных и неэмбриогенных каллусах, полученных из незрелых зародышей пшеницы и ячменя (дефицитного по АБК мутанта AZ34 и его исходного сорта Steptoe).
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования послужили растения пшеницы (сорт Башкирская 26) и ячменя (сорт Steptoe и его АБК-дефицитный мутант AZ34). Донорные растения выращивали в полевых условиях научного стационара Уфимского Института биологии УФИЦ РАН (Уфимский район).
Получение эмбриогенных и неэмбриогенных каллусов пшеницы и ячменя
Базовая индукционная среда для получения каллусов содержала макро-, микросоли и витамины по прописи Мурасиге–Скуга (Murashige, Skoog, 1962), а также 100 мг/л миоинозита, 30 г/л сахарозы, 100 мг/л гидролизата альбумина, 2 мг/л глицина, 10 г/л агара. Перед автоклавированием pH среды доводили до 5.7.
В качестве эксплантов использовали незрелые зародыши через 13–15 сут после массового цветения.
Каллусы пшеницы получали согласно (Круглова, Сельдимирова, 2011). При этом для получения эмбриогенных каллусов зародыши инокулировали на базовую индукционную среду, дополненную 2.0 мг/л 2,4-Д и 0.2 мг/л кинетина. Неэмбриогенные каллусы получали из зародышей, инокулированных на базовую индукционную среду, дополненную 5.0 мг/л 2,4-Д и 0.2 мг/л кинетина. Все каллусы инкубировали в течение 4 недель в темноте, при 26°C.
Также для получения неэмбриогенных каллусов пшеницы часть эмбриогенных каллусов, полученных на индукционной среде с 2.0 мг/л 2,4-Д, длительно (в течение полугода) культивировали на среде того же состава, пересаживая каллусы на свежую среду каждые 4 недели, до полной потери ими эмбриогенной способности (см ниже).
Каллусы ячменя получали согласно (Сельдимирова и др., 2017). На базовой индукционной среде, дополненной 2.0 мг/л 2,4-Д, 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O, у ячменя сорта Steptoe формировались эмбриогенные каллусы, тогда как у его АБК-дефицитного мутанта AZ34 – неэмбриогенные каллусы. Эмбриогенные каллусы у AZ34 получали на базовой индукционной среде, дополненной 2.0 мг/л 2,4-Д, 0.5 мг/л 6-БАП, 12.5 мг/л CuSO4 · 12H2O и 0.5 мг/л АБК. Все каллусы инкубировали в течение 4 недель в темноте, при 26°C.
Прижизненную съемку каллусов вели с применением стереомикроскопа Technival 2 (Carl Zeiss, Jena, Germany) и цифровой камеры Olympus Camedia C-4000 (Olympus Optical Co., LTD, Japan).
Определение эмбриогенной способности каллусов пшеницы и ячменя
Для определения эмбриогенной способности каллусы переносили на регенерационную среду (среда, соответствующая по составу базовой индукционной среде) и культивировали при 16/8-часовом фотопериоде в течение 2 недель. Далее проводили гистологическую оценку проявления/непроявления компетентности каллусов к эмбриогенезу по наличию/отсутствию в их составе соматических зародышей на той или иной стадии развития.
Постоянные гистологические препараты готовили согласно (Световой микроскоп …, 2013) с применением микротома HM 325 (Microm, Германия) и окрашиванием срезов методом тройного окрашивания или же только реактивом Шиффа. Препараты анализировали с использованием светового микроскопа Axio Imager.A1 light microscope (Carl Zeiss, Jena, Germany), оснащенного объективом EC Plan-NEOFLURAL 10×/0.3, и фотографировали с использованием цифровой камеры AxioCam MRc5 с программным обеспечением Axio Vision 4.7 (Carl Zeiss, Jena, Germany).
Определение количественного содержание гормонов в каллусах пшеницы и ячменя
Часть каллусов использовали для определения количественного содержания гормонов. Для этого через 4 недели после введения в культуру in vitro были взяты каллусы ячменя обоих типов, а также эмбриогенные и полученные на индукционной среде с повышенным содержанием 2,4-Д неэмбриогенные каллусы пшеницы. Длительно культивируемые каллусы пшеницы анализировали после полной потери ими эмбриогенной способности (по окончании 6-го пассажа, каждый пассаж длительностью 4 недели).
Растительный материал гомогенизировали, экстрагировали 80% этанолом и инкубировали в холодильной камере при 4°C в течение ночи. Далее проводили фильтрацию гомогенизата с помощью бумажных фильтров для отделения жидкой фазы и дальнейшего упаривания фильтрата до водного остатка.
Экстракцию ИУК и АБК из аликвоты водного остатка проводили по модифицированной схеме с уменьшением объема (Veselov et al., 1992; Vysotskaya et al., 2008). Водный остаток с помощью 1 N HCl подкисляли до рН 2–3 и проводили экстракцию диэтиловым эфиром в соотношении 1 : 5 (органическая фаза/водная фаза). Из объединенной органической фазы ИУК и АБК реэкстрагировали 1% раствором гидрокарбоната натрия, взятым в соотношении 1 : 3 (водная фаза/органическая фаза). Органическую фазу отделяли и отбрасывали, а из водной после подкисления до рН 2–3 вновь дважды экстрагировали ИУК и АБК диэтиловым эфиром и метилировали диазометаном. Полученная эфирная фаза упаривалась до сухого остатка. Для определения содержания гормонов сухой остаток с ИУК и АБК восстанавливали 100 мкл 80% раствора этанола, затем аликвоту в серии разведений добавляли в лунки планшетов и проводили иммуноферментный анализ в соответствующих тест-системах с использованием специфичных антител к ИУК и АБК. Тест-система для определения ИУК имеет низкую кросс-реативность по отношению к 2,4-Д (0.1%) (Veselov et al., 1992), и поэтому результаты, полученные с ее помощью, позволяют судить о количестве эндогенной ИУК, а присутствие в культуральной среде 2,4-Д не вызывает интерференции.
Содержание цитокининов определяли по (Kudoyarova et al., 2014). Цитокинины из водного остатка концентрировали на предварительно смоченном картридже С18 (Sep-Pak Classic C18), промывали 20 мл дистиллированной воды и элюировали 5 мл 80% этанола. Полученную фазу подвергали испарению в ротационном испарителе. После испарения растворителя сухой остаток растворяли в 0.02 мл 80% этанола и наносили на пластины силикагеля Merck 50 × 200 × 0.25 мм 60F-254 для разделения метаболитов цитокининов при помощи тонкослойной хроматографии (растворитель : 2-бутанол : 14 М NH4OH ⋅ H2O в соотношении 6 : 1 : 2). Различные формы цитокининов элюировали в течение 15 ч 0.1 М фосфатным буфером (рН 7.2–7.4) из соответствующих зон, идентифицированных по положению метчиков в УФ-свете. Затем аликвоту в серии разведений добавляли в лунки планшетов и проводили иммуноферментный анализ. При этом использовали антитела против транс-зеатинрибозида, которые, как было показано ранее, высокоспецифичны к производным транс-зеатина (Kudoyarova et al., 2007). Эта процедура обеспечивала успешное разделение и определение нуклеотида зеатина (Rf 0–0.1), глюкозидов зеатина (Rf 0.1–0.2), рибозида зеатина (Rf 0.4–0.5), а также свободного основания зеатина (Rf 0.6–0.7). Извлечение стандартов из силикагеля составило более 90%. Надежность иммуноанализа гормонов была подтверждена при помощи теста на разведение, анализа хроматографического распределения иммунореактивного материала, а также путем сравнения данных, полученных с помощью иммуноанализа, с результатами высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией (Kudoyarova et al., 2014). Антитела имели высокую иммунореактивность по отношению к зеатину, его рибозиду, 9-N-глюкозиду и нуклеотиду, но низкую кроссреактивность к БАП, кинетину дигидрозеатину и изопентениладенину и их производным (Кудоярова и др., 1990).
Статистическую обработку полученных результатов проводили с применением программы Microsoft Office Excel 2010. В таблицах представлены средние арифметические значения и ошибки средних. Достоверность различий определяли с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
Сравнительный анализ содержания фитогормонов в эмбриогенных и неэмбриогенных каллусах пшеницы
Культивирование in vitro незрелых зародышей пшеницы на среде, дополненной 2.0 мг/л 2,4-Д, через 4 недели приводило к формированию плотных бугорчатых каллусов, состоящих главным образом из меристематических клеток. После культивирования таких каллусов на регенерационной среде в течение 2 недели в них, по данным морфологического (рис. 1а) гистологического (рис. 1б) анализа, отмечено формирование соматических зародышей с такими органами на ранних стадиях развития, как лист, корень, побег, семядоля (щиток). Такие каллусы, способные к индукции непрямого соматического эмбриогенеза, оценены как эмбриогенные (далее – ЭК).
Рис. 1.
Эмбриогенные и неэмбриогенные каллусы пшеницы (2 недели культивирования in vitro на регенерационной среде). (а) – эмбриогенный каллус, полученный на среде, дополненной 2.0 мг/л 2,4-Д; (б) – гистологический срез соматического зародыша в каллусе, изображенном на (а); (в) – неэмбриогенный каллус, полученный на среде с содержанием 2,4-Д, в 5.0 мг/л; (д) – неэмбриогенный каллус, полученный при длительном культивировании эмбриогенного каллуса на среде, дополненной 2.0 мг/л 2,4-Д; (г, е) – гистологические срезы каллусов, изображенных на (в, г), соответственно. (а, в, д) – прижизненная съемка, (б, г, е) – СМ, постоянные препараты. АП – апекс побега, ДК – дегенерировавшие клетки, ЖК – жизнеспособные клетки, К – каллус, КМ – корневая меристема, Л – лист, СЗ – соматический зародыш, Щ – щиток. Шкала: (а, в–г) – 1 мм, (б, е) – 500 мкм.
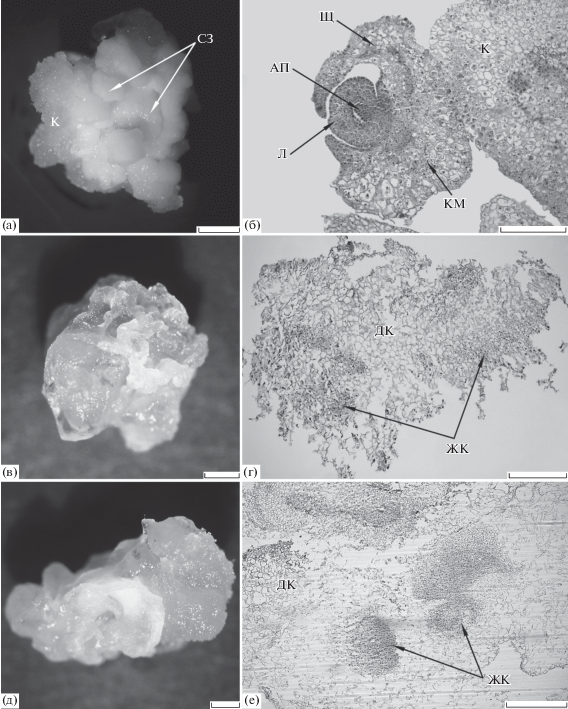
В результате культивирования in vitro незрелых зародышей пшеницы на среде, дополненной 5.0 мг/л 2,4-Д, формировались рыхлые водянистые каллусы. Такие каллусы через 2 недели культивирования на регенерационной среде (рис. 1в), согласно гистологическим данным (рис. 1г), были представлены в основном крупными сильновакуолизированными клетками, главным образом дегенерировавшими, и небольшим количеством мелких жизнеспособных, но не обладающих признаками меристематичности клеток. Соматические зародыши в таких каллусах отмечены не были, поэтому каллусы оценивались как неэмбриогенные (далее – НЭК-5).
При длительном культивировании in vitro эмбриогенных каллусов на среде, дополненной 2.0 мг/л 2,4-Д, их меристематические клетки активно пролиферировали. Однако через 2 недели культивирования на регенерационной среде в таких каллусах (рис. 1д), по данным гистологического анализа (рис. 1е), большинство клеток дегенерировало, а оставшиеся жизнеспособные клетки утрачивали признаки меристематичности. Такие каллусы оценивались как неэмбриогенные (далее – НЭК-дк).
В ходе выполнения экспериментов изучали содержание фитогормонов в каллусах пшеницы, различающихся по компетентности к соматическому эмбриогенезу in vitro. Полученные данные отражены в табл. 1.
Таблица 1.
Содержание фитогормонов в каллусах пшеницы
| Тип каллуса | Содержание фитогормонов, нг/г сырой массы |
||
|---|---|---|---|
| АБК | ИУК | сумма ЦК | |
| ЭК | 1.1 ± 0.1б | 13.1 ± 1.2а | 1.3 ± 1.2а |
| НЭК-5 | 0.7 ± 0.05а | 16.8 ± 1.5аб | 1.2 ± 0.1а |
| НЭК-дк | 1.0 ± 0.1аб | 21.4 ± 2.1б | 1.8 ± 0.2б |
Условные обозначения: НЭК-5 – неэмбриогенные каллусы, полученные на среде МС, дополненной 5.0 мг/л 2,4-Д, НЭК-дк – неэмбриогенные каллусы, полученные в результате длительного культивирования in vitro, ЭК – эмбриогенные каллусы. Средние значения по отдельным гормонам, помеченные разными буквами, различаются при р < 0.05.
Анализ полученных данных (табл. 1) показывает, что НЭК-5 характеризуются наиболее низким содержанием АБК, тогда как между ЭК и НЭК-дк существенных различий не обнаружено. Содержание ИУК, минимальное у ЭК, сравнительно выше у неэмбриогенных каллусов обоих типов. Максимальное содержание цитокининов выявлено в НЭК-дк, в то время как у ЭК и НЭК-дк этот показатель практически не различается.
Сравнительный анализ содержания фитогормонов в эмбриогенных и неэмбриогенных каллусах ячменя
Эмбриогенные каллусы ячменя сорта Steptoe (далее – ЭК (Steptoe)) получали путем культивирования незрелых зародышей in vitro на среде, дополненной 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O. Такие каллусы характеризовались как плотные бугорчатые структуры. Через 2 недели культивирования на регенерационной среде морфологический (рис. 2а) и гистологический (рис. 2б) анализ показал наличие в составе таких каллусов соматических зародышей, содержащих лист, корень, побег, семядолю (щиток) на ранних стадиях развития.
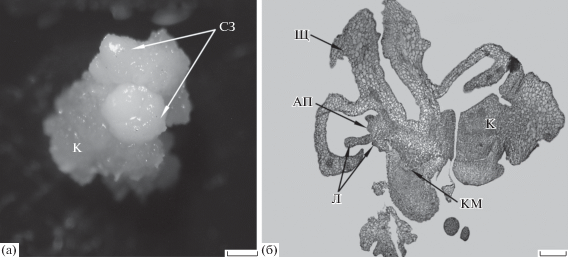
Рис. 2.
Эмбриогенный каллус ячменя сорта Steptoe, полученный на среде, дополненной 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O (2 недели культивирования in vitro на регенерационной среде). (а) – каллус с соматическими зародышами, (б) – гистологический срез соматического зародыша в каллусе. (а) – прижизненная съемка, (б) – СМ, постоянный препарат. Обозначения те же, что и на рис. 1. Шкала: (а) – 1 мм, (б) – 200 мкм.
Каллусы АБК-дефицитного мутанта ячменя AZ34, полученные на той же среде, через 2 недели культивирования in vitro на регенерационной среде (рис. 3а) проявили крайне низкую способность к соматическому эмбриогенезу. В таких каллусах, по гистологическим данным, наблюдалась или остановка развития соматических зародышей на самых ранних стадиях развития (рис. 3а), или формирование имеющих аномальное строение соматических зародышей: в апексах побегов отсутствовали меристематические клетки, а апексы корня не имели четко оформленного строения (рис. 3б–3в). В таких каллусах часто наблюдалось формирование элементов сосудистой системы (рис. 3б–3г). Каллусы и с остановившимися в развитии, и с аномальными соматическими зародышами оценивались как неэмбриогенные (далее – НЭК-(AZ34)) и не были способны к формированию растений-регенерантов на регенерационной среде (как это установлено нами ранее: Сельдимирова и др., 2017).
Рис. 3.
Неэмбриогенный каллус АБК-дефицитного мутанта ячменя сорта AZ34, полученный на среде, дополненной 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O (2 недели культивирования in vitro на регенерационной среде). (а) – каллус с соматическими зародышами, остановившимися в развитии, (б) – ранний соматический зародыш, остановившийся в развитии, (в) – соматический зародыш аномального строения, не способный к дальнейшему развитию, (г) – тяжи сосудистой ткани в каллусе. (а) – прижизненная съемка, (б–е) – СМ, постоянные препараты. ААП – аномальный апекс побега, АКМ – аномальная корневая меристема, ОСЗ – соматический зародыш, остановившийся в развитии, СТ – сосудистая ткань. Остальные обозначения те же, что и на рис. 1. Шкала: (а) – 2 мм, (б–г) – 200 мкм.

Введение синтетической АБК в состав индукционной среды через 2 недели после переноса каллусов мутанта AZ34 на регенерационную среду привело к формированию соматических зародышей (рис. 4а) нормального строения, согласно результатам гистологического анализа (рис. 4б). Такой каллус расценивался как эмбриогенный (далее – ЭК (AZ34)).
Рис. 4.
Эмбриогенный каллус АБК-дефицитного мутанта ячменя сорта AZ34, полученный на среде, дополненной 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O, а также 0.5 мг/л АБК (2 недели культивирования in vitro на регенерационной среде). (а) – каллус с соматическими зародышами, (б) – гистологический срез соматического зародыша в каллусе. (а) – прижизненная съемка, (б) – СМ, постоянный препарат. Обозначения те же, что и на рис. 1. Шкала: (а) – 1 мм, (б) – 500 мкм.

Данные по содержанию фитогормонов в каллусах ячменя приведены в табл. 2.
Таблица 2.
Содержание фитогормонов в каллусах ячменя
| Тип каллуса (генотип) | Содержание фитогормонов, нг/г сырой массы |
||
|---|---|---|---|
| АБК | ИУК | сумма ЦК | |
| ЭК (Steptoe) | 2.7 ± 0.6б | 19.8 ± 1.3аб | 7.8 ± 1.1а |
| НЭК (AZ34) | 1.2 ± 0.3а | 28.6 ± 2.5б | 7.0 ± 0.6а |
| ЭК (AZ34) | 9.1 ± 1.6с | 16.0 ± 0.6а | 6.5 ± 0.6а |
Условные обозначения: ЭК (Steptoe) – эмбриогенные каллусы, полученные из зародышей ячменя сорта Steptoe, НЭК (AZ34) – неэмбриогенные каллусы, полученные из зародышей его АБК дефицитного мутанта, ЭК (AZ34) – каллусы мутанта, приобретшие эмбриогенность при добавлении в среду АБК. Средние значения по отдельным гормонам, помеченные разными буквами, различаются при р < 0.05.
Как свидетельствует анализ полученных данных (табл. 2), содержание АБК было минимальным в НЭК (AZ34), полученном из зародышей дефицитного по АБК мутанта AZ34, более высоким – в ЭК (Steptoe) и максимальным – в ЭК (AZ34), приобретшем эмбриогенность при добавлении в среду синтетической АБК. Содержание ИУК, напротив, наиболее высокое в НЭК (AZ34), снижалось в каллусах, полученных в варианте с добавлением АБК (ЭК (AZ34)). В ЭК (Steptoe) отмечено промежуточное значение содержания ИУК. Что касается цитокининов, то их максимальное содержание выявлено в ЭК (Steptoe), минимальное – у ЭК (AZ34) при промежуточном значении у НЭК (AZ34), однако в целом эти показатели достаточно сходны.
ОБСУЖДЕНИЕ
Полученные данные об участии ряда гормонов в индуцировании эмбриогенной способности зародышевых каллусов пшеницы и ячменя дают возможность включиться в дискуссию о роли регуляторов роста растений в процессах соматического эмбриогенеза in vitro. Кроме того, различия по способности к индукции формирования соматических зародышей у дефицитного по АБК мутанта ячменя AZ34 и его исходного Steptoe сорта позволяют уточнить роль АБК в процессе непрямого соматического эмбриогенеза in vitro.
Сравнение содержания гормонов в неэмбриогенном каллусе пшеницы, полученном на индукционной среде с повышенной концентрацией 2,4-Д, с эмбриогенным вариантом каллуса показывает, что отсутствие способности к индукции соматического эмбриогенеза может быть связано как с тенденцией повышенного содержания в них ауксинов (в 1.3 раза выше в неэмбриогенном варианте), так и с пониженной концентрацией АБК (в 1.6 раз ниже в неэмбриогенном каллусе). При расчете соотношения ауксинов и АБК различия между этими вариантами оказались еще более значительными (соотношение ИУК/АБК в 2 раза выше в неэмбриогенном каллусе по сравнению с эмбриогенным каллусом).
Совпадение пониженного уровня ауксинов с повышенным содержанием АБК в эмбриогенном каллусе может быть следствием способности АБК влиять на уровень ауксинов путем активации процесса их конъюгирования (Park et al., 2009). Вместе с тем, не исключено обратное влияние ИУК на уровень АБК в каллусе, поскольку известна способность ауксинов влиять на метаболизм АБК (Hansen, Grossmann, 2000). Наши данные, казалось бы, противоречат результатам исследований, в которых было отмечено повышение уровня ауксинов в культивируемых зиготических зародышах подсолнечника через 24 ч после добавления АБК в среду (Charriere et al., 1999). Однако и в этой работе, как и в нашей, повышение уровня ауксинов происходило на фоне быстрого снижения концентрации АБК в образцах в начале культивировании in vitro. В целом, влияние АБК на ауксины в условиях культуры in vitro может быть двойственным, поскольку показана способность этого гормона не только активировать конъюгирование ауксинов, но и стимулировать их синтез (Park et al., 2009). Вероятно, характер действия АБК на метаболизм ауксинов может меняться на разных стадиях культивирования in vitro.
В отличие от неэмбриогенного каллуса пшеницы, полученного на индукционной среде с повышенной концентрацией 2,4-Д, каллус, утративший эмбриогенную способность в результате длительного культивирования in vitro, характеризовался иным гормональным балансом. В таком каллусе не выявлено различий в содержании АБК по сравнению к эмбриогенным каллусом. При этом в неэмбриогенном каллусе, полученном в результате длительного культивирования, содержание ауксинов было выше примерно в 2 раза, а содержание цитокининов – в 1.4 раза по сравнению с эмбриогенным каллусом.
Известно, что пониженное в результате мутаций содержание цитокининов сопровождается снижением уровня ауксинов (Hansen, Grossmann, 2000), что позволяет связать более низкое содержание ИУК в эмбриогенном каллусе с пониженным содержанием цитокининов в его тканях.
Ранее нами было выявлено влияние АБК на окислительный метаболизм цитокининов (Vysotskaya et al., 2009), что позволяет ожидать пониженный уровень цитокининов в каллусе при повышении содержания АБК в нем. В обзоре Т. Гаспара с соавт. (Gaspar et al., 1996) также высказывается предположение о влиянии АБК на синтез и метаболизм цитокининов в культуре тканей in vitro. Однако эту закономерность нам выявить не удалось: при непродолжительном (4 недели) культивировании уровень АБК в неэмбриогенном каллусе пшеницы, полученном на среде с относительно высокой концентрацией 2,4-Д, был понижен по сравнению с эмбриогенным каллусом, в то время как по содержанию цитокининов каллусы обоих этих типов различались незначительно, тогда как в неэмбриогенном каллусе, полученном в результате длительного (полгода) культивирования, содержание цитокининов было выше.
Хотя у пшеницы соотношение содержания ауксинов и АБК было ниже в эмбриогенном каллусе как по сравнению с неэмбриогенным каллусом, полученном на среде с повышенной концентрацией 2,4-Д (за счет более высокого уровня АБК у эмбриогенного каллуса), так и по сравнению с неэмбриогенным каллусом, полученным путем длительного культивирования (за счет повышенной концентрации ИУК у последнего), корреляция между эмбриогенностью и соотношением ИУК : АБК могла быть случайным совпадением.
Для того чтобы доказать причинно-следственную связь между этими показателями, мы сравнили способность каллусов к соматическому эмбриогенезу у дефицитного по АБК мутанта AZ34 ячменя и его исходного сорта Steptoe.
Прежде всего, важно отметить, что соматические зародыши в каллусе, полученном из незрелых зародышей дефицитного по АБК мутанта на индукционной среде, не содержащей АБК, останавливались в развитии на ранних стадиях или имели аномальное строение (рис. 3) и тем самым не были способны к дальнейшему развитию. Такой каллус оценивался нами как неэмбриогенный. Соматические зародыши нормального строения, способные к дальнейшему развитию, формировались в каллусе AZ34 только при добавлении в среду АБК (рис. 4). В то же время каллус, полученный из незрелых зародышей исходного сорта Steptoe на индукционной среде, не содержащей АБК, характеризовался способностью к соматическому эмбриогенезу in vitro (рис. 2). Эти данные согласуются с полученными нами ранее (Сельдимирова и др., 2017) данными о способности/неспособности каллусов ячменя к формированию регенерантов. В целом, полученные результаты указывают на важную стимулирующую роль АБК в формировании полноценных соматических зародышей in vitro.
Определение эндогенного содержания АБК в каллусах ячменя, полученных на индукционной среде без добавления АБК, показало, что уровень этого гормона был в 2 с лишним раза ниже в каллусе AZ34 по сравнению с каллусом Steptoe. Эти результаты соответствуют данным, полученным ранее на растениях этого сорта в условиях in vivo (Кудоярова и др., 2014; Veselov et al., 2018). При этом уровень ИУК у растений мутанта был в 1.4 раза выше, чем у растений исходного генотипа. Таким образом, при непродолжительном культивировании in vitro каллусов ячменя выявлялась та же закономерность, что и у пшеницы: более низкий уровень ауксинов зарегистрирован у растений с повышенным содержанием АБК, что можно объяснить влиянием АБК на метаболизм ИУК. Как в случае каллусов пшеницы, у ячменя потеря способности к соматическому эмбриогенезу in vitro сопровождалась повышением соотношения ИУК : АБК.
Приобретение клетками каллуса AZ34 компетенции к соматическому эмбриогенезу при добавлении в индукционную среду экзогенной АБК сопровождалось, как и можно было ожидать, повышением содержания в нем АБК. При этом наблюдалось достоверное (почти в 2 раза) снижение уровня ауксинов под влиянием экзогенной АБК, что подтверждает связь между снижением уровня ауксинов и накоплением АБК.
Вызывают интерес данные о формировании сосудистой ткани в каллусах АБК-дефицитного мутанта ячменя AZ34, полученных на индукционной среде без добавления АБК (рис. 3б–3г). Хорошо известна определяющая роль ауксинов в формировании сосудистой системы в растениях in vivo (Fukuda, 2004; Медведев, Шарова, 2011). Выявлено участие ауксинов и в формировании сосудов в культивируемых in vitro эксплантах (Fukuda, 1997; Seldimirova et al., 2016а). Полученные нами данные о формировании сосудов в указанном типе каллусов ячменя можно связать с повышенным содержанием ИУК на фоне пониженного содержания АБК в них.
Как и у пшеницы, не удалось выявить связи уровня цитокининов с содержанием АБК в каллусах ячменя. На фоне пониженного содержания АБК у дефицитного по этому гормону мутанта AZ34 содержание цитокининов было таким же, как в каллусе, полученном из незрелых зародышей исходного сорта, а введение АБК в культуральную среду сопровождалось лишь тенденцией снижения уровня цитокининов.
Таким образом, полученные нами данные позволили выявить следующую тенденцию: потеря способности к соматическому эмбриогенезу как у пшеницы, так и у ячменя сопровождается повышением соотношения ИУК : АБК.
Полученные нами результаты согласуются с данными других исследователей (Dolgikh et al., 2003; Jimenez, Thomas, 2006; Zhou et al., 2017). Например, в работе Ю.И. Долгих с соавт. (Dolgikh et al., 2003) показана возможность усиления эмбриогенной способности каллусов кукурузы путем культивирования зародышей на среде для индукции каллусогенеза, содержащей ко-факторы ИУК-оксидазы – пара-кумаровую кислоту или 2,4-дихлорфенол, или в результате обработки зародышей экзогенной АБК.
Данные о повышенном содержании ауксинов в неэмбриогенных каллусах пшеницы обоих типов могут свидетельствовать в пользу мнения о возможности увеличения содержания ауксинов в клетках каллусов под влиянием экзогенных синтетических ауксинов. В свою очередь, высокое содержание ИУК (совместно с цитокининами) значительно повышает пролиферативную активность каллусов и тем самым делает невозможным переход каллусных клеток к дифференциации.
На примере каллусов моркови также показано, что экзогенная 2,4-Д способствовала накоплению эндогенной ИУК. При этом повышение концентрации 2,4-Д, в свою очередь, поддерживало пролиферативное состояние каллусов и препятствовало инициации соматического эмбриогенеза, тогда как удаление 2,4-Д из среды вело к снижению уровня эндогенного ауксина, что делало возможным как дифференциацию клеток каллуса, так и способствовало созреванию соматических зародышей (Ribnicky et al., 1996). Сходные данные представлены в работе, авторы которой выявили, что 2,4-Д способствует накоплению триптофан-производной ИУК в клеточных культурах моркови во время пролиферации каллуса (Michalczuk et al., 1992). Кроме того, установлено, что 2,4-Д сама легко проникает в культивируемые экспланты (Bronsema et al., 1998; Швецов, Еникеев, 2009) и используется клетками как ауксин (Ribnicky et al., 1996; Швецов, Еникеев, 2009), поскольку синтетические аналоги ауксина, в том числе и 2,4-Д, эффективно связываются с рецепторами ауксина (Song, 2014).
Имеются сведения о том, что маркером компетентности клеток каллусов к инициации соматического эмбриогенеза являются уровни эндогенных цитокининов (Besse et al., 1992). Однако из полученных нами данных видно, что содержание цитокининов было сходным в большинстве типов каллусов. На основании этих данных можно сделать вывод, что определяющую роль в способности каллусов к индукции соматического эмбриогенеза играет соотношение содержания ИУК : АБК. Тем самым создается возможность разработки экспериментальных способов направленного повышения способности к инициации соматического эмбриогенеза и в целом к регенерации растений в каллусных культурах in vitro у изученных злаков.
Полученные данные лишний раз свидетельствуют о том, что для индукции и поддержания тех или иных физиологических программ растениям необходимо определенное качественное сочетание и количественное соотношение фитогормонов.
В работе использована приборная база Центра коллективного пользования “Агидель” УФИЦ РАН.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (грант № 17-04-01477).
Список литературы
Егорова Н.А. Некоторые аспекты биотехнологии эфиромасличных растений: индукция каллюсо- и морфогенеза, использование сомаклональной изменчивости // Физиол. раст. и генет. 2014. Т. 46. № 2. С. 108–120.
Круглова Н.Н., Сельдимирова О.А. Регенерация пшеницы in vitro и ex vitro: цито-гистологические аспекты. Уфа: Гилем, 2011. 124 с.
Круглова Н.Н., Сельдимирова О.А. Пути морфогенеза in vitro клеток андроклинного каллюса пшеницы // Физиол. раст. и генет. 2013. Т. 45. № 5. С. 382–389.
Круглова Н.Н., Сельдимирова О.А., Веселов Д.С. К вопросу об участии ауксинов в индукции и регуляции морфогенеза в модельной каллусной системе in vitro (на примере злаков) // Биомика. 2017. Т. 9. № 4. С. 289–297.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Веселов Д.С. Абсцизовая кислота в системах культуры in vitro эксплантов // Изв. Уфимского научн. центра РАН. 2018а. № 2. С. 55–60.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Веселов Д.С. Участие абсцизовой кислоты в стимулировании соматического эмбриогенеза растений in vitro // Успехи соврем. биол. 2018б. Т. 138. № 5. С. 516–528.
Круглова Н.Н., Титова Г.Е., Сельдимирова О.А. Каллусогенез как путь морфогенеза in vitro у злаков // Онтогенез. 2018в. Т. 49. № 5. С. 273–288.
Кудоярова Г.Р., Веселов С.Ю., Каравайко Н.Н., Гюли-Заде В.З., Чередова Е.П., Мустафина А.Р., Мошков И.Е., Кулаева О.Н. Иммуноферментная тест-система для определения цитокининов // Физиол. раст. 1990. Т. 37. № 1. С. 193–199.
Кудоярова Г.Р., Веселов Д.С., Шарипова Г.В., Ахиярова Г.Р., Dodd I.C., Веселов С.Ю. Водный обмен и рост исходных и дефицитных по АБК мутантных растений ячменя при повышении температуры воздуха // Физиол. раст. 2014. Т. 61. № 2. С. 207–213.
Медведев С.С., Шарова Е.И. Биология развития растений. В 2-х т. Т. 1. Начала биологии развития растений. Фитогормоны. СПб.: Изд-во С.-Петерб. ун-та, 2011. 253 с.
От микроспоры к сорту / Ред. Батыгина Т.Б., Круглова Н.Н., Горбунова В.Ю., Титова Г.Е., Сельдимирова О.А. М.: Наука, 2010. 174 с.
Световой микроскоп как инструмент в биотехнологии растений / Ред. Круглова Н.Н., Егорова О.В., Сельдимирова О.А., Зайцев Д.Ю., Зинатуллина А.Е.. Уфа: Гилем, Башк. энцикл., 2013. 128 с.
Сельдимирова О.А., Круглова Н.Н. Баланс эндогенных и экзогенных гормонов и пути морфогенеза в андроклинных каллусах пшеницы in vitro // Изв. Уфимского научн. центра РАН. 2015. № 1. С. 33–39.
Сельдимирова О.А., Круглова Н.Н., Веселов Д.С., Яновская А.А. Оптимизация состава питательной среды для индукции каллусообразования у ячменя сорта Steptoe и его АБК-дефицитного мутанта AZ34 // Биомика. 2017. Т. 9. № 4. С. 298–303.
Третьякова И.Н., Барсукова А.В. Соматический эмбриогенез в культуре in vitro трех видов лиственницы // Онтогенез. 2012. Т. 43. № 6. С. 425–435.
Швецов С.Г., Еникеев А.Г. Поглощение и выделение клетками сои 2,4-дихлорфеноксиуксусной кислоты в суспензионной культуре // Физиол. и биохим. культ. раст. 2009. Т. 41. № 4. С. 359–363.
Aguilar M.L., Espadas F.L., Coello J., Maust B.E., Trejo C., Robert M.L., Santamaría J.M. The role of abscisic acid in controlling leaf water loss, survival and growth of micropropagated Tagetes erecta plants when transferred directly to the field // J. Exp. Bot. 2000. V. 51. № 352. P. 1861–1866.
Al-Khayri J.M. Factors affecting somatic embryogenesis in date palm (Phoenix dactylifera L.) // Somatic Embryogenesis and Genetic Transformation in Plants / Eds Junaid A., Srivastava P.S., Sharma M.P. New Delhi: Narosa Publishing House, 2013. P. 15–37.
Al-Khayri J.M., Al-Bahrany A.M. Effect of abscisic acid and polyethylene glycol on the synchronization of somatic embryo development in date palm (Phoenix dactylifera L.) // Biotechnology. 2012. V. 11. № 6. P. 318–325.
Alwael H.A., Naik P.M., Al-Khayri J.M. Synchronization of somatic embryogenesis in date palm suspension culture using abscisic acid // Date Palm Biotechnology Protocols. Volume I. Tissue Culture Applications. Methods in Molecular Biology. 2017. V. 1637. P. 215–226.
Besse I., Verdeil J.L., Duval Y., Sotta D., Maldiney R., Miginiac E. Oil palm (Elaeis guineensis Jacq.) clonal fidelity: endogenous cytokinins and indoleacetic acid in embryogenic callus cultures // J. Exp. Bot. 1992. V. 43. № 252. P. 983–989.
Bespalhok J.C., Hattori F.K. Friable embryogenic callus and somatic embryo formation from cotyledon explants of African marigold (Tagetes erecta L.) // Plant Cell Rept. 1998. V. 17. P. 870–875.
Bronsema F.B.F., van Oostveen W.J.F., Prinsen E., van Lammeren A.A.M. Distribution of [14C] dichlorophenoxyacetic acid in cultured zygotic embryos of Zea mays L. // J. Plant Growth Regul. 1998. V. 17. № 2. P. 81–88.
Charrière F., Sotta B., Miginiac E., Hahne G. Induction of adventitious shoots or somatic embryos on in vitro cultured zygotic embryos of Helianthus annuus: Variation of endogenous hormone levels // Plant Physiol. Biochem. 1999. V. 37. № 10. P. 751–757.
Dolgikh Y.I., Pustovoitova T.N., Zhdanova N.E. Hormonal regulation of somatic embryogenesis on maize // Phytohormones in Plant Biotechnology and Agriculture / Eds Macháčková I., Romanov G.A. Springer, Dordrecht, 2003. P. 243–247.
Fukuda H. Tracheary element differentiation // Plant Cell. 1997. V. 9. № 7. P. 1147–1156.
Fukuda H. Signals that control plant vascular cell differentiation // Nat. Rev. Mol. Cell Biol. 2004. V. 5. № 5. P. 379–391.
Gaspar T., Kevers C., Penel C., Greppin H., Reid D.M., Thorpe T.A. Plant hormones and plant growth regulators in plant tissue culture // In Vitro Cell. Dev. Biol. Plant. 1996. V. 32. № 4. P. 272–289.
Hand M.L., de Vries S., Koltunow A.M. A comparison of in vitro and in vivo asexual embryogenesis // Methods Mol. Biol. 2016. V. 1359. P. 3–23.
Hansen H., Grossmann K. Auxin-induced ethylene triggers abscisic acid biosynthesis and growth inhibition // Plant Physiol. 2000. V. 124. № 11. P. 1437–1448.
Horstman A., Bemer M., Boutilier K. A transcriptional view on somatic embryogenesis // Regeneration. 2017. V. 4. № 4. P. 201–216.
Ikeuchi M., Sugimoto K., Iwase A. Plant callus: mechanisms of induction and repression // Plant Cell. 2013. V. 25. P. 3159–3173.
Jimenez V.M. Regulation of in vitro somatic embryogenesis with emphasis on the role of endogenous hormones // R. Brasil. Fisiol. Veg. 2001. V. 13. P. 196–223.
Jimenez V.M. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis // Plant Growth Regul. 2005. V. 47. P. 91–110.
Jimenez V.M., Thomas C. Participation of plant hormones in determination and progression of somatic embryogenesis // Somatic Embryogenesis / Eds Mujib A., Samaj J. Berlin; Heidelberg: Springer-Verlag, 2006. P. 103–118.
Krikorian A.D. Hormones in tissue culture and micropropagation // Plant Hormones / Ed. Davies P.J. Kluwer Academic Publishers, 1995. P. 774–796.
Kudoyarova G.R., Korobova A.V., Akhiyarova G.R., Arkhipova T.N., Zaytsev D.Yu., Prinsen E., Egutkin N.L., Medvedev S.S., Veselov S.Yu. Accumulation of cytokinins in roots and their export to the shoots of durum wheat plants treated with the protonophore carbonyl cyanide m-chlorophenylhydrazone (CCCP) // J. Exp. Bot. 2014. V. 65. P. 2287–2294.
Kudoyarova G.R., Vysotskaya L.B., Cherkozyanova A., Dodd I.C. Effect of partial rootzone drying on the concentration of zeatin type cytokinins in tomato (Solanum lycopersicum L.) xylem sap and leaves // J. Exp. Bot. 2007. V. 58. P. 161–168.
Lema-Ruminska J., Goncerzewicz K., Gabriel M. Influence of abscisic acid and sucrose on somatic embryogenesis in cactus Copiapoa tenuissima Ritt. forma mostruosa // Sci. World J. 2013. V. 2013. Article ID 513985. 7 p. doi https://doi.org/10.1155/2013/513985
Mauri P.V., Manzanera J.A. Effect of abscisic acid and stratification on somatic embryo maturation and germination of holm oak (Quercus ilex L.) // In vitro Cell. Dev. Biol. Plant. 2004. V. 40. № 5. P. 495–498.
Michalczuk l., Ribnicky D.M., Cooke T.J., Cohen J.D. Regulation of indole-3-acetic acid biosynthetic pathways in carrot cell // Plant Physiol. 1992. V. 100. № 3. P. 1346–1353.
Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco cultures // Physiol. Plant. 1962. V. 15. P. 473–497.
Nic-Can G.I., Loyola-Vargas V.M. The role of the auxins during somatic embryogenesis // Somatic Embryogenesis: Fundamental Aspects and Applications / Eds Loyola-Vargas V., Ochoa-Alejo N. Springer, Cham, 2016. P. 171–182.
Nishiwaki M., Fujino K., Koda Y., Masuda K., Kikuta Y. Somatic embryogenesis induced by the simple application of abscisic acid to carrot (Daucus carota L.) seedlings in culture // Planta. 2000. V. 211. № 5. P. 756–759.
Ochatt S., Revilla M. From stress to embryos: Some of the problems for induction and maturation of somatic embryos // In vitro Embryogenesis in Higher Plants / Eds Germana M.A., Lambardi M. Springer, New York, 2016. P. 523–536.
Park S.Y., Fung P., Nishimura N., Jensen D.R., Fujii H., Zhao Y., Lumba S., Santiago J., Rodrigues A., Chow T.F., Alfred S.E., Bonetta D., Finkelstein R., Provart N.J., Desveaux D., Rodriguez P.L., McCourt P., Zhu J.K., Schroeder J.I., Volkman B.F., Cutler S.R. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins // Science. 2009. V. 324. P. 1068–1071.
Phytohormones and Abiotic Stress Tolerance in Plants / Eds Khan N.A., Nazar R., Iqbal N., Anjum N.A. Luxembourg: Springer, 2012. 306 p.
Plant Tissue Culture: An Introductory Text / Eds Bhojwani S.S., Dantu P.K. Springer India, 2013. P. 31–33.
Rai M.K., Jaiswal V.S., Jaiswal U. Effect of ABA and sucrose on germination of encapsulated somatic embryos of guava (Psidium guajava L.) // Sci. Hortic. 2008. V. 117. P. 302–305.
Rai M.K., Shekhawat N.S., Harish Gupta A.K., Phulwaria M., Ram K., Jaiswal U. The role of abscisic acid in plant tissue culture: a review of recent progress // Plant Cell Tiss. Org. Cult. 2011. V. 106. № 2. P. 179–190.
Ribnicky D.M., Ilic N., Cohen J.D., Cooke T.J. The effects of exogenous auxins on endogenous indole-3-acetic acid metabolism (the implications for carrot somatic embryogenesis) // Plant Physiol. 1996. V. 112. P. 549–558.
Seldimirova O.A., Kudoyarova G.R., Kruglova N.N., Zaytsev D.Yu., Veselov S.Yu. Changes in distribution of cytokinins and auxins in cell during callus induction and organogenesis in vitro in immature embryo culture of wheat // In Vitro Cell Dev. Biol. Plant. 2016a. V. 52. № 3. P. 251–264.
Seldimirova O.A., Zaytsev D.Yu., Galin I.R., Kruglova N.N. Phytohormonal regulation of in vitro formation of wheat androgenic structures // Научн. результат. Серия: физиол. 2016b Т. 2. № 1(7). С. 3–8.
Sharma P., Pandey S., Bhattacharya A., Nagar P.K., Ahuja P.S. ABA associated biochemical changes during somatic embryo development in Camellia sinensis (L.) O. Kuntze // J. Plant Physiol. 2004. V. 161. № 11. P. 1269–1276.
Sholi N., Chaurasia A., Agrawal A. et al. ABA enhances plant regeneration of somatic embryos derived from cell suspension cultures of plantain cv. Spambia (Musa sp.) // Plant Cell Tiss. Org. Cult. 2000. V. 9. P. 133–140.
Somatic Embryogenesis: Fundamental Aspects and Applications / Eds Loyola-Vargas V., Ochoa-Alejo N. Springer, Cham, 2016. 506 p.
Souza J.M.M., Tomaz M.L., Arruda S.C.C., Demétrio C.G.B., Venables W.N., Martinelli A.P. Callus sieving is effective in improving synchronization and frequency of somatic embryogenesis in Citrus sinensis // Biol. Plant. 2011. V. 55. P. 703–707.
Song Y. Insight into the mode of action of 2,4-dichlorophenoxyacetic acid (2,4-D) as an herbicide // J. Integr. Plant Biol. 2014. V. 56. № 2. P. 106–113.
Stasolla C., Kong L., Yeung E.C., Thorpe T.A. Maturation of somatic embryos in conifers: Morphogenesis, physiology, biochemistry, and molecular biology // In Vitro Cell. Dev. Biol. Plant. 2002. V. 38. № 2. P. 93–105.
Stasolla C., Yeung E.C. Recent advances in conifer somatic embryogenesis: improving somatic embryo quality // Plant Cell Tiss. Org. Cult. 2003. V. 74. P. 15–35.
Sugiyama M. Historical review of research on plant cell dedifferentiation // J. Plant Research. 2015. V. 128. № 5. P. 349–359.
Tuteja N. Abscisic acid and abiotic stress signaling // Plant Signal. Behav. 2007. V. 2. P. 135–138.
Vales T., Feng X., Ge L., Xu N., Cairney J., Pullman G., Peter G. Improved somatic embryo maturation in loblolly pine by monitoring ABA-responsive gene expression // Plant Cell Rep. 2007. V. 26. P. 133–143.
Veselov D.S., Sharipova G.R., Veselov S.Yu., Dodd I.C., Ivanov I.I., Kudoyarova G.R. Rapid changes in root HvPIP2;2 aquaporins abundance and ABA concentration are required to enhance root hydraulic conductivity and maintain leaf water potential in response to increased evaporative demand // Funct. Plant Biol. 2018. V. 45. P. 143–149.
Veselov S., Kudoyarova G., Egutkin N., Gyuli-Zade V., Mustafma A., Kof E. Modified solvent partitioning scheme providing increased specifi city and rapidity of immunoassay for indole 3-acetic acid // Physiol. Plant. 1992. V. 86. P. 93–96.
Von Arnold S., Sabala I., Bozhkov P., Dyachok J., Filonova L. Developmental pathways of somatic embryogenesis // Plant Cell Tiss. Org. Cult. 2002. V. 69. № 3. P. 233–249.
Vysotskaya L.B., Korobova A.V., Kudoyarova G.R. Abscisic acid accumulation in the roots of nutrient-limited plants: Its impact on the differential growth of roots and shoots // J. Plant Physiol. 2008. V. 165. P. 1274–1279.
Vysotskaya L.B., Korobova A.V., Veselov S.Yu., Dodd I.C., Kudoyarova G.R. ABA mediation of shoot cytokinin oxidase activity: assessing its impacts on cytokinin status and biomass allocation of nutrient deprived durum wheat // Funct. Plant Biol. 2009. V. 36. № 1. P. 66–72.
Winkelmann T. Somatic versus zygotic embryogenesis: Learning from seeds // Methods Mol. Biol. 2016. V. 1359. P. 25–46.
Zhang S., Han S., Yang W., Wei H., Zhang M., Qi L. Changes in H2O2 content and antioxidant enzyme gene expression during somatic embryogenesis of Larix leptolepis // Plant Cell Tiss. Org. Cult. 2010. V. 100. P. 21–29.
Zhou X., Zheng R., Liu G., Xu Y., Zhou Y., Laux T., Zhen Y., Harding S.A., Shi J., Chen J. Desiccation treatment and endogenous IAA levels are key factors influencing high frequency somatic embryogenesis in Cunninghamia lanceolata (Lamb.) Hook // Front. Plant Sci. 2017. V. 8: 2054. doi https://doi.org/10.3389/fpls.2017.02054
Дополнительные материалы отсутствуют.


