Онтогенез, 2019, T. 50, № 3, стр. 205-214
Астроцитарные маркеры в таницитах третьего желудочка головного мозга крысы в постнатальном онтогенезе и при старении
Д. А. Суфиева a, *, О. В. Кирик a, Д. Э. Коржевский a
a ФГБНУ “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, д. 12, Россия
* E-mail: dinobrione@gmail.com
Поступила в редакцию 29.11.2018
После доработки 29.11.2018
Принята к публикации 10.01.2019
Аннотация
Целью данной работы было изучение распределения основных астроцитарных маркеров (глютаминсинтетазы, глиального фибриллярного кислого белка, коннексина 43) в субпопуляциях таницитов дна третьего желудочка в постнатальном онтогенезе. С использованием иммуногистохимических методов были исследованы фронтальные срезы головного мозга крыс линии Вистар на следующих сроках: 7 (n = 4), 30 (n = 4) сутки постнатального развития, 4–6 месяцев (n = 8), 20 месяцев (n = 4). Было установлено, что в ходе постнатального развития и при старении танициты претерпевают ряд цитохимических и структурных изменений. В первую неделю развития выстилка дна третьего желудочка характеризуется процессами дифференцировки таницитов. В течение первого месяца постнатального развития происходит окончательное установление профиля синтеза белков, характерных для взрослых животных. При старении, несмотря на то, что не меняется цитохимический профиль, происходит реорганизация отростков таницитов. Полученные данные будут способствовать установлению роли исследуемых белков в процессах развития, становления и старения таницитов дна третьего желудочка.
ВВЕДЕНИЕ
Танициты дна третьего желудочка представляют собой специализированную популяцию глиальных клеток. Они характеризуются биполярной формой и наличием длинного базального отростка. Апикальной частью клетки контактируют со спинномозговой жидкостью (CSF), а базальные отростки взаимодействуют с нейронами, глией и кровеносными сосудами подлежащей нервной ткани, в том числе с сосудами портальной системы гипофиза. Такое расположение и морфология таницитов определяет их основные функции: участие в организации ликворо-энцефалического и гемато-ликворного барьеров, обеспечение двунаправленного активного транспорта различных веществ (метаболитов, гормонов, ростовых факторов), контроль высвобождения рилизинг-факторов нейросекреторными клетками гипоталамуса в портальную систему гипофиза (Bolborea, Dale, 2013; Rizzoti, Lovell-Badge, 2017).
Различают 4 субпопуляции таницитов (α1, α2, β1, β2 танициты), которые характеризуются рядом структурных, цитохимических и функциональных особенностей, а также определенной локализацией в стенке III желудочка: α танициты выстилают вентро-латеральные стенки третьего желудочка, β1 танициты – латеральные области инфундибулярного углубления, β2 танициты образуют выстилку стенки срединного возвышения (Rodríguez et al., 2010).
Танициты совмещают в себе ряд характеристик радиальной глии и астроцитов. В частности, танициты, дифференцируясь из радиальной глии, сохраняют ее основную морфологическую особенность – биполярность. Было показано, что танициты характеризуются присутствием ряда астроцитарных маркеров – белка промежуточных филаментов GFAP (глиальный фибриллярный кислый белок), белка щелевых контактов Cx43 (коннексин 43), фермента GS (глютаминсинтетеза) и некоторых других (Rodriguez et al., 2005). Перечисленные три маркера являются одними из основных и наиболее часто используемых при изучении астроцитов. Анализ распределения данных белков в таницитах в постнатальном онтогенезе представляет особый интерес с точки зрения выявления функциональных особенностей различных субпопуляций таницитов, а также установления возможных возрастных изменений как в раннем постнатальном онтогенезе, так и при старении. В связи с чем, целью данного исследования стало изучение GFAP, Cx43 и GS в различных субпопуляциях таницитов на разных сроках постнатального онтогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования послужил промежуточный мозг крыс линии Вистар на различных сроках постнатального онтогенеза: 7 (n = 4), 30 (n = 4) сутки постнатального развития, взрослые животные (4–6 мес.) (n = 8) и старые животные (20 мес.) (n = 4). При содержании и умерщвлении животных соблюдали международные правила Хельсинкской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Головной мозг был фиксирован в цинк-этанол-формальдегиде. Обезвоженные объекты заливали в парафин по общепринятой методике. Изготавливали фронтальные срезы толщиной 5 мкм на уровне от –3.24 до –4.44 мм по отношению к брегме (Paxinos, Watson, 2007). Морфологическому исследованию подвергали фронтальные срезы промежуточного мозга на уровне аркуатного ядра гипоталамуса. После стандартной процедуры депарафинирования и регидратации срезы подвергали тепловому демаскированию в модифицированном цитратном буфере S1700 (Dako, Дания) с последующим блокированием эндогенной пероксидазы. Иммуногистохимическое окрашивание проводили с использованием моноклональных мышиных антител к GS в разведении 1 : 400 (Chemicon, США), GFAP (клон SPM 507) в разведении 1 : 100 (Spring Bioscience, США) и Cx43 (клон F-7) в разведении 1 : 100 (Santa Cruze Biotechnology, США). В качестве вторичного реагента был использован набор MACH 2 Universal HRP Polymer Kit for mouse or rabbit (Biocare medical, США). Для визуализации продукта реакции применяли хромоген 3'3-диаминобензидин из набора DAB+ (Dako, Дания). После проведения реакции часть срезов подкрашивали гематоксилином Джилла. Полученные препараты анализировали с помощью светового микроскопа Leica DM750 (Германия) и фотографировали с помощью фотокамеры ICC50 (Leica, Германия). Для обработки изображений использовали программу LAS EZ (Leica, Германия).
Для конфокальной микроскопии при двойном иммуногистохимическом выявлении GS и GFAP были использованы мышиные моноклональные антитела к GS (Chemicon, США) и кроличьи поликлональные антитела к GFAP (Dako, Дания). В качестве вторичных реагентов были использованы ослиные антитела против мыши, меченые биотином (Jackson ImmunoResearch, США) и моновалетный Fab-фрагмент антикроличьего иммуноглобулина осла, конъюгированный с флуорохромом Rhodamine Red™-X (RRX) (Jackson ImmunoReaserch, США), а также конъюгат стрептавидина с флуорохромом Cy2 (Jackson ImmunoResearch, США). Для выявления Cx43 применялись мышиные моноклональные антитела к исследуемому белку (клон F-7) (Santa Cruze Biotechnology, США). В качестве вторичного реагента использовали биотинилированные антитела из набора LSAB 2 (Dako, Дания) и конъюгат стрептавидина с Сy3 (InvitroGen, США). Ядра подкрашивали ядерным красителем Sytox Green (InvitroGen, США). Полученные препараты исследовали при помощи конфокального лазерного микроскопа LSM 710 (Zeiss, Германия). Для возбуждения флуоресценции Cy2 и Sytox Green применяли лазер с длинной волны 488 нм, для Cy3 и RRX – 561 нм. Была использована комбинация фильтров MBS 488/561. Анализ полученных изображений проводили при помощи компьютерных программ Zen-2012 и LSM Image Browser (Zeiss, Германия). Оценка результатов ИГХ исследования проводилась полуколичественным методом. Экспрессия исследуемого маркера расценивалась как “–” – отсутствие реакции, “+” – слабая (реакция наблюдалась не во всех клетках), “++” – умеренная (реакция наблюдалась во всех клетках, интенсивность реакции умеренная), “+++” – высокоинтенсивная (выраженная реакция присутствует во всех клетках).
Таблица 1.
Астроцитарные маркеры GS, GFAP, Cx43 в эпендимоцитах и субпопуляциях таницитов на различных сроках постнатального онтогенеза
| Тип клеток | Возраст | |||
|---|---|---|---|---|
| 7 сутки постнатального развития | 30 сутки постнатального развития | 4–6 месяцев | 20 месяцев | |
| Эпендимоциты | GS + GFAP + Cx43 +++ |
GS – GFAP + Cx43 +++ |
GS – GFAP – Cx43 +++ |
GS – GFAP – Cx43 +++ |
| α1 танициты | GS + GFAP + Cx43 +++ |
GS – GFAP +++ Cx43 +++ |
GS – GFAP +++ Cx43 +++ |
GS – GFAP +++ Cx43 +++ |
| α2 танициты | GS +++ GFAP + Cx43 +++ |
GS – GFAP ++ Cx43 ++ |
GS ++ GFAP ++ Cx43 ++ |
GS +++ GFAP +++ Cx43 ++ |
| β1 танициты | GS +++ GFAP + Cx43 + |
GS ++ GFAP + Cx43 – |
GS +++ GFAP + Cx43 + |
GS +++ GFAP + Cx43 + |
| β2 танициты | GS – GFAP – Cx43 + |
GS – GFAP + Cx43 – |
GS + GFAP + Cx43 + |
GS – GFAP + Cx43 + |
РЕЗУЛЬТАТЫ
На 7 сутки постнатального развития при иммуногистохимическом выявлении GS реакция в выстилке дна третьего желудочка была различной. В α2 и β1 таницитах наблюдалась высокоинтенсивная реакция. Продукт реакции локализовался как в телах, так и в отростках клеток (рис. 1а). Выстилка, образованная α1 таницитами, представляет собой многорядную структуру. В этой области встречались единичные иммунопозитивные биполярные клетки (рис. 1б). Интенсивность реакции в этих клетках варьировала от слабой до высокоинтенсивной. В эпендимоцитах и β2 таницитах реакция на исследуемый белок отсутствовала, однако в области расположения эпендимоцитов также встречались отдельные иммунопозитивные биполярные клетки. В подлежащей нервной ткани положительную реакцию на GS давали астроциты, в средней области срединного возвышения (zona interna) встречались отдельные GS-иммунопозитивные звездчатые клетки (предположительно астроциты).
Рис. 1.
Танициты дна третьего желудочка головного мозга крысы. а, б, в, г – 7 сутки постнатального развития; д, е – 30 сутки постнатального развития. Иммуногистохимическая реакция на GS (а, б, д), GFAP (в), Cx43 (г, е). Увеличение ×100. Масштабный отрезок равен 20 мкм. Звездочка – полость желудочка, стрелка – тела таницитов, головка стрелки – кровеносный сосуд.
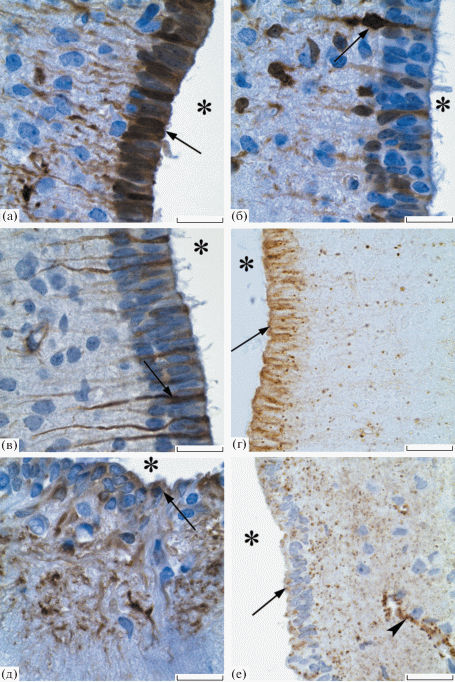
К 30 стукам постнатального развития профиль синтеза GS в исследуемых клетках изменился. Так, в эпендимоцитах α1, α2 и β2 таницитах реакция отсутствовала. Положительная иммуногистохимическая реакция на этом сроке развития наблюдалась лишь в β1 таницитах (рис. 1д, 2а). Продукт реакции локализовался в телах и проксимальных отделах отростков этих клеток, а интенсивность реакции была слабее по сравнению с таковой у 7-дневных крысят. GS-иммунопозитивными являлись астроциты и звездчатые клетки в срединном возвышении.
У половозрелых крыс (4–5 мес.) реакция на GS наблюдалась в α2, β1 и единичных β2 таницитах. Продукт реакции локализовался в телах (α2, β1 и β2 танициты) и проксимальных отделах отростков (β1 танициты). В α2 и β2 таницитах интенсивность реакция была слабой, но сопоставимой с таковой в астроцитах, в то время как в β1 таницитах реакция на GS была высокоинтенсивной (рис. 2в). В эпендимоцитах реакция отсутствовала.
Рис. 2.
Инфундибулярное углубление третьего желудочка головного мозга крысы. а, б – 30 сутки постнатального развития; в, г, д – взрослые животные (4–5 мес.); е – старое животное (20 мес.). а, в – область α2 и β1 таницитов, двойная иммуногистохимическая реакция на GS и GFAP. б, г – иммуногистохимичекая реакция на Cx43, подкраска ядерным красителем Sytox Green: б – 3D реконструкция, число оптических срезов – 22, г – одиночный оптический срез. д, е – иммуногистохимическая реакция на GFAP, 3D реконструкция 14 (д) и 45 (е) оптических срезов. Масштабный отрезок равен 50 мкм (а), 100 мкм (в, г). Конфокальная лазерная микроскопия. Объективы Plan-Apochromat 20×/0.8 M27 (а, в, г), Plan-Apochromat 100×/1.40 Oil DIC M27 (б, е), LD C-Apochromat 40×/1.1 W Korr M27 (д).
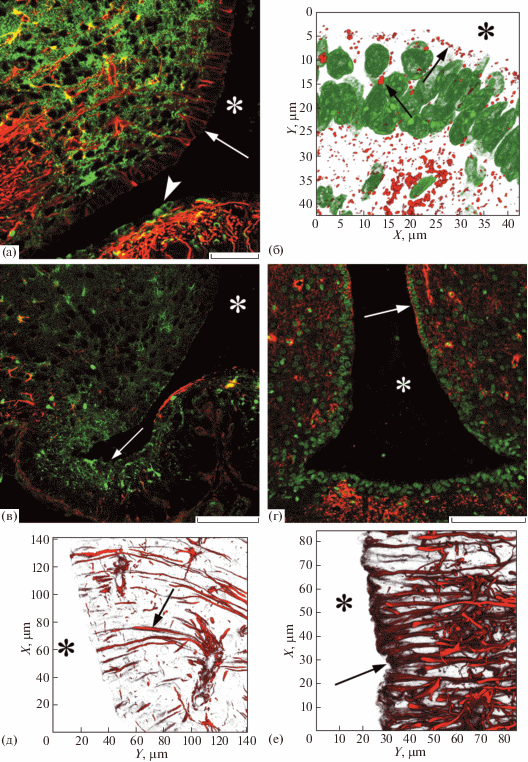
У старых животных в выстилке дна третьего желудочка GS-иммуноположительными являлись α2 и β1 танициты. В эпендимоцитах, α1 и β2 таницитах реакция отсутствовала. Интересно отметить, что у старых животных в области проксимальных отделов отростков β1 таницитов выявлялось значительное число клеток округлой формы, которые давали высокоинтенсивную реакцию на GS.
Иммуногистохимическое окрашивание на GFAP выявило, что на 7 сутки развития высокоинтенсивная реакция определяются в отдельных α1 и α2 таницитах, при этом иммунопозитивные клетки располагались преимущественно кластерами. Продукт реакции локализовался как в телах, так и отростках клеток (рис. 1в). Также встречались единичные иммунопозитивные β1 танициты, однако в этой субпопуляции таницитов окрашивались только тела клеток. В β2 таницитах реакция отсутствовала. В выстилке, образованной эпендимоцитами, отдельные клетки высокоинтенсивно окрашивались на GFAP. Кроме того, среди эпендимоцитов встречались единичные GFAP-иммунопозитивные биполярные клетки. В субэпендмной области GFAP+ астроциты подстилали эпендиму, образовывая сплошной слой. В срединном возвышении положительная реакция на GFAP выявляется в звездчатых клетках в zona interna.
К 30 суткам постнатального развития слабая реакция на GFAP наблюдалась в единичных эпендимоцитах. В α1 таницитах реакция распространилась на все клетки данной субпопуляции и оставалась высокоинтенсивной. Продукт реакции локализовался в телах и отростках клеток. В α2 таницитах реакция сохранилась, главным образом, в отростках и расширенных ножках этих клеток (рис. 2а), а интенсивность реакции в этой субпопуляции была слабее по сравнению с 7-дневными крысятами. В β таницитах реакция была слабой и локализовалась в отростках клеток. Высокоинтенсивная реакция наблюдалась в астроцитах, выстилающих субэпендимную область и в звездчатых клетках срединного возвышения. Также окрашивалась область пограничной периваскулярной глиальной мембраны, за исключением зоны фенестрированных капилляров срединного возвышения.
У половозрелых животных реакция на GFAP в эпендимоцитах отсутствовала. В α1 и α2 таницитах реакция была интенсивной, продукт реакции локализовался преимущественно в отростках и расширенных ножках таницитов, а также в телах клеток (рис. 2д). В β таницитах реакция отсутствовала, но слабая реакция наблюдалась в дистальных отделах отростков и в расширенных ножках этих клеток (рис. 2в). В звездчатых клетках срединного возвышения и субэпендимных астроцитах реакция была высокоинтенсивной.
У старых животных характер распределения GFAP не изменяется. Также как и у взрослых, GFAP выявлялся в телах и отростках α таницитов, и в отростках β таницитов. Однако с возрастом наблюдалась тенденция к значительному усилению реакции в исследуемых клетках, а также в α1 и α2 таницитах наблюдается сильное разветвление проксимальных отделов отростков (увеличивается число отростков второго и третьего порядков) (рис. 2д, 2е). Кроме того, наблюдается реорганизация отростков: отростки становятся более извилистыми и практически не образуют пучков.
При иммуногистохимическом выявлении Cx43 на 7 сутки постнатального развития высокоинтенсивная реакция наблюдалась в эпендимоцитах, α1 и α2 таницитах, и слабая реакция – в β1 и β2 таницитах. Продукт реакции, главным образом, локализовался в апикальной части клеток (α танициты), а также вдоль латеральной поверхности клетки (α и β танициты). Распределение носило мелкогранулярный характер (рис. 1г). Гранулы характеризовались преимущественно округлой, реже овальной формой. Также отдельные гранулы встречались по ходу отростков α таницитов. В подлежащей нервной ткани контурировались кровеносные сосуды, за исключением капилляров срединного возвышения.
На 30 сутки постнатального развития положительная высокоинтенсивная ИГХ реакция на Cx43 выявлялась в эпендимоцитах и α1 таницитах преимущественно в апикальной части, а также вдоль латеральной поверхности этих клеток (рис. 1е, 2б). В α2 таницитах Cx43 располагался вдоль латеральной поверхности клеточной мембраны, однако реакция была значительно слабее по сравнению с α1 таницитами, и в дистальных отделах отростков и расширенных ножках, где реакция была высокоинтенсивной. В β таницитах реакция отсутствовала. Кроме того, Cx43-иммуноположительными являлись астроциты и звездчатые клетки срединного возвышения.
У половозрелых и старых животных положительная реакция на Сx43 наблюдалась в эпендимоцитах и α таницитах. Характер распределения ИГХ реакции совпадает с таковым у 30-дневных крысят. В области β1 и β2 таницитов отдельные Сx43+ гранулы выявлялись вдоль латеральных стенок, в дистальных отделах отростков и ножках этих клеток. В подлежащей нервной ткани контурировались кровеносные сосуды, за исключением фенестрированных капилляров срединного возвышения. А также положительная реакция наблюдалась в астроцитах и звездчатых клетках zona interna срединного возвышения.
Результаты, полученные в ходе данного исследования, суммированы в табл. 1.
ОБСУЖДЕНИЕ
Несмотря на то, что танициты дна третьего желудочка были открыты Хорстманом еще в 1954 г. (Horstmann, 1954) и с тех пор активно изучаются, данные, касающиеся организации таницитов в постнатальном развитии и при старении, немногочисленны. Установлено, что эти клетки у крыс дифференцируются из радиальной глии в последние два дня эмбрионального и в первую неделю постнатального развития, достигая полной дифференцировки в течение первого месяца жизни. Исследования, касающиеся раннего онтогенеза выстилки третьего желудочка мозга крысы, были проведены с помощью электронной микроскопии, где основное внимание уделялось ультраструктурным изменениям (Monroe, Paull, 1974; Угрюмов, Чандрасекхар, 1980; Bruni et al., 1983). Было продемонстрировано, что танициты подвергаются возрастным изменениям, а именно, происходит дезорганизация их отростков (Koopman et al., 2017). Большой массив работ, посвященных изучению таницитов, направлен на исследование цитохимичских и функциональных характеристик этих клеток у половозрелых животных. Показано, что танициты могут синтезировать ряд маркеров, типичных для радиальной глии и астроцитов (Rodríguez et al., 2005). В данной работе, были изучены наиболее важные астроцитарные маркеры в таницитах – глютаминсинтетаза, глиальный фибриллярный кислой белок, коннексин 43 – и охарактеризованы как с точки зрения субпопуляционных различий таницитов, так и в возрастном аспекте.
Глютаминсинтетаза (GS) – фермент, который участвует в детоксикации аммония путем катализации реакции превращения аммония и глутамата в глутамин, а также в метаболизме гамма аминомаслянной кислоты. Главным образом, в мозге GS локализована в астроцитах, также было показано, что в мозге GS присутствует в радиальной глии, некоторых эпендимоцитах у низших позвоночных и в олигодендроцитах. У крыс GS начинает синтезироваться на 14 день эмбрионального развития клетками нейроэпителия, а на 16 день – клетками радиальной глии. Было показано, что в течение развития активность GS увеличивается, что связывают скорее не с пролиферацией астроцитов, а с ее дифференцировкой, и достигает показателей активности взрослого мозга к 20 постнатальным суткам. Период полураспада фермента очень короткий и составляет 13–22 ч, и уровень GS очень жестко регулируется. В регуляции экспрессии и модуляции активности принимают участие медиаторы и гормоны (инсулин, тиреоидные гормоны, кортикостероиды). GS участвует в поддержании гомеостаза нервной ткани, предохраняет нейроны от эксайтотокстичности (Suarez et al., 2002; Коржевский и др., 2016; Kolos, Korzhevskii, 2018).
В настоящем исследовании было продемонстрировано, что на всех исследованных сроках GS присутствует в α2 и β1 таницитах. Такое распределение может быть связано с тем, что именно эти две субпопуляции таницитов прилежат к аркуатному ядру (AN) гипоталамуса, которое отвечает за энергетический баланс организма. Было показано, что AN, в отличие от вентромедиального (VMN) и дорсомедиального (DMN) ядер, характеризуется тем, что оно “закрыто” для прилежащих структур (при введении таких веществ как трипановый синий или пероксидазы хрена в AN, эти вещества распределяются в пределах этого ядра, не проникая в прилежащие VMN и срединное возвышение, и наоборот, при введении этих веществ в ядра гипоталамуса или срединное возвышение, в AN они не обнаруживаются). При этом, AN более “открыто” для различных веществ СМЖ, по сравнению с теми же VMN и DMN, таким образом формируя особое микроокружение для нейронов AN (Rodríguez et al., 2010). Учитывая все вышеизложенное, можно предположить, что нейроны AN будут нуждаться в более активных защитных механизмах, для поддержания гомеостаза нервной ткани, и α2 и β1 танициты, наряду с астроцитами, принимают активное участие в синтезе GS для 1) детоксикации аммония и 2) регуляции баланса глутамат/глутамин для предохранения нейронов от гибели путем эксайтотоксичности. Также, возможно и другое объяснение. При исследовании GS в таницитах, проведенное на сибирских хомяках (Phodopus sungorus), было продемонстрировано, что уровень синтеза GS в таницитах зависит от длины светового дня. В длинный фотопериод уровень синтеза GS значительно выше по сравнению с коротким фотопериодом. Авторы предполагают, что поскольку танициты оплетают своими ножками кровеносные сосуды и могут быть вовлечены в регуляцию транспорта различных веществ через гематоэнцефалический барьер (BBB) в нервную ткань, то вероятно, эти клетки учувствуют в транспорте нейтральных аминокислот (в обмен на глутамин) из крови в нервную ткань, таким образом снабжая нейроны AN энергетическим субстратом (Nilaweera et al., 2011).
Интересно, что в первую неделю развития как в области эпендимоцитов, так и α1 таницитов наблюдаются GS иммунопозитивные биполярные клетки, в то время как на более поздних сроках постнатального развития обе эти клеточные популяции характеризуются негативной реакцией на GS. По всей видимости, GS+ биполярными клетками на 7 сут развития являются радиальные глиоциты, которые согласно литературным данным, начинают синтезировать GS на 16 день эмбрионального развития и участвуют в подержании соответствующего микроокружения в развивающемся мозге (Akimoto et al., 1993; Suarez et al., 2002).
Глиальный фибриллярный кислый белок (GFAP) – белок промежуточных филаментов III типа. Он образует глиальные промежуточные филаменты как зрелых, так и дифференцирующихся астроцитов. Предполагается, что GFAP задействован в модуляции движения астроцитов и обеспечении стабильной морфологии их тел и отростков. Кроме того, считается, что GFAP важен для нейрон-глиальных взаимодействий (Коржевский и др., 2012).
В ходе данного исследования было установлено, что становление профиля синтеза и локализации GFAP в таницитах происходит в течение первого месяца развития. Так, на 7 сутки постнатального развития GFAP выявляется в отдельных α1, α2 и β1 таницитах. С развитием реакция распространяется на все клетки данных субпопуляций, а также наблюдается и в β2 таницитах, при этом изменяется локализация белка. В α1 таницитах он локализуется как телах, так и отростках клеток на всех изученных сроках, в то время как в α2 таницитах на ранних сроках GFAP наблюдается в телах и отростках, а с 30 суток постнатального развития данный белок локализуется, главным образом, в отростках и ножках α2 таницитов. В β1 таницитах на 7 сутки развития GFAP выявлялся только в телах клеток. Начиная с первого месяца развития, также как и в β2 таницитах, GFAP локализуется, главным образом, в отростках и ножках таницитов. Промежуточные филаменты являются важными компонентами клеток сложной формы, и, таким образом, обеспечивают не только их ригидность, но и, при необходимости, гибкость за счет динамических изменений в структуре промежуточных филаментов. Кроме того, для таких клеток немаловажным является закрепление органелл, а также их локализация и правильное расположение в цитоплазме, где не последнюю роль играют промежуточные филаменты (Минин, Молдавер, 2008; Lowery et al., 2015). Такое распределение GFAP в субпопуляциях таницитов может быть связано с тем, что танициты характеризуются наличием длинного базального отростка, и преимущественная локализация GFAP в отростках может указывать на необходимость дополнительной механической стабилизации отростков и ножек таницитов. Кроме того, поскольку промежуточные филаменты – это динамичные структуры, можно полагать, что они важны для изменения формы ножек таницитов.
В ходе старения в таницитах происходит ряд изменений: 1) значительно усиливается реакция на GFAP; 2) проксимальные отделы отростков αтаницитов сильно разветвляются, по сравнению с половозрелыми животными; 3) происходит реорганизация их отростков (отростки становятся извилистыми, не образуют пучков). Ранее Золи и соавт. было показано, что количество GFAP у 24-месячных крыс увеличивается в 3 раза по сравнению с половозрелыми животными, а число таницитов уменьшается (Zoli et al., 1995). Однако, исследования таницитов в мозге человека не выявила различий в количестве клеток у взрослых и пожилых людей (Koopman, 2017). При этом в работах, посвященных изучению возрастных особенностей таницитов, дезорганизация отростков таницитов отмечалась во всех исследованиях (Zoli et al., 1995; Yin, Gore, 2010; Koopman et al., 2017). По-видимому, усиление синтеза GFAP и разветвление отростков таницитов является компенсаторным механизмов вследствие возрастной деструкции их отростков.
Коннексин 43 (Cx43) – белок щелевых контактов. Щелевые контакты опосредуют межклеточный транспорт ионов и небольших молекул: аминокислот, нуклеотидов, метаболитов и вторичных посредников (например, Ca2+, глюкоза, cAMP, ATP, IP3). Известно не менее 20 членов семейства белков щелевых контактов, которые разделяются по их молекулярной массе, среди которых коннексин 43 (белок с массой 43 kDa) является основным белком щелевых контактов в астроцитах. Также этот белок характерен для эпендимоцитов и микроглиоцитов (Schulz et al., 2015).
В ходе данной работы было показано, что Cx43 встречается во всех субпопуляциях таницитов на всех исследованных сроках. Однако стоит отметить, что плотность щелевых контактов в различных субпопуляциях таницитов сильно варьировала. Наибольшее число щелевых контактов идентифицировалось в α1 таницитах, меньше в α2 таницитах, в то время как в β1 и β2 таницитах Cx43 иммунопозитивные гранулы встречались крайне редко. Различна была также и локализация белка. В α1 таницитах Cx43 локализовался, главным образом, на апикальной поверхности клеток и в ножках таницитов, реже вдоль латеральных стенок. В α2 таницитах Cx43 наблюдался в основном вдоль латеральных стенок и в ножках клеток, в β таницитах единичные гранулы встречались вдоль латеральных стенок, дистальных отделах отростков и ножках этих клеток. В настоящем исследовании видимых различий в локализации и плотности Cx43+ гранул в ходе постнатального развития и при старении выявлено не было. Щелевые контакты в таницитах были показаны как in vivo, так и in vitro (на клеточных культурах β1 таницитов). Долгое время, считалось, что Cx43 встречается только в α1 таницитах, и вопрос функционального значения щелевых контактов именно в этих клетках оставался открытым (Rodriguez et al., 2010). В исследовании, проведенном на клеточных культурах таницитов, было показано, что Cx43 участвует в высвобождении ATP в межклеточное пространство в ответ на введение глюкозы, где ATP в свою очередь, связываясь с P2Y1 рецепторами, опосредует внутриклеточный Ca-сигналинг в таницитах (Orellana et al., 2012). Таким образом, Орелана и соавт. продемонстрировали, что танициты чувствительны к изменениям концентрации глюкозы в СМЖ, и установили возможный механизм ответа таницитов (с участием Cx43) на данное изменение. В исследовании Силвасы-Сабо и соавт. было показано распределение Cx43 в таницитах взрослых мышей схожее с тем, что было получено в данном исследовании (Szilvasy-Szabo et al., 2017). Предполагается, что посредством щелевых контактов танициты взаимодействуют друг с другом и могут обмениваться информацией для координации их функций, например, для обеспечения импульсного высвобождения тропных гормонов гипофиза в портальное кровообращение (Yin, Gore, 2010; Szilvasy-Szabo et al., 2017). Интересной особенностью таницитов является присутствие Cx43 в апикальной части клеток, где клетки не могут образовывать щелевых контактов. Считается, что в данном случае формируются гемиканалы, которые могут служить для транспорта малых молекул между CSF и цитоплазмой таницитов, таким образом обеспечивая контроль состава CSF. Также Cx43 был обнаружен в ножках таницитов, которыми они оплетают кровеносные сосуды. Предполагается, что это позволяет таницитам осуществлять мониторинг состава крови. Кроме того, наличие гемиканалов на апикальной и базальной частях клетки указывает на возможность двунаправленного регулируемого транспорта веществ между CSF и кровью (Szilvasy-Szabo et al., 2017).
Таким образом, было установлено, что в ходе постнатального развития и при старении танициты претерпевают ряд цитохимических и структурных изменений. В первую неделю развития выстилка дня третьего желудочка характеризуется процессами дифференцировки таницитов: 1) область α1 таницитов и эпенидмоцитов характеризуется синтезом GS, что не характерно для этих клеток на более поздних стадиях развития; 2) GFAP наблюдается в отдельных α и β1 таницитах, в то время как с 30 суток постнатального развития этот белок промежуточных филаментов присутствует во всех субпопуляциях таницитов. В течение первого месяца постнатального развития происходит окончательное установление профиля синтеза белков, характерных для взрослых животных. При старении, несмотря на то, что не меняется цитохимический профиль, происходит реорганизация отростков таницитов, что проявляется в том, что танициты не образуют пучков, а их отростки разветвляются в проксимальных отделах и становятся извилистыми. Дальнейшее изучение таницитов необходимо для установления роли этих клеток в физиологических и патофизиологических процессах функционирования медиабазального гипоталамуса и сможет пролить свет на многие аспекты молекулярной организации созревания и функционирования барьерных структур головного мозга.
Исследование выполнено при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-315-00134).
Список литературы
Коржевский Д.Э., Кирик О.В., Карпенко М.Н. и др. Теоретические основы и практическое применение методов иммуногистохимии: руководство / Под ред. Коржевского Д.Э. СПб.: СпецЛит, 2012. 110 с.
Коржевский Д.Э., Гилерович Е.Г., Кирик О.В. и др. Иммуногистохимическое исследование головного мозга / Под ред. Коржевского Д.Э. СПб.: СпецЛит, 2016. 143 с.
Минин А.А., Молдавер М.В. Виментиновые промежуточные филаменты и их роль во внутриклеточном распределении органелл // Успехи биологической химии. 2008. Т. 48. С. 221–252.
Угрюмов М.В., Чандрасекхар К. Электронно-микроскопическое исследование дифференцировки таницитов у крыс в перинатальный период // Онтогенез. 1980. Т. 11. № 4. С. 351–358.
Akimoto J., Itoh H., Miwa T. et al. Immunohistochemical study of glutamine synthetase expression in early glial development // Brain Res. Dev. Brain Res. 1993. V. 72. № 1. P. 9–14.
Bruni J.E., Clattenburg R.E., Millar E. Tanycyte ependymal cells in the third ventricle of young and adult rats: a Golgi study // Anat. Anz. 1983. V. 153. № 1. P. 53–68.
Bolborea M., Dale N. Hypothalamic tanycytes: potential roles in the control of feeding and energy balance // Trends in Neurosciences. 2013. V. 36. № 2. P. 91–100.
Horstmann E. Die Faserglia des Selachiergehirns // Z. Zellforsch. 1954. V. 39. P. 588–617.
Kolos E.A., Korzhevskii D.E. Glutamine synthetase – containing cells of the dorsal root ganglion at different stages of rat ontogeny // Russ. J. Dev. Biol. 2018. V. 49. № 3. P. 179–183.
Koopman A.C.M., Taziaux M., Bakker J. Age-related changes in the morphology of tanycytes in the human female infundibular nucleus/median eminence // J. Neuroendocrinol. 2017. V. 29. P. 1–9.
Lowery J., Kuczmarski E.R., Herrman H. et al. Intermediate filaments play a pivotal role in regulating cell architecture and function // J. Biol. Chem. 2015. V. 290. № 28. P. 17145–17153.
Monroe B.G., Paull W.K. Ultrastructural changes in the hypothalamus during development and hypothalamic activity: The median eminence // Prog. Brain Res. 1974. V. 41. P. 185–208.
Nilaweera K., Herwig A., Bolborea M. et al. Photoperiodic regulation of glycogen metabolism, glycolysis, and glutamine synthesis in tanycytes of the siberian hamster suggests novel roles of tanycytes in hypothalamic function // Glia. 2011. V. 59. № 11. P. 1695–1705.
Orellana J.A., Sáez P.J., Cortés-Campos C. et al. Glucose increases intracellular free Ca(2+) in tanycytes via ATP released through connexin 43 hemichannels // Glia. 2012. V. 60. № 1. P. 53–68.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates, 6th ed. New York: Elsevier/Academic Press. 2007. 456 p.
Rizzoti K., Lovell-Bodge R. Pivotal role of median eminence tanycytes for hypothalamic function and neurogenesis // Mol. Cell. Endocrinol. 2017. V. 445. P. 7–13.
Rodríguez E.M., Blázquez J.L., Pastor F.E. et al. Hypothalamic tanycytes: a key component of brain-endocrine interaction // Int. Rev. Cytol. 2005. V. 247. P. 89–164.
Rodríguez E.M., Blázquez J.L., Guerra M. The design of barriers in the hypothalamus allows the median eminence and the arcuate nucleus to enjoy private milieus: the former opens to the portal blood and the latter to the cerebrospinal fluid // Peptides. 2010. V. 31. № 4. P. 757–776.
Schulz R., Görge P.M., Görbe A. et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection // Pharmacol. Ther. 2015. V. 53. P. 90–106.
Suarez I., Bodega G., Fernandez B. Glutamine synthetase in brain: effect of ammonia // Neurochem. Int. 2002. V. 41. P. 123–142.
Szilvásy-Szabó A., Varga E., Beliczai Z. et al. Localization of connexin 43 gap junctions and hemichannels in tanycytes of adult mice // Brain Res. 2017. V. 1673. P. 64–71.
Yin W., Gore A.C. The hypothalamic median eminence and its role in reproductive aging // Ann. N.Y. Acad. Sci. 2010. V. 1204. P. 113–122.
Zoli M., Ferraguti F., Frasoldati A. et al. Age-related alterations in tanycytes of the mediobasal hypothalamus of the male rat // Neurobiology of Aging. 1995. V. 16. № 1. P. 77–83.
Дополнительные материалы отсутствуют.


