Онтогенез, 2019, T. 50, № 3, стр. 194-204
Начальные стадии эмбриогенеза Liparis parviflora (Orchidaceae)
Г. Л. Коломейцева a, А. С. Рябченко a, *, А. В. Бабоша a
a Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, ул. Ботаническая д. 4, Россия
* E-mail: marchellos@yandex.ru
Поступила в редакцию 05.05.2018
После доработки 17.09.2018
Принята к публикации 04.10.2018
Аннотация
Исследован эмбриогенез Liparis parviflora, одного из представителей трибы Malaxideae (Orchidaceae). Обсуждена поливариантность первых клеточных делений зародышей у разных видов и родов внутри трибы Malaxideae. Показано, что все клетки собственно зародыша образуются из апикальной (ca) клетки 2-клеточного проэмбрио. Базальная клетка (cb) зародыша на протяжении всего эмбриогенеза не претерпевает делений, суспензор остается одноклеточным, но в процессе развития меняет свою форму, образуя несколько удлиненных лопастей, и элиминирует на поздних стадиях развития зародыша. Таким образом, эмбриональное развитие данного вида, в основном, соответствует описанному нами Dienia-типу. При этом лопастная форма суспензора, обнаруженная у L. parviflora, ранее не была описана ни у одного из представителей трибы Malaxideae.
ВВЕДЕНИЕ
Орхидные (Orchidaceae Juss.) – второе по величине семейство цветковых растений, насчитывающее около 1000 родов и 20 000 видов (Chowdhery, 1998; Chase et al., 2015). Среди особенностей репродуктивной биологии этого семейства отмечена полная или частичная редукция эндосперма, функции которого на ранних этапах развития может выполнять суспензор (подвесок) (Maheshwari, 1950; Поддубная-Арнольди, 1959). Для семейства орхидных экспериментальные работы, доказывающие транспортные или трофические функции суспензора, практические неизвестны. Можно сослаться на работу, посвященную изучению эмбриогенеза Cymbidium sinense, в которой показано отсутствие в оболочке суспензора кутикулярного слоя (Yeung et al., 1996). Трофическая функция суспензоров других цветковых растений экспериментально доказана на примере фасоли (Yeung, 1979; Alpi, 1990). Так, было выявлено, что суспензор Phaseolus coccineus способен синтезировать гиббереллины (Alpi, 1990).
Зародыш орхидей в эмбриогенезе проходит несколько стадий от деления зиготы до образования недифференцированного зародыша, находящегося в семени в состоянии первичного покоя. У многих растений зародыш за это время не только увеличивается за счет многочисленных клеточных делений, но и претерпевает частичную или полную элиминацию части своего тела – суспензора. Дегенерация суспензора происходит через механизм запрограммированной смерти клеток (Raghavan, 2001; Lombardi et al., 2007).
У представителей трибы Malaxideae (подсемейство Epidendroideae), включающей 13 родов, был выявлен особый тип эмбриогенеза – Liparis-тип, характерный для таких близкородственных родов как Crepidium Blume, Malaxis Sol. et Sw., Liparis Rich., Oberonia Lindl. Было высказано предположение, что у родов, входящих в трибу Malaxideae, эмбриогенез близок к наиболее типичному (плезиоморфному) Cypripedioid-типу, за исключением вздутого суспензора (Clements, 1999).
В литературе отображено разнообразие строения суспензоров у разных видов Liparis, в составе которых разные авторы наблюдали от 1 до 6 клеток (Veyret, 1974; Rao, Rao, 1983; Sood, 1992). Однако нами было показано, что у орхидеи Dienia ophrydis (J. Köenig) Ormerod & Seidenf., также принадлежащей к трибе Malaxideae, клетка cb, в дальнейшем дающая начало суспензору, не делится, и, таким образом, суспензор состоит из одной клетки (Kolomeitseva et al., 2017). Очевидно, что решение вопроса о характере эмбриогенеза у представителей данной трибы требует расширение круга изучаемых видов.
Цель работы – изучить эмбриогенез Liparis parviflora (Blume) Lindl., в том числе особенности развития суспензора и элиминации отдельных структур зародышевого мешка.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали растения Liparis parviflora из коллекции ГБС РАН. Изучено 62 плода разной степени зрелости, полученных в 2017 и 2018 гг. от 8 экспериментальных растений. Растения содержали в оранжерее с умеренно теплым температурным режимом (зимняя ночная температура 14–16°С) при относительной влажности воздуха 60–75% и естественной освещенности. Цветение продолжалось с февраля по конец января. Плоды, завязанные посредством самоопыления, фиксировали в 2% параформальдегиде на 0.05 М фосфатном буфере pH 7.4 и хранили до момента использования в холодильной камере при 4°С.
Фиксированные семязачатки окрашивали на предметном стекле в течение 2–3 ч во влажной камере одним из следующих флуоресцентных красителей: водными растворами калькофлуора (1–5 мг/мл, Fluorescent Brighter 28, Sigma-Aldrich, США), берберина (0.01%, Sigma-Aldrich, США), пропидиум йодида (0.05 мг/мл, Sigma-Aldrich, США), прямого желтого (2.5 мг/мл, Direct Yellow, Sigma-Aldrich, США), а также раствором дипиридамола (dipyridamole (2,2',2'',2'''-{(4,8-dipiperidinylpyrimido[5,4-d]pyrimidine-2,6-diyl)dinitrilo}tetraethanol, Sigma, США), 10–12 мг/мл в 5%-ной уксусной кислоте. Аналогичным образом нефиксированные семязачатки окрашивали 2',7'-дихлорфлуоресцеин диацетатом (DCFH, 0.4 мг/мл, Serva, Германия). По окончании инкубации препараты на предметном стекле несколько раз отмывали дистиллированной водой или 50%-ным глицерином (при окраске дипиридамолом), помещали в 50%-ный глицерин, накрывали покровным стеклом и хранили при 4°С до момента использования (обычно 1–2 нед.). Для изучения автофлуоресценции использовали фиксированные неокрашенные препараты, заключенные в 50%-ный глицерин. Всего было изучено 248 препаратов.
Полученные препараты просматривали на конфокальном микроскопе Olympus FV 1000 D при возбуждении фиолетовым лазером 405 нм или с дополнительным освещением лазерами 473 и 560 нм. При исследовании окрашенных препаратов использовали 5–20% мощности соответствующего лазера, при изучении автофлуоресценции интенсивность увеличивали до 50%. Сигнал регистрировали в синем (425–460 нм), зеленом (485–530 нм) и красном (560–660 нм) каналах, что соответствовало стандартным для данного микроскопа установкам ширины каналов флуоресценции для красителей DAPI (4,6-diamidino-2-phenylindole), Alexa fluor 488 и Rhodamine. В работе использовали терминологию клеточных линий (Souèges, 1939), принятую в современной литературе (Шамров, 1997).
РЕЗУЛЬТАТЫ
Согласно нашим исследованиям, зигота L. parviflora делится поперечной перегородкой, в результате чего образуется 2-клеточный проэмбрио (предзародыш), халазальная (апикальная) клетка (ca) которого дает начало собственно зародышу, а микропилярная (базальная) (cb) – суспензору (рис. 1). Образовавшиеся клетки почти одинаковы по размеру, но уже на стадии 2-клеточного зародыша в клетке суспензора образуются довольно крупные вакуоли. На этой стадии сохраняется нуцеллус и при некоторых способах окраски в микропилярной части зародышевого мешка хорошо видна структура, ранее названная нами “петассум” (рис. 1в, 2в) (Kolomeitseva et al., 2017). Он состоит из остатков пыльцевой трубки и нитчатого аппарата синергид и закрывает вход в зародышевый мешок. На рис. 1в петассум виден благодаря желто-коричневой автофлуоресценции, а на рис. 2в при окраске пропидиум йодид флуоресцирует зеленым. Хорошо заметны ядро сохранившейся синергиды (рис. 1а, 1б) и оплодотворенное, но не поделившееся ядро эндосперма (рис. 1).
Рис. 1.
Начальные стадии эмбриогенеза Liparis parviflora: (а) – зародышевый мешок с зиготой (берберин); (б) – первое деление зиготы (берберин); (в) – семязачаток на стадии двуклеточного зародыша (автофлуоресценция); (г) – дериваты ca и cb (прямой желтый). На всех фото микропиле расположено в левом верхнем углу. Сокращения: З – зигота; Э – эндосперм; ВИ –внутренний интегумент; М – микропиле; НИ – наружный интегумент; НЦ – нуцеллус; ПС – петассум; ЯСГ – ядро синергиды; Я – ядро; ca – халазальное ca-производное; cb – микропилярное cb-производное. Масштабный отрезок: 10 мкм.
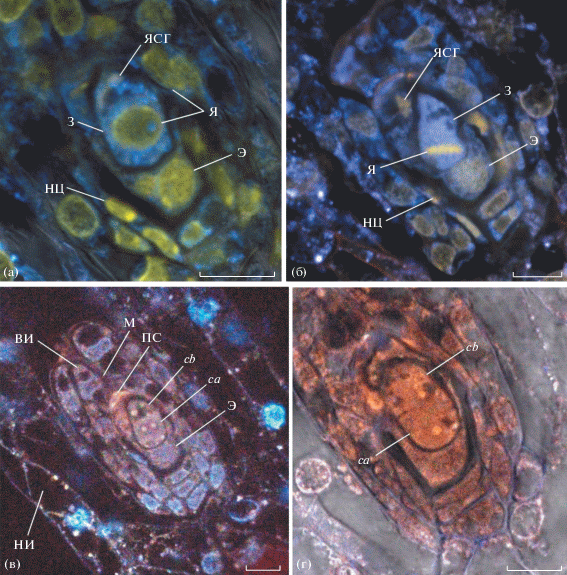
Рис. 2.
Начальные стадии развития зародыша Liparis parviflora: (а) – 3-клеточный зародыш (пропидиум йодид); (б) – общий вид семязачатка на стадии 3-клеточного зародыша (дипиридамол); (в) – 4-клеточный зародыш – стадия тетрады (пропидиум йодид); (г) – 4-клеточный зародыш – стадия тетрады, клетка суспензора с крупным ядром (берберин); (д) – 7-клеточный зародыш (пропидиум йодид); (е) – 7-клеточный зародыш, видна мантия суспензора (берберин). На всех фото микропиле расположено в левом верхнем углу. Сокращения: Э – эндосперм; ВК – вакуоль; ВИ – внутренний интегумент; М – микропиле; НИ – наружный интегумент; МСП – мантия суспензора; ПС – петассум; СЗ – собственно зародыш; ЯСГ – ядро синергиды; ЯСП – ядро суспензора; cb (СП) – микропилярное cb-производное (суспензор); cc – cc-производное, ci – нижняя клетка собственно зародыша; q – ярус; m – m-производное. Масштабный отрезок: 10 мкм.
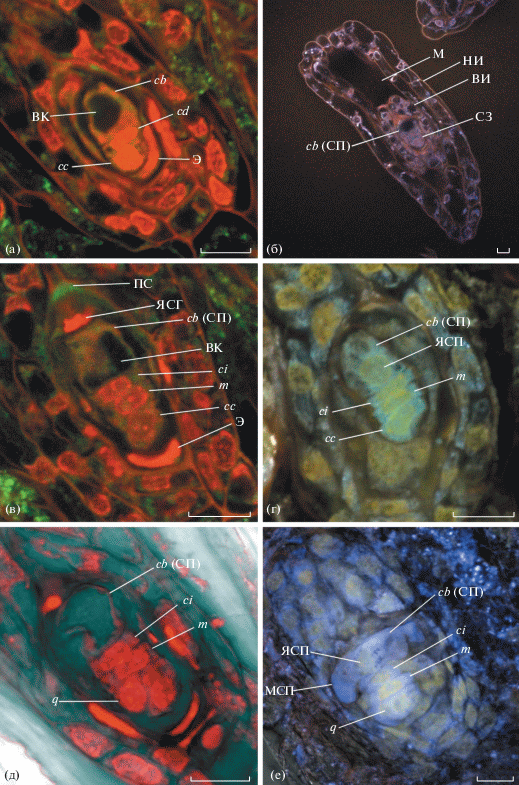
Поскольку клетка cb в дальнейшем не участвует в процессе построения собственно зародыша, обозначения клеточных генераций относятся не к зиготе, а только к апикальной клетке, что соответствует правилам вторичной тетрады С2. При таком варианте развития производные апикальной клетки (верхняя клетка cc и нижняя cd) условно считаются 2-клеточным проэмбрио, при этом клетка cc конструктивно и функционально замещает клетку ca, а клетка cd – клетку cb (Шамров, 1997). При дальнейшем делении клеток индексы присваиваются ярусам с учетом этого условного удаления истинной клетки cb из схемы эмбриогенеза, а производные клетки ca (cc и cd) принимают участие в построении собственно зародыша. Обозначение неделящейся клетки суспензора cb в системах Souèges (1939) и Johansen (1950) в дальнейшем остается без изменений. В итоге формальную схему строения 3-клеточного зародыша L. parviflora можно представить следующим образом: cc + cd + cb, где клетки cc и cd являются производными клетки ca (рис. 2а).
Во время дальнейшего эмбриогенеза L. parviflora клетка cd периклинальной перегородкой делится на m и ci, в результате образуется линейная тетрада (cc + m + ci + cb) (рис. 2в, 2г). Обозначение нижней клетки тетрады cb мы сохранили неизменным для напоминания о происхождении одноклеточного суспензора именно от этой базальной клетки 2-клеточного проэмбрио. На стадии 4-клеточного зародыша вакуоли суспензора сильно увеличиваются в размерах, что иногда приводит к сильной деформации ядра (рис. 2). Нуцеллус на этой стадии также еще сохраняется.
Далее возможны 2 варианта деления клеток до стадии квадрантов – типичный и сокращенный (рис. 8). Наиболее часто 5-клеточный зародыш образуется путем поперечного деления клетки ci с образованием клеток n и n'. В результате образуется 5-клеточный зародыш с формулой (cc + m + + n + n' + cb). Последующее циркумаксиальное деление клетки cc приводит к образованию квадранта. Второй, сокращенный вариант развития зародыша предполагает циркумаксиальное деление клетки cc с образованием квадранта (q + m + + ci + cb) (рис. 2д, 2е).
В результате следующих делений строение зародышей в обоих вариантах становится одинаковым: в первом случае циркумаксиально (двумя вертикальными перегородками) делится клетка cc, образуя слой q из 4-х клеток, которые видны на поперечном срезе. Во втором случае клетка ci делится периклинально, образуя слои n и n'. Итоговую формулу квадранта можно записать следующим образом: q + m + n + n' + cb. Срединные клетки зародыша n и n' и их ядра сильно уплощены (рис. 8).
На этой стадии эмбриогенеза нуцеллус претерпевает частичную деградацию, живыми остаются только клетки в его халазальной части. Их ядра сильно расплющены и иногда имеют неправильную форму. Структуры внутри зародышевого мешка (остатки не разрушенной синергиды, эндосперм) хорошо видны на стадии зиготы, и постепенно элиминируются после образования 5–7-клеточного зародыша. На стадии 3-клеточного зародыша у суспензора образуются 1–2 крупные вакуоли, занимающие более половины объема клетки cb (рис. 2а). Часто эти вакуоли прижимают ядро к клеточной стенке так, что оно деформируется, теряя округлую форму (рис. 2е).
Начиная со стадии 5-клеточного зародыша, вокруг суспензора становится видна тонкая оболочка, которую ранее мы назвали мантией (Kolomeitseva et al., 2017). На начальных стадиях развития форма суспензора, вероятно, определяется ограниченным объемом зародышевого мешка. Суспензор расположен в пространстве между собственно зародышем и микропилярной частью нуцеллуса, он имеет неправильную округло-приплюснутую форму и не разделен на лопасти. После разрушения нуцеллуса суспензор выходит в интегументальное пространство. При этом наблюдается исчезновение петассума. Суспензор разделяется на 3 удлиненные лопасти, равно утолщенные по всей длине (рис. 3). Одни из них выходят наружу за пределы интегументов, другие остаются в пределах наружного интегумента и направлены к халазальному концу семязачатка. Длина лопастей суспензора превышает длину собственно зародыша. Его функции, по-видимому, связаны с получением питательных веществ из клеток внутреннего слоя наружного интегумента. На стадии 10–15-клеточного зародыша происходит почти полная элиминация внутреннего интегумента.
Рис. 3.
Глобулярные стадии развития зародыша Liparis parviflora: (а) – два семязачатка с глобулярными зародышами (берберин); (б) – глобулярный зародыш с суспензором, выходящим за пределы наружного интегумента (берберин); (в) – суспензор выходящий за пределы семенной кожуры (автофлуоресценция); (г) – глобулярный зародыш с 2-лопастным суспензором, выходящим за пределы семенной кожуры (DCFH). На всех фото микропиле расположено в левом верхнем углу. Сокращения: НКЗ – нижняя клетка собственно зародыша; СЗ – собственно зародыш; СП – суспензор; СК – семенная кожура. Масштабный отрезок: 10 мкм.
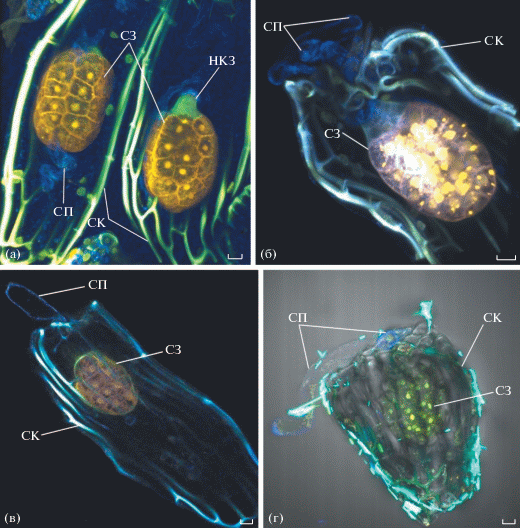
На стадии 20–30-клеточного глобулярного зародыша (рис. 3), клетка суспензора cb теряет свое содержимое, на фотографиях видны только ее слабо флуоресцирующие клеточные стенки.
ОБСУЖДЕНИЕ
Род Liparis Lindl. широко распространен в тропиках, субтропиках и умеренных областях земного шара и включает 320–400 видов (Cribb, 2005; Alrich, Higgins, 2008). L. parviflora (подрод Cestichis, секция Blepharoglossum Schltr.) – симподиально нарастающая наземная или эпифитная орхидея из горных лесов Южной и Юго-Восточной Азии. Псевдобульбы 2-листные, с несколькими быстро отмирающими влагалищными листьями в основании. Соцветия верхушечные, многоцветковые. Цветки мелкие (0.5–0.7 см), широко раскрытые, зеленоватые с широкой красной полосой вдоль центральной жилки губы. Губа двулопастная, несет многочисленные короткие реснички по краям передней лопасти и сильно отогнута назад. Цветки нересупинантные, обычно повернуты губой к цветоносу (Holttum, 1964).
С помощью молекулярно-генетических методов была показана полифилетичность рода Liparis. В результате он был разделен на несколько близкородственных родов – Crepidium Blume, Dienia Lindl., Malaxis Sol. ex Sw., Oberonioides Szlach. и др. (Cameron, 2005).
Попытки классифицировать зародыши орхидей по типу суспензоров предпринимались неоднократно, в середине ХХ века было выделено от 5 (Swamy, 1949) до 13 (Johansen, 1950) типов зародышей. Современные эмбриологические модели Clements (1999) получили названия в соответствии с таксономическим делением семейства орхидных, согласно классификации R. Dressler (1993). Всего было выделено 17 типов эмбриогенеза. По этой классификации наиболее типичным (плезиоморфным) типом эмбриогенеза у орхидных считается Cypripedioid-тип с малоклеточным суспензором базального происхождения (от cb-клетки проэмбрио). В группу орхидей с Cypripedioid-типом эмбриогенеза были, однако, включены не только виды орхидей с малоклеточным (1–2-клеточным) суспензором (Calanthe Veitchii, Paphiopedilum sp., Phaius tankervillae (Banks ex I’Herit) Blume, Spathoglottis plicata Blume) или многоклеточным (3–8-клеточным) суспензором (Arundina graminifolia (D. Don) Hochr., Bulbophyllum oreonastes Rchb. f., Coelogyne parishii Hook. f., Cypripedium cordigerum D. Don), но и виды с зародышами без суспензора (Epipactis Zinn., Epipogium J.G. Gmel. ex Borkh.) (Поддубная-Арнольди, 1976; Ye et al., 1997; Clements, 1999; Sriyot et al., 2015 и др.).
Представители трибы Malaxideae вызывают особый интерес в связи со структурными особенностями их зародышей, которые были описаны ранее и представлены в виде рисунков (Veiret, 1974; Sood, Rao, 1986; Sood, 1992) и фотографий (Kolomeitseva et al., 2017). Вариабельность числа клеток суспензоров у плезиоморфного Cypripedioid-типа эмбриогенеза отразилась на характеристике Liparis-типа с неопределенным числом клеток суспензора у разных родов внутри трибы Malaxideae. Считалось, что Liparis-тип эмбриогенеза можно экстраполировать на весь родовой комплекс трибы Malaxideae (Clements, 1999). Но наши исследования показывают, что это не так. У Liparis pulverulenta Guill., согласно исследованиям Y. Veyret (1974), на стадии октантов суспензор 6-клеточный, причем в его состав входит 2-клеточный гипофизис. В то же время, у других представителей рода L. paradoxa Rchb. f. и L. rostrata Rchb. f. был выявлен 1-клеточный суспензор (Sood, 1989). А у L. viridiflora (Blume) Lindl. суспензор вообще не был обнаружен (Rao, Rao, 1983).
Исследование Y. Veyret (1974) было одним из первых, посвященных эмбриогенезу орхидей из разных таксономических групп, в том числе и из трибы Malaxideae. Было обнаружено, что в эмбриогенезе Liparis pulverulenta во 2-й клеточной генерации тетрады образуются по т-образному типу А2 (рис. 4).
Рис. 4.
Серии деления клеток второй клеточной генерации: А1 – изобилатеральная; А2 – Т-образная; С1 – обратно Т-образная; С2 – линейная (по: Veyret, 1974). Микропилярный полюс внизу.
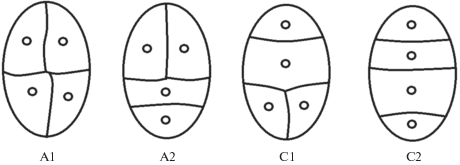
Всего по данным Y. Veyret (1974), применившей классификацию Souéges (1934, 1939) к зародышам орхидей, выявлено 4 варианта тетрад (рис. 4): А1 – изобилатеральная, А2 – T-образная, С1 – обратно T-образная, С2 – линейная. Конфигурация А считается более примитивной по сравнению с конфигурацией С, а форма с индексом 1 более примитивна по отношению к форме с индексом 2. Ранее наши исследования показали, что в эмбриогенезе зародыш Dienia ophrydis (триба Malaxideae) развивает 2 варианта тетрад – линейные (С2) и T-образные (А2). Тетрады линейной формы (С2) преобладают над тетрадами T-образной формы (А2) примерно в отношении 10 : 1. С одной стороны, это указывает на прогрессивное положение орхидных в эволюционной системе цветковых растений, но одновременно подтверждает вывод предыдущих авторов о том, что при классификации типов эмбриогенеза нельзя придавать исключительное значение направлению клеточных перегородок в первых клеточных генерациях (Johansen, 1950; Титова, Шамров, 1997).
Согласно исследованиям Y. Veyret (1974), у Liparis pulverulenta в 3-й клеточной генерации (стадия квадрантов) ярус квадрантов представлен 4-мя клетками, производными от са в циркумаксиальной компоновке (рис. 5). Клетка m делится поперек, образуя 2 лежащих одна над другой клетки d и f, причем нижняя из образованных клеток f сильно сужена по сравнению с соседними клетками. Клетка ci делится вдоль так, что этот ярус представлен 2-мя соседними бластомерами. На этой стадии зародыш представлен 8 клетками и включает ярусы ca, d, f, ci.
Рис. 5.
Схема эмбриогенеза Liparis pulverulenta: 1 – вторая клеточная генерация (тетрада); 2 – третья клеточная генерация (стадия квадрантов); 3 – четвертая клеточная генерация (стадия октантов) (по: Veyret, 1974).
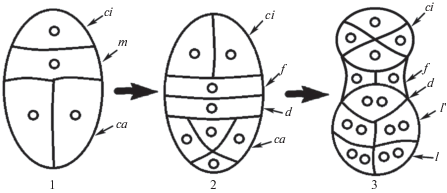
У L. pulverulenta в 4-й клеточной генерации (стадия октантов) верхний и нижний октанты распределяются по 4 в 2 слоя, каждая из клеток d и f делится вертикально, ярус ci формируется из 4 циркумаксиально расположенных клеток. По своему положению на границе между суспензором и собственно зародышем и по происхождению от cb, ярус f является частью суспензора и его можно считать гипофизисом, а ярус d – базальной частью собственно зародыша, также производной от деривата cb. Согласно наблюдениям автора, у L. pulverulenta зародыш на стадии октантов представлен 16 клетками и включает ярусы l, l ', d, f, ci (Veyret, 1974). Такой тип развития зародыша в литературе был описан впервые.
У Malaxis acuminata (Sood, Rao, 1986) (рис. 6), а также у L. paradoxa и L. rostrata (Sood, 1989) (рис. 7) клетка cb 2-клеточного проэмбрио делится поперек, образуя 3-клеточный зародыш (ca + m + ci), затем клетка ca делится продольно, образуя T-образную тетраду. После поперечного деления клетки ci образуется 5-клеточный зародыш (ca + + m + n + n'). В 3-й клеточной генерации путем продольного деления одной из клеток слоя ca образуется квадрант (q + m + n + n'). Стадия октантов включает продольное деление слоев m и n, а также поперечное деление слоя q. В результате стадия глобулярного зародыша включает следующие ярусы: l + l ' + m + n + n' (Onagrad-тип). Клетка суспензора n' постепенно уменьшается в размерах, но не элиминируется вплоть до стадии зрелого семени, морфологически участвуя в построении собственно зародыша (рис. 6, 7).
Рис. 6.
Схема эмбриогенеза Malaxis acuminata D. Don: 1 – 3-клеточный зародыш 2 – 5-клеточный зародыш, клетка ca делится в продольном направлении; 3 – четвертая клеточная генерация; 4 – стадия октантов (по: Sood, Rao, 1986).
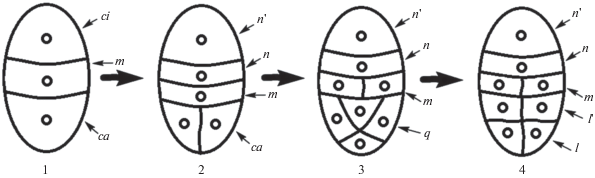
Рис. 7.
Схема эмбриогенеза Liparis paradoxa и L. rostrata: 1 – 2-клеточный зародыш; 2 – 1-е деление клетки cb; 3 – 3-клеточный зародыш; 4 – стадия тетрад, клетка ca делится в продольном направлении; 5 – стадия тетрад, клетка ci делится в поперечном направлении; 6 – 5-клеточный зародыш; 7 – стадия квадрантов (по: Sood, 1989).
Наши исследования эмбриогенеза L. parviflora показали существенные отличия от эмбриогенеза L. pulverulenta (Veyret, 1974), L. paradoxa и L. rostrata (Sood, 1989), хотя все эти виды входят в один род.
Прежде всего, у исследованных другими авторами видов рода Liparis тип эмбриогенеза рассматривается в пределах серии 1-го периода, когда клетка cb неоднократно делится и участвует в построении тела собственно зародыша. В нашем исследовании эмбриогенеза L. parviflora показано, что клетка cb не участвует в построении собственно зародыша, поэтому нумерация клеток проходит по закону серии 2-го периода.
Во-вторых, у исследованных ранее видов рода Liparis во второй клеточной генерации T-образная тетрада образуется по эмбриональному типу А2, а у L. parviflora большая часть тетрад развивается по линейному типу С2. Деление апикальной клетки тетрады (ca) у L. pulverulenta происходит в продольном направлении, деление апикальной клетки тетрады (cс) у L. parviflora – чаще в поперечном направлении.
Выявленное нами у L. parviflora отсутствие деления клетки cb на всем протяжении эмбриогенеза не согласуется с наблюдениями других авторов (Veyret, 1974; Sood, Rao, 1986; Sood, 1989) о том, что производными клетки cb являются не только клетки суспензора, но и базальные клетки собственно зародыша. Сравнение рисунков из работы Veyret (1974) (рис. 5) и наших фотографий (рис. 1, 2) позволяет предположить, что 1- или 2-клеточный гипофизис по Veyret соответствует описанному нами ранее у Dienia ophrydis соединительному рукаву – фитингу одноклеточного суспензора (Kolomeitseva et al., 2017).
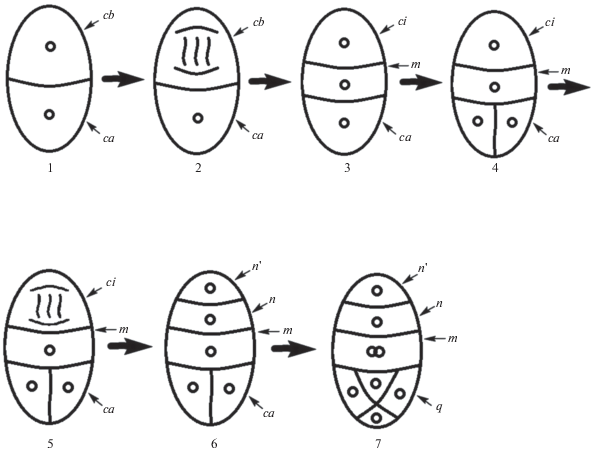
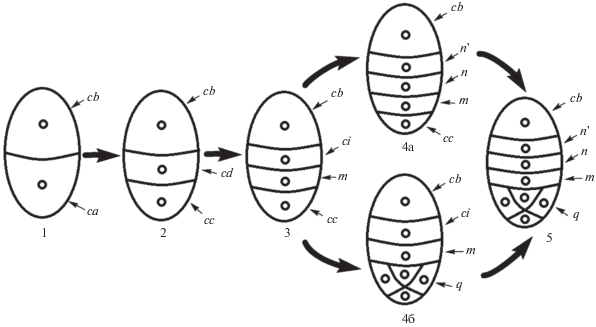
Рис. 8.
Схема эмбриогенеза Liparis parviflora. 1 – 2-клеточный зародыш; 2 – 1-е деление клетки ca; 3 – стадия тетрад, клетка cd делится в поперечном направлении; 4а – клетка ci делится в поперечном направлении; 4б – клетка сс делится циркумаксиально с образованием q-слоя; 5 – стадия квадрантов.
В другой работе, посвященной изучению эмбриогенеза Liparis paradoxa и L. rostrata, показано, что слой ci делится не вдоль, а поперек, продуцируя слои n и n', которые в дальнейшем не подвергаются делению (Sood, 1989). У этих видов собственно зародыш на стадии октантов включает дериваты l, l ', m, n, n', то есть развивается по Onagrad-типу.
Согласно нашим исследованиям, эмбриогенез L. parviflora сходен с эибриогенезом Dienia ophrydis, который ранее мы отнесли к особому Dienia-типу (Kolomeitseva et al., 2017). Он характеризуется производным от cb-деривата одноклеточным суспензором и отсутствием гипофизиса. Клетка суспензора cb у обоих видов в течение всего эмбриогенеза не делится ни в продольном, ни в поперечном направлениях. На стадии октантов схема эмбриогенеза выглядит следующим образом: q + + m + n + n' + cb (рис. 8). После отмирания суспензора в теле собственно зародыша не остается ни одной клетки, производной от cb-деривата, то есть инициали первичного корня полностью отсутствуют. Начиная со стадии квадрантов суспензор снаружи окружен особой мантией, которая становится хорошо заметна с помощью конфокального микроскопа. На ранних стадиях развития клетка суспензора содержит крупные вакуоли, что отличает ее от других клеток, кроме нижней клетки собственно зародыша. Суспензор начинает отмирать одновременно с отмиранием живых клеток наружного интегумента.
Основные различия между видами касаются размеров и формы суспензора. Более или менее цельную форму суспензор Liparis parviflora имеет только на ранних стадиях развития. Однако даже тогда она далека от округлой. Вероятно, это обусловлено менее развитой у L. parviflora мантией и, соответственно, большей эластичностью его клеточной стенки. По-видимому, форма одноклеточного суспензора на стадии квадрантов определяется формой микропилярной части зародышевого мешка. Другие различия связаны с числом и размерами вакуолей. У L. parviflora суспензор развивает одну или несколько крупных вакуолей, способных увеличиваться в размерах и деформировать форму ядра внутри клетки суспензора.
На поздних стадиях суспензор L. parviflora образует не менее 3-х удлиненных лопастей, часть из которых выходит за пределы интегументов (рис. 3). Ранее подобная форма суспензора не была описана ни у одного из представителей трибы Malaxideae.
Таким образом, эмбриогенез L. parviflora отличается от описанного в литературе эмбриогенеза близкородственных видов L. pulverulenta (Veyret, 1974), L. paradoxa, L. rostrata (Sood, 1989), Malaxis acuminata D. Don (Sood, Rao, 1986), M. saprophyta (King & Pantl.) Tang & Wang (Sood, 1992), и сходен с эмбриогенезом Dienia ophrydis (Kolomeitseva et al., 2017). Согласно нашим исследованиям, у Liparis parviflora на стадии октантов зародыш включает дериваты l, l', m (верхнюю производную от клетки cd), ci (нижнюю производную от клетки cd), cb. Схема эмбриогенеза изученного вида ближе всего к Dienia-типу эмбриогенеза и характеризуется тем, что все клетки собственно зародыша образуются из апикальной (ca) клетки 2-клеточного проэмбрио. Базальная клетка (cb) зародыша на протяжении всего эмбриогенеза не претерпевает делений, суспензор остается одноклеточным, хотя в процессе развития и меняет свою форму.
Работа выполнена в рамках ГЗ ГБС РАН (№ 118 021 490 111-5) на базе УНУ “Фондовая оранжерея”.
Список литературы
Поддубная-Арнольди В.А. Исследование эмбриональных процессов у некоторых орхидей на живом материале / Эмбриологические исследования покрытосеменных. Труды Главного ботанического сада. М.: Изд-во Академии наук СССР, 1959. Т. 6. С. 49–89.
Поддубная-Арнольди В.А. Цитоэмбриология покрытосемянных растений. Основы и перспективы. М.: Наука, 1976. 508 с.
Титова Г.Е., Шамров И.И. Проэмбрио // Эмбриология цветковых растений. Терминология и концепции. 2. Семя / Под ред. Батыгиной Т.Б. СПб: Мир и семья-95, 1997. С. 321–325.
Шамров И.И. Принципы классификации типов эмбриогенеза // Эмбриология цветковых растений. Терминология и концепции. 2. Семя / Под ред. Батыгиной Т.Б. СПб: Мир и семья-95, 1997. С. 493–508.
Alpi A. Gibberellins in embryo development // Plant Grouth Substances. Berlin: Springer-Verlag. 1990. P. 469–475.
Alrich P., Higgins W. The Marie Selby Botanical Gardens illustrated Dictionary of Orchid Genera / Eds Hansen D. et al. Ithaca, London: Cornell Univ. Press, 2008. 482 p.
Cameron K.M. Leave it to the leaves: a molecular phylogenetic study of Malaxideae (Epidendroideae, Orchidaceae) // American J. Botany. 2005. V. 92. P. 1025–1032.
Chase M.W., Cameron K.M., Freudenstein J.V., Pridgeon A.M., Salazar G., Berg C., Schuiteman A. An updated classification of Orchidaceae // Botanical J. Linnean Society, 2015. V. 177. № 2. P. 151–174.
Chowdhery H.J. Orchid Flora of Arunachal Pradesh. Bishen Singh Mahendra Pal Singh, Dehra Dun, India, 1998. 824 p.
Clements M.A. Embryology / Genera Orchidacearum. General Introduction, Apostasioideae, Cypripedioideae / Eds Pridgeon A.M., Cribb J.C., Chase M.W., Rasmussen F.N. New York: Oxford University Press, 1999. V. 1. P. 38–58.
Cribb P.J. Dienia // Genera Orchidacearum. V. 4. Epidendroideae (Part 1) / Eds Pridgeon A.M., Cribb J.C., Chase M.W., Rasmussen F.N. New York: Oxford University Press, 2005. P. 460–462.
Dressler R.L. Phylogeny and Classification of the Orchid Family. Portland, Oregon: Dioscorides Press, 1993. 278 p.
Holttum R.E. Revised Flora of Malaya. V. 1. Orchids of Malaya. Singapure: Government Printing Office, 1964. 759 p.
Johansen D.A. Plant Embryology: Embryogeny of the Spermatophyta. Waltham, Massachusetts: Chronica Botanica Co., 1950. 305 p.
Kolomeitseva G.L., Ryabchenko A.S., Babosha A.V. Features of the embryonic development of Dienia ophrydis (Orchidaceae) // Cell and Tessue Biology. 2017. V. 11. № 4. P. 314–323.
Lombardi L., Ceccarelli N., Piccarelli P., Lorenzi R. DNA degradation during programmed cell death in Phaseolus coccineus suspensor // Plant Physiology and Biochemistry. 2007. V. 45. P. 221–227.
Maheshwari P. An Introduction to the Embryology of Angiosperms. Bombay-New Dehli: McGraw-Hill Book Company, 1950. 452 p.
Raghavan V. Life and times of the suspensor of angiosperm embryos // Phytomorphology Golden Jubilee Issue 2001: Trends in Plant Sciences / Ed. Rangaswamy N.S. International Society of Plant Morphologists, Department of Botany, University of Delhi. Delhi, India, 2001. P. 251–274.
Rao P.R.M., Rao K.M. Embryology of Liparis viridiflora // Acta Botanca Indica. 1983. V. 11. P. 228–234.
Sood S.K. Embryology and systematic position of Liparis (Orchidaceae) // Plant Systematics and Evolution. 1989. V. 166. P. 1–9.
Sood S.K. Embryology of Malaxis saprophyta, with comments on the systematic position of Malaxis (Orchidaceae) // Plant Systematics and Evolution. 1992. V. 179. P. 95–105.
Sood S.K., Rao P.R.M. Gametophytes, embryogeny and pericarp of Microstylis wallichii Lindl. (Orchidaceae) // Bot. Mag. Tokyo. 1986. V. 99. P. 351–359.
Souèges R. L’hypophyse et L’epiphyse: les Problems D’histogenese qui leur sont Lies // Bull. Soc. Bot. France. 1934. V. 81. S. 737–748, 769–778.
Souèges R. Exposes d’embryologie et de Morphologie Vegetales. X. Embryogenie et classification. Deuxieme fascicule: Essai d’un systeme embryogenique (Partie generale) // Act. Sci. Industr. 1939. S. 1–85.
Sriyot N., Thammathaworn A., Theerakulpisut P. Embryology of Spathoglottis plicata Blume: a reinvestigation and additional data // Tropical Natural History. 2015. V. 15. № 2. P. 97–115.
Swamy B.G.L. Embryological studies in the Orchidaceae. 2. Embryology // Amer. Midland Naturalist. 1949. V. 41. P. 202–232.
Veyret Y. Development of the embryo and the young seedling stages of orchids // The Orchids: Scientific Studies / Ed. Withner C.L. New York: John Wiley & Sons, 1974. P. 223–265.
Ye X.L., Zee S.Y., Yeung E.C. Suspensor development in the Nun orchid, Phaius tankervillae // International Journal of Plant Sciences. 1997. V. 158. № 6. P. 704–712.
Yeung E.C., Sussex I.M. Embryogeny of Faseolus coccineus: the suspensor and the growth of the embryo proper in vitro // Z.Pflanzenphysiology. 1979. Bd. 91. S. 423–433.
Yeung E.C., Zee S.Y., Ye X.L. Embryology of Cymbidium sinense: embryo development // Annals of Botany. 1996. T. 78. P. 105–110.
Дополнительные материалы отсутствуют.


