Онтогенез, 2019, T. 50, № 4, стр. 219-227
Апоптоз сперматозоидов и его роль в снижении качества семени
А. Н. Накидкина a, *, Т. И. Кузьмина a, **
a Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал ФГБНУ “Федеральный научный центр животноводства – ВИЖ имени академика Л.К. Эрнста”
196601 Санкт-Петербург – Пушкин, Московское шоссе, 55а, Россия
* E-mail: alena_boiceva@mail.ru
** E-mail: prof.kouzmina@mail.ru
Поступила в редакцию 29.11.2017
После доработки 29.11.2017
Принята к публикации 15.10.2018
Аннотация
Важность целостности ДНК сперматозоидов сложно переоценить: от качества генетического материала в популяции сперматозоидов зависит вероятность успешного оплодотворения, эмбриональное и последующее развитие потомства, а значит – репродуктивный потенциал мужской особи. Апоптоз имеет огромное значение для мужских гамет со времени закладки гонад у эмбриона и вплоть до момента оплодотворения яйцеклетки. Этот механизм программируемой клеточной гибели необходим для создания правильного соотношения между половыми клетками и клетками Сертоли в процессе внутриутробного развития; путем апоптоза из тестикул устраняются поврежденные клетки у взрослой особи, и этот процесс усиливается при ряде неблагоприятных воздействий. Наконец, зрелые сперматозоиды подвергаются апоптозу и последующему фагоцитозу в женских половых путях для избежания воспалительных реакций в результате распада погибших гамет. Неправильное протекание апоптоза может приводить к аномальному развитию мужских гамет, бесплодию, а также к оплодотворению яйцеклетки сперматозоидом с дефектной ДНК и последующей гибелью потомства. Таким образом, апоптоз, как показывают последние исследования, является одной из основных причин фрагментации ДНК сперматозоидов, что становится все более значимой проблемой в условиях широкого применения вспомогательных репродуктивных технологий.
ВВЕДЕНИЕ
Первые публикации, в которых поднимается вопрос значимости апоптоза для процесса сперматогенеза, относятся к концу 80-х – началу 90-х годов прошедшего столетия (Allan et al., 1987; Miething, 1992; Bartke, 1995). Немного позже появились данные, демонстрирующие возможность протекания апоптоза и у зрелых сперматозоидов (Stephan et al., 1996; Maione et al., 1997; Sakkas et al., 1999b), а также участие этого процесса во фрагментации ДНК мужских гамет (Sakkas et al., 1999b). Были и исследования, показавшие отсутствие апоптоза у зрелых сперматозоидов (Weil et al., 1998); также высказывались мнения об апоптозе сперматозоидов, как о последствии незавершенного сперматогенеза (Sakkas et al., 1999a). Тем не менее, сегодня факт наличия механизма апоптоза у созревающих и зрелых сперматозоидов, а также его значимость для сперматогенеза и постэякуляционных процессов широко принята научным сообществом (Grunewald et al., 2001, 2009; Paasch et al., 2003; Oosterhuis and Vermes, 2004; Taylor et al., 2004; Martin et al., 2007; Bejarano et al., 2008; Ortega-Ferrusola et al., 2008; Aitken, 2011; Shukla et al., 2012; Aitken et al., 2013; Dogan et al., 2013).
Как известно, апоптоз соматических клеток может протекать по 2 путям – наружному, или рецептор-зависимому, и внутреннему, или митохондриальному. Внешний путь апоптоза активируется через рецепторы фактора некроза опухоли, которые распознают и связывают соответствующие цитокины, такие как TRAIL (TNF-related apoptosis-inducing ligand) и FASL (Fas ligand). Это приводит к кластеризации ФНО-рецепторов и последующей активации FADD (Fas-associated protein with death domain) и каспаз 8 или 10, что в совокупности представляет собой сигнальный комплекс индукции клеточной гибели (Aitken, 2011). Внутренний путь апоптоза является собственной программой гибели клетки при нарушениях клеточного гомеостаза, и регулируется взаимодействием про- и анти-апоптотических белков, относящихся к семейству регуляторов апоптоза BCL-2 (B-cell lymphoma 2) (Youle, Strasser, 2008). Для запуска апоптоза по внутреннему пути необходимо высвобождение митохондриями цитохрома С и других апоптогенных факторов, что происходит в результате повышения проницаемости наружной мембраны этого органоида. За указанный процесс отвечают про-апоптотические белки BAX, BAK1 (BAK), а также, возможно, BOK, которые, в свою очередь, могут быть активированы про-апоптотическими белками семейства BH3, такими как BCL2L11 (BIM), BBC3 (PUMA), BID, BAD, BMF, BIK, HRK и PMAIP1 (NOXA) (Aitken, 2011). Высвобожденный цитохром С участвует в образовании апоптосомы, а также нарушает работу электрон-транспортной цепи (ЭТЦ) митохондрий, смещая нормальное 4-электронное восстановление кислорода в сторону одноэлектронного, что приводит к образованию супероксида вместо воды (Cai, Jones, 1998; Kushnareva et al., 2002). Апоптосома, в свою очередь, активирует каспазу 9 с последующей активацией эффекторных каспаз 3 и 7 – запускается каспазный каскад. Впоследствии происходит экстернализация фосфатидилсерина на поверхности цитоплазматической мембраны – сигнал для “тихого” поглощения гибнущих клеток макрофагами, что является главным отличием программируемой клеточной гибели от некроза (Dogan et al., 2013).
Рис. 1.
Схема индукции капацитации и апоптоза в сперматозоидах млекопитающих. Примечание: NO – оксид азота (II); ${\text{O}}_{2}^{\centerdot }$ – супероксидный анион; ONOO– – пероксинитрит; ЭТЦ – электронтранспортная цепь митохондрий; ${\text{OH}}\centerdot $ – гидроксильный радикал; H2O2 – пероксид водорода.
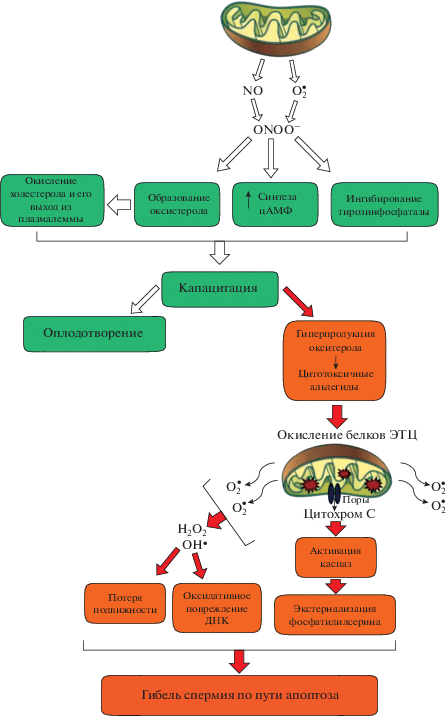
Мужские гаметы в процессе своего развития могут подвергаться апоптозу, как и соматические. Как и у соматических клеток, необходимость его протекания в процессе сперматогенеза определяется потребностью в регуляции числа клеток, устранении клеток с поврежденной ДНК и с другими нарушениями клеточного гомеостаза. Присутствие апоптотических сперматозоидов в эякуляте может иметь различные причины: попадание в женский репродуктивный тракт незрелых и дефектных клеток и необходимость их “тихого” поглощения макрофагами (Mendoza et al., 2013; Aitken et al., 2011), феномен абортивного тестикулярного апоптоза для удаления аномальных форм спермиев (Sakkas et al., 2004), а также различные патологии (Oehninger, 2003; Mendoza et al., 2013). В данном обзоре будут рассмотрены роль и особенности протекания апоптоза мужских половых клеток, а также практическое значение данного процесса для криоконсервации и определения качества спермы.
АПОПТОЗ В ПРОЦЕССЕ СПЕРМАТОГЕНЕЗА
Апоптоз, как известно, играет важную роль в закладке, дифференцировке и жизнеобеспечении половых клеток как женских, так и мужских гонад. Баланс количества сперматогоний и клеток Сертоли в тестикулах достигается именно путем апоптоза “лишних” премейотических половых клеток в периоде эмбриогенеза, а нарушение этого равновесия приводит к бесплодию (Aitken, 2011). Также апоптоз важен и для “контроля качества” созревающих сперматозоидов взрослой особи – поврежденные половые клетки удаляются из семенных канальцев механизмом программируемой гибели. Таким образом предотвращается попадание гамет с поврежденной ДНК в эякулят и обеспечивается безопасность оплодотворения. Апоптоз незрелых сперматозоидов в тестикулах происходит чаще всего на стадии пахитены и контролируется преимущественно системой Fas/FasL (Lin et al., 2010). Получаемые в последние годы данные свидетельствуют, что любое нарушение сперматогенеза может служить фактором, повышающим уровень апоптоза в тестикулах. Например, гормональные нарушения, влияющие на созревание половых клеток (Chimento et al., 2010; Tsounapi et al., 2012), или делеции в генах, ответственных за сперматогенез (Grad et al., 2010; Liu et al., 2010; Kosir et al., 2012), вызывают активацию апоптоза незрелых мужских гамет. В последние годы немало внимания уделяется изучению роли в сперматогенезе различных регуляторов клеточного цикла, и появляются свидетельства их участия в механизме индукции программируемой клеточной гибели незрелых мужских гамет (Tang et al., 2015; Rotgers et al., 2017). Недавно было показано, что ключевую роль в регуляции апоптоза в ходе первой волны сперматогенеза у мыши играет фактор транскрипции E2F1 (Rotgers et al., 2017), а изменение его экспрессии, причем как в сторону уменьшения, так и в сторону увеличения, приводит к нарушениям в процессе сперматогенеза у мыши (Yamasaki et al., 1996; Agger et al., 2005), а также к образованию тестикулярной карциномы in situ – предшественника герминогенного тестикулярного рака – у человека (Novotny et al., 2007).
ОСОБЕННОСТИ ПРОТЕКАНИЯ АПОПТОЗА ЗРЕЛЫХ СПЕРМАТОЗОИДОВ
Апоптоз сперматозоидов на сегодняшний день – плохо изученный процесс, однако ясно, что есть существенные отличия между апоптозом у мужских гамет и у соматических клеток. Свидетельства наличия апоптоза у зрелых сперматозоидов человека одними из первых были приведены Грюневальдом и соавт. (Grunewald et al., 2009). Копперс и соавт. (Koppers et al., 2011) показали, что зрелые сперматозоиды способны активировать внутренний путь апоптоза, характеризующийся гиперпродукцией АФК митохондрионом, экстернализацией фосфатидилсерина, активацией каспазного каскада, вакуолизацией цитоплазмы и оксидативным повреждением ДНК. Авторами также показано наличие у зрелых сперматозоидов функционирующего сигнального пути PI3K (фосфатидилинозитол-3-киназа)/AKT (протеинкиназа B), который действует посредством поддержания про-апоптотического белка BAD (Bcl-2-associated death promoter) в фосфорилированном, анти-апоптозном состоянии. Дефосфорилирование PI3K приводит к инактивации AKT и последующему дефосфорилированию BAD, в результате чего происходит инактивация анти-апоптотических белков Bcl-2 и Bcl-xL, формирование пор в наружной мембране митохондрий и, как следствие, выход цитохрома С в цитозоль. Одним из наиболее ранних событий апоптоза спермиев является гиперпродукция АФК, и, в частности, супероксида, митохондриями клетки и сопутствующая потеря подвижности (Koppers et al., 2011). В результате происходит атака полиненасыщенных жирных кислот спермия свободными радикалами, что приводит к образованию цитотоксичных альдегидов, таких как 4-гидроксиноненал и акролеин (Aitken et al., 2012). Эти пероксиды липидов являются сильными электрофилами, которые связываются с нуклеофильными центрами близкорасположенных белков. Некоторые непосредственные мишени пероксидов – белки-участники ЭТЦ митохондрий, и в результате нарушения работы этих белков происходит “утечка” электронов из ЭТЦ, которые тут же взаимодействуют с кислородом, образуя H2O2 и усиливая перекисное окисление липидов. Таким путем оксидативный стресс, вызванный митохондриями, становится самораспространяющимся процессом, который приводит к гибели клетки по внутреннему пути апоптоза (Aitken et al., 2015). Потеря подвижности, по-видимому, является следствием нехватки АТФ, с одной стороны, а с другой – связывания альдегидов с ключевыми белками аксонемы, такими как тяжелые цепи динеина (Baker et al., 2015). Следующим событием внутреннего пути апоптоза спермиев является активация каспазного каскада и экспрессия фосфатидилсерина на поверхности клетки, который обнаруживается аннексином V. Эти события описаны у сперматозоидов многих видов млекопитающих (Martí et al., 2008; Gallardo Bolaños et al., 2013; Dogan et al., 2013; Krakowski et al., 2013; Kostro et al., 2014; Vasicek et al., 2014; Zeng et al., 2014), и есть все основания полагать, что, как и у соматических клеток, экспрессия фосфатидилсерина является сигналом “тихого” поглощения погибающих спермиев макрофагами, без выброса провоспалительных цитокинов. Здесь начинаются очередные различия между апоптозом соматических клеток и сперматозоидов. Дело в том, что фагоциты начинают поглощать гибнущие спермии задолго до повреждения ДНК нуклеазами, тогда как у соматических клеток на этом этапе происходит активация эндонуклеаз митохондрий и цитоплазмы и транспорт их в ядро для нанесения “последнего удара” – разрезания нитей ДНК. У сперматозоидов же такое невозможно по 2 причинам. Во-первых, ядро спермиев содержит очень мало нуклеосом: большинство из них удаляются из клетки в процессе сперматогенеза. Во-вторых, сперматозоиды отличаются от всех остальных типов клеток тем, что ДНК мужских гамет отделена от митохондрий и цитоплазмы средней части клетки. Таким образом, активированные нуклеазы физически не способны проникнуть в ядро. Более того, вполне возможно, что необходимость защиты хроматина спермия от нуклеаз и стала главным фактором, определившим наблюдаемое сегодня у большинства видов строение сперматозоида (Aitken et al., 2015).
СВЯЗЬ АПОПТОЗА И КАПАЦИТАЦИИ СПЕРМИЕВ
Грюневальдом и соавт. (Grunewald et al., 2009) в 2009 году был сделан вывод о том, что индукция капацитации происходит путем предотвращения апоптоза. Выдвинута гипотеза, согласно которой капацитация и апоптоз являются связанными процессами, объединенными зависимостью от продолжительной выработки АФК внутри клетки (Aitken et al., 2015). Эйткен и соавт. (Aitken et al., 2015) предложили модель, согласно которой при попадании спермиев в женские половые пути, капацитация индуцируется вследствие выработки АФК, которые активируют продукцию цАМФ, ингибируют тирозинфосфатазу и усиливают образование оксистеролов, что предшествует их удалению с поверхности клетки при контакте с альбумином. Продолжительная генерация АФК популяцией сперматозоидов неизбежно приводит к превышению способности этих клеток выдерживать оксидативный стресс. В результате “перекапацитированные” мужские гаметы, не способные защититься от АФК, погибают по внутреннему пути апоптоза, описанному выше. В итоге, сперматозоиды зависят от продукции АФК, необходимых для осуществления капацитации, без которой оплодотворение невозможно. В то же время, такой механизм постэякуляционного созревания хранит в себе смертельную опасность для этих клеток – потому что продукция АФК является и путем индукции апоптоза мужских гамет, а система антиоксидантной защиты зрелых сперматозоидов слаба в сравнении с соматическими клетками. Предложенная модель требует дальнейшего экспериментального подтверждения; однако, имеющиеся на сегодняшний день данные свидетельствуют, что только популяция сперматозоидов, достаточный процент клеток в которой способны успешно балансировать на тонкой грани между капацитацией и апоптозом, сможет успешно оплодотворить яйцеклетку. Схема индукции капацитации и апоптоза зрелых сперматозоидов приведена на рис. 1.
АПОПТОЗ И КРИОКОНСЕРВАЦИЯ СПЕРМЫ
Криоконсервация семени и процесс оттаивания наносят значительный урон сперматозоидам млекопитающих, выражающийся, главным образом, в повреждении мембран и снижении подвижности спермиев (Martin et al., 2007; Paoli et al., 2014). Было показано, что наблюдается значительное повышение уровня апоптоза в оттаявших образцах криоконсервированного семени быков в сравнении с таковым в образцах свежего семени, в результате чего происходит уменьшение процента жизнеспособных клеток (Martin et al., 2004, 2007). Отсюда можно сделать вывод, что в снижении оплодотворяющей способности спермы после оттаивания играет роль не только непосредственное повреждение клеток кристаллами льда, но также и апоптоз, индуцированный в процессе криоконсервации/оттаивания. Действительно, существуют данные, подтверждающие значимость апоптоза в снижении оплодотворяющей способности спермы после криоконсервации (Anzar et al., 2002). Есть также свидетельства, что криоконсервация сперматозоидов ведет не только к гибели клеток, но может вызывать и сублетальные повреждения по механизму апоптоза (Anzar et al., 2002; Pena et al., 2003; Martin et al., 2004; Ortega et al., 2010). Повреждения криоконсервированных сперматозоидов, связанные с апоптозом, часто описываются как “апоптозоподобные признаки” (Martin et al., 2004; Ortega-Ferrusola et al., 2008, 2010); именно эти повреждения приводят к потере подвижности спермиев, что значительно снижает оплодотворяющую способность спермы (Mendoza et al., 2013). Как уже говорилось выше, большинство повреждений ДНК мужских гамет при апоптозе являются окислительно-индуцированными, а немедленного расщепления хроматина, которое имеет место у соматических клеток, здесь не наблюдается. Тем не менее, есть данные, свидетельствующие о росте уровня фрагментации ДНК и экстернализации фосфатидилсерина при охлаждении спермы барана (Del Valle et al., 2010; Mendoza et al., 2013). Причиной “апоптозоподобных признаков”, возникающих при криоконсервации, может быть чувствительность митохондриальной мембраны к повреждениям при низких температурах; изменение текучести мембраны митохондрий может негативно сказаться на мембранном потенциале этого органоида, что, в свою очередь, ведет к гиперпродукции АФК (Said et al., 2010). Известно, что при криоконсервации нарушается работа системы антиоксидантной защиты спермиев (Paoli et al., 2014), и, таким образом, эти клетки становятся еще более восприимчивы к окислительному стрессу (Lasso et al., 1994; Paoli et al., 2014). Проводились исследования возможности снижения оксидативных повреждений при добавлении in vitro различных антиоксидантов. Было показано, что добавляемые в процессе криоконсервации витамин Е (Taylor et al., 2009), аскорбат и каталаза (Li et al., 2010) способны снизить уровень АФК сперматозоидов и повысить их подвижность, хотя эти соединения и не имеют положительного эффекта на целостность ДНК. В то же время, ресвератрол и аскорбиновая кислота продемонстрировали способность снижать уровень повреждений ДНК, причем ресвератрол – как у фертильных, так и у бесплодных мужчин, а аскорбиновая кислота – только у бесплодных; однако, оба эти антиоксиданта оказались не способны предотвратить потерю спермиями подвижности после оттаивания (Branco et al., 2010). Помимо антиоксидантов, криопротекторные свойства продемонстрировали соединения кремния, а именно высокодисперсный кремнезем (ВДК) и его модификации (Чуйко, 2003; Настасієнко и др., 2010). Нами получены данные, что положительное влияние ВДК (А-300) обусловлено его способностью снижать уровень апоптоза в популяции сперматозоидов быка (Бойцева и др., 2017), а также стимулировать капацитацию (Бойцева и др., 2015). Мы предполагаем, что такой эффект обусловлен воздействием данного соединения на продукцию АФК и систему антиоксидантной защиты клетки.
“Апоптозоподобные признаки”, упомянутые ранее, включают сниженный мембранный потенциал митохондрий, изменения каспазной активности, экстернализацию фосфатидилсерина, а также повышение проницаемости цитоплазматической мембраны спермиев, что показано у быка и коня (Martin et al., 2004; Ortega-Ferrusola et al., 2008, 2010). Существуют данные, свидетельствующие о наличии аналогичных признаков и при криоконсервации спермы человека (Duru et al., 2001; Paasch et al., 2004). Считается, что активация каспаз при криоконсервации протекает по механизму, связанному с экстернализацией фосфатидилсерина (Paoli et al., 2014). Тем не менее, было показано, что у человека активация каспаз 3, 8 и 9, а также снижение мембранного потенциала митохондрий при криоконсервации не ведут к достоверному повышению уровня фрагментации ДНК (Paasch et al., 2004). Исследования Томсона и соавт. (Thomson et al., 2009) свидетельствуют, что фрагментация ДНК при криоконсервации спермы человека в большей степени связана с окислительными повреждениями, нежели с индукцией апоптоза, что, по-видимому, объясняется особенностями строения зрелых спермиев (см. выше). Интересным является тот факт, что в этих исследованиях была показана негативная корреляция между количеством клеток с активированными каспазами и уровнем фрагментации ДНК в популяции криоконсервированных сперматозоидов. Такие результаты говорят о том, что фрагментация ДНК при криоконсервации происходит независимо от индукции апоптоза и, вероятно, не в апоптотических спермиях. Таким образом, можно заключить, что индукция апоптоза в криоконсервированных сперматозоидах является вторичным процессом, следующим за оксидативным стрессом, вызванным повреждениями мембран клеток и нарушениями работы системы антиоксидантной защиты мужских гамет.
АПОПТОЗ, КАК БИОМАРКЕР КАЧЕСТВА СПЕРМЫ
Если процессы, связанные с апоптозом, происходят в любом эякуляте по одному механизму, значит их можно использовать для оценки качества семени. Как уже было сказано, большая часть повреждений ДНК при апоптозе являются окислительно-индуцированными, так как единственным продуктом апоптоза, способным проникнуть в ядро сперматозоида, является H2O2. Де Йюлис и соавт. (De Iuliis et al., 2009) продемонстрировали корелляцию между уровнем 8-гидрокси-2'-дезоксигуанозина – продукта окисления – и нарушением репрограммирования хроматина, а также фрагментацией ДНК, таким образом показав эффективность 8-гидрокси-2'-дезоксигуанозина, как биомаркера качества спермы. Также существуют специфические пробы на АФК, производимые митохондриями (мАФК), при повышенном уровне которых происходит перекисное окисление мембран и потеря подвижности (Aitken et al., 2012; Amaral et al., 2013). Не стоит также забывать и про специфический маркер апоптоза – витальное окрашивание Аннексина V. Окрашивание аллофикоцианином-аннексином V совместно с маркерами жизнеспособности (Sytox и Hoechst 33342) показало, что у пациентов с нормозооспермией процент живых интактных клеток выше (Varum et al., 2007). Также есть корелляция с подвижностью спермиев: наибольший процент клеток с экстернализованным фосфатидилсерином наблюдается в образцах с более высоким содержанием низкоподвижных фракций спермы (Weng et al., 2002). Снижение мембранного потенциала митохондрий, также как и присутствие активированных каспаз, которое говорит о протекании последних стадий апоптоза, также являются признаками неудовлетворительного качества спермы и низкой способности к оплодотворению (Weng et al., 2002; Kotwicka et al., 2008). Стоит также заметить, что апоптоз в эякулированном семени часто является результатом процессов, начавшихся еще во время сперматогенеза, и, таким образом, может быть признаком низкой фертильности или стерильности индивида (Aitken et al., 2011; Amaral et al., 2013).
ЗАКЛЮЧЕНИЕ
Имеющиеся на сегодняшний день данные свидетельствуют, что процессы, связанные с апоптозом (снижение митохондриального потенциала, активация каспаз, экстернализация фосфатидилсерина и др.), целиком и полностью зависят от состояния митохондриона мужских гамет и контролируются им как активно (индукция апоптоза для предотвращения оплодотворения яйцеклетки спермием с дефектной ДНК), так и пассивно (при необратимых повреждениях митохондриона). Роль этого органоида для зрелого сперматозоида поистине огромна и не ограничивается только продукцией АТФ: митохондрион осуществляет регулируемую генерацию АФК (митохондриальные АФК – мАФК), что необходимо для индукции капацитации (Amaral et al., 2013; Aitken, 2017), а также участвует в кальциевой сигнализации (Correia et al., 2015) и, возможно, даже в передаче эпигенетической информации (Amaral et al., 2013), что уже показано для других типов клеток (Lu, Thompson, 2012). Все это говорит о том, что апоптоз сперматозоидов является частью сложной системы регуляции жизнедеятельности сперматозоида, имеющей своей целью обеспечить безопасность оплодотворения и гарантировать передачу лучшего генетического материала потомству. Апоптоз, таким образом, является механизмом “естественного” повышения качества семени, и его чрезмерный уровень может говорить о значительных проблемах репродуктивной системы индивида, либо о влиянии экстремальных внешних или внутренних факторов среды и организма. Сложная взаимосвязь механизмов капацитации и апоптоза требует углубленных исследований, однако несомненным является тот факт, что оба эти процесса критически зависят от продукции АФК, что делает окислительный стресс клинически значимым явлением. В дальнейшем необходимо более углубленно изучить роль митохондрий в жизнедеятельности зрелого сперматозоида, что необходимо для лучшего понимания причин гиперпродукции АФК этим органоидом и индукции апоптоза, и, в дальнейшем, совершенствования методик вспомогательных репродуктивных технологий и криоконсервации семени.
Работа выполнена по государственному заданию Министерства образования Российской Федерации в соответствии с темой № АААА-А18-118021590132-9 (рег. ЦИТиС).
Список литературы
Бойцева Е.Н., Денисенко В.Ю., Кузьмина Т.И. Оценка показателей постэякуляционного созревания сперматозоидов Bos taurus хлортетрациклиновым тестом // Онтогенез. 2015. Т. 46. № 6. С. 362–367.
Бойцева Е.Н., Бычкова Н.В., Кузьмина Т.И. Влияние наночастиц высокодисперсного кремнезема на апоптоз сперматозоидов Bos taurus // Цитология. 2017. Т. 59. № 5. С. 375–380.
Настасієнко Н.С., Кузема П.О., Галаган Н.П. и др. Дослідження біологічної активності кремнеземів, модифікованих ди- та триметилсілільними групами і сорбітом, по відношенню до сперматозоїдів биків методом фотон-кореляційної спектроскопії // Фізика живого. 2010. Т. 18. № 3. С. 99–106.
Медицинская химия и клиническое применение диоксида кремния / Под ред. Чуйко А.А. Киев: Наукова думка, 2003. 417 с.
Agger K., Santoni-Rugiu E., Holmberg C. et al. Conditional E2F1 activation in transgenic mice causes testicular atrophy and dysplasia mimicking human CIS // Oncogene. 2005. V. 24. P. 780–789.
Aitken R.J. The capacitation-apoptosis highway: oxysterols and mammalian sperm function // Biol. Reprod. 2011. V. 85. P. 9–12.
Aitken R.J. Reactive oxygen species as mediators of sperm capacitation and pathological damage // Mol. Reprod. Dev. 2017. V. 84. № 10. P. 1039–1052.
Aitken R.J., Baker M.A., Nixon B. Are sperm capacitation and apoptosis the opposite ends of a continuum driven by oxidative stress? // Asian J. Androl. 2015. V. 17. P. 633–639.
Aitken R.J., Findlay J.K., Hutt K.J. et al. Apoptosis in the germ line // Reproduction. 2011. V. 141. P. 139–150.
Aitken R.J., Koppers A.J. Apoptosis and DNA damage in human spermatozoa // Asian J. Androl. 2011. V. 13. P. 36–42.
Aitken R.J., Whiting S., De Iuliis G.N. et al. Electrophilic aldehydes generated by sperm metabolism activate mitochondrial reactive oxygen species generation and apoptosis by targeting succinate dehydrogenase // J. Biol. Chem. 2012. V. 287. P. 33048–33060.
Allan D.J., Harmon B.V., Kerr J.F.R. Cell death in spermatogenesis // Perspectives on Mammalian Cell Death. London. Oxford Univ. Press. 1987. P. 229–258.
Amaral A., Lourenço B., Marques M. et al. Mitochondria functionality and sperm quality // Reproduction. 2013. V. 146. № 5. P. 163–174.
Anzar M., He L., Buhr M.M. et al. Sperm apoptosis in fresh and cryopreserved bull semen detected by flow cytometry and its relationship with fertility // Biol. Reprod. 2002. V. 66. P. 354–360.
Baker M.A., Weinberg A., Hetherington L. et al. Defining the mechanisms by which the reactive oxygen species by‑product, 4‑hydroxynonenal, affects human sperm cell function // Biol. Reprod. 2015. V. 92. № 4. P. 108.
Bartke A. Apoptosis of male germ cells, a generalized or a cell type-specific phenomenon? // Endocrinology. 1995. V. 136. № 1. P. 3–4.
Bejarano I., Lozano G.M., Ortiz A. et al. Caspase 3 activation in human spermatozoa in response to hydrogen peroxide and progesterone // Fertil. Steril. 2008. V. 90. P. 1340–1347.
Branco C.S., Garcez M.E., Pasqualotto F.F. et al. Resveratrol and ascorbic acid prevent DNA damage induced by cryopreservation in human semen // Cryobiology. 2010. V. 60. № 2. P. 235–237.
Cai J., Jones D.P. Superoxide in apoptosis. Mitochondrial generation triggered by cytochrome C loss // J. Biol. Chem. 1998. V. 273. P. 11401–11404.
Chimento A., Sirianni R., Delalande C. et al. 17 beta-estradiol activates rapid signaling pathways involved in rat pachytene spermatocytes apoptosis through GPR30 and ER alpha // Mol. Cell Endocrinol. 2010. V. 320. P. 136–144.
Correia J., Michelangeli F., Publicover S. Regulation and roles of Ca2+ stores in human sperm // Reproduction. 2015. V. 150. № 2. P. R65–R76.
De Iuliis G.N., Thomson L.K., Mitchell L.A. et al. DNA damage in human spermatozoa is highly correlated with the efficiency of chromatin remodeling and the formation of 8‑hydroxy‑2'‑deoxyguanosine, a marker of oxidative stress // Biol. Reprod. 2009. V. 81. P. 517–524.
Del Valle I., Mendoza N., Casao A. et al. Significance of non-conventional parameters in the evaluation of cooling-induced damage to ram spermatozoa diluted in three different media // Reprod. Domest. Anim. 2010. V. 45. P. e260–e268.
Dogan S., Mason M.C., Govindaraju A. et al. Interrelationships between apoptosis and fertility in bull sperm // J. Reprod. Dev. 2013. V. 59. № 1. P. 18–26.
Gallardo Bolaños J.M., Miró Morán Á., Balao da Silva C.M. et al. Autophagy and apoptosis have a role in the survival or death of stallion spermatozoa during conservation in refrigeration // PLoS One. 2012. V. 7. № 1. P. e30688.
Grad. I., Cederroth C.R., Walicki J. et al. The molecular chaperone Hsp90ais required for meiotic progression of spermatocytes beyond pachytene in the mouse // PLoS One. 2010. V. 5. № 12. P. e15770.
Grunewald S., Kriegel C., Baumann T. et al. Interactions between apoptotic signal transduction and capacitation in human spermatozoa // Hum. Reprod. 2009. V. 24. № 9. P. 2071–2078.
Koppers A.J., Mitchell L.A., Wang P. et al. Phosphoinositide 3‑kinase signalling pathway involvement in a truncated apoptotic cascade associated with motility loss and oxidative DNA damage in human spermatozoa // Biochem. J. 2011. V. 436. P. 687–698.
Kosir R., Juvan P., Perse M. et al. Novel insights into the downstream pathways and targets controlled by transcription factors CREM in the testis // PLoS One. 2012. V. 7. № 2. P. e31798.
Kostro K., Krakowski L., Lisiecka U. et al. Flow cytometric evaluation of sperm apoptosis in semen of silver foxes in the breeding period // Anim. Reprod. Sci. 2014. V. 144. P. 54–58.
Krakowski L., Obara J., Wąchocka A. et al. Assessment of extent of apoptosis and DNA defragmentation in chilled semen of stallions during the breeding season // Reprod. Domest. Anim. 2013. V. 48. № 5. P. 826–832.
Kushnareva Y., Murphy A.N., Andreyev A. Complex I-mediated reactive oxygen species generation: modulation by cytochrome C and NAD(P)+ oxidation–reduction state // Biochem. J. 2002. V. 368. P. 545–553.
Lasso J.L., Noiles E.E., Alvarez J.G. et al. Mechanism of superoxide dismutase loss from human sperm cells during cryopreservation // J. Androl. 1994. V. 15. № 3. P. 255–265.
Li Z., Lin Q., Liu R. et al. Protective effects of ascorbate and catalase on human spermatozoa during cryopreservation // J. Androl. 2010. V. 31. № 5. P. 437–444.
Lin Y.C., Yao P.L., Richburg J.H. FasL gene-deficient mice display a limited disruption in spermatogenesis and inhibition of mono-(2-ethylhexyl) phthalate-induced germ cell apoptosis // Toxicol. Sci. 2010. V. 114. P. 335–345.
Liu Z., Zhou S., Liao L. et al. Jmjd1a demethylase-regulated histone modification is essential for cAMP-response element modulator-regulated gene expression and spermatogenesis // J. Biol. Chem. 2010. V. 285. P. 2758–2770.
Lu C., Thompson C.B. 2012 Metabolic regulation of epigenetics // Cell Metabolism. 2012. V. 16. P. 9–17.
Maione B., Pittoggi C., Achene L. et al. Activation of endogenous nucleases in mature sperm cells upon interaction with exogenous DNA // DNA Cell Biol. 1997. V. 16. № 9. P. 1087–1097.
Marchetti C., Obert G., Deffosez A. et al. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm // Hum. Reprod. 2002. V. 17. P. 1257–1265.
Martí E., Pérez‑Pé R., Colás C. et al. Study of apoptosis‑related markers in ram spermatozoa // Anim. Reprod. Sci. 2008. V. 106. № 1–2. P. 113–132.
Martin G., Cagnon N., Sabido O. et al. Kinetics of occurrence of some features of apoptosis during the cryopreservation process of bovine spermatozoa // Hum. Reprod. 2007. V. 22. P. 380–388.
Martin G., Sabido O., Durand P. et al. Cryopreservation induces an apoptosis-like mechanism in bull sperm // Biol. Reprod. 2004. V. 71. P. 28–37.
Mendoza N., Casao A., Pérez-Pé R. et al. New insights into the mechanisms of ram sperm protection by seminal plasma proteins // Biol. Reprod. 2013. V. 88. № 6. P. 149.
Miething A. Germ-cell death during prespermatogenesis in the testis of the golden hamster // Cell Tissue Res. 1992. V. 267. № 3. P. 583–590.
Muratori M., Tamburrino L., Marchiani S. et al. Investigation on the origin of sperm DNA fragmentation: role of apoptosis, immaturity and oxidative stress // Mol. Med. 2015. V. 21. P. 109–122.
Novotny G.W., Sonne S.B., Nielsen J.E. et al. Translational repression of E2F1 mRNA in carcinoma in situ and normal testis correlates with expression of the miR-17-92 cluster // Cell Death Differ. 2007. V. 14. P. 879–882.
Oehninger S., Morshedi M., Weng S. et al. Presence and significance of somatic cell apoptosis markers in human ejaculated spermatozoa // Reprod. Biomed. Online. 2003. V. 7. P. 469–476.
Ortega-Ferrusola C., Gonzalez Fernandez L., Salazar Sandoval C. et al. Inhibition of the mitochondrial permeability transition pore reduces “apoptosis like” changes during cryopreservation of stallion spermatozoa // Theriogenology. 2010. V. 74. P. 458–465.
Ortega-Ferrusola C., Sotillo-Galan Y., Varela-Fernandez E. et al. Detection of “apoptosis-like” changes during the cryopreservation process in equine sperm // J. Androl. 2008. V. 29. P. 213–221.
Paasch U., Grunewald S., Fitzl G. et al. Deterioration of plasma membrane is associated with activation of caspases in human spermatozoa // J. Androl. 2003. V. 24. P. 246–252.
Paasch U., Sharma R.K., Gupta A.K. et al. Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoa // Biol. Reprod. 2004. V. 71. № 6. P. 1828–1837.
Paoli D., Lombardo F., Lenzi A. et al. Sperm cryopreservation: effects on chromatin structure // Adv. Exp. Med. Biol. 2014. V. 791. P. 137–150.
Pena F.J., Johannisson A., Wallgren M. et al. Assessment of fresh and frozen-thawed boar semen using an Annexin-V assay: a new method of evaluating sperm membrane integrity // Theriogenology. 2003. V. 60. P. 677–689.
Rotgers E., Nurmio M., Pietilä E. et al. E2F1 controls germ cell apoptosis during the first wave of spermatogenesis // Andrology. 2015. V. 3. № 5. P. 1000–1014.
Said T.M., Gaglani A., Agarwal A. Implication of apoptosis in sperm cryoinjury // Reprod. Biomed. Online. 2010. V. 21. № 4. P. 456–462.
Sakkas D., Mariethoz E., Manicardi G. et al. Origin of DNA damage in ejaculated human spermatozoa // Rev. Reprod. 1999a. V. 4. P. 31–37.
Sakkas D., Mariethoz E., St. John J.C. Abnormal sperm parameters in humans are indicative of an abortive apoptotic mechanism linked to the Fas-mediated pathway // Exp. Cell Res. 1999b. V. 251. P. 350–355.
Sakkas D., Seli E., Manicardi G.C. et al. The presence of abnormal spermatozoa in the ejaculate: did apoptosis fail? // Hum. Fertil. (Camb.). 2004. V. 7. P. 99–103.
Shukla K.K., Mahdi A.A., Rajender S. Apoptosis, spermatogenesis and male infertility // Front. Biosci. 2012. V. 4. P. 746–754.
Stephan H., Polzar B., Rauch F. et al. Distribution of deoxyribonuclease I (DNase I) and p53 in rat testis and their correlation with apoptosis // Histochem. Cell Biol. 1996. V. 106. № 4. P. 383–393.
Taylor K., Roberts P., Sanders K. et al. Effect of antioxidant supplementation of cryopreservation medium on post-thaw integrity of human spermatozoa // Reprod. Biomed. Online. 2009. V. 18. № 2. P. 184–189.
Taylor S.L., Weng S.L., Fox P. et al. Somatic cell apoptosis markers and pathways in human ejaculated sperm: potential utility as indicators of sperm quality // Mol. Hum. Reprod. 2004. V. 10. P. 825–834.
Thomson L.K., Fleming S.D., Aitken R.J. et al. Cryopreservation-induced human sperm DNA damage is predominantly mediated by oxidative stress rather than apoptosis // Hum. Reprod. 2009. V. 24. № 9. P. 2061–2070.
Tsounapi P., Saito M., Dimitriadis F. et al. Antioxidant treatment with edaravone or taurine ameliorates diabetes-induced testicular dysfunction in the rat // Mol. Cell Biochem. 2012. V. 369. P. 195–204.
Varum S., Bento C., Sousa A.P. et al. Characterization of human sperm populations using conventional parameters, surface ubiquitination, and apoptotic markers // Fertil. Steril. 2007. V. 87. № 3. P. 572–583.
Vasicek J., Pivko J., Chrenek P. Reproductive performance of New Zealand White rabbits after depletion of apoptotic spermatozoa // Folia Biol. (Krakow). 2014. V. 62. № 2. P. 109–117.
Vaux D.L., Korsmeyer S.J. Cell death in development // Cell. 1999. V. 96. P. 245–254.
Weil M., Jacobson M.D., Raff M.C. Are caspases involved in the death of cells with a transcriptionally inactive nucleus? Sperm and chicken erythrocytes // J. Cell Sci. 1998. V. 111. P. 2707–2715.
Weng S.L., Taylor S.L., Morshedi M. et al. Caspase activity and apoptotic markers in ejaculated human sperm // Mol. Hum. Reprod. 2002. V. 8. № 11. P. 984–991.
Yamasaki L., Jacks T., Bronson R. et al. Tumor induction and tissue atrophy in mice lacking E2F-1 // Cell. 1996. V. 85. P. 537–548.
Youle R.J., Strasser A. The BCL-2 protein family: opposing activities that mediate cell death // Nat. Rev. Mol. Cell Biol. 2008. V. 9. № 1. P. 47–59.
Zeng C., Tang K., He L. et al. Effects of glycerol on apoptotic signaling pathways during boar spermatozoa cryopreservation // Cryobiology. 2014. V. 68. P. 395–404.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


