Онтогенез, 2019, T. 50, № 4, стр. 278-288
Метилирование ДНК в сперматозоидах мышей при моделировании длительного пребывания в условиях микрогравитации
М. А. Усик a, b, *, И. В. Огнева a, b
a ГНЦ РФ – Институт медико-биологических проблем РАН
123007 Москва, Хорошевское шоссе, д. 76а, Россия
b Первый МГМУ им. И.М. Сеченова
119991 Москва, ул. Трубецкая, д. 8, стр. 2, Россия
* E-mail: iogneva@yandex.ru
Поступила в редакцию 17.12.2018
После доработки 15.03.2019
Принята к публикации 25.03.2019
Аннотация
Механизмы взаимодействия клетки и гравитационного поля до сих пор малоизученны и практически отсутствуют данные о влиянии изменения силы тяжести на половые клетки. Целью данной работы было определение уровней экспрессии генов, кодирующих цитоскелетные белки (бета- и гамма-актин, актин-связывающие белки альфа-актинин-1 и альфа-актинин-4, бета-тубулин, десмин) методом количественной ПЦР, уровня локального (CpG-островки промоторных областей исследованных генов) и тотального метилирования методом рестрикционного анализа, содержания 5-гидроксиметилцитозина методом дот-блоттинга, а также содержания ферментов, обеспечивающих установление/поддержание соответствующего уровня метилирования методом вестерн-блоттинга, в сперматозоидах мышей, которые в течение 30 суток подвергались антиортостатическому вывешиванию и последующему 12-часовому восстановлению. Мы также вводили мышам перорально эссенциальные фософолипиды, определяя вышеописанные параметры. Полученные результаты свидетельствуют о том, что антиортостатическое вывешивание не приводило к существенным изменениям уровня экспрессии генов, кодирующих белки актинового цитоскелета в сперматозоидах, однако после 12-часового восстановления экспрессия увеличивалась. При этом метилирование CpG-островков в промоторных областях этих генов снижалось. Пероральное введение эссенциальных фосфолипидов нивелировало эти изменения. Экспрессия гена бета-тубулина снижалась после вывешивания, и 12-часовое восстановление не меняло ситуацию, равно как и введение эссенциальных фосфолипидов. В целом, общий уровень метилирования был снижен только в группе 12-часового восстановления, коррелируя с увеличением экспрессии исследованных генов. В то же время, содержание метилаз/деметилаз не менялось, однако увеличивалось содержание ацетилазы гистонов, позволяя предположить, что в условиях изменения внешнего механического напряжения свою роль в изменении экспрессии генов могут играть процессы модификации хроматина.
ВВЕДЕНИЕ
Роль силы тяжести в онтогенезе до сих пор остается малопонятной, несмотря на целый ряд исследований различных аспектов влияния механического воздействия на развитие, в частности раннее развитие млекопитающих (Бартон и др., 1988; Ontogenesis of Mammals in Microgravity, NASA TM – 103978, 1993; Fritzsch et al., 1995; Serova et al., 1996; Savel’ev et al., 1998; Schenker et al., 1998; Boonstra, 1999; Kojima et al., 2000; Serova, 2001). Было показано, что экспонирование крыс во второй половине беременности в условиях космического полета не приводит к заметным и устойчивым изменениям в развитии зародышей (Serova et al., 1996; Boonstra, 1999). Однако поскольку крысы являются амниотами, то, возможно, более чувствительными к изменению силы тяжести могут быть ранние стадии развития эмбрионов и даже половые клетки. Так, для мужских половых клеток, известно, что скорость движения сперматозоидов мышей после 7-суточного антиортостатического вывешивания, моделирующего эффекты невесомости, снижается (Kamiya et al., 2003), увеличивается экспрессия генов, кодирующих проапоптотические белки (Li et al., 2013), снижается эффективность сперматогенеза (Pellegrini et al., 2010; Zhang et al., 2014). Тем не менее, чем обусловлены подобные изменения в сперматозоидах совершенно не ясно.
На сегодняшний день не вызывает сомнений участие внешнего механического поля в установлении паттернов экспрессии различных генов, в первую очередь, кодирующих цитоскелетные белки и связанные с ними сигнальные каскады, что было продемонстрировано в целом ряде экспериментов, связанных с изучением влияния изменения силы тяжести на различные типы клеток и тканей (Zayzafoon et al., 2004; Meyers et al., 2004, 2005; Dai et al., 2007; Patel et al., 2007; Gershovich et al., 2008; Pan et al., 2008). Так, было показано, что при экспонировании мезенхимальных стволовых клеток на машине случайного позиционирования, где суммарный вектор силы тяжести в среднем за минуту равен нулю, меняется экспрессия генов, кодирующих актин и тубулин (Plett et al., 2004; Gershovich et al., 2008). Однако каким образом трансудуцируется внешний сигнал об изменении механического поля в изменении экспрессии генов остается совсем неясным.
Метилирование цитозина в сайтах CpG, особенно в промоторной области, является одним из основных факторов, определяющих эффективность экспрессии данного гена. Однако в условиях космического полета данные по этому вопросу весьма немногочисленны. Было показано, что у ростков риса имело место гиперметилирование, что совсем не коррелировало с уровнем экспрессии генов (Ou et al., 2009), хотя Cинг (Singh et al., 2010), используя модельную систему на Т-лимфоцитах человека, продемонстрировали гипометилирование ДНК. В то же время в лимфобластоидных клетках наблюдалось изменение уровня не только метилирования, но и гидроксиметилирования (Chowdhury et al., 2016).
Проведенное нами исследование образцов тканей сердца и легких мышей, которые были зафиксированы в условиях космического полета показало, что тотальный уровень метилирования ДНК увеличивается на 21–32% в условиях космического полета, при этом экспрессия генов метилаз/деметилаз не менятеся, за исключением деметилазы Tet2 (гидроксилазы), которая снижается в той же полетной группе (Ogneva et al., 2018). Однако в той работе мы не определяли содержание непосредственно фермента. Активное деметилирование генома млекопитающих было открыто только в 2009 году, хотя первые данные были получены в 1971 г. и показано, что гидроксилазы семейства Tet могут участвовать в превращении 5mC в 5hmC, роль которого до сих пор не ясна, но возможно 5hmC является промежуточным продуктом перед полностью неметилированным состоянием (Guo et al., 2011).
Учитывая все вышесказанное целью нашей работы было определение уровней экспрессии генов, кодирующих цитоскелетные белки в сперматозоидах мышей, полный цикл сперматогенеза которых проходил в условиях, моделирующих эффекты невесомости. При этом, мы решили определить уровень тотального метилирования генома (в том числе и содержания 5hmC), метилирования некоторых CpG островков в промоторных областях исследованных генов и содержания ферментов, обеспечивающих установление/поддержание соответствующего уровня метилирования.
Кроме того, наши предыдущие исследования показывают, что введение фосфолипидов, в том числе пероральное, мышам позволяет предотвратить изменение паттерна цитоскелетных белков и экспрессии кодирующих их генов (Ogneva et al., 2016), поэтому и в данной работе мы также вводили эссенциальные фосфолипиды и оценивали их эффект на вышеуказанные параметры.
МАТЕРИАЛЫ И МЕТОДЫ
Организация эксперимента
Моделирование эффектов микрогравитации проводили с использованием стандартной модели сдвига жидкостей в краниальном направлении в сочетании с безопорностью задних конечностей грызунов – модели антиортостатического вывешивания грызунов Ильина-Новикова в модификации Морей-Холтон (Morey-Holton et al., 2005).
В ходе эксперимента животные (мыши, самцы линии C57black/6) содержались в стандартных виварных условиях, получая стандартный корм для грызунов и воду ad libitum. За 10 дней до начала эксперимента животных случайным образом разделили на две группы (по n = 21), одна из которых начала получать перорально эссенциальные фософолипиды в виде препарата EssentsialeR Forte N (A. NATTERMANN and Cie. GmbH, Германия) в дозировке 500 мг/кг/сутки и получала их в течение всего последующего срока эксперимента (30 суток).
Животные были распределены случайным образом по следующим группам:
– контрольная группа С (n = 7) – m = 28.2 ± 0.7 г;
– контрольная группа + эссенциальные фосфолипиды CE (n = 7) – m = 28.4 ± 0.5 г;
– группа вывешивания 30HS (n = 7) – m = 27.0 ± ± 0.9 г;
– группа вывешивания + эссенциальные фосфолипиды 30HSE (n = 7) – m = 25.0 ± 0.9 г;
– группа восстановления в течение 12 ч после 30-суточного вывешивания 30HS+12h (n = 7) – m = = 26.1 ± 0.7 г;
– группа восстановления в течение 12 ч после 30-суточного вывешивания + эссенциальные фосфолипиды 30HSE (n = 7) – m = 26.0 ± 0.8 г.
После эвтаназии животных выделяли эпидидимисы семенников и семявыносящий канал для последующего получения сперматозоидов. Все процедуры с животными были одобрены комиссией по биомедицинской этике ГНЦ РФ – ИМБП РАН (протокол № 425 от 20 июня 2016 г.).
Выделение сперматозоидов
Сразу после выделения эпидидимисы помещали в 1 мл подогретой до 37°С среды α-MEM с 10% бычьей сывороткой, которые далее измельчали и инкубировали на шейкере (Thermo Shuker PST-60HL-4, BIOSAN, Южная Корея) в течение 30 мин при 37°С. Взвесь фильтровали через нейлоновые фильтры диаметром сетки 70 мкм, центрифугировали 3 мин при 10 000 об./мин и полученный таким образом осадок, представляющий собой смесь подвижных форм сперматозоидов, замораживали для последующего выделения белка и мРНК.
Определение относительного содержания мРНК генов, кодирующих цитоскелетные белки, методом количественной ПЦР
Тотальную РНК из замороженных сперматозоидов выделяли, используя RNeasy Micro Kit (Qiagen, Германия), согласно инструкции производителя. Проводили обратную транскрипцию, с использованием в качестве праймера d(T)15 и добавляя 50 нг РНК. Оценку относительного содержания мРНК исследуемых генов осуществляли с помощью ПЦР в реальном времени с праймерами, подобранными программой Primer3Plus (табл. 1), результаты которой обрабатывали с использованием метода 2(-DeltaDeltaC(T)) (Livak et al., 2001).
Таблица 1.
Последовательность праймеров и размер продуктов
| Ген | Последовательность праймера, прямой/обратный (5'…3') | Размер продукта, п.о. |
|---|---|---|
| Actb (бета-актин) | gctgcgttttacaccctttc/gtttgctccaaccaactgct | 218 |
| Actg (гамма-актин) | ctggtggatctctgtgagca/tcaggagggaagaaaccaga | 184 |
| Actn1 (альфа-актинин-1) | ggtcagcagcaacctcctc/tctttctccaccttctctcca | 167 |
| Actn4 (альфа-актинин-4) | accctgaacagactcccttg/gatcgacaagcctccatctc | 168 |
| Tubb2b (бета-тубулин 2B) | ggcagcaagaagctaacgag/cgaacacgaagttgtctggc | 302 |
| Des (десмин) | gtgaagatggccttggatgt/cgggtctcaatggtcttgat | 182 |
Определение уровня тотального метилирования ДНК и метилирования CpG-островков в промоторных областях генов методом рестрикционного анализа (MspI/HpaII).
Для определения уровня метилирования тотальную ДНК выделяли из замороженных сперматозоидов, используя набор для выделения ДНК (Синтол, Россия) основанный на фенол/хлороформном методе согласно инструкции производителя.
Для анализа тотального CpG метилирования в локусах 5'-CCGG-3' использовали EpiJET Methylation Analysis Kit (MspI/HpaII) (Thermo Scientific, США) согласно инструкции производителя. В случае, когда внутренний цитозин в тетрануклеотиде 5'-CCGG-3' метилирован, активность рестриктазы Epi HpaII блокирована, в то время как активность рестриктазы Epi MspI – нет. При проведении рестрикции брали 1 мкг геномной ДНК, а также по 1 мкг неметилированной плазмидной ДНК pUC DNA/SmaI и полностью метилированной плазмидной ДНК mpUC DNA/SmaI в качестве контроля отсутствия деградации ДНК в буфере для рестрикции и эффективности работы ферментов MspI и HpaII. Анализ результатов рестрикции проводили в 1% агарозном геле с маркером размеров FastRuler Middle Range DNA Ladder (Thermo Scientific, США), обработку результатов – в программе Image Lab (Bio-Rad, США), нормируя на общее содержание геномной ДНК в соответствующей пробе.
Для определения уровня метилирования CpG-островков в промоторных областях генов, кодирующих цитоскелетные белки, ДНК, полученную после рестрикции, переосаждали фенол/хлороформным методом, затем проводили количественную ПЦР с соответствующими праймерами, подобранными программой Primer3Plus (табл. 2), и анализировали результаты согласно инструкции производителя EpiJET Methylation Analysis Kit (MspI/HpaII) (Thermo Scientific, США).
Таблица 2.
Последовательность праймеров к промоторным областям, содержащим CpG-островки, генов, кодирующих цитоскелетные белки, и размер продуктов
| Ген | Последовательность праймера, прямой/обратный (5'…3') | Размер продукта, п.о. |
|---|---|---|
| Actb (бета-актин) | ccatcgccaaaactcttcat/gggttttataggacgccaca | 229 |
| Actg (гамма-актин) | acgggactcaccccagat/atggcgatctttccaaaagc | 292 |
| Actn1 (альфа-актинин-1) | ctgctggggtttgtagcttg/ccttaagctgaaccggagtg | 180 |
| Actn4 (альфа-актинин-4) | accccgaaacaggttaaagc/gcctgcgcagttcacttg | 243 |
| Tubb2b (бета-тубулин 2B) | cccttctcaagtccgagaca/ggtgggttcggtcttttatg | 250 |
| Des (десмин) | ggtctcctgtcagctccttg/gtagccctcctgacatcacc | 203 |
Определение уровня содержания 5-гиброксиметилцитозина (5hmC) в ДНК методом дот-блоттинга.
Выделенную фенол/хлороформным методом ДНК наносили на нитроцеллюлозную мембрану, предварительно измерив концентрацию и денатурировав (95°С в течение 5 мин, далее 4°С – 3 мин), в трех разведениях – 1 мкг, 500 нг, 200 нг. Высушивали на воздухе, приваривали к мембране ультрафиолетом и инкубировали в 4% обезжиренном молоке в течение ночи при 4°С.
Для определения 5hmC использовали специфичные антитела на основе иммуноглобулинов кролика (Abcam, Великобритания) в разведении 0.5 мкг/мл в соответствии с инструкцией производителя. В качестве вторичных антител использовали биотинилированные козьи антитела против IgG кролика (Jackson ImmunoResearch Lab., Inc., США) в разведении 1 : 10 000. Затем мембраны обрабатывали раствором стрептавидина, конъюгированного с пероксидазой хрена (Sigma, Германия) в разведении 1 : 10 000. Доты выявляли с помощью 3,3'-диаминобензидина (Merck, США). Для анализа полученных данных была использована программа ImageJ.
Определение содержания белков методом вестерн-блоттинга
Выделение тотального белка из сперматозоидов и денатурирующий электрофорез, проводили по методу Лэмли с помощью системы Bio-Rad (США). Измеряли концентрацию белка в каждой пробе и во все лунки наносили одинаковое количество белка. Перенос на нитроцеллюлозную мембрану проводили по Тоубину и др. (Towbin et al., 1979).
Для определения каждого белка были использованы специфичные антитела на основе иммуноглобулинов кролика в разведениях, рекомендованных фирмой-производителем (Abcam, Великобритания): для метилазы S-фазы Dnmt1 – 1 : 1000, для метилазы de novo Dnmt3a – 1 : 2000, для 5-метилцитозингидроксилазы (деметилазы) TET1 – 2 мкг/мл, TET2 – 1 : 1000, TET3 – 2 мкг/мл, для ацетилазы гистонов KAT1/HAT1 – 1 : 1000, для деацетилазы гистонов HDAC1 – 1 : 1000. В качестве вторичных антител использовали биотинилированные козьи антитела против IgG кролика (Jackson ImmunoResearch Lab., Inc., США) в разведении 1 : 10 000. Далее все мембраны обрабатывали раствором стрептавидина, конъюгированного с пероксидазой хрена (Sigma, Германия) в разведении 1 : 10 000. Белковые полосы выявляли с помощью 3,3'-диаминобензидина (Merck, США) и данные анализировали в программе ImageJ.
Статистическая обработка
Полученные результаты статистически обрабатывали с помощью ANOVA, используя для оценки достоверности отличий между группами пост-хоковский t-тест с уровнем значимости p < 0.05. Данные представлены в виде M ± SE, где М – среднее арифметическое, SE – ошибка среднего значения.
РЕЗУЛЬТАТЫ
Относительное содержание мРНК генов, кодирующих цитоскелетные белки
Относительное содержание мРНК гена бета-актина и десмина не менялось в исследованных группах (рис. 1а и 1е).
Рис. 1.
Относительное содержание мРНК и уровень метилирования CpG островков в промоторных областях генов, кодирующих цитоскелетные белки. Столбцы гистограмм отражают изменение относительного содержания мРНК (левая ось ординат), линии графика – уровень метилирования СpG-островков в промотной области соответствующего гена (правая ось ординат). а – бета-актин (Actb). б – гамма-актин (Actg). в – альфа-актинин-1 (Actn1). г – альфа-актинин-4 (Actn4). д – бета-тубулин 2B (Tubb2b). е – десмин (Des). * – p < 0.05 по сравнению с контрольной группой С.
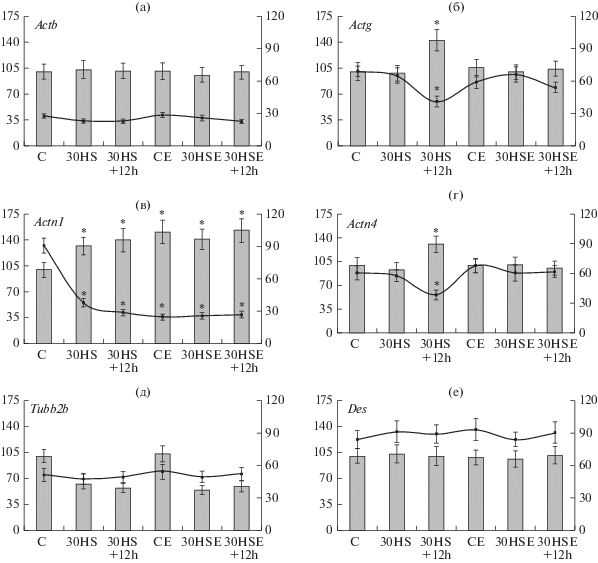
Содержание мРНК гена гамма-актина (рис. 1б), не меняясь в ходе антиортостатического вывешивания (группа 30HS), возрастало через 12 ч восстановления (группа 30HS+12h) на 42% (p < 0.05), при этом в группах с применением эссенциальных фосфолипидов подобных изменений не было. Аналогичные изменения отмечались для гена, кодирующего актин-связывающий белок альфа-актинин-4, где в группе 30HS+12h относительное содержание мРНК было выше на 31% (p < 0.05) относительно группы С (рис. 1г).
Относительное содержание мРНК гена, кодирующего альфа-актинин-1 (рис. 1в), увеличивалось в группе 30HS на 32% (p < 0.05) по сравнению с группой C и оставалось повышенным (на 40%, p < 0.05) через 12 ч восстановления (группа 30HS+12h). В то же время в группах с применением эссенциальных фосфолипидов вывешивание не приводило к изменению уровня экспрессии гена альфа-актинина-1, однако пероральное введение эссенциале привело к увеличению экспрессии этого гена (на 51% (p < 0.05) в группе CE по сравнению с группой С, на 41 и 53% (p < 0.05) в группах 30HSE и 30HSE+12h соответственно).
Относительное содержание мРНК гена, кодирующего одну из субъединиц тубулина – Tubb2b, снижалось после вывешивания на 38% (p < 0.05) и оставалось на том же уровне через 12 ч реадаптации (ниже контроля на 43%, p < 0.05) (рис. 1д). Аналогичная картина имела место и в группах с применением эссенциальных фосфолипидов: в группе 30HSE относительное содержание мРНК Tubb2b было ниже, чем в контроле на 46% (p < 0.05), в группе 30HSE+12h – на 41% (p < 0.05). При этом различий между группами C и CE не отмечалось.
Уровень метилирования CpG островков в промоторных областях генов, кодирующих цитоскелетные белки
Изменений уровня метилирования промоторной области гена Actb не наблюдалось (рис. 1а). Для промоторной области гена Actg в группе 30HS+12h имело место достоверное (p < 0.05) снижение уровня метилирования: с 69 (для группы C) до 41% (рис. 1б).
Наиболее существенные изменения уровня экспрессии отмечали для гена Actn1, что коррелировало с наиболее заметными изменениями уровня метилирования CpG островков его промоторной области (рис. 1в). Так, в группах 30HS и 30HS+12h уровень метилирования был ниже, чем в контрольной группе на 53 и 62% соответственно (p < 0.05). При этом в группах с применением эссенциальных фосфолипидов вывешивание и последующее восстановление не влияло на уровень метилирования, который был одинаковым во всех этих группах, однако относительно группы C снижение было существенным: в группе CE на 66%, в группе 30HSE – на 65%, в группе 30HSE+12h – на 64% (p < 0.05).
Для гена Actn4 снижение уровня метилирования промоторной области (рис. 1г) наблюдали только в группе 30HS+12h (на 22% относительно группы C (p < 0.05)).
Для CpG островков промоторных областей генов Tubb2b (рис. 1д) и Des (рис. 1е) изменений уровня метилирования отмечено не было.
Общий уровень метилирования и относительное содержание 5-гидроксиметилцитозина
Тотальный уровень метилирования генома (рис. 2а) сперматозоидов не менялся после 30-суточного антиортостатического вывешивания мышей, однако последующее 12-часовое восстановление приводило к его снижению на 23% (группа 30HS+12h) относительно уровня контроля (p < 0.05). При этом в группах с применением эссенциальных фосфолипидов изменений не наблюдалось.
Рис. 2.
Параметры тотального метилирования генома. а – относительный уровень общего метилирования генома. б – относительное содержание 5-гидроксиметилцитозина (5hmC) и типичный дот-блот. * – p < 0.05 по сравнению с контрольной группой С.

В то же время, относительное содержание 5‑гидроксиметилцитозина не изменилось ни в одной из групп исследования (рис. 2б).
Относительное содержание метилаз/деметилаз и ацетилаз/деацетилаз
Относительное содержание метилазы S-фазы DNMT1 (рис. 3а), метилазы de novo DNMT3a (рис. 3а), деметилаз (гидроксилаз) TET1, TET2, TET3 (рис. 3б) не менялось ни в одной из групп исследования.
Рис. 3.
Относительное содержание белков, участвующих в установлении/регуляции паттернов метилирования, и типичные вестерн-блоты. а – метилазы: S-фазы DNMT1 и de novo DNMT3a. б – деметилазы (гидроксилазы): TET1, TET2, TET3. в – гистон-деацетилаза HDAC1 и гистон-ацетилаза HAT1. * – p < 0.05 по сравнению с контрольной группой С.
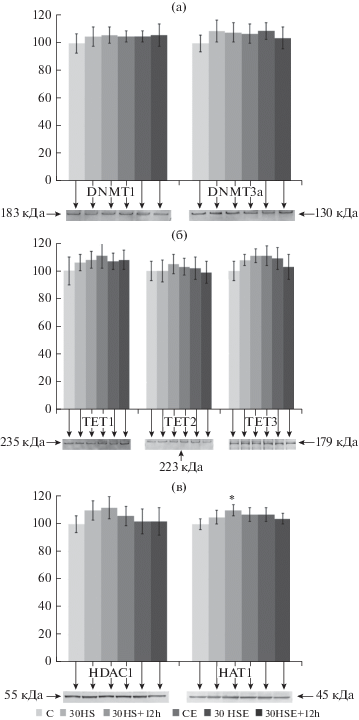
Также не менялось содержание гистон-деацетилазы HDAC1 (рис. 3в), однако содержание гистон-ацетилазы HAT1 (рис. 3в) несколько, но достоверно, увеличивалось на 10% (p < 0.05) в группе 12-часового восстановления после 30-суточного вывешивания (30HS+12h), оставаясь неизменным во всех остальных группах исследования.
ОбСУЖДЕНИЕ
Эволюция всех живых организмов на Земле происходила в условиях постоянного действия силы тяжести, что обусловливает целый ряд, по-видимому, негативных изменений, возникающих в различных живых системах при ее отсутствии, в частности в условиях космического полета. На сегодняшний день механизмы взаимодействия гравитационного поля с живыми системами остаются малопонятными, в первую очередь на клеточно-молекулярном уровне. Например, неясно каким образом реализуется механизм, действие которого приводит как к длительному, так и транзиторному изменению экспрессии целого ряда генов, в частности, кодирующих цитоскелетные белки.
Экспрессия генов, кодирующих цитоскелетные белки
Полученные нами в данной работе результаты свидетельствуют о том, что экспрессия изоформ актина в сперматозоидах мышей в условиях 30‑суточного вывешивания не менятеся, однако последующее 12-часовое восстановление приводит к увеличению содержания мРНК гамма-актина, также как и изоформ актин-связывающих белков – альфа-актининов 1 и 4. Сопоставляя эти результаты с результатами, полученными нами ранее при исследовании тканей сердца и мышц задних конечностей (Ogneva et al., 2014a, 2015, 2016), можно предполагать, что ранний период реадаптаци после длительного вывешивания можно расценивать как увеличение механической нагрузки, “требующее” более развитого цитоскелета.
В предыдущих работах мы предполагали, что первичные акты клеточной механорецепции могут быть связаны с диссоциацией от кортикального цитоскелета различных изформ альфа-актинина (альфа-актинина-1 в случае увеличения механического напряжения и альфа-актинина-4 – при его уменьшении) и, соответственно, с регуляцией экспрессии соответствующих генов (Ogneva et al., 2014b). Поэтому, предполагая, что антиортостатическое вывешивание будет приводить к снижению внешней механической нагрузки и, как следствие к диссофциации на ранних этапах альфа-актинина-4, мы ожидали что после 30 суток произойдет увеличение экспрессии альфа-актинина-1, в связи с возможностью их взаимной регуляции уровней экспрессии (Honda et al., 1998). Действительно, в группе 30HS было отмечено увеличение относительного содержания мРНК гена альфа-актинина-1.
В продолжение вышеизложенной гипотезы мы применяли эссенциальные фосфолипиды с целью изменения структуры кортикального цитоскелета. Эссенциальные фосфолипиды способствуют экстракции холестерина из клеточных мембран, благодаря наличию полиненасыщенных жирных кислот в обоих липидных хвостах. Экстракция холестерина из клеточных мембран приводит, в свою очередь, к изменению жесткости кортикального цитоскелета (Chubinskiy-Nadezhdin et al., 2011). Мы предполагаем, что изменение жесткости кортикального цитоскелета может вести к изменению порога чувствительности клетки к изменению внешнего механического поля (Ogneva, 2013; Ogneva et al., 2014, 2016). Полученные ранее результаты дают некоторые основания полагать, что подобный подход может быть эффективным для разработки методов протекции в условиях невесомости. Поскольку эссенциальные фосфолипиды встраиваются в различные клеточные мембраны (Jayraman et al., 2008), в том числе и сперматозоиды, то была выбрана длительность эксперимента, соответствующая почти полному циклу сперматогенеза у мышей. Нам удалось предотвратить изменения, наблюдавшиеся в группах без применения фосфолипидов, в частности, в ранний период реадаптации. Однако, хотя для альфа-актинина-1 относительный уровень содержания мРНК между группами CE, 30HSE и 30HSE+12h был одинаковым, тем не менее, этот уровень был существенно выше по сравнению с группой C.
Антиортостатическое вывешивание также привело к снижению уровня экспрессии гена, кодирующего одну из изоформ тубулина, который не восстановился за последующие 12 ч реадаптации. Возможно, именно снижением содержания тубулина можно объяснить снижение скорости движения сперматозоидов, которое отмечалось в условиях микрогравитации (Kamiya et al., 2003; Ikeuchi et al., 2005). Более того, в данном случае, применение эссенциальных фосфолипидов не позволило предотвратить подобные изменения. С одной стороны, это может свидетельствовать о разнообразии механизмов реализации клеточной чувствительности к внешним механических условиям. С другой стороны, можно предположить, что дифференцировка вторичных сперматоцитов, прошедших 2-ое деление мейоза, и последующее созревание сперматид, в ходе которых происходит формирование жгутика, требующее наличия белка тубулина (соответственно и экспрессии кодирующего его гена), могут быть существенно более зависимы от вторичных факторов, возникающих при моделировании эффектов микрогравитации, нежели от прямого изменения внешнего механического поля. Таким фактором может быть, например, наблюдаемое в условиях невесомости изменение гормонального статуса (Kamiya et al., 2003).
Вышеописанные изменения относительного содержания мРНК генов, кодирующих цитоскелетные белки, могут быть связаны с действием целого ряда факторов, таких как ремоделирование и модификации хроматина, изменение метилирования генома, рекрутирование комплексов активации и сайленсинга (например, белков групп Polycomb и Trithorax) и т.д.
В данной работе мы решили проанализировать модификации непосредственно ДНК, а именно метилирование генома.
Уровень метилирования генома и содержание белков, участвующих в установлении/регуляции паттернов метилирования
Точечный анализ уровня метилирования свидетельствует о том, что увеличение уровней содержания мРНК генов, кодирующих цитоскелетные белки, коррелировало со снижением уровня метилирования CpG-островков в промоторных областях этих генов. В то же время, снижение содержания мРНК (для гена Tubb2b) происходило в отсутствие изменений метилирования CpG островков промоторной области этого гена. Однако следует отметить, что нам удалось подобрать эффективные праймеры для амплификации локуса промоторной области данного гена, который содержит лишь один GC-бокс, хотя в целом их пять (Eukaryotic promoter database EPD, https://epd.vital-it.ch). Вполне возможно, что именно этот локус не подвергся изменению метилирования, в то время как другие могли быть модифицированы.
В то же время общий уровень метилирования ДНК снижался в группе 30HS+12h что может быть соотнесено как с увеличением экспрессии цитоскелетных генов в этой группе, так и в целом свидетельствовать о вероятном увеличении экспрессии генома в ранний период реадаптации после длительного антиортостатического вывешивания. Отсутствие изменений содержания 5-гидроксиметилцитозина, который, как полагают, может быть промежуточным продуктом между 5-метилцитоизном и полностью неметилированным состоянием (Guo et al., 2011), во всех группах исследования, в том числе и в группе 30HS+12h позволяет предположить, что за 12 ч восстановления произошло полное деметилирование тех участков генома, которые были модифицированы.
В связи с вышеизложенным, мы предположили, что имело место изменение содержания ферментов, которые изменяют уровень метлирования генома – метилазы и деметилазы. Однако полученные данные показывают, что содержание ни метилазы S-фазы DNMT1, ни метилазы de novo DNMT3a, ни деметилаз семейства TET не изменилось. Следовательно, могла измениться эффективность их рекрутирования к геному, что, в свою очередь, может быть связано с модификацией хроматина, например, с изменением уровня ацетилирования гистонов.
Поэтому мы определили содержание наиболее консервативных ацетилазы и деацетилазы гистонов. Изменений содержания деацетилазы HDAC1 обнаружено не было, но относительное содержание ацетилазы HAT1 в группе, где имело место изменение уровня метилирования ДНК – 30HS+12h, несколько, хотя достоверно, возрастало, что возможно, приводило к увеличению уровня ацетилирования гистонов. Последнее, в свою очередь, может регулировать эффективность транскрипции как напрямую, снижая связывание гистонов с ДНК за счет изменения заряда (Vettese-Dadey et al., 1996), так и путем запуска длинной цепочки, участниками которой могут быть белки ремоделинга хроматина активаторы транскрипции, белки, связывающиеся с метилированной ДНК и рекрутирующие метилазы, и т.п. (Dhalluin et al., 1999; Hassan et al., 2002; Shorgen-Knaak et al., 2006).
Работа поддержана программой фундаментальных исследований ГНЦ РФ – ИМБП РАН и программой Президиума РАН “Молекулярная и клеточная биология”.
Список литературы
Бартон Р., Смит А. Онтогенез млекопитающих в невесомости. M.: Наука, 1988. С. 13–14.
Ontogenesis of Mammals in Microgravity. NASA TM – 103978. 1993.
Boonstra J. Growth factor-induced signal transduction in adherent mammalian cells is sensitive to gravity // FASEB J. 1999. V. 13. № 9001. P. 35–42.
Chowdhury B., Seetharam A., Wang Z. et al. Study of alterations in DNA epigenetic modifications (5 mC and 5 hmC) and gene expression influenced by simulated microgravity in human lymphoblastoid cells // PLoS One. 2016. V. 11. № 1. P. e0147514.
Chubinskiy-Nadezhdin V.I., Negulyaev Y.A., Morachev-skaya E.A. Cholesterol depletion-induced inhibition of stretch-activated channels is mediated via actin rearrangement // Biochem. Biophys. Res. Commun. 2011. V. 412. № 1. P. 80–85.
Dai Z.Q., Wang R., Ling S.K. et al. Simulated microgravity inhibits the proliferation and osteogenesis of rat bone marrow mesenchymal stem cells // Cell Prolif. 2008. V. 41. № 2. P. 375.
Dhalluin C., Carlson J.E., Zeng L. et al. Structure and ligand of a histone acetyltransferase bromodomain // Nature. 1999. V. 399. P. 491–496.
Dumond R., Singh K.P., Kumari J.W. Simulated microgravity-induced epigenetic changes in human lymphocytes // J. Cell Biochem. 2010. V. 111. № 1. P. 123–129.
Fritzsch B., Bruce L.L. Utricular and saccular projections of fetal rats raised in normal gravity and microgravity // ASGSB Bull. 1995. V. 9. P. 97.
Gershovich P.M., Gershovic J.G., Buravkova L.B. Simulated microgravity alters actin cytoskeleton and integrin-mediated focal adhesions of cultured human mesenchymal stromal cells // J. Grav. Physiol. 2008. V. 15. № 1. P. 203–204.
Guo J.U., Su Y., Zhong C. et al. Emerging roles of TET proteins and 5-hydroxymethylcytosines in active DNA demethylation and beyond // Cell Cycle. 2011. V. 10. № 16. P. 2662–2668.
Hassan A.H., Prochasson P., Neely K.E. et al. Function and selectivity of bromodomains in anchoring chromatin-modifying complexes to promoter nucleosomes // Cell. 2002. V. 111. P. 369–379.
Honda K., Yamada T., Endo R. et al. Actinin-4, a novel actin-bundling protein associated with cell motility and cancer invasion // J. Cell Biol. 1998. V. 140. № 6. P. 1383–1393.
Ikeuchi T., Sasaki S., Umemoto Y. et al. Human sperm motility in a microgravity environment // Reprod. Med. Biol. 2005. V. 4. № 2. P. 161–168.
Jayaraman T., Kannappan S., Ravichandran M.K. et al. Impact of Essentiale L on ethanolinduced changes in rat brain and erythrocytes // Singapore Med. J. 2008. V. 49. № 4. P. 320–327.
Kamiya H., Sasaki S., Ikeuchi T. et al. Effect of simulated microgravity on testosterone and sperm motility in mice // J. Androl. 2003. V. 24. № 6. P. 885–890.
Kojima Y., Sasaki S., Kubota Y. et al. Effects of simulated microgravity on mammalian fertilization and preimplantation embryonic development in vitro // Fertil. Steril. 2000. V. 74. № 6. P. 1142–1147.
Li H.Y., Zhang H., Miao G.Y. et al. Simulated microgravity conditions and carbon ion irradiation induce spermatogenic cell apoptosis and sperm DNA damage // Biomed. Environ. Sci. 2013. V. 26. № 9. P. 726–734.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(–Delta Delta C(T)) method // Methods. 2001. V. 2. P. 402–408.
Meyers V.E., Zayzafoon M., Douglas J.T. et al. RhoA and cytoskeletal disruption mediate reduced osteoblastogenesis and enhanced adipogenesis of human mesenchymal stem cells in modeled microgravity // J. Bone Miner. Res. 2005. V. 20. № 10. P. 1858–1866.
Meyers V.E., Zayzafoon M., Gonda S.R. et al. Modeled microgravity disrupts collagen I/integrin signaling during osteoblastic differentiation of human mesenchymal stem cells // J. Cell Biochem. 2004. V. 93. № 4. P. 697–707.
Morey-Holton E., Globus R.K., Kaplansky A. et al. The hindlimb unloading rat model: literature overview, technique update and comparison with space flight data // Adv. Space Biol. Med. 2005. V. 10. P. 7–40.
Ogneva I.V. Cell mechanosensitivity: mechanical properties and interaction with gravitational field // Biomed. Res. Int. 2013. V. 2013. P. 598461.
Ogneva I.V., Biryukov N.S. Lecithin prevents cortical cytoskeleton reorganization in rat soleus muscle fibers under short-term gravitational disuse // PLoS One. 2016. V. 11. № 4. P. e0153650.
Ogneva I.V., Biryukov N.S., Leinsoo T.A. et al. Possible role of non-muscle alpha-actinins in muscle cell mechanosensitivity // PLoS One. 2014b. V. 9. № 4. P. e96395.
Ogneva I.V., Gnyubkin V., Laroche N. et al. Structure of the cortical cytoskeleton in fibers of postural muscles and cardiomyocytes of mice after 30-day 2-g centrifugation // J. Appl. Physiol. 2015. V. 118. № 5. P. 613–623.
Ogneva I.V., Loktev S.S., Sychev V.N. Cytoskeleton structure and total methylation of mouse cardiac and lung tissue during space flight // PLoS One. 2018. V. 13. № 5. P. e0192643.
Ogneva I.V., Maximova M.V., Larina I.M. Structure of cortical cytoskeleton in fibers of mouse muscle cells after being exposed to a 30-day space flight on board the BION-M1 biosatellite // J. Appl. Physiol. 2014a. V. 116. № 10. P. 1315–1323.
Ou X., Long L., Zhang Y. et al. Spaceflight induces both transient and heritable alterations in DNA methylation and gene expression in rice (Oryza sativa L.) // Mutat. Res. 2009. V. 662. № 1–2. P. 44–53.
Pan Z., Yang J., Guo C. et al. Effects of hindlimb unloading on ex vivo growth and osteogenic/adipogenic potentials of bone marrow-derived mesenchymal stem cells in rats // Stem Cells Dev. 2008. V. 17. № 4. P. 795–804.
Patel M.J., Liu W., Sykes M.C. et al. Identification of mechanosensitive genes in osteoblasts by comparative microarray studies using the rotating wall vessel and the random positioning machine // J. Cell Biochem. 2007. V. 101. № 3. P. 587–599.
Pellegrini M., Di Siena S., Claps G. et al. Microgravity promotes differentiation and meiotic entry of postnatal mouse male germ cells // PLoS One. 2010. V. 5. № 2. p. e9064.
Plett P.A., Abonour R., Frankovitz S.M. et al. Impact of modeled microgravity on migration, differentiation, and cell cycle control of primitive human hematopoietic progenitor cells // Exp. Hematol. 2004. V. 32. № 8. P. 773–781.
Savel’ev S.V., Serova L.V., Besova N.V. et al. Effect of weightlessness on rats endocrine system development // Aviakosm. Ekolog. Med. 1998. V. 32. № 2. P. 31–36.
Schenker E., Forkheim K. Mammalian mice embryo early development in weightlessness environment on STS 80 space flight // Israel Aerospace Medicine Institute Report. 1998.
Serova L.V. Microgravity and development of the mammals: problems results prospects // Aviakosm. Ekolog. Med. 2001. V. 35. № 2. P. 32–35.
Serova L.V., Natochkin I.V., Nosovskii A.M. et al. Effect of weightlessness on the mother-fetus system (results of embryological experiment NIH-R1 abroad the “Space Shuttle” // Aviakosm. Ekolog. Med. 1996. V. 30. № 6. P. 4–8.
Shogren-Knaak M., Ishii H., Sun J.M. et al. Histone H4-K16 acetylation controls chromatin structure and protein interactions // Science. 2006. V. 311. P. 844–847.
Singh K.P., Kumari R., Dumond J.W. Simulated microgravity-induced epigenetic changes in human lymphocytes // J. Cell Biochem. 2010. V. 111. № 1. P. 123–129.
Towbin H., Staehlin T., Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some application // Proc. Natl. Acad. Sci. USA. 1979. V. 76. P. 4350–4354.
Vettese-Dadey M., Grant P.A., Hebbes T.R. et al. Acetylation of histone H4 plays a primary role in enhancing transcription factor binding to nucleosomal DNA in vitro // EMBO J. 1996. V. 15. P. 2508–2518.
Zayzafoon M., Gathings W.E., McDonald J.M. Modeled microgravity inhibits osteogenic differentiation of human mesenchymal stem cells and increases adipogenesis // Endocrinology. 2004. V. 145. № 5. P. 2421–2432.
Zhang X., Li L., Bai Y. et al. Mouse undifferentiated spermatogonial stem cells cultured as aggregates under simulated microgravity // Andrologia. 2014. V. 46. № 9. P. 1013–1021.
Дополнительные материалы отсутствуют.


