Онтогенез, 2019, T. 50, № 4, стр. 270-277
Микроразмножение и сомаклональная изменчивость Tulipa suaveolens (Liliaceae) in vitro
Т. А. Крицкая a, *, А. С. Кашин a, М. Ю. Касаткин a
a Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410012 Саратов, Астраханская, д. 83, Россия
* E-mail: kritckaiata@gmail.com
Поступила в редакцию 18.12.2018
После доработки 08.02.2019
Принята к публикации 17.02.2019
Аннотация
Цель работы состояла в получении растений-регенерантов Tulipa suaveolens Roth in vitro, изучении особенностей морфогенеза и в оценке их генетической стабильности с помощью молекулярных ISSR маркеров. Введены в культуру in vitro особи двух генетически контрастных популяций охраняемого вида T. suaveolens. Исходным материалом для клонального микроразмножения служили проростки, полученные из зрелых семян после трех месяцев культивирования при пониженных температурах. Выбор протокола клонального микроразмножения был обусловлен литературными данными. Основные этапы морфогенеза in vitro у проростков из обеих популяций T. suaveolens происходили синхронно в полном соответствии с протоколом. Доказано, что формирование микролуковичек происходит путем прямого органогенеза. Несмотря на морфологическое соответствие регенерантов интактным растениям, ISSR анализ показал достаточно высокий уровень (13.9–15.8%) сомаклональной изменчивости. В ISSR-спектрах растений-регенерантов были обнаружены уникальные фрагменты, полностью отсутствующие у особей донорной популяции.
ВВЕДЕНИЕ
Наряду с традиционными способами сохранения биоразнообразия растительного мира, такими как создание особо охраняемых природных территорий, сохранение коллекций растений в ботанических садах и создание банка семян, в настоящее время широко используются методы биотехнологии растений, а именно поддержание культур редких видов на питательной среде в генетических банках in vitro (IPGRI…, 2003; Белокурова и др., 2005; Molkanova et al., 2010). Однако прежде чем система in vitro может быть приспособлена для сохранения генофонда, она должна удовлетворять ряду требований, важнейшими из которых являются введение материала в культуру in vitro, разработка эффективного способа регенерации растений для каждого закладываемого на хранение образца и генетическая стабильность полученной культуры (Molkanova et al., 2010, 2018; Генофонд…, 2012).
Tulipa suaveolens Roth (=T. schrenkii Regel) является высоко декоративным луковичным поликарпиком семейства Liliaceae и гипотетическим родоначальником садового T. × gesneriana L. (Mordak, 1990; The Plant List, 2018). Нарушение естественных степей приводит к сокращению численности его популяций, поэтому вид занесен в Красные книги Российской Федерации, Украины, Казахстана и Азербайджана.
Имеющиеся в литературе данные, касающиеся клонального микроразмножения T. suaveolens, указывают на крайне низкие показатели регенерации и скорости роста in vitro (Moskov et al., 1980). Низкий регенерационный потенциал тюльпанов в целом отмечался многими авторами (Wilmink et al., 1995; Podwyszyńska, Marasek, 2003; Ptak, Bach, 2007; Maślanka, Bach, 2010). Во всех перечисленных работах первичными эксплантами для введения в культуру in vitro являлись фрагменты луковиц или цветка. Для редкого вида T. suaveolens и тот, и другой вариант не представляется возможным. Изъятие достаточного для охвата генетического разнообразия популяции количества луковиц может нанести ей существенный урон. Части цветков невозможно доставить до лаборатории в приемлемом виде. К тому же, одна из перечисленных методик получения микролуковичек (Podwyszyńska, Marasek, 2003) позже была подвергнута критике (Podwyszyńska, 2005). Основаниями для критики стали обнаруженные в ходе наблюдений за регенерантами отклонения от исходных материнских форм, проявляющиеся в изменении цвета и формы цветка, вариегатности листьев, появлении аномальных цветков.
Достаточно эффективный протокол клонального микроразмножения был разработан Akhmetova et al. (2007) для гибридных форм тюльпанов. В качестве первичных эксплантов авторы использовали изолированные зародыши. Формирование побегов происходило как путем прямой регенерации, так и через каллусогенез. Позже методика была модифицирована, и в качестве первичных эксплантов стали использовать сегменты семядолей и чешуи микролуковиц, полученные из проростков, выращенных из зрелых семян тюльпанов (Ахметова, Миронова, 2008). Путем прямого органогенеза получены полноценные растения-регенеранты, которые в последующем успешно выдержали адаптацию к нестерильным условиям. При этом на предмет анатомических особенностей и сомаклональной изменчивости регенеранты не проверяли.
Похожие результаты получены на культуре T. tarda (Maślanka, Bach, 2014). В одном из вариантов эксперимента авторы так же использовали проростки. Формирование побегов происходило как путем прямой регенерации, так и через каллусогенез. Анатомическое исследование показало, что полученные in vitro микролуковички имели апикальную меристему, свойственную нормально сформированным луковицам. При этом отсутствовали кроющие чешуи, что объясняется высокой влажностью внутри культуральных чашек Петри.
Известно, что предпочтительными инициальными структурами для клонального микроразмножения являются меристематические ткани растений, так как они, в отличие от каллуса, остаются генетически стабильными в течение множественных субкультивирований (Бутенко, 1999). При культивировании растений с целью сохранения биологического разнообразия этот фактор является ключевым. В этом отношении наиболее оптимальным следует считать протокол Ахметовой и Мироновой (2008). Однако остается открытым вопрос об уровне сомаклональной изменчивости.
Мощным инструментом при выявлении сомаклональной изменчивости является фрагментный анализ ДНК, например, RAPD (Random Amplified Polymorphic DNA) или ISSR (Inter Simple Sequence Repeats). В данном случае происходит изменение сайта узнавания праймера, – в результате чего он не отжигается на ДНК мутантной пробы по сравнению с контролем, – либо его делеция, либо инсерция, в результате которых изменяется длина амплифицированного фрагмента (Куцев, 2009). На примере Lilium tsingtauense (Liliaceae) было показано, что ISSR-маркеры являются более воспроизводимыми при выявлении сомаклональной изменчивости, чем RAPD (Yang et al., 2010).
Цель данной работы состояла в получении растений-регенерантов T. suaveolens in vitro, изучении особенностей морфогенеза и в оценке их генетической стабильности с помощью молекулярных ISSR-маркеров.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор материала и введение в культуру in vitro
Исследования проводили в 2016–2018 гг. с использованием общепринятых приемов работы с культурами тканей и органов растений (Бутенко, 1999).
Руководствуясь правилами сбора редких и исчезающих видов растений для ботанических садов (Горбунов и др., 2008), в качестве исходных эксплантов брали зрелые семена растений. Сбор семян T. suaveolens проводили в середине-конце июня из генетически контрастных, согласно результатам ISSR анализа (Kritskaya et al., 2018), популяций из Хвалынского (2 км южнее с. Черный затон) и Озинского р-нов (окрестности урочища “Синяя гора”) Саратовской области.
Перед началом стерилизации семена погружали в мыльный раствор и перемешивали на лабораторной качалке 30 мин. После этого их многократно промывали дистиллированной водой. Затем семена обрабатывали 96%-ным этиловым спиртом в течение 30 с, переносили в 1.25% раствора NaOCl (“Электра”, Волгоград) и перемешивали 15 мин на шейкере. На завершающем этапе стерилизации семена трехкратно промывали стерильной дистиллированной водой.
В условиях ламинарного бокса (“Lamsystems”, Россия) семена помещали на питательную среду Мурасиге и Скуга (Murashige, Skoog, 1962) без гормоноподобных регуляторов роста. Пробирки с семенами переносили в фитотрон с температурой 5 ± 1°C для холодной стратификации согласно справочнику по прорастанию семян (Николаева и др., 1999).
Через три месяца сформированные проростки пересаживали в новые пробирки на питательную среду для микроразмножения согласно протоколу Ахметовой и Мироновой (2008).
Микроразмножение и морфогенез
Методика состоит из трех последовательных этапов, на всех этапах базовой является среда Мурасиге и Скуга. На первом этапе проростки тюльпанов помещали на питательную среду с БАП 0.2 мг/л + + НУК 0.5 мг/л (Var1) или БАП 0.5 мг/л + + НУК 1.0 мг/л (Var2) и культивировали в условиях 16-часового фотопериода (светодиодные лампы Uniel LED-M80-20W/SP/E27/CL, КНР) и температуры 25 ± 1°C в течение 2.5 мес. На следующем этапе полученные побеги длиной 20–30 мм пересаживали на среду, содержащую 5% сахарозы, и дополненную индолил-3-масляной кислотой 0.5 мг/л. Пробирки ставили в холодильный шкаф (5 ± 1°C без освещения) на 10–12 нед. По истечении рекомендованного времени пробирки с регенерантами вновь переносили в стандартные условия (16-часовой фотопериод и температура 25 ± 1°C) и культивировали еще 8–10 недель до полного формирования микролуковичек (Ахметова, Миронова, 2008).
Эксперимент выполнялся в трех повторностях, на каждую повторность брали не менее 10 проростков.
Для изучения особенностей морфогенеза на каждом из этапов фиксировали по 10 культивируемых образцов в смеси формалина, ледяной уксусной кислоты и 50% этилового спирта в объемном соотношении 4 : 1 : 10 (ФУС) в течение 3 ч. Фиксированный материал переносили в раствор глицерин–спирт в соотношении 1 : 1. Подготовленные таким образом образцы изучали под стереомикроскопом Stemi 2000-CS (Carl Zeiss, Germany). Анатомические срезы готовили при помощи ротационного микротома согласно общепринятым методикам (Дженсен, 1965). В качестве контроля использовали проростки, выращенные на питательной среде без гормоноподобных регуляторов роста.
ISSR анализ
Для тестирования на предмет сомаклональной изменчивости были выбраны полностью сформированные растения-регенеранты (по 6 шт. от каждого варианта эксперимента), полученные от образцов донорной популяции из Озинского р-на Саратовской области, и сами исходные растения популяции в качестве контроля (10 особей).
ДНК выделяли с использованием набора NucleoSpin® Plant II (MACHEREY-NAGEL, Германия) согласно протоколу производителя. ПЦР проводили в амплификаторе Mastercycler gradient (Eppendorf, Germany) с 10 ISSR-праймерами (табл. 1), выбранными нами ранее для T. suaveolens (Кашин и др., 2016) и синтезированными ЗАО “Синтол” (Москва).
Таблица 1.
ISSR-праймеры, выявляющие полиморфизм ДНК T. suaveolens
| Название праймера | Последова-тельность (5′-3′) | Наличие сомаклональной вариабельности |
|---|---|---|
| UBC810 | (GA)8T | – |
| UBC811 | (GA)8C | + |
| UBC816 | (CA)8T | – |
| UBC824 | (TC)8G | + |
| UBC827 | (AC)8G | – |
| UBC836 | (AG)8YT | + |
| UBC841 | (GA)8YT | + |
| UBC843 | (CT)8RA | + |
| UBC845 | (CT)8RG | + |
| UBC851 | (GT)8YG | – |
ПЦР проводили в объеме 20 мкл. Реакционная смесь содержала 4 мкл готовой реакционной смеси MaGMix (по 200 мкM каждого dNTP, 1.5 мM MgCl2, 1.5 ед. SmarTaqDNA-полимеразы и буфер; Dialat Ltd., Москва, Россия), 15 мкл деионизированной воды, 3.4 пмоль каждого праймера и 1 мкл исходной ДНК. ПЦР проводили по следующему алгоритму: изначальная денатурация в течение 5 мин при 95°C, затем 35 циклов по 30 с при 95°C, 30 с при 44°C и 2 мин при 72°C, с финальной элонгацией в течение 10 мин при 72°C.
Разделение продуктов амплификации проводили электрофоретически в 2%-ном агарозном геле в 0.5× ТВЕ-буфере. Готовый гель окрашивали бромистым этидием, фрагменты ДНК анализировали с помощью трансиллюминатора (Vilber Lourmat, Франция) и фотографировали с помощью гель-документирующей системы (Doc-print VX2, Германия). Фотографии гелей анализировали в программе Corel DRAW X8. Типирование ISSR-фрагментов было представлено в виде матрицы наличия или отсутствия бэндов, закодированных как “1” или “0” соответственно.
Долю полиморфных фрагментов (P) определяли по формуле:
Анализ полученной матрицы проводили в программе PAST 3 (Hammer et al., 2001) кластеризацией методом невзвешенного попарно-группового среднего (UPGMA) с использованием коэффициента Жаккара и в программе TFPGA 1.3 (Miller, 1997) – с использованием генетических дистанций Нэи (Nei, 1972, 1978).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Введение в культуру in vitro
Доля семян, свободных от инфекции, при использовании изложенной выше методики стерилизации составила 100% для обеих популяций. Начало прорастания семян наблюдали на 29-е сутки стратификации. Через три месяца стратификации проростки приобретали зеленую окраску и формировали собственные корни. Всхожесть семян составила от 72 до 100%, что согласуется с предыдущими данными по лабораторной всхожести семян T. suaveolens (Кашин и др., 2016), полученными в результате простого проращивания их на чашках Петри.
Микроразмножение и морфогенез
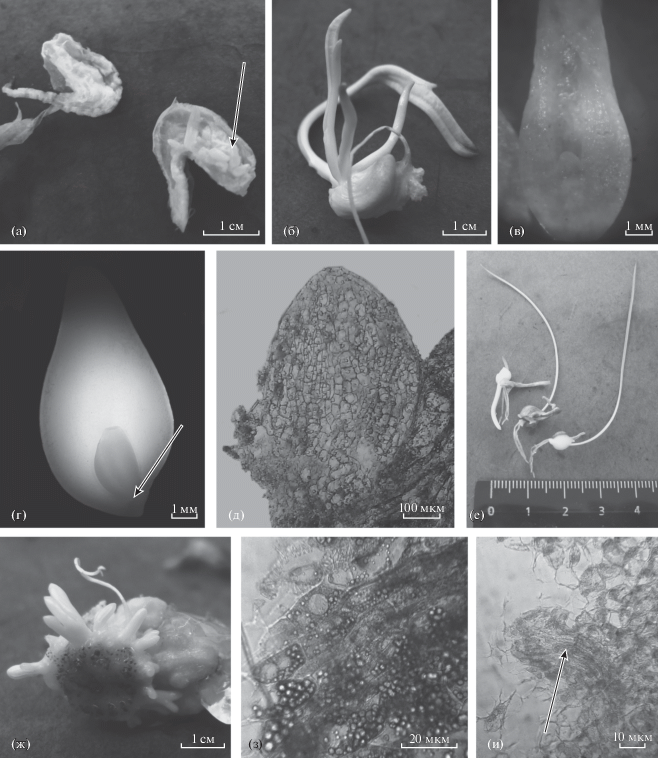
Основные этапы морфогенеза in vitro у обеих популяций T. suaveolens выделялись в соответствии с вышеизложенным протоколом микроразмножения (Ахметова, Миронова, 2008). На первом этапе наблюдали разрастание кроющей чешуи проростков, имеющей вид полого мешка, с последующим формированием на ее внутренней поверхности множества адвентивных почек (рис. 1а), которые затем прорастали и развивали листовые структуры длиной 20–30 мм (рис. 1б). Формирующиеся микропобеги разрывали общую кроющую чешую, оставаясь при этом прикрепленными к ней. В основании микропобегов отмечалось образование веретеновидного тупо заостренного вздутия, представляющего собой новую формирующуюся микролуковицу, включающую в себя на этом этапе органогенеза стенку собственной кроющей чешуи и почку (рис. 1в). В некоторых случаях формирование микропобегов происходило на наружной поверхности кроющей чешуи в месте ее контакта с питательной средой (рис. 1ж). При этом ткани контактирующей поверхности сильно разрастались и становились рыхлыми по аналогии с тканями каллусного типа. Однако анатомическое исследование показало отсутствие каллуса внутри таких образцов и на их поверхности. По морфологическим признакам клетки, составляющие разросшуюся ткань, сходны с клетками кроющей чешуи, отличающейся от клеток других тканей содержанием в цитоплазме многочисленных крахмальных зерен (рис. 1з). Также в тканях были обнаружены проводящие ксилемные элементы, подходящие к каждому развивающемуся микропобегу (рис. 1и). Микропобеги имели такое же анатомическое строение, как и описанные выше микропобеги, сформированные на внутренней стороне кроющей чешуи. То есть в обоих вариантах развитие происходит на кроющей чешуе путем прямого органогенеза.
Рис. 1.
Этапы морфогенеза T. suaveolens in vitro: (а) – формирование адвентивных почек на внутренней стороне кроющей чешуи проростка; (б) – проросток с микропобегами; (в) – начальная стадия формирования микролуковицы (продольный срез основания микропобега); (г) – полностью сформированная микролуковица с почкой (продольный срез); (д) – продольный срез покоящейся почки; (е) – микролуковицы с проросшей почкой и придаточными корнями; (ж) – микропобеги, развивающиеся в месте контакта наружной поверхности кроющей чешуи с питательной средой; (з) – строение клеток кроющей чешуи; (и) – ксилемный элемент в тканях образца.
Среднее число побегов на один проросток составило 4.8 ± 0.8 шт. для варианта питательной среды с БАП 0.2 мг/л + НУК 0.5 мг/л, и 7.9 ± 0.5 шт. – для варианта с БАП 0.5 мг/л + НУК 1.0 мг/л. Частота побегообразования = 65.7%.
В течение последующих двух этапов на отсаженных микропобегах происходило окончательное формирование микролуковиц, состоящих из почки и нескольких чешуй (рис. 1г, 1д), которые прорастали к концу последнего этапа и не отличались морфологически от интактных растений ювенильного возрастного состояния (рис. 1е).
У контрольной группы на внутренней поверхности кроющей чешуи проростка развивалась одна единственная микролуковица, которая так же по морфологии не отличалась от луковиц интактных растений.
В целом, апробированный протокол клонального микроразмножения является эффективным для T. suaveolens и позволяет массово получать посадочный материал данного вида через прямой органогенез.
ISSR анализ
Всего в результате ПЦР образцов ДНК исходной природной популяции T. suaveolens Озинского района Саратовской области (Ozn) и растений-регенерантов, полученных при использовании двух вариантов питательных сред (Var1 и Var2), с десятью праймерами получен 101 ISSR-фрагмент длиной 300–2500 пн. ISSR-спектры растений-доноров и прошедших культуру in vitro растений-регенерантов сходны, но не идентичны (рис. 2).
Рис. 2.
ISSR-спектр разных генотипов T. suaveolens, полученный при использовании праймера UBC824. М – маркер молекулярного веса; К – отрицательный контроль; 1–10 – особи донорной популяции Озинского района Саратовской области; 11–16 – растения-регенеранты (11–13 – Var1; 14–16 – Var2). Стрелки указывают на отсутствующие у донорной популяции фрагменты.
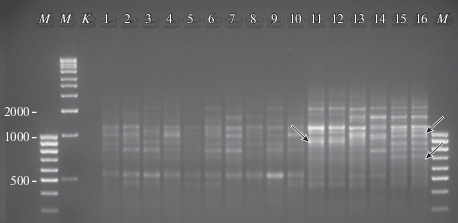
В ISSR-спектрах растений-регенерантов были обнаружены уникальные фрагменты, отсутствующие как у особей донорной популяции, так и у особей смежных популяций, изученных ранее (Крицкая и др., 2018). Их доля составила 13.9% у регенерантов Var1 и 15.8% – у регенерантов Var2. Четыре фрагмента (3.9%), напротив, присутствовали во всех донорных генотипах и полностью отсутствовали у регенерантов. Генетические дистанции Нэи (Nei, 1972, 1978) между исследуемыми выборками приведены в табл. 2.
Таблица 2.
Усредненные генетические дистанции (ниже диагонали) и идентичность (выше диагонали) Нэи (Nei, 1972, 1978) между экспериментальными выборками T. suaveolens
| Ozn | Var1 | Var2 | |
|---|---|---|---|
| Ozn | – | 0.7170 | 0.7515 |
| Var1 | 0.3327 | – | 0.7612 |
| Var2 | 0.2857 | 0.2728 | – |
Из таблицы видно, что в целом, генетическая идентичность регенерантов, полученных в разных вариантах эксперимента, между собой выше этого показателя между ними же и исходными растениями-донорами. Из этого следует, что в культуре in vitro происходит селекция генотипов T. suaveolens или они претерпевают сходные изменения. Это также хорошо видно на UPGMA дендрограмме (рис. 3). Регенеранты образовали отдельный кластер, достоверно различающийся (индекс бутстрепа 100%) от кластера, состоящего из образцов популяции-донора. Природные образцы, несмотря на внутрипопуляционный полиморфизм, сформировали четкий однородный кластер.
Рис. 3.
UPGMA-дендрограмма, построенная на основе ISSR данных для T. suaveolens, с использованием коэффициента Жаккара. Бутстреп = 100 реплик, показана только достоверная бутстреп-поддержка – более 70%. Ozn – особи донорной популяции; Var1 – регенеранты, образованные на питательной среде с БАП 0.2 мг/л + НУК 0.5 мг/л и Var2 – регенеранты, образованные на питательной среде с БАП 0.5 мг/л + НУК 1.0 мг/л.

ISSR анализ показал достаточно высокий уровень сомаклональной изменчивости растений-регенерантов T. suaveolens, полученных в результате одного полного цикла клонального микроразмножения in vitro. Известно, что при увеличении количества циклов микроразмножения доля сомаклональной изменчивости, как правило, тоже возрастает. Например, было показано, что регенеранты сортовой линии кукурузы, выделенные из каллусов после 8-месячного культивирования, сильнее отличались от исходной линии и между собой по сравнению с регенерантами, полученными из 2-месячных каллусных культур (Осипова и др., 2003). У сортовых линий тюльпанов “Blue Parrot” и “Prominence”, размножаемых in vitro с использованием тидиазурона, в течение первых трех лет культивирования сомаклональная изменчивость не превышала 3.3%, а на четвертый год резко возрастала до 100% у сорта “Blue Parrot” и 51.4% – у сорта “Prominence” (Podwyszyńska, 2005). Существует гипотеза, согласно которой есть определенный “порог” сомаклональной изменчивости – аналог “бутылочного горлышка” эволюции, пройти через который могут только жизнеспособные сомаклоны, в то время как клетки, содержащие вредоносные мутации, погибают (Wang, Wang, 2012). В итоге такой естественный отбор in vitro должен привести к стабилизации культуры. Это объясняет согласованность генотипических изменений, обнаруженную у регенерантов в нашем эксперименте.
ЗАКЛЮЧЕНИЕ
Таким образом, при клональном микроразмножении наблюдается селекция и модификация генотипов T. suaveolens, что противоречит основной миссии генетических банков. Во-первых, уже на уровне проростков происходит отбор генотипов, и 34.3% из них не отзываются на воздействие экзогенных регуляторов роста и не дают микропобегов. Во-вторых, полученные в результате регенерации микролуковички обладают уникальными апликонами, не обнаруженными в ISSR-спектрах исходной природной популяции и ближайших к ней популяций, изученных ранее. По этим причинам создание генетического банка in vitro для сохранения генофонда T. suaveolens, по крайней мере, с использование клонального микроразмножения по апробированному в данной работе протоколу видится нецелесообразным. Учитывая подверженность тюльпанов, выращиваемых в коллекциях ex situ, вирусным заболеваниям, в качестве основных мероприятий по сохранению генофонда T. suaveolens следует рекомендовать создание, поддержание и мониторинг особо охраняемых природных территорий с восстановлением численности популяций этого вида.
В целях разработки технологии, позволяющей эффективное сохранение генофонда T. suaveolens в генетическом банке in vitro, необходим поиск новых регуляторов роста растений и их сочетаний, которые бы не оказывали мутагенного действия на геном. Тем не менее, вышеизложенный протокол клонального микроразмножения является высоко эффективным и может быть использован для поддержания или получения новых селекционных форм с их последующей мультипликацией.
Работа выполнена при поддержке Российского Фонда Фундаментальных Исследований (грант № 16-04-00142).
Список литературы
Ахметова А.Ш., Миронова Л.Н. Клональное микроразмножение тюльпана сорта Lucky Strike // Биотехнология как инструмент сохранения биоразнообразия растительного мира: матер. II Всерос. науч.-практ. конф. Белгород: Изд-во БелГУ, 2008. С. 148–152.
Белокурова В.Б., Листван Е.В., Майстров П.Д. и др. Использование методов биотехнологии растений для сохранения и изучения биоразнообразия мировой флоры // Цитология и генетика. 2005. № 1. С. 41–51.
Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе: учеб. пособие. М.: ФБК-ПРЕСС, 1999. 160 с.
Генофонд растений Красной книги Российской Федерации, сохраняемый в коллекциях ботанических садов и дендрариев / Отв. редактор Демидов А.С. М.: Товарищество научных изданий КМК, 2012. 220 с.
Горбунов Ю.Н., Дзыбов Д.С., Кузьмин З.Е. и др. Методические рекомендации по реинтродукции редких и исчезающих видов растений (для ботанических садов). Тула: Гриф и К, 2008. 56 с.
Дженсен У. Ботаническая гистохимия. М.: Мир, 1965. 377 с.
Кашин А.С., Крицкая Т.А., Петрова Н.А. и др. Тюльпан Геснера в Саратовской области и на прилегающей территории: распространение, разнообразие, состояние популяций. Саратов: Изд-во Сарат. ун-та, 2016. 100 с.
Куцев М.Г. Фрагментный анализ ДНК растений: RAPD, DAF, ISSR. Барнаул: ARTIKA, 2009. 164 с.
Николаева М.Г., Лянгузова И.В., Поздова Л.М. Биология семян. СПб.: РАН., Ботан. ин-т им. В.Л. Комарова, 1999. 232 с.
Akhmetova A.Sh., Baiburina R.K., Mironova L.N. In vitro propagation of clones of Tulipa L. hybrid forms // Biotechnology in Russia. 2007. V. 2. P. 1–7.
IPGRI Handbooks for Genebanks № 6: A Guide to Effective Management of Germplasm Collections / Eds. Engels J.M.M., Visser L. Rome: IPGRI, 2003. 172 p.
Hammer O., Harper D.A.T., Ryan P.D. PAST: Palaeontological Statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. № 1. P. 9.
Kritskaya T.A., Kashin A.S., Schanzer I.A. et al. Genetic differentiation of Tulipa suaveolens (Liliaceae) in the North-East of its range in the European part of Russia // Botanicheskii Zhurnal. 2018. V. 103. № 2. P. 187–201.
Maślanka M., Bach A. The effect of abscisic acid, ethylene and inhibitors of their biosynthesis (Fluridone and salicylic acid) on somatic embryos conversion in tulips // Ecological Chemistry and Engineering. 2010. V. 17. P. 1135–1139.
Maślanka M., Bach A. Induction of bulb organogenesis in in vitro cultures of tarda tulip (Tulipa tarda Stapf.) from seed-derived explants // In Vitro Cellular & Developmental Biology – Plant. 2014. V. 50. P. 712–721.
Miller M.P. Tools for population genetic analyses (TFPGA) 1.3: A Windows program for the analysis of allozyme and molecular population genetic data / Computer software distributed by author, 1997.
Molkanova O., Egorova D., Mitrofanova I. Preservation characteristics of valuable plant species in in vitro genebanks at russian botanical gardens // In Vitro Cellular & Developmental Biology – Plant. 2018. V. 54 (Suppl. 1): S1. P. S46.
Molkanova O.I., Korotkov O.I., Vetchinkina E.M. et al. The gene banks: problems of formation, preservation and use // Bulletin of Udmurt University. Series Biology. Earth Science. 2010. V. 3. P. 33–39.
Mordak H. Quid est Tulipa schrenkii Regel et T. heteropetala Ledeb. (Liliaceae)? Novosti Sistematiki Vysshikh Rastenij. 1990. V. 27. P. 27–32.
Moskov I., Savova I., Boshniakova P. et al. In vitro induction of organogenesis and callus in some bulb plants. I. Hyacinth (Hyacinthus orientalis L.), snowdrop (Galanthus nivalis L.) and tulip (Tulipa schrenkii L.) // Fiziologiia na rasteniiata (Sofiia). 1980. V. 6. № 1. P. 67–75.
Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Plant Physiology. 1962. V. 15. № 13. P. 473–497.
Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals // Genetics. 1978. V. 89. P. 583–590.
Nei M. Genetic distance between populations // American Naturalist. 1972. V. 106. № 949. P. 283–292.
Osipova E.S., Koveza O.V., Troitskij A.V. et al. Analysis of specific RAPD and ISSR fragments in maize (Zea mays L.) somaclones and development of SCAR markers on their basis // Russian J. Genetics. 2003. V. 39. № 12. P. 1412–1419.
Podwyszyńska M., Marasek A. Effects of thidiazuron and paclobutrazol on regeneration potential of tulip flower stalk explants in vitro and subsequent shoot multiplication // Acta Societatis Botanicorum Poloniae. 2003. V. 72. P. 181–190.
Podwyszyńska M. Somaclonal variation in micropropagated tulips based on phenotype observation // J. Fruit and Ornamental Plant Research. 2005. V. 13. P. 109–122.
Ptak A., Bach A. Somatic embryogenesis in tulip (Tulipa gesneriana L.) flower stem cultures // In Vitro Cellular & Developmental Biology – Plant. 2007. V. 43. P. 35–39.
The Plant List. [Интернет-ресурс] URL: http://www.theplantlist.org/tpl1./record/kew-290014. Дата публикации: 23.03.2012. Дата обращения: 10.12.2018.
Wang Q.M., Wang L. An evolutionary view of plant tissue culture: somaclonal variation and selection // Plant Cell Reports. 2012. V. 31. № 9. P. 1535–1547.
Wilmink A., Van de Ven B.C.E., Custers J.B.M. et al. Adventitious shoot formation in tulip: histological analysis and response to selective agents // Plant Science. 1995. V. 110. P. 155–164.
Yang W.R., Zhang Q.X., Pan H.T. et al. In vitro regeneration of Lilium tsingtauense Gilg. and analysis of genetic variability in micropropagated plants using RAPD and ISSR techniques // Propagation of Ornamental Plants. 2010. V. 10. № 2. P. 59–66.
Дополнительные материалы отсутствуют.


