Онтогенез, 2019, T. 50, № 6, стр. 383-397
Эволюция жизненных циклов Metazoa и происхождение пелагических личинок
В. В. Малахов a, Е. В. Богомолова a, Т. В. Кузьмина a, Е. Н. Темерева a, *
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские Горы, 1, Россия
* E-mail: temereva@mail.ru
Поступила в редакцию 04.05.2019
После доработки 31.05.2019
Принята к публикации 07.06.2019
Аннотация
На основе различных гипотез происхождения многоклеточных животных проанализирована проблема происхождения жизненного цикла Metazoa. В соответствии с гипотезами гастреи и фагоцителлы исходный жизненный цикл предков Metazoa – голопелагический. В рамках гипотез первичной седентарности предок Metazoa имел пелагобентический жизненный цикл с расселительными личинками – синзооспорами. В соответствии с этой гипотезой Eumetazoa происходят от прогенетических личинок седентарного предка. Исходный жизненный цикл Eumetazoa (многоклеточных животных, обладающих нервной системой, мускулатурой, ртом и кишечником) – это голопелагический жизненный цикл. Именно такой жизненный цикл свойствен Ctenophora, которые являются наиболее рано обособившейся ветвью Eumetazoa. Cnidaria и Bilateria являются сестринскими группами. Их общий предок приобрел пелаго-бентический жизненный цикл de novo. Пелагическая часть жизненного цикла Cnidaria включает только бластулы и гаструлы. У части Anthozoa сохраняются планктотрофные гаструлы. Планулы Medusozoa – это лецитотрофные личинки с упрощенным строением, они утратили расселительную функцию в связи с появлением в жизненном цикле стадии медузы. У трехслойных Bilateria произошла пролонгация пелагической части жизненного цикла за счет появления ресничных билатерально-симметричных личинок, которые в действительности представляют собой ювенильные формы, поднятые в толщу воды. Этот филогенетический модус может быть обозначен специальным термином “ларвализация”. Таким образом, личинки всех трехслойных билатерий имеют общее происхождение от ювенильных стадий общего предка билатерий. Их ресничные шнуры произошли от видоизмененых ресничных щупалец ювенильных стадий общего предка Bilateria. Прослежены гомологичные элементы в ресничных шнурах личинок Trochozoa и Deuterostomia.
ВВЕДЕНИЕ
Проблема эволюция жизненных циклов Metazoa и происхождение их пелагических личинок – это один из “вечных” вопросов сравнительной эмбриологии беспозвоночных. Как известно, существует две точки зрения на проблемы первичного жизненного цикла и происхождения пелагических личинок. Выдающийся российский эмбриолог П.П. Иванов считал, что прямое развитие первично и что “личинка появляется в развитии животного потому, что питательного материала, накапливающегося в ооците в период желткообразования, недостаточно для полного завершения зародышем своего развития, и он выходит из яйца на более или менее ранней эмбриональной стадии” (Иванов, 1937, с. 95). Мнение о том, что прямое развитие или развитие с непитающимися лецитотрофными личинками первичны для многоклеточных, а планктотрофные личинки возникали независимо и несколько раз, широко распространено в литературе (см., например, Salvini-Plawen, 1980; Иванова-Казас, 1987, 1988, 1995; Willmer, 1990; Haszprunar et al., 1995; Jenner, 2000; Hadfield et al., 2001; Sly et al., 2003; Raff, 2008; Raff, Raff, 2009 и др.).
Прямо противоположная точка зрения в те же годы была высказана И.И. Ёжиковым, который полагал, что если “развитие имеет примитивный характер, то каждая стадия ведет свободный образ жизни и самостоятельно поддерживает свое существование” (Ёжиков, 1939, с. 261). Многие авторы придерживались мнения, что жизненный цикл с планктотрофными личинками – это первичная черта многоклеточных животных и что переход к лецитотрофным личинкам и прямому развитию происходил в эволюции многократно в разных эволюционных ветвях Metazoa (Thorson, 1946; Jagersten, 1955, 1959, 1972; Strathmann, 1978, 1985, 1993; Nielsen, 1985, 1987, 1998, 2012, 2013; Nielsen, Norrevang, 1985; Davidson et al., 1995; Peterson et al., 1997; Peterson, Davidson, 2000; Erwin, Davidson, 2002).
Попытки разобраться в этом вопросе неизбежно заставляют нас обратиться к проблеме происхождения многоклеточных животных и их жизненных циклов.
ПРОБЛЕМА ПРОИСХОЖДЕНИЯ МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ И ИХ ЖИЗНЕННЫХ ЦИКЛОВ
Многочисленные гипотезы происхождения многоклеточных животных в свое время были рассмотрены А.В. Ивановым (1968), работа которого до сих остается самым подробным обзором на тему происхождения Metazoa. Мы не будем здесь рассматривать гипотезы происхождения Metazoa от многоядерных инфузорий путем целлюляризации (см., например, Hadzi, 1944, 1953, 1963), поскольку в настоящее время они утратили научное значение и представляют интерес только в историческом плане. Среди гипотез происхождения Metazoa от колоний одноядерных протистов можно выделить две группы гипотез, которые целесообразно назвать гипотезами первичной мобильности и гипотезами первичной седентарности.
К гипотезам первичной мобильности относятся две до сих популярные гипотезы: гипотеза гастреи, разработанная Э. Геккелем (Haeckel, 1874), и гипотеза фагоцителлы, предложенная И.И. Мечниковым (Metschnikoff, 1886). Обе гипотезы в оригинале можно найти в первоисточниках (Haeckel, 1874; Мюллер, Геккель, 1940; Metschnikoff, 1886; Мечников, 1950), а подробный их пересказ – в книге А.В. Иванова (1968). Обе гипотезы имели и имеют многочисленных сторонников и противников, которые их развивали, модифицировали и критиковали, однако рамки настоящей статьи не позволяют углубляться в эти интересные вопросы. Ниже мы упоминаем только те аспекты гипотез, которые важны для обсуждаемой проблемы.
В обеих гипотезах предполагается, что предком многоклеточных животных была активно плавающая в толще воды колония гетеротрофных жгутиконосцев (рис. 1, 2). Колония с небольшим числом клеток в гипотезе гастреи получила название “Морея” (от стадии морулы в дроблении многоклеточных). Более поздняя филогенетическая стадия – шарообразная колония – “Бластея” (от стадии бластулы). В дальнейшем на переднем полюсе такой колонии появилось впячивание – первичный кишечник, соединенный с внешней средой первичным ртом. Такой гипотетический двухслойный предок с двумя эпителиальными слоями, ртом и хорошо выраженной полостью кишечника был назван “Гастреей” (рис. 1).
В гипотезе гастреи предки Metazoa имели голопелагический жизненный цикл. В соответствии с пелагическим образом жизни бластея и гастрея обладали радиальной симметрией. Позднее, как надставка над голопелагическим жизненным циклом, появилась донная стадия. Геккель (Haeckel, 1874) рассматривал губок и кишечнополостных как наиболее примитивных многоклеточных, сохранивших организацию гастреи во взрослом состоянии (рис. 1). Согласно авторам более поздних работ, от радиально-симметричной пелагической гастреи, перешедшей к донному существованию, произошли предки Bilateria, у которых, таким образом, сформировался пелаго-бентический жизненный цикл (см., например, Nielsen, 1985, 1987, 1998, 2012, 2013).
В одной из широко известных модификаций гипотезы гастреи предполагалось, что переход к донному существованию произошел не на стадии гастреи, а на стадии бластеи: так возникла билатеробластея, из которой впоследствии сформировалась билатерогастрея (Jagersten, 1955, 1959, 1972). В дальнейшем от билатерогастреи произошли как трехслойные Bilateria, так и двухслойные организмы (Cnidaria и Ctenophora), а также губки. В гипотезе билатерогастреи предполагалось, что первичный жизненный цикл предков Metazoa – голопелагический, а пелаго-бентический цикл сформировался уже на стадии бластулообразных предков (Jagersten, 1955, 1959, 1972).
В гипотезе фагоцителлы (Metschnikoff, 1886; Мечников, 1950) предками многоклеточных считались шаровидные колонии жгутиконосцев, которые питались путем фагоцитоза, т.е. захвата пищевых частиц отдельными клетками – членами колонии (рис. 2). Наглотавшиеся пищевых частиц клетки теряли жгутики и погружались внутрь колонии, формируя внутреннюю массу амебоидных клеток. В дальнейшем такая временная дифференцировка стала постоянной: наружный жгутиковый слой (кинобласт) обеспечивал локомоцию, а клетки внутренней массы (фагоцитобласта) – переваривание пищевых частиц, которые они захватывали через поры между клетками кинобласта. Такой гипотетический предок с наружным жгутиковым эпителием и внутренней массой амебоидных клеток-фагоцитов был назван “фагоцителлой”. В дальнейшем на заднем полюсе фагоцителлы возник участок, где амебоидные клетки фагоцитобласта особенно активно захватывали пищевые частицы – прообраз первичного рта, однако этот рот вел не в кишечник, а к амебоидным клеткам фагоцитобласта (рис. 2).
Гипотеза фагоцителлы была разработана И.И. Мечниковым (1886) на основе его собственных исследований эмбриогенеза Hydrozoa. В эмбриональном развитии гидроидных не встречается такой способ формирования энтодермы, как впячивание стенки бластулы (инвагинация). И.И. Мечников (1886) считал, что Hydrozoa – самая примитивная группа стрекающих кишечнополостных, и потому рассматривал инвагинацию как вторичный способ формирования энтодермы, который возник как результат эволюции механизмов процесса гаструляции. И.И. Мечников (1886) и его сторонники рассматривали лишенные рта и кишечника планулы гидроидных и паренхимулы губок как стадии, рекапитулирующие строение гипотетической фагоцителлы.
Заметим, что согласно современным взглядам, Medusozoa (в том числе Hydrozoa) – это апоморфная группа Cnidaria, в жизненном цикле которых появилась дополнительная пелагическая стадия медузы (Collins, 2002; Marques, Collins, 2004; Collins et al., 2006). Планулы Medusozoa – это короткоживущие лецитотрофные личинки, они лишены рта и функционирующего кишечника. Поэтому отсутствие инвагинации, которое характерно для эмбриогенеза Hydrozoa, есть следствие редукции рта и кишечника у лецитотрофной планулы.
Исходя из гипотезы фагоцителлы, предки Metazoa также имели голопелагический жизненный цикл. Пелаго-бентический жизненный цикл возникал несколько раз как надстройка над голопелагическим циклом (см. Иванов, 1968). Фагоцителлы без рта перешли к донному образу жизни и дали начало губкам, фагоцителлы с ротовым отверстием, но без кишечника перешли к ползанию по дну и дали начало бескишечным турбелляриям Acoela (от которых произошли все Bilateria), потомки пелагических фагоцителл, сформировавшие эпителизованный кишечник, прикрепились аборальным полюсом и дали начало предкам Cnidaria (рис. 2).
Гипотезы первичной седентарности также имеют давнюю историю. Большое влияние на развитие эволюционной морфологии имела гипотеза синзооспоры, подробно разработанная А.А. Захваткиным (1949). Согласно этой гипотезе предками Metazoa были колонии донных жгутиконосцев. Они размножались зооспорами, образующимися в результате палинтомического деления зиготы (рис. 3, 1). После периода плавания одиночная жгутиковая зооспора прикреплялась и сначала существовала в виде одиночного прикрепленного жгутиконосца. После оседания одиночной зооспоры за счет монотомического деления формировалась колония. На следующем эволюционном этапе жгутиковые зооспоры, образующиеся в результате палинтомического деления зиготы, не разъединялись, а оставались соединенными (рис. 3, 2). Такая расселительная пелагическая стадия была названа А.А. Захваткиным (1949) синзооспорой. Синзооспора прикреплялась и сразу давала начало не одиночной особи, а колонии жгутиконосцев.
Рис. 3.
Происхождение многоклеточных животных в соответствии с гипотезой первичной седентарности: 1 – колония жгутиконосцев, размножающаяся одиночными зооспорами, 2 – колония жгутиконосцев, размножающаяся синзооспорами, 3 – губки, размножающиеся расселительными личинками – жгутиковыми бластулами (=синзооспорами).

По мнению А.А. Захваткина (1949), бластулообразные личинки, характерные для многих Metazoa, представляют собой не что иное, как синзооспоры. Таким образом, согласно гипотезе синзооспоры, первичный жизненный цикл Metazoa – это пелаго-бентический жизненный цикл. А.А. Захваткин (1949) считал, что гипотеза синзооспоры объясняет, почему низшие многоклеточные, например губки и книдарии, являются прикрепленными организмами. Гипотезу синзооспоры поддержал В.Н. Беклемишев (Beklemishev, 1963; Беклемишев, 1964), который предполагал, что низшие черви (Scolecida) происходят от неотенических планул гидроидных. Сторонником гипотез первичной седентарности был известный зоолог Рейнгардт Ригер (Rieger, 1994), который считал, что можно построить эволюционный ряд прикрепленных колониальных предков разного уровня организации – от низших Metazoa до трехслойных Bilateria, а одиночные подвижные формы представляют собой потомков прогенетических личинок таких колоний. В XXI веке гипотезы первичной седентарности получили новое развитие (Nielsen, 2008; Mikhailov et al., 2009).
В современной трактовке гипотеза первичной седентарности предполагает, что пелаго-бентический жизненный цикл был изначально присущ предкам многоклеточных животных. При этом бластулообразные личинки не рекапитулируют филогенетическую стадию бластеи (как в гипотезах первичной мобильности), а являются чисто расселительными, первично лецитотрофными личинками.
Согласно гипотезе первичной седентарности, предками многоклеточных были донные колонии воротничковых жгутиконосцев, которые, постепенно усложняясь, дали начало современным губкам (рис. 3, 3). Среди губок бластулообразные личинки характерны, например, для Homoscleromorpha и Calcispongia (подробнее см. Ересковский, 2005). При метаморфозе передняя половина личинки впячивается и дает начало хоанодерме, тогда как задняя половина становится зачатком пинакодермы и клеток мезохила. Если представить себе, что такая двухслойная стадия не прикрепилась, а продолжала пелагическое существование, мы получим инвагинационную гаструлу, плавающую ртом вперед.
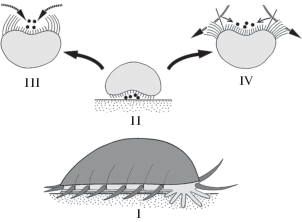
В рамках гипотезы первичной седентарности предполагается, что Eumetazoa происходят от прогенетических личинок губкоподобных организмов (рис. 4). Такие прогенетические пелагические организмы захватывали пищу отверстием, образовавшимся в результате впячивания передней половины бластулы, и переваривали ее в полости, образованной впятившимся эпителием. Таким образом, гипотетический предок Eumetazoa имел организацию геккелевской гастреи, однако по своему происхождению эта гастрея представляла собой прогенетическую личинку губок (см. Nielsen, 2008).
Губки начинают питаться только после прикрепления. Типичным для губок способом питания является фильтрационная микрофагия – т.е. питание очень мелкими пищевыми частицами, которые всасываются через микроскопические поры и захватываются псевдоподиями отдельных клеток. Поскольку предки Eumetazoa были прогенетическими потомками личиночных стадий, первоначально они должны были иметь мелкие размеры. Это означало, что при питании даже мелкой добычей они, по существу, оказывались макрофагами. Возможно, овладение относительно крупной добычей способствовало развитию настоящей мускулатуры и нервной системы, т.е. тех черт, которые наряду с наличием рта и кишечника отличают Eumetazoa от губок.
Исходя из современной версии гипотезы первичной седентарности, предок Eumetazoa должен был обладать следующими чертами:
1) это был двухслойный организм (т.е. имел два эпителизованных слоя: эктодерму и энтодерму – разделенных прослойкой мезоглеи, которая могла содержать клеточные элементы);
2) он вел пелагический образ жизни;
3) он обладал радиальной (осевой) симметрией, которая характерна для первично-пелагических организмов;
4) он имел ресничный способ локомоции;
5) он двигался оральным полюсом вперед.
Есть ли среди современных Eumetazoa хотя бы одна группа, которая обладает таким набором признаков? Такая группа есть, и эта группа – Ctenophora. Разумеется, современные гребневики далеко ушли от гипотетического прототипа, но они остаются двухслойными животными. Типичные представители Ctenophora – планктонные организмы, обитающие в толще воды. Гребневики обладают осевой симметрией, которая сочетается с радиальной симметрией в строении систем органов. Никаких признаков билатеральной симметрии у гребневиков нет. Несмотря на крупные размеры, гребневики сохраняют чисто ресничный способ движения, хотя для локомоции служат не жгутики, как у личинок губок и у гипотетичеких предков Eumetazoa, а весьма специализированные ресничные клетки эпидермиса в составе гребных пластинок. Отметим, что среди Eumetazoa ресничная локомоция характерна для личинок или для очень мелких организмов (коловраток, гастротрих, мелких турбеллярий и других форм, в отношении которых можно предполагать прогенетическое происхождение, – см. Малахов, 2009, 2010). Сохранение у таких крупных организмов, как гребневики, чисто ресничной локомоции – это отголосок их прогенетического происхождения. При нормальной локомоции гребневики движутся оральным полюсом вперед.
Таким образом, Ctenophora оказываются самой базальной группой Eumetazoa (рис. 5), и этот вывод хорошо согласуется с современным представлением об очень раннем обособлении гребневиков, которое поддерживается молекулярной филогенетикой и нейрофилогенетикой (Ryan et al., 2010, 2013; Moroz et al., 2014; Moroz, 2015; Moroz, Kohn, 2015; Jekely et al., 2015; Telford, 2016; Whelan et al., 2015; и др.).
Типичные представители Ctenophora имеют голопелагический жизненный цикл, который, таким образом, оказывается исходным для Eumetazoa. В пределах типа гребневиков у Platyctenida происходит переход к донному образу жизни и, таким образом, формируется пелаго-бентический жизненный цикл. По-видимому, появление пелаго-бентического жизненного цикла у Platyctenida произошло независимо от остальных Eumetazoa. У бентосных гребневиков Platyctenida не выражена передне-задняя полярность и сохраняется осевая симметрия, характерная для их ближайших пелагических предков.
ПРОИСХОЖДЕНИЕ ПЕЛАГО-БЕНТИЧЕСКОГО ЖИЗНЕННОГО ЦИКЛА CNIDARIA И ТРЕХСЛОЙНЫХ BILATERIA
По современным данным (Владыченская и др., 1995; Collins, 1998; Kim et al., 1999; Collins, Valentine, 2001; Halanych, Passamaneck, 2001; Алешин, Петров, 2002; Hejnol et al., 2009; Whelan et al., 2015; Budd, Jensen, 2017 и др.), Cnidaria и трехслойные Bilateria – сестринские группы организмов (рис. 5). В учебниках и руководствах обычно отражены представления о радиальной симметрии Cnidaria. Тем не менее, анализ строения и развития стрекающих кишечнополостных позволяет заключить, что Cnidaria – исходно билатерально-симметричная группа.
Согласно современным данным, базальной группой Cnidaria являются представители подтипа Anthozoa (см. Collins, 2002; Marques, Collins, 2004; Collins et al., 2006). Многочисленные исследования выявили билатеральный характер экспрессии гомеобоксных генов и транскрипционных факторов в развитии Anthozoa (см. Finnerty, Martindale, 1997; Martinez et al., 1998; Finnerty, 2001, 2003; Martindale et al., 2002; Finnerty et al., 2003, 2004; Scholz, Technau, 2003; Martindale et al., 2004; Kusserow et al., 2005; Matus et al., 2006a, 2006b, 2007a, 2007b, 2008; Marlow et al., 2009; Saina et al., 2009; DuBuc et al., 2012; He et al., 2018 и др.). Анализ строения и развития кораллов различных систематических групп позволяет заключить, что все Anthozoa – билатерально-симметричные животные (Малахов, 2016). Этот вывод тем более парадоксален, что все Anthozoa – сидячие формы, а сидячий образ жизни, как известно, способствует развитию радиальной, а не билатеральной симметрии (Беклемишев, 1964).
Одним из возможных эволюционных сценариев (рис. 6), объясняющих филогенетическую близость трехслойных Bilateria и Cnidaria, а также билатеральную симметрию последних, является происхождение обеих групп от двухслойного бентосного предка, передвигавшегося на оральной поверхности (Малахов, 2004, 2010, 2013; Arendt et al., 2015, 2016; Arendt, 2018). Впоследствии предки Cnidaria прикрепились к субстрату аборальным полюсом и стали сидячими организмами, что способствовало развитию вторичной радиальной симметрии (рис. 6, 5, 6). Предположение об исходной билатеральности общего предка Cnidaria и трехслойных Bilateria объясняет, почему базальная группа стрекающих кишечнополостных, а именно Anthozoa, остаются билатерально-симметричными формами, несмотря на их сидячий образ жизни (см. Малахов, 2016). Предки трехслойных Bilateria сохранили подвижный образ жизни (рис. 6, 7). Их щелевидный рот сомкнулся и дал начало сквозному кишечнику, а обособившиеся карманы целентерона – метамерным целомическим полостям (Малахов, 2004, 2010, 2013).
Рис. 6.
Происхождение Cnidaria и трехслойных Bilateria: 1 – пелагический предок Eumetazoa, 2 – Ctenophora, 3 – переход к донному образу жизни, 4 – двуслойный билатерально-симметричный предок Cnidaria и трехслойных Bilateria, ползавший на оральной поверхности, 5, 6 – переход Cnidaria к прикрепленному образу жизни и формирование вторичной радиальной симметрии, 7 – предок трехслойных Bilateria. Толстые стрелки показывают филогенетические трансформации, тонкие стрелки – направление движения организмов.
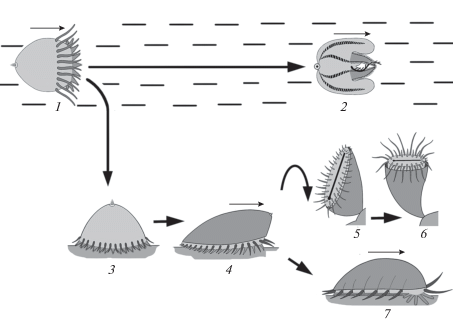
Для современных Anthozoa характерен типичный пелаго-бентический жизненный цикл (рис. 7). У одиночных шестилучевых кораллов Actiniaria пелагический период включает непитающуюся жгутиковую бластулу и планктотрофную гаструлу с хорошо развитой кишечной полостью, ртом и аборальным сенсорным органом. Гаструлообразная личинка актиний оседает на оральную поверхность, некоторое время ползает по дну на оральной поверхности, а затем переворачивается и прикрепляется аборальным органом к субстрату (Gemmil, 1921, 1922). В таком характере метаморфоза личинок актиний трудно не увидеть рекапитуляцию того филогенетического пути, который прошли предки Cnidaria (см. выше).
Рис. 7.
Жизненный цикл шестилучевых кораллов Actiniaria: 1 – взрослая прикрепленная особь, 2 – оплодотворение, 3 – бластула, 4 – планктотрофная гаструла, 5 – оседание личинки на оральную поверхность, 6 – ювенильная особь, прикрепившаяся аборальным полюсом.

Уже у плавающей личинки актиний появляется два мезентерия, придающих личинке билатеральную симметрию, а после оседания число мезентериев закономерно увеличивается, при этом их закладка характеризуется выраженной билатеральной симметрией (Wilson, 1888; Gemmil, 1920, 1921; Nyholm, 1943; Hyman, 1940; Chevalier, Beauvais, 1987; Малахов, 2016).
У одиночных кораллов Ceriantharia в толще воды живут и питаются весьма поздние стадии с большим числом щупалец и мезентериев (Beneden, 1891, 1923; McMurrich, 1910; Carlgren, 1924; Leloup, 1964; Молодцова, Малахов, 1995а, б). В других группах кораллов стадии с таким числом щупалец и мезентериев – это бентосные ювенильные особи. Таким образом, у цериантарий исходно бентосные ювенильные стадии как бы “поднимаются” в толщу воду и превращаются в планктотрофных личинок, претерпевая соответствующие адаптации к планктонному образу жизни. Это филогенетическое явление, а именно пролонгация пелагической части жизненного цикла за счет адаптации исходно бентосных ювенильных стадий к планктонному существованию, может быть обозначено термином “ларвализация”. Как мы увидим, данное явление играет важную роль в происхождении личиночных стадий многоклеточных животных.
В других группах кораллов, например у Octocorallia и Zoantharia, личинки становятся лецитотрофными, утрачивают рот и функционирующий кишечник (Hyman, 1940). Упрощенные лецитотрофные личинки (планулы) характерны для всех Medusozoa. Планулы лишены рта, но это двухслойные личинки, состоящие из эктодермы и энтодермы. Таким образом, планулы – это лецитотрофные гаструлы. Очевидно, что в случае Medusozoa упрощенное строение личинок связано с появлением в жизненном цикле новой расселительной стадии – медузы.
ПРОИСХОЖДЕНИЕ ЛИЧИНОК ТРЕХСЛОЙНЫХ BILATERIA
Учитывая, что Cnidaria и трехслойные Bilateria являются сестринскими группами, можно предполагать, что пелаго-бентический жизненный цикл предков трехслойных животных первоначально протекал так же, как у стрекающих кишечнополостных. Исходно его пелагическая часть включала, как у Cnidaria, только бластулу и гаструлу (рис. 8). У всех Bilateria произошла пролонгация пелагической части жизненного цикла за счет появления билатерально-симметричных личинок с ресничными шнурами, обеспечивающими локомоцию и питание. При этом первые личиночные стадии (ресничные бластулы и гаструлы) обладают радиальной симметрией и отражают радиально-симметричный этап эволюционного развития. Последующие личиночные стадии (трохофоры, актинотрохи, торнарии, диплеврулы и др.) в своем строении подчиняются билатеральной симметрии. Несмотря на то, что эти личинки ведут пелагическое существование и приспособлены к жизни в толще воды, в их строении отражается организация билатерально-симметричных донных стадий развития предка, хотя и в измененной форме. По существу, билатерально-симметричные личинки Bilateria – это ювенильные формы, поднятые в толщу воды (рис. 9). Органы исходно донной ювенильной формы при этом изменились таким образом, чтобы обеспечить существование в толще воды. Таким образом, билатерально-симметричные личинки Bilateria возникли благодаря процессу “ларвализации” первоначально донных ювенильных стадий.
Рис. 8.
Первоначальный жизненный цикл предков трехслойных Bilateria: 1 – взрослая особь, 2 – оплодотворение, 3 – бластула, 4 – гаструла, 5 – ранняя донная ювенильная особь, 6 – поздняя ювенильная особь.

Рис. 9.
Жизненный цикл предков трехслойных Bilateria с билатерально-симметричной планктотрофной личинкой: 1 – взрослая особь, 2 – оплодотворение, 3 – бластула, 4 – гаструла, 5 – билатерально-симметричная планктотрофная личинка, 6 – поздняя ювенильная особь. Пунктирная стрелка показывает филогенетический переход билатерально-симметричной ювенильной стадии к пелагическому образу жизни.

Большое разнообразие во внешнем облике, строении ресничных шнуров и анатомической организации ставит вопрос о том, возможно ли вообще говорить о едином происхождении личинок трехслойных Bilateria. Неудивительно, что многие авторы, рассматривая вопрос о происхождении личинок с весьма разных позиций, приходили к сходному выводу о независимом происхождении личинок в разных группах Bilateria (Hyman, 1951; Иванова-Казас, 1985, 1995; Strathmann, 1993; Haszprunar et al., 1995; Sly et al., 2003; Valentine, Collins, 2000; Raff, 2008). Другие авторы все же допускают, что билатерально-симметричная планктотрофная личинка могла сформироваться уже у предка билатерий (Davidson et al., 1995; Peterson et al., 2004; Marlow et al., 2014), однако облик такой личинки остается неясным. В настоящее работе мы попытаемся сформулировать оригинальную гипотезу происхождения личинок трехслойных Bilateria.
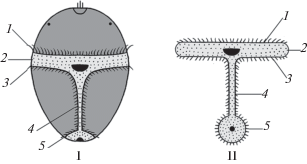
Если мы признаем, что трехслойные Bilateria имели общего предка, то в строении билатерально-симметричных пелагических личинок всех билатерий мы должны находить общие черты, унаследованные от такого предка. Анализ организации щупальцевого аппарата Cnidaria показывает, что вокруг первичного рта исходно располагается два круга щупалец (см. Малахов, 2016). Мы предполагаем, что у общих предков Bilateria на основе двух кругов щупалец сформировались две системы органов (рис. 10). Наружный круг щупалец дал начало метамерным придаткам (конечностям). Внутренний круг дал начало ресничным щупальцам, образующим замкнутый контур вокруг щелевидного первичного рта. После смыкания последнего передняя часть этого контура дала ресничные щупальца, средняя часть вдоль линии замыкания бластопора – ресничную подошву (невротрох), а задняя часть – ресничное кольцо вокруг ануса – телотрох (рис. 10). При переходе ювенильных стадий к планктонному существованию эти составляющие дали начало ресничным шнурам личинок (рис. 11).
Рис. 10.
Происхождение ресничных щупалец и метамерных конечностей трехслойных Bilateria: I – кишечнополостный предок с двумя кругами щупалец, II – замыкание щелевидного бластопора и дифференцировка щупалец, III – общий предок трехслойных Bilateria (на всех рисунках вид с оральной = вентральной стороны). Обозначения: 1 – щупальца наружного круга, 2 – щупальца внутреннего круга, 3 – щелевидный первичный рот, 4 – рот, 5 – анус, 6 – адоральные ресничные щупальца, 7 – ресничная ползательная подошва, 8 – ресничное кольцо вокруг ануса, 9 – метамерные конечности.

Рис. 11.
Происхождение ресничных шнуров личинки Bilateria от ресничных органов ювенильной стадии: I – донная ювенильная стадия, II – пелагическая планктотрофная личинка. Обозначения: 1 – адоральные ресничные щупальца ювенили и адоральное ресничное поле личинки, 2 – ресничная ползательная подошва ювенили и невротрох личинки, 3 – ресничное кольцо вокруг ануса у ювенили и телотрох личинки.

Высказанные выше соображения близки к построениям Нильсена (Nielsen, 1985; 2005, 2018) о происхождении ресничных образований трохофорных личинок Protostomia от ресничного кольца, окружавшего первичный рот у гипотетической гастреи. Однако на самом деле, ресничный контур вокруг щелевидного бластопора является прототипом ресничных шнуров не только Protostomia, но и Deuterostomia. Действительно, при сравнении развертки ресничных образований типичной трохофоры аннелид и торнарии кишечнодышащих нельзя не отметить удивительное сходство, позволяющее выделить гомологичные элементы ресничного вооружения.
Ресничное вооружение типичной личинки первичноротых животных – трохофоры – включает следующие элементы (рис. 12). Во-первых, это более или менее широкое адоральное ресничное поле, простирающееся по поверхности тела личинки справа и слева ото рта на боковые стороны и далее на спинную сторону. На спинной стороне имеется разрыв, хорошо известный из данных сравнительной эмбриологии разных групп трохофорных животных (Newby, 1940; Anderson, 1973; Иванова-Казас, 1974, 1977; Adrianov et al., 2008). Поэтому развертка ресничных образований типичной трохофоры напоминает букву “Т”, где адоральное ресничное поле соответствует горизонтальной перекладине (рис. 12). У планктотрофных личинок передний и задний края адорального ресничного поля окаймлены увеличенными ресничками, образующими ресничные шнуры – прототрoх и метатрох, которые играют важную роль в питании. У непитающихся лецитотрофных личинок прототрох и метатрох, как правило, не выражены (т.е. реснички переднего и заднего краев адорального ресничного поля не отличаются от остальных ресничек). Вдоль линии замыкания бластопора по брюшной стороне проходит ресничная полоска – невротрох, которая обычно особенно широка у ползающих лецитотрофных личинок. Вокруг ануса имеется ресничное кольцо – телотрох. Таким образом, ресничные образования трохофоры образуют непрерывный контур вокруг линии смыкания бластопора.
Рис. 12.
Типичная трохофора с брюшной стороны (I) и развертка ее ресничных шнуров (II). Обозначения: 1 – проторох, 2 – адоральное ресничное поле, 3 – метатрох, 4 – невротрох, 5 – телотрох.
Разумеется, трохофорные личинки даже в пределах аннелид, а тем более в пределах весьма обширной группы трохофорных животных (Trochozoa), весьма разнообразны, и их сравнение с “типичной” трохофорой – интересная и важная задача, которую надо рассматривать в отдельной работе.
Торнарии – личинки представителей типа Hemichordata, т.е. вторичноротых животных, которые как по классическим, так и по современным представлениям весьма далеки от трохофорных животных. Более того, анализ филогенетических деревьев, построенных на основе данных молекулярной филогеномики, говорит о базальном положении вторичноротых на филогенетическом древе трехслойных Bilateria (Peterson, Eernisse, 2001; Halanych, 2004; Philippe et al., 2005, 2009; Dunn et al., 2008, 2014; Giribet, 2015; Telford et al., 2015). В соответствии с этим планктонные личинки вторичноротых имеют ряд архаичных черт, например, таких как наличие в ресничных шнурах не ресничных, а жгутиковых клеток. Цилиарное вооружение торнарии хорошо известно из классических и современных работ (Agassiz, 1872; Bateson, 1884; Morgan, 1891, 1894; Spengel, 1893; Heider, 1909; Stiasny-Wijnhoff, Stiasny, 1926, 1927; Dawydoff, 1948; Jagersten, 1972; Urata, Yamaguchi, 2004; Nielsen, Hay-Smidt, 2007) и состоит из следующих элементов: адоральное ресничное поле окаймлено преоральным и посторальным ресничными шнурами; на заднем конце личинки имеется кольцевой телотрох; по средней линии брюшной стороны проходит ресничная полоска невротроха (рис. 13). У планктотрофных торнарий в связи с необходимостью обеспечить питание личинки в течение долгого периода пелагического существования конфигурация адорального ресничного поля и форма пре- и посторальных ресничных шнуров сильно усложняется (Morgan, 1891; Stiasny-Wijnhoff, Stiasny, 1927; Damas, Stiasny, 1961). Не менее сложная конфигурация адорального ресничного поля и ресничных шнуров свойственна планктотрофным личинкам иглокожих, у которых, однако, редуцированы невротрох и телотрох.
Рис. 13.
Типичная личинка вторичноротых животных – торнария с брюшной стороны (I) и развертка ее ресничных шнуров (II). Обозначения: 1 – преоральный ресничный шнур, 2 – адоральное ресничное поле, 3 – посторальный ресничный шнур, 4 – невротрох, 5 – телотрох.

Адоральное ресничное поле играет главную роль в питании трохофорных личинок и личинок вторичноротых животных. Биением ресничек пищевые частицы передвигаются по адоральному ресничному полю, но сам захват пищевых частиц происходит по-разному. У трохофорных личинок пищевые частицы захватываются посредством механизма “down-stream collecting” (рис. 14), когда реснички ресничных шнуров бьют навстречу друг другу (Strathmann et al., 1972; Henderson, Strathmann 2000; Riisgård et al., 2000; Rouse, 1999, 2000; Pernet, Strathmann, 2011). У личинок вторичноротых животных пищевые частицы захватываются посредством механизма “up-stream collecting” (рис. 15), когда реснички ресничных шнуров бьют в противоположные стороны, при этом пищевые частицы отбрасываются на адоральное поле за счет реверсивного удара ресничек (Bullivant, 1968; Strathman, 1971, 1975; Strathmann, Bonar, 1976; Gilmour, 1978, 1981, 1985, 1986, 1988; Hart, 1991; Lacalli, 1993; Riisgård, Manriquez, 1997; Riisgard, 2002; Riisgård et al., 2004; Strathmann, 2005; Riisgård, Larsen, 2010). Это важное различие, тем не менее, является чисто функциональным и не может препятствовать признанию гомологии адорального ресничного поля и других элементов ресничного вооружения личинок. Какой способ сбора пищевых частиц можно считать первичным?
Рис. 14.
Механизм работы ресничных шнуров трохофоры – “down-stream collecting”: I – трохофора с брюшной стороны, II – схема захвата пищевых частиц. Обозначения: 1 – прототрох, 2 – адоральное ресничное поле, 3 – метатрох, жирные стрелки показывают направление биения ресничек, тонкие стрелки показывают движение частиц по адоральному полю.

Рис. 15.
Механизм работы ресничных шнуров торнарии – “up-stream collecting”: I – торнария с брюшной стороны, II – схема захвата пищевых частиц. Обозначения: жирные стрелки показывают направление биения ресничек, тонкие стрелки – движение частиц по адоральному полю, прерывистые толстые стрелки – направление токов воды.

Планктотрофные личинки трехслойных Bila-teria – это адаптированные к жизни в толще воды ювенильные, в прошлом бентосные, стадии. Мы не можем сказать, как питались гипотетические общие предки билатерий. Если они собирали частицы с поверхности осадка, то тогда реснички на обращенной к субстрату поверхности щупалец не имели дифференцировки (рис. 16). При адаптации к питанию из толщи воды произошла дифференцировка ресничного аппарата и появились ресничные шнуры, окаймляющие адоральное ресничное поле. При этом у трохофорных животных сформировался механизм “down-stream collecting”, тогда как у вторичноротых – “up-stream collecting” (рис. 16).
Рис. 16.
Происхождение двух механизмов сбора пищевых частиц из толщи воды: I – гипотетический предок Bilateria, собиравший частицы с поверхности осадка, II – поперечный срез щупальца предка Bilateria, собирающего частицы с поверхности осадка, III – поперечный срез щупальца Trochozoa (“down-stream collecting”), IV – поперечный срез щупальца Deuterostomia (“up-stream collecting”). Обозначения: жирные стрелки показывают направления филогенетических трансформаций, прерывистые стрелки – направление токов воды, тонкие стрелки – движение пищевых частиц.
ЗАКЛЮЧЕНИЕ
Настоящая статья представляет собой краткий конспект положений, которые нуждаются в дальнейшем развитии.
Независимо от того, какую из гипотез происхождения многоклеточных мы принимаем (гипотезу гастреи, фагоцителлы или гипотезу синзооспоры), исходный жизненный цикл Eumetazoa (многоклеточных животных, обладающих нервной системой, мускулатурой, ртом и кишечником) – это голопелагический жизненный цикл. Такой жизненный цикл сохранили Ctenophora, которые могут рассматриваться как наиболее рано обособившаяся ветвь Eumetazoa.
У общих предков Cnidaria и трехслойных Bilateria сформировался пелаго-бентический жизненный цикл. Пелагическая часть жизненного цикла Cnidaria включает радиально-симметричные ресничные бластулы и гаструлы. У части Anthozoa гаструлы являются долго плавающими планктотрофными личинками и выполняют расселительную функцию. Личинки Medusozoa утратили расселительную функцию, которую взяли на себя медузы. В связи с этим планулы Medusozoa имеют упрощенное строение и лишены рта. Тем не менее, поскольку планулы – это двухслойные личинки, их можно рассматривать как лецитотрофные гаструлы.
У трехслойных Bilateria произошла пролонгация пелагической части жизненного цикла за счет появления билатерально-симметричных личинок с ресничными шнурами, обеспечивающими локомоцию и питание. По существу, билатерально-симметричные личинки Bilateria – это ювенильные формы, поднятые в толщу воды. Этот филогенетический модус может быть обозначен термином “ларвализация”. Органы исходно донной ювенильной формы при этом изменились таким образом, чтобы обеспечить существование в толще воды. Таким образом, билатерально-симметричные личинки Bilateria имеют общее происхождение.
Ресничные шнуры личинок представляют собой видоизменение ресничного шупальцевого аппарата ювенильных стадий общего предка Bilateria. В силу этого, ресничный аппарат личинок даже очень далеких в филогенетическом отношении групп построен по общему плану, и в нем можно выделить гомологичные элементы. Основные элементы ресничного аппарата личинок билатерий – адоральное ресничное поле, невротрох и телотрох.
Работа выполнена в рамках государственной темы № АААА-А16-116021660057-5 при поддержке Российского Фонда Фундаментальных Исследований (проекты №№ 19-04-00449; 17-04-00586), а также Российского Научного Фонда (проект № 18-04-00082 – работа с научной литературой).
Список литературы
Алёшин В.В., Петров Н.Б. Молекулярные свидетельства регресса в эволюции многоклеточных животных // Журн. Общ. Биол. 2002. Т. 63. № 3. С. 195–208.
Беклемишев В.Н. Основы сравнительной анатомии беспозвоночных. М.: Наука, 1964. Т. 1. 433 с.
Владыченская Н.С., Кедрова О.С., Милютина И.А., Окштейн И.Л., Алёшин В.В., Петров Н.Б. Положение типа Placozoa в системе многоклеточных животных по результатам сравнения последовательностей гена 18S рРНК // Докл. РАН. 1995. Т. 344. № 1. С. 1–3.
Ересковский А.В. Сравнительная эмбриология губок (Porifera). СПб: СПбГУ, 2005. 304 с.
Ёжиков И.И. Соотношение онтогенеза и филогенеза // Успехи совр. биол. 1939. Т. 11. Вып. 2. С. 217–240.
Иванов П.П. Общая и сравнительная эмбриология. М.-Л.: Биомедлиз, 1937. 811 с.
Иванов А.В. Происхождение многоклеточных животных: Филогенетические очерки. Л.: Наука, 1968. 287 с.
Иванова-Казас О.М. К вопросу соотношения морфологических осей у Spiralia // Зоол. журн. 1974. № 53. С. 5–19.
Иванова-Казас О.М. Сравнительная эмбриология беспозвоночных животных: трохофорные, щупальцевые, щетинкочелюстные, погонофоры. М.: Наука, 1977. 312 с.
Иванова-Казас О.М. Происхождение и филогенетическое значение трохофорных личинок. // Зоол. журн. 1985. Т. 64. № 4. С. 485–497.
Иванова-Казас О.М. Происхождение, эволюция и филогенетическое значение ресничных личинок // Зоол. журн. 1987. Т. 66. № 3. С. 325–338.
Иванова-Казас О.М. Морфологическая полярность в онтогенезе и филогенезе Tunicata // Биол. моря. 1988. № 4. С. 3–17.
Иванова-Казас О.М. Эволюционная эмбриология животных. СПб.: Наука, 1995. 565 с.
Захваткин А.А. Сравнительная эмбриология низших беспозвоночных. Источники и пути формирования индивидуального развития многоклеточных. М.: Сов. наука, 1949. 396 с.
Малахов В.В. Происхождение билатерально-симметричных животных (Bilateria) // Журнал общей биологии. 2004. Т. 65. № 5. С. 371–388.
Малахов В.В. Революция в зоологии: новая система билатерий // Природа. 2009. № 3. С. 40–54.
Малахов В.В. Новая система билатерий // Вестник РАН. 2010. Т. 80. № 1. С. 27–44.
Малахов В.В. Революция в зоологии: новые представления о системе и филогении многоклеточных животных // Вестник РАН. 2013. Т. 83. № 3. С. 210–215.
Малахов В.В. Симметрия и щупальцевый аппарат книдарий // Биология моря. 2016. Т. 42. № 4. С. 249–259.
Мечников И.И. Избранные биологические произведения. М.: АН СССР, 1950. 796 с.
Молодцова Т.Н., Малахов В.В. Cerianthus lloidii (Antozoa, Ceriantharia) из вулканической экосистемы бухты Кратерная. 1. Морфология и анатомия взрослых полипов, географическое распространение // Зоол. журн. 1995а. Т. 74. № 10. С. 5–17.
Молодцова Т.Н., Малахов В.В. Cerianthus lloidii (Antozoa, Ceriantharia) из вулканической экосистемы бухты Кратерная. 2. Личиночное развитие // Зоол. журн. 1995б. Т. 74. № 11. С. 4–11.
Мюллер Ф., Геккель Э. Основной биогенетический закон. Избранные работы. М.–Л.: изд-во АН СССР, 1940. 297 с.
Adrianov A.V., Mayorova A.S., Malakhov V.V. Embryonic development of the peanut worm Themiste pyroides (sipuncula: Sipunculoidea) from the Sea of Japan // Invertebrate Reproduction and Development. 2008. V. 52. № 3. P. 143–151.
Agassiz A. Tornaria, the young stage of Balanoglossus // Amer. Nat. V. 6. P. 636–637.
Anderson D.T. Embryology and Phylogeny of Annelids and Arthropods (International Series of Monographs in pure and applied Biology, Zoology 50). 1973. Pergamon Press, Oxford. 495 p.
Arendt D. Hox genes and body segmentation // Science. 2018. V. 361. P. 1310–1311.
Arendt D., Benito-Gutierrez E., Brunet T. et al. Gastric pouches and the mucociliary sole: setting the stage for nervous system evolution // Philos. Trans. R. Soc. Lond. Biol. Sci. 2015. V. 370. № 1684. P. 1–18.
Arendt D., Tosches M.A., Marlow H. From nerve net to nerve ring, nerve cord and brain–evolution of the nervous system // Nat. Rev. Neurosci. 2016. V. 17. P. 61–72.
Bateson W. The early stages in the development of Balanoglossus // Quart. J. Micr. Sci. 1884. V. 24. P. 208–236.
Beklemishev V. On the relationship of the turbellaria to the other groups of the animal kingdom // The Lower Metazoa / Dougherty E.C. Berkeley, 1963. Los Angeles: Univ. Calif. Press. P. 324–244.
Beneden E. van. Recherches sur le développment des Arachnactis. Contribution à la morphologie de Cerianthides // Arch. Biol. Paris. 1891. V. 11. P. 114–146.
Beneden E. van. Travaux posthumes d’Édouard Van Beneden sur les Cérianthaieres // Archieves de Biologie Volume Hors Série. 1923. P. 1–242.
Budd G.E., Jensen S. The origin of the animals and a ‘Savannah’ hypothesis for early bilaterian evolution // Biol. Rev. 2017. V. 92. № 1. P. 446–473.
Bullivant J.S. The method of feeding of Lophophorates (Bryozoa, Phoronida, Brachiopoda) // New Zealand J. Mar. Freshwat. Res. 1968. V. 2. P. 135–146.
Carlgren O. Die Larven der Ceriantharien, Zoantharien und Aktiniarien, mit einem Anhang zu den Zoantharien. Wiss. Erg. Deut. Exp. “Valdivia” 1898–1899. 1924. V. 19. P. 342–476.
Chevalier J.P., Beauvais L. Classification en sous-orederes Scléractiniairies // Traité de Zoologie / Grassé P.P. 1987. V. 3. P. 679–764.
Collins A.G. Evaluating multiple alternative hypotheses for the origin of Bilateria: an analysis of 18S rRNA molecular evidence // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 15458–15463.
Collins A.G. Phylogeny of Medusozoa and the evolution of cnidarian life cycles // J. Evol. Biol. 2002. V. 15. № 3. P. 418–432.
Collins A.G., Valentine J.W. Defining phyla: evolutionary pathways to metazoan body plans // Evol. Dev. 2001. V. 3. P. 432–442.
Collins A.G., Schuchert P., Marques A.C. et al. Medusozoan Phylogeny and Character Evolution Clarified by New Large and Small Subunit rDNA Data and an Assessment of the Utility of Phylogenetic Mixture Models // Syst. Biol. 2006. V. 55. № 1. P. 97–115.
Damas D., Stiasny G. Les larves planctoniques d’enteropneustes (tornaria et planctosphaera). Verh. K. vlaam. Acad. Wet. (KI. Wetenschappen). 1961. V. 15. P. 1–68.
Davidson E.H., Peterson K.J., Cameron R.A. Origin of bilaterian body plans: evolution of developmental regulatory mechanisms // Science. 1995. V. 270. P. 1319–1325.
Dawydoff C. Classe des Enteropneustes + Classe des Pterobranches // Traité de Zoologie. 1948. V. II. P. 369–489. Masson, Paris.
Dubuc T.Q., Ryan J.F., Shinzato C., Satoh N., Martindale M.Q. Coral Comparative Genomics Reveal Expanded Hox Cluster in the Cnidarian-Bilaterian Ancestor // Integr. Compar. Biol. 2012. V. 52. № 6. P. 835–841.
Dunn C.W., Giribet G., Edgecombe G.D., Hejnol A. Animal Phylogeny and Its Evolutionary Implications // Annu. Rev. Ecol. Evol. Syst. 2014. V. 45. P. 371–395.
Dunn C.W., Hejnol A., Matus D.Q., Pang K., Browne W.E., Smith S.A., Seaver E., Rouse G.W., Obst M., Edgecombe G.D., Sørensen M.V., Haddock S.H.D., Schmidt-Rhaesa A., Okusu A., Kristensen R.M., Wheeler W.C., Martindale M.Q., Giribet G. Broad phylogenomic sampling improves resolution of the animal tree of life // Nature. 2008. V. 452. P. 745–750.
Erwin D.H., Davidson E.H. The last common bilaterian ancestor // Development. 2002. V. 129. № 13. P. 3021–3032.
Gemmil J.F. The development of the sea anemones, Metridium dianthus (Ellis) and Adamsia palliata (Bohad) // Phil. Trans. Roy. Soc. Lond., ser. B. 1920. V. 290. P. 351–375.
Gemmill J.F. The development of the sea anemone Bolocera tuediae (Johnst.) // Quart. J. Microscop. Sci. 1921. V. 65. P. 577–587.
Gemmill J.F. Development of the sea anemone Bolocera // Quart. J. Microscop. Sci. 1922. V. 65.
Finnerty J.R. Cnidarians reveal intermediate stages in the evolution of hox clusters and axial complexity // Amer. Zool. 2001. V. 41. P. 608–620.
Finnerty J.R. The origins of axial patterning in the metazoa: how old is bilateral symmetry? // Int. J. Dev. Biol. 2003. V. 47. P. 523–529.
Finnerty J.R., Martindale M.Q. Homeoboxes in sea anemones (Cnidaria: Anthozoa): a PCR-based survey of Nematostella vectensis and Metridium senile // Biol. Bull. 1997. V. 193. P. 62–76.
Finnerty J.R., Paulson D., Burton P. et al. Early evolution of a homeobox gene: The ParaHox gene Gsx in the Cnidaria and the Bilateria // Evol. Dev. 2003. V. 5. P. 331–345.
Finnerty J.R., Pang K., Burton P. et al. Origins of bilateral symmetry: Hox and Dpp expression in a sea anemone // Science. 2004. V. 304. P. 1335–1337.
Gilmour T.H.J. Ciliation and function of the food-collecting and waste-rejecting organs of lophophorates // Can. J. Zool. 1978. V. 56. P. 2142–2155.
Gilmour T.H.J. Food-collecting and waste-rejecting mechanism in Glottidia pyramidalis and the persistence of lingulacean inarticulate brachiopods in the fossil record // Can. J. Zool. 1981.V. 59. P. 1539–1547.
Gilmour T.H.J. An analysis of videotape recording of larval feeding in the sea urchin Lytechinus pictus (Verril) // Can. J. Zool. 1985. V. 63. P. 1354–1359.
Gilmour T.H.J. Streamline and particles paths in the feeding mechanisms of larvae of the sea urchin Lytechinus pictus Verril // J. Exp. Mar. Biol. Ecol. 1986. V. 5. P. 27–36.
Gilmour T.H.J. Feeding behavior of holothurians larvae // Am. Zool. 1988. V. 28. P. 67A.
Giribet G. New animal phylogeny: future challenges for animal phylogeny in the age of phylogenomics // Annu. Rev. Ecol. Evol. Syst. 2015. V. 45. P. 371–395.
Haeckel E. Die Gastraea-Theorie, die phylogenetische Classification des Thierreichs und die Homologie der Keimblatter // Jen. Zeitschr. Naturw. 1874. B. 8. P. 1–55.
Hadfield M.G., Carpizo-Ituarte E.J., del Carmen K., Nedved B.T. Metamorphic competence, a major adaptive convergence in marine invertebrate larvae // Amer. Zool. 2001. V. 41. P. 1123–31.
Hadži J. Turbelarijska teorija knidarijev (Turbellarien-Theorie der Knidarier) // Slovenska akad. zn. in umet., Ljubljana, 1944. P. 238.
Hadži J. An attempt to reconstruct the system of animal classification // Syst. Zool. 1953. V. 2. P. 145–154.
Hadži J. The evolution of the Metazoa. London: Pergamon Press. 1963. 499 p.
Halanych K.M. The new view of animal phylogeny // Annu. Rev. Ecol. Evol. Syst. 2004. V. 35. P. 229–256.
Halanych K.M., Passamaneck Y. A brief review of metazoan phylogeny and future prospects in Hox research // Amer. Zool. 2001. V. 41. P. 629–639.
Hart M.W. Particle Captures and the Method of Suspension Feeding by Echinoderm Larvae // Biol. Bull. 1991. V. 180. P. 12–27.
Haszprunar G., Salvini-Plawent L., Rieger R.M. Larval Planktotrophy-A Primitive Trait in the Bilateria? // Acta Zool. 1995. V. 76. № 2. P. 141–154.
He S., del Viso F., Chen C.-Y., Ikmi A., Kroesen A.E., Gibson M.C. An axial Hox code controls tissue segmentation and body patterning in Nematostella vectensis // Science. 2018. P. 1377–1380.
Heider K. Zur Entwicklung von Balanoglossus clavigerus D. Ch. // Zool. Anz. 1909. V. 34. P. 695–904.
Hejnol A., Obst M., Stamatakis A., Ott M., Rouse G.W., Edgecombe G.D., Martinez P., Baguñà J., Bailly X., Jondelius U., Wiens M., Müller W.E.G., Seaver E., Whee-ler W.C., Martindale M.Q., Giribet G., Dunn C.W. Assessing the root of bilaterian animals with scalable phylogenomic methods // Proc. Biol. Sci. 2009. V. 276. P. 4261–4270.
Henderson S.Y., Strathmann R.R. Contrasting scaling of ciliary filters in swimming larvae and sessile adults of fan worms (Annelida: Polychaeta) // Invertebrate Biology. 2000. V. 119. P. 58–66.
Hyman L.H. The Invertebrates. Protozoa Through Ctenophora. 1940. V. 1. McGraw-Hill, New York. 726 p.
Hyman L.H. The Invertebrates, v. 2. Platyhelminthes and Rhynchocoela. The Acoelomate Bilateria. New York: McGraw-Hill, 1951.
Jägersten G. On the early phylogeny of the Metazoa. The Bilaterogastraea-theory // Zool. Bidr. Uppsala. 1955. B. 30. P. 321–354.
Jägersten G. Further remarks on the early phylogeny of the Metazoa // Zool. Bidr. Uppsala. 1959. V. 33. P. 79–108.
Jägersten G. Evolution of the Metazoan Life Cycle: A Comprehensive Theory. L, N.-Y.: Academic Press; 1972. 282 p.
Jékely G., Paps J., Nielsen C. The phylogenetic position of ctenophores and the origin(s) of nervous systems // EvoDevo. 2015. V. 6. P. 1–9.
Jenner R.A. Evolution of animal body plans: the role of metazoan phylogeny at the interface between pattern and process // Evol. Dev. 2000. V. 2. P. 208–221.
Kim J.I., Li T., Ho I.C., Grusby M.J., Glimcher L.H. Requirement for the c-Maf transcription factor in crystallin gene regulation and lens development // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 3781–3785.
Kusserow A., Pang K., Sturm C., Hrouda M., Lentfer J., Schmidt H.A., Technau U., von Haeseler A., Hobmayer B., Martindale M.Q., Holstein Th.W. Unexpected complexity of the Wnt gene family in a sea anemone // Nature. 2005. V. 433. P. 156–160.
Lacalli T.C. Ciliary Bands in Echinoderm Larvae: Evidence for Structural Homologies and a Common Plan // Acta Zool. (Stock).1993. V. 74. P. 127–133.
Leloup E. Larves de Cerianthaires // Discov. Rep. 1964. V. 33. P. 251–307.
Marlow H.Q., Srivastava M., Matus D.Q., Rokhsar D., Martindale M.Q. Anatomy and Development of the Nervous System of Nematostella vectensis, an Anthozoan Cnidarian // Dev. Neurobiol. 2009. V. 69. P. 235–254.
Marlow H., Tosches M.A., Tomer R., Steinmetz P.R., Lauri A., Larsson T., Arendt D. Larval body patterning and apical organs are conserved in animal evolution // BMC Biol. 2014. V. 12. № 7. P. 1–17.
Marques A.C., Collins A.G. Cladistic analysis of Medusozoa and cnidarian evolution // Invertebr. Biol. 2004. V. 123. P. 32–42.
Martindale M.Q., Finnerty J.R., Henry J.Q. The Radiata and the evolutionary origins of the bilaterian body plan // Mol. Phylog. Evol. 2002. V. 24. № 3. P. 358–365.
Martindale M.Q., Pang K., Finnerty J.R. Investigating the origins of triploblasty: ‘mesodermal’ gene expression in a diploblastic animal, the sea anemone Nematostella vectensis (phylum, Cnidaria; class, Anthozoa) // Development. 2004. V. 131. P. 2463–2474.
Martinez D.E., Bridge D., Masuda-Nakagawa L.M., Cartwright P. Cnidarian homeoboxes and the zootype [letter] // Nature. 1998. V. 393. P. 748–749.
Matus D.Q., Pang K., Marlow H., Dunn C.W., Thomsen G.H., Martindale M.Q. Molecular evidence for deep evolutionary roots of bilaterality in animal development // Proc. Natl. Acad. Sci. USA. 2006a. V. 103. P. 11195–11200.
Matus D.Q., Thomsen G.H., Martindale M.Q. Dorso/ ventral genes are asymmetrically expressed and involved in germlayer demarcation during cnidarian gastrulation // Curr. Biol. 2006b. V. 16. P. 499–505.
Matus D.Q., Pang K., Daly M., Martindale M.Q. Expression of Pax gene family members in the anthozoan cnidarian, Nematostella vectensis // Evol. Dev. 2007a. V. 9. P. 25–38.
Matus D.Q., Thomsen G.H., Martindale M.Q. FGF signaling in gastrulation and neural development in Nematostella vectensis, an anthozoan cnidarian // Dev. Genes Evol. 2007b. V. 217. P. 137–148.
Matus D.Q., Magie C.R., Pang K., Martindale M.Q., Thomsen G.H. The Hedgehog gene family of the cnidarian, Nematostella vectensis, and implications for understanding metazoan Hedgehog pathway evolution // Dev. Biol. 2008. V. 313. P. 501–518.
McMurrich J.P. The Actinaria of the Siboga Expedition. I. Ceriantharia // Siboga-Expeґditie. 1910. V. 15a. P. 1–48.
Metschnikoff E. Embryologische Studien an Medusen. Ein Beitrag zur Geniealogie der Primitiv-Organe. Wien. 1886. P. 1–159.
Mikhailov K., Konstantinova A., Nikitin M. The origin of Metazoa: a transition from temporal to spatial cell differentiation // Bioessays. 2009. V. 31. P. 758–768.
Morgan T.H. Growth and metamorphosis of tornaria // J. Morph. 1891. V. 5. P. 407–458.
Morgan T.H. The development of Balanoglossus // J. Morph. 1894. V. 9. P. 1–86.
Moroz L.L. Convergent evolution of neural systems in ctenophores // J. Experiment. Biol. 2015. V. 218(Pt 4). P. 598–611.
Moroz L.L., Kocot K.M., Citarella M.R., Dosung S., Norekian T.P., Povolotskaya I.S., Grigorenko A.P., Dailey C., Berezikov E., Buckley K.M., Kohn A.B. The ctenophore genome and the evolutionary origins of neural systems // Nature. 2014. V. 510. P. 109–114.
Moroz L.L., Kohn A.B. Unbiased view of synaptic and neuronal gene complement in ctenophores: Are there pan-neuronal and pansynaptic genes across Metazoa? // Integr. Comp. Biol. 2015. V. 55. № 6. P. 1028–1049.
Newby W.W. The embryology of the echiuroid worm Urechis caupo // Mem. Am. Philos. Soc. 1940. V. 16. P. 1–219.
Nielsen C. Animal phylogeny in the light of the trochaea theory // Biol. J. Linn. Soc. 1985. V. 25. P. 243–299.
Nielsen C. Structure and function of metazoan ciliary bands and their phylogenetic signifi cance // Acta Zool. (Stockh.) 1987. V. 68. P. 205–262.
Nielsen C. Origin and evolution of animal life cycles // Biol. Rev. 1998. V. 73. P. 125–155.
Nielsen C. Trochophora larvae: cell-lineages, ciliary bands and body regions. 2. Other groups and general discussion // J. Exp. Zool. (Mol. Dev. Evol.). 2005. V. 304B. P. 401–447.
Nielsen C. Six major steps in animal evolution: are we derived sponge larvae? // Evol. Dev. 2008. V. 10. № 2. P. 241–257.
Nielsen C. Animal Evolution: Interrelationships of the Living Phyla. 3rd edition. Oxford: Oxford University Press; 2012. P. 1–421.
Nielsen C. Life cycle evolution: was the eumetazoan ancestor a holopelagic, planktotrophic gastraea? // BMC Evol. Biol. 2013. V. 13. № 171. P. 1–24.
Nielsen C. Origin of the trochophora larva // Royal Society Open Science. 2018. V. 5. № 180042. https://doi.org/10.1098/rsos.180042
Nielsen C., Hay-Schmidt A. Development of the enteropneust Ptychodera flava: ciliary bands and nervous system // J. Morphol. 2007. V. 268. P. 551–570.
Nielsen C., Norrevang A. The trochaea theory: an example of life cycle phylogeny. S. Conway Morris, J.D. George, R. Gibson and H.M. Platt: The Origins and Relationships of Lower Invertebrates. 1985. P. 28–41. Oxford University Press, Oxford.
Nyholm K.G. Zur Entwicklung und Entwick- lungsbiologie der Ceriantharien und Aktinicn // Zool. Bidrag Uppsala. 1943. V. 22. P. 87–248.
Pernet B., Strathmann R. Opposed Ciliary Bands in the Feeding Larvae of Sabellariid Annelids // Biol. Bull. 2011. V. 220. P. 186–198.
Peterson K.J., Cameron R.A., Davidson E.H. Set-aside cells in maximal indirect development: evolutionary and developmental significance // Bioessays. 1997. V. 19. № 7. P. 623–631.
Peterson K.J., Davidson E.H. Regulatory evolution and the origin of the bilaterians // Proc. Nat. Acad. Sci. USA. 2000. V. 97. № 9. P. 4430–4433.
Peterson K.J., Eernisse D.J. Animal phylogeny and the ancestry of bilaterians: inferences from morphology and 18S rDNA gene sequences // Evol. Dev. 2001. V. 3. P. 170–205.
Peterson K.J., Lyons J.B., Nowak K.S., Takacs C.M., Wargo M.J., McPeek M.A. Estimating metazoan divergence times with a molecular clock. Proc. Nat. Acad. Sci. USA. 2004. V. 101. P. 6536–6541.
Philippe H., Derelle R., Lopez P., Pick P., Borchiellini C., Boury-Esnault N., Vacelet J., Renard E., Houliston E., Queinnec E., Da Silva C., Wincker P., Le Guyader H., Leys S., Jackson D.J., Schreiber F., Erpenbeck D., Morgenstern B., Worheide G., Manuel M. Phylogenomics Revives Traditional Views on Deep Animal Relationships // Curr. Biol. 2009. V. 19. P. 706–712.
Philippe H., Lartillot N., Brinkmann H. Multigene analyses of bilaterian animals corroborate the monophyly of Ecdysozoa, Lophotrochozoa, and Protostomia // Mol. Bioi. Evol. 2005. V. 22. P. 1246–1253.
Raff R.A. Origins of the other metazoan body plans: the evolution of larval forms // Philos. Trans. R. Soc. Lond. B. 2008. V. 363. P. 1473–1479.
Raff R.A., Raff E.C. Evolution in the light of embryos: seeking the origins of novelties in ontogeny. In: Form and function in developmental evolution (eds. Laubichler MD, Maienschen J). Cambridge. Cambridge University Press. 2009. P. 83–111.
Reiger R. The Biphasic Life Cycle–A Central Theme of Metazoan Evolution // Amer. Zool. 1994. V. 34. P. 484–491.
Riisgård H.U. Methods of ciliary filter feeding in adult Phoronis muelleri (phylum Phoronida) and in its free-swimming actinotroch larva // Mar. Biol. 2002. V. 141. P. 75–87.
Riisgård H.U., Larsen P.S. Particle capture mechanisms in suspension-feeding invertebrates // Mar. Ecol. Prog. Ser. 2010. V. 418. P. 255–293.
Riisgård H.U., Manriquez P. Filter-feeding in fifteen marine ectoprocts (Bryozoa): particle capture and water pumping // Mar. Ecol. Progr. Ser. 1997. V. 154. P. 223–239.
Riisgård H.U., Nielsen C., Fuchs J., Rasmussen B.F., Obst M., Funch P. Ciliary feeding structures and particle capture mechanism in the freshwater bryozoan Plumatella repens (Phylactolaemata) // Invert. Biol. 2004. V. 123. № 2. P. 156–167.
Riisgård H.U., Nielsen C., Larsen P.S. Downstream collecting in ciliary suspension feeders: the catch-up principle // Mar. Ecol. Prog. Ser. 2000. V. 207. P. 33–51.
Rouse G.W. Trochophore concepts: ciliary bands and the evolution of larvae in spiralian Metazoa // Biol. J. Linn. Soc. 1999. V. 66. P. 411–464.
Rouse G. Bias? What bias? The evolution of downstream larval-feeding in animals // Zool. Scr. 2000. V. 29. P. 213–236.
Ryan J.F., Pang K., Mullikin J.C., Martindale M.Q., Baxevanis A.D. The homeodomain complement of the ctenophore Mnemiopsis leidyi suggests that Ctenophora and Porifera diverged prior to the ParaHoxozoa // EvoDevo. 2010. V. 1. № 9.
Ryan J.F., Pang K., Schnitzler C.E., Nguyen A-D., Moreland R.T., Simmons D.K., Koch B.J., Francis W.R., Havlak P., NISC Comparative Sequencing Program, Smith S.A., Putnam N.H., Haddock S.H.D., Dunn C.W., Wolfsberg T.G., Mullikin J.C., Martindale M.Q., Baxevanis A.D. The Genome of the Ctenophore Mnemiopsis leidyi and Its Implications for Cell Type Evolution // Science. 2013. V. 342. № 1242592. P. 1–8.
Saina M., Genikhovich G., Renfer E., Technau U. BMPs and chordin regulate patterning of the directive axis in a sea anemone // Proc. Nat. Acad. Sci. USA. 2009. V. 106. P. 18592–18597.
Salvini-Plawen L.V. Was ist eine Trochophora? Eine Analyse der Larventypen mariner Protostomier // Zool. Jahrb. Anat. 1980. V. 103. P. 389–423.
Scholz C.B., Technau U. The ancestral role of Brachyury: expression of NemBra1 in the basal cnidarian Nematostella vectensis (Anthozoa) // Dev. Genes Evol. 2003. V. 212. P. 563–570.
Sly B.J., Snoke M.S., Raff R.A. Who came first–larvae or adults? Origins of metazoan bilaterian larvae // Int. J. Dev. Biol. 2003. V. 47. P. 623–632.
Spengel J.W. Die Enteropneusten des Golfes von Neapel // Fauna Flora Golf. Neapel. 1893. V. 18. P. 1–758.
Stiasny-Wijnhoff G., Stiasny G. Uber Tornarien-Typen und ihre Beziehung zur Systematik der Enteropneusten // Zool. Anz. 1926. V. 68. P. 159–165.
Stiasny-Wijnhoff G., Stiasny G. Die Tornarien. Kritik der Beschreibungen und Vergleich samlicher bekannter Enteropiieustenlarren // Ergebn. Fortschr. Zool. 1927. V. 7. P. 38–208.
Strathmann R.R. The behavior of planktotrophic echinodermlarvae: mechanisms, regulation, and rates of suspension feeding // J. Exp. Mar. Biol. Ecol. 1971. V. 6. P. 109–160.
Strathmann R.R. Larval feeding in echinoderms // Amer. Zool. 1975. V. 5. P. 717–730.
Strathmann R. Length of pelagic period in echinoderms with feeding larvae from the Northeast Pacific // J. Experiment. Mar. Biol. Ecol. 1978. V. 34. P. 23–27.
Strathmann R. Feeding and nonfeeding larval development and life-history evolution in marine invertebrates // Ann. Rev. Ecol. Syst. 1985. V. 16. P. 339–361.
Strathmann R. Hypotheses on the origin of marine larvae // Ann. Rev. Ecol. Syst. 1993. V. 24. P. 89–117.
Strathmann R.R. Ciliary sieving and active ciliary response in capture of particles by suspension-feeding brachiopod larvae // Acta Zool. 2005. V. 86. P. 41–54.
Strathmann R.R., Jahn T.L., Fonseca J.R.C. Suspension feeding by marine invertebrate larvae: clearance of particles by ciliated bands of a rotifer, pluteus, and trochophore // Biol. Bull. Mar. Biol. Lab., Woods Hole. 1972. V. 142. P. 505–519.
Strathmann R., Bonar D. Ciliary feeding of tornaria larvae of Ptychodera flava (Hemichordata: Enteropneusta) // Mar. Biol. (Berl). 1976. V. 34. P. 317–324.
Telford M.J. Fighting over a comb // Nature. 2016. V. 529. P. 286–287.
Telford M., Budd G., Philippe H. Phylogenomic Insights into Animal Evolution // Curr. Biol. 2015. V. 25. P. 876–887.
Thorson G. Reproduction and larval development of Danish marine bottom invertebrates. Meddeleser fra Kommissionen for Danmarks Fiskeri-og Havundersogelser, Serie Plankton. 1946. V. 4. P. 1–523.
Urata M., Yamaguchi M. The development of the enteropneust hemichordate Balanoglossus misakiensis Kuwano // Zool. Sci. (Tokyo). 2004. V. 21. P. 533–540.
Valentine J.W., Collins A.G. The significance of moulting in ecdysozoan evolution // Evol. Dev. 2000. V. 2. P. 152–156.
Whelan N.V., Kocot K.M., Moroz L.L., Halanych K.M. Error, signal, and the placement of Ctenophora sister to all other animals // Proc. Nat. Acad. Sci. USA. 2015. V. 112. P. 5773–5778.
Willmer P. Invertebrate Relationships. Patterns in Animal Evolution. Cambridge University Press, Cambridge. 1990.
Wilson H.V. On the development of Manicina areolata // J. Morph. 1888. V. 2. P. 191–252.
Дополнительные материалы отсутствуют.






