Онтогенез, 2019, T. 50, № 6, стр. 398-406
Выявление эволюционно первичных черт плана строения и филотипической стадии развития Porifera
a Санкт-Петербургский государственный университет, биологический факультет
199034 Санкт Петербург, Университетская набережная 7/9, Россия
b Институт Биоразнообразия Средиземноморья, Морской и Континентальной Экологии (IMBE),
Экс-Марсель Университет, CNRS, IRD
Марсель, Франция
c Институт биологии развития им. Н.К. Кольцова РАН, ИБР РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: alexander.ereskovsky@imbe.fr
Поступила в редакцию 06.05.2019
После доработки 28.06.2019
Принята к публикации 06.07.2019
Аннотация
Каждый тип многоклеточных животных имеет свой план строения, или “bauplan”. При этом филотипической стадией считается та стадия онтогенеза, на которой появляются признаки, характеризующие bauplan данной группы. У разных животных филотипической стадии соответствуют совершенно разные стадии развития. Губки (Porifera) – одна из наиболее просто устроенных и, вероятно, древнейшая филогенетическая группа современных животных. На основе сравнительного анализа развития губок в процессе (1) полового и бесполого размножения, (2) регенерации из небольших фрагментов тела, (3) реагрегации диссоциированных клеток, мы предлагаем гипотетический вариант филотипической стадии развития губок, и вводим для нее термин “спонготип” [spongotype]. Это ювенильная губка с одним оскулюмом, находящаяся на стадии рагона. Основной признак, который позволяет рассматривать рагон в качестве филотипической стадии Porifera – полное соответствие расположения всех клеточных и анатомических структур рагона и половозрелой губки. Можно сказать, что на стадии рагона формируется осевой комплекс зачатков структур взрослой губки, а за ней следуют только ростовые процессы.
ВВЕДЕНИЕ
Bauplan (план строения) – основное понятие биологии развития и эволюционной морфологии, применяемое при выделении новых крупных групп животных (например, в ранге типа) и при создании филогенетических построений высокого таксономического уровня. Bauplan – это тот самый “морфологический тип”, который, как считал Кювье (Cuvier, 1817), должен служить основой для разделения животных на четыре большие группы (позвоночные, моллюски, членистые, радиата). Сейчас под термином bauplan мы понимаем план строения организма, который сформировался в ходе эволюции крупного таксона и характеризуется оригинальной архитектоникой.
Из концепций, связанных с термином bauplan, можно выделить две основные. Первая восходит к идеям Оуэна о существовании архетипа (Owen, 1848). Bauplan выявляется на основании сравнительного анализа строения взрослых животных, а более ранним стадиям развития никакого внимания не уделяется. Однако хорошо известно, что сходные траектории развития могут приводить к формированию сильно отличающихся друг от друга взрослых животных, а заметно различающиеся стадии могут присутствовать в развитии похожих организмов (см., например, Иванова-Казас, 1995; Gilbert, Raunio, 1997). В рамках второй концепции Bauplan можно охарактеризовать в ходе сопоставления строения личинок, которые обладают значительной эволюционной консервативностью (Raff, 1996). Эмбриональное развитие при этом опять не рассматривается.
Одновременно с “морфологическим типом” Кювье, появилась концепция “плана развития”, которая была введена фон Бэром (von Baer, 1828). Бэр в основе каждого плана строения видел создавший его путь развития, специфически (для данного плана строения) организованный, то есть “тип развития”. Таким образом, план развития по Бэру – это bauplan в процессе его онтогенетического формирования. Интересно, что наблюдения фон Бэра над процессами развития были в числе тех фактов, которые обеспечили подтверждение дарвиновской теории общности происхождения (Darwin, 1859).
Существуют, однако, группы типов (и классов) животных, траектории развития которых существенно отличаются друг от друга, но проходят через общие стадии. Хороший пример этого явления – развитие целомических Spiralia, в состав которых входят типы Annelida, Mollusca, и Sipunculida. Во взрослом состоянии представители этих типов сильно отличаются друг от друга, и то же самое можно сказать об их раннем развитии и характерных для него морфогенезах. Однако большинство этих животных проходит через общую стадию развития – личинку – трохофору. И именно на этой стадии становится наиболее очевиден общий для всех перечисленных групп bauplan. Первым, кто сфокусировал свои исследования на подобных стадиях, назвав их Korpergrundgestalt, был Зидель (Seidel, 1960). Позднее Сандер ввел для них термин “филотипическая стадия” [phylotypic stage] (Sander, 1983). Оба автора рассматривали подобные стадии как ключевые для развития всех представителей данной таксономической группы. Они не считали филогенетически значимыми такие стадии как дробление и гаструляция, не обращали внимания на особенности морфогенетических процессов, обеспечивающих развитие.
Филотипическая стадия снова стала одной из центральных тем биологии развития после публикации результатов исследований Слэка и его коллег (Slack et al., 1993), причем обсуждение этой темы стало строиться на данных молекулярной биологии. Эти авторы охарактеризовали филотипическую стадию как стадию, на которой завершаются основные морфогенетические движения, а все зачатки органов и структур оказываются на своих местах, то есть окончательно формируется осевой комплекс зачатков. Другими словами, филотипическая стадия – это такая стадия эмбрионального развития, на которой появляются признаки и структуры, характерные для типа. Филотипические стадии были выявлены для многих животных: стадия хвостовой почки (фарингула) для позвоночных; стадия зародышевой полоски для артропод; полностью сегментированный, завершивший эпиболию на вентральной стороне, зародыш пиявок и т.д. (Slack et al., 1993; Minelli, Schram, 1994; Hall, 1998; Gilbert, 2013).
Филотипические стадии – далеко не самые ранние в эмбриогенезе. Более того, в пределах одной и той же филогенетической группы они могут “перемещаться” по относительной временной шкале онтогенеза. Относительное смещение стадий во времени может быть ассоциировано с адаптациями ранних стадий к условиям среды, с эволюционными изменениями репродуктивной стратегии и тактики, или же с особенностями снабжения эмбрионов питательными веществами. В то же время, сами филотипические стадии в очень малой степени изменяются в результате адаптивной эволюции (Slack et al., 1993). Консервативные филотипические стадии “заложены” между предыдущими и последующими стадиями развития, которые гораздо более эволюционно пластичны.
Наиболее общие черты паттерна морфологического разнообразия развития хорошо описываются моделью песочных часов. Эта модель предполагает, что ограничения, накладывающиеся на процессы развития (developmental constraints), максимальны в “среднем” эмбриогенезе (Duboule, 1994; Raff, 1996), что приводит к морфологической консервативности этой фазы. Один из часто цитируемых примеров эволюционной консервативности “среднего” эмбриогенеза – консервативность паттерна экспрессии генов HOX-кластера вдоль передне-задней оси различных представителей Bilateria (Dubule, 1994; Raff, 1996; Slack et al., 1993). В настоящее время активно изучаются как сами консервативные стадии эмбриогенеза, так и их роль в создании ограничений, обеспечивающих эволюционную консервативность планов строения животных (Kalinka, Tomancak, 2012; Drost et al., 2017; Yanai, 2018).
Однако необходимо отметить, что существование филотипических стадий развития постоянно ставится под сомнение. С одной стороны, некоторые сравнительные исследования показали отсутствие единообразия предполагаемых филотипических стадий, а с другой стороны, само это понятие вызывает ассоциации с устаревшими типологическими концепциями (см., например, Richardson et al., 1997, 1998; Fèlix, 1999; Scholtz, 2004, 2005).
Далеко не для всех типов животных филотипические стадии были выделены и охарактеризованы. Например, наличие или отсутствие филотипической стадии в онтогенезе представителей такой большой и разнообразной группы как Porifera до сих никогда не обсуждалось. Данный обзор – первая попытка поиска филотипической стадии в развитии губок.
ВЫЯВЛЕНИЕ ФИЛОТИПИЧЕСКОЙ СТАДИИ В ОНТОГЕНЕЗЕ PORIFERA
Формирование плана строения многоклеточных животных контролируется в ходе онтогенеза многоуровневыми каскадами взаимодействий продуктов регуляторных генов, экспрессия которых упорядочена в пространстве и во времени (Peter, Davidson, 2011). Исследования роли регуляторных генов в эмбриональном развитии Pori-fera очень немногочисленны. Однако уже было показано, что морфологически различающиеся регионы, расположенные вдоль оси тела личинки и взрослой губки, специфицируются за счет генетических механизмов (Degnan et al., 2015). Действительно, для всех однооскулюмных губок, а также для всех радиально симметричных губок с вторичным оскулюмом, характерна четко выраженная радиальная симметрия относительно апико-базальной оси тела (рис. 1). У большинства губок тело регионализовано: в нем выделяются эктосома и эндосома, различающиеся структурой скелета и водоносной системы (Ereskovsky, Lavrov, 2019).
Рис. 1.
Губки, обладающие хорошо выраженной апико-базальной осью тела и радиальной симметрией. а – монооскулюмная губка Sycon sp.; б – Haliclona sp. с радиально симметричными “ветвями”; в – Rossella sp., формирующая вторичный оскулюм.

К сожалению, проблему наличия или отсутствия у губок филотипической стадии невозможно обсуждать на молекулярном уровне из-за отсутствия сравнительных данных. Однако к решению этой проблемы можно привлечь данные сравнительной эмбриологии и рассмотреть ее с морфологической точки зрения.
РАЗВИТИЕ ГУБОК ПРИ ПОЛОВОМ РАЗМНОЖЕНИИ
Как уже отмечалось, для разных групп животных в качестве филотипических могут быть охарактеризованы очень разные стадии эмбрионального развития. Раннее развитие губок крайне разнообразно (Ereskovsky, 2010). Поэтому с точки зрения морфологии невозможно выделить какую-либо стадию развития, общую для всех филогенетических групп губок. Один и тот же паттерн дробления и одинаковая морфология на стадии бластулы могут в ходе дальнейшего развития привести к формированию сильно различающихся личинок. И наоборот, развитие морфологически сходных личинок может начинаться с разных паттернов дробления и быть основано на очень разных морфогенезах (рис. 2).
Рис. 2.
Схематическое изображение процессов дробления и последующих морфогенезов, ведущих к формированию личинок губок. 1–4 – паттерны дробления, характерные для губок: инкурвационное (1), полиаксиальное (2), радиальное (3), хаотическое (4). 5–9 – три основных варианта строения бластулы губок: стомобластула (5), целобластула (6, 7), морула (8, 9). 10–31 – морфогенетические процессы и формирование предличинок. 32–46 – личинки. 10 – инкурвация; 11, 12 – строение целобластулы сохраняется до личиночной стадии; 13 – мультиполярная ингрессия; 14 – униполярная пролиферация; 15, 25 – ингрессия материнских клеток (показаны черным цветом) внутрь морулы; 16 – клеточная деламинация; 17 – морульная деламинация; 18 – уплощение морулы; 19 – морульная деламинация; 20 – мультиполярная эмиграция; 21 – целобластула Calcinea, не имеющая базальной мембраны; 22 – инвагинация; 23 – пре-паренхимелла; 24, 27, 28, 29, 30 – морулы; 25 – пре-псевдобластула; 26 – двухслойная морула; 31 – целобластула Homoscleromorpha, имеющая базальную мембрану; 32 – амфибластула Calcaronea; 33 – кальцибластула Calcinea; 34 – целобластула Halisarcidae; 35 – дисферула Halisarcidae; 36 – паренхимелла Halisarcidae; 37 – паренхимелла Verticillitidae; 38 – псевдобластула Chondrosida; 39 – трихимелла Hexactinellida; 40 – молодая губка рода Tetilla с прямым развитием; 41 – паренхимелла Tethyida; 42 – целобластула Polymastia и Chondrilla; 43–45 – паренхимелла Dendroceratida (43), Haplosclerida (44), Poecilosclerida (45); 46 – цинктобластула Homoscleromorpha (по: Ereskovsky, 2010, с изменениями).
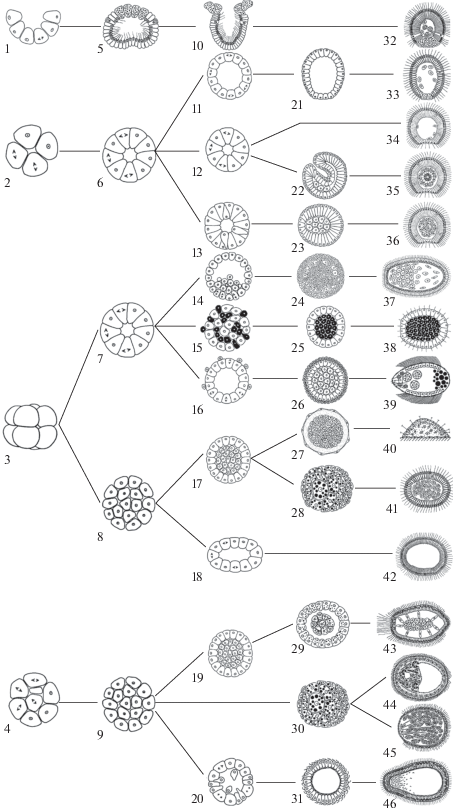
В качестве иллюстрации этого положения можно привести следующие данные. Для губок известно четыре типа дробления: инкурвационное (подкласс Calcaronea: Calcarea), полиаксиальное (подкласс Calcinea: Calcarea и сем. Halisarcidae: Demospongiae), псевдорадиальное (Chondrosidae, Spirophorida, Polymastiida: Demospongiae и Hexactinellida) или хаотическое (все Homoscleromorpha и большинство Demospongiae) (рис. 2: 1–4). В ходе дробления формируются бластулы трех типов: стомобластула, целобластула и морула (рис. 2: 5–9). Интересно, что последние два типа бластул формируются при использовании разных паттернов дробления (рис. 2). В ходе эмбрионального развития у губок формируется девять типов личинок, и морфогенезы, обеспечивающие формирование личинки, очень разнообразны (Ereskovsky, Dondua, 2006; Ereskovsky, 2010).
У всех личинок хорошо выражена переднезадняя полярность, которая проявляется в структуре наружного слоя клеток, в организации массы внутренних клеток (если она имеется), а также в распределении спикул (если они имеются). Допуская некоторую схематизацию, можно выделить у губок два основных типа строения личинок: полая однослойня личинка (целобластула, кальцибластула, цинктобластула, амфибластула) и двухслойная личинка, не имеющая полости (перенхимелла, хоплитомелла, трихимелла) (рис. 3) (Ereskovsky, 2010).
Рис. 3.
Основные типы строения личинок губок: a – кальцибластула; б – псевдобластула; в – амфибластула; г – дисферула; д – хоплитомелла; е – паренхимелла (личинка представителя Poecilosclerida); ж – трихимелла; з – цинктобластула (ap – передний полюс; bm – базальная мембрана, cc – личиночная хоаноцитная камера, ci – клетки, несущие жгутики, cr – клетки с внутриядерными кристаллоидами; crc – клетки креста, fc – жгутиковая камера, mc – материнские клетки, ic – внутренняя камера; ilc – внутренние клетки личинки, mcc – полицилиарные клетки, pi – личиночная пинакодерма, pp – задний полюс, s – личиночные спикулы, sb – симбиотические бактерии) (по: Ereskovsky, 2010, с изменениями).

Основное событие метаморфоза личинок – приобретение ими элементов плана строения (bauplan) взрослых губок, в первую очередь – водоносной системы. Первая структура взрослого организма, формирующаяся de novo, это экзопинакодерма, которая изолирует молодую губку от водной среды. На более поздних этапах метаморфоза формируются хоаноцитные камеры и каналы водоносной системы, прорываются отверстия оскулюма и остий, а также синтезируются элементы скелета, характерные для взрослых губок.
Набор морфогенетических процессов, за счет которых происходит метаморфоз, сильно зависит от типа личинки (то есть от еe строения). В результате метаморфоза из личинки развивается монооскулюмная губка, водоносная система которой часто отличается от водоносной системы взрослой губки. У Calcarea молодая особь, только что завершившая метаморфоз, имеет водоносную систему асконоидного типа и называется олинтус (Minchin, 1900); у Demospongiae и Homoscleromorpha молодая губка имеет водоносную систему лейконоидного или сиконоидного типа и называется рагон (рис. 4, 5a, б) (Sollas, 1888). Однако принципиальных различий между строением рагоном и олинтусом не существует.
Рис. 4.
Строение ювенильной губки на стадии рагона (at – атриум, cc – хоаноцитные камеры, o – оскулюм, os – остия) (по: Sollas, 1888, с изменениями).

Рис. 5.
Разнообразные онтогенетические и регенерационные процессы, ведущие к формированию филотипической стадии губок – стадии спонготипа: а – спонготип; б – метаморфоз личинки; в – развитие губки из почки; г – развитие губки из геммулы; д – реагрегация клеток; е – регенерация губки из небольшого фрагмента тела.
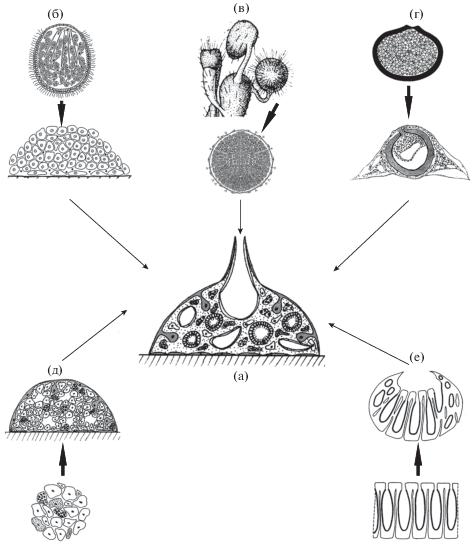
У губок с прямым развитием, которые либо выходят из материнского организма (в случае живорождения), либо развиваются в водной среде (в случае яйцерождения), развитие проходит через стадию ювенильной особи, также имеющей структуру рагона (Sara et al., 2002; Watanabe, 1978).
РАЗВИТИЕ ГУБОК ПРИ РАЗНЫХ ВАРИАНТАХ БЕСПОЛОГО РАЗМНОЖЕНИЯ
При почковании у всех губок, исключая род Oscarella (Homoscleromorpha) (Ereskovsky, Tokina, 2007), почка на ранних стадиях развития представляет собой конгломерат, состоящий из дифференцированных клеток разных типов, и находящийся на поверхности тела взрослой особи. У подобных почек нет ни каналов, ни оскулюма, и только иногда они имеют хоаноцитные камеры (см. обзоры: Fell, 1993; Ereskovsky et al., 2017). Отсоединившись от взрослого организма, почки оседают на субстрат и прикрепляются к нему, после чего начинают расти и формировать водоносную систему. Таким образом, почки практически всех губок напоминают стадии, которые личинка проходит во время метаморфоза – сначала стадию куколки, а потом рагона (рис. 5в).
Почкование губок группы Homoscleromorpha в значительной степени отличается от этого процесса у других губок, причем эти различия касаются и морфогенетических процессов, и структуры почки. Почка представляет собой вырост стенки тела родительской особи и развивается за счет эпителиального морфогенеза – эвагинации. Клетки в области почкования не мигрируют, не образуют сгущений, не пролиферируют. В состав почки входят все типы клеток, которые можно будет обнаружить у формирующейся из нее взрослой губки (Ereskovsky, Tokina, 2007). Перед оседанием на субстрат почка приобретает структуру рагона с сиконоидной водоносной системой.
Многие пресноводные и некоторые эстуарные/морские губки из класса Demospongiae формируют покоящуюся структуру, которая называется геммула (Simpson, 1984; Fell, 1993). Геммула представляет собой компактную однородную массу клеток, окруженную коллагеновой капсулой, часто включающей спикулы. Прорастание геммулы сопровождается митозами тезоцитов (внутренних тотипотентных клеток), активной клеточной миграцией и клеточной дифференцировкой. В результате всех этих процессов получается маленькая, но полностью функциональная ювенильная губка, имеющая структуру рагона с лейконоидной водоносной системой (рис. 5г) (Brien, 1932; Höhr, 1977).
Таким образом, ювенильные губки, формирующиеся за счет бесполого размножения как в случае почкования, так и при прорастании геммул, имеют строение рагона.
РАЗВИТИЕ ГУБОК В ХОДЕ РЕГЕНЕРАЦИОННЫХ ПРОЦЕССОВ
На губках выполнено большое количество экспериментов по диссоциации и последующей реагрегации клеток. Было показано, что клетки многих губок на последних стадиях реагрегации организованы в компактное сферическое тело, совсем не похожее на рыхлые структуры с немногочисленными межклеточными контактами, наблюдающиеся на начальных этапах реагрегации (Lavrov, Kosevich, 2014, 2016). На следующем этапе у агрегатов формируется пинакодерма. Эта стадия называется “примморф” (Custodio et al., 1998), и ее достижение означает завершение агрегации клеток и отделение внутренней среды агрегата от окружающей среды с помощью сплошного слоя пинакодермы. После прикрепления к твердому субстрату структура примморфа полностью преобразуется за счет разнообразных морфогенетических процессов, и в результате формируется маленькая, но полностью функциональная и хорошо структурированная губка (Lavrov, Kosevich, 2014, 2016). Эта губка имеет строение рагона (рис. 5e).
Молодая губка, которая формируется из небольшого фрагмента тела взрослой особи, тоже развивается через стадию рагона, хотя родительские особи могут иметь самое разнообразное строение (рис. 5д). В случае, если родительская особь является асконоидной губкой, регенерация не связана с масштабными перестройками трехслойной структуры фрагмента ее тела, состоящего из эпителиальной пинакодермы, мезохила и эпителиальной хоанодермы. Трехслойный фрагмент просто сворачивается хоанодермой внутрь, образуя при этом замкнутую внутреннюю полость (Jones, 1957). Небольшой фрагмент тела сиконоидной губки подвергается в начале регенерации серьезным деструктивным изменениям, в особенности затрагивающим ту часть системы каналов водоносной системы, которая расположена вблизи раневой поверхности (Короткова и др., 1965). Развитие регенерата лейконоидной губки также связано с существенной реорганизацией исходного строения родительской губки (Connes, 1966; Короткова, Никитин, 1968).
СТАДИЯ РАГОНА – ФИЛОТИПИЧЕСКАЯ СТАДИЯ РАЗВИТИЯ ГУБОК
В обзоре был проведен сравнительный анализ развития представителей типа Porifera в ходе: 1) полового и бесполого размножения; 2) реагрегации диссоциированных клеток; 3) регенерации из небольшого фрагмента тела. Результаты этого анализа позволяют утверждать, что у губок имеется филотипичекая стадия развития, которой можно дать название “спонготип” (spongotype). Этой филотипическй стадии соответствует стадия монооскулюмной ювенильной губки – рагона. Стадия рагона типична для Demospongiae, ей же сответствует олинтус, характерный для Calcarea (рис. 4, 5а). Рагон имеет хорошо выраженную апико-базальную ось, его тело радиально симметрично. Для него характерны небольшие размеры порядка 1–2 мм. Поверхность рагона покрыта уплощенными эпителиальными клетками – пинакоцитами. Основная причина, позволяющая рассматривать рагон как филотипическую стадию Porifera – полное соответствие расположения всех его клеточных и анатомических структур и половозрелой губки. Можно сказать, что на стадии рагона формируется осевой комплекс зачатков структур взрослой губки, а за ней следуют только ростовые процессы.
ЗАКЛЮЧЕНИЕ
В заключение необходимо еще раз подчеркнуть, что развитие практически любого представителя типа Porifera в любой ситуации (половое размножение, бесполое размножение, регенерационные процессы) и при использовании любых морфогенетических процессов проходит через общую для всех губок стадию рагона. Эта стадия морфологически единообразна для всех филогенетических групп типа Porifera. Мы предлагаем рассматривать эту стадию не только как филотипическую стадию Porifera, но и как модель гипотетической предковой губки – спонготип. Для того, чтобы подтвердить или опровергнуть корректность сделанных выводов, необходимо провести детальное исследование молекулярно-генетических механизмов, регулирующих формирование рагона у представителей разных филогенетических групп губок. Такое исследование будет способствовать лучшему пониманию механизмов, вовлеченных в эволюцию планов строения как губок, так и других многоклеточных животных.
Работа была выполнена при поддержке гранта РНФ 17-14-01089.
Список литературы
Иванова-Казас О.М. Эволюционная эмбриология животных. СПб.: Наука, 1995. 565 с.
Короткова Г.П., Ефремова С.М., Каданцева А.Г. Особенности морфогенезов при развитии Sycon lingua из небольших кусочков тела // Вестник ЛГУ. 1965. Т. 4. № 21. С. 14–30.
Короткова Г.П., Никитин Н.С. Особенности морфгенеза при развитии кремнероговой губки Halichondria panicea из небольшого фрагмента тела // Тр. Мурманск. морск. биол. ин-та. Вып. 16 (20). Л.: Наука, 1969. С. 17–26.
Brien P. Contribution à l'étude de la régénération naturelle chez les Spongillidae Spongilla lacustris (L.), Ephydatia fluviatilis (L.) // Archives de Zoologie expérimentale et générale. 1932. V. 74. P. 461–506.
Connes R. Contribution à l'étude histologique des premiers stades d’embryogenèse somatique chez Tethya lyncurium Lamarck. Bull Soc Zool France // 1966. V. 91. P. 639–645.
Custodio M.R., Prokic I., Steffen R., Koziol C., Borojevic R., Brummer F., Nickel M., Müller W.E.G. Primmorphs generated from dissociated cells of the sponge Suberites domuncula: a model system for studies of cell proliferation and cell death // Mech Ageing Dev. 1998. V. 105. P. 45–59.
Cuvier G. Le règne animal distribué d’après son organization. T. 1. Paris. 1817. 625 p.
Darwin C. On the Origin of Species. London: Murray, 1859. 502 p.
Degnan B.M., Adamska M., Richards G.R., Larroux C., Leininger S., Bergum B., Calcino A., Maritz K., Nakanishi N., Degnan S.M. Porifera: Evolutionary developmental biology of invertebrates. V. 1. Wanninger A., Ed. Wein: Springer, 2015. P. 65–106.
Drost H-G., Janitza P., Grosse I., Quint M. Cross-kingdom comparison of the developmental hourglass // Curr. Opin. Gen. Dev. 2017. V. 45. P. 69–75.
Duboule D. Temporal colinearity and the phylotypic progression: a basis for the stability of a vertebrate Bauplan and the evolution of morphologies through heterochrony // Dev. Suppl. 1994. P. 135–142.
Ereskovsky A.V. The Comparative Embryology of Sponges. Springer-Verlag, Dordrecht Heidelberg London New York, 2010. 410 p.
Ereskovsky A.V., Dondua A.K. The problem of germ layers in sponges (Porifera) and some issues concerning early metazoan evolution // Zool. Anz. 2006. V. 245. P. 65–76.
Ereskovsky A.V., Tokina D.B. Asexual reproduction in homoscleromorph sponges (Porifera; Homoscleromorpha) // Mar. Biol. 2007. V. 151. P. 425–434.
Ereskovsky A., Lavrov A. Porifera: Invertebrate Histology, Elise E.B., LaDouceur E.E.B., Eds., Chichester: John Wiley & Sons, Inc., 2019 (In press).
Ereskovsky A.V., Geronimo A., Pérez T. Asexual and puzzling sexual reproduction of the Mediterranean sponge Haliclona fulva (Demospongiae): life cycle and cytological structures // Invert. Biol. 2017. V. 136. P. 403–421.
Fell P.E. Porifera: Reproductive biology of Invertebrates. V. 6. Asexual Propagation and reproductive strategies. Adiyodi, K.G., Adiyodi, R.G., Eds. Chichester: John Wiley and Sons, Ltd., 1993. P. 1–44.
Gilbert S.F. Developmental Biology, 10th Edition. Sunderland: Sinauer Associates, 2013.
Gilbert S.F., Raunio A.M. Eds. Embryology. Constructing the Organism. Sunderland: Sinauer Associates, 1997. 537 p.
Hall B.K. Evolutionary developmental biology. Second ed. Amsterdam: Kluwer Acad Publ, 1998. 401 p.
Höhr D. Differenzierungsvorgänge in der keimenden Gemmula von Ephydatia fluviatilis. Wilhelm Roux’s Arch // 1977. V. 182. P. 329–346.
Jones W.C. The contractility and healing behaviour of pieces of Leucosotenia complicata // Quart. J. Microsc. Sci. 1957. V. 98. P. 203–217.
Kalinka A.T., Tomancak P. The evolution of early animal embryos: conservation or divergence? // Trends Ecol. Evol. 2012. V. 27. P. 385–393.
Lavrov A.I., Kosevich I.A. Sponge cell reaggregation: mechanisms and dynamics of the process // Russ. J. Dev. Biol. 2014. V. 45. P. 205–223.
Lavrov A.I., Kosevich I.A. Sponge cell reaggregation: cellular structure and morphogenetic potencies of multicellular aggregates // J. Exp. Zool. A Ecol. Genet. Physiol. 2016. V. 325. P. 158–177.
Minchin E.A. Sponges – phylum Porifera: Treatise on Zoology. V. 2. The Porifera and Coelenterata. Ray Lankaster, E., Ed. London: Adam and Charles Black, 1900. 421 p.
Minelli A., Schram F.R. Owen revisited: a reappraisal of morphology in evolutionary biology // Bijdr Dierkunde. 1994. V. 64. P. 65–74.
Owen R. On the Archetype and Homologies of the Vertebrate Skeleton. Paternoster Row: John van Voorst, 1848.
Peter I.S., Davidson E.H. Evolution of gene regulatory networks controlling body plan development // Cell. 2011. V. 144. P. 970–985.
Raff R.A. The Shape of Life: Genes, Development and the Evolution of Animal Form. Chicago. University of Chicago Press, 1996. 544 p.
Richardson M.K., Hanken J., Gooneratne M.L., Pieau C., Raynaud A., Selwood L., Wright G.M. There is no highly conserved embryonic stage in the vertebrates: implications for current theories of evolution and development. Anat. Embryol // 1997. V. 196. P. 91–106.
Richardson M.K., Allen S.P., Wright G.M., Raynaud A., Hanken J. Somite number and vertebrate evolution // Development. 1998. V. 125. P. 151–160.
Sander K. Specification of the basic body plan in insect embryogenesis // Adv. Insect Physiol. 1976. V. 12. P.125–238.
Sarà A., Cerrano C., Sarà M. Viviparous development in the Antarctic sponge Stylocordyla borealis Loven, 1868 // Polar Biol. 2002. V. 25. P. 425–431.
Scholtz G. Baupläne versus ground patterns, phyla versus monophyla: aspects of patterns and processes in evolutionary developmental biology. In: Evolutionary Developmental Biology of Crustacea. Balkema. Scholtz G., Ed., Lisse, 2004. P. 3–16.
Scholtz G. Homology and ontogeny: Pattern and process in comparative developmental biology // Theory Biosci. 2005. V. 124. P. 121–143.
Seidel F. Körpergrundgestalt und Keimstruktur: eine Erörterung über die Grundlagen der vergleichenden und experimentellen Embryologie und deren Gültigkeit bei phylogenetischen Überlegungen // Zool. Anz. 1960. V. 164. P. 245–305.
Simpson T.L. The cell biology of Sponges. Springer-Verlag. New York, 1984. 582 p.
Slack J.M.W., Holland P.M.H., Graham C.F. The zootype and the phylotypic stage // Nature. 1993. V. 361. P. 490–492.
Sollas W.J. Report on the Tetractinellida collected by H.S.M. Challendger during the years 1873-1876 // Rep. Sci. Res. Voyage Challenger Zool. 1888. V. 25. P. 1–458.
von Baer K.E. Űber Entwickelungsgeschichte der Thiere: Beobachtung und Reflektion. Köenigsberg, 1828. 310 p.
Watanabe Y. The development of two species of Tetilla (Demosponge) // Nat. Sci. Rep. Ochanomizu Univ. 1978. V. 29. P. 71–106.
Yanai I. Development and Evolution through the Lens of Global Gene Regulation // Trends Genet. 2018. V. 34. P. 11–20.
Дополнительные материалы отсутствуют.


