Онтогенез, 2019, T. 50, № 6, стр. 407-423
Шаг вверх, два шага вниз: порядок заложения органов цветка
М. В. Ремизова *
Московский государственный университет им. М.В. Ломоносова
119234 Москва, ул. Ленинские Горы, 1 (12), Россия
* E-mail: margarita.remizowa@gmail.com
Поступила в редакцию 13.05.2019
После доработки 01.06.2019
Принята к публикации 08.06.2019
Аннотация
У большинства покрытосеменных органы в цветке закладываются акропетально – от околоцветника к гинецею. В статье приведен обзор отклонений от типичного для цветков акропетального паттерна развития, которые можно встретить как в олигомерных, так и в полимерных циклических цветках. Растения, у которых обнаруживается один и тот же нетипичный для покрытосеменных паттерн развития цветка, не обязательно связаны близким родством, сходство в структуре и развитии их цветков скорее объясняется конвергентными особенностями организации и функционирования репродуктивной сферы. И наоборот, у представителей одного семейства наряду с обычным паттерном развития цветка зачастую можно обнаружить и отклоняющиеся варианты. Цветки родственных или неродственных растений, имеющие одинаковый план строения, могут демонстрировать как базовый характер морфогенеза, так и развиваться по несвойственному большинству цветковых пути. Иными словами, эволюция паттернов развития цветка весьма гомопластична. Неоднократный переход к нестандартным паттернам развития (и обратно) случался в эволюции покрытосеменных, по-видимому, очень легко и носил сальтационный характер.
ВВЕДЕНИЕ
Рассуждая об эволюции чего-либо, обычно имеют в виду, что эволюция изучаемой структуры, органа, процесса и т.п. движется от некоего исходного предкового состояния к приобретенному, продвинутому состоянию. Высшим растениям в этом смысле не повезло. Чарльз Дарвин уже давно высказался, что происхождение высших растений – “отвратительная тайна”. Отвратительность, по мнению автора теории происхождения видов путем естественного отбора, заключалась в том, что цветковые появились “внезапно” и за короткий промежуток времени дали большое разнообразие форм (Friedman, 2009). Появившись в меловом периоде как бы из ниоткуда, они радиировали с потрясающей скоростью (Herendeen et al., 2017), что противоречило учению Дарвина о постепенном и плавном характере эволюции. С тех пор мнение о скорости и самих механизмах эволюции подверглось значительному пересмотру. Однако, несмотря на весь прогресс современной ботанической науки “отвратительность” никуда не исчезла. Главным образом, до сих пор неясно, как и когда в эволюции семенных растений отделилась линия цветковых растений, как и каким образом произошло становление покрытосемянности, как и каким образом возникли цветки (Мейен, 1964; Красилов, 1989; Endress, 2006, 2019; Friis et al., 2006). Морфологов главным образом интересуют гомологии цветка и его частей с теми репродуктивными структурами, которые имеются у голосеменных. Второй вопрос – как именно выглядели цветки древнейших покрытосеменных и были ли они у них вообще, поскольку приобретение плодолистика с его замкнутой отграниченной от внешней среды завязью в эволюции группы могло произойти и до формирования цветков. Третий вопрос – являются ли покрытосеменные монофилетической группой или же становление покрытосемянности и цветка произошло независимо в разных группах растений. Обычно все эти вопросы рассматриваются в комплексе.
На данный момент устоялось мнение, что покрытосеменные представляют собой монофилетическую группу (например, Wickett et al., 2014; Magallón et al., 2015; Gitzendanner et al., 2018). Таким образом, можно предполагать наличие цветка предкового, исходного для всех покрытосеменных типа. Изучать эволюцию цветка только и можно, отталкиваясь от этого предкового состояния. Так сложилось, что строение цветка предкового типа нам, в сущности, неизвестно. Получаемые реконструкции “примитивного” цветка являются в какой-то степени следствием “научной моды” – в свое время в качестве предков покрытосеменных последовательно перебрали почти все имеющиеся современные и ископаемые группы голосеменных (Friis et al., 2011), соответственно с выбором голосеменного предка менялись и представления об исходном для покрытосеменных строении цветка: можно сравнить, например, взгляды Веттштейна (Wettstein, 1924) и Тахтаджяна (1964). Данные молекулярной филогенетики также не позволяют прояснить вопрос о предках цветковых растений поскольку они выявляются как сестринская группа по отношению ко всем современным голосеменным (например, Hansen et al., 1999; Donoghue, Doyle, 2000; Graham, Iles, 2009; Doyle, 2012). Сейчас ближайшим ископаемым родственником покрытосеменных полагают Caytonia (Doyle 2008, 2012; Taylor E.L., Taylor T.N., 2009; Endress, 2019), репродуктивные структуры которой совсем не похожи на цветки, но есть много общего в строении ее семенных капсул и семяпочек цветковых. Раз голосеменные нам не помощники, то остается выявлять исходное для покрытосеменных строение цветка, сравнивая современные (и ископаемые) цветки друг с другом. До наступления “эры” молекулярной филогенетики этим занимались, разрабатывая кодексы примитивности и продвинутости признаков (Имс, 1964; Тахтаджян, 1966, 1970; Базилевская и др., 1968; Endress, 2011a,b). Сейчас эволюцию признаков строения цветка пытаются изучать, используя методы компьютерного анализа, основанные на топологии молекулярно-филогенетических деревьев. У этих методов также есть ограничения – топологии получаемых деревьев в целом сходны между собой, но могут несколько различаться в зависимости от алгоритма построения и участков ДНК, выбранных для анализа, на маленьких выборках на результат сильно влияет набор таксонов, в молекулярное дерево по понятным причинам невозможно напрямую вставить ископаемые. Немаловажно, что для анализа морфологической эволюции целостность цветка искусственно разбивают на отдельные признаки, так как планами строения цветка (т.е. их диаграммами) компьютеры оперировать пока не научились.
Самые последние достижения в реконструкции цветка предкового типа таковы – исходный для покрытосеменных цветок был обоеполым, актиноморфным, со свободными органами, околоцветник был простой, т.е. из одинаковых элементов, без дифференциации на чашечку и венчик (Endress, Doyle, 2009, 2015; Sauquet et al., 2017). Возможно, все органы располагались кругами (Sauquet et al., 2018; Sokoloff et al., 2018). Это последнее утверждение “потрясает основы” нескольких последних десятилетий: длительное время считали, что для исходного цветка был характерен спиральный филлотаксис11.
Представления об исходном для цветка спиральном типе филлотаксиса (напр., Тахтаджян 1966; Cronquist, 1988; Endress, 1990) базировались на наблюдении, что такие цветки полимерные, т.е. имеют нефиксированное и обычно большое число органов (это сочетание признаков почти весь XX век считали примитивным, противопоставляя полимерные спиральные и олигомерные циклические цветки с относительно небольшим и фиксированным числом органов). Интересно отметить, что все цветки почти нацело делятся на спиральные и циклические, цветков со смешанным филлотаксисом очень мало (Endress, 2006; Sauquet et al., 2018; Sokoloff et al., 2018). Здесь явно есть некая пространственная закономерность. Большое число органов легче разместить по спирали, меньшее – чередующимися кругами (Хохряков, 1974; Endress, Doyle, 2007; Endress, 2006, 2011a). Растений со спиральными цветками относительно мало, они встречаются у базальных покрытосеменных, магнолиид и ранункулид (Endress, Doyle, 2009, 2015; Sauquet et al., 2017). Переход из одного состояния в другое осуществляется у растений, по-видимому, достаточно легко (Endress, 1987, 1990, 2006; Endress, Doyle, 2007, 2015), иногда это можно наблюдать даже в пределах одного цветка, например, у Magnoliaceae (Zagórska-Marek, 1994; Leins, Erbar, 2010). Упорядоченное расположение органов может сменяться на нерегулярное при очень маленьком размере органа относительно размера цветка (Endress, 2006, 2011a), особенно часто это происходит в цветках с многочисленными тычинками и плодолистиками. Таким образом, феномен “переключения” типа филлотаксиса можно объяснить отношением размера флоральной меристемы к размеру продуцируемых ей примордиев – чем больше это отношение, тем выше вероятность того, что органы будут располагаться по спирали. По-видимому, полимерные крупные цветки не следует считать примитивными, так как их появление не связано с проявлениями законов эволюции, а является следствием пространственной закономерности (Хохряков, 1974). Оба типа филлотаксиса обеспечивают наиболее оптимальную, компактную для разного числа органов упаковку бутона (Endress, 1987).
БАЗОВЫЕ ПАТТЕРНЫ МОРФОГЕНЕЗА ЦВЕТКА
Морфогенез цветка как специализированного репродуктивного побега с закрытым ростом– это последовательность заложения его органов, другое определение для растений как модульных организмов представить невозможно. Морфогенез цветка служит, в конечном счете, для получения дефинитивной структуры. Исходя из вышеозначенных неоспоримых признаков предкового цветка (обоеполые со свободными органами) и особенностей функционирования апикальных меристем логично предположить, что порядок заложения органов такой – сначала закладываются элементы околоцветника, затем андроцея и в последнюю очередь – гинецея. Таким образом, на флоральной меристеме в акропетальной последовательности появятся примордии элементов околоцветника, затем тычинок и плодолистиков (Endress, 2006, 2011b; Rudall, 2011). Отклонения от этого базового паттерна и будут проявлениями эволюции морфогенеза. Здесь имеется в виду именно порядок заложения, а не скорость формирования дефинитивной структуры, так как иногда органы, заложившись в “правильное” время, задерживаются в своем развитии, например, лепестки у многих высших двудольных. Отметим, что в недавних обзорах, посвященных базипетальным паттернам развития, приведены примеры обоих типов (Rudall, 2010, 2011).
Флоральная меристема закладывает органы несколько иначе, чем продуцирующая листовые примордии апикальная меристема побега (Classen-Bokhoff, 2016). Листья появляются поочередно по мере того, как апикальная меристема побега достигла некоего критического размера, чтобы стать способной отделить новый примордий, после этого размер апикальной меристемы восстанавливается и т.д. (Kwiatkowska, 2008; Barton, 2010). Таким образом, листья закладываются акропетально и никак иначе. Флоральная меристема перед началом заложения органов относительно крупная, терминация роста происходит еще до того, как появятся все примордии (Kwiatkowska, 2008; Landau et al, 2015; Classen-Bokhoff, 2016; Denay, 2017), у Arabidopsis, например, после заложения чашелистиков. После терминации роста по мере появления примордиев размер флоральной меристемы не увеличивается или увеличивается незначительно – она вся расходуется на заложение органов. Закрытый рост и заложение органов уже после того, как флоральная меристема достигла своего окончательного размера, предоставляют в конечном счете возможность отойти от строго акропетального заложения органов (Classen-Bokhoff, 2016).
В спиральных цветках отклонения от акропетального заложения органов, по-видимому, невозможны в силу геометрических закономерностей. В каждом узле прикрепляется единственный орган (рис. 1а), зачатки органов появляются постепенно через равные промежутки времени и равные угловые расстояния: в спиральных цветках угол между двумя последовательно заложившимися органами примерно равен 137.5° или реже 99.5° (Endress, 1987; 1990, 2011a; Endress, Doyle 2007; Leins, Erbar, 2010). Важным свойством спиральных цветков является также относительно большой объем флоральной меристемы, который значительно превышает размер продуцируемых ею примордиев, причем с самого начала развития цветка. Терминация флоральной меристемы, по-видимому, происходит здесь поздно, особенно в крупных цветках (Sokoloff et al., 2018). Собственно этим и объясняется как полимерность спиральных цветков, так и неопределенное число органов в них. Таким образом, в спиральных цветках все органы разновозрастные, расположенные на разных уровнях и разных радиусах (рис. 1а). Из-за этого они остаются свободными, срастаться им “неудобно” (Endress, 1987, 1990, 2011a). Можно сказать, что в спиральных цветках есть морфогенетический запрет на срастание органов.
Рис. 1.
Строго акропетальные паттерны развития цветков. а – спиральный цветок с простым околоцветником, координатная сетка помогает установить, что все органы находятся на разном удалении от центра цветка и на разных радиусах. б – циклический цветок высшего двудольного с простой полиандрией. в – олигомерный цветок высших двудольных. г – типичный цветок однодольного растения. На всех рисунках для каждого варианта представлены диаграммы четырех последовательных стадий развития и схема продольного разреза сформированного цветка, на которой стрелками показано направление заложения органов. Черные плоские дуги – элементы простого околоцветника, черные выпуклые дуги – чашелистики. Белые дуги – лепестки. Овалы – тычинки. Круг – гинецей (вне зависимости от его строения). На диаграммах не показано срастание органов.
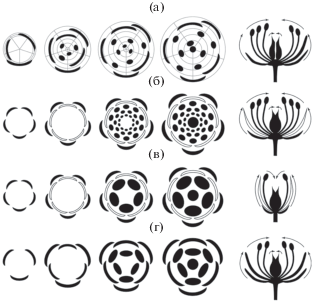
Интересно, что у однодольных спиральные цветки отсутствуют (Endress, 1995; Remizowa et al., 2010). В этой монофилетической группе растений циклический цветок был унаследован от общего предка. У подавляющего большинства однодольных цветки тримерные пентациклические с двукруговым околоцветником. Потеря одного из кругов или реже околоцветника целиком у однодольных случается, но увеличение числа кругов околоцветника у однодольных не реализуется. Циклическое расположение элементов околоцветника диктует расположение кругами и остальных органов, даже если они в большом и неопределенном числе.
Циклические цветки более разнообразны в паттернах строения и развития (Endress, 1987, 1990, 2011a; Leins, Erbar, 2010). Органы в пределах круга располагаются на одном уровне, причем обычно из-за чередования кругов органы n и n + 2 кругов расположены на одинаковых радиусах (рис. 1б–1г). Это дает возможность для срастания органов. С геометрической точки зрения циклические цветки характеризуют еще два понятия – число кругов (полнота цветка) и число органов в круге (меризм). Число кругов редко превышает 5, а число органов в круге – 6–7 (обычно 3 у однодольных и 5 у высших двудольных). Можно добавить, что околоцветник в циклических цветках обычно двукруговой (рис. 1б–1г). Таким образом, циклические цветки принципиально олигомерные. Полимерные циклические цветки (меризм и полнота варьируют относительно независимо!) встречаются реже (Endress, 2011a; Ronse De Craene, 2016).
У многих групп растений с циклическими цветками можно наблюдать эквифинальность морфогенеза – один и тот же план строения цветка (по полноте и меризму) обеспечивается несколько разным морфогенезом (например, Ajani et al., 2016; Erbar, Leins, 1997; Erbar, 2010). Обычно вариации связаны с одновременным или неодновременным заложением органов в пределах одного круга. Хорошим примером могут служить однодольные с тримерным пентациклическим цветком, у которых в зависимости от строения соцветия элементы околоцветника и иногда андроцея закладываются в пределах одного круга одновременно или поочередно (Remizowa et al., 2013). Интересно отметить, что одновременность или неодновременность заложения элементов околоцветника (и других органов) почти никак не влияет на возможность их срастания друг с другом. Одновременность заложения до какой-то степени важна только при постгенитальном срастании органов одного круга. При постгенитальном срастании органы закладываются по отдельности и затем слипаются эпидермами, здесь важно, чтобы срастающиеся участки соседних органов соответствовали друг другу (см. Endress, 2006 – явление синорганизации). Если такого соответствия нет, то срастание откладывается на более поздние стадии развития цветка, когда участвующие в срастании органы выравняются в размерах.
ОТКЛОНЕНИЯ ОТ АКРОПЕТАЛЬНОГО ПАТТЕРНА ЗАЛОЖЕНИЯ ОРГАНОВ
Околоцветник. Астериды
В соцветиях-корзинках Asteraceae (Asterales), многоцветковых соцветиях Valerianaceae s.str. (Dipsacales), у некоторых Apiaceae (Apiales) и Acanthaceae (Lamiales) отклонения от акропетального паттерна заложения органов можно наблюдать в околоцветнике (рис. 2а): чашелистики закладываются после лепестков, обычно одновременно с тычинками (Sattler, 1973; Harris, 1995; Erbar, Leins, 1997; Schönenberger, Endress, 1998; Schönenberger, 1999; Erbar, 2010; Ajania et al., 2016). У астерид, к которым относятся все четыре семейства, этот феномен объясняется общей тенденцией к редукции чашечки. У Apiaceae и Acanthaceae степень развития чашелистиков разная, они меньше лепестков и даже иногда отсутствуют. У Apiaceae функцию защиты бутона выполняют лепестки (в отличие от большей части высших двудольных они здесь не задерживаются в развитии), дополнительную защиту обеспечивают листья внутри соцветия и непосредственно под ним. Время заложения чашечки варьирует у разных представителей, пять чашелистиков закладываются перед лепестками, одновременно с ними или после них (Erbar, Leins, 1997; Erbar, 2010; Ajania et al., 2016). При плоде чашечка у зонтичных не сохраняется. Для Acanthaceae характерны те же тенденции, но функцию защиты бутона на ранних стадиях берут на себя сросшиеся прицветнички (Schönenberger, Endress, 1998; Schönenberger, 1999), число сросшихся чашелистиков не всегда стабильно, чашечка может состоять из большего, чем пять, числа узких чашелистиков, иногда их число невозможно установить, так как свободные верхушки у них не выражены. У сложноцветных чашечка преобразуется в структуры так называемого паппуса (волоски, щетинки, пленки), способствующие распространению плодов-семянок, или исчезает совсем. Плотность соцветий у сложноцветных такова, что цветкам чашечка как защита бутона, в сущности, не нужна (Sattler, 1973; Harris, 1995). У сложноцветных эту роль по отношению ко всему соцветию выполняют листочки обертки корзинки. У Valerianaceae s.str. чашечка разрастается только ко времени формирования плода, обычно она выглядит, как кольцо с щетинками, т.е. очень похожа на паппус сложноцветных. При эволюционных преобразованиях чашечки чашелистики некоторых акантовых, многих сложноцветных и валериановых полностью утратили свою индивидуальность, предполагаемое число чашелистиков (их 5) можно установить только при обращении к родственным формам (Cronquist, 1955; Schönenberger, Endress, 1998; Schönenberger, 1999; Semple, 2006; Endress, 2008, 2011b; Naghiloo, Classen-Bockhoff, 2017).
Рис. 2.
Цветки с базипетальным развитием околоцветника. а – цветок астерид с заложением чашечки после венчика, также возможны варианты (не показаны), в которых чашелистики закладываются одновременно с андроцеем или гинецеем. б – цветок с подчашием Dipsacaceae s.str., также возможны варианты (не показаны), в которых чашелистики закладываются перед или после заложением тычинок. в – цветок с подчашием Rosaceae. Листочки подчашия показаны угловатыми дугами.
Околоцветник. Цветки с подчашием
Подчашие, которое представляет собой листочки, расположенные снаружи от чашелистиков, отмечено у нескольких неродственных групп высших двудольных – в порядке Dipsacales, семействах Malvaceae (Malvales), Rosaceae и Dirachmaceae (Rosales), Lythraceae (Myrtales) и т.д., среди однодольных подчашие имеется у Tofieldiaceae (Alismatales). Природа этого образования не во всех случаях до конца ясна, вероятнее всего подчашие возникало независимо в вышеперечисленных группах. Обычно листочки подчашия закладываются перед чашелистиками, что соответствует базовому акропетальному паттерну формирования околоцветника – например, у Malvaceae (Bello et al., 2016), Dirachmaceae (Ronse De Craene, Miller, 2004) и Tofieldiaceae (Remizowa et al., 2006). У Dipsacaceae s.str в плотных головчатых соцветиях развитие цветка с базипетальными паттернами формирования околоцветника начинается с листочков подчашия (рис. 2б), затем закладываются лепестки. Время появления чашечки запаздывает по-разному у изученных родов (Naghiloo, Classen-Bockhoff, 2017). Таким образом, чашечка развивается базипетально по отношению к венчику, как у и многих астерид без подчашия. У не образующих плотных соцветий Rosaceae, если листочки подчашия в числе чашелистиков, то они закладываются немного позже чашечки (рис. 2в), обычно почти одновременно с лепестками, если последние имеются (Innes et al., 1989; Ronse De Craene, 2003; Hollender et al., 2012). Паттерн заложения элементов подчашия у таких розоцветных с трудом поддается описанию и является, скорее, предметом договора. Обычно в развитии видно, что закладывающиеся чашелистики уже соединены некими меристематическими валиками, если принять эти валики за элементы подчашия, то следует говорить об одновременном заложении чашечки и подчашия. У Lythrum (Lythraceae) листочки подчашия (их число равно числу чашелистиков) также закладываются после чашечки базипетально (Cheung, Sattler, 1967; Sattler, 1973). Базипетальное заложение многочисленных элементов подчашия, появляющихся значительно позже чашелистиков (когда уже имеются почти все остальные органы цветка), можно наблюдать у Neuradaceae: Malvales и Agrimonia: Rosaceae (Decraene, Smets, 1995).
Если интерпретировать подчашие как часть цветка, то имеет место нарушение акропетального паттерна в пределах околоцветника, но общий порядок заложения органов – околоцветник, андроцей, гинецей – остается неизменным.
Андроцей. Полиандрия
Большая часть отклонений от акропетального порядка заложения органов встречается в циклических цветках с полимерным андроцеем (Rudall, 2010, 2011; Leins, Erbar, 2010; Endress, 2006, 2011a; Ronse Decraene, Smets, 1992, 1993a). Такие цветки имеют некоторое сходство со спиральными цветками – они крупные и число тычинок (но не остальных органов) в них неопределенно большое.
Полиандрию (рис. 3) вне зависимости от типа филлотаксиса цветка принято разделять на простую и комплексную (Ronse Decraene, Smets, 1992, 1993a; Leins, Erbar, 2010). При простой полиандрии все многочисленные тычинки закладываются индивидуальными примордиями. При комплексной полиандрии сначала появляются один кольцевой или несколько (обычно 5) первичных примордиев, на которых затем уже закладываются индивидуальные тычинки, в последнем случае тычинки расположены пучками. Кольцевые первичные примордии (иногда говорят о кольцевой меристеме) образуются исключительно на выпуклом или плоском к моменту их появления цветоложе. Тычинки в таких цветках при малом размере их примордиев неупорядоченно заполняют все доступное пространство, при относительно крупных примордиях закладываются чередующимися кругами или группами. При заложении пучками индивидуальные примордии тычинок располагаются в шахматном порядке или радиальными рядами (Leins, Erbar, 2010; Endress, 2006, 2011a; Ronse Decraene, Smets, 1992, 1993a). Комплексная полиандрия отмечена только у высших двудольных, в не связанных близким родством группах (Endress 2006, 2011a,b; Leins, Erbar, 2010),
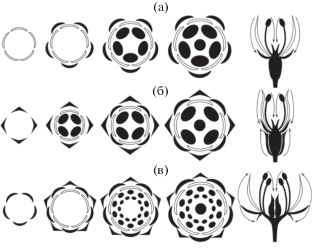
Рис. 3.
Развитие цветков с полиандрией. а – простая полиандрия на гипантии/вогнутом цветоложе. б – комплексная полиандрия с акропетальным заложением тычинок на кольцевом первичном примордии. в – комплексная полиандрия с акропетальным заложением тычинок на нескольких первичных примордиях. г – комплексная полиандрия с базипетальным заложением тычинок на кольцевом первичном примордии. д – комплексная полиандрия с базипетальным заложением тычинок на нескольких первичных примордиях. Серым показаны склоны гипантия/вогнутого цветоложа. Пунктирные линии – границы первичных примордиев.

При комплексной полиандрии индивидуальные примордии тычинок (все или частично) появляются после заложения гинецея. При простой полиандрии всегда только часть тычинок могут закладываться после гинецея. Практически во всех отклоняющихся от типичного паттерна случаях акропетальный порядок появления околоцветника, андроцея и гинецея как совокупностей соответствующих органов сохраняется (Endress, 2006). Эти отклонения в полиандричных цветках можно разделить на два типа – с сохранением акропетальной последовательности заложения тычинок и с базипетальным заложением тычинок.
Простая полиандрия и задержка заложения внутренних тычинок. Эта ситуация возможна только в цветках с гипантием (рис. 3а). Гипантий представляет собой вогнутое чашевидное, блюдцевидное или бокальчатое образование, на котором по внешнему его краю и склонам прикрепляются околоцветник и андроцей, а на дне – гинецей. В ходе морфогенеза цветка с простой полиандрией склоны гипантия начинают формироваться в основном уже после того, как заложились элементы околоцветника, внешние тычинки и гинецей, сами примордии плодолистиков еще могут быть не видны, но граница будущего гинецея видна четко. В процессе формирования гипантия цветоложе начинает разрастаться, в результате чего андроцей как бы отодвигается от гинецея. Рост гипантия продолжается достаточно долго так, что свободное пространство между гинецеем и уже заложенными тычинками становится достаточным для размещения новых примордиев, и на нем появляются примордии тычинок. В случае простой полиандрии все тычинки закладываются кругами, у самых внутренних тычинок расположение может становиться нерегулярным, если примордии тычинок маленькие относительно диаметра гипантия (Endress, 2006, 2011a). Чем дольше продолжается рост гипантия, тем больше можно разместить на нем “дополнительных” тычинок (Ronse Decraene, Smets, 1991, 1992). Таким образом, в цветках с гипантием часть тычинок закладываются позже плодолистиков (рис. 3а). При этом в самом андроцее, если рассматривать его отдельно, акропетальный порядок заложения органов сохраняется – дополнительные тычинки появляются внутри от уже имеющихся. В качестве примеров можно привести Geum и Rosa: Rosaceae: Rosales (Ronse Decraene, Smets, 1992; Maas et al., 1995), Acca и Rhodomyrtus: Myrtaceae: Myrtales (Ronse Decraene, Smets, 1991, 1992), Punica: Lythraceae: Myrtales (Ronse Decraene, Smets, 1991) и Deinanthe: Hydrangeaceae: Cornales (Hafford, 1998).
Отдельного внимания заслуживает то, что при увеличении размеров гипантия на нем закладываются дополнительно именно тычинки, а не элементы околоцветника или плодолистики. Рост гипантия в данном случае организован так, что увеличение его размеров происходит между андроцеем и гинецеем – это не дает возможности увеличить число органов околоцветника. С плодолистиками сложнее. В случаях с ценокарпным гинецеем “нежелательность” появления дополнительных плодолистиков еще как-то объяснима – к целостной конструкции, приспособленной к определенному типу опыления, роста пыльцевых трубок, вскрыванию плода нерационально пристраивать снаружи что-то дополнительное. Но и в апокарпном гинецее дополнительные плодолистики снаружи от уже имеющихся не появляются. Здесь это можно объяснить тем, что новые объемы меристематической ткани постепенно появляются со стороны андроцея, и новые примордии размещаются, ориентируясь на ближайшие к ним примордии тычинок, а не на плодолистики. В таких условиях расположение плодолистиков не было бы однородным. Другое объяснение состоит в том, что плодолистики, если они расположены более чем в один круг, “умеют” закладываться только акропетально ко внутри от уже имеющихся плодолистиков, “обратный” базипетальный ход по каким-то причинам в гинецее невозможен. Вероятно, базипетальный паттерн можно было бы организовать и в гинецее, если бы прирост гипантия шел в направлении от гинецея, а не наоборот.
Цветки с гипантием не обязательно имеют много кругов тычинок. У многих бобовых андроцей двукруговой, но примордии внутренних тычинок появляются после (иногда значительно) заложения гинецея, как только гипантий подрастет настолько, чтобы предоставить им место (например, Prenner, 2003; Tucker, 2000, 2003a).
Комплекная полиандрия с сохранением акропетального заложения тычинок. При комплексной полиандрии (рис. 3б–3д) сначала появляется, как было сказано выше, первичный кольцевой или несколько отдельных первичных примордиев андроцея (Ronse Decraene, Smets, 1991, 1992; Leins, Erbar, 2010). Ко времени формирования индивидуальных тычинок андроцей хорошо отграничен от гинецея, даже если индивидуальные плодолистики еще плохо заметны – у подавляющего большинства растений с комплексной полиандрией гинецей ценокарпный с конгенитально сросшимися плодолистиками, формироваться такой гинецей начинает как единое целое. При формировании кольцевого примордия на выпуклом или плоском цветоложе многочисленные индивидуальные тычинки на нем закладываются чередующимися кругами, мерность которых значительно превышает мерность околоцветника, или без видимого порядка заполняют все отведенное им пространство. Кольцевые примордии с акропетальным заложением тычинок (рис. 3б) можно наблюдать, например, у Papaver, Eschscholzia: Papaveraceae: Ranunculales (Ronse Decraene, Smets, 1990, 1992, 1993a; Ronse De Craene, 2003), Nelumbo: Nelumbonaceae: Proteales (Hayes et al., 2000), Acacia: Leguminosae: Fabales (Ronse Decraene, Smets, 1992; Prenner, 2011), Caloncoba, Camptostylus: Achariaceae: Malpighiales (Bernhard, Endress, 1999). В цветках с гипантием (т.е. на вогнутом цветоложе) образуются отдельные первичные примордии пучков тычинок (рис. 3в). Характерно, что пучки тычинок расположены напротив лепестков и даже конгенитально срастаются с ними –на основании молодого лепестка с внутренней, обращенной к гинецею его стороне появляется первичный примордий андроцея. По мере роста гипантия первичные примордии подрастают по направлению к гинецею, и уже на них в акропетальном направлении закладываются индивидуальные тычинки. Этот редкий паттерн развития цветка найден, например, у Melaleuca, Callistemon и Chamaelaucium из семейства Myrtaceae (Ronse Dectaene, Smets, 1991; Orlovich et al., 1998; Leins, Erbar, 2010).
Комплексная полиандрия с базипетальным заложением тычинок. У большей части растений с комплексной полиандрией индивидуальные тычинки на первичных примордиях закладываются базипетально – от гинецея к околоцветнику, многочисленные примеры приведены в обобщающих работах (например, Corner, 1946; Ronse Decraene, Smets, 1992; Endress, 2006, 2011a; Leins, Erbar, 2010). Таким образом, при комплексной базипетальной полиандрии не только тычинки закладываются после плодолистиков (но не андроцей целиком!), но и нарушен базовый акропетальный паттерн их появления.
Базипетальный паттерн может реализовываться на первичном кольцевом примордии (рис. 3г): тычинки закладываются чередующимися кругами или без определенного порядка, равномерно заполняя отведенное им пространство – например, у Dilleniaceae: Dilleniales (Endress, 1997), Salicaceae: Malpighiales (Bernhard, Endress, 1999), Capparaceae: Brassicales (Ronse Decraene, Smets, 1997), Lecythidaceae: Ericales (Tsou, Mori, 2007) и даже очень редко у Leguminosae: Swartzia (Tucker, 2003b). Второй вариант – заложение тычинок группами (рис. 3д), например, у Malvaceae: Malvales и Loasaceae: Cornales (Ronse Decraene, Smets, 1992; Leins, Erbar, 2010). Особенность кольцевого базипетального варианта (рис. 3г) в том, что при основании кольцевого примордия может начаться зональный рост – цветоложе вместе c первичным кольцевым примордием подрастает в направлении заложения тычинок, что позволяет получить большее их число. В случаях, когда зональный рост сосредоточен исключительно под андроцеем, формируется тычиночная трубка, как у Malvaceae.
При формировании пучков тычинок (рис. 3д) они чаще чередуются с лепестками – Hypericaceae: Malpighiales (Ronse Decraene, Smets, 1992; Leins, Erbar, 2010), Paeoniaceae: Saxifragales (Leins, Erbar, 2010), Philadelphus, Carpenteria: Hydrangeaceae: Cornales (Roels et al., 1997; Hufford, 1998), а если и расположены напротив них, то не образуют с ними комплекса – лепесток и противолежащий ему пучок тычинок закладываются отдельно – Theaceae: Ericales (Leins, Erbar, 2010), Lagerstroemia: Lythraceae: Myrtales (Ronse Decraene, Smets, 1991). Первичные примордии пучков тычинок появляются на выпуклом или вогнутом цветоложе. При вогнутом цветоложе происходит формирование гипантия, который удлиняется вместе с первичными примодиями андроцея по направлению к околоцветнику. На выпуклом цветоложе (у Hypericaceae) дополнительного роста цветоложа, насколько можно судить, нет – первичные примордии сразу формируются “нужного” размера.
Инвертированные цветки. Инвертированные цветки (рис. 4), несомненно, – самый интересный случай как отклонения от типичного для покрытосеменных плана строения цветка, так и от акропетального заложения органов. В инвертированных цветках андроцей занимает место гинецея в центре цветка, гинецей же расположен ближе к околоцветнику, на месте тычинок. Инвертировано и число соответствующих органов – тычинки в небольшом числе, в то время как плодолистиков много. Цветки такого строения найдены только у однодольной Lacandonia (Triuridaceae, Pandanales, рис. 4а) и у базального покрытосеменного Trithuria (Hydatellaceae, Nymphaeales, рис. 4б). Интерпретация репродуктивных структур Lacandonia как цветков общепринята (Ambrose et al., 2006; Rudall, 2008; Álvarez-Buylla, 2010). Относительно Trithuria существуют 2 точки зрения: ее репродуктивные единицы некоторые авторы считают псевдантиями – конденсированными соцветиями из редуцированных мужских и женских цветков (Endress, Doyle, 2009; Endress, 2010a), другие же придерживаются эвантовой интерпретации (Rudall et al., 2009; Sokoloff et al., 2010). В обоих родах околоцветник циклический, плодолистики свободны. Примечательно, что типичный порядок заложения околоцветник-андроцей-гинецей не нарушен (Ambrose et al., 2006; Rudall et al., 2007, 2009; Sokoloff et al., 2010). Сначала закладывается околоцветник, затем в центре цветка появляются тычинки, после них базипетально появляются примордии плодолистиков, самые молодые плодолистики находятся возле околоцветника. В обычных цветках при базовом акропетальном характере заложения органов определение позиции новых органов определяется уже имеющимися, в циклических цветках это приводит к четкому чередованию кругов органов. В инвертированных цветках этому требованию отвечает только околоцветник. Начиная с андроцея, у Trithuria (рис. 4б) расположение органов становится неупорядоченным (Rudall et al., 2007, 2009; Sokoloff et al., 2010). У Lacandonia (рис. 4а) после заложения околоцветника в центре цветка появляются три крупных округлых первичных примордия, они удлиняются с ростом цветоложа, затем на первичных примордиях появляется крупный зачаток тычинки и два ряда расположенных ниже него зачатков плодолистиков (Ambrose et al., 2006; Álvarez-Buylla, 2010). Одновременно с заложением тычинок появляются первичные примордии второй очереди (предназначенные только для заложения плодолистиков), они занимают три свободных сектора флоральной меристемы, первый плодолистик здесь закладывается ближе к тычинкам, остальные появляются ниже двумя рядами. На всех шести первичных примордиях по мере удлинения цветоложа в базипетальном направлении закладываются новые плодолистики. Сравнивая с комплексной базипетальной полиандрией можно сказать, что именно наличие общих примордиев является некоторой гарантией упорядоченного расположения органов, находящихся между околоцветником и центром цветка. Базипетальное развитие гинецея и андроцея можно наблюдать не только в обоеполых, но и в однополых цветках Hydatellaceae (Rudall et al., 2007), в то время как у Triuridaceae с однополыми цветками базипетальный характер заложения плодолистиков наблюдается только у Triuris (Ambrose et al., 2006), у остальных изученных родов все плодолистики закладываются одновременно на общем складчатом примордии или кругами в акропетальной последовательности (Rudall, 2008).
Рис. 4.
Развитие инвертированных цветков. а – Lacandonia. б – Trithuria. Пунктирные линии – границы первичных/общих примордиев.

Инверсия “гинецей-андроцей” произошла, вероятно, из-за того, что представителям Hydatellaceae и Triuridaceae изначально были свойственны однополые цветки и при переходе к обоеполому цветку андроцей и гинецей поменялись местами. Большая часть Triuridaceae – действительно, двудомные растения. Положение Lacandonia, единственного представителя семейства с обоеполым цветком, на молекулярно-филогенетических деревьях (например, Mennes et al., 2013) не оставляет сомнений во вторичном приобретении этим родом обоеполого цветка. С Trithuria такой красивой картины не получается. Примерно половина видов Trithuria – двудомные или однодомные растения с однополыми цветками, вторая половина – имеют обоеполые цветки (Sokoloff et al., 2008). Результаты анализа эволюции половой принадлежности цветков на молекулярно-филогенетических деревьях не дают однозначного результата (Anger et al., 2017, Graham et al., 2019).
Цветки с общими примордиями элементов околоцветника и тычинок. У некоторых высших двудольных с однокруговым или двукруговым андроцеем лепестки и противолежащие им тычинки закладываются общим примордием (Ronse Decraene et al., 1993). Часто такие цветки приводят как пример нарушения акропетального порядка заложения органов – лепестки после тычинок (см. Sattler, 1973; Rudall, 2009, 2011). Уже само наличие общего примордия является свидетельством того, что лепестки закладываются одновременно с противолежащими им тычинками. У растений с однокруговым андроцеем развитие цветка начинается с заложения чашелистиков, затем, чередуясь с чашелистиками, появляются общие примордии лепестков и тычинок, последним закладывается гинецей, т.е. акропетальный порядок заложения околоцветника, андроцея и гинецея не нарушен (рис. 5а). У каждого из общих примордиев с самого начала присутствует “перетяжка” или углубление, разделяющая примордий на две части – из внешней, как правило, меньшей части развивается лепесток, а из крупной внутренней – тычинка. Тычинки в таких цветках не чередуются с лепестками. Подобный паттерн развития встречается у неродственных групп, например у представителей Primulaceae: Ericales (Ronse Decraene, Smets, 1995) и Plumbaginaceae: Caryophyllales (De Laet et al., 1995).
Рис. 5.
Развитие цветков с общими примордиями элемент околоцветника + тычинка. а – цветок высшего двудольного с однокруговым андроцеем. б – цветок высшего двудольного с двукруговым андроцеем, тычинки напротив чашелистиков в наружном круге. в – цветок высшего двудольного с двукруговым андроцеем, тычинки напротив чашелистиков во внутреннем круге. г – цветок однодольного с шестью общими примордиями. д – цветок однодольного с тремя общими примордиями. Пунктирные линии – границы общих примордиев. На схемах продольных разрезов линиями без стрелок показаны органы, заложившиеся одновременно.

У высших двудольных в пентамерных или тетрамерных цветках с двукруговым андроцеем также возможны общие примордии лепестков и противолежащих им тычинок (рис. 5б–5в), при этом тычинки, лежащие напротив чашелистиков, закладываются “самостоятельно”. Последовательность развития цветка в большинстве подобных изученных случаев выглядит так – сначала на флоральной меристеме появляются примордии чашелистиков, затем одновременно примордии “свободных” тычинок и общие примордии лепестков и противолежащих им тычинок, последним закладывается гинецей (см. также Endress, 2010b). Интересным свойством этого паттерна развития, является то, что положение лежащих напротив чашелистиков тычинок может быть как снаружи, так и внутри от тычинок, расположенных на радиусе лепестков. Более того, изначальный характер их расположения может измениться в ходе развития цветка (Endress, 2010b, Leins, Erbar, 2010). Цветки такого устройства можно обнаружить, например, у Caryophyllaceae: Caryophyllales и Geraniaceae: Geraniales (Ronse Decraene, Smets, 1995; Ronse Decraene et al., 1998, Endress, 2010b).
В литературе часто можно встретить указания, что время появления общих примордиев лепестков и тычинок может быть различным. Для некоторых таксонов считают, что они появляются следующими за примордиями чашелистиков, опережая заложение “свободных” тычинок, для других – что сначала закладываются тычинки напротив чашелистиков и только после них появляются общие примордии (см. например Ronse Decraene, Smets, 1993b, 1995). Оба этих варианта при внимательном рассмотрении являются ошибкой интерпретации данных. Во-первых, расположенные напротив лепестков тычинки (в данном случае в комплексе с лепестками) никогда не закладываются раньше тычинок, расположенных напротив чашелистиков (Endress, 2010b). Во-вторых, относительное время заложения органов устанавливают исходя из размера примордиев (более крупные свидетельствуют о более раннем их появлении), но у двудольных с двукруговым андроцеем примордии лепестков и примордии расположенных напротив них тычинок обычно более мелкие, чем примордии тычинок напротив чашелистиков (Endress, 2010b). И в-третьих, изображений развивающихся цветков, на которых имеются только общие примордии или только примордии “свободных” тычинок и отсутствуют примордии другого типа обнаружить не удается.
У растений с тримерными цветками также встречаются общие примордии элементов околоцветника и тычинок. Среди высших двудольных можно отметить Caulophyllum: Berberidaceae: Ranunculales (Brett, Posluszny, 1982). У Caulophyllum два круга чашелистиков и два круга лепестков. И лепестки, и противолежащие им тычинки закладываются общими примордиями – сначала внешние, затем внутренние общие пары. Из-за наличия общих примордиев можно было бы сказать, что внутренние лепестки (но не весь околоцветник целиком) закладываются позднее внешних тычинок. Тем не менее в данном случае правильнее говорить об одновременном заложении венчика и андроцея, так как разделение всех общих примордиев на соответствующие части начинается одновременно.
В тримерных цветках однодольных два круга элементов околоцветника и два круга тычинок. У Allium: Amaryllidaceae: Asparagales (Sattler, 1973), Tofieldia: Tofieldiaceae: Alismatales (Remizowa et al., 2006a) и Scheuchzeria: Scheuchzeriaceae: Alismatales (Posluszny, 1983; Volkova et al., 2016) и внешние, и внутренние листочки простого околоцветника закладываются общими примордиями с тычинками (рис. 5г). Все шесть общих примордиев появляются практически одновременно (наружные лишь немного ранее внутренних, лучше это заметно у Allium) и одновременно же разделяются на индивидуальные примордии листочков околоцветника и тычинок. Последним закладывается гинецей. Таким образом, заложение околоцветника и андроцея происходит одновременно.
У большей части однодольных, где обнаружены общие примордии (см. Endress, 1995; Hardy, Stevenson, 2000; Narita, Takahashi, 2008; Remizowa et al., 2012), они формируются только для внутренних элементов околоцветника и тычинок, причем околоцветник может быть как простой, так и двойной, с сильной дифференциацией наружных и внутренних элементов (рис. 5д). Как правило, после заложения внешних элементов околоцветника одновременно появляются примордии наружных тычинок и общие примордии внутренних элементов околоцветника и тычинок. Таким образом, внутренние элементы околоцветника и андроцей закладываются одновременно. Для некоторых Сommelinaceae в литературе имеются сообщения о базипетальном развитии андроцея – наружные тычинки закладываются позднее появления общих примордиев (Hardy, Stevenson, 2000). Эту точку зрения можно опровергнуть, так как после заложения внешних тычинок на них сильно давят развивающиеся чашелистики, из-за этого наружные тычинки несколько задерживаются в развитии, их примордии меньше по размеру, что создает видимость позднего их заложения (см. также Endress, 2010b).
Итак, в олигомерных цветках с однокруговым или двукруговым андроцеем наличие общих примордиев околоцветника и тычинок приводит к одновременному заложению по крайней мере внутренних элементов околоцветника и всего андроцея. С чем связано наличие общих примордиев с эволюционной точки зрения – не совсем понятно. У двудольных общие примордии лепестков и тычинок отмечены только у растений с верхней завязью. У однодольных наличие общих примордиев не коррелирует, как кажется, ни с чем – они отмечены при любом положении завязи и любом типе околоцветника. Адаптивный смысл наличия общих примордиев также неясен. Архитектура цветков с общими примордиями весьма разнообразна и может быть достигнута и без их наличия. Синдромы опыления также самые разные. Можно было бы предположить, что в силу одновременного заложения большого числа органов сокращается абсолютное время развития цветка, но и это предположение не находит подтверждения.
ОБСУЖДЕНИЕ
Как видно из приведенных выше примеров, случаи отклонения от строго акропетального заложения органов в цветках не редки. С уверенностью можно сказать, что этот феномен не встречается в спиральных цветках. У однодольных базипетальные паттерны отмечены только у некоторых Triuridaceae (Ambrose et al., 2006; Rudall, 2008; Álvarez-Buylla, 2010). Другие приведенные Рудалл (Rudall, 2011) примеры базипетального заложения органов у однодольных, строго говоря, таковыми не являются. Например, одновременное заложение тычинок и внутренних элементов околоцветника не свидетельствует о базипетальном заложении последних. В цветках с многочисленными тычинками при строго акропетальном порядке их заложения иногда внешние тычинки задерживаются в развитии, что связано, вероятно, с давлением на них околоцветника. Более сложный случай представляют пальмы (Arecaceae: Arecales) с полимерным андроцеем. В оригинальных исследованиях (Uhl, Moore, 1977, 1980; Uhl, Dransfield, 1984; Uhl, 1988) показано, что у полиандричных пальм тычинки закладываются акропетально кругами или группами в виде дуг и секторов. При заложении тычинок группами сначала появляются группы напротив внешних элементов околоцветника, затем – напротив внутренних. Если тычинки закладываются секторами, то внутри сектора они появляются акропетально, располагаясь без видимого порядка. В самых многотычинковых цветках, все многочисленные неупорядоченно расположенные тычинки закладываются одновременно, но примордии крупнее ближе к центру цветка и тычинки, расположенные по периферии цветка, запаздывают в развитии.
В циклических олигомерных цветках высших двудольных базипетальные паттерны связаны как правило с околоцветником, а в полимерных – с андроцеем. Рудалл (Rudall, 2009, 2011), систематизируя разнообразие случаев базипетального заложения органов, предлагает выделять интразональные и интерзональные базипетальные паттерны. Под зоной она понимает совокупность органов одного типа – зона чашелистиков, лепестков, тычинок или плодолистиков. Для однодольных деление околоцветника на зоны не уточняется. Большинство выявленных случаев базипетального заложения органов относятся к интразональным паттернам – органы закладываются базипетально в пределах одной зоны, как правило, это цветки с полимерным андроцеем. Из них необходимо удалить случаи задержки развития органов после их заложения, например, у Aquilegia (Ranunculaceae) многочисленные тычинки закладываются акропетально, но их созревание происходит базипетально (Feng et al., 1995; Tuker, Hodges, 2005; Ren et al., 2011). Интерзональные варианты, встречающиеся в олигомерных цветках, более редки, здесь вся зона закладывается позже расположенной выше нее зоны, например, лепестки после тычинок. Надо сказать, что интерзональные варианты еще более редки, чем предлагает Рудалл (Rudall, 2009, 2011). Так, при заложении элементов околоцветника и противолежащих им тычинок общими примордиями нарушения акропетального порядка заложения органов, строго говоря, не происходит. Некоторые из приведенных примеров являются результатом спорной интерпретации исходных данных. Например, развитие цветка Valeriana в исходной работе Саттлер (Sattler, 1973) описывает так: сначала тычинки, затем лепестки, чашечка и гинецей. Приведенные иллюстрации, однако, свидетельствуют, что венчик закладывается по крайней мере одновременно с тычинками (на общем кольцевом меристематическом валике), такую последовательность заложения органов наблюдали и у Centranthus из того же семейства (Erbar, Leins, 1996). Тоже самое можно сказать и про Stylidium (Stylidiaceae, Asterales) – согласно Саттлеру (Sattler, 1973) развитие цветка этого растения также начинается с тычинок, затем появляются чашелистики и венчик. На иллюстрациях же видно, что венчик появляется одновременно с тычинками, а до этого – чашечка, именно такую картину описала Эрбар (Erbar, 1992). Оба растения имеют спайнолепестный венчик, закладывающийся кольцевым валиком. Интерпретация Саттлера связана с тем, что за появление органа в развитии цветка он принимает появление его свободной верхушки (Sattler, 1973). Также Саттлер не принимает концепции общих примордиев лепесток/тычинка у высших двудольных (при этом он не против общих примордиев листочек околоцветника/тычинка у однодольных с простым околоцветником), поэтому во всех случаях заложения лепестка и тычинки общим примордием последовательность развития интерпретирована как “тычинки перед венчиком”. Согласно представлениям Саттлера на крупном примордии тычинки или ниже него появляется примордий лепестка. Взгляды Саттлера не являются общепринятыми (Ronse Dectaene et al., 1993; Leins, Erbar, 2010).
Все же случаи несомненных интерзональных паттернов существуют. В первую очередь, это олигомерные цветки некоторых астерид, особенно с плотными соцветиями, например, все Asteraceae, часть Dipsacaceae s.str. и Valerianaceae s.str. Несвоевременное (позже венчика) заложение чашечки можно объяснить с одной стороны редукционными тенденциями, с другой – гетерохрония в развитии околоцветника позволяет сократить время развития (Naghiloo, Classen-Bockhoff, 2017) и обеспечить более экономное расходование ресурсов. Так как чашечка для защиты бутона уже не нужна, то основная ее функция у перечисленных выше семейств – участие в распространении плодов. Разрастаться чашечка начинает именно ко времени образования плодов. Тем не менее, несмотря на позднее заложение чашечки развитие цветка начинается c околоцветника – венчик закладывается перед или, как у Valerianaceae s.str., одновременно с тычинками. Еще один интерзональный случай – заложение лепестков после тычинок у Lythrum (Cheung, Sattler, 1967; Sattler, 1973; Rudall, 2009) и Trapa (Sinjushin, 2018) из семейства Lythaceae (Myrtales). Цветки Lythrum сочетают два интразональных и один интерзональный паттерн – сначала закладывается чашечка, после нее подчашие, затем наружные тычинки, гинецей, внутренние тычинки и наконец – лепестки. У Trapa подчашие и тычинки напротив лепестков отсутствуют, развитие цветка начинается с заложения чашечки, затем напротив чашелистиков одновременно с началом формирования гипантия закладываются тычинки, следующими на гипантии, чередуясь с чашелистиками закладываются лепестки, последним появляется гинецей (Sinjushin, 2018). Из многочисленных представителей Lythraceae развитие цветка кроме Lythrum и Trapa изучено только у Lagerstroemia, для которой характерна комплексная базипетальная полиандрия на гипантии, при этом весь достаточно сложно организованный андроцей закладывается одновременно (Ronse Decraene, Smets, 1991). Единственное, что объединяет Lagerstroemia, Lythrum и Trapa, – наличие гипантия и очень маленькие размеры примордиев лепестков. После заложения лепестки долго не увеличиваются в размерах, вплоть до самых поздних стадий развития бутона. Похожий случай представляет Dirachma: Dirachmaceae: Rosales (Ronse De Craene, Miller, 2004), у Dirachma тычинки расположены в один круг напротив лепестков. Лепестки закладываются на гипантии позже тычинок, почти одновременно с плодолистиками. Заложение лепестков после тычинок характерно также для Astrantia: Apiaceae (Erbar, Leins, 1997; Erbar, 2010). У этого представителя зонтичных сначала общими примордиями закладываются чашелистики и тычинки (это, вероятно, единственный случай общих примордиев такого типа), одновременно с разделением общих примордиев закладываются лепестки. По дефинитивной структуре цветка Astrantia ничем не отличается от других зонтичных. В целом в олигомерных цветках высших двудольных развитие начинается с околоцветника. При заложении чашечки после венчика мы имеем дело с базипетальным развитием околоцветника, при позднем заложении лепестков акропетальный паттерн в пределах околоцветника сохраняется.
Более драматические случаи интерзонального паттерна наблюдаются при заложении всех тычинок после гинецея. Здесь уже явное нарушение базовой последовательности – околоцветник-андроцей-гинецей. Заложение гинецея перед андроцеем установлено для некоторых видов Senna: Leguminosae: Fabales (Tucker, 1996; Marazzi, Endress, 2008), Platycrater: Hydrangeaceae: Cornales (Ge et al., 2007); Napoleonaea: Lecythidaceae: Ericales (Ronse De Craene, 2011) и Conostegia: Melastomataceae: Myrtales (Wanntorp et al., 2011). Характерно, что ближайшие родственники всех этих трех неродственных друг другу растений уже имеют склонность к позднему заложению тычинок. У бобовых при расположении тычинок более чем в один круг внутренние тычинки закладываются позже гинецея. Для Lecythidaceae, Melastomataceae и Hydrangeaceae в целом характерна комплексная полиандрия или заложение тычинок на гипантии. Таким образом, уже характерные для представителей названных семейств особенности доведены у “эктремалов” до предела. Было бы интересно изучить гистологические особенности флоральной меристемы и паттерн экспрессии “тычиночных” генов В-класса у этих растений, чтобы установить, является ли видимый порядок заложения органов точным отражением внутренних, не видимых с поверхности, процессов.
Большинство растений с проявлениями базипетальных паттернов – это растения с комплексной базипетальной полиандрией, т.е. околоцветник, андроцей и гинецей как совокупности соответствующих органов закладываются акропетально, тычинки на первичных примордиях закладываются базипетально. Остальные варианты комплексной полиандрии более редки. В чем привлекательность этого паттерна? Крупные цветки с многочисленными тычинками в качестве награды опылителю предоставляют пыльцу. В теории, чем больше тычинок, тем лучше. При строго акропетальном заложении органов гинецей вынужден “ждать”, пока не появятся примордии всех тычинок. Такой цветок развивается относительно долго, растениям приходится искать компромисс между увеличением числа тычинок и сокращением времени развития цветка. Переход к комплексной базипетальной полиандрии изящно снимает вопрос времени – индивидуальные тычинки формируются параллельно с гинецеем, а благодаря зональному росту в основании андроцея число тычинок можно еще увеличить (Endress, 2006). Особенно многочисленными получаются тычинки на кольцевых первичных примордиях. Наличие зонального роста в основании андроцея выгодно отличает базипетальную от акропетальной комплексной полиандрии и простой полиандрии на гипантии с заложением части тычинок после гинецея. При акропетальной комплексной полиандрии нет возможности увеличить число тычинок после заложения гинецея – первичные примордии сразу демонстрируют свой конечный размер, число тычинок в этом случае можно увеличивать только уменьшением размера индивидуальных примордиев тычинок относительно размера первичного примордия. Акропетальное заложение тычинок на удлиняющемся гипантии, по-видимому, трудно контролировать с генетической точки зрения – чаще при увеличении размеров гипантия дополнительные тычинки появляются не ко внутри от уже имеющихся и частично после заложения гинецея, а между ними и перед заложением плодолистиков, т.е. увеличивается не число кругов тычинок, а их число в уже имеющихся кругах (см. Ronse Decraene, Smets, 1991, 1992; Hufford, 1998). И хотя простая полиандрия на гипантии – второй по распространенности паттерн развития полимерного андроцея у высших двудольных с циклическими цветками, число тычинок в таких цветках редко достигает такового в цветках со вторичной полиандрией.
ЗАКЛЮЧЕНИЕ
Итак, для большинства покрытосеменных характерен строго акропетальный порядок заложения органов цветка. Отклонения от этого порядка можно встретить только в циклических цветках. Для того, чтобы лучше понять разнообразие отклонений от строго акропетального порядка заложения органов в цветках можно построить пространство логических возможностей по двум параметрам – акропетальное/базипетальное заложение совокупностей органов, т.е. околоцветник-андроцей-гинецей и акропетальное/базипетальное заложение органов в пределах одной категории (табл. 1). В целом, цветковые растения очень неохотно нарушают базовую акропетальную последовательность заложения категорий органов “околоцветник-андроцей-гинецей”. Отклонения от этой последовательности проявляются в основном в том, что 1) часть органов одной категории закладывается одновременно или после расположенной выше органов другой категории (внутренние элементы околоцветника одновременно с тычинками, часть тычинок после гинецея), 2) часть или все органы определенной категории закладываются позже расположенной выше категории органов, но в этом случае они закладываются на “своевременно” появившихся первичных примордиях (часть или все индивидуальные тычинки после гинецея при комплексной полиандрии), 3) одновременное заложение двух категорий органов (околоцветник одновременно с андроцеем у некоторых однодольных) и 4) все органы определенной категории после вышерасположенных органов другой категории (гинецей после андроцея в инвертированных цветках, редкие случаи заложения всех тычинок после гинецея у высших двудольных). Заложение органов цветка всегда начинается с околоцветника и почти всегда заканчивается гинецеем (кроме случаев простой полиандрии на гипантии, где часть тычинок закладываются позже гинецея и кроме специально оговариваемых случаев у высших двудольных). В пределах каждой категории заложение органов также обычно акропетальное. Базипетальное заложение элементов околоцветника можно наблюдать в олигомерных цветках высших двудольных (чашелистики после лепестков у астерид, листочки подчашия после чашелистиков в цветках с подчашием). Базипетальное развитие андроцея характерно для нескольких несвязанных близким родством групп двудольных с комплексной полиандрией. Базипетальное развитие гинецея можно обнаружить только в инвертированных цветках.
Таблица 1.
Возможное пространство логических возможностей паттернов развития цветка
| Органы внутри каждой категории акропетально | Околоцветник базипетально | Андроцей базипетально | Гинецей базипетально | |
|---|---|---|---|---|
| Околоцветник-андроцей-гинецей акропетально | Базовый вариант | Цветки с подчашием (листочки подчашия после чашелистиков и обычно одновременно с лепестками); олигомерные цветки (чашечка после лепестков) |
Цветки с полимерным андроцеем и комплексной полиандрией | |
| Частичное отклонение от строго акропетального порядка “околоцветник-андроцей-гинецей” | Внутренние элементы околоцветника одновременно с андроцеем (цветки с общими примордиями); Lythrum, Trapa, Dirachma, Astrantia – лепестки после андроцея; часть тычинок после гинецея в цветках с полимерным андроцеем и простой полиандрией на гипантии или комплексной полиандрией |
Олигомерные цветки (чашечка после лепестков и одновременно с андроцеем или после него) | Часть тычинок после гинецея в цветках с полимерным андроцеем и комплексной полиандрией | |
| Полное отклонение от строго акропетального порядка “околоцветник-андроцей-гинецей” | Околоцветник одновременно с андроцеем (цветки с общими примордиями); Senna, Conostegia – андроцей после гинецея |
Platycrater, Napoleonaea – андроцей после гинецея | Инвертированные цветки |
Все эти разнообразные паттерны возникают с одной стороны независимо в неродственных друг другу семействах и даже порядках покрытосеменных, а с другой стороны роды, принадлежащие одному семейству (а иногда и виды одного рода) могут демонстрировать разные паттерны развития цветка. Например, у Hydrangeaceae зафиксированы типичный паттерн, простая полиандрия на гипантии, комплексная полиандрия и заложение всего андроцея после гинецея (Roels et al., 1997; Hufford, 1998, Ge et al., 2007). С уверенностью можно сказать, что отклонения от типичного варианта развития цветка сосредоточены в основном в группе высших двудольных (eudicots), но это далеко не единственная группа растений с циклическим цветком. Причины возникновения того или иного паттерна, его адаптивный смысл также не всегда ясны.
Работа выполнена при поддержке РФФИ (базальные группы покрытосеменных, проект 18-04-00797а) и РНФ (однодольные, пространство логических возможностей, проект 19-14-00055).
Список литературы
Базилевская Н.А., Белоконь И.П., Щербакова А.А. Краткая история ботаники. М., 1968. 307 с.
Имс А. Морфология цветковых растений. М.: Мир, 1964. 497 с.
Красилов В.А. Происхождение и ранняя эволюция цветковых растений. М.: Наука, 1989. 263 с.
Мейен С.В. Основы палеоботаники. Справочное пособие. М.: Недра, 1987. 403 с.
Тахтаджян А.Л. Происхождение и расселение цветковых растений. Л.: Наука, 1970. 145 с.
Тахтаджян А.Л. Система и филогения цветковых растений. М.–Л.: Наука, 1966. 611 с.
Хохряков А.П. О некоторых закономерностях эволюции цветка // Проблемы филогении высших растений. М.: Наука, 1974. С. 163–172.
Ajania Y., Bull-Hereñu K., Classen-Bockhoff R. Patterns of flower development in Apiaceae–Apioideae // Flora. 2016. V. 221. P. 38–45.
Álvarez-Buylla E.R., Ambrose B.A., Flores-Sandoval E., Englund M., Garay-Arroyo A., García-Ponce B., de la Torre-Bárcena E., Espinosa-Matías S., Martínez E., Piñeyro-Nelson A., Engström P., Meyerowitz E.M. B-Function Expression in the Flower Center Underlies the Homeotic Phenotype of Lacandonia schismatica (Triuridaceae) // Plant Cell. 2010. V. 22. P. 3543–3559.
Ambrose B.A., Espinosa-Matías S., Vázquez-Santana S., Vergara-Silva F., Martínez E., Márquez Guzmán J., Álvarez-Buylla E.R. Comparative developmental series of the Mexican triurids support a euanthial interpretation for the unusual reproductive axes of Lacandonia schismatica (Triuridaceae) // Amer. J. Bot. 2006. V. 93. P. 15–35.
Anger N., Fogliani B., Scutt C.P., Gâteblé G. Dioecy in Amborella trichopoda: evidence for genetically based sex determination and its consequences for inferences of the breeding system in early angiosperms // Ann. Bot. 2017. V. 119. P. 591–597.
Barton M.K. Twenty years on: The inner workings of the shoot apical meristem, a developmental dynamo // Dev. Biol. 2010. V. 341. P. 95–113.
Bello M.A., Martínez-Asperilla A., Fuertes-Aguilar J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance // Bot. J. Linn. Soc. 2016. V. 181. P. 84–98.
Bernhard A., Endress P.K. Androecial development and systematics in Flacourtiaceae s.l. // Plant Syst. Evol. 1999. V. 215. P. 141–155.
Brett J.F., Posluszny U. Floral development in Caulophyllum thalictroides (Berberidaceae) // Can. J. Bot. 1982. V. 60. P. 2133–2141.
Cheung M., Sattler R. Early floral development of Lythrum salicaria // Can. J. Bot. 1967. V. 45. P. 1609–1618.
Classen-Bockhoff R. The shoot concept of the flower: Still up to date? // Flora. 2016. V. 221. P. 46–53.
Corner E.J.H. Centrifugal stamens. // J. Arnold. Arbor. 1946. V. 27. P. 423–437.
Cronquist A. Phylogeny and Taxonomy of the Compositae // Am. Midl. Nat. 1955. V. 53. P. 478–511.
Cronquist A. The evolution and classification of flowering plants. Bronx: The New York Botanic Garden, 1988. 555 p.
De Laet J., Clickemaillie D., Jansen S., Smets E. Floral ontogeny in the Plumbaginaceae // J. Plant Res. 1995. V. 108. P. 289–304.
Decraene L.P., Smets E.F. Complex polyandry in the Magnoliatae: definition, distribution and systematic value // Nord. J. Bot. 1992. V. 12. P. 621–649.
Decraene L.P., Smets E.F. The floral development of Neurada procumbens L. (Neuradaceae) // Acta. Bot. Neerl. 1995. V. 45. P. 229–241.
Denay G., Chahtane H., Tichtinsky G., Parcy F. A flower is born: an update on Arabidopsis floral meristem formation // Curr. Opin. Plant Biol. 2017. V. 35. P. 15–22.
Donoghue M.J., Doyle J.A. Seed plant phylogeny: Demise of the anthophyte hypothesis? // Curr. Biol. 2000. V. 10. P. R106–R109.
Doyle J.A. Integrating Molecular Phylogenetic and Paleobotanical Evidence on Origin of the Flower // Int. J. Plant Sci. 2008. V. 169. P. 816–843.
Doyle J.A. Molecular and Fossil Evidence on the Origin of Angiosperms // Annu. Rev. Earth Planet. Sci. 2012. V. 40. P. 301–326.
Endress P.K. Floral phyllotaxis and floral evolution // Bot. Jahrb. Syst. 1987. V. 108. P. 417–438.
Endress P.K. Patterns of floral construction in ontogeny and phylogeny // Bot. J. Linn. Soc. 1990. V. 39. P. 153–175.
Endress P.K. Major traits of monocot flowers // Monocotyledons: Systematics and Evolution: In 2 vol. Wristable, Kent: Wristable Litho Printers Ltd., 1995. V. 1. P. 43–79.
Endress P.K. Relationships between floral organization, architecture, and pollination mode in Dillenia (Dilleniaceae) // Plant Syst. Evol. 1997. V. 206. P. 99–118.
Endress P.K. Angiosperm floral evolution: morphological developmental framework // Adv. Bot. Res. 2006. V. 44. P. 1–61.
Endress P.K., Doyle J.A. Floral phyllotaxis in basal angiosperms: development and evolution // Curr. Opin. Plant Biol. 2007. V. 10. P. 52–57.
Endress P.K. The Whole and the Parts: Relationships Between Floral Architecture and Floral Organ Shape, and Their Repercussions on the Interpretation of Fragmentary Floral Fossils // Ann. Mo. Bot. Gard. 2008. V. 95. P. 101–120.
Endress P.K., Doyle J.A. Reconstructing the ancestral angiosperm flower and its initial specializations // Amer. J. Bot. 2009. V. 96. P. 22–66.
Endress P.K. Disentangling confusions in inflorescence morphology: Patterns and diversity of reproductive shoot ramification in angiosperms // J. Syst. Evol. 2010a. V. 48. P. 225–239.
Endress P.K. Synorganisation without organ fusion in the flowers of Geranium robertianum (Geraniaceae) and its not so trivial obdiplostemony // Ann. Bot. 2010b. V. 106. P. 687–695.
Endress P.K. Evolutionary diversification of the flowers in angiosperms // Amer. J. Bot. 2011a. V. 98. P. 370–396.
Endress P.K. Changing views of flower evolution and new questions // Flowers on the Tree of Life. Systematics Association Special volume. Series 80. Cambridge: Cambridge University Press, 2011b. P. 120–141.
Endress P.K., Doyle J.A. Ancestral traits and specializations in the flowers of the basal grade of living angiosperms // Taxon. 2015. V. 64. P. 1093–1116.
Endress P.K. The morphological relationship between carpels and ovules in angiosperms: pitfalls of morphological interpretation // Bot. J. Linn. Soc. 2019. V. 189. P. 201–227.
Erbar C. Floral development of two species of Stylidium (Stylidiaceae) and some remarks on the systematic position of the family Stylidiaceae // Can. J. Bot. 1992. V. 70. P. 258–271.
Erbar C. Floral organ determination and ontogenetical patterns during Angiosperm evolution // Int. J. Plant Dev. Biol. 2010. V. 4. P. 1–6.
Erbar C., Leins P. Distribution of the character states “early” and “late sympetaly” within the “Sympetalae Tetracyclicae” and presumably related groups // Botanica Acta. 1996. V. 109. P. 427–440.
Erbar C., Leins P. Different Patterns of Floral Development in Whorled Flowers, Exemplified by Apiaceae and Brassicaceae // Int. J. Plant Sci. 1997. V. 158. P. S49–S64.
Feng M., Fu D.-Z., Liang H.-X., Lu A.-M. Floral morphogenesis of Aquilegia L. (Ranunculaceae) // Acta Bot. Sin. 1995. V. 37. P. 791–794.
Friedman W.E. The meaning of Darwin’s “abominable mystery” // Amer. J. Bot. 2009. V. 96. P. 5–21.
Friis E.M., Crane P.R., Pedersen K.R. The Early Flowers and Angiosperm Evolution. Cambridge: Cambridge University Press, 2011. 600 p.
Friis E.M., Pedersen K.R., Crane P.R. Cretaceous angiosperm flowers: Innovation and evolution in plant reproduction // Palaeogeogr. Palaeoclimatol. Palaeoecol. 2006. V. 232. P. 251–293.
Ge L.P., Lu A.M., Gong C.E. Ontogeny of the fertile flower in Platycrater arguta // Int. J. Plant Sci. 2007. V. 168. P. 835–844.
Gitzendanner M.A., Soltis P.S., Wong G.K.-S., Ruhfel B.R., Soltis D.E. Plastid phylogenomic analysis of green plants: A billion years of evolutionary history // Amer. J. Bot. 2018. V. 105. P. 291–301.
Graham S.W., Iles W.J. Different gymnosperm outgroups have (mostly) congruent signal regarding the root of flowering plant phylogeny // Amer. J. Bot. 2009. V. 96. P. 216–227.
Graham S., Gerelle W., Jost M., Logacheva M., Sauquet H., Moore M., Les D., Macfarlane T. Remizowa M., Conran J., Wanke S., Rudall P.J., Sokoloff D., Marques I. Connecting phylogenetic and microevolutionary views on dioecy evolution: insights from an ancient angiosperm lineage (Hydatellaceae, Nymphaeales) // Botany 2019. Abstracts. Abstract 1033. https://2019.botanyconference.org/engine/search/index. php?func=detail&aid=1033
Hansen A., Hansmann S., Samigullin T., Antonov A., Martin W. Gnetum and the Angiosperms: Molecular Evidence that Their Shared Morphological Characters Are Convergent, Rather than Homologous // Mol. Biol. Evol. 1999. V. 16. P. 1006–1009.
Hardy C.R., Stevenson D.W. Floral Organogenesis in Some Species of Tradescantia and Callisia (Commelinaceae) // Int. J. Plant Sci. 2000. V. 161. P. 551–562.
Harris E.M. Inflorescence and floral ontogeny in asteraceae: A synthesis of historical and current concepts // Bot. Rev. 1995. V. 61. P. 93–278.
Hayes V., Schneider E.L., Carlquist S. Floral Development of Nelumbo nucifera (Nelumbonaceae) // Int. J. Plant Sci. 2000. V. 161. P. S183–S191.
Herendeen P.S., Friis E.M., Pedersen K.R., Crane P.R. Palaeobotanical Redux: How Old are the Angiosperms? // Nature Plants. 2017. V. 3. P. 1–8.
Hollender C.A., Geretz A.C., Slovin J.P., Liu Z. Flower and early fruit development in a diploid strawberry, Fragaria vesca // Planta. 2012. V. 235. P. 1123–1139.
Hufford L. Early development of androecia in polystemonous Hydrangeaceae // Amer. J. Bot. 1998. V. 85. P. 1057–1067.
Innes R.L., Remphrey W.R., Lenz L.M. An analysis of the development of single and double flowers in Potentilla fruticosa // Can. J. Bot. 1989. V. 67. P. 1071–1079.
Kwiatkowska D. Flowering and apical meristem growth dynamics // J. Exp. Bot. V. 59. P. 187–201.
Landau U., Asis L., Eshed Williams L. The ERECTA, CLAVATA and class III HD-ZIP Pathways Display Synergistic Interactions in Regulating Floral Meristem Activities // PLOS ONE. 2015. V. 10. e0125408.
Leins P., Erbar C. Flower and Fruit. Morphology, ontogeny, phylogeny, function and ecology. Stuttgart: Schweizerbart science publishers, 2010. 439 p.
Maas F.M., Hofman-Eijer L.B., Hulsteijn K. Flower Morphogenesis in Rosa hybrida “Mercedes” as Studied by Cryo-scanning Electron and Light Microscopy. Effects on Light and Shoot Position on a Branch // Ann. Bot. 1995. V. 75. P. 199–205.
Magallón S., Gómez-Acevedo S., Sánchez-Reyes L.L., Hernández-Hernández T. A metacalibrated time-tree documents the early rise of flowering plant phylogenetic diversity // New Phytol. 2015. V. 207. P. 437–453.
Marazzi B., Endress P.K. Patterns and development of floral asymmetry in Senna (Leguminosae, Cassiinae) // Amer. J. Bot. 2008. V. 95. P. 22–40.
Mennes C.B., Smets E.F., Moses S.N., Merckx V.S.F.T. New insights in the long-debated evolutionary history of Triuridaceae (Pandanales) // Mol. Phylogenet. Evol. 2013. V. 69. P. 994–1004.
Naghiloo S., Classen-Bockhoff R. Developmental Changes in Time and Space Promote Evolutionary Diversification of Flowers: A Case Study in Dipsacoideae // Front. Plant Sci. 2017. V. 8. article 1665.
Narita M., Takahashi H. A comparative study of shoot and floral development in Paris tetraphylla and P. verticillata (Trilliaceae) // Pl. Syst. Evol. 2008. V. 272. P. 67–78.
Orlovich D.A., Drinnan A.N., Ladiges P.Y. Floral development in Melaleuca and Callistemon (Myrtaceae) // Aust. Syst. Bot. 1998. V. 11. P. 689–710.
Posluszny U. Re-evaluation of certain critical relationships in the Alismatidae: floral organogenesis of Scheuchzeria palustris (Scheuchseriaceae) // Amer. J. Bot. 1983. V. 70. P. 925–533.
Prenner G. Floral ontogeny in Lathyrus latifalius (Fabaceae-Vicieae) // Phyton. 2003. V. 43. P. 392–400.
Prenner G. Floral ontogeny of Acacia celastrifolia: an enigmatic mimosoid legume with pronounced polyandry and multiple carpels // Flowers on the Tree of Life. Systematics Association Special volume. Series 80. Cambridge: Cambridge University Press, 2011. P. 256–278.
Remizowa M.V., Rudall P.J., Choob V.V., Sokoloff D.D. Racemose inflorescences of monocots: structural and morphogenetic interaction at the flower/inflorescence level // Ann. Bot. 2013. V. 112. P. 1553–1566.
Remizowa M.V., Sokoloff D.D., Rudall P.J. Patterns of floral structure and orientation in Japonolirion, Narthecium, and Tofieldia // Aliso. 2006. V. 22. P. 159–171.
Remizowa M.V., Sokoloff D.D., Rudall P.J. Evolutionary history of the monocot flower // Ann. Mo. Bot. Gard. 2010. V. 97. P. 617–645.
Ren Y., Gu T., Chang H. Floral development of Dichocarpum, Thalictrum, and Aquilegia (Thalictroideae, Ranunculaceae) // Plant Syst. Evol. 2011. V. 292. P. 203–213.
Roels P., Decraene L.P., Smets E.F. A floral ontogenetic investigation of the Hydrangeaceae // Nord. J. Bot. 1997. V. 17. P. 235–254.
Ronse De Craene L. The Evolutionary Significance of Homeosis in Flowers: A Morphological Perspective // Int. J. Plant Sci. 2003. V. 164. P. S225–S235.
Ronse De Craene L.P. Floral development of Napoleonaea (Lecythidaceae), a deceiptively complex flower // Flowers on the Tree of Life. Systematics Association Special volume. Series 80. Cambridge: Cambridge University Press, 2011. P. 279–265.
Ronse De Craene L. Meristic changes in flowering plants: How flowers play with numbers // Flora. 2016. V. 221. P. 22–37.
Ronse De Craene, L.P., Miller A.G. Floral development and anatomy of Dirachma socotrana, (Dirachmaceae): a controversial member of the Rosales // Plant Syst. Evol. 2004. V. 249. P. 111–127.
Ronse Decraene L.P., Clinckemaillie D., Smets E. Stamen-Petal Complexes in Magnoliata // Bull. Jard. Bot. Belg. 1993. V. 62. P. 97–112.
Ronse Decraene L.P., Smets E. The Systematic Relationship between Begoniaceae and Papaveraceae: A Comparative Study of Their Floral Development // Bull. Jard. Bot. Belg. 1990. V. 60. P. 229–273.
Ronse Decraene L.P., Smets E. The impact of receptacular growth on polyandry in the Myrtales // Bot. J. Linn. Soc. 1991. V. 105. P. 257–269.
Ronse Decraene L.P., Smets E. The distribution and systematic relevance of the androecial character polymery // Bot. J. Linn. Soc. 1993a. V. 113. P. 285–350.
Ronse Decraene L.P., Smets E. Dédoublement revisited: towards a renewed interpretation of the androecium of the Magnoliophytina // Bot. J. Linn. Soc. 1993b. V. 113. P. 103–124.
Ronse Decraene L.P., Smets E. The distribution and systematic relevance of the androecial character oligomery // Bot. J. Linn. Soc. 1995. V. 118. P. 193–247.
Ronse Decraene L.P., Smets E. A floral ontogenetic study of some species of Capparis and Boscia, with special emphasis on the androecium // Bot. Jahrb. Syst. 1997. V. 119. P. 231–255.
Ronse Decraene L.P., Smets E.F., Vanvinckenroye P. Pseudodiplostemony, and its implications for the evolution of the androecium in the Caryophyllaceae // J. Plant Res. 1998. V. 111. P. 25.
Rudall P.J. Fascicles and Filamentous Structures: Comparative Ontogeny of Morphological Novelties in Triuridaceae // Int. J. Plant Sci. 2008. V. 169. P. 1023–1037.
Rudall P.J. All in a spin: centrifugal organ formation and floral patterning // Curr. Opin. Plant Biol. 2010. V. 13. P. 108–114.
Rudall P.J Centrifugal stamens in a modern phylogenetic context: Was Corner right? // Flowers on the Tree of Life. Systematics Association Special volume. Series 80. Cambridge: Cambridge University Press, 2011. P. 142–155.
Rudall P.J., Remizowa M.V., Prenner G., Prychid C.J., Tuckett R.E., Sokoloff D.D. Nonflowers near the base of extant angiosperms? Spatiotemporal arrangement of organs in reproductive units of Hydatellaceae and its bearing on the origin of the flower // Amer. J. Bot. 2009. V. 96. P. 67–82.
Rudall P.J., Sokoloff D.D., Remizowa M.V., Conran J.G., Davis J.I., Macfarlane T.D., Stevenson D.W. Morphology of Hydatellaceae, an anomalous aquatic family recently recognized as an early-divergent angiosperm lineage // Amer. J. Bot. 2007. V. 94. P. 1073–1092.
Sattler R. Organogenesis of flowers : a photographic text-atlas. Toronto: University of Toronto Press, 1973. 207 p.
Sauquet H., von Balthazar M., Magallón S., Doyle J.A., Endress P.K., Bailes E.J., Barroso de Morais E., Bull-Hereñu K., Carrive L., Chartier M., Chomicki G., Coiro M., Cornette R., El Ottra J.H.L, Epicoco C., Foster C.S.P., Jabbour F., Haevermans A., Haevermans T., Hernández R., Little S.A., Löfstrand S., Luna J.A., Massoni J., Nadot S., Pamperl S., Prieu C., Reyes E., Dos Santos P., Schoonderwoerd K.M., Sontag S., Soulebeau A., Yannick Staedler, Tschan G.F., Leung A.W., Schönenberger J. The ancestral flower of angiosperms and its early diversification // Nature Comm. 2017. V. 8. article 16047.
Sauquet H., von Balthazar M., Doyle J.A., Endress P.K., Magallón S., Staedler Y., Schönenberger J. Challenges and questions in reconstructing the ancestral flower of angiosperms: A reply to Sokoloff et al. // Amer. J. Bot. 2018. V. 105. P. 127–135.
Semple J.C. Quadruple, triple, double, and simple pappi in the goldenasters, subtribe Chrysopsidinae (Asteraceae: Astereae) // SIDA, Contributions to Botany. V. 22. P. 503–531.
Schönenberger J. Floral structure, development and diversity in Thunbergia (Acanthaceae) // Bot. J. Linn. Soc. 1999. V. 130. P. 1–36.
Schönenberger J., Endress P.K. Structure and Development of the Flowers in Mendoncia, Pseudocalyx, and Thunbergia (Acanthaceae) and Their Systematic Implications // Int. J. Plant Sci. 1998. V. 159. P. 446–465.
Sinjushin A.A. Revisiting the floral structure and ontogeny of Trapa natans L. (Lythraceae) // Wulfenia. 2018. V. 25. P. 57–70.
Sokoloff D.D., Remizowa M.V., Macfarlane T.D., Rudall P.J. Classification of the early-divergent angiosperm family Hydatellaceae: one genus instead of two, four new species and sexual dimorphism in dioecious taxa // Taxon. 2008. V. 57. P. 179–200.
Sokoloff D.D., Remizowa M.V., Yadav S.R., Rudall P.J. Development of reproductive structures in the sole Indian species of Hydatellaceae, Trithuria konkanensis, and its morphological differences from Australian taxa // Aust. Syst. Bot. 2010. V. 23. P. 217–228.
Sokoloff D.D., Remizowa M.V., Bateman R.M., Rudall P.J. Was the ancestral angiosperm flower whorled throughout? // Amer. J. Bot. 2018. V. 105. P. 5–15.
Taylor E.L., Taylor T.N. Seed ferns from the late Paleozoic and Mesozoic: Any angiosperm ancestors lurking there? // Amer. J. Bot. 2009. V. 96. P. 237–251.
Tsou C. Mori S.A. Floral organogenesis and floral evolution of the Lecythidoideae (Lecythidaceae) // Amer. J. Bot. 2007. V. 94. P. 716–736.
Tucker S.C. Trends in evolution of floral ontogeny in Cassia sensu stricto, Senna, and Chamaecrista (Leguminosae: Caesalpinioideae: Cassieae: Cassiinae); a study in convergence. // Amer. J. Bot. 1996. V. 83. P. 687–711.
Tucker S.C. Floral development in Tribe Detarieae (Leguminosae: Caesalpinioideae): Amherstia, Brownea, and Tamarindus // Amer. J. Bot. 2000. V. 87. P. 1385–1407.
Tucker S.C. Floral Development in Legumes // Plant Physiol. 2003a. V. 131. P. 911–926.
Tucker S.C. Floral ontogeny in Swartzia (Leguminosae: Papilionoideae: Swartzieae): distribution and role of the ring meristem // Amer. J. Bot. 2003b. V. 90. P. 1271–1292.
Tucker S.C., Hodges S.A. Floral Ontogeny of Aquilegia, Semiaquilegia, and Enemion (Ranunculaceae) // Int. J. Plant Sci. 2005. V. 166. P. 557–574.
Uhl N.W. Floral organogenesis in palms // In: Aspects of floral development. Berlin: J. Cramer, 1988. P. 25–44.
Uhl N.W., Dransfield J. Development of the inflorescence, androecium and gynoecium with reference to palms // In: Contemporary problems in plant anatomy. New York: Academic Press, New York, 1984. P. 397–449.
Uhl N.W., Moore H.E. Centrifugal stamen initiation in phytoelephantoid palms // Amer. J. Bot. 1977. V. 64. P. 1152–1161.
Uhl N.W., Moore H.E. Androecial development in six polyandrous genera representing five major groups of palms // Ann. Bot. 1980. V. 45. P. 57–75.
Volkova O.A., Remizowa M.V., Sokoloff D.D., Severova E.E. A developmental study of pollen dyads and notes on floral development in Scheuchzeria (Alismatales: Scheuchzeriaceae) // Bot. J. Linn. Soc. 2016. V. 182. P. 791–810.
Wanntorp L., Puglisi C., Penneys D., Ronse De Craene L.P. Multiplicationsof floral organs in flowers – a case study in Conostegia (Melastomataceae, Myrtales) // Flowers on the Tree of Life. Systematics Association Special volume. Series 80. Cambridge: Cambridge University Press, 2011. P. 218–235.
Wettstein R. 1924. Handbuch der Systematischen Botanik. Franz Deuticke: Leipzig und Wien. 994 p.
Wickett N.J., Mirarab S., Nguyen N., Warnow T., Carpenter E., Matasci N., Ayyampalayam S., Barker M.S., Burleigh J.G., Gitzendanner M.A., Ruhfel B.R., Wafula E., Der J.P., Graham S.W., Mathews S., Melkonian M., Soltis D.E., Soltis P.S., Miles N.W., Rothfels C.J., Pokorny L., Shaw A.J., DeGironimo L., Stevenson D.W., Surek B., Villarreal J.C., Roure B., Philippe H., dePamphilis C.W., Chen T., Deyholos M.K., Baucom R.S., Kutchan T.M., Augustin M.M., Wang J., Zhang Y., Tian Z., Yan Z., Wu X., Sun X., Wong G.K., Leebens-Mack J. Phylotranscriptomic analysis of the origin and early diversification of land plants // PNAS. 2014. V. 111. P. E4859–E4868.
Zagórska-Marek B. Phyllotaxic diversity in Magnolia flowers. Acta Soc. Bot. Polon. 1994. V. 63. P. 117–137.
Дополнительные материалы отсутствуют.


